Алматы энергетика және байланыс институты
Өнеркәсіптік жылуэнергетика кафедрасы
СУДЫ ДАЙЫНДАУДЫҢ ФИЗИКА-химияЛЫҚ ТӘСІЛДЕРІ
050717 – Жылуэнергетика мамандығы бойынша барлық оқу түрінің студенттері үшін зертханалық жұмыстарды орындауға арналған әдістемелік нұсқаулар
Алматы 2008
ҚҰРАСТЫРУШЫЛАР: Туманова А. А., Идрисова К. С. Суды дайындаудың физика-химиялық тәсілдері. 050717 – Жылуэнергетика мамандығы бойынша барлық оқу түрінің студенттері үшін зертханалық жұмыстарды орындауға арналған әдістемелік нұсқаулар. – Алматы: АЭжБИ, 2008. – 50 б.
«Суды дайындаудың физика-химиялық тәсілдері» пәнінен зертханалық жұмыстарды орындауға арналған әдістемелік нұсқаулар 050717 – Жылуэнергетика мамандығы бакалаврларына арналған. Техникалық бағыттардың оқу стандартына сәйкес жасалған.
Кіріспе
Зертханалық жұмыстарды орындауға арналған әдістемелік нұсқаулар «Суды дайындаудың физика-химиялық тәсілдері» пәнін 3 кредит көлемінде оқитын бакалаврларға ұсынылып отыр. Мақсаты – тәжірибелерді орындаудың нәтижесінде студенттердің осы пәннен білім деңгейін жоғарлату, алған білімдерді ағымды және аралық бақылауларға, емтиханға дайындалу кезінде пайдалану.
Әдістемелік нұсқаулардың мазмұны курстың оку бағдарламасына сәйкес келіп, өнеркәсіптік өндірістер мен жылу электр стансаларында суды дайындау және бақылаудың негізгі бөлімдерінен құрастырылған 14 зертханалық жұмыстан тұрады.
Зертханалық жұмыстар СДФХТ курсының негізгі құрама бөліктерінің бірі болып табылады. Жұмыстарды орындау үшін студентке зертханалық жабдықтармен, өлшейтін аспаптармен және негізгі зертханалық операцияларды өткізудің техникасымен танысу қажет.
Әрбір зертханалық жұмысты орындаудың алдында студент осы жұмысқа теориялық жағынан дайындалып, зертханалық жұмыстың әдістемесімен танысу қажет.
Тәжірибелік жұмыс бойынша есеп бергенде «Работы учебные» ҚР ФС 10352-1910-У-е - 001-2002 қолдану қажет.
№1 зертханалық жұмыс. Судың мөлдірлігі. Қалқыған заттар мөлшері
Жұмыстың мақсаты: судың мөлдірлігі мен қалқыған заттар мөлшерін анықтауды үйрену.
1.1 Теориялық кіріспе
Мөлдірлік – қалқыған заттар мен коллоидты қоспаларды оңай және лезде бақылауға мүмкіндік беретін су сапасының технологиялық көрсеткіші. Мөлдірліктің өлшемі болып ішіндегі бақыланатын затты байқауға болатын су бағанының биіктігі табылады. Заттың көрінуіне байланысты мөлдірліктің бірнеше түрін ажыратады. Ақ тақташаны (әдетте фарфор) немесе диаметрі 20 см дискті бақылау «диск бойынша мөлдірлік» деп аталады. Бұл шама тек жер үсті суаттарының (өзен, көл, су қоймалар) сулары үшін өлшенеді.
«Крест бойынша» мөлдірлікті қалыңдығы 1 мм айқасқан қара екі түзу түсірілген ақ тақташа көмегімен анықтайды. Жылуэнергетикада көбінесе әріптерінің биіктігі 3,5 мм стандартты типографтық шрифт оқылатын су бағанының биіктігіне тең «шрифт бойынша (Снеллен бойынша)» мөлдірлік қолданылады.
Судың мөлдірлік бойынша жіктелуі 1.1 кестеде келтірілген.
1.1 к е с т е - Судың мөлдірлігін бағалау
|
Мөлдірлікті бағалау |
«Шрифт бойынша» мөлдірлік, см |
Қалқыған заттардың мөлшері, мг/дм3 |
|
Мөлдір |
> 30 |
< 3 – 4 |
|
Әлсіз лай |
25 – 30 |
< 5 – 6 |
|
Орташа лай |
20 – 25 |
6 – 10 |
|
Лай |
10 – 20 |
10 – 30 |
|
Өте лай |
< 10 |
> 30 |
«Крест бойынша» мөлдірлік пен «шрифт бойынша» мөлдірліктің және қалқыған заттар құрамының арасында өзара байланыс бар, ол 1.2 кестеде келтірілген. Бірақ мөлдірліктің мәні арқылы қалқыған заттардың құрамын бағалау айтарлықтай болжамды болады, өйткені ол суда еріген заттардың түсіне де байланысты.
1.2 к е с т е - Мөлдірлік бойынша қалқыған заттардың құрамын бағалау
|
Мөлдірлік, см |
Қалқыған заттар, мг/дм3 |
Мөлдірлік, см |
Қалқыған заттар, мг/дм3 |
||
|
«крест бойынша» |
«шрифт бойынша» |
«крест бойынша» |
«шрифт бойынша» |
||
|
0,5 |
5 |
160-300 |
16 |
160 |
9-14 |
|
2 |
20 |
40-120 |
17 |
170 |
8-12 |
|
3 |
30 |
30-90 |
18 |
180 |
7-10 |
|
5 |
50 |
16-75 |
19 |
190 |
6-9 |
|
6 |
60 |
14-52 |
21 |
210 |
5-8 |
|
8 |
80 |
11-40 |
23 |
230 |
4-6 |
|
9,5 |
95 |
10-33 |
25 |
250 |
3-6 |
|
11 |
110 |
10-27 |
26 |
260 |
3-6 |
|
12,5 |
125 |
10-20 |
28 |
280 |
3-6 |
|
14 |
140 |
10-17 |
30 |
300 |
3-6 |
Қалқыған заттар – сүзгі арқылы талданатын сынаманы өткізгенде сүзгіде қалып қоятын суда ерімейтін бөлшектер. Олар не тура, яғни сынаманы сүзуден кейін сүзгіде қалған қалдықтарды 105 – 110ºС-та қалыпты салмаққа дейін кептіріп және өлшеп, не жанама, яғни қоспалардың жалпы мөлшері мен еріген заттардың мөлшері арасындағы айырма арқылы анықталады. Қалқыған заттарды анықтау үшін сүзгілеуді, центрифугирлеуді немесе жанама есептеуді қолдануға болады. Анықтау әдісін таңдау қойылған мақсатқа, зертхананың жабдықтарының құрамына, қалқыған заттардың мөлшері мен сипатына байланысты. Азғантай мөлшерді (50мг/дм3-ден аз) дәл анықтау үшін мембраналық сүзгі арқылы сүзуді қолданады. Қалқыған заттардың мөлшері көп болатын суды талдау үшін қағаз сүзгіні пайдаланған жөн.
1.2 Мөлдірліктің анықтауын орындау
Талдауды орындау үшін кемінде 500 см3 талданатын су алынады. Сынаманы сақтамайды, анықтау сынама алынғаннан кейін бірден жүргізіледі.
Өлшеу үшін ішкі диаметрі 2,5-3,0 см және биіктігі шамамен 50 см, сантиметрлермен калибрленген, түбі тегіс шыны цилиндрді қолданады. Цилиндрдің төменгі жағында суды ағызу үшін және су бағанының биіктігін төмендету үшін шүмегі бар құбырша болуы қажет. Типографтық шрифттің үлгісіндегі әріптердің биіктігі 3,5 мм болуы қажет. Өлшегіш цилиндрді штативтің табанына түбі шрифттен 4 см ара қашықтықта орналасатындай етіп бекітеді. Алынған сынаманы жақсылап шайқайды және цилиндрдің жоғарғы белгісіне дейін құяды. Одан кейін су бағанын үстінен бақылай отырып, шүмекті ашады және шрифтті оқу мүмкін болғанға дейін ақырындап суды ағызады. Егер цилиндр жоғарғы белгіге дейін толып тұрғанда шрифтті оқу мүмкін болса, онда талданатын судың мөлдірлігі 50 см-ден көп. Шрифтті бақылауды шашыраңқы күндізгі жарықта жақсы жарықтанған бөлмеде терезеден 1 м қашықтықта жүргізеді. Талдаудың нәтижесін сантиметр түрінде дәлдігі 1 см-ге дейін болатын су бағанының биіктігімен өрнектейді.
1.3 Қалқыған заттар мөлшерінің анықтауын орындау
Анықтау үшін сынамалар шыны немесе полиэтилен шөлмектерге алынады. Ең дұрысы анықтауды бір тәуліктен кешіктірмей бірден жүргізу керек. Сынамаларды сақтауға болмайды.
Егер судағы қалқыған заттардың мөлшері 100 мг/дм3-ден кем болса, сынаманы көлемі 1000 см3-ден кем емес етіп алу керек. Қалқыған заттардың мөлшері көп болған жағдайда судың аз көлемімен (500 см3) шектелуге болады, бірақ көлемі 1000 см3 сынаманы пайдаланғанда нәтижелер дәлірек болады.
Цилиндрге 1000 см3 мұқият араластырылған сынама өлшеніп алынады (немесе көлемі азырақ, бірақ құрамындағы қалқыған заттар 250 мг-нан кем емес болатын) және кептірілген, алдын ала өлшенген қағаз сүзгі арқылы сүзіледі.
Сүзу алдында сүзгіні тұзсызданған судың бірнеше тамшыларымен сулап алып, одан соң абайлап воронкаға салу керек. Фильтраттың бірінші үлестерінің құрамында (100-200 см3) сүзгінің талшықтары болуы мүмкін, сондықтан оларды талданатын сынамаға қайта құю керек. Сүзу аяқталғаннан кейін құрамында темір немесе марганец қосылыстары бар (мысалы, кейбір артезиан сулары) қыздырылған қалдықтың түсі ашық қоңыр түстен қара түске дейін болуы мүмкін. Бұл жағдайда қыздыруды аяқтау үшін ыдысты муфель пешінде 15-20 мин. ұстау жеткілікті. Қыздырылған қалдығы бар ыдысты эксикаторға салады да салқындағаннан кейін өлшейді.
1.4 Нәтижелерді өңдеу
Судың қыздырылған қалдығы ҚҚ келесі формуламен есептеледі:
ҚҚ=![]() [мг/дм3]
[мг/дм3]
мұнда m2 – қыздырылған қалдығы бар ыдыстың салмағы, г;
m2 – бос ыдыстың салмағы, г;
Vсын – талдауға алынған су сынамасының көлемі, см3.
№2 зертханалық жұмыс. Судың қышқылдығын анықтау
Жұмыстың мақсаты: судың қышқылдығын анықтауды үйрену.
2.1 Теориялық кіріспе
Қышқылдық деп судағы
сутек иондарының (Н+) көтеріңкі
мөлшерін (рН<7,0) айтады. Металдарға қатысты қышқылдық
өндірістік судың агрессивтілігінің елеулі көрсеткіші
болып табылады. Сутек иондарының көтеріңкі концентрациясы
Н-катиондау кезінде пайда болады. Бұл процесс өндірістік суларды
әртүрлі катиондардың қоспаларынан тазарту үшін пайдаланылады.
Процесс нәтижесінде барлық катиондар сутек (Н+)
катионына (немесе, дәлірек, ![]() ) алмасады. Егер судағы катион-қоспалары
жеткілікті көп болса, катиондық тазалау (Н-катиондау) процесінің
нәтижесінде Н+ - иондарының концентрациясы
айтарлықтай жоғары болуы мүмкін, бұл судың
жоғары қышқылдығына әкеледі.
) алмасады. Егер судағы катион-қоспалары
жеткілікті көп болса, катиондық тазалау (Н-катиондау) процесінің
нәтижесінде Н+ - иондарының концентрациясы
айтарлықтай жоғары болуы мүмкін, бұл судың
жоғары қышқылдығына әкеледі.
Өндірістік сулардың қышқылдығы құрамында келесі заттардың болуына байланысты:
- күшті қышқылдар, көбінесе тұз (HCl) және күкірт (H2SO4) қышқылдары;
- әлсіз көп негізді қышқылдар, көбінесе көмір (H2CO3), фосфор (H3PO4) және кремний (H2SiO3) қышқылдары.
Бұл жағдайда зерттелетін ерітіндідегі қышқылдар титрленетін заттар болып, ал күшті негіз ерітіндісі, мысалы NaOH, титрант болып табылады. Қышқылдардың барлығы қосылған негізбен реакцияға түскенін анықтау үшін қышқылды-негізді индикаторлар пайдаланылады (мысалы фенолфталеин, метилоранж).
Ерітіндіде күшті және әлсіз көп негізді қышқылдар болатындықтан, титрлеу екі кезеңде жүреді деп болжауға болады:
I) Метилоранжбен титрлеу
Титранттың алғашқы үлестерін қосқанда, алдымен күшті қышқылдар реакцияға түседі:
HCl+NaOH→NaCl+H2O;
H2SO4+2NaOH→ Na2SO4+2H2O;
Барлық күшті қышқылдар реакцияға түскен, ал негіздің артық мөлшері әлі қосылмаған момент эквиваленттіктің бірінші нүктесіне сай келеді. Эквиваленттіктің бірінші нүктесінде күшті қышқылдар (Н+-иондарының көзі) және негіздер (ОН--иондарының көзі) болмайды, сондықтан ерітіндінің рН-ы негізінде судың автопротолизі және қалған әлсіз қышқылдармен анықталады. Күшті қышқылдарды титрлеудің секірмесі рН=5– 9 аралығында жатады. HCl және H2SO4 күшті қышқылдарымен қоса фосфор қышқылының бірінші саты бойынша титрленуі де жүреді
H3PO4+NaOH↔NaH2PO4+H2O (pH=3,96).
Күшті қышқылдарды титрлеудің соңғы нүктесін анықтау үшін индикаторларды қолдануға болады. Дәстүрлі түрде түстің өзгеру интервалы ∆рН=3,1÷4,4 болатын метилоранж индикаторы пайдаланылады. Метилоранж индикаторы эквиваленттік нүктеге жетпей түсін өзгертетінін еске ұстау қажет, демек күшті қышқылдардың кейбір мөлшері толық титрленбеген түрде қалады. Барлық күшті қышқылдар мен фосфор қышқылын бірінші саты бойынша титрлеу үшін бұл индикатор әбден жарамды.
2) Фенолфталеинмен титрлеу
Фенолфталеин индикаторымен титрлеу арқылы әлсіз қышқылдардың мөлшері анықталады: көмір (H2CO3), кремний (H2SiO3) және екінші саты бойынша фосфор (NaH2PO4) қышқылдары.
Көмір (1-саты бойынша), кремний (толық) және фосфор (2-саты бойынша) қышқылдарын титрлеу үшін фенолфталеин индикаторы қолданылады, оның түсінің өзгеру интервалы ∆pH=8-10 құрайды.
Фенолфталеин индикаторымен титрлеу нәтижелері карбонаттар мөлшерінің жартысына (HСO3- күйіне дейін), фосфаттардың бір бөлігіне (HPO42- күйіне дейін) және силикаттардың толық мөлшеріне сай келеді.
Көмір (Na2CO3 күйіне дейін) және фосфор (Na3PO4 күйіне дейін) қышқылдарын толық титрлеу іс жүзінде мүмкін емес, себебі бұл қышқылдардың диссоциациясының соңғы сатысындағы қышқылдық константалары өте төмен. Бұл қышқылдардың толық мөлшерін анықтау үшін кері титрлеу әдісін қолданады.
Жалпы қышқылдықты кері титрлеу әдісімен анықтау
Көмір және фосфор қышқылдарының мөлшерін анықтау үшін бастапқы талданатын ерітіндіге белгілі мөлшерде алынған сілтінің артық мөлшерін қосады. Сілті ерітіндідегі барлық қышқылдармен әрекеттеседі.
Реакцияға түспеген сілтінің артық мөлшерін тұз қышқылымен титрлейді: NaOH + HCl → NaCl + H2O.
2.2 Анықтауды орындау
Сыйымдылығы 250 см3
конустық колбаға талданатын судың 100 см3 сынамасы
алынады. Сынамаға 5 тамшы метилоранж индикаторын қосып, қызыл
түске боялған ерітіндіні 0,1н натрий гидроксиді ерітіндісімен
титрлейді, судың қышқылдығы ![]() 0,5 мг-экв/дм3 болса,
титрлеуді ерітінді қызғылт-сары түске өзгергенге дейін
0,01н натрий гидроксидінің ерітіндісімен жүргізеді.
Титранттың шығындалған көлемін (Vмо ,см3)
белгілеп алып, бес тамшы фенолфталеин индикаторын қосады да, сұйықтық
тұрақты қызғылт түске боялғанға дейін
титрлейді. Бұл көлемді Vфф, см3 деп
белгілейді. Сенімдірек нәтижелерді алу үшін талданатын судың
екіден кем емес параллель сынамаларын титрлеу ұсынылады. Параллель
анықтаулардың арасындағы айырмашылық 0,1 см3-ден
артық болмауы қажет.
0,5 мг-экв/дм3 болса,
титрлеуді ерітінді қызғылт-сары түске өзгергенге дейін
0,01н натрий гидроксидінің ерітіндісімен жүргізеді.
Титранттың шығындалған көлемін (Vмо ,см3)
белгілеп алып, бес тамшы фенолфталеин индикаторын қосады да, сұйықтық
тұрақты қызғылт түске боялғанға дейін
титрлейді. Бұл көлемді Vфф, см3 деп
белгілейді. Сенімдірек нәтижелерді алу үшін талданатын судың
екіден кем емес параллель сынамаларын титрлеу ұсынылады. Параллель
анықтаулардың арасындағы айырмашылық 0,1 см3-ден
артық болмауы қажет.
Көмір қышқылы бар қышқылдықты анықтау қажет болса, сыйымдылығы 250 см3 конустық колбаға 0,1н натрий гидроксиді ерітіндісінің тура мөлшерін құйып алады және колбаға бірден 100 см3 талданатын суды құяды, одан соң 5 тамшы фенолфталеин индикаторын қосып, араластырады және сұйықтықтың түсі қызғылт немесе қызыл күреңнен түссізге өзгергенге дейін 0,1н қышқыл ерітіндісімен титрлейді және титрлеуге шығындалған қышқылдың көлемін Vқ, см3 деп белгілейді.
2.3 Нәтижелерді өңдеу
Қышқылдықты Қ, мг-экв/дм3 (моль/дм3), келесі формулалармен анықтайды:
Қмо![]()
Қфф![]()
Қжалпы![]()
мұнда Vсын – талдауға алынған сынаманың көлемі, см3; Vмо – метилоранж бойынша титрлеуге шығындалған сілті көлемі; Vфф – фенолфталеин бойынша титрлеуге шығындалған сілті көлемі; Сэкв(NaOH) – NaOH-тың нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлық концентрациясы, моль/дм3); Сэкв(HCl) – HCl-дың нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлық концентрациясы, моль/дм3);
№3 зертханалық жұмыс. Судың сілтілігін анықтау
Жұмыстың мақсаты: судың сілтілігін анықтауды үйрену.
3.1 Теориялық кіріспе
Судың сілтілігі деп судағы гидроксил иондарының жоғары концентрациясына әкелетін заттардың жалпы мөлшерін айтады. Бұл – күшті негіздер, сонымен қатар гидролизге ұшырайтын және суға ОН- иондарын әкелетін күшті негіздер мен әлсіз қышқылдардың тұздары. Мысалы:
![]() ↔
↔![]()
Суда еріген затқа байланысты оның сілтілік реакциясын қамтамасыз ететін сілтіліктің бірнеше түрін ажыратады: гидраттық Сг (ОН- иондарының әсерінен), бикарбонаттық Сб (НСО3-), карбонаттық Ск (СО32-), фосфаттық Сфосф(HPO42-, PO43-), силикаттық Ссил (HSiO3-, SiO32-), гуматтық (гумин және фульвоқышқыл тұздарының әсерінен) және т.б.
Сілтілікті титрлеу әдісімен анықтайды. Титрленетін зат болып гидроксид иондары бар талданатын су табылады. Титрант – күшті қышқыл ерітіндісі. Тәжірибеде әдетте тұз (HCl) бен күкірт (H2SO4) қышқылдары және келесі индикаторлар: фенолфталеин (өту нүктесінде рН=8,3), метилоранж (рН=4,4), аралас индикаторлар (рН=5,1 және 5,4) пайдаланылады.
Қолданылатын индикаторларға байланысты сілтіліктің тағы да екі түрін ажыратады: фенолфталеин бойынша сілтілік Сф-ф және метилоранж бойынша сілтілік См-о.
Фенолфталеин бойынша сілтілік диссоциация және гидролиз процестерінің нәтижесінде суда ОН--топтарының болуына байланысты болғандықтан, фенолфталеиннің қатысында түссізденгенге дейін титрлеу кезде келесі реакциялар жүреді:
OH-+H+↔H2O
Бұл жағдайда гидролиз процесінде келесі реакциялар жүреді:
CO32-+ H2O↔HCO3- +OH-;
PO43-+ H2O↔HPO42-+OH-;
SiO32-+ H2O↔HSiO3-+OH-;
HSiO3-+ H2O↔H2SiO3+OH-.
Метилоранжбен титрлеген кезде жоғарыда келтірілген реакциялардан басқа келесі реакциялар жүреді:
НCO3-+ H2O↔H2CO3 +OH-;
НPO42-+ H2O↔H2PO4-+OH-.
Осылайша, метилоранж бойынша сілтілік судағы барлық күшті және әлсіз негіздердің мөлшеріне сәйкес болады, сондықтан оны көбінесе жалпы сілтілік (Сж) деп атайды, яғни Смо= Сж .
Электр стансаларының технологиялық суларындағы сілтілік көбінесе олардың құрамында гидроксид-, карбонат- және бикарбонат-иондарының болуына байланысты, олай болса жалпы сілтілікті, фенолфталеин бойынша сілтілікті және гуматты сілтілікті анықтағаннан кейін сілтіліктің басқа да түрлерін есептеуге болады (3.2 кесте).
3.1 к е с т е - Сілтіліктің түрлерін анықтау
|
Сфф және Сж арасындағы қатынас |
Судағы иондар |
Сілтілік түрлері |
||
|
Гидраттық Сг |
Карбонаттық Ск |
Бикарбо-наттық Сб |
||
|
2Сф-ф<Сж |
НСО3- және СО32- (гуматтар) |
болмайды |
Ск=2Сфф |
Сб=Сж-2Сфф+Сгум |
|
2Сф-ф=Сж |
СО32- |
болмайды |
Ск=Сж=2Сф-ф |
болмайды |
|
2Сф-ф >Сж |
СО32- және ОН- |
Сг=2Сфф-Сж+ Сгум |
Ск=2(Сж-Сфф-Сгум) |
болмайды |
|
Сф-ф=0 |
НСО3- |
болмайды |
болмайды |
Сб=Сж |
3.2 Анықтауды орындау
Сыйымдылығы 250 – 300 см3 таза конустық колбаға пипеткамен немесе өлшегіш цилиндрмен 100 см3 (немесе көлемі азырақ) талданатын су алынады. Егер көлемін азырақ алса, 100 см3-ге дейін таза сумен толтырып, фенолфталеин спирттік ерітіндісінің 2 – 3 тамшысын қосады және қызғылт немесе күрең қызғылт түске боялған сұйықтықты тұз немесе күкірт қышқылының титрленген ерітіндісімен түссізденгенге дейін титрлейді. Титрлеуге шығындалған қышқыл мөлшерін Vфф деп белгілейді.
Одан кейін осы колбаға 2 – 3 тамшы метилоранж қосып, бюреткаға қышқыл құймай, түсі сарыдан қызғылт сарыға өткенге дейін титрлеуді жалғастырады (қызыл түске жету қосылған қышқылдың артық мөлшерін білдіреді – сынама артық титрленген, тәжірибені қайтадан жүргізу керек). Титрлеуді белсенді және жиі-жиі араластырумен жүргізеді, ерітіндінің көлемінде реакция жүруі үшін қышқылды тамшылатып қосады. Метилоранжбен титрлеуге кететін қышқыл шығынын Vмо деп белгілейді.
Егер фенолфталеин қосқаннан кейін ерітінді түссіз болса, демек фенолфталеин бойынша сілтілігі жоқ. Бұл жағдайда сынамаға метилоранж қосып, жоғарыда айтылғандай, титрлеу жүргізіледі.
3.3 Нәтижелерді өңдеу
Талданатын судың сілтілігі, мг-экв/дм3 (ммоль/дм3), келесі формулалармен анықталады:
Сфф =![]() ;
;
Сж=![]() ;
;
Сгум =![]() ;
;
мұнда Сфф – фенолфталеин бойынша сілтілік; Сж – метилоранж бойынша сілтілік немесе жалпы сілтілік; Сгум - гуматтық сілтілік; Vсын – талдауға алынған су сынамасының көлемі, см3; Сэкв(қышқыл) – қышқылдың нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлық концентрациясы, моль/дм3); Vфф – фенолфталеинмен титрлеуге шығындалған қышқыл көлемі, см3; Vмо – метилоранжбен титрлеуге шығындалған қышқыл көлемі, см3; Сэкв(сілті) – сілтінің нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлық концентрациясы, моль/дм3); Vгум – гумин қышқылдарын титрлеуге шығындалған сілті көлемі, см3.
№4 зертханалық жұмыс. Көмір қышқылын анықтау
Жұмыстың мақсаты: судағы көмір қышқылының концентрациясын анықтауды үйрену.
4.1 Теориялық кіріспе
Табиғи суларда көмір
қышқылы келесі түрлерде кездеседі: CO2 , H2CO3,
![]() ,
, ![]() .
Көмір қышқылының судағы концентрациясы ерітілген CO2
концентрациясының ондық үлестерін
құрайтындықтан, әдетте көмір
қышқылының концентрациясын CO2 арқылы
өрнектейді. Суда көмір қышқылы екі саты бойынша
диссоциацияланады – бикарбонат- және карбонат-иондардың
түзілуімен:
.
Көмір қышқылының судағы концентрациясы ерітілген CO2
концентрациясының ондық үлестерін
құрайтындықтан, әдетте көмір
қышқылының концентрациясын CO2 арқылы
өрнектейді. Суда көмір қышқылы екі саты бойынша
диссоциацияланады – бикарбонат- және карбонат-иондардың
түзілуімен:
![]() ;
;
![]() .
.
Көмір қышқылының әртүрлі
формаларының қатынасы тұрақты температурада сутек
иондарының концентрациясымен анықталады, яғни судың рН
мәнімен. рН-тың төменгі мәндерінде көмір
қышқылының барлығы ерітілген CO2 түрінде
болады. рН жоғарлаған сайын CO2 үлесі
азаяды да ![]() үлесі
жоғарылайды. рН =8,35 көмір қышқылының
барлық түрлері
үлесі
жоғарылайды. рН =8,35 көмір қышқылының
барлық түрлері ![]() -ке айналады. рН мәнін ары
қарай жоғарылату
-ке айналады. рН мәнін ары
қарай жоғарылату ![]() -ионының
-ионының ![]() -ке ауысуына әкеледі.
Соңғысының концентрациясы максимальды мәніне рН=12
жетеді.
-ке ауысуына әкеледі.
Соңғысының концентрациясы максимальды мәніне рН=12
жетеді.
Көмір қышқылының судағы әртүрлі формаларының балансын келесі теңдеумен өрнектеуге болады:
![]() .
.
Тәжірибеде бос көмір қышқылын сілті ерітіндісімен бикарбонатқа дейін титрлеп, анықтайды:
CO2+H2O↔H2CO3
H2CO3+NaOH↔NaHCO3+ H2O
4.2 Анықтауды орындау
4.1 суретте көрсетілген аспап құрастырылады. Аспапты каучукты құбыршамен 2 алу нүктесіне жалғап, құбырша 3 арқылы құйылуына мүмкіндік беріп, колбаны 1 талданатын сумен толтырады. Бұдан кейін резеңке құбыршаны 2 қысқышпен қысып, құбыршаны 3 құрамында аскарит немесе натронды ізбесі бар хлоркальцийлі құбыршамен ауыстыра отырып, алып тастайды. Құбыршадағы 2 қысқышты әлсіретеді және ондағы сұйықтық деңгейі 200 см3 белгіге жеткенше судың колбадан ағып кетуіне мүмкіндік береді. Құбыршаны 2 қайтадан қысады және бюретка 5 арқылы фенолфталеиннің 1%-дық ерітіндісінің 0,2 см3 енгізеді. Енді сұйықтықты тиісті түс тұрақтанғанға дейін сұйықтықтың түсін эталонмен салыстыра отырып 0,1н немесе 0,01н сілті ерітіндісімен титрлейді. Егер эталон талданатын суда дайындалса, онда сондай өлшемді колбаға сақтандырусыз 200см3 талданатын су құйылады, оған 0,2 см3 0,01%-дық фенолфталеин ерітіндісі және 1см3 30%-дық сілті ерітіндісі қосылады. Сынаманы титрлегенде алынған эталонның түсіне жетуге ұмтылады. Егер эталондарды буферлі қоспалардан дайындаса, 4.1 суретте көрсетілгендей бірдей өлшемді екі колба алынады. Бұл колбалардың біреуіне 120 см3 Na3BO3 ерітіндісі және 80 см3 тұз қышқылының 0,1н ерітіндісі құйылады, бұл қоспа рН=8,3. Екінші колбаға 130 см3 борлы қышқыл натрдың ерітіндісі және 70 см3 0,1н тұз қышқылы құйылады, бұл қоспада рН=8,5. Екі колбаға да 0,2 см3 1%-дық фенолфталеин ерітіндісін енгізеді және колбаларды резеңке тығындармен нығыздап жабады. Бұл эталондар 1 ай бойы тұрақты. Титрлеу қарқындылығы «эталондар аралығында», яғни біреуінен ашығырақ және екіншісінен боздау болатын күйге жетуге ұмтылады. Бұл кезде титрленетін сұйықтықтың рН мәні шамамен 8,4-ке дейін жетеді.
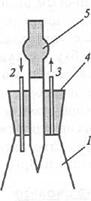
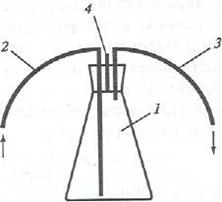
4.1 сурет - Су сынамасын алуға және ондағы бос көмір қышқылын анықтауға арналған аспап
1 – конустық колба; 2 – талданатын суды әкелуге арналған құбырша; 3 – талданатын суды әкетуге арналған құбырша; 4 – резеңке тығын; 5 – титрлеу жүргізілетін бюретка ұшы.
4.3 Нәтижелерді өңдеу
Талдаудың нәтижелері келесі формула арқылы алынады:
С(СО2)=![]()
мұнда С(СО2) – талданатын судағы бос көмір қышқылының концентрациясы, мг/дм3; VNaOH – 200 см3 талданатын суды титрлеуге шығындалатын 0,1н немесе 0,01н сілті ерітіндісінің көлемі, см3; 44 – берілген реакциядағы СО2 эквиваленттерінің молярлы массасы, г/моль; Сэкв (NaOH) - титрлеуге қолданылған сілті ерітіндісінің нормальдігі, г-экв/дм3 (эквиваленттердің молярлы концентрациясы, моль/дм3); К – сілтілік нормальдігін түзету коэффиценті; 200 – талдауға алынған су сынамасының көлемі, см3.
Н – катиондалған судағы көмір қышқылының мөлшерін анықтағанда VNaOH шамасынан осындай көлемді суды метилоранжбен титрлеуге кеткен сілті ерітіндісінің шығынын, яғни минералды қышқылдардың мөлшерін (қышқылдық) алып тастайды.
4.4 Бос көмірқышқылын кері титрлеу әдісімен анықтау
Сынаманы алу және дайындау
Бос СО2 –нің концентрациясы 5 мг/дм3-ден артық және бос минералды қышқылдары жоқ (рН>4,5) табиғи судың және декарбонизаторлардан кейінгі судың сынамаларын алу 4.1 суретте көрсетілген құрылғының көмегімен жүргізіледі. Стақанға сыйымдылығы 200-250 см3 тарирленген ыдысты салады. Ыдыстың түбіне дейін сынама алатын штуцерге резеңке шлангімен жалғасқан шыны құбырша түсірілген судың стақанға деңгейі ыдыс аузынан 5-10 см-ге жоғарылағанша ыдыс арқылы су жіберіледі. Одан кейін ақырындап шыны құбыршаны суырып алады, ал ыдысты сол мезетте су астында тығынмен жабады. Жабық ыдысты стаканнан алып шығады да зертханаға көшіреді.
Сынама алатын тарирленген ыдыс ретінде сыйымдылығы сәйкес өлшегіш колбаны пайдалануға болады, оның аузындағы белгі мүмкіндігінше төмен болуы қажет.
Н – катиондалған су мен бос минералды қышқылдары бар (рН<4,5) судың сынамасын алуды да осылай жүргізеді.
4.5 Анықтауды жүргізу
Бос көмір қышқылының концентрациясы қышқылдары жоқ суларды кері титрлеу әдісімен талдайды. Бұл үшін өлшегіш колбадан деңгейі тура 250 см3 көлемді білдіретін белгіде тұратындай етіп судың бір бөлігін ағызып тастайды. Одан кейін колбаға 3-5 тамшы финолфталеин ерітіндісін және тамызғышпен 1,0 см3 0,5н NaOH ерітіндісін (немесе 5,0 см3 0,1н ерітіндісін) қосады. Колбаны тығынмен жауып, ішіндегіні мұқият араластырады. Сұйықтықты титрлеуге арналған колбаға құйып, сынама алуға арналған колбаны жаңадан қайнатылған тұзсызданған судың азғантай мөлшерімен (10-15 см3) 1 – 2 рет шайқайды. Оларды негізгі сынамаға қосып, қызыл күрең түске боялған сұйықтықты 0,1н тұз қышқылының ерітіндісімен индикатор бояуы кеткенге дейін титрлейді. Шығындалған қышқыл көлемін V1 белгілейді.
4.6 Нәтижелерді өңдеу
Бос көмірқышқылының концентрациясын келесі формуламен есептейді (мг/дм3) :
С(СО2)=![]() ,
,
мұнда Сэкв (NaOH) – күйдіргіш натрдың титрленген ерітіндісінің нормальдік концентрациясы г-экв/дм3 (эквиваленттердің молярлы концентрациясы, моль/дм3); V(NaOH ) – талдау кезінде қосылатын осы ерітіндінің көлемі, см3; V1 – NaOH – тың артық мөлшерін кері титрлеуге шығындалған тұз қышқылы ерітіндісінің көлемі, см3; Сэкв(HCl) – бұл ерітіндінің нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлы концентрациясы, моль/дм3); Vсын – талдауға алынған су сынамасының көлемі, см3; Мэкв(СО2)=44 – СО2 эквивалентінің молярлы массасы, г/моль.
Бос минералды қышқылдары бар (рН<4,5 болатын) суларды да кері титрлеу әдісімен талдайды. Сынама алынатын тарирленген ыдыстан судың бір бөлігін тарирленген ыдыстың көлемін көрсететін белгіге дейін ағызып тастайды. Одан кейін колбаға 3 – 5 тамшы фенолфталин индикаторын және тамызғышпен 5,0 см3 0,5н NaOH ерітіндісін қосады. Колбаны тығынмен жауып, ерітіндіні мұқият араластырады. Сұйықтықты титрлеуге арналған қолбаға құйып, сынама алуға арналған колбаны жаңадан қайнатылған тұзсызданған сумен шайқайды және ішіндегіні 0,1н тұз қышқылының ерітіндісімен фенолфталеиннің қызыл күрең түсі кеткенге дейін титрлейді. Шығындалған қышқыл көлемін V2 деп белгілейді. Одан кейін талданатын сынамаға 1 – 2 тамшы метилоранж индикаторының ерітіндісін қосады және титрлеуді ерітінді қызғылт сары (бірақ қызыл емес!) түске боялғанға дейін бюреткаға қышқыл құймай титрлеуді жалғастырады. Бұл кезде шығындалған қышқыл көлемін V3 деп белгілейді.
Нәтижелерді өңдеу
Құрамында минералды қышқылдары бар сулардағы бос көмірқышқылының концентрациясы:
С(СО2)=![]()
мұнда V2 - фенолфталеин индикаторымен титрлеуге шығындалған тұз қышқылының көлемі, см3 ; V3 – метилоранж индикаторымен титрлеуге шығындалған тұз қышқылының көлемі, см3 ; Сэкв(HCl) – бұл ерітіндінің нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлы концентрациясы, моль/дм3); Vсын – талдауға алынған су сынамасының көлемі, см3 ; Мэкв(СО2)=44-СО2 эквивалентінің молярлы массасы, г/моль.
Ескерту. Егер әлсіз ұшпайтын органикалық қышқылдардың кедергі келтіретін әсеріне түзету анықтауы жүргізілсе, онда бұл жағдайда бос көмірқышқылының концентрациясы келесі формула арқылы есептеледі:
С(СО2)= ![]()
мұнда V2 және V3 - сәйкесінше фенолфталеинмен және метилоранжбен алдын ала қайнатылған сынамаларды титрлеуге шығындалған HCl ерітіндісінің көлемі, см3.
№ 5 зертханалық жұмыс. Аммиак және аммоний тұздарының мөлшерін анықтау
Жұмыстың мақсаты: судағы аммиак пен аммоний тұздарының мөлшерін анықтауды үйрену
5.1 Теориялық кіріспе
Аммиак (әдетте аммоний тұздары түрінде) – беттік табиғи суларда жиі кездесетін қоспа болып табылады. Бұл қоспа грунттық суларда да жиі кездеседі. Аммиактың пайда болуы құрамында азоты бар әртүрлі органикалық заттардың минералдану процесіне байланысты. Жылу күштік шаруашылық суларында аммиактың болуы оның көптеген табиғи сулардың әдетті қоспасы екендігінен бұрын мына жағдайға байланысты: коррозиялық процестерді әлсірету үшін бірқатар электростансаларда бу-су цикліне аммиакты арнайы қосады. Бұл жағдайда аммиактың будағы қалыпты мөлшері бу құрамындағы көмір қышқылының концентрациясына байланысты болады. Әдетте аммиакты қосуды бу конденсатының рН мәні 9,1±0,1 болатындай етіп реттеп отырады. СО2 мөлшері 2-3 мг/дм3 шамасында болса, аммиактың концентрациясын 0,5-1,0 мг/дм3 деңгейінде ұстап тұру жеткілікті. Аммиактың судағы айтарлықтай жоғарырақ концентрациялары онымен әсерлесетін жез және басқа да мыс қорытпалары үшін, әсіресе бұл суда еріген оттегі бір уақытта болғанда, коррозиялық қауіптілік көрсетеді.
Бос негіз, карбонат немесе бикарбонат түрінде кездесетін аммиак концентрациясы метилоранж индикаторын қосып, 0,01н тұз (немесе күкірт) қышқылының ерітіндісімен тура титрлеу арқылы анықталуы мүмкін. Титрлеу кезінде өтетін реакциялар:
NH3 - H2O + HCl ↔ NH4Cl + H2O
NH4HCO3 + HCl ↔ NH4Cl + CO2 + H2O
(NH4)2 CO3+ 2HCl ↔ 2NH4Cl + CO2 + H2O.
Бұл әдіс қаныққан, аса қыздырылған будағы және шығыр шығындағы аммиакты анықтауға қолданылады. Сонымен бірге аммиак мөлшері 0,3-0,4, мг/дм3-ден артық болғанда ғана қолданылады. Аммиактың аз мөлшерінде әдістеме қолданылмайды, өйткені титрлеуге 0,01н қышқыл ерітіндісінің шығыны 0,6 см3-ден аз және анықтау дәл емес болады.
Сенімдірек және дәлірек нәтижелерді аммиак және аммоний тұздарын Несслер реактивін пайдаланып колориметрлік әдіспен анықтау арқылы алуға болады.
Эквиваленттілік нүктесінде рН=5,1 шамасында болатындықтан, бұл титрлеуге жарайтын индикатордың рН=5,0.
5.2 Анықтауды орындау
Конустық колбаға 100 см3 талданатын конденсатты құйып алып, 2-3 тамшы индикатор қосады және ақырындап 0,01н тұз немесе күкірт қышқылының ерітіндісімен титрлейді (егер метилоранж индикаторы қолданылса – сарыдан қызғылт сарыға; метилқызыл индикаторы қолданылса – сарыдан қызылға; аралас индикатор қолданылса – жасылдан шарапты қызылға түй өзгергенге дейін). Екі-үштен кем емес параллель титрлеуді жүргізеді.
5.3 Нәтижелерді өңдеу
Аммиак концентрациясын, мг/дм3, келесі формуламен есептейді:
C (NH3)=![]()
мұнда VHCl – титрлеуге шығындалған тұз қышқылы ерітіндісінің көлемі, см3; Сэкв(HCl) – тұз қышқылының концентрациясының нормальдігі, г-экв/дм3 (эквиваленттердің молярлы концентрациясы, моль/дм3 ); Vсын - талдауға алынған сынама көлемі, см3; 17 – аммиак эквивалентінің молярлы массасы, г/моль.
№ 6 зертханалық жұмыс. Судың кермектілігі
Жұмыстың мақсаты: Судың кермектілігін анықтауды үйрену.
6.1 Теориялық кіріспе
Кермектілік деп судағы кальций және магний иондарының эквиваленттерінің молярлы концентрацияларының (нормальдіктерінің) қосындысын айтады. Лезде бақылау кезінде кермектілік катионитті сүзгілерден кейінгі суларда, коагуляция мен ізбестеуді жүргізгенде мөлдірлеткіш суында және буды өндірістік тұтынушыларының конденсатында анықталады.
Жалпы кермектілікті кальций және магний иондарының қосынды концентрациясы түрінде анықтайды:
Кж=Cэкв(Са2+)+Сэкв(Mg2+)
Кальций кермектілігі кальций иондарының концентрациясына байланысты:
КСа2+= Cэкв(Са2+)
Магний кермектілігі магний иондарының концентрациясына байланысты:
КMg2+= Сэкв(Mg2+)
Кермектіліктің өлшем бірлігі г-экв/дм3(моль/дм3), мг-экв/дм3(ммоль/дм3) немесе мкг- экв/дм3(мкмоль/дм3).
Кермектілікті қамтамасыз ететін қосылыстардың табиғаты бойынша карбонатты (уақытша) Кк және карбонатты емес (тұрақты) Кке кермектіліктерді ажыратады.
Карбонатты кермектілік гидрокарбонат- және карбонат-иондарына эквивалентті кальций және магний иондарының болуымен түсіндіріледі (Ca(HCO3)2, MgCO3) . Егер Кж > Сж болса, онда Кк = Сж, ал кері жағдайда
Кк = Кж.
Карбонатты емес (бейкарбонатты) кермектілік деп күшті қышқылдар
аниондарымен (хлоридтер, сульфаттар, нитраттар) байланысқан кальций және магний иондарының мөлшерін айтады (CaSO4, MgCl2, Ca(NO3)2):
Кке = Кж - Кк
Судың жалпы кермектілігін комплексонометрлік (комплексонометрия) титрлеу әдісімен анықтайды. Бұл әдісті кермектілігі 5 мкг-экв/дм3-ден жоғары болатын өндірістік сулар үшін пайдалануға болады.
Кермектілікті анықтау әдісі комплексті қосылыстар түзетін реакцияларда негізделеді. Онда Са2+ және Mg2+ иондары комплекс түзуші рөлін, ал металлоиндикатор молекуласы және ЭДТА (трилон Б) - лиганд рөлін атқарады. Анықтауды жүргізудің негізгі шарты ерітіндінің рН-ын бақылау болып табылады.
Біріншіден, Са2+, Mg2+ иондары мен индикаторлар және ЭДТА арасында тұрақты комплекстер түзілуі үшін рН= 9–10 белгілі мәнін ұстап отыру қажет, ол үшін сынамаға NH3-H2O және NH4Cl қоспасы болып табылатын аммиакты буферлі ерітінді қосады.
Екіншіден, ЭДТА ортаның рН-ның әртүрлі көрсеткіштерінде бірнеше түрде болуы мүмкін, бірақ бұл түрлердің тек біреуінде ғана кальций және магний мен тұрақты комплекстер түзілуі мүмкін. рН=9-10 болғанда ЭДТА-ның белсенді түрінің молярлық үлесі айтарлықтай үлкен, бірақ оны одан ары үлкейтуге (ортаның рН-ын жоғарылатып) болмайды, өйткені күшті сілтілі ортада тұнбаға түсетін магний гидроксиді (Mg(OH)2) түзілуі мүмкін.
Талданатын суға металлоиндикатордың ерітіндісін қосқанда (мысалы, көк қышқылды хром К), ол Са2+ және Mg2+ иондарымен комплекс түзеді, бұл кезде ерітінді түсін өзгертеді (шарапты-қызыл түске боялады):
Ca2++HInd2-+NH3→CaInd-+NH4+;
Mg2++HInd2-+NH3→MgInd-+NH4+.
Одан кейін боялған ерітіндіге жайлап ЭДТА ерітіндісін қосады. Кальций және магний иондарының ЭДТА-мен комплекстерінің тұрақтылық константалары кальций және магний иондарының индикатормен комплекстерінің тұрақтылық константаларына қарағанда жоғары. ЭДТА-ны қосқанда кальцийдің (магнийдің) индикатормен комплекстері бұзылып, кальцийдің (магнийдің) ЭДТА-мен түссіз комплекстері түзіледі. Оның нәтижесінде ерітінді бос индикатордың көкшіл түсіне ие болады:
CaInd-+H2Y2-+NH3→CaY2-+HInd2-+NH4+;
MgInd-+H2Y2-+NH3→MgY2-+HInd2-+NH4+.
Индикатор түсінің өзгеруіне дейін шығындалған ЭДТА көлемі бойынша кальций және магний иондарының концентрациясын есептейді.
Талданатын суда болатын Cu2+, Fe3+, Zn2+, Mn2+ катиондары индикатормен өте берік комплексті қосылыстар түзеді және титрлеу процесінде ерітіндінің түсі өзгермейді немесе ЭДТА-ның өте көп артық мөлшерінде де өте баяу өзгереді. Бұл құбылыс индикатордың тыйымдалуы деген атқа ие болды. Бәсекелесетін реакциялардың алдын алу үшін кедергі келтіретін металл иондарын тұндыру немесе экстракция арқылы ерітіндіден алып тастау қажет.
Әр ионға (Са2+ немесе Mg2+) байланысты кермектікті жеке анықтау үшін ЭДТА тек біреуіне ғана әсер ететіндей жағдай жасау қажет.
Кальцийлік кермектілік
Кальций және магний сілтілік ортада ЭДТА-мен берік комплекс түзеді және жарамды индикатор болғанда онымен титрленеді. Егер ортаның рН-ы жеткілікті жоғары болса, магний Mg(OH)2 түрінде тұнбаға түседі:
Mg2++2OH- →Mg(OH)2↓
Бұл жағдайда кальций ерітіндіде қалып қояды, оны ЭДТА – ның стандартты ерітіндісімен титрлеуге болады:
Са2++Н2Y2-+2OH-→CaY2-+2H2O
Бұл жағдайда индикатор ретінде мурексид, кальцион немесе флуорексон қолданылуы мүмкін, олар титрлеу процесінде кальций иондарының концентрацияларының өзгеруі кезінде түсін өзгертеді.
Магнийлік кермектілік
Егер кальций иондарын титрлеу аяқталғаннан кейін ортаның рН-ын 8-9-ға дейін төмендетсе, магний гидроксиді ерітіндіге өтеді және магний иондарын ЭДТА ерітіндісімен титрлеу мүмкін. рН-тың төмендеуі талданатын ерітіндіге аммоний хлоридін (NaOH+NH4Cl=NaCl+NH4OH) қосу арқылы немесе қышқылмен бейтараптап, одан соң аммиакты буферді қосумен жүргізіледі.
Сонымен қатар магнийлік кермектікті жалпы және кальцийлік кермектіліктер арасындағы айырма бойынша немесе кальцийді аз еритін оксалаттар түрінде тұндыру арқылы анықтауға болады:
Ca2++C2O42-+ H2O→CaC2O4∙2H2O↓
одан кейін магнийді ЭДТА ерітіндісімен титрлейді:
Mg2++Н2Y2-+2OH-→MgY2-+2H2O
6.2 Сынаманы дайындау
Талдау үшін сынаманы талданатын сумен алдын ала шайқалған таза ыдысқа алады. Егер сынама лай болса (қалқыған заттармен ластанған), оны сүзу қажет. Алуға ұсынылатын сынамалар 6.1 кестеде келтірілген.
6.1 к е с т е - Талдау үшін су сынамаларының ұсынылатын көлемдері
|
Жалпы кермектіліктің күтілетін мәні, мг-экв/дм3 |
Су сынамасының көлемі, см3 |
|
1-ден аз |
100 |
|
5-ке дейін |
100 |
|
9-ға дейін |
50 |
|
15-ке дейін |
25 |
Сыйымдылығы 250-300 см3 таза конустық колбаға пипеткамен талданатын судың белгілі көлемін құйып алады, 100 см3 жалпы көлемге дейін тұзсызданған сумен толтырып, 5 см3 аммиакты қоспа және 5 см3 натрий сульфидінің (немесе натрийдің диэтилдитиокарбаматы) ерітіндісін құяды.
Егер ерітіндіде анықтауға кедергі келтіретін мыс және темір иондары болса, онда ерітінді не қараяды, не лай немесе тұнба пайда болады. Бұл жағдайда сынаманы «ақ таспа» қожсыз фильтр қағазы арқылы сүзіп, фильтратты сыйымдылығы сондай таза конустық колбаға жинайды. Сұйықтықтың барлық көлемін сүзгіден өткізгеннен кейін сүзгіні бір рет тазаланған сумен жуады, жуатын суларды сол колбаға жинап, индикатор қосады да титрлеуге кіріседі.
6.3 Жалпы кермектілікті анықтау
Егер талданатын суда кедергі келтіретін иондар болса, сынаманы талдауға жоғарыда айтылған әдістеме бойынша алдын ала дайындайды. Егер талданатын суда кедергі келтіретін иондар болмаса, онда сынамаға 5 см3 аммиакты буферлі ерітінді енгізеді, 5-6 тамшы қара-көк қышқылды хром индикаторының ерітіндісін немесе эрихром қара Т қосып (бұл индикатордың ерітіндісін эрихром қара Т қатты индикаторлы қоспаның бірнеше түйіршектеріне алмастыруға болады), араластырады және жайлап ЭДТА ерітіндісімен шарапты-қызыл түстен көкшіл түске өткенге дейін титрлейді. Трилон Б ерітіндісінің көлемін Vж, см3 деп белгілейді.
Жалпы кермектілікті келесі формуламен анықтайды:
Кж=![]() [мг-экв/дм3]
[мг-экв/дм3]
мұнда Кж – жалпы кермектілік, мг-экв/дм3 ; Vж – титрлеуге шығындалған трилон Б ерітіндісінің көлемі, см3 ; Vсын –тәжірибеге алынған сынама көлемі, см3 ; Сэкв(ЭДТА) – ЭДТА ерітіндісінің нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлы концентрациясы, моль/дм3).
6.4 Кальцийлік кермектілікті анықтау
Титрлеу үшін таза колбаға өлшегіш цилиндрмен немесе пипеткамен талданатын судың белгілі көлемі алынады (6.1 кесте), қажет болса 100 см3 жалпы көлемге дейін тұзсызданған сумен жеткізеді, 2 см3 2н NaOH ерітіндісін қосып араластырады және 5 минутқа қалдырады, бұл уақыт аралығында Mg(OH)2 тұнады.
Егер талданатын суда кедергі келтіретін иондар болса, онда сынаманы жоғарыда айтылған әдістеме бойынша алдын-ала дайындайды. Магний иондары тұнғаннан кейін сынамаға мурексид қатты индикаторлы қоспасының бірнеше түйіршектерін (немесе флуорексон) қосып араластырады да, трилон Б ерітіндісімен қызғылт күрең түстен күрең көк түске өзгергенге дейін титрлейді.
Егер рН=12 болса, кальцийлі кермектілікті қара-көк хром индикаторымен де титрлеуге болады. Титрлеуді ерітінді түсі қызыл күрең түстен күрең көк түске өзгергенге дейін жүргізеді.
Шығындалған трилон Б ерітіндісінің көлемі VСа, см3 деп белгілейді.
Кальцийлік кермектілікті келесі формула бойынша есептейді:
Кса=![]() [мг-экв/дм3, ммоль/дм3] ,
[мг-экв/дм3, ммоль/дм3] ,
мұнда Vса – титрлеуге кеткен ЭДТА көлемі, см3; Vсын – талдауға алынған сынама көлемі, см3; Сэкв(ЭДТА) – ЭДТА ерітіндісінің нормальдік концентрациясы, г-экв/дм3 (эквиваленттердің молярлы концентрациясы, моль/дм3).
Кальций концентрациясын С(Са2+)=Кса∙ 20,04 [мг/дм3] формуласы бойынша есептейді, мұнда 20,04 – кальций эквивалентінің молярлы массасы, мг/ммоль.
6.5 Магнийлік кермектілікті анықтау
Магнийлік кермектікті жалпы және кальцийлік кермектіліктердің айырымы бойынша анықтайды. Бұл көрсеткішті тәжірибелік жолмен, яғни титриметрлік әдіспен де анықтауға болады. Ол үшін титрлеуге арналған таза колбаға өлшегіш цилиндр немесе пипеткамен талданатын судың белгілі көлемін құяды (6.1 кесте), қажет болса көлемін тұзсыздандырылған сумен жалпы көлемі 100 см3-ге дейін толықтырады, кальций иондарын тұндыру үшін аммоний оксалатының 5 см3 мен аммиакты буферлі ерітіндінің 5 см3 қосады. Судың жалпы сілтілігі 5 мг-экв/дм3-ден жоғары болса, аммоний оксалатының мөлшерін де пропорционалды жоғарлату қажет. 10 минуттан кейін кальций оксалатының тұнбасы толық түзіледі. Көп мөлшерде қоймалжын тұнба түзілсе сынаманы «ақ таспа» тығыз күлсіз фильтр қағазы арқылы сүзіп, фильтр қағазын тазартылған судың шамалы мөлшерімен жуады. Бұл суларды да сол колбаға жинап, титрлеуді бастайды.
Сынамаға 3—6 тамшы қышқылдық қара-көк хром индикаторын немесе қара эриохром Т индикаторын (индикатор ерітіндісі орнына қара эриохром Т индикаторының бірнеше түйіршектерін салуға болады) қосып араластырады да түсі қызыл-күлгін түстен көгілдір-көк түске ауысқанға дейін ЭДТА ерітіндісімен баяу титрлейді. ЭДТА ерітіндісінің шығындалған көлемін (V, см3) дәлелдейді. Магнийлік кермектілікті (мг-экв/дм3 немесе ммоль . экв)/дм3) келесі формуламен есептейді:
![]()
мұнда VMg — титрлеуге шығындалған ЭДТА көлемі, см3; Vсын — талдауға алынған сынама көлемі, см3; Сэкв (ЭДТА) — ЭДТА ерітіндісінің нормальдігі, г-экв/дм3 (эквиваленттік молярлы концентрациясы, моль/дм3) .
Магний концентрациясын келесі формуламен есептейді:
C(Mg2+)=КMg . 12,16 [мг/дм3],
мұнда 12,16 — магний эквивалентінің молярлы массасы, мг/ммоль.
№ 7 зертханалық жұмыс. Хлорид-иондарының мөлшерін анықтау
Жұмыстың мақсаты: Судағы хлорид-иондар мөлшерін анықтауды үйрену
7.1 Теориялық кіріспе
Хлоридтардың концентрациясын меркуриметрлік немесе аргентометрлік әдістермен анықтауға болады. Бұл әдістер хлоридтерді табиғи (шикі), жұмсартылған, қоректік және қазандық суларда анықтауға жарайды. Қазандарды шықтық қоректендірудегі қоректік су мен бу шығында хлоридтерді анықтау бұл әдістермен жүргізілмейді. Мұндай суларды нефелометрлік және колориметрлік әдістермен талдайды.
Хлоридтерді жиірек олардың сынап(II)-иондарымен аз диссоциациялана-тын қосылысты түзуге негізделген меркуриметрлік әдіспен анықтайды.
Анықтауды дифенилкарбазид немесе нитропруссид индикаторларымен тура титрлеу әдісімен жүргізеді. Нитропруссид индикаторы улы зат болғандықтан, оны қолданбауға тырысу керек.
7.2 Анықтауды орындау
Аликвотаны дұрыс таңдау үшін талдауды жүргізудің алдында хлорид-иондардың массалық концентрациясының сапалық анықтауын жүргізеді. Талданатын сынаманың көлемі 5см3 аликвотты бөлігін көлемі 10 см3 пробиркаға құйып, азот қышқылының 1-2 тамшысымен қышқылдатып, күміс нитраты ерітіндісінің 3-5 тамшысын қосып араластырады. Тұнбаның мөлшеріне байланысты 7.1-кестеге сәйкес талдауды жүргізуге қажетті сынаманың аликвотты бөлігін таңдайды.
7.1 к е с т е - Талданатын судың аликвотты бөлігін таңдау
|
Тұнбаның сипаттамасы |
Сынаманың аликвотты бөлігінің көлемі, см3 |
|
Үлкен үлпектәрізді тұнба Қатты лайланған Аз лайланған Опалесценция |
1-5 10 20-50 50-100 |
Дифенилкарбазид индикаторымен титрлеу. 1-10 мг хлоридтері бар талданатын судың өлшенген бөлігін көлемі 250 см3 конустық колбаға құйып, көлемін 100 см3–ге дейін тұзсыздандырылған сумен жеткізіп, 5-6 тамшы индикатор ерітіндісін қосады. Ерітінді түсі көкшіл немесе күлгін болса (рН>7, сілтілік ортаны көрсетеді), оны 0,5 %-дық азот қышқылы ерітіндісімен сары немесе жасыл-сары түске дейін бейтараптайды. Егер рН<7, яғни орта қышқылдық болса, ерітіндіні 0,1 н натрий гидроксиді ерітіндісімен түсі көгілдірге айналғанша бейтараптайды да қайтадан 0,5% азот қышқылымен жасыл-сары түске дейін апарады. Бейтарапталған сынаманы сынап (II) нитраты ерітіндісімен түсі лимон-сарыдан көк-ақшыл көкке айналғанға дейін титрлейді.
Мұнымен қатар бақылау тәжірибесін жүргізеді. Азот қышқылы мен индикатор қосылған таза суда лайдың түзілуіне сынап (II) нитраты ерітіндісінің шығыны ≤0,05 см3 құрайды.
7.3 Нәтижелерді өңдеу
Хлорид-иондар мөлшерін , мг/дм3, келесі формуламен есептейді:
![]()
мұнда V— талданатын сынаманың титрлеуіне шығындалған сынап нитраты ерітіндісінің көлемі, см3; Vo — «бос» сынаманың титрлеуіне шығындалған сынап нитраты ерітіндісінің көлемі, см3; Сэкв (Hg(NO3)2) — сынап нитраты ерітіндісінің эквиваленттік концентрациясы, моль/дм3 , г-экв/дм3;
35,5 — хлорид-ионының эквивалентінің молярлы массасы, г/моль;
Vсын — талдауға алынған сынаманың көлемі, см3.
№8 зертханалық жұмыс. Судың тотығушылығын (оттегіні химиялық жұмсауды) анықтау
Жұмыстың мақсаты: судың тотығушылығын анықтауды үйрену.
8.1 Теориялық кіріспе
Оттегіні химиялық жұмсау (ОХЖ) деп күшті тотықтырғыштармен әрекеттесетін тотықсыздандырғыштардың (бейорганикалық және органикалық) судағы жалпы мөлшерін сипаттайтын шаманы айтады. Әдетте бұл шаманы тотығуға шығынданатын оттегі мөлшерінің бірлігімен өлшейді. Бейорганикалық заттардың (әрқайсысын бөлек) судағы мөлшерін арнайы әдістермен нақты анықтауға болатындықтан, ОХЖ жалпы мәнінен судағы бейорганикалық тотықсыздандырғыштар мөлшеріне сәйкес келетін тотықтырғыштың шығынын алып тастап, айырымы бойынша жеткілікті дәлдікпен талданатын судағы органикалық заттардың салыстырмалы мөлшерін табуға болады.
Қолданылатын тотықтырғышқа байланысты тотығушылықтың бірнеше түрі болады: бихроматтық тотығушылық – тотықтырғыш рөлін бихромат-ионы атқарады, перманганаттық тотығушылық – тотықтырғыш перманганат-ионы.
Судағы органикалық қоспалардың жағымсыз әсері олардың тотығып, қондырғылардың коррозиялануына әкелетін органикалық қышқылдардың түзілуіне байланысты.
Қоспалардың құрамына әртүрлі органикалық қосылыстар жатады да, олардың әрқайсысы өзінің ыдырауына тотықтырғыштың әртүрлі мөлшерін қажет етеді. Сондықтан органикалық қоспалардың тотығу реакцияларын стехиометриялық деп санауға болмайды, яғни органикалық қосылыстар мен тотықтырғыш тотығу реакциясына қандай қатынаста түскені белгісіз болғандықтан, тотықтырғыш мөлшері бойынша судың тотығушылығын есептеу мүмкін емес. Мұнымен қатар, тотығу процесі жиі жеткіліксіз жылдамдықпен және толық емес өтеді, яғни қоспалардың барлығы емес, тек бөлігі ғана тотығады. Сондықтан тотығушылықты кез келген титриметриялық әдіспен анықтау үшін кері титрлеу әдісін қолданады.
Кері титрлеуді былай жүргізеді: органикалық қоспаларды калийдің бихроматы немесе перманганатының артық мөлшерімен күкірт қышқылды ортада қыздырып, тотықтырады, одан кейін тотықтырғыштың әрекеттеспеген қалдығын сәйкес титрантпен титрлейді ( калий бихроматын – Мор тұзымен, ал перманганатты – натрий оксалаты немесе қымыздық қышқылымен).
Калий бихроматы органикалық қоспаларды күкірт қышқылды ортада ұзақ қайнатқанда тотықтырады. Калий перманганаты қоспаларды төменірек қышқылдықта және ерітіндіні 10 мин. қайнатқанда тотықтырады (яғни жағдайы жұмсағырақ). Қалий перманганатына қарағанда калий бихроматы қоспалардың көбірек мөлшерін тотықтырады, сондықтан осы екі әдіспен алынатын нәтижелер елеулі өзгешеленеді. Бихроматтық тотығушылық перманганаттықтан едәуір жоғары болады да, судың органикалық қоспалармен ластану дәрежесін дәлірек сипаттайды. Калий бихроматын су тотығушылығының толығырақ анықтауында, ал калий перманганатын ағымдағы шамамен анықтауда қолданады.
Тотығушылықты перманганатометриялық әдіспен анықтау (Кубель әдісі бойынша).
Бұл әдісті тотығушылығы < 100 мг/дм3 О2 сынамаларда қолдануға болады. Органикалық қоспалардың калий перманганатымен тотығуын жалпы келесі теңдеумен өрнектеуге болады:
KMnO4 +CqHmOnNjSp + H2SO4 → MnSO4 + K2SO4 + qCO2↑ +pSO3↑ + (j/2)(NH4+)2SO4+H2O.
Перманганат-ион қышқылдық та, сілтілік те ортада тотықтырғыш болады, бірақ судағы барлық органикалық қоспаларды толығымен ыдырата алмайды, өйткені ондай күшті емес. Тотығу процесі баяу өтеді, оның жылдамдығы температурамен, тотықтырғыш концентрациясымен, ортаның қышқылдығымен және органикалық заттар табиғатымен анықталады. Сондықтан тотығудың шарттарын таңдағанда тотықтырғыштың өзінің оттегінің бөлінуімен ыдырауын азайту қажет. Зерттелетін судағы барлық органикалық қосылыстар үшін мұндай шарттарды таңдау өте қиын болатындықтан, көптеген органикалық қоспалардың тотығуы толығымен жүрмейді.
Сірке қышқылы, дихлор сірке, үш хлор сірке және пимелин қышқылдары, бензофенон, мочевина және т.б. органикалық қоспалар перманганатометриялық әдіспен мүлдем анықталмайды. Әртүрлі органикалық қоспалардың ≈ 20 %-ы перманганат-иондарымен ≤ 50 %-ға ғана тотығады.
Сонымен, перманганатты тотығушылық табиғи судың органикалық заттармен ластануының шартты сипаттамасы болып келеді. Бірақ бұл әдіс қазіргі кезде су дайындау қондырғыларын таңдағанда, жобалағанда және оларды пайдаланғанда тотығушылықты тез анықтауда қолданылады.
8.2 Анықтауды жүргізу
Перманганаттық тотығушылықты қышқылдық ортада анықтау
Бұл әдіспен анықталатын тотығушылықтың максималды мәні 10 мг/дм3 құрайды (сынаманы алдын ала сұйылтпай). Сынаманы 10 есе ғана сұйылтуға болады. Сондықтан тотығушылығы >100 мг/дм3 О2 суларды талдауға бұл әдіс жарамайды.
Көлемі 250—300 см3 колбаға қалқыған заттардан сүзілген талданатын судың 100 см3 алады (немесе одан азырақ, егер судың тотығушылығы жоғары болса). Су органикалық қоспалармен қатты ластанған болса, аликвотты бөлігі ≤5 см3, ал азырақ ластанған болса, 20 см3 құрайды. Колбадағы сұйықтықтың көлемін 100 см3-ке дейін тұзсыздандырылған сумен сұйылтып, күкірт қышқылының 10 см3 және бюреткадан 0,01 н калий перманганаты ерітіндісінің нақты 10 см3 қосады. Колбаны воронкамен жауып, плиткада қайнағанша қыздырады да, 10 мин. қайнатады. Қайнау кезінде ерітіндінің бояуын байқау керек: ерітінді түссізденсе, колбаға калий перманганатының 5—10 см3 қосып, тағы қайнатады. Ыстық ерітіндіге қымыздық қышқылы (Н2С2О4) немесе натрий оксалаты (Na2C2O4) 0,01 н ерітіндісінің 10 см3 қосып, жақсылап араластырады. Колбадағы ерітінді бұл кезде түссізденеді (марганец диоксидінің қоңыр тұнбасы түзілсе – ол ериді). Түссізденген ерітіндіні бюреткадан 0,01 н калий перманганаты ерітіндісімен тұрақты әлсіз қызғылт түске дейін титрлейді. Қайнату кезінде қоңыр түс пайда болса немесе қоңыр түсті тұнба түзілсе, анықтауды талданатын судың азырақ көлемінде қайталайды. Мұнымен қатар тұзсыздандырылған судың 100 см3-нің тотығушылығын анықтайды («бос» тәжірибені жасайды).Тотығушылықты 2-3 параллельді сынамаларда анықтайды. Нәтижелердің айырымы 0,25 мг/дм3 О2 аспау қажет.
Перманганаттық тотығушылықты сілтілік ортада анықтау
Сілтілік ортада перманганаттық тотығушылықты анықтау үшін көлемі 250 см3 конустық колбаға талданатын судың 50 см3 алып, 100 см3-ке дейін тұзсыздандырылған сумен сұйылтады. Ерітіндіге 10%-дық сілтінің 2 см3 қосып, қайнағанша қыздырады да, калий перманганатының 0,01 н ерітіндісі-нің 10 см3 қосады.
Ерітіндіні 10 мин. қайнатады. Ыстық ерітіндіге 10 см3 10 н күкірт қышқылы мен 10 см3 0,01 н қымыздық қышқылы ерітінділерін қосады. Түссізденген ерітіндіні 0,01 н калий перманганаты ерітіндісімен 1 мин. ішінде кетпейтін әлсіз қызғылт түске дейін титрлейді.
Перманганатпен қайнатуды сілтілік ортада жүргізгенде қоңыр түсті тұнба пайда болып, ерітінді жасыл-күлгін түске боялады. Бұл құбылыстар тәжірибені талданатын судың азырақ мөлшерімен қайталауды талап етпейді. МnО2 қоңыр тұнбасының үстіндегі ерітінді толық түссізденгенде анықтауларды талданатын судың азырақ мөлшерімен қайталау қажет. Бұл жағдайда бақылау анықтауды да сілтілік ортада жүргізеді, ол үшін тұзсыздандырылған судың 100 см3 алып, әдістеме бойынша өңдейді.
Тотығушылықтың есептеулерін қышқылдық ортадағыдай жүргізеді.
8.3 Нәтижелерді өңдеу
Перманганаттық тотығушылықты келесі формуламен есептейді
![]() [мг/дм3
О2],
[мг/дм3
О2],
мұнда V— талданатын су сынамасының титрлеуіне шығынданатын калий перманганаты ерітіндісінің көлемі, см3; V0 — дистилленген су сынамасының титрлеуіне шығынданатын калий перманганаты ерітіндісінің көлемі, см3; Vсын — анализге алынған талданатын судың көлемі, см3; Сэкв(КМnO4) — калий перманганатының нормальдік (молярлы эквиваленттік, моль/дм3) концентрациясы, г-экв/дм3; К— калий перманганаты ерітіндісінің нормальдігін түзету коэффициенті; 8 — оттегінің эквиваленттік молярлы массасы, г/моль.
№9 зертханалық жұмыс. Суда еріген оттегі концентрациясын анықтау
Жұмыстың мақсаты: судағы еріген оттегі концентрациясын анықтауды үйрену.
Анықтауды орындау
Көлемі 250 мл конустық колбаға өлшеуіш цилиндрмен қала құбыры суының 100 мл алып, талданатын сынамаға пипеткамен МnС12 немесе MnSO4 ерітінділерінің 1 мл және басқа пипеткамен (KI + КОН) сілтілік ерітіндісінің 1 мл қосады. Колбаны тығынмен жауып, абайлап мұқият араластырады да колбаны столға 3-4 минутқа қояды.
Өтетін реакциялардың белгілерін (нышандарын) жазып, теңдеулерін құрастырады.
Талданатын сынамасы бар колбаға бюреткадан күкірт қышқылының 3 мл қосып, колбаны тығынмен жабады. Ерітіндіні тұнбасы толық ерігенше абайлап араластырып, колбаны столға 2-3 минутқа қояды.
Өтетін реакцияның белгілерін (нышандарын) жазып, теңдеуін құрастырады.
Дайындалған сынаманы Na2S2O3 натрий тиосульфаты ерітіндісімен титрлейді. Сынамаға түсі ақшыл-сары болғанша тиосульфат ерітіндісін қосады. Одан кейін колбаға еріген крахмалдың бірнеше тамшысын қосып, титрлеуді ерітінді түссізденгенше жүргізеді.
Тәжірибені қайталайды. Екі титрлеудің нәтижелерінің айырмашылығы 0,2 мл-ден аспау қажет. Егер нәтижесі ≥ 0,2 мл болса, анализді қайталайды. Сынаманың титрленуіне шығындалған натрий тиосульфаты ерітіндісі көлемінің орташа мәндерін (V1) табады. Тәжірибе нәтижелері 9.1 кестеге келтіріледі.
9.1 к е с т е - Тәжірибе нәтижелері
|
Na2S2O3 ерітіндісінің көлемі V2, мл |
Na2S2O3 ерітіндісінің нормальдік концентрациясы N2, моль/л |
Талданатын сынама көлемі, V1, мл |
Талданатын сынамадағы О2 нормальдік концентрациясы N1, моль/л |
|
|
|
|
|
Суда еріген
оттегінің нормальды концентрациясын біле тұра, оның массасын
есептейді (мкг/л). Есептеуді
жүргізгенде Э(О2) = ![]() O2 және молярлы массасы М (О2) = 8 г/моль екенін ескеру
қажет.
O2 және молярлы массасы М (О2) = 8 г/моль екенін ескеру
қажет.
Бақылау талдауды жүргізу
Лаборанттан еріген оттегінің мөлшерін бақылау анализін жүргізетін ерітіндісі бар колбаны алады. Тәжірибеде келтірілген сызбанұсқа бойынша талдау жүргізіп, нәтижелері кестеде келтіріледі. Сынамадағы еріген оттегінің массалық концентрациясын есептейді.
№ 10 зертханалық жұмыс. Судағы коллоидті-дисперсті қоспаларды коагуляция әдісімен кетіру
Жұмыстың мақсаты: коагулянттың оптималды дозасы мен процестің рН мәнін анықтауды үйрену.
10.1 Теориялық кіріспе
Коагуляция деп судағы коллоидті бөлшектердің іріленуіне және тұнуына әкелетін суды коагулянттармен өңдеу процесін айтады.
Табиғи сулардың коллоидті-ерітілген қоспаларының (мөлшерлері 1-100 нм) дзетта-потенциалы теріс болғандықтан, олардың коагуляциясы оң зарядталған коллоидті ерітіндіні енгізумен жүргізіледі. Іс жүзінде суға дайын коллоидті ерітіндіні енгізбейді, суда коллоидті ерітіндінің түзілуіне әкелетін процесті жүргізеді. Су дайындау стансаларында коагулянттар ретінде алюминий сульфаты, темір (Ш) хлориді, темір(II) сульфаты қолданылады. Коагулянттар күшті қышқылдар мен әлсіз негіздердің әрекеттесуінен түзілетін тұздар болғандықтан, гидролиз процесін иондық түрде былай өрнектеуге болады (А12(SО4)3 мысалында):
А13+ + Н2О → (А1ОН)2+ + Н+
(АlOН)2+ + Н2О→ Al(OH)2+ + H+
А1(ОН)2+ + Н2О → Аl(ОН)3 + H+.
Гидролиздің молекулалық түріндегі қосынды процесі:
А12(SО4)3 + 3Н2О = 2А1(ОН)3 + 3H2SO4.
Гидролиз
процесі – қайтымды. Гидролиз процесінің алюминий және темір (III)
гидроксидтерінің түзілуіне дейін өтуінің қажетті
шарты – түзілетін Н+-иондарды байланыстыру. Табиғи
суларда су сілтілігінің резервіне, яғни кальций
гидрокарбонатының (![]() иондарының) белгілі мөлшеріне
байланысты коагулянт Ме(ОН)3-ке дейін гидролизденеді. Кальций
гидрокарбонаты коагулянттың гидролизденуі кезінде бөлінетін
қышқылды (H2SO4, HC1) аз
диссоциацияланған көмір қышқылына айналдырады.
Бұл көмір қышқылы СО2
мен Н2О-ға ыдырайды.
иондарының) белгілі мөлшеріне
байланысты коагулянт Ме(ОН)3-ке дейін гидролизденеді. Кальций
гидрокарбонаты коагулянттың гидролизденуі кезінде бөлінетін
қышқылды (H2SO4, HC1) аз
диссоциацияланған көмір қышқылына айналдырады.
Бұл көмір қышқылы СО2
мен Н2О-ға ыдырайды.
Са(НСО3)2+Н2SО4 = CaSO4 +2H2CO3
Немесе иондық түрінде
H+ + HCO3- =H2O +CO2↑.
Табиғи судағы A12(SO4)3 гидролизінің қосынды теңдеуі былай өрнектеледі: A12(SO4)3 + 3Са(НСО3)2 = 2А1(ОН)3 + 3CaSO4 + 6СО2↑.
A12(SO4)3 1 мг гидролизденгенде судың сілтілік резервінің, яғни НСО3- -иондарының (6/342)= 0,017 мг-экв, ал FeCI3-нің 1 мг гидролизденгенде - 0,018 мг-экв шығынданады.
Коагуляция процесі судың сілтілік резервімен лимиттенеді.
Коагуляция процесі дұрыс өтетін A12(SO4)3 = (Допт 1) пен FeCl3 = (Допт 2) коагулянттарының шекті дозалары сәйкесінше келесі формулалар бойынша есептеледі:
![]()
![]()
Мұнда С - бастапқы судың сілтілік резерві, мг-экв/л; Ср – коагуляция процесінен кейінгі судың берілетін сілтілік резерві, мг-экв/л..
Коагулянттың оптималды дозасын таңдағанда 2 жағдай болуы мүмкін:
а) Сілтілік резерв коагулянттың гидролизденуінен түзілетін қышқылды бейтараптауға жеткілікті: С ≥ 0,017∙Допт 1; С > 0,018∙Допт 2.
б) Сілтілік резерв коагулянттың гидролизденуінен түзілетін қышқылды бейтараптауға жеткіліксіз: С ≤0,017∙Допт 1; С > 0,018∙Допт 2.
Судың жеткіліксіз сілтілік резервінде оны жоғарылату үшін суды сілтілендіреді (ізбестейді). Судың 1 литрінде 2 г Са(ОН)2 немесе 1,5 г СаО ерітіледі.
A12(SO4)3 гидролизденуінің процесі дұрыс өтуі үшін сілтінің дозасы келесі формуламен есептеледі:
![]() мг/л СаО=Х∙28.
мг/л СаО=Х∙28.
10.2 Анықтауды орындау
а) Коагулянттың оптималды дозасын анықтау
Көлемі 750-800 мл 7 колбаға коагуляцияланатын судың 500 мл кұйып, 40°С-ге дейін қыздырады. Содан кейін бюреткамен коагулянт ерітіндісін енгізеді. Әрбір колбаға қосылатын коагулянт мөлшерін оқытушы береді (коагулянт дозалары, мг/л: 25, 50, 100, 150, 200, 300, 400). Реагентті қосқаннан кейін колбалардағы ерітінділерді ақырын араластырып, 30 минутқа қойып қояды.
Осы уақытта бастапқы судың жалпы кермектілігін, жалпы сілтілігін, тотығушылығын және рН анықтайды.
30 минут өткеннен кейін әрбір колбадағы су ерітіндісін сүзіп, аталған су сапасының технологиялық көрсеткіштеріне анализ жасайды.
б) Коагуляция рН-ның оптималды мәндерін анықтау
Көлемі 750-800 мл 7 колбаға коагуляцияланатын судың 500 мл кұйып, 40°С-ге дейін қыздырады. Коагулянт гидролизінде түзілетін қышқылды бейтараптау үшін коагулянт ерітіндісімен бірге ізбес сүті қосылады (концентрациясы 1 мг/мл). рН мәнін өзгерту үшін колбаларға СаО-ның әртүрлі мөлшерлері қосылады, мг/л: 3,75; 7,5; 15,0; 22,5; 30,0; 45,0; 60,0. Түзілген ерітінділерді 30 минутқа қойып қояды.
Осы уақытта бастапқы судың жалпы кермектілігін, жалпы сілтілігін, тотығушылығын және рН мәнін анықтайды.
30 минут өткеннен кейін әрбір колбадағы су ерітіндісін сүзіп, аталған су сапасының технологиялық көрсеткіштеріне анализ жасайды.
10.3 Нәтижелерді өңдеу және жұмыс бойынша есеп беру
Жұмыс бойынша есеп беруге кіреді:
а) судың коллоидті қоспаларын технологиялық коагуляциялау процесі маңызының қысқаша сипаттамасы:
б) коагуляциялау процесі жүргізілген шарттарының қысқаша сипаттамасы;
в) анализдерді жүргізу әдістемесі мен толық есептелуі;
г) қорытындылар.
Тәжірибе нәтижелерін 10.1 және 10.2 кестелерде келтіреді. Нәтижелер бойынша судың тотығушылығының коагулянт дозасы мөлшеріне немесе рН мәніне тәуелділік қисығын тұрғызады.
10.1 к е с т е - Коагулянт дозасының оптималды мөлшерлерін анықтау
|
Зерттелетін су |
Тотығушылық |
Сілтілік, мг-экв/л |
Кермектілік, мг-экв/л |
рН |
||
|
мг/л |
төмендеуі, % |
жалпы |
карбонатсыз |
|||
|
Бастапқы |
|
|
|
|
||
|
Коагуляциядан кейін |
|
|
|
|
||
10.2 к е с т е - рН-тың оптималды мәндерін анықтау
|
Зерттелетін су |
Тотығушылық |
Сілтілік, мг-экв/л |
Кермектілік, мг-экв/л |
||
|
мг/л |
төмендеуі, % |
жалпы |
карбонатсыз |
||
|
Бастапқы |
|
|
|
||
|
Коагуляциядан кейін |
|
|
|
||
№11 зертханалық жұмыс. Суды ізбестеу
Жұмыстың мақсаты: ізбестеу процесін жүргізу үшін ізбестің оптималды мөлшерін анықтау.
11. 1 Теориялық кіріспе
Ізбестеу әдісі – суды Са(ОН)2 ізбеспен өңдеу, коагуляция сияқты ерітіндіден нашар еритін қосылыстар (қатты фаза) түрінде бөлек қоспаларды бөліп алуда негізделген тұндыру әдістерінің бірі болып табылады.
Суды ізбескелегенде қатты фазаға келесі қоспалар ауысуы мүмкін: бос көмір қышқылы - СО2, бикарбонат-иондар - HCO3-, карбонат - иондар – СО32-, кальций мен магний иондары. Сондықтан ізбестеуді декарбонизация әдісі (СО2 кетіру), сілтілікті төмендету әдісі (СО32-, HCO3- кетіру) және жұмсарту әдісі (Са2+ мен Mg2+ концентрацияларын төмендету) ретінде қарастыруға болады.
Ізбесті суға қосқанда диссоциациялану процесімен қатар судың Са2+ және ОН- иондарымен байытылуы жүреді:
Са(ОН)2= Са2+ + 2ОН-
Нәтижесінде судың рН жоғарылап, көмір қышқылдық тепе-теңдікті оңға қарай ығыстырады:
СО2 + Н2О=Н2СО3
Н2СО3 → Н+ +НСО3-
НСО3- → Н+ +СО32- (2.2.1)
Суды ізбеспен (Са(ОН)2) өңдеу процесін келесі теңдеулермен өрнектеуге болады:
ОН- + Н+ = Н2О
СО2 + 2ОН- = СО32- + Н2О.
Ізбестің сәйкес дозасын қосқанда көмір қышқылының барлығы және бикарбонат-иондардың барлығы карбонат-иондарға (СО32-) ауысады. Карбонат-иондардың концентрациясын жоғарылату нашар еритін кальций карбонатының түзілуіне әкеледі:
Са2+ + СО32- → СаСО3.
Бұл
процесс кальций-иондары мен карбонат-иондар концентрацияларының
көбейтіндісі кальций карбонатының ерігіштік көбейтіндісі
мәнінен (![]() жоғары
болғанда өтуі мүмкін, яғни
жоғары
болғанда өтуі мүмкін, яғни ![]() ≥
≥![]() шарты орындалғанда.
шарты орындалғанда.
Ізбестің
мөлшерін ![]() мен
мен
![]() -иондарын
карбонат-иондарына толық ауыстыру үшін қажеттіден
көбірек мөлшерде дозаласа гидроксид-иондарының концентрациясы
жоғарылап, суда нашар еритін магний гидроксиді түзіледі: Т = 298К-де
-иондарын
карбонат-иондарына толық ауыстыру үшін қажеттіден
көбірек мөлшерде дозаласа гидроксид-иондарының концентрациясы
жоғарылап, суда нашар еритін магний гидроксиді түзіледі: Т = 298К-де ![]() =
= ![]() моль2/л2, яғни
моль2/л2, яғни ![]() =
= ![]() моль2/л2 шарты орындалғанда.
моль2/л2 шарты орындалғанда.
Судың ізбестуіне қажетті ізбес дозасы келесі формуламен анықталады:
![]()
![]() мг/л Ca(OH)2.
мг/л Ca(OH)2.
Ізбесті ізбес сүті Са(ОН)2 түрінде дозалайды. Са(ОН)2 ерітіндісінің концентрациясын мына формула бойынша есептейді
![]() =
=![]()
Ал ізбестеуге қажетті көлем:
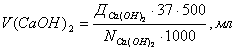
11.2 Жұмысты орындау тәртібі
Ізбестің
қажетті дозасын анықтау үшін бастапқы судың жалпы
және кальцийлік кермектілігін, жалпы сілтілігін және бос
көмір қышқылының концентрациясын анықтайды.
Ізбестің артық мөлшерін ![]() тең деп алады.
тең деп алады.
Ізбестеу процесін жүргізу үшін V= 750 мл колбасына 500 мл су құйып, оны 70-80°Сге дейін қыздырады. Судың 500 мл өңдеуіне есептелген ізбес көлемін қосады. Колбадағы ерітіндіні 5 мин. араластырып, одан кейін 1 сағатқа қояды.
Тұндырылған суды қағаз сүзгісінен сүзіп, ізбестелген судың технологиялық көрсеткіштеріне анализ жүргізеді.
Бастапқы және өңделген судың көрсеткіштерін салыстырып, ізбестеу процесінің нәтижесінде су құрамының сапалы өзгеруі туралы қорытынды жасайды.
11.3 Тәжірибе нәтижелерін өңдеу және жұмыс бойынша есеп беру
Жұмыс бойынша есеп беруге кіреді:
а) ізбестеу процесі маңызының қысқаша сипаттамасы:
б) ізбестеуге қажетті ізбес дозасын есептеу;
в) ізбестеу процесі жүргізілген шарттарының қысқаша сипаттамасы;
г) қорытындылар.
Тәжірибе нәтижелерін 11.1 кестеде келтіреді.
11.1 к е с т е - Тәжірибе нәтижелері
|
Зерттелетін су |
Кермектілік, мг∙экв/л |
Сілтілік, мг∙экв/л |
||||
|
Кж |
КСа |
КMg |
Сж |
Сгидр |
Скарб |
|
|
Бастапқы
|
|
|
||||
|
Ізбестелген
|
|
|
||||
№12 зертханалық жұмыс. Сүзгіш материалдардың қасиеттерін зерттеу
Жұмыстың мақсаты - әртүрлі сүзгіш материалдардың физикалық қасиеттерін зерттеу
12.1 Теориялық кіріспе
а) Сүзгіш материалдар
Сүзгіш материалдарды сипаттайтын негізгі көрсеткіштерге олардың беріктігі мен түйіршіктілігі жатады. Сүзгіш материалының түйіршіктілігі сүзгі тиеуі жұмысының технологиялық мүмкіндіктерін анықтайтын маңызды сипаттамасы болып табылады. Сүзгіш материалы бөлшектерінің мөлшерлері туралы нұсқаулар оның түйіршіктілігін сипаттағанда жеткіліксіз болады. Мысалы, материал дәндерінің диаметрі 0,5-1,0 мм болса, бұл сипаттамаға түйіршіктіліктің әртүрлі қатынастары келуі мүмкін: 1) 5% - дәндерінің диаметрі 0,5-1,0 мм және 95% - дәндерінің диаметрі 0,8-1,0 мм; 2) 95% - дәндерінің диаметрі 0,5-0,6 мм және 5% - 0,6-1,0 мм. Бірінші материал ірі түйіршіктіге жатса, екіншісі – ұсақ түйіршікті болады. Әрине, мұндай материалдармен тиелген сүзгілердің жұмысы да әртүрлі болады.
Электр стансалары су дайындау қондырғыларының өнеркәсіптік сүзгілердің пайдалану тәжірибесінен сүзгіш материалы дәндерінің 0,6-0,8 мм аралығындағы орташа диаметрін ұсынуға болады (салмағы бойынша шаң тәрізді бөлшектердің мөлшері ≤ 1,0 %, әр тектілік коэффициенті ≤ 2,0).
Түйіршіктілікпен қатар сүзгі материалының маңызды көрсеткіштеріне оның механикалық және химиялық төзімділігі жатады. Механикалық төзімділік деп жуу кезінде дәндер бір-бірімен үйкеліс нәтижесінде сүзгі материалының тозуға, су температурасы тұрақсыз болғанда материалдың ұсақтануына және жуатын сумен бірге ұсақ бөлшектердің шығарылуына әкелетін дәндердің жарылуға қарсыласуын айтады.
Химиялық төзімділігі деп сүзгі материалының сүзілетін судың әсеріне төзімділігін айтады.
Электр стансалары мен өнеркәсіптік өндірістерде кеңінен таралған материалдарға кварц құмы мен ұнтақталған антрацит жатады.
Кварцтың механикалық төзімділігі антрациттікінен жоғары. Бірақ химиялық төзімділігі бойынша, әсіресе жоғары температура мен сілтілік ортада, кварц сүзгіде кремний қышқылының мөлшерін жоғарылатады, яғни антрациттің химиялық төзімділігі кварцтікінен жоғары болады. Кварц құмымен салыстырғанда меншікті салмағы 2 есе төмен антрацит су дайындау қондырғысының өзіндік мұқтаждарына судың шығынын азайтуға мүмкіндік береді.
б) Суды механикалық сүзгі арқылы сүзу
Өңделетін су сүзгі материалы кеуектерінен өткенде оның бөлек ағыншалары әртүрлі зигзаг тәрізді жолдармен жүреді. Су сүзгі материалы дәндерінің бетімен үйкелісіп, қысымы мөлшерінің азаюымен сипатталатын қозғалысқа кедергіні еңсереді. Су қысымы мөлшерінің азаюы әдетте метр немесе миллиметр су бағанасымен өлшенеді (м.су бағ., мм.су бағ.). Сүзу материалына келетін судың қысымы су қысымы мөлшерінің азаюынан жоғары болу қажет.
Механикалық сүзгі жұмысының негізгі көрсеткіші - су қысымының азаюы. Бұл параметрдің өзгеруі және оны анықтау келесі факторларға тәуелді болады: 1) сүзу материалының гранулометрлік сипаттамасына; 2) сүзу материалы қабатының биіктігіне; 3) сүзу жылдамдығына; 4) сүзу материалы ластануының дәрежесіне. Аталған 4 факторлардың бірінші үшеуі берілген механикалық сүзгі үшін белгілі және азды-көпті тұрақты болып саналады. Сондықтан осы факторлардан туындайтын сүзгідегі су қысымы мөлшерінің азаюы да белгілі және тұрақты болады. Төртінші факторға, яғни сүзу материалы ластануының дәрежесіне келгенде, сүзгі жұмыс істеген сайын бұл мөлшер үздіксіз өседі де оған сәйкес сүзгідегі су қысымы азаюын жоғарылатады. Механикалық сүзгідегі су қысымы мөлшерінің азаюы екі бөліктен құрастырылады: 1) сүзу ортасы және сүзу жылдамдығымен анықталатын, қысымның бастапқы азаюы деп аталатын (яғни сүзгі материалы таза болған кезде); 2) сүзгіге келетін судағы қалқыған заттардың сипаттамасы және концентрациясымен анықталатын айнымалы шамамен.
Механикалық сүзгідегі су қысымы мөлшерінің азаюы берілген жағдайда соңғы максималды рауалы мәніне жеткенде немесе сүзгіден шығатын судың мөлдірлігі төмендеген кезде судың сүзуін тоқтатып, сүзгі материалындағы қалқыған заттарды кетіреді. Ол үшін сүзгіні судың кері ағынымен төменнен жоғары қарай жуады.
12.2 Тәжірибелік қондырғының сүлбесі
Тәжірибелік қондырғының сүлбесі 12.1 суретте келтірілген.
Бастапқы ерітіндінің күбісінде (1) оқытушының тапсырмасы бойынша зерттелетін су ерітіндісін дайындайды. Тапсырмаға байланысты 1, 2, 3 сатылардағы сүзгілерге зерттелетін сүзгі материалдары бар картридждер орнатылады. Сүзу материалы жұмысының параметрлерін анықтау үшін әрбір сатыдан кейін сынама алатын нүктелер орнатылған.
Жұмыс екі этапта орындалады.
1-ші этапта:
а) Оқытушыдан тапсырма алу: бастапқы ерітіндіні дайындаудың параметрлерін.
б) Картридждерді зерттелетін сүзу материалымен толтырып, сүзу қондырғысының сәйкес сатыларының корпустарына орнату.
в) Зерттелетін сүзу материалына сәйкес берілген лайлылықтағы, кермектіліктегі және сілтіліктегі ерітіндіні дайындау.
2 этапта жұмысты қондырғыда орындап, көрсеткіштерді алады. Ол үшін:
а) Сорғыны қосып, сүзгілерді сумен толтырады да, сонымен қатар әрбір сатыдағы ауаны ауа шығарғыштар арқылы шығарады.
б) Уақыттың белгілі кезеңдерінде немесе судың белгілі көлемдері өткеннен кейін талдауға сынама алынады.
в) Сүзу материалы ретінде кварц құмы, гидроантрацит, полипропилен жібі қолданылса, судың бастапқы және тәжірибелік мөлдірлігі мен лайлылығын анықтайды (шрифт немесе крест бойынша).
г) Иониттерді зерттегенде талданатын сынамада жалпы кермектілік пен жалпы сілтілікті анықтайды.
12.3 Орындалған жұмыс бойынша есеп беру келесі бөлімдерден тұрады:
12.3.1 Жұмыстың қысқаша сипаттамасынан;
12.3.2 Алынған нәтижелердің кестесінен;
12.3.3 Алынған нәтижелер бойынша қорытындылардан.

12.1 сурет - Тәжірибелік қондырғының сүлбесі
1 – бастапқы ерітіндінің күбісі, 2 – сорғы, 3 –суқұбырын бекіту шүмегі, 4 — күбідегі бастапқы суды жіберетін шүмек, 5 — 1 сатыдағы сүзгі, 6 — 2 сатыдағы сүзгі, 7 - 3 сатыдағы сүзгі, 8 - 1 сатыдан шығардағы шүмек, 9 - 2 сатыдан шығардағы шүмек, 10 - 3 сатыдан шығардағы шүмек, 11, 12 – бекіту шүмегі, 13 – сүзгі қондырғысынан шығардағы бекіту шүмегі, 14 – 1 сатыдағы сынама алу шүмегі, 15 - 2 сатыдағы сынама алу шүмегі, 16 - 3 сатыдағы сынама алу шүмегі, 17 – сүзілген су күбісі, 18 – суды суқұбыры арқылы беру.
Бастапқы берілгендері мен алынған нәтижелерді 12.1 кестеде келтіреді.
12.1 к е с т е - Тәжірибе нәтижелері
|
|
|
|||
|
№ |
|
|
|
|
|
1. |
|
|
|
|
|
2. |
|
|
|
|
|
... |
|
|
|
|
|
... |
|
|
|
|
№ 13 зертханалық жұмыс. Суды ион алмасу әдісімен өңдеу
Жұмыстың мақсаты: суды катиондау процесін зерттеп, катиониттің алмасу сиымдылығын анықтауды үйрену
13.1 Теориялық кіріспе
Ион алмасу деп ерітінді мен ионит арасында зарядтарының таңбалары бірдей болатын иондармен эквиваленттік алмасу процесін айтады.
Иониттер ретінде ион алмасу процестерінде жоғары сорбциялық қасиеттері бар заттар кеңінен қолданылады. Иониттер - құрамындағы оң және теріс зарядталған иондарын ерітіндідегі иондарға эквиваленттік мөлшерлерде алмасуға қабілетті заттар. Алмасатын иондар зарядының таңбасына қарай иониттер катиониттер мен аниониттерге бөлінеді.
Жалпы түрінде ион алмасу процесін келесі теңдеулер түрінде өрнектеуге болады:
RM1 + M2+ ↔ RM2 + M1+
немесе RA1 + A2- ↔ RA2 + A1,
мұнда RM1, RA1 – сәйкесінше катионит пен анионит, M2+ мен A2- - зерттелетін ерітіндінің катионы мен анионы.
Иониттердің қасиеттеріне көптеген табиғи және жасанды заттар ие, олардың ішінде кеңінен ион алмасу шайырлары қолданылады. Ион алмасу шайырлары – ион алмасу реакцияларына қабілетті арнайы функционалды топтары бар ерімейтін жоғары молекулалық қосылыстар.
Иониттердің ерітіндідегі иондармен алмасуға қабілеттілігі олардың құрылымына байланысты. Иониттер бастапқы заттар ретінде сополимерлену реакциясы бойынша стиролдан және тізбекті полистиролды көлденең тігу үшін оған қосылған 8 % дивинилбензолдан алынатын ерімейтін қатты матрицадан тұрады. Дәндер түрінде алынған көміртектік тізбектерінің кеңістіктік торы – матрица суға салынған кезде оның полярлы молекулаларымен әрекеттесіп, өзінің көлемін 1,1-2,0 есе ұлғайтады. Осылайша алынған матрицаны химиялық реагенттермен өңдеп, оған ерітінділерде диссоциациялануға қабілеттілігі бар арнайы функционалды топтарды енгізеді.
Ионитті валенттік күштермен немесе тор күштерімен байланған каркас түрінде елестетуге болады. Ионит бейтарап болады, өйткені каркас оң немесе теріс зарядталып, қарама-қарсы зарядталған иондарының зарядымен орнын толтырады. Каркастың зарядын қалпына келтіретін иондар қарсы иондар деп аталады. Бұл қарсы иондардың каркас аралығында белгілі қозғалмалылығы болады. Қарсы иондардың тек бір ғана (А) түрі бар ионитті иондардың басқа (В) түрі бар ерітіндіге салса, А иондары иониттен ерітіндіге ауысады да, В иондары эквиваленттік мөлшерде ерітіндіден ионитке ауысады. Тепе-теңдік жағдайында ионит пен ерітіндіде ион алмасу тепе-теңдігінің тұрақтысымен анықталатын белгілі мөлшерлік қатынаста А және В иондары болады.
Матрицада бекітілген ион (функционалды топтың бөлігі) зарядтың түзілуін анықтап, потенциалтүзуші ион деп аталады. Каркастың заряды қарсы иондар деп аталатын қарама-қарсы таңбалы иондар зарядымен орнын толтырады. Қарама қарсы иондар диффузиялық қабатты құрап, матрицаның айналасында қозғалады да осындай таңбасы бар басқа иондарға аустырылуы мүмкін.
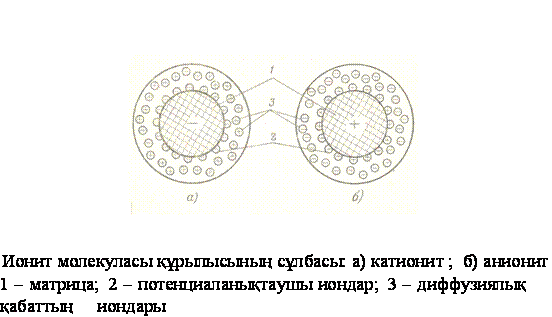
Ион
алмасуға қабілеттілік иониттердің
құрамындағы функционалды топтарына байланысты болады.
Катиониттерде бұл топтар қышқылдықтарға жатады:
-SO3H (сульфотобы), -СООН (карбоксил тобы), аниониттерде – негіздіктерге.
Сульфотоптары бар монофункционалды катиониттер күшті қышқылды
болады (күшті диссоциацияланатын), ал карбоксил топтары бар – әлсіз
қышқылды болады (әлсіз диссоциацияланатын). Күшті
қышқылды катиониттер (мысалы, КУ-2-8) иондарымен ортаның
рН-ның кез келген мәндерінде алмасады, өйткені олардың
функционалды топтары күшті қышқылдардай рН-тың кез
келген мәндерінде диссоциацияланады. Әлсіз қышқылды
функционалды топтар қышқылдық ортада
диссоциацияланбаған түрінде қалатындықтан бұл
жағдайда карбоксил катиондарының ион алмасуға
қабілеттілігі төмендейді. Сондықтан оларды рН![]() 7 ерітінділерді
өңдеуде қолданады. Сульфокөмір катионитінде
функционалды топтарының екеуі де бар болатындықтан, оны орташа
қышқылдыларға жатқызады.
7 ерітінділерді
өңдеуде қолданады. Сульфокөмір катионитінде
функционалды топтарының екеуі де бар болатындықтан, оны орташа
қышқылдыларға жатқызады.
Ион алмасу технологиясында селективтілік (талғамдылық) деп аталатын бір иондардың басқаларға қарағанда көбірек адсорбциялануға қабілеттілігі мен ион алмасу тепе-теңдігі орнауының жылдамдығы үлкен рөл атқарады.
Иондардың алмасу процесінің қайтымдылығы қымбат тұратын иониттерді технологиялық процесте бірнеше рет пайдалануға мүмкіндік береді.
Иониттердің сапасы ион алмасу технологиялардың тиімділігі мен нәтижелілігін анықтайтын физикалық және химиялық қасиеттерімен сипатталады.
Негізгі физикалық қасиеттеріне гранулометрлік құрамы (дәндердің мөлшері), үйілген массасы, механикалық төзімділік пен осмостық тұрақтылық, ионит құрылымы мен сулы ерітінділерінде ісіну дәрежесі жатады.
Химиялық қасиеттеріне химиялық тұрақтылығы, қышқылдығы (катиониттер үшін) немесе сілтілігі (аниониттер үшін), алмасу сыйымдылығы, сіңірілетін иондарды судан берілген тереңдікте кетіруде реагенттер мен жуатын судың меншікті шығыны, термиялық және радиациялық тұрақтылықтары жатады.
Ионит дәндерінің ірілігі 0,3-1,5 мм аралығында болады, оның ішінде ионит көлемінің 80%-на дейін дәндерінің диаметрі 0,5-1,0 мм құрайды.
Ионит дәндерінің механикалық беріктілігі мен осмостық тұрақтылығы оны бірнеше жылдың ішінде пайдаланғанда материлдың шығынына әсер етеді. Механикалық беріктілік деп иониттердің тозушылығын айтады. Осмостық тұрақтылығы иониттерді пайдалану кезінде микрожарықтарға, ары қарай ионит дәндерінің жарылуына әкелетін судың осмостық қысымының әсерінен дәндердің мезгіл-мезгіл ісінуі және сығылуына байланысты.
Иониттердің негізгі технологиялық сипаттамасына алмасу сыйымдылығы жатады. Алмасу сыйымдылығы деп иониттің массасы (г-экв/кг) немесе көлемі (г-экв/м3) бірлігімен сіңірген иондарының мөлшерін айтады. Алмасу сыйымдылығы статикалық және динамикалыққа бөлінеді.
Тәжірибеде статикалық алмасу сыйымдылықтың мөлшерін қанықтырылған және жуылған иониттің ісінген дәндерінің үйілу көлемінің 1 м2-не келетін кальций оксиді (СаО) кг-мен көрсетеді.
Динамикалық алмасу сыйымдылығы 2 көрсеткішпен сипатталады: «секіргенге дейінгі» динамикалық алмасу сыйымдылығы (ДАС) және толық динамикалық алмасу сыйымдылығы (ТДАС). Әдетте динамикалық алмасу сыйымдылығын сорбцияланған заттардан жуылған құрғақ иониттің (катиониттер үшін – сутектік, ал аниониттер үшін – хлоридті түрінде болатын) 1 грамына (немесе дм3) келетін сорбцияланатын ионның милиграмм-эквиваленттерімен көрсетеді.
«Секіргенге дейінгі» динамикалық алмасу сыйымдылығын (ДАС) бағанадан шығатын ерітіндіде берілген ионның пайда болуынан анықтайды (яғни фильтраттағы ионның концентрациясы нөлге жақын болғанда). ДАС ерітіндіден ұсталатын иондардың түрі мен концентрациясына, өңделетін ерітіндіде тұз компоненттерінің қатынасына, ерітіндінің рН мәніне, ионит қабатының биіктігіне, сүзу көлеміне, регенерацияланатын реагенттің меншікті шығынына ж.т.б тәуелді. Мәні бойынша иониттің «секіргенге дейін» алмасу сыйымдылығы жұмыстық динамикалық алмасу сыйымдылығына жақын (≈) .
ДАС келесі кейіптеме бойынша есептелінеді:
ДАС= Vф.С.1000 / Vионит [мг-экв/л],
мұнда Vф – фильтратта ерітінді иондары пайда болғанға дейінгі фильтраттың жалпы көлемі, л
С – ерітінді иондарының концентрациясы, мг-экв/л,
Vионит – ионит көлемі, л.
Иониттің толық динамикалық алмасу сыйымдылығы (ТДАС) ионның ерітіндіден алмасуының тоқтауы бойынша анықталады (яғни ерітіндіден сіңірілетін ионның концентрациясы фильтраттағымен теңескенде).
Иониттің толық динамикалық алмасу сыйымдылығын келесі кейіптемемен есептейді:
ТДАС = (Vф.С – ∑ Vсу.Ссу).1000 / Vионит [мг–экв/л] (2)
мұнда Vсу - ерітінді иондары пайда болған кездегі («секіргеннен кейін») фильтраттың жалпы көлемі, л;
С су – ерітінді иондары фильтрат порциясында пайда болған кездегі («секіргеннен кейін») ерітіндінің концентрациясы, мг-экв/л.
Алынған нәтижелер бойынша ионит қанығуының «Сион – Vфильтрат» координаттарында шығыс қисығын тұрғызады.
Дәндерінің мөлшерлері 0,25-1,0 мм активті SO3H тобы бар КУ-2-8 күшті қышқылды катионит келесі көрсеткіштермен сипатталады:
Құрғақ қалдықтың үйілу салмағы – 0,8 г/мл,
Ісінген күйіндегі меншікті көлемі –2,5 мл/г,
0,1 н HCl бойынша ТДАС – 4,9-5,1 мг-экв/г.
КУ-2-8 күшті қышқылды катиониттің регенерациялауын азот қышқылының 4 М ерітіндісімен, 1-4 М күкірт қышқылы ерітіндісімен немесе 1-4 М (NH4)2C2O4 аммоний оксалаты ерітіндісімен жүргізеді.
Тәжірибені жүргізу тәртібі
Катиониттің толық динамикалық алмасу сиымдылығын (ТДАС) анықтау
Штативта тік орнатылған шыны бағанасына тегіс және тығыз етіп 3 г катионитті салады. Катионитті дистилленген сумен сулайды. Бағанадан 3-4 мл/мин. ағу жылдамдығымен қанықтыратын ион ерітіндісін (мыс тұзының ерітіндісін) жібереді. Тәжірибені жүргізу кезінде катионит қабатында ауа көпіршектері болмау керек.
Бағана шүмегінің астына өлшеуіш цилиндр қойып, талдауға бағанадан шығатын ерітіндінің (фильтраттың) сынамаларын (әрқайсысы 5 мл-ден) алып бастайды. Сынақтың әрқайсысында төменде келтірілген әдістеме бойынша мыс иондары мөлшерінің фотометрлік анықтауын жүргізеді.
Иониттің сіңіріп алған мыс иондарының мөлшерін есептегенде, мыс иондары жоқ фильтраттың жалпы көлемі және ерітіндідегі мыстың бастапқы концентрациясы ескерілу қажет.
Катиониттің толық динамикалық алмасу сиымдылығын (мг-экв/г) анықтау үшін нәтижелерді қосып, құрғақ катиониттің массасына бөледі.
Ионның өтіп кеткенге дейін алмасу сиымдылығын анықтау үшін, мыс иондарының сәйкес келетін мөлшерін катиониттің массасына бөледі.
Катионитті регенерациялау үшін ионит арқылы 5-6 мл/мин жылдамдығымен Сэ= 0,25 моль/л аммоний оксалаты ерітіндісін ((NH4)2C2O4) немесе 3-4% күкірт қышқылы ерітіндісін өткізеді. Процесті регенерациялаудан шығатын ерітіндінің талдауы мыс иондарының жоқ екендігін көрсеткенге дейін жүргізеді.
Регенерациялау процесі біткеннен кейін, ионитті дистилленген сумен жуып, элюатты конустық колбаға немесе стаканға жинайды, онда метил- оранж индикаторы арқылы қышқылдың бар-жоқтығын анықтайды. Сумен жуу процесін қышқылды толық шығарғанға дейін жүргізеді.
Мыс(II) иондарын аммиакпен анықтаудың фотометрлік әдістемесі
Көлемі 50 мл өлшеуіш колбаларға пипеткамен талданатын ерітіндінің аликвотты бөлігін құйып, оған аммиактың 1:3 сұйытылған ерітіндісінің 10 мл
қосып, колбаның белгісіне дейін дистилленген су құяды. Колбаны тығынмен
жауып, ерітіндіні жақсылап араластырады. Содан кейін фотоэлектроколори-метрде ерітіндінің оптикалық тығыздығын өлшейді (қызыл светофильтр, кюветалардың қалыңдығы l=1,0 см.).
Ерітіндідегі мыс иондарының мөлшерін градуирленген қисық бойынша анықтайды (Х өсіне экстраполяциялап).
Градуирленген қисықты тұрғызу: 5 өлшеуіш колбаға мыс(II) тұзы стандартты ерітіндісінің 2, 4, 6, 8, 10 мл пипеткамен құяды. Содан кейін әдістеме бойынша аммиактың 1:3 сұйытылған ерітіндісінің 10 мл қосып, колбаның белгісіне дейін дистилленген су құяды. Ерітінділердің оптикалық тығыздығын өлшеп, градуирленген қисықты тұрғызады ( абсцисса өсінде – мыс иондарының концентрациясы, мг/мл, ал ордината өсінде – ерітіндінің оптикалық тығыздығы А, нм.).
№14 зертханалық жұмыс. Суды кері осмос әдісімен тұзсыздандыру
Жұмыстың мақсаты - кері осмостық қондырғыда суды минералсыз-дандырудың мембраналық әдісін зерттеп, терең тұзсыздандырылған суды алу
14.1 Теориялық кіріспе
Кері осмос деп ерітіндіні жартылай өткізгіш мембраналар арқылы өткізгенде еріген заттары мембранада ұсталып қалып, ал еріткіштің мембранадан өтуіне негізделген бөлу процесін айтады. Бұл әдіс сұйық қоспаларды бөлуде, суды тазарту мен тұщыландыруда кеңінен қолданылады.
Тұзсыздандыру – тұз мөлшері дистилленген судыкінен төмен болатын терең тұзсыздандырылған суды алудың минералсыздандыру процесі.

14.1 Суды кері осмостық тұзсыздандыру процесінің қағидалы сүлбесі
Бұл сүлбе бойынша еріген заттар мембрана бетінен үздіксіз әкетілу тиісті. Бастапқы ерітінді (1) жартылай өткізгіш мембраналары (2) бар кері осмостық қондырғыда (2) екі ағынға бөлінеді: еріген заттарынан тазартылған фильтрат (4) (немесе пермеат) және бастапқы ерітіндімен салыстырғанда еріген заттар мөлшері жоғарырақ болатын концентрат (5).
Бөлудің қозғаушы күші қысым болып келетіндіктен, кері осмос баромембраналық процеске жатады. Кері осмоста арнайы қасиеттері бар мембраналар қолданылады. Олардың ішінде негізгілері және міндеттілері – мембрананың селективтілігі мен меншікті өндірулігі.
Селективтілік деп мембрананың қоспа компоненттерін әртүрлі өткізгіштікпен бөлу қабілеттілігін айтады.
Жартылай өткізгіш мембраналар арқылы бөлу процесінің селективтілігі φ (%) келесі формуламен анықталады
φ= (х1 –х2)/ х1 . 100= (1- х2/х1) . 100 (1),
мұнда х1 мен х2 – еріген заттың бастапқы қоспа мен фильтраттағы концентрациялары.
Тұздар ерітінділерін бөлгенде немесе концентрлегенде φ шамасын кейде тұздылық коэффициенті немесе мембрананың тұздылығы деп атайды.
Меншікті өндірулік (q, м3 /м2. сут) – уақыт бірлігінде мембрана ауданы бірлігінен өтетін көлемді ағын. Мембраналардың меншікті өндірулігі ерітіндінің сүзу жылдамдығымен (V) келесі қатынаспен байланысады
V=11,6 10-6 q (2)
және мембрананың затты ұстап қалу қабілеттілігіне байланысты
R=1- CФ/Со (3)
Ерітіндінің жартылай өткізгіш мембрана арқылы сүзілу жылдамдығы сүзу қысымымен және тұзсыздандырылатын су мен фильтраттың шамаларымен келесі қатынаспен байланысады: V = k0 (p- ∆π).
Ерітіндінің осмостық қысымы еріген зат табиғатына, ерітінді концентрациясы мен температурасына тәуелді. Ерітінді концентрациясы мен температурасы өскен сайын осмостық қысымы да жоғарылайды.
Кері осмос селективтілігі мен жылдамдығына әсер етуші негізгі факторлар: жұмыстық қысым, аппараттағы гидродинамикалық режим, бөлінетін ерітіндінің табиғаты мен концентрациясы, температурасы, сонымен қатар мембраналар жұмысының ұзақтығы.
Кері осмос процесінің жұмыстық қысымы әдетте 3-10 МПа құрайды. Мұндай қысым кері осмос технологиясын қиындатады (мысалы, ультрасүзудің жұмыстық қысымы 0,3-1 Мпа). Қысымды таңдау меншікті өндірулікті қамтамасыз ету шартына ғана емес, ерітіндінің осмостық қысымына да байланысты.
Көптеген жағдайларда кері осмос әдісін бір валентті тұздар үшін концентрациясы 5-10%, екі валентті - 10-15%, ал көп валенттілер үшін - 15-20% құрайтын электролит ерітінділерін тазартуда тиімді қолдануға болады. Органикалық заттар ерітінділері үшін бұл интервал кеңірек және зат молекулалары мөлшерлері мен оның мембранамен әрекеттесу дәрежесіне тәуелді болады.
Сулы ерітінділерді
бөлу, тазарту және концентрлеуде кеңінен қолданылатын ацетатцеллюлозалық
мембраналар ![]() 600С-де
бұзылады. Сондықтан мұндай мембраналарды
қолданғанда бөлмелік температуралардың шектерінен аспау
қажет.
600С-де
бұзылады. Сондықтан мұндай мембраналарды
қолданғанда бөлмелік температуралардың шектерінен аспау
қажет.
Суды кері осмостық тұзсыздандыруда жартылай өткізгіш мембранадан еріткіш молекулалары ғана өтетіндіктен, оның бетінде еріген заттар концентрациясы жоғарылайды. Мембрана бетіне перпендикуляр келетін еріген зат концентрациясы градиентінің құрастырушысы концентрациялық поляризация деп аталатын құбылысқа әкеледі. Сонымен қатар, кері осмостық қондырғыларда мембрана бетіне параллельді келетін еріген зат концентрациясы градиентінің құрастырушысы да пайда болады. Су мембрана бетінің бойымен қозғалғанда оның бөлігі сүзіледі де ерітіндідегі еріген заттар концентрациясы жоғарылайды. Бұл құбылыс ерітінділердің концентрленуі деп аталады.
Концентрациялық поляризация мен ерітінділердің концентрленуі ерітінділердің кері осмостық бөлінуіне ілесіп жүреді, бірақ табиғи және ағын суларын тұзсыздандыруда олардың рөлі әртүрлі.
Концентрациялық поляризация барлық жағдайларда теріс фактор болады да, концентрациялық поляризацияның деңгейі деп аталатын шамамен бағаланады: Г= СМ /С.
Концентрациялық поляризация мембрана бетінің жанында еріген заттар концентрациясын жоғарылатуына байланысты, Г шамасы әрқашан >1 болады. Бұл жағдай фильтраттың тұздылығының өсуіне және мембрана бетінде нашар еритін заттар тұнбаларының түзілуіне мүмкіндік береді. Тұнбаның түзілуі концентрациялық поляризацияның ары қарай жүруіне апарады, өйткені тұнба қабатында ерітіндіні араластыру мен еріген заттар диффузиясы қиындайды. Сонымен қатар, мембраналардың бетінде тұнбаның түзілуі қосымша гидравликалық қысымға байланысты олардың өндірулігін төмендетеді
Тұнбаның түзілуін болдырмау үшін минералсыздандырылатын ерітіндіні алдымен табиғаты әртүрлі қоспалардан тазартады: дисперсті бөлшектерден, макромолекулалардан, микроорганизмдерден, органикалық заттардан, яғни алдын ала тазартуды жүргізеді.
Ерітіндіні концентрлеу ары қарай өңдеуге жіберілетін сулардың көлемін көп есе азайтуға немесе технологиялық процесте қайтадан қолдануға болатын бағалы заттар мөлшері бар ерітіндіні алуға мүмкіндік береді. Бірақ кейбір жағдайларда ерітіндіні концентрлеу теріс фактор болып кетуі мүмкін. Мысалы, конструкциясы дұрыс емес немесе дұрыс жиналмаған кері осмостық қондырғыда бөлінетін ерітінді мембрана бойымен қозғалмайтын (тұрып қалған) зоналардың түзілуінің мүмкіндігін тұғызады.
Суды тұзсыздандырудың кері осмостық мембраналары
Жартылай өткізгіш мембраналар кері осмостық қондырғының негізгі элементі, оған процестің тиімділігі мен қолданудың мүмкін аймағы тәуелді болып табылады. Кері осмостық мембраналар әртүрлі полимерлы материалдардан жасалады: полиамидтерден, полиуретандардан, поликарбонаттардан, полиакрилнитрилден, жай және күрделі эфирлерден, целлюлозадан ж.т.б. Қазіргі кезде ацетилцеллюлозадан (ацетаттық) және хош иісті полиамидтен жасалған мембраналар кеңінен таралған.
Материалдың ішінде электр статикалық зарядтың таралуы бойынша мембраналар ионогенсіз, ионактивті (катион- және анионактивті) және өрнектіге (мозаикалық) бөлінеді. Ионогенсіз мембраналарға көптеген полимерлы мембраналар (оның ішінде ацетилцеллюлозалық) жатады. Ионактивті қасиеттер жуылатын (динамикалық) мембраналарда пайда болады. Мозаикалық мембраналар кезектесетін анионактивті және катионактивті зоналардан тұрады. Мозаикалық мембраналар арқылы сүзу процесі пьезодиализ деп аталады.
Судағы көптеген қоспалардың әсері толығымен зерттелмегендіктен, кері осмостық қондырғыларға келіп түсетін суға құрамындағы қоспаларының шекті мүмкін концентрацияларына талаптар әлі жетілдірілмеген.
Әртүрлі дәрежеде минерализденген сулардың кері осмостық тұзсыздандыруын жүргізу осы суларды өңдегенде су дайындауда кеңінен қолданылатын су сапасының көрсеткіштері бойынша (лайлылығы, мөлдірлігі, қалқыған бөлшектер мөлшері) мембрана өндірулігі мен тұз мөлшері өзгеруінің интенсивтілігі туралы қорытынды жасауға болмайтындығын анықтады.
Суды кері осмостық тұзсыздандыру стансаларының технологиялық сүлбелеріне келесі элементтер кіреді:
1) кері осмостық тұзсыздандырудың алдындағы бастапқы суды алдын ала дайындау қондырғысы;
2) кері осмостық тұзсыздандыру қондырғысы;
3) кері осмостық қондырғысынан шығатын қонцентратты өңдеу қондырғысы;
4) фильтратты өңдейтін қондырғы;
5) станса жұмысын бақылап, автоматтық және қолмен басқару жүйелері.
Суды дайындауда кері осмосты пайдалану суаттардың ластануын азайтуға және иониттердің жаңғыртуында қолданылатын реагенттердің мөлшерін азайтуға мүмкіндік береді.
Тәжірибелік қондырғының сүлбесі 14.2 суретте келтірілген.
№1 күбіде оқытушының тапсырмасы бойынша зерттелетін судың ерітіндісі дайындалады. Сүзгілер мен кері осмостық мембрана жұмысының параметрлерін анықтау үшін әрбір сатыдан кейін манометрлер мен сынама алу крандары орнатылған.
Жұмыс тәртібі:
а) тұз мөлшері белгілі бастапқы ерітіндіні дайындайды;
б) № 5 кранды ашып, бастапқы ерітіндіні жіберетін №2 сорғыны қосады. Бұл кезде № 3 кран жабық болу керек. Сүзгілерді сумен толтырады. Ол үшін № 12, 16, 21, 18 крандарды ашады, № 11, 15, 20 крандарды жабады немесе бастапқы су құбырының №3 кранын ашады (онда №2 сорғыны өшіреді);
в) уақыттың белгілі аралықтарында немесе өткізілген судың белгілі көлемдерінде талдауға сынама алынады;
г) суды жүзгін дисперсті механикалық қоспалардан тазартатын 1 сатыдағы сұзгіден өткен суды зерттеу үшін: 1) 1 сатыдан кейін № 11 сынама алынатын кранын ашады; 2) 2 сатының алдындағы № 12 кранды жабады;
д) суды органикалық қоспалардан тазартатын 2 сатыдағы карбон сүзгісінен өткен суды зерттеу үшін: 1) № 12 кран және сынама алынатын
№ 15 кранды ашады; 2) № 11 сынама алынатын және 3 сатының алдындағы № 16 крандарды жабады;
е) тұздардан тазартатын 3 сатыдағы кері осмостық мембранадан өткен суды зерттеу үшін: 1) № 12, № 16 және сынама алынатын № 20 крандарды ашады; 2) № 11, № 15 сынама алынатын крандарды және 4 сатының алдындағы № 21 кранды жабады;
ж) дәмдік сапасын жақсартатын 4 сатыдағы карбон сүзгісінен өтетін суды зерттеу үшін : 1) № 11, 15, 20 сынама алынатын крандарды жабады; судың сынамасын 4 сатыдан шығу жерінен алады;
и) судың сапасын зерттегенде талданатын сынамаларда кермектілікті, сілтілікті және жалпы тұздылығын анықтайды. Бастапқы берілгендер мен алынған нәтижелерді 14.1 кестеде келтіреді.
Ескерту: Тәжірибелік қондырғы жұмыс істеген кезде №18 сынама алу краны ашық болу қажет.
Тәжірибелік қондырғыны өшіру:
1. №18 краннан басқа крандардың барлығын жабады;
2. № 2 және 9 сорғыларды электр тораптан айырады;
3. №3 (бастапқы ерітіндіні жіберетін) және №5 (бастапқы су құбырын ашатын) вентильдерді жабады;
4. крандардың барлығын жабады.
Жұмыс 2 этапта жасалады.
Бірінші этапта:
а) оқытушыдан тапсырма алынады: модельді су ерітіндісін дайындау үшін тұздардың бастапқы концентрациялары беріледі;
б) модельді ерітіндіні дайындайды (тұздар массаларын есептейді,
өлшендіні таразыда өлшеп алады, дистилленген суда ерітеді);
в) ионометриялық немесе кондуктометриялық талдау әдістемелеріне сәйкес берілген ион концентрациясын анықтайтын градуирленген қисықты тұрғызады.
Екінші этапта жұмыс кері осмостық қондырғыда орындалады:
а) уақыттың берілген аралықтарында (немесе судың берілген көлемдерінде) карбон сүзгісі мен кері осмостық мембранадан кейін талдауға судың сынамалары (және концентрат сынамалары) алынады;
б) кері осмостық қондырғы жұмысының аяғында бастапқы су мен талданатын сынамалардың жалпы кермектілігі мен сілтілігі, тұздылығы анықталады.
Бастапқы берілгендері мен алынған нәтижелерді кестеге жазады.
14.1 к е с т е - Тәжірибе нәтижелері
|
№ |
V, л |
С, мг-экв/л |
К, мг-экв/л |
NaCl, мг/л |
ρ, Ом . см |
φ,% |
|
Бастапқы ерітінді |
|
|
|
|
|
|
|
Карбон сүзгі-сінен кейін алынған су |
|
|
|
|
|
|
|
Мембранадан кейін алынған су |
|
|
|
|
|
|
|
Концентрат
|
|
|
|
|
|
|
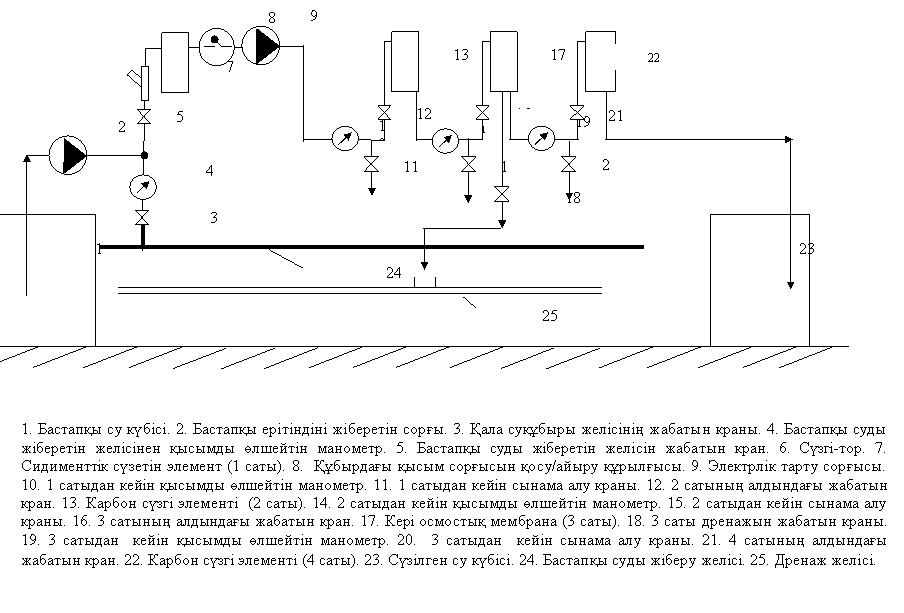 |
![]() 14.2
сурет - Тәжірибелік қондырғының сүлбесі
14.2
сурет - Тәжірибелік қондырғының сүлбесі
№14 тәжірибелік жұмысқа қосымша
Тұзсыздандырылған судың талдауын ионометрия әдісімен жүргізу
Ионометрия — судағы иондар мөлшерін потенциометрия әдісімен анықтау. Бұл әдіс индикаторлы және референтті электродтардан құрастырылған электродтық жұптың потенциалын өлшеуге негізделген. Әдістің ерекшелігі: мұнда тек белгілі ионмен әрекеттесетін индикаторлы электрод қолданылады. Ол үшін ішкі және сыртқы ерітінділер белгілі иондарды ғана іріктейтін жартылай өткізгіш мембрана арқылы бөлінеді. Мұндай мембраналар ионоселективті деп аталады. Ионометрия әдісіндегі Х-ионының анықталатын концентрациялар аймағы 10-6 sup>-6 - 10-1 М.
Өлшеуіш аспап ретінде кіріс кедергісі ≥1 МОм милливольтметрлердің кез келген түрін қолдануға болады. Молярлы концентрациясының теріс логарифмі бірліктерінде градуирленген милливольтметр рХ-метр немесе иономер деп аталады.
Аналитикалық тәжірибеде ионометрия әдісі иондарды тура анықтауда немесе индикаторлы ретінде титрлеу әдісінде қолданылады. Иономерлер ғылыми зерттеулерде, сонымен қатар суды тазартудың физика-химиялық, химиялық және биохимиялық технологиялық процестерде басқару және бақылау аппаратурасының құрамында кеңінен қолданылады.
Жұмыстың мақсаты — иономерде тұзсыздандырылған судың анализін жүргізу.
Жұмысты жүргізу және нәтижелерін өңдеу әдістемесі
Тәжірибе қондырғыларының құрамы
Магнит араластырғышы, рХ-метр.
Ыдыс: калибрленген қисықты тұрғызу үшін V=100 мл цилиндрлер - 5 дана; V=250 мл колба – 1 дана; V=5 және 10 мл пипеткалар -1 данадан.
Ерітінділерді дайындау
1. Электролит ерітіндісін дайындау.
Концентрациясы 0,1 г-ион/л ерітіндіні дайындау үшін дистилленген судың 250 мл-де 0,025 г-ионы бар зат өлшендісін ерітеді.
2. Ерітінді концентрацияларының шкаласын дайындау.
V=100 мл 5 өлшеуіш цилиндрге ерітіндінің 1; 5; 10; 50 және 100 мл құйып, көлемін 100 мл-ге дейін дистилленген сумен толтырады. Түзілген ерітінділердің концентрациялары 1; 5; 10; 50 және 100 мг-ион/л сәйкес болады. Бұл мәндер рХ шкаласының келесі мәндеріне сәйкес келеді: 3; 2,3; 2; 1,3 және 1.
Тәжірибені орындау тәртібі
1.Берілген ионның концентрациясын анықтайтын калибрленген графикті тұрғызу.
Дайындалған ерітінділер шкаласы иономердің өлшеуіш стаканына құйылады. Өлшеуіш стакандағы зерттелетін ерітіндіні келесіге ауыстырудың алдында оны электродтармен бірге дистилленген сумен жуады.
Концентрациялар шкаласы бойынша ең кіші мәнінен бастап әрбір ерітіндінің потенциалы өлшенеді. Өлшеулердің барлығын магнит араластырғышы айналымының бірдей мәнінде жүргізеді. Өлшеулердің нәтижелерін кестеге жазады.
14.2 к е с т е - ЭҚК мәнінің ерітінді концентрациясына тәуелділігі
|
С, мг-ион/л |
|
|
|
|
|
|
|
|
|
|
рХ |
|
|
|
|
|
|
|
|
|
|
ЭДС(1), мВ |
|
|
|
|
|
|
|
|
|
|
ЭДС(2), мВ |
|
|
|
|
|
|
|
|
|
|
Орташа ЭҚК, мВ |
|
|
|
|
|
|
|
|
|
Анықтау дәлірек болу үшін өлшеулерді 2 рет жүргізеді.
2. Зерттелетін ионның судағы мөлшерін анықтау. Зерттелетін ионның белгісіз мөлшері бар ерітіндіні аспаптың өлшеуіш ұяшығына орналастырып, ЭҚК мәнін анықтайды.
Тапсырма
1. 14.2 кестенің берілгендері бойынша ЭҚК-нің зерттелетін ион концентрациясына ЭҚК=f(pX) түріндегі тәуелділік графигін тұрғызады.
2. Калибрленген графикті қолданып, зерттелетін ион концентрациясын анықтайды.
Тұзсыздандырылған судың талдауын кондуктометрия әдісімен
жүргізу
Ағын суларының құрамындағы және электр зарядын тасымалдауға қабілеттілігі бар минералды және органикалық қоспалар 2-ші ретті өткізгішке жататын жүйені құрайды. Кез келген өткізгіш сияқты, қоспалары бар судың электрлік кедергісі (R) болады. Ағын суларының электрлік өткізгіштігін электр өткізгіштік (W) сипаттайды. Бұл шамалар келесі теңдеулермен сипатталады:
R = pL/S (1)
W=1/R =(1/ρ)(S/L) = χ S/L (2)
мұнда р — меншікті кедергі; χ — меншікті электр өткізгіштік; S — су аралығы қимасының ауданы; L — электродтар арасындағы арақашықтық.
Меншікті электр өткізгіштік деп ұзындығы 1 см және қимасының ауданы 1 см2 зерттелетін су бағанасының кедергісін айтады. Су фазасының меншікті кедергісі еріген заттар табиғатына, концентрациясы мен температурасына тәуелді.
Меншікті электр өткізгіштік – меншікті электрлік кедергіге кері шама болып табылады:
χ =1/ρ (3)
мұнда ρ — судың меншікті электрлік кедергісі.
Ағын суларының электр өткізгіштігі олардың құрамына ғана емес, сонымен қатар температурасына да тәуелді болады. Бұл тәуелділік дәлірек түрде 2 дәрежедегі полином түрінде өрнектеледі:
χ =χ0 (1 + αt + βt2) (4)
мұнда α мен β — еріген заттар табиғаты мен концентрациясына тәуелді коэффициенттер.
Электр өткізгіштігін өлшеуге негізделген суды талдау әдісі кондуктометрия деп аталады.
Кондуктометрлік әдіс зерттелетін су сынамаларында заттар концентрациясын анықтауда, суды тазарту және тұнбаларды өңдеу процестерінде қолданылатын реагент ерітінділерінің концентрацияларын анықтауда, сонымен қатар электрохимиялық қондырғыларда электродтық пакеттер жұмысының параметрлерін анықтауда қолданылады.
Жұмыстың мақсаты —тұзсыздандырылған судың анализін
кондуктометрия әдісімен жүргізу.
Жұмысты орындау тәртібі және нәтижелерді өңдеу әдістемесі
Тәжірибе қондырғыларының құрамы
УК-02/1 типті контактті құрылғысы бар кондуктометр.
Ыдыс: V=100 мл калибрленген қисықты тұрғызуға цилиндрлер — 6 дана; V=250 мл жұмыстық ерітінді колбасы — 1 дана; V=5 және 10 мл пипеткалар — 1 данадан, зертханалық термометр.
Ерітінділерді дайындау
1. Электролит жұмыстық ерітіндісін дайындау. NaCl-нің концентрациясы 10 г/л жұмыстық ерітіндісін дайындау үшін өлшендінің 2,5 г дистилленген судың 250 мл-де ерітеді.
V=100 мл 6 өлшеуіш цилиндрге жұмыстық ерітіндінің 1; 2; 5; 10; 20; 30 мл қx көлемдерін 100 мл-ге дейін дистилленген сумен толтырады. Ерітінділердің концентрациялары сәйкесінше 100; 200; 500; 1000; 2000 және 3000 мг/лге тең болады.
Жұмысты орындау тәртібі
Еритін минералды тұздардың концентрациясын анықтау үшін калибрленген қисықты тұрғызу және зерттелетін ерітіндінің электр өткізгіштігіне температураның әсерін зерттеу
1. Кондуктометрдің өлшеуіш стаканына ретімен ерітінділер құйылады. Өлшеуіш стакандағы зерттелетін ерітіндіні келесіге ауыстырудың алдында оны аспап құрылғысымен бірге дистилленген сумен жуады. ≈15°С-де әрбір ерітіндінің төменгі концентрациясынан бастап меншікті электрлік кедергісі өлшенеді. Өлшеулердің нәтижелерін кестеде келтіреді. Анықтауды жоғарырақ дәлділікпен жүргізу үшін өлшеулерді аспап сезімталдығының әртүрлі шектерінде жүргізіп, әрбір зерттелетін ерітінді нәтижелерінің корреляциясының бар екендігін анықтайды.
Меншікті кедергінің өлшеулерін 20, 25, 30 және 35°С-де жүргізеді. Зерттелетін ерітінділер температураларының нақты мәндерін 14.3 кестеде келтіреді.
14.3 кесте - Меншікті электрлік кедергінің (ρ) ерітінді концентрациясы (С) мен температурасына (t, 0С) тәелділігі
|
С, мг/л |
С1 |
С2 |
С3 |
С4 |
С5 |
С6 |
С7 |
С8 |
|
T, 0C |
М е н ш і к т і э л е к т р л і к к е д е р г і с і, ρ, Ом . см |
|||||||
|
t1= |
|
|
|
|
|
|
|
|
|
t2= |
|
|
|
|
|
|
|
|
|
…. |
|
|
|
|
|
|
|
|
|
tn = |
|
|
|
|
|
|
|
|
2. Бақылау ерітіндісінде тұздар мөлшерін анықтау. Судың бақылау үлгісінде температурасы мен меншікті кедергісін анықтайды. Жоғарыда алынған тәуелділікті қолдана отырып, тұздар концентрациясын табады (NaCl-ға есептей отырып).
Тапсырма
1. 14.3 кестенің берілгендері мен (3) теңдеуді қолдана отырып, χ =f(C)t=const координаттарында калибрленген қисықты және χ =f(t)c=const тәелділік қисығын тұрғызады.
2. Бақылау ерітіндісінде тұздар мөлшерін анықтайды.
Әдебиеттер тізімі
1. Копылов А.С., Лавыгин В.М., Очков В.Ф. Водоподготовка в энергетике: Учебное пособие для вузов. - М.: Издательство МЭИ, 2003. -310 с.
2. Стерман Л.С., Покровский В.Н. Физические и химические методы обработки воды на ТЭС: Учебник для вузов. - М.: Энергоатомиздат, 1991. - 328 с.
3. Громогласов А.А., Копылов А.С., Пильщиков А.П. Водоподготовка: Процессы и аппараты: Учебное пособие для вузов. - М.: Энергоатомиздат, 1990. - 272 с.
4. Белан Ф.И. Водоподготовка.- М.: Энергия, 1979. - 208 с.
5. Вихрев В.Ф., Шкроб М.С. Водоподготовка.-М.: Энергия, 1973.-420 с.
6. Коровин Н.В. Общая химия.- М.: Высшая школа, 2006.
7. Задачи и упражнения по общей химии. Под ред.Н.В.Коровина.- М.: Высшая школа, 2004.
Мазмұны
Кіріспе ...…………………………………………………………………………. 3
№1 зертханалық жұмыс. Судың мөлдірлігі. Қалқыған заттар мөлшерін анықтау …. 4
№ 2 зертханалық жұмыс. Судың қышқылдығын анықтау................................ 6
№ 3 зертханалық жұмыс. Судың сілтілігін анықтау........................................ 9
№ 4 зертханалық жұмыс. Көмір қышқылын анықтау....................................... 11
№ 5 зертханалық жұмыс. Аммиак және аммоний тұздарының мөлшерін анықтау........................ 15
№ 6 зертханалық жұмыс. Судың кермектілігін анықтау ............................... 16
№ 7 зертханалық жұмыс. Хлорид-иондар мөлшерін анықтау ........................ 21
№ 8 зертханалық жұмыс. Судың тотығушылығын (оттегіні химиялық пайдалану) анықтау .. 22
№ 9 зертханалық жұмыс. Суда еріген оттегі концентрациясын анықтау ......25
№ 10 зертханалық жұмыс. Судағы коллоидті-дисперсті қоспаларды коагуляция әдісімен кетіру ..... 26
№ 11 зертханалық жұмыс. Суды ізбестеу …..................................................... 29
№ 12 зертханалық жұмыс. Сүзгіш материалдардың қасиеттерін зерттеу.........31
№ 13 зертханалық жұмыс. Суды ион алмасу әдісімен өңдеу..........................35
№ 14 зертханалық жұмыс. Суды кері осмос әдісімен тұзсыздандыру .......... 39
Әдебиеттер тізімі ……........................................................................................ 50