МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
Некоммерческое акционерное общество
«Алматинский университет энергетики и связи»
К.С. Идрисова
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ПОДГОТОВКИ ВОДЫ
Учебное пособие
![]() Алматы 2011
Алматы 2011
УДК 621.182.12
ББК 24. 5Я 73
429 Учебное пособие / К.С.Идрисова
Физико-химические методы подготовки воды
АУЭС. Алматы, 2011. - 80 с.
ISBN 9965 - 850 - 24 - 0
Рассмотрены современные физико-химические методы обработки воды для ТЭС и промышленных предприятий, обезвреживание сточных вод. Дана краткая характеристика природных вод, приведена их классификация. Описаны методы предочистки воды, ионный обмен, обработка охлаждающей воды, электрохимические методы обработки воды, очистка сточных вод.
Учебное пособие предназначено для студентов, обучающихся по специальности 5B071700 – Теплоэнергетика.
Ил. 23, табл. 12, библиогр. - 18 назв.
ББК 24. 5Я 73
РЕЦЕНЗЕНТЫ: КазНТУ, д-р. хим. наук, доц. Елигбаева Г.Ж.
АУЭС, канд. техн. наук, проф. Стояк В.В.
Печатается по плану издания Министерства образования и науки Республики Казахстан на 2010 г.
ISBN 9965 - 850 - 24 - 0
©НАО «Алматинский университет энергетики и связи», 2011 г.
Введение
Курс «Физико-химические методы подготовки воды» является обязательным предметом для студентов высших учебных заведений и включается в учебные планы в качестве профильной дисциплины для студентов, обучающихся по специальности 5В071700- теплоэнергетика.
Задачами курса являются: ознакомление со свойствами и составом природных и контурных вод; с основными физико-химическими методами подготовки воды для КЭС и промышленных предприятий; с методами предотвращения коррозии оборудования, образования накипи и отложений, шлама, загрязнения пара и т.д.
Знание основных физико-химических методов подготовки воды необходимо для организации надежной и экономичной работы основного теплоэнергетического оборудования, осуществления оптимальных условий водно-химического режима, сокращения потребления химических реагентов при обработке воды, безопасной эксплуатации оборудования, уменьшения объема и агрессивности сточных вод и т.п.
Настоящая книга является учебным пособием по курсу «Физико-химические методы подготовки воды».
1 Использование воды в теплоэнергетике
Согласно Правилам технической эксплуатации электрических станций и сетей (ПТЭ) режим эксплуатации водоподготовительных установок и водно-химический режим должны обеспечить работу электростанций и предприятий тепловых сетей без повреждений и снижения экономичности, вызываемых коррозией внутренних поверхностей водоподготовительного, теплоэнергетического и сетевого оборудования, а также без образования накипи и отложений на теплопередающих поверхностях, отложений в проточной части турбин, шлама в оборудовании и трубопроводах электростанций и тепловых сетей [1].
Оборудование современных ТЭС и АЭС эксплуатируется при высоких тепловых нагрузках, что требует жесткого ограничения толщины отложений на поверхностях нагрева по условиям температурного режима их металла в течение рабочей кампании. Такие отложения образуются из примесей, поступающих в циклы электростанций, в том числе и с добавочной водой, поэтому обеспечение высокого качества водных теплоносителей ТЭС и АЭС является важнейшей задачей. Использование водного теплоносителя высокого качества упрощает также решение задач получения чистого пара, минимизации скоростей коррозии конструктивных материалов котлов, турбин и оборудования конденсатно-питательного тракта.
Для удовлетворения разнообразных требований к качеству воды, потребляемой при выработке электрической и тепловой энергии, возникает необходимость специальной физико-химической обработки ее. Эта вода является, по существу, исходным сырьем, которое после надлежащей обработки (очистки) используется для следующих целей:
- в качестве исходного вещества для получения пара в котлах, парогенераторах, ядерных реакторах кипящего типа, испарителях, паропреобразоватслях;
- для конденсации отработавшего в паровых турбинах пара;
- для охлаждения различных аппаратов и агрегатов ТЭС и АЭС;
- в качестве теплоносителя в первом контуре АЭС с ВВЭР, в тепловых сетях и системах горячего водоснабжения.
Одновременно с очисткой природной воды на электростанциях необходимо решать комплексно вопросы, связанные с утилизацией образующихся при этом сточных вод. Такое решение является мерой защиты от загрязнения природных источников питьевого и промышленного водоснабжения.
Выбор метода обработки воды, составление общей схемы технологического процесса при применении различных методов, определение требований, предъявляемых к качеству ее, существенно зависят от состава исходных вод, типа электростанции, параметров ее, применяемого основного оборудования (паровых котлов, турбин), системы теплофикации и горячего водоснабжения.
1.2 Обращение воды в циклах ТЭС
При обращении воды в рабочих циклах конденсационных тепловых электростанций (КЭС) и теплоэлектроцентралей (ТЭЦ) вводятся следующие определения:
Природная (техническая) вода (Dисх) используется в качестве исходного сырья на водоподготовительной установке, а также для других целей на ТЭС и АЭС.
Добавочная вода(Dд.в) направляется в контур для восполнения потерь пара и конденсата после обработки с применением физико-химических методов очистки.
Турбинный конденсат (Dт.к) содержащий незначительное количество растворенных и взвешенных примесей, — основная составляющая питательной воды.
Возвратный конденсат (Dв.к) от внешних потребителей пара используется после очистки от внесенных загрязнений. Он является составной частью питательной воды.
Питательная вода (Dп.в) подаваемая в котлы, парогенераторы или реакторы для замещения испарившейся воды в этих агрегатах, представляет собой главным образом смесь турбинного и возвратного конденсата, добавочной воды, а также конденсата регенеративных подогревателей.
Котловая вода, вода парогенератора, реактора (Dк.в) — вода, находящаяся в элементах указанных агрегатов.
Продувочная вода (Dпр) — выводимая из котла, парогенератора или реактора вода на очистку или в дренаж для поддержания в испаряемой (котловой) воде заданной концентрации примесей. Состав и концентрация примесей в котловой и продувочной водах одинаковы.
Охлаждающая или циркуляционная вода (Dо.в) используется в конденсаторах паровых турбин для конденсации отработавшего пара.
Подпиточная вода (Dв.п) подается в тепловые сети для восполнения потерь циркулирующей в них воды.
При эксплуатации ТЭС и АЭС возникают внутристанционные потери пара и конденсата:
а) в котлах при непрерывной и периодической продувке, при открытии предохранительных клапанов, при обмывке водой или обдувке паром наружных поверхностей нагрева от золы и шлака, на распыливание жидкого топлива в форсунках, на привод вспомогательных механизмов;
б) в турбогенераторах через лабиринтные уплотнения и паровоздушные эжекторы;
в) в пробоотборных точках;
г) в баках, насосах, трубопроводах при переливе, испарении горячей воды, просачивании через сальники, фланцы и т.н.
Обычно внутристанционные потери пара и конденсата, восполняемые добавочной питательной водой, не превышают в различные периоды эксплуатации на ТЭС 2—3 %, на АЭС 0,5—1 % их общей паропроизводительности.
На промышленных ТЭЦ, отпускающих пар на различные технологические нужды предприятий, существуют также внешние потери пара и конденсата, поэтому количество добавочной воды для таких ТЭЦ может достигать 10—50 % количества генерируемого пара.
1.3 Загрязнение водного теплоносителя в трактах ТЭС
Существуют несколько источников загрязнений теплоносителя в пароводяных трактах ТЭС и АЭС:
примеси добавочной воды, вводимой в цикл для покрытия внутренних и внешних потерь пара и конденсата;
присосы в конденсат пара охлаждающей воды в конденсаторах или сетевой воды в теплообменниках;
примеси загрязненного конденсата, возвращаемого от внешних потребителей пара на ТЭЦ;
примеси, искусственно вводимые в пароводяной тракт для коррекции водного режима (фосфаты, гидразин, аммиак и другие разнообразные добавки);
продукты коррозии конструкционных материалов, переходящие в теплоноситель.
В зависимости от типа основного теплоэнергетического оборудования и условий работы вклад и влияние каждого из перечисленных источников в суммарное загрязнение водного теплоносителя ТЭС и АЭС могут значительно варьироваться.
Присосы охлаждающей воды в конденсаторах турбин обусловлены более высоким давлением с водной стороны конденсатора по сравнению с паровой, находящейся под глубоким вакуумом. Необходимо иметь в виду, что присосы воды наблюдаются практически во всех конденсационных установках (исключая воздушно-конденсационные так называемые «сухие» градирни) и составляют обычно 0,005— 0,003 % количества конденсирующегося пара.
В качестве основных конструкционных материалов ТЭС на органическом топливе применяются стали перлитного и аустенитного классов и сплавы на основе меди, в том числе латуни. Продукты коррозии конструкционных материалов переходят в теплоноситель большей частью в виде коллоидных и грубодисперсных форм.
Повышение температуры и давления в контурах ТЭС и АЭС значительно изменяет способность воды растворять содержащиеся в ней примеси. Это связано с перестройкой структуры, проявляющейся, в частности, в уменьшении диэлектрической проницаемости воды, что отражает ослабление полярности ее молекул. При высокой температуре растворяющей способностью обладает не только жидкая вода, но и водяной пар, сближение растворяющих свойств которых обусловлено уменьшением разности их плотностей (соотношение 1050:1 при 100°С и 1:1 при критической температуре 374,15°С на линии насыщения). Способность пара растворять примеси и осложнение в связи с этим работы пароперегревателей котлов и паровых турбин за счет образования отложений и интенсификации коррозионно-эрозионных процессов вызывают необходимость поддерживать чистоту питательной воды энергетических блоков за счет как приготовления добавочной воды высокого качества, так и очистки питательной воды от растворенных и взвешенных примесей.
1.4 Водоподготовка и ее влияние на окружающую среду
На тепловых электростанциях применяются различные методы обработки воды, однако в основном их можно разделить на безреагентные, или физические методы и методы, в которых используются различные препараты (химические реагенты). Безреагентные (физические) методы применяются и как отдельные этапы в общем технологическом процессе обработки воды, и как самостоятельные методы, обеспечивающие получение воды требуемого качества. Применяя химическую обработку (включая также методы ионного обмена), можно получить как умягченную, так и глубокообессоленную воду; при одном из наиболее распространенных на ТЭС физических методов — термической обработке воды — всегда получают дистиллят, т.е. воду с очень небольшим содержанием примесей. Однако в ряде случаев при термической обработке, проводимой в целях глубокого обессоливания, применяется умягченная вода, т.е. вода, уже прошедшая химическую обработку или ионирование.
Для заполнения контура паротурбинной установки и восполнения потерь в нем на современных крупных ТЭС может применяться только глубокообессоленная вода. В настоящее время такую воду получают почти всегда химическим и термическим методами обессоливания. Заполнение тепловых сетей и компенсация потерь в них проводятся обычно водой, умягченной ионированием.
При эксплуатации водоподготовительных установок (ВПУ) образуются сточные воды в количестве 5—20% расхода обрабатываемой воды, которые обычно содержат шлам, состоящий из карбонатов кальция и магния, гидроксида магния, железа и алюминия, органических веществ, песка, а также различные соли серной и соляной кислот с концентрацией, достигающей десятков грамм на кубический дециметр, переходящие в стоки при регенерации фильтров. С учетом известных предельно допустимых концентраций (ПДК) вредных веществ в водоемах стоки ВПУ перед их сбросом должны соответствующим образом очищаться, причем затраты на обезвреживание стоков обычно сопоставимы с затратами на приготовление воды требуемого качества, поэтому задача создания малосточных ВПУ является актуальной.
Физико-химические основы процессов обработки воды (природной, сточной, конденсатов), схемы, аппараты и технологические процессы, используемые в этих целях, достаточно полно рассматриваются в источниках, приведенных в списке литературы.
2 Классификация природных вод и характеристика их примесей
Дисперсные системы
Природная вода – сложная дисперсная система, содержащая множество разнообразных минеральных и органических примесей.
Дисперсная система состоит из мелких частиц вещества, распределенного в другом веществе (среде). Система называется гомогенной, если внутри нее нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам. Гетерогенные системы – системы, внутри которых есть такие поверхности раздела. Гомогенная система – однофазная, гетерогенная – состоит из не менее двух фаз.
При размере частиц примесей воды меньше 10-3 мкм – это гомогенная система (однофазная из двух или более веществ).
Если размер частиц ≥10-3 мкм, то примеси образуют с водой гетерогенную неоднородную систему.
Истинные растворы, где примеси находятся в молекулярно-растворенном виде или в виде ионов, – это гомогенные системы. Гетерогенные системы – коллоиды (размер частиц: 10-2 – 10-1 мкм) или суспензии (частицы >10-1 мкм). Суспензии могут быть представлены взвесями, эмульсиями, пенами (частный случай эмульсий).
2.2 Системы классификации
Вода – один из лучших растворителей. Изначально в Мировом океане были – в той или иной степени – растворены все вещества Земли. И это растворение продолжается: количество поровых вод илов и горных пород составляет около 19% всей гидросферы.
Уже несколько столетий разрабатываются
системы классификации природных вод и способы как можно более краткой
характеристики качества воды (индекс качества воды). Выделено 625 и даже более
классов, групп, типов и разновидностей вод. В.И. Вернадский считал, что число
видов природных вод больше 1500 единиц.
15
Однако чем более детально
разрабатывалась классификация вод, тем больше исследователи удалялись от
желаемой краткости и ясности в определении качества воды. Оказалось
невозможным оценить пригодность воды для питьевых, технических, других целей
только на основе предложенных универсальных индексов воды.
Сегодня наиболее употребительны классификационные системы С.А. Щукарева, О.А. Алёкина и Л.А. Кульского [2].
Классификация С.А. Щукарева
Классификация основана на принципе
преобладания одного или нескольких из трех главных катионов (Na+,
Ca2+, Mg2+) и трех главных анионов (Cl-,
SО![]() , HCO-). Вода относится к тому или другому классу в зависимости от
содержания упомянутых ионов в количестве, превышающем 25%-экв. (суммы
процент-эквивалентов анионов и катионов в отдельности принимают за 100).
Комбинируя типы вод по содержанию катионов, получают 49 классов вод. Например,
вода может называться гидрокарбонатной натриево-кальциевой или
сульфатно-гидрокарбонатной кальциевой.
, HCO-). Вода относится к тому или другому классу в зависимости от
содержания упомянутых ионов в количестве, превышающем 25%-экв. (суммы
процент-эквивалентов анионов и катионов в отдельности принимают за 100).
Комбинируя типы вод по содержанию катионов, получают 49 классов вод. Например,
вода может называться гидрокарбонатной натриево-кальциевой или
сульфатно-гидрокарбонатной кальциевой.
По общей минерализации каждый класс разделен на группы: А – менее 1,5 г/л; В – от 1,5 до 10 г/л; С – от 10 до 40 г/л и D – более 40 г/л.
Классификация Щукарева очень проста и удобна для сопоставления различных по химическому составу вод, но громоздка (49 классов, 4 группы). Кроме того, деление на классы носит формальный характер, вследствие чего часть классов – нереальная.
Классификация Л.А. Кульского
|
Таблица 1 – Классификация вод по фазово-дисперсному состоянию примесей
|
Группа |
Наименование |
Размер, мкм |
Характеристика примесей |
|
Гетерогенная система |
|||
|
I |
Взвеси |
>10-1 |
Суспензии и эмульсии, обусловливающие мутность |
|
II |
Коллоидно-растворенные |
10-1–10-2 |
Коллоиды и высокомолекулярные |
|
Гомогенная система |
|||
|
III |
Молекулярно-раст-воренные вещества |
10-2–10-3 |
Газы, растворимые в воде; органические вещества, при-дающие воде запах и привкус |
|
IV |
Вещества, диссоци-ированные на ионы (электролиты) |
<10-3 |
Соли, кислоты, основания, придающие воде жесткость, щелочность и минерализо-ванность |
Классификация О.А. Алёкина
Классификация О.А. Алёкина с поправкой Е.В. Посохова и Ж.С. Сыдыкова сочетает принципы деления вод по преобладающим ионам и по соотношению между ними. Все воды делятся на три класса по преобладающему аниону: гидрокарбонатные (карбонатные), сульфатные и хлоридные. Внутри каждого класса выделяют три группы по преобладанию одного из катионов: кальций, магний, натрий (или натрий + калий).
По химическому составу примеси природных вод можно разделить на два типа: минеральные и органические.
К минеральным примесям воды
относятся растворенные газы (N2,
O2, СО2),
газы, образующиеся в результате биохимических процессов (NH3,
CH4,
H2S), газы, вносимые сточными водами, разнообразные соли, кислоты,
основания, в различной степени находящиеся в диссоциированной форме, т.е. в виде катионов и анионов (Na+,
K+, Са2+,
Mg2+,
NH![]() ,
Fe2+,
Fe3+, Мn2+, НСО
,
Fe2+,
Fe3+, Мn2+, НСО![]() , Сl-,
SO
, Сl-,
SO![]() ,
SiO
,
SiO![]() ,
NO
,
NO![]() ).
).
3 Физико-химические показатели качества природных вод
Под качеством природной воды, в целом, понимается характеристика ее состава и свойств, определяющая ее пригодность для конкретных видов водопользования, при этом критерии качества представляют собой признаки, по которым производится оценка качества воды [3].
3.1 Взвешенные примеси
Взвешенные твердые примеси, присутствующие в природных водах, состоят из частиц глины, песка, ила, суспендированных органических и неорганических веществ, планктона и различных микроорганизмов. Взвешенные частицы влияют на прозрачность воды.
Содержание в воде взвешенных примесей, измеряемое в мг/л, дает представление о загрязненности воды частицами, в основном, условным диаметром более 1·10-4 мм – таблица 1.
При содержании в воде взвешенных веществ менее 2–3 мг/л или больше указанных значений, но условный диаметр частиц меньше 1·10-4 мм, определение загрязненности воды производят косвенно по мутности воды.
3.2 Мутность и прозрачность
Мутность воды вызвана присутствием тонкодисперсных примесей, обусловленных нерастворимыми или коллоидными неорганическими и органическими веществами различного происхождения. Качественное определение проводят описательно: мутность не заметна (отсутствует), слабая опалесценция, опалесценция, слабомутная, мутная и сильная муть.
В России мутность чаще всего измеряют в нефелометрических единицах мутности НЕФ (NTU) для небольших значений в пределах 0-40 НЕФ (NTU), например, для питьевой воды. В условиях большой мутности обычно применяется измерение единиц мутности по формазину (ЕМФ). Пределы измерений – 40-400 ЕМФ.
Индикатор по НЕФ (NTU) – рассеивание излучения, по ЕМФ – ослабление потока излучения.
Наряду с мутностью, особенно в случаях, когда вода имеет незначительные окраску и мутность, и их определение затруднительно, пользуются показателем «прозрачность».
Мера прозрачности – высота столба воды, при которой можно наблюдать опускаемую в воду белую пластину определенных размеров (диск Секки) или различать на белой бумаге шрифт определенного размера и типа (шрифт Снеллена). Результаты выражаются в сантиметрах.
3.3 Минерализация
Минерализация – суммарное содержание всех найденных при химическом анализе воды минеральных веществ. Минерализация природных вод, определяющая их удельную электропроводность, изменяется в широких пределах и меняется от 30 до 1500 мкСм/см. Природные воды по минерализации по ГОСТ разделены на следующие группы:
Таблица 2 – Характеристика вод по ГОСТ
|
Группа воды |
Единицы измерения, г/кг |
|
Пресные Солоноватые Соленые Рассолы |
До 1 Более 1 до 25 Более 25 до 50 Более 50 г/кг |
Предел пресных вод – 1 г/кг – установлен в связи с тем, что при минерализации более этого значения вкус воды неприятен – соленый или горько-соленый.
Граница 50 г/кг между солеными водами и рассолами обусловлена тем, что соленость больше этого значения не бывает в морях; такая соленость характерна только для соленых озер и некоторых подземных вод.
Таблица 3 – Характеристика вод по общей минерализации (наиболее распространенная градация)
|
Наименование воды |
Общая минерализация, г/кг |
|
Ультрапресная Пресная Слабопресная Соленая Сильносоленая Рассол Ультрарассол |
До 0,1 Более 0,1 до 1,0 Более 1,0 до 3,0 Более 3,0 до 10,0 Более 10,0 до 50,0 Более 50,0 до 300,0 Более 300,0 |
3.4 Цветность
Показатель качества воды, характеризующий интенсивность окраски воды и обусловленный содержанием окрашенных соединений, выражается в градусах платино-кобальтовой шкалы и определяется путем сравнения окраски испытуемой воды с эталонами.
Цветность природных вод обусловлена, главным образом, присутствием гумусовых веществ и соединений трехвалентного железа, колеблется от единиц до тысяч градусов – таблица 4.
Таблица 4 – Характеристика вод по цветности
|
Цветность |
В градусах |
|
Очень малая Малая Средняя Высокая Очень высокая |
До 25 Более 25 до 50 Более 50 до 80 Более 80 до 120 Более 120 |
3.5 Жесткость
Жесткость воды обусловливается наличием в воде ионов кальция (Са2+), магния (Mg2+), стронция (Sr2+), бария (Ва2+), железа (Fe3+), марганца (Mn2+). Но общее содержание в природных водах ионов кальция и магния несравнимо больше содержания всех других перечисленных ионов – и даже их суммы. Поэтому под жесткостью понимают сумму количеств ионов кальция и магния – общая жесткость, складывающаяся из значений карбонатной (временной, устраняемой кипячением) и некарбонатной (постоянной) жесткости. Первая вызвана присутствием в воде гидрокарбонатов кальция и магния, вторая наличием сульфатов, хлоридов, силикатов, нитратов и фосфатов этих металлов. Однако при значении жесткости воды более 9 ммоль/л, нужно учитывать содержание в воде стронция и других щелочноземельных металлов.
По стандарту ИСО 6107-1-8:1996, включающему более 500 терминов, жесткость определяется как способность воды образовывать пену с мылом.
В России жесткость воды выражают в ммоль/л. В жесткой воде обычное натриевое мыло превращается (в присутствии ионов кальция) в нерастворимое «кальциевое мыло», образующее бесполезные хлопья. И, пока таким способом не устранится вся кальциевая жесткость воды, образование пены не начнется. На 1 ммоль/л жесткости воды для такого умягчения воды теоретически затрачивается 305 мг мыла, практически – до 530. Но, конечно, основные неприятности – от накипеобразования. Международные своды нормативов качества воды не нормируют жесткость воды – только отдельно содержание в воде ионов кальция (Са2+) и магния (Mg2+). По значению общей жесткости природные воды делят на группы – таблица 5.
Таблица 5 – Классификация воды по жесткости
|
Характеристика воды по жесткости |
Ммоль/л |
|
Очень мягкая |
До 1,5 |
|
Мягкая |
Более 1,5 до 4,0 |
|
Средней жесткости |
Более 4 до 8 |
|
Жесткая |
Более 8 до 12 |
|
Очень жесткая |
Более 12 |
3.6 Щелочность
Щелочностью воды называется суммарная концентрация содержащихся в воде анионов слабых кислот и гидроксильных ионов (выражена в ммоль/л), вступающих в реакцию при лабораторных исследованиях с соляной или серной кислотами с образованием хлористых или сернокислых солей щелочных и щелочноземельных металлов.
Различают следующие формы щелочности воды: бикарбонатная (гидрокарбонатная), карбонатная, гидратная, фосфатная, силикатная, гуматная – в зависимости от анионов слабых кислот, которыми обусловливается щелочность.
Щелочность природных вод, рН которых обычно <8,35, зависит от присутствия в воде бикарбонатов, карбонатов, иногда и гуматов. Щелочность других форм появляется в процессах обработки воды.
Так как в природных водах почти всегда щелочность определяется бикарбонатами, то для таких вод общую щелочность принимают равной карбонатной жесткости.
3.7 Органические вещества
Спектр органических примесей очень широк:
- группа растворенных примесей:
гуминовые кислоты и их соли – гуматы натрия, калия, аммония;
некоторые примеси промышленного происхождения;
часть аминокислот и белков;
- группа нерастворенных примесей:
фульвокислоты (соли) и гуминовые кислоты и их соли – гуматы кальция, магния, железа;
жиры различного происхождения;
частицы различного происхождения, в том числе микроорганизмы.
Органические вещества, попадающие в открытые водоемы в результате вымывания почв и торфянников, объединяют обычно под названием – гумусовых. Большое значение в повышении количественного и качественного содержания органических веществ в поверхностных водоемах играют недостаточно очищенные бытовые, производственные, а также сельскохозяйственные стоки.
Содержание органических веществ в воде оценивается по методикам определения окисляемости воды, содержания органического углерода, биохимической потребности в кислороде, а также поглощения в ультрафиолетовой области.
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью. Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая (методики определения двух последних применяются редко). Окисляемость выражается в миллиграммах кислорода, эквивалентного количеству реагента, пошедшего на окисление органических веществ, содержащихся в 1 л воды.
Окислители могут действовать и
на неорганические
2
примеси, например,
на ионы Fe2+, S2-, NO
![]() но соотношение между этими ионами и органическими
примесями в поверхностных водах существенно сдвинуто в сторону органических
примесей, то есть «органики» в решающей степени больше.
но соотношение между этими ионами и органическими
примесями в поверхностных водах существенно сдвинуто в сторону органических
примесей, то есть «органики» в решающей степени больше.
В подземных водах (артезианских) это соотношение – обратное, то есть органических примесей гораздо меньше, чем указанных ионов. Практически их совсем нет. К тому же неорганические примеси могут определяться непосредственно индивидуально.
Биохимическая потребность в
кислороде (БПК) –
показатель, определяемый при окислении «органики» природных вод не химическими веществами, а биохимическими воздействиями в аэробных условиях. Чаще определяют биохимическое потребление кислорода за пять суток – БПК, и, как правило, этот показатель в поверхностных водах находится в пределах 0,5-4,0 мгО/л.
3.8 Сухой и прокаленный остаток
Эти показатели нужны, во-первых, для проверки правильности определения содержания в воде разных ионов и, во-вторых, для предварительного определения возможности применения ионообменного, обратноосмотического или других методов обработки воды.
По разности значений сухого и прокаленного остатков можно приблизительно определять количество органических веществ.
4 Очистка воды методом коагуляции
4.1 Характеристика коллоидных систем
Коллоидные примеси представляют собой агломераты из большого числа молекул с наличием поверхности раздела между твердой фазой и водой. Коллоидные частицы не выделяются из воды под действием силы тяжести, т.е. не оседают на дно сосуда, в котором находится коллоидный раствор. Коллоидные частицы не задерживаются обычными фильтрующими материалами (песок, фильтровальная бумага) из-за соотношения размера пор в объеме фильтрующего материала и размера коллоидных частиц [4].
Коллоидные системы в природных водах обладают агрегативной устойчивостью, т.е. стабильностью дисперсности (стабильностью размера коллоидных частиц). Агрегативная устойчивость при малых размерах коллоидных частиц способствует седиментационной устойчивости, т.е. постоянству концентрации коллоидных частиц по всему объему раствора.
По способности связывать воду коллоидные вещества делятся на гидрофобные и гидрофильные. Гидрофобные коллоиды – частицы глины, песка, золи оксидов металлов (алюминия, железа) – не связывают существенных количеств молекул воды, обладают значительным электрическим зарядом. Гидрофильные коллоиды – вещества, придающие воде цветность. Они попадают в водоемы со сточными водами, способны связывать большое количество молекул воды, обладают незначительным электрическим зарядом.
При потере агрегативной устойчивости коллоидные частицы слипаются. Физико-химический процесс укрупнения коллоидных частиц за счет их слипания под действием сил межмолекулярного притяжения с последующим выделением их из воды называют коагуляцией.
Основное назначение коагуляции - удаление из воды органических примесей. Кроме того, при коагуляции происходит снижение концентрации грубодисперсных примесей, цветности, а также улучшаются условия осаждения карбоната кальция и гидроксида магния при реагентном методе умягчения воды.
Контроль качества процесса коагуляции проводят, оценивая окисляемость, прозрачность, цветность исходной и обработанной воды.
4.2 Строение коллоидных частиц
Агрегативная устойчивость коллоидной системы объясняется существованием двойного электрического слоя и скачка потенциала на границе раздела между коллоидной частицей и водой.
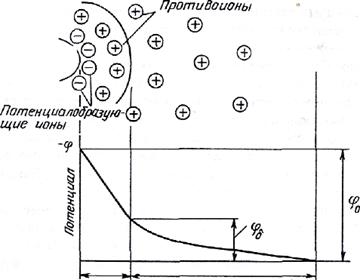
На поверхности коллоидной частицы, обладающей избыточной энергией, располагаются потенциалобразующие ионы (см. рисунок 1).
Коллоидная
частица
Рисунок 1 – Строение неподвижной коллоидной частицы
Таким
образом, вокруг коллоидной частицы существует двойной
электрический слой, включающий
потенциалобразующие ионы и противоионы. При этом на границе коллоидной частицы
возникает потенциал (![]() двойного электрического слоя, а на границе диффузной части
двойного электрического слоя – потенциал
двойного электрического слоя, а на границе диффузной части
двойного электрического слоя – потенциал ![]() ). Если коллоидная
частица неподвижна, комплекс частицы с
двойным электрическим слоем электронейтрален.
Частицу дисперсной фазы вместе с двойным электрическим слоем называют мицеллой. Внутреннюю
часть мицеллы составляет агрегат основного вещества, на поверхности которого
расположены потенциалобразующие ионы. Агрегат с потенциалобразующими ионами
образует ядро мицеллы. Ядро с противоионами плотной части двойного
электрического слоя составляет гранулу. Заряженная гранула, окруженная
противоионами диффузного слоя, представляется электронейтральной мицеллой.
). Если коллоидная
частица неподвижна, комплекс частицы с
двойным электрическим слоем электронейтрален.
Частицу дисперсной фазы вместе с двойным электрическим слоем называют мицеллой. Внутреннюю
часть мицеллы составляет агрегат основного вещества, на поверхности которого
расположены потенциалобразующие ионы. Агрегат с потенциалобразующими ионами
образует ядро мицеллы. Ядро с противоионами плотной части двойного
электрического слоя составляет гранулу. Заряженная гранула, окруженная
противоионами диффузного слоя, представляется электронейтральной мицеллой.
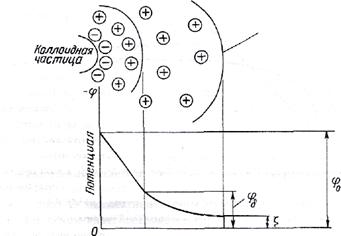
При броуновском движении коллоидной частицы в жидкости происходит разрыв двойного электрического слоя по поверхности скольжения. Часть ионов диффузного слоя захватывается частицей, а остальные ионы диффузного слоя остаются в растворе (см. рисунок 2). При этом устанавливается разность потенциалов между движущейся коллоидной частицей и окружающей ее средой на поверхности скольжения.
Потенциал
на поверхности скольжения называется электрокинетическим потенциалом или
![]() (дзета)-потенциалом.
(дзета)-потенциалом.
 |
Расстояние от коллоидной частицы
Рисунок 2 – Строение движущейся коллоидной частицы
Для коллоидных частиц,
находящихся в природной воде, ![]() - потенциал составляет приблизительно – 70
мВ. Значение
- потенциал составляет приблизительно – 70
мВ. Значение ![]() -
потенциала зависит от концентрации
противоионов в диффузном слое и соответственно раствора. При добавлении
в коллоидную систему достаточного количества
многовалентных противоионов, способных к избирательной адсорбции поверхностью коллоидной частицы,
значение
-
потенциала зависит от концентрации
противоионов в диффузном слое и соответственно раствора. При добавлении
в коллоидную систему достаточного количества
многовалентных противоионов, способных к избирательной адсорбции поверхностью коллоидной частицы,
значение ![]() -потенциала стремится к нулю, а затем может
произойти перезарядка частицы, т.е.
изменение
знака заряда на противоположный.
-потенциала стремится к нулю, а затем может
произойти перезарядка частицы, т.е.
изменение
знака заряда на противоположный.
4.3 Устойчивость коллоидной системы
Коллоидные мицеллы находятся в воде под действием силы тяжести, заставляющей частицы опускаться на дно сосуда, а также под действием диффузионных сил, вызываемых броуновским движением, под влиянием которых частицы стремятся равномерно распределиться по всему объему жидкости.
Суммарная энергия взаимодействия U коллоидных частиц складывается из энергии электростатического отталкивания и энергии межмолекулярного притяжения (см. рисунок 3). Кривая зависимости суммарной энергии взаимодействия между коллоидными частицами от расстояния х между ними имеет два энергетических минимума (1, 3) и один максимум (2) (потенциальный барьер).
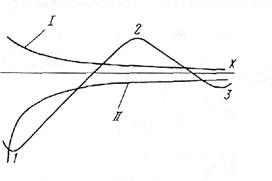 |
U
Рисунок 3 – Суммарная энергия взаимодействия между коллоидными частицами
На
малых и больших расстояниях между коллоидными частицами преобладает энергия притяжения
(состояние 1,2), обеспечивающая
слипание коллоидных частиц, т.е. коагуляцию. На средних расстояниях между коллоидными
частицами, соответствующих толщине двойного электрического слоя,
преобладает энергия отталкивания (состояние 3), препятствующая слипанию
частиц. При значении потенциала адсорбционного слоя ![]() более - 20 мВ образуется потенциальный
барьер, обеспечивающий агрегативную
устойчивость однородной коллоидной системы. Коллоидные системы
природных вод имеют
более - 20 мВ образуется потенциальный
барьер, обеспечивающий агрегативную
устойчивость однородной коллоидной системы. Коллоидные системы
природных вод имеют ![]() =
- 70 мВ. С учетом того, что
=
- 70 мВ. С учетом того, что ![]() >
> ![]() , коллоидные системы природных вод характеризуются высоким потенциальным барьером и большой
агрегативной устойчивостью.
, коллоидные системы природных вод характеризуются высоким потенциальным барьером и большой
агрегативной устойчивостью.
4.4 Коагуляция коллоидных частиц
Коагуляцию можно обеспечить
путем добавления в коллоидную систему электролита (электролитная
коагуляция). При этом происходит
сжатие двойного электрического слоя и уменьшение ![]() -потенциала
по абсолютной величине. Когда суммарный заряд противоионов в адсорбционном
слое станет равным заряду потенциалобразующих ионов,
-потенциала
по абсолютной величине. Когда суммарный заряд противоионов в адсорбционном
слое станет равным заряду потенциалобразующих ионов, ![]() -потенциал станет равным нулю и коагуляция
будет протекать наиболее интенсивно. Состояние коллоидной системы, при котором
-потенциал станет равным нулю и коагуляция
будет протекать наиболее интенсивно. Состояние коллоидной системы, при котором
![]() =0, носит
название изоэлектрического состояния. Значение рН, отвечающее
изоэлектрическому состоянию, называется рН изоэлектрической точки (рНиз).
=0, носит
название изоэлектрического состояния. Значение рН, отвечающее
изоэлектрическому состоянию, называется рН изоэлектрической точки (рНиз).
Однако осуществление коагуляции природных вод путем добавления электролита (высаливания) приводит к повышению солесодержания. Это снижает технико-экономические показатели процесса очистки воды на следующей стадии полного или частичного удаления из воды ионизированных примесей.
При очистке добавочной воды применяют взаимную коагуляцию разнородных дисперсных систем – гетерокоагуляцию. Для этого в очищаемую воду добавляют коагулянт, т.е. раствор минеральной соли, способный образовывать искусственный коллоидный раствор. Так как коллоидные частицы природных вод обычно имеют отрицательный заряд, минеральную соль выбирают таким образом, чтобы частицы образованного этой солью искусственного коллоидного раствора имели положительный заряд. При добавлении в обрабатываемую природную воду коагулянта происходит нейтрализация отрицательно заряженных коллоидных частиц природной воды положительно заряженными коллоидными частицами коагулянта, их слипание и укрупнение в хлопья, выпадающие в осадок.
В коллоидных частицах природных вод противоионами чаще всего являются катионы преимущественно натрия и калия, способные к обмену на катионы, содержащиеся в воде. При обмене одновалентных противоионов коллоидной частицы на двухвалентные катионы кальция и магния, обычно содержащиеся в воде, агрегативная устойчивость коллоидных систем снижается. Еще в большей степени их устойчивость понижается под влиянием трехвалентных катионов. Поэтому наибольший эффект дает коагулирование взвесей солями трехвалентных металлов.
При очистке природной воды от органических примесей в качестве коагулянта применяют сернокислый алюминий (глинозем) Al2(SO4)3·18H2O, сернокислую закись железа (железный купорос) FeSO4·7H2O, оксихлорид алюминия Аlm(ОН)nСl3(m-n). Сернокислое железо используют в качестве коагулянта при совмещении процессов коагуляции и известкования.
При добавлении в обрабатываемую воду сернокислого алюминия происходит диссоциация Аl2(SO4)3
Al2(SO4)3 ![]() 2Аl3+ + 3SO
2Аl3+ + 3SO![]() .
.
Ионы алюминия вступают в обмен с противоионами, находящимися в адсорбционном слое коллоидных частиц, загрязняющих воду. Этот процесс заканчивается, когда будет исчерпана обменная способность коллоидных частиц.
Параллельно с процессами диссоциации и ионного обмена происходит гидролиз избытка добавленного в воду сернокислого алюминия с образованием частиц малорастворимого гидроксида алюминия
Аl3+ + 3Н2О ![]() Al(OH)3
Al(OH)3![]() + 3Н+
+ 3Н+
При этом образуется коллоид труднорастворимого соединения гидроксида алюминия Аl(ОН)3, который вызывает процесс гетерокоагуляции.
При рН>8 алюминий в водном растворе образует растворимые алюминаты АlО2-. При рН<4,5 гидролиз сернокислого алюминия практически не происходит, гидроксид алюминия не образуется, а введенный в воду алюминий остается в растворе в виде катионов Аl3+.
Под влиянием ионов
SO![]() и образующихся в первый момент
ионов
Аl3+ происходит электролитная коагуляция.
и образующихся в первый момент
ионов
Аl3+ происходит электролитная коагуляция.
Ионы водорода, выделяющиеся
при гидролизе сернокислого алюминия, понижают рН воды и, сдвигая его значение
от рНиз, ухудшают процесс коагуляции. Одновременно избыток ионов
водорода прекращает процесс гидролиза сернокислого алюминия. Поэтому необходимо
удалять катионы водорода из зоны реакции. При очистке природных вод это обычно
осуществляется при взаимодействии катионов водорода с присутствующими в воде бикарбонат-ионами НСО![]() .
.
Если содержание бикарбонат-ионов в воде недостаточно, то для связывания выделяющихся при гидролизе ионов Н+ в воду добавляют известь, соду или едкий натр.
Наличие разноименно заряженных коллоидных частиц природной воды и коагулянта приводит, как отмечалось выше, к гетерокоагуляции. В результате электролитной коагуляции и гетерокоагуляции образуются микрохлопья, при этом происходит очистка воды от коллоидных примесей. В дальнейшем микрохлопья слипаются, захватывают грубодисперсные примеси и образуют коагуляционную структуру в виде хлопьев (флокул), имеющих диаметр 0,5-3,0 мм с плотностью 1,001-1,1 г/см3. Образовавшиеся из микрохлопьев флокулы под действием силы тяжести оседают в воде и могут быть выделены из нее в процессе отстаивания.
В качестве коагулянта применяют также сернокислую закись железа FeSO4 при совмещении коагуляции с известкованием. При растворении в воде сернокислая закись железа диссоциирует с образованием двухвалентных катионов железа. После диссоциации происходит обмен катионов железа на часть противоионов коллоидных частиц, находящихся в обрабатываемой воде, а затем гидролиз сернокислой закиси железа.
Гидролиз двухвалентного железа происходит очень медленно при рН<8 и хлопья гидрозакиси железа Fe(OH)2 образуются только при рН>9. Так как в природной воде содержится достаточное количество растворенного кислорода, то происходит окисление закисного железа в окисное, а гидролиз окисного железа и образование коллоидов гидроксида железа происходит при рН>3,5. Исходя из значения произведения растворимости для проведения коагуляции с помощью сернокислой закиси железа, следует добиваться образования коллоидов в виде хлопьев гидроксида железа Fe(OH)3. Однако с приемлемой для практики очистки воды скоростью закисное железо окисляется растворенным в воде кислородом только при рН>8. Для проведения коагуляции с помощью FeSO4 при рН>8 приходится подщелачивать воду. Поэтому FeSO4 в качестве коагулянта применяют в основном в тех случаях, когда вода имеет высокое значение рН, например, при умягчении воды реагентами (известью или известью и содой).
В качестве коагулянта в процессах очистки воды от органических примесей применяют также неорганические полимерные соединения алюминия, среди которых можно выделить полиоксихлорид алюминия Аlm(ОН)nСl3(m-n) (ОХА). По сравнению с сернокислым алюминием ОХА имеет существенные преимущества: в меньшей степени снижает рН и щелочность воды, что позволяет применять его при очистке воды с низкой щелочностью без предварительного подщелачивания; эффективен в более широком диапазоне рН – от 6 до 9, в некоторых случаях от 5 до 10; существенно снижает продолжительность образования крупных хлопьев и увеличивает скорость их осаждения; в обработанной ОХА воде содержание хлоридов увеличивается примерно в 2-8 раз меньше, чем сульфатов при дозировании Al2(SO4)3.
В качестве вспомогательных веществ, способствующих хлопьеобразованию при коагуляции, применяют высокомолекулярные вещества, называемые флокупянтами. К флокулянтам относится полиакриламид ПАА – полиэлектролит, растворимый в воде и диссоциирующий с образованием одного сложного высокомолекулярного поливалентного иона и многих простых маловалентных ионов с зарядом противоположного знака. ПАА – амфотерный полиэлектролит: знак заряда его высокомолекулярного иона зависит от рН раствора. Молекулы ПАА представляют собой вытянутые нити длиной до 1 мкм и толщиной (3-7)·10-4 мкм.
Причиной хлопьеобразования является сорбция гидрофобными коллоидными частицами молекул ПАА. Отдельные звенья цепочки удлиненных молекул ПАА сорбируются несколькими коллоидными частицами, после чего молекула ПАА сворачивается в клубок. Получающиеся хлопьевидные агрегаты осаждаются со значительной скоростью.
4.5 Выбор дозы коагулянта и значения рН
Правильный выбор дозы коагулянта является одним из основных условий протекания процесса коагуляции. Оптимальная доза коагулянта, т.е. минимальная доза, при которой достигается достаточно быстрое и полное осветление и снижение концентрации органических примесей в очищаемой воде, зависит от физико-химических свойств примесей воды, а также от температуры и способа осуществления коагуляции.
В практике очистки воды оптимальную дозу коагулянта определяют с помощью пробного коагулирования. Методика пробного коагулирования заключается в следующем. В несколько конических стеклянных колб вносят пробы исследуемой воды и нагревают их до 40°С, затем в каждой колбе создают определенные значения рН путем добавления в них раствора кислоты или щелочи. После этого в каждую колбу вводят определенный объем раствора коагулянта известной концентрации, содержимое колб перемешивают и оставляют в покое в течение 30 мин. По истечении указанного времени содержимое колб фильтруют через бумажный фильтр и в фильтрате определяют окисляемость – показатель, характеризующий концентрацию органических примесей. На основании полученных данных определяют оптимальное значение рН, при котором наблюдается максимальное снижение окисляемости.
4.6 Качество коагулированной воды
Качество коагулированной воды зависит от состава исходной воды и соблюдения оптимальных условий проведения коагуляции. В коагулированной воде снижается содержание органических примесей и взвешенных веществ; уменьшается щелочность, повышаются концентрации углекислоты, сульфат-ионов (при применении в качестве коагулянта сернокислого алюминия или сернокислого железа), хлорид-ионов (при использовании в качестве коагулянта ОХА). При налаженной технологии процесса обычно обеспечиваются следующие показатели качества коагулированной воды:
-
остаточная
перманганатная окисляемость составляет 30-40%
исходной величины;
- кремнесодержание снижается на 60-90%;
- концентрация растворенной углекислоты повышается на дозу коагулянта;
- концентрация сульфат-ионов увеличивается на дозу коагулянта в случае применения в качестве коагулянта сернокислого алюминия или сернокислого железа;
-
концентрация
хлорид-ионов увеличивается на дозу коагулянта в
случае применения в качестве коагулянта ОХА;
- щелочность уменьшается на дозу коагулянта;
- жесткость общая остается неизменной, но одновременно происходит перераспределение жесткости: карбонатная жесткость уменьшается на дозу коагулянта;
- содержание взвешенных веществ составляет 1-2 мг/дм;
- прозрачность воды по шрифту более 30 см.
5 Очистка воды методом известкования
5.1 Основные закономерности метода известкования
Основное назначение известкования заключается в снижении щелочности (декарбонизация) исходной воды, которое достигается повышением значения рН свыше 9,0 с одновременным выводом (осаждением) образующихся карбонат-ионов в составе труднорастворимого соединения СаСО3. Для этого в обрабатываемую воду вводят известь в виде раствора или суспензии («известковое молоко»). В результате подачи извести в обрабатываемой воде повышается концентрация ионов Са2+ и ОН-
Са(ОН)2 → Са2+ + 2ОН-, (5.1)
что приводит к смещению углекислотного равновесия при одновременном повышении рН.
В общем виде процесс известкования состоит из следующих стадий:
- взаимодействие ионов ОН- с гидратированными молекулами
углекислоты
СО2 + 2ОН-
→ НСО![]() + ОН- → СО
+ ОН- → СО![]() + 2Н2О; (5.2)
+ 2Н2О; (5.2)
- взаимодействие ионов ОН- с бикарбонат-ионами, присутствующими в воде и определяющими ее щелочность
HCO![]() + ОН- → СО
+ ОН- → СО![]() + Н2О;
(5.3)
+ Н2О;
(5.3)
- образование твердой фазы (кристаллизация) СаСО3 из ионов
СО![]() и ионов Са2+,
содержащихся в исходной воде и введенных с известью, при превышении
произведения растворимости карбоната кальция
и ионов Са2+,
содержащихся в исходной воде и введенных с известью, при превышении
произведения растворимости карбоната кальция
Са2+ +
СО![]() → СаСО3 тв.
(5.4)
→ СаСО3 тв.
(5.4)
При дозировании извести в количестве, большем, чем это необходимо для перевода свободной углекислоты и бикарбонат-ионов в карбонат-ионы, в воде появляется избыточная концентрация гидроксид-ионов и может быть превышено произведение растворимости Mg(OH)2. В этом случае происходит снижение магниевой жесткости воды
Mg2+ + 2ОН- → Mg(OH)2↓. (5.5)
Изменение (качественное) концентрации углекислотных компонентов и компонентов солей жесткости, рассчитанное для состояния равновесия, в процессе дозирования извести иллюстрирует рисунок 4.
В соответствии с приведенными
зависимостями, дозирование извести до рН ≈ 8,3 первоначально приводит к
переводу углекислоты в бикарбонат-ионы (первая стадия реакции (5.2)) при
соответствующем увеличении, мг-экв/кг,
щелочности и концентрации кальция. Дальнейшее повышение концентрации ионов ОН- в воде сопровождается
переводом ионов НСО![]() в карбонат-ионы в соответствии с
уравнением (5.3). При некотором значении рН,
зависящем от состава исходной воды, достигается произведение растворимости
карбоната кальция, после чего начинается кристаллизация СаСО3 (зона
б). В этот период начинается снижение
концентрации иона Са2+ и щелочности воды при одновременном
перераспределении концентрации компонентов
углекислотного равновесия (снижение концентрации НСО
в карбонат-ионы в соответствии с
уравнением (5.3). При некотором значении рН,
зависящем от состава исходной воды, достигается произведение растворимости
карбоната кальция, после чего начинается кристаллизация СаСО3 (зона
б). В этот период начинается снижение
концентрации иона Са2+ и щелочности воды при одновременном
перераспределении концентрации компонентов
углекислотного равновесия (снижение концентрации НСО![]() − ионов и увеличение концентраций ионов СО
− ионов и увеличение концентраций ионов СО![]() и ОН-).
и ОН-).
Дальнейшее дозирование извести приводит к такому повышению концентрации гидроксид-ионов, когда достигается произведение растворимости гидроксида магния и начинается его кристаллизация (зона с). В этот период наряду с уменьшением концентрации магния при некотором значении рН, зависящем от состава раствора, начинается рост концентрации кальция (происходит замена кальциевой жесткости на магниевую) и далее общей жесткости и щелочности обрабатываемой воды (зона d).
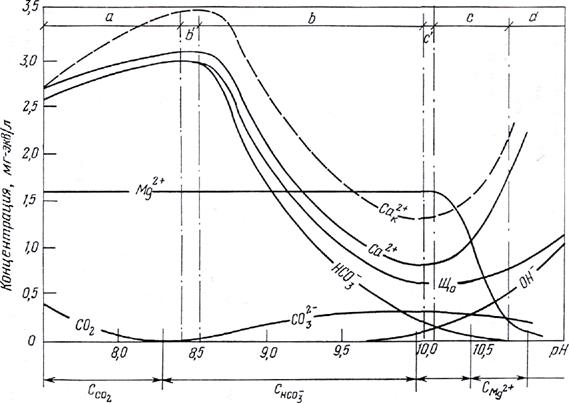 |
Рисунок 4 – Изменение концентрации при дозировании извести
Как следует из рисунка 4, область оптимальных значений рН известкованной воды, соответствующая максимальному снижению щелочности и жесткости, находится в интервале 10,0-10,5 и зависит не только от состава исходной воды, но и от задач известкования (необходимость добиться минимальной остаточной щелочности, наиболее глубокого снижения общей жесткости), а также режима работы осветлителя – недопустимости выноса шлама, а, следовательно, и ограничения доли легкого гидроксида магния в общем количестве шлама. При сочетании известкования с коагуляцией сернокислым железом известь также расходуется на гидролиз коагулянта в соответствии с реакцией
4FeSO4 + 4Са(ОН)2 + 2Н2О + О2 → 4Fe(OH)3 + 4CaSО4. (5.6)
Изменение концентрации кальция в этом случае показано на рисунке 4 пунктирной линией. На рисунке также отмечены зоны метастабильного состояния пересыщенной по СаСО3 (зона b') и Mg(OH)2 (зона c') воды, т.е. зоны, когда уже достигнуто произведение растворимости соответствующего соединения, однако их кристаллизация еще не происходит.
Анализ протекающих при известковании воды химических процессов позволяет определить необходимые дозы извести и области технологической применимости известкования.
В соответствии с приведенными
химическими реакциями, уменьшение щелочности воды произойдет, если суммарное
содержание кальция, находящегося в исходной воде и введенного с известью, будет
не меньше (в эквивалентных единицах),
чем концентрация образующихся ионов СО![]() .
.
Известь, т.е. ионы ОН-,
согласно реакциям (5.2), (5.3) и (5.6) должны вводиться в воду, во-первых, для
связывания СО2, во-вторых, для разложения НСО![]() -
ионов, а в третьих, для разложения коагулянта. Поэтому минимальная
доза извести составит
-
ионов, а в третьих, для разложения коагулянта. Поэтому минимальная
доза извести составит
![]() .
(5.7)
.
(5.7)
В соответствии с этим общее количество ионов Са2+, содержащихся в воде и поступивших с известью, будет равно
![]()
![]() . (5.8)
. (5.8)
Концентрация образовавшихся в
результате дозирования извести ионов СО![]() , мг-экв/л, составит
, мг-экв/л, составит
![]() . (5.9)
. (5.9)
Если ![]() , то доза извести, определенная
по уравнению (5.7), достаточна для снижения щелочности исходной воды. Из
уравнений (5.8) и (5.9) следует, что это условие соблюдается,
если
, то доза извести, определенная
по уравнению (5.7), достаточна для снижения щелочности исходной воды. Из
уравнений (5.8) и (5.9) следует, что это условие соблюдается,
если
![]() , (5.10)
, (5.10)
или, учитывая, что ![]()
![]() мало в зоне оптимального значения рН,
получим условие, при котором выделение магния из воды не требуется
мало в зоне оптимального значения рН,
получим условие, при котором выделение магния из воды не требуется
![]() .
(5.11)
.
(5.11)
Если в этом случае продолжать дозирование извести, происходит выделение из воды Mg2+ в результате кристаллизации Mg(OH)2. Однако это не будет сопровождаться снижением щелочности или жесткости воды: магниевая жесткость будет заменяться на кальциевую до определенных значений рН:
MgCl2 + Ca(OH)2 → Mg(OH)2 + СаСl2;
MgSO4 + Са(ОН)2 → Mg(OH)2 + CaSO4, (5.12)
а затем и щелочность и жесткость начнут возрастать по мере дальнейшего увеличения рН (см. рисунок 4, зона d).
Тем не менее, на практике при совмещении известкования с коагуляцией исходной воды дозу извести рассчитывают и на удаление ионов магния, поскольку Mg(OH)2 служит хорошим «коллектором» (сорбентом) при удалении из воды кремнекислых соединений. Доза извести в этом случае рассчитывается по уравнению
![]() , (5.13)
, (5.13)
где Iи − избыток извести, равный обычно 0,1-0,2 мг-экв/л.
Для вод, характеризующихся наличием условно «магниевой бикарбонатной щелочности», если выполняется соотношение
![]() ,
,
необходимо увеличить дозу извести на величину дефицита ионов Са2+
![]() . (5.14)
. (5.14)
При этом избыточные ионы ОН-, вводимые вместе с известью, будут приводить к выделению ионов магния в эквивалентном количестве
![]() .
.
Чтобы достичь требуемой глубины выделения магния в эквивалентном количестве, необходимо обеспечить соответствующую концентрацию ионов ОН- в известкованной воде, т.е. дозировать известь с избытком:
![]() (5.15)
(5.15)
или, с учетом уравнения (5.14),
![]() . (5.16)
. (5.16)
Для вод с высокой некарбонатной жесткостью с целью снижения нагрузки на катионитные фильтры водоподготовительных установок применяют известково-содовый метод умягчения, при котором ввод дополнительных карбонат-ионов достигается дозированием кальцинированной соды Na2CO3. В этом случае доза извести рассчитывается с учетом глубокого удаления ионов магния по уравнению (5.13), а доза соды Дс − по уравнению:
![]() (5.17)
(5.17)
или по уравнению
![]() ,
(5.18)
,
(5.18)
если целесообразно поддерживать остаточную жесткость обработанной воды на определенном уровне.
5.3 Кинетика кристаллизации солей жесткости при известковании воды
Практическое снижение щелочности при известковании, как правило, ниже расчетного, вследствие неполноты выкристаллизовывания образующихся труднорастворимых соединений. При этом процесс взаимодействия извести (или извести и соды) с содержащимися в обработанной воде углекислотными компонентами завершается в минимальный срок (ионные реакции), в то время как образование твердой фазы солей жесткости, а также последующее отделение этих частиц требует для своего завершения достаточно большого промежутка времени.
На практике известкование воды проводят в аппарате, который носит название осветлитель. В осветлителе совмещаются процессы образования твердой фазы и ее отделения (осветление) от воды в восходящем потоке воды. Принципиальная схема организации известкования в осветлителе представлена на рисунке 5.
В процессе образования осадка выпадающие частицы постепенно укрупняются, проходя стадию коллоидного состояния, сорбируя органические и другие примеси и приобретая при этом обычно одноименный по знаку заряд. Наличие заряда до определенного момента может задерживать дальнейший рост частиц и их агломерацию. В результате образуются очень мелкие частицы, отделение которых от воды возможно лишь при малых скоростях восходящего потока воды и одновременно при большой длительности ее пребывания в осветлителе. Поэтому для интенсификации процесса известкования применяют технологию «зародышевых» кристаллов. Эта технология заключается в том, что обрабатываемую воду и реагенты смешивают в присутствии ранее выделившегося осадка, вводя их раздельно в нижнюю коническую часть осветлителя.
В зависимости от химического состава выделяемых при известковании веществ, интенсивности первоначального перемешивания и скорости последующего обтекания частиц, образующийся осадок может быть хлопьевидным, аморфным или зернистым.
Хлопьевидный осадок может быть получен при выделении из известкуемой воды наряду с соединениями кальция также соединений магния в небольшом количестве и введении коагулянта. Такой осадок характеризуется губчатым строением частиц. Большим содержанием воды, относительно малой прочностью и гидравлической крупностью, высокими адгезионными и сорбционными свойствами.
Зернистый осадок получают при больших скоростях движения воды в аппарате. Он состоит почти целиком из СаСО3, поскольку более мелкие частицы Mg(OH)2 выносятся током воды из осветлителя. Основным преимуществом использования зернистого осадка является значительно меньшая расчетная длительность обработки воды. Однако способность к адгезии и сорбции у частиц зернистого осадка незначительна. Следовательно, результаты обработки по качеству известкованной воды будут хуже, чем при использовании хлопьевидного осадка.
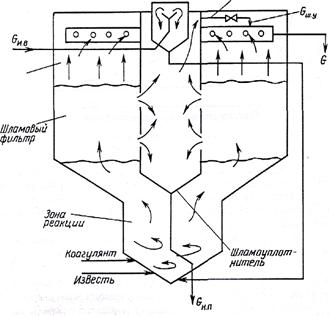
Рисунок 5 – Принципиальная схема организации известкования
в осветлителе
5.4 Практические результаты известкования воды
В эксплуатационных условиях результаты известкования обычно оцениваются по следующим показателям; остаточная щелочность, стабильность, содержание взвешенных веществ, окисляемость, жесткость, содержание железа, сухой остаток [5].
Остаточная щелочность обычно составляет примерно 0,5-0,8 мг-экв/кг, причем меньшие значения отвечают большей остаточной жесткости (3-5 мг-экв/кг) и меньшей минерализации исходной воды, а большие – соответственно меньшим значениям Ж0ост. С увеличением солесодержания в соответствии с ростом равновесных концентраций и снижением скорости кристаллизации остаточная щелочность может достигать 1,0-1,5 мг-экв/кг. Повышенные значения остаточной щелочности наблюдаются также и при известковании воды с высоким содержанием органических примесей.
Стабильность - одно из важнейших и обязательных требований к известкованной воде. Чем ближе вода, представляющая собой в процессе обработки пересыщенный раствор, к состоянию равновесия, тем она стабильнее и тем меньше ее склонность к образованию впоследствии отложений на трубопроводах и на зернах фильтрующего материала осветлительных фильтров. Степень отклонения от стабильности на практике характеризуют так называемой нестабильностью, т.е. возможным последующим снижением щелочности и жесткости известкованной воды. На практике нестабильность определяют по разности щелочности воды на выходе из осветлителя и щелочности фильтрата осветлительных фильтров, установленных после осветлителя.
Содержание взвешенных веществ при налаженном режиме работы осветлителя обычно составляет Свзв = 2-5 мг/кг при норме не более 10 мг/кг. Вследствие значительной трудоемкости процесса определения содержания взвешенных веществ этот показатель используют в качестве контрольного. Для оперативной оценки устойчивости работы осветлителя содержание взвешенных веществ заменяют на косвенный показатель – прозрачность. Прозрачность обычно определяют по кресту пли по шрифту. При устойчивой работе осветлителя (Сив < 5 мг/кг) прозрачность составляет не менее 30 см.
Окисляемость известкованной воды составляет 3-4 мг О/кг, если исходная вода содержит только природные примеси. При загрязнении исходной воды промышленными стоками степень удаления органических примесей колеблется в широких пределах и составляет обычно 30-50%, а окисляемость известкованной воды может достигать 7-10 мг/кг, Следует помнить об условности перманганатной окисляемости, которая в наибольшей мере сказывается при загрязнении воды органическими примесями техногенного происхождения.
Жесткость известкованной воды зависит от ее остаточной щелочности, дозы коагулянта и некарбонатной жесткости исходной воды
![]() .
.
Снижение содержания кремнекислых соединений при известковании зависит от количества выделяемой гидроокиси магния. Обычно остаточная концентрация SiO2 составляет 30-50% исходной, но, как правило, не меньше 2-5 мг/кг.
Остаточное содержание железа обычно определяется в основном кинетикой кристаллизации труднорастворимых гидроокисей Fe(OH)2 и Fe(OH)3 и присутствием в воде их коллоидно-дисперсных форм, включая органические комплексные соединения. Если концентрация Fе2+ в исходной воде значительна, доза извести должна быть увеличена на исходную концентрацию железа, выраженную в мг-экв/кг. Обычно остаточная концентрация железа в известкованной и коагулированной воде составляет 50-150 мкг/кг.
6 Умягчение воды
6.1 Теоретические основы умягчения воды, классификация методов
Под умягчением воды подразумевается процесс удаления из нее катионов жесткости, т.е. кальция и магния. В соответствии с ГОСТ 2874-82 «Вода питьевая» жесткость воды не должна превышать 7 мг-экв/л. Отдельные виды производств к технологической воде предъявляют требования глубокого ее умягчения, т.е. до 0,05...0,01 мг-экв/л. Обычно используемые водоисточники имеют жесткость, отвечающую нормам хозяйственно-питьевых вод, и в умягчении не нуждаются. Умягчение воды производят в основном при ее подготовке для технических целей. Так, жесткость воды для питания барабанных котлов не должна превышать 0,005 мг-экв/л. Умягчение воды осуществляют методами: термическим, основанным на нагревании воды, ее дистилляции или вымораживании; реагентными, при которых находящиеся в воде ионы Са (II) и Mg (II) связывают различными реагентами в практически нерастворимые соединения; ионного обмена, основанного на фильтровании умягчаемой воды через специальные материалы, обменивающие входящие в их состав ионы Na (I) или Н (I) на ионы Са (II) и Mg (II), содержащиеся в воде; диализа; комбинированным, представляющим собой различные сочетания перечисленных методов.
Выбор метода умягчения воды определяется ее качеством, необходимой глубиной умягчения и технико-экономическими соображениями. В соответствии с рекомендациями СНиПа при умягчении подземных вод следует применять ионообменные методы; при умягчении поверхностных вод, когда одновременно требуется и осветление воды, - известковый или известково-содовый метод, а при глубоком умягчении воды — последующее катионирование. Основные характеристики и условия применения методов умягчения воды приведены в таблице 6.
Для получения воды для хозяйственно-питьевых нужд обычно умягчают лишь ее некоторую часть с последующим смешением с исходной водой, при этом количество умягчаемой воды Qy определяют по формуле
![]() ,
,
где Жои – общая жесткость исходной воды, мг-экв/л; Жос – общая жесткость воды, поступающей в сеть, мг-экв/л; Жоу – жесткость умягченной воды, мг-экв/л.
Таблица 6 – Выбор метода умягчения воды
|
Показатель |
Методы умягчения воды |
|||
|
термический |
реагентный |
ионообменный |
Диализа |
|
|
Характер-истика процесса |
Воду нагревают до температуры выше 100°С, при этом удаляется карбонатная и некарбонатная жесткости (в виде карбоната кальция, гидрок-сида магния и гипса) |
В воду добавляют известь, устраняющую карбонатную и магниевую жесткость, а также соду, устраняющую некарбонатную жесткость |
Умягчаемая вода пропус-кается через катионитовые фильтры |
Исходная вода фильтруется через полупроницаемую мембрану |
|
Назначение метода |
Устранение кар-бонатной жест-кости из воды, употребляемой для питания кот-лов низкого и ср-еднего давления |
Неглубокое умягчение при одновремен-ном осветле-нии воды от взвешенных веществ |
Глубокое умяг-чение воды, содержащей незначительное количество взвешенных веществ |
Глубокое умягчение воды |
|
Расход воды на собствен-ные нужды |
— |
Не более 10% |
До 30% и бо-лее пропорцио-нально жесткос-ти исходной воды |
10 |
|
Условия эффективно-го примене-ния: мутно-сть исход-ной воды, мг/л |
До 50 |
До 500 |
Не более 8 |
До 2,0 |
|
Жесткость воды, мг-экв/л |
Карбонатная же-сткость с преоб-ладанием Са(НСО3)2, некарбонатная жесткость в виде гипса |
5...30 |
Не выше 15 |
До 10,0 |
|
Остаточная жесткость воды, мг-экв/л |
Карбонатная же-сткость до 0,035, CaSО4 до 0,70 |
До 0,70 |
0,03...0,05 при одноступенча-том и до 0,01 при двухступе-нчатом катион-ировании |
0,01 и ниже |
|
Температура воды, 0С |
До 270 |
До 90 |
До 30 (глауконит), до 60 (сульфоугли) |
До 60 |
6.2 Термический метод умягчения воды
Термический метод умягчения воды целесообразно применять при использовании карбонатных вод, идущих на питание котлов низкого давления, а также в сочетании с реагентными методами умягчения воды. Он основан на смещении углекислотного равновесия при ее нагревании в сторону образования карбоната кальция, что описывается реакцией
Са(НСО3)2 → CaCО3 + СО2↑ + Н2О.
Равновесие смещается за счет понижения растворимости оксида углерода (IV), вызываемого повышением температуры и давления. Кипячением можно полностью удалить оксид углерода (IV) и тем самым значительно снизить карбонатную кальциевую жесткость. Однако полностью устранить указанную жесткость не удается, поскольку карбонат кальция хотя и незначительно (13 мг/л при температуре 18°С), но все же растворим в воде.
При наличии в воде гидрокарбоната магния процесс его осаждения происходит следующим образом: вначале образуется сравнительно хорошо растворимый (110 мг/л при температуре 18°С) карбонат магния
Mg(HCО3) → MgCО3 + СО2↑ + Н2О,
который при продолжительном кипячении гидролизуется, в результате чего выпадает осадок малорастворимого (8,4 мг/л) гидроксида магния
MgCО3 + Н2О → Mg(OH)2 + CО2↑.
Следовательно, при кипячении воды жесткость, обусловливаемая гидрокарбонатами кальция и магния, снижается. При кипячении воды снижается также жесткость, определяемая сульфатом кальция, растворимость которого падает до 0,65 г/л.
На рисунке 6 показан термоумягчитель конструкции Копьева, отличающийся относительной простотой устройства и надежностью работы. Предварительно подогретая в аппарате обрабатываемая вода поступает через эжектор на розетку пленочного подогревателя и разбрызгивается над вертикально размещенными трубами, и по ним стекает вниз навстречу горячему пару. Затем совместно с продувочной водой от котлов она по центрально подающей трубе через дырчатое днище поступает в осветлитель со взвешенным осадком. Выделяющиеся при этом из воды углекислота и кислород вместе с избытком пара сбрасываются в атмосферу. Образующиеся в процессе нагревания воды соли кальция и магния задерживаются во взвешенном слое. Пройдя через взвешенный слой, умягченная вода поступает в сборник и отводится за пределы аппарата. Время пребывания воды в термоумягчителе составляет 30-45 мин, скорость ее восходящего движения во взвешенном слое 7-10 м/ч, а в отверстиях ложного дна 0,1-0,25 м/ч.
 |
1,10 - подача исходной и отвод умягченной воды; 2 - продувка котлов; 3 - эжектор; 4 - выпар; 5 - пленочный подогреватель; 6 - сброс пара; 7 - кольцевой перфорированный трубопровод отвода воды к эжектору; 8 - наклонные сепарирующие перегородки; 9 - сборник умягченной воды; 11 - взвешенный слой; 12 - центральная подающая труба; 13 - ложные перфорированные днища; 14 - сброс шлама; 15 - сброс дренажной воды.
Рисунок 6 – Термоумягчитель конструкции Копьева
6.3 Термическое обессоливание в испарителях кипящего слоя
Восполнение потерь пара и конденсата на многих ТЭС производится дистиллятом, получаемым в испарителях. Аппараты, в которых происходит процесс парообразования с концентрацией примесей, называются испарителями. Парообразование с концентрацией примесей может происходить в трубной системе (греющей секции) или в объеме при вскипании воды за счет снижения (мгновенного) давления.
В первом случае испарители называют поверхностного типа, во втором- мгновенного вскипания.
Этот метод подготовки добавочной воды паротурбинных установок называется термическим обессоливанием воды.
При термическом обессоливании из воды получают пар, который затем конденсируют. Таким образом, можно разделить растворитель (воду) и содержащиеся в ней примеси. Вещества, загрязняющие воду, остаются в объеме испаряемой воды и удаляются из испарителя с отводимой (продувочной) водой.
Дистиллят пригоден для использования в качестве добавочной воды для любых современных паровых котлов.
Испарители поверхностного типа достаточно широко распространены на тепловых электростанциях и применяются для получения добавочной воды цикла и отпуска промышленным потребителям.
В питательную воду испарителей мгновенного вскипания могут добавляться мелкодисперсные примеси природного мела или строительного гипса. Эти примеси играют роль затравки для осаждения примесей из воды при кипении ее в объеме.
При работе испарителя к нему непрерывно подводятся пар и вода, подлежащая обессоливанию. Чтобы исключить образование накипи на греющих поверхностях поступающую в испаритель, воду умягчают одним из следующих методов:
1) двухступенчатое Nа-катионирование с предварительным известкованием и коагуляцией;
2) Н-Nа- катионирование;
3) Cl-Nа-ионирование.
Умягчение морской воды такими методами не ведется, т.к. это потребовало бы огромного расхода реагентов.
Однако при использовании ионитов расходуются реагенты, которые затем сбрасываются в водоемы, солесодержание водоемов повышается. На электростанциях сбросы засоленных вод запрещены, поэтому при применении термического обессоливания эти воды необходимо выпаривать досуха, выделенные соли сбрасывать в специальные хранилища. Все это – дополнительные затраты.
В последние годы разработаны испарительные установки, работающие без предварительного ионирования воды.
Испарители, в которых процесс парообразования протекает в слоях воды, расположенных над греющей секцией испарителя, называются испарителями с вынесенной зоной кипения. В испарителях с вынесенной зоной кипения, образующийся пар конденсируется обычно либо в теплообменниках (как в случае с ионированной водой), либо в трубчатом пучке другого испарителя, работающего при более низком давлении. В таких испарителях накипь практически не образуется.
Пар, подаваемый в испаритель, называют первичным паром, а образовавшийся из поступающей в испаритель воды – вторичным.
Если вторичный пар конденсируется непосредственно в теплообменнике, испарительная установка является одноступенчатой. В многоступенчатой установке вторичный пар каждого испарителя (каждой ступени установки), за исключением последнего, конденсируется в греющей секции другого испарителя и только вторичный пар последнего испарителя – в конденсаторе, т.е. вторичный пар предыдущего испарителя является греющим для последующего.
Питание многоступенчатой испарительной установки может протекать параллельно (вода поступает из общей линии в каждый испаритель) и последовательно (вся питательная вода поступает в первую ступень установки).
При параллельном питании испарителей многоступенчатой установки продувка производится из каждой ступени, при последовательном – только из испарителя последней ступени. Продувка определяет степень упаривания исходной воды и выбирается такой, чтобы отложение накипи на поверхностях греющей секции не происходило.
Потери теплоты с продувкой при параллельном питании больше, чем при последовательном. Эти потери можно устранить, установив теплообменники, в которых вода будет охлаждаться, однако это усложняет установку.
Одноступенчатые испарительные установки применяются на электростанциях, на которых потери пара и конденсата не превышают 2-3%. Такие потери характерны для КЭС и ТЭЦ, имеющих лишь внутренние потери. Если на ТЭЦ есть внешние и общие потери, компенсировать эти потери одноступенчатыми установками невозможно. В таких случаях применяют многоступенчатые испарительные установки или подают пар тепловому потребителю не непосредственно от турбины, а от специальных аппаратов, называемых паропреобразователи. По конструкции паропреобразователи не отличаются от испарителей кипящего типа, в которых парообразование идет на поверхностях греющей секции.
В испарителях мгновенного вскипания пар образуется не при кипении, а при вскипании воды, предварительно подогретой до температуры, превышающей на несколько градусов температуру насыщения воды в камере, в которой происходит парообразование.
Качество полученного дистиллята определяется его общим солесодержанием, а также (для подпитки котлов высокого давления) количеством кремниевой кислоты, содержащейся в 1 кг дистиллята. Также нормируют концентрации железа, меди, кислорода и углекислоты в соответствии с Правилами технической эксплуатации электрических станций и сетей (ПТЭ) [6].
7 Ионный обмен
7.1 Умягчение воды катионированием
Сущность ионного обмена заключается в способности ионообменных материалов или ионитов поглощать из воды (раствора электролита) положительные или отрицательные ионы в обмен на эквивалентное количество ионов ионита. Процесс водообработки методом ионного обмена, в результате которого происходит обмен катионов, называют катионированием. Катиониты в воде разбухают, увеличиваясь в объеме. Отношение объемов одинаковых масс катионитов в набухшем и воздушно-сухом состоянии называют коэффициентом набухания. Он выражается отношением насыпных плотностей воздушно-сухого и набухшего ионитов [7].
Ионный состав и степень разбухания частиц ионообменной смолы являются результатом равновесия движущих сил в системе частица-вода. Наряду с небольшой долей энергии, освобождающейся вследствие гидратации функциональных групп, движущие силы возникают в основном из-за разности концентраций между внутренней набухшей частью зерна и окружающей его водой. Вода набухания в частице смолы с мобильными противоионами функциональных групп имеет концентрацию 1,5...6 г-экв/л. Следуя за перепадом концентрации, противоионы функциональных групп пытаются покинуть частицу смолы и протолкнуть в нее молекулы воды. Это влечет за собой смещение потенциала Доннана на граничной поверхности частицы. Миграция противоионов и набухание смолы прекращаются по достижении условий минимального запаса энергии. Внутри частицы аккумулируются те многоатомные противоионы с небольшим радиусом, которые вступают с функциональными группами в ассоциации с малым запасом энергии. Эта селективность, являющаяся основой процесса, понижается с увеличением концентрации среды и уменьшением степени «сшивания» ионообменника.
Энергия вхождения различных катионов в
катионит по величине их динамической активности может быть охарактеризована для
одинаковых условий следующим рядом:
Na+ <
NH![]() < К+ <
Mg2+ < Са2+ <
<
Al3+<
Fe3+, т.е. чем
больше заряд катионов, тем больше их энергия вхождения
в катионит. Для катионов одинаковой валентности энергия вхождения в катионит
зависит от их гидратации; что касается энергии вхождения иона водорода в
катионит, то она в 17 раз больше, чем у натрия, и в 4 раза больше, чем у
кальция.
< К+ <
Mg2+ < Са2+ <
<
Al3+<
Fe3+, т.е. чем
больше заряд катионов, тем больше их энергия вхождения
в катионит. Для катионов одинаковой валентности энергия вхождения в катионит
зависит от их гидратации; что касается энергии вхождения иона водорода в
катионит, то она в 17 раз больше, чем у натрия, и в 4 раза больше, чем у
кальция.
Основополагающим фактором кинетики процесса является скорость ионообмена между ионами воды и омываемой частицей смолы. Непосредственно на наружной поверхности омываемой частицы образуется неподвижная водяная пленка, толщина которой зависит от скорости потока умягчаемой воды и размеров зерна смолы. Ион Са2+ или Mg2+, который стремится попасть внутрь частицы смолы, в функциональную группу, должен диффундировать из воды через пленку, пройти через граничную поверхность частицы и внутри смолы в растворе набухания устремиться к ассоциации с функциональной группой.
У чистых смол, диффузионные пути которых не загрязнены и не заблокированы, диффузия ионов через пленку является важнейшим этапом процесса. С увеличением скорости потока уменьшается толщина водяной пленки, что облегчает прохождение через нее ионов. Повышение температуры умягчаемой воды влечет уменьшение ее вязкости, что способствует увеличению скорости диффузии и улучшению кинетики ионообмена. Другим важным фактором является отношение объема частицы к ее поверхности. С уменьшением диаметра частицы на каждую функциональную группу приходится большая поверхность обмена.
Скорость обмена катионов зависит от их диффузии к поверхности раздела катионит — вода и определяется структурой катионита. При компактной структуре катионита обмен происходит быстро и в основном на наружных поверхностях – экстрамицеллярный обмен. Однако при этом не полностью используется сорбционная емкость катионита. При пористой структуре катионита, когда размеры капиллярных каналов больше диаметра гидратированных ионов, обмен происходит на внутренних поверхностях – интермицеллярный обмен. Скорость его меньше, а обменная способность катионита больше. Скорости реакции обмена ионов в катионитах и достижения полного равновесия весьма велики. По данным В.А. Клячко, даже в пористых катионитах реакция обмена Са2+, Mg2+, Na+ на ионы водорода достигает 90...98% в течение долей минуты, а равновесие устанавливается за 5...6 мин. Поэтому допустимы большие скорости фильтрования умягчаемой воды через катиониты.
Каждый катионит обладает определенной обменной емкостью (способностью), выражающейся количеством катионов, которые катионит может обменять в течение фильтроцикла. Обменную емкость катионита измеряют в грамм-эквивалентах задержанных катионов на 1 м3 катионита, находящегося в набухшем (рабочем) состоянии после пребывания в воде, т.е. в таком состоянии, в котором катионит находится в фильтре. Различают полную и рабочую обменную емкость катионита. Полной обменной емкостью называют то количество катионов кальция и магния, которое может задержать 1 м3 катионита, находящегося в рабочем состоянии, до того момента, когда жесткость фильтрата сравнивается с жесткостью исходной воды. Рабочей обменной емкостью катионита называют то количество катионов Са2+ и Mg2+, которое задерживает 1 м3 катионита до момента «проскока» в фильтрат катионов солей жесткости.
Обменную емкость, отнесенную ко всему объему катионита, загруженного в фильтр, называют емкостью поглощения.
При пропуске воды сверху вниз через слой катионита происходит ее умягчение, заканчивающееся на некоторой глубине.
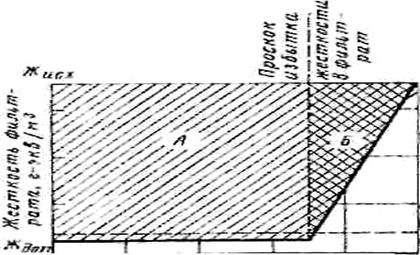
Количество умягченной воды, м3/м3 катионита
Рисунок 7 – Кинетика работы катионитного фильтра, А и А+Б - рабочая и полная способность катионита
Слой катионита, умягчающий воду, называют работающим слоем, или зоной умягчения. При дальнейшем фильтровании воды верхние слои катионита истощаются и теряют обменную способность. В ионный обмен вступают нижние слои катионита, и зона умягчения постепенно опускается. Через некоторое время наблюдаются три зоны: работающего, истощенного и свежего катионита. Жесткость фильтрата будет постоянной до момента совмещения нижней границы зоны умягчения с нижним слоем катионита. В момент совмещения начинается «проскок» катионов Са2+ и Mg2+ и увеличение остаточной жесткости, пока она не станет равной жесткости исходной воды, что свидетельствует о полном истощении катионита. Пренебрегая жесткостью умягченной воды, рабочую обменную емкость катионита в г-экв/м3, можно определить по следующей формуле
![]() ,
,
где Жи – жесткость исходной воды, г-экв/м3; Q – количество умягченной воды, м3; а–площадь катионитового фильтра, м2; hк –высота слоя катионита, м.
Обозначив скорость фильтрования воды в катионитовом фильтре Vк, количество умягченной воды можно найти по формуле
![]()
откуда длительность работы катионитового фильтра (межрегенерационный период) находим по формуле
![]() .
.
По исчерпании рабочей обменной способности катионита его подвергают регенерации, т.е. восстановлению обменной емкости истощенного ионообменника путем пропуска раствора кислоты или поваренной соли.
7.2 Катиониты и их свойства
Катиониты по составу разделяют на минеральные и органические, которые, в свою очередь, делят на естественного и искусственного происхождения (см. таблицу 7).
Таблица 7 – Классификация катионитов
|
Катиониты |
|||
|
минеральные |
Органические |
||
|
естественные |
искусственные |
естественные |
Искусственные |
|
Глауконит Волконсконит Алюмосиликаты натрия, калия, кальция, магния, железа, хрома |
Алюмосиликаты |
Гумусовые и бурые угли, торф |
Сульфоуголь, КУ-1; KY-2; IR-100; IR-120; КБ-4; 1IRS-50; Зеролит 216 и Зеролит 225, Вофатит, Амберлайт и др. |
Минеральные катиониты естественного происхождения характеризуются малой обменной способностью и недостаточной химической стойкостью, что привело к замене их искусственными катионитами. Минеральные катиониты искусственного происхождения приготовляют смешением раствора сульфата алюминия с растворами соды и жидкого стекла.
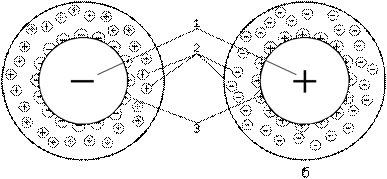 Зерно
ионита
Зерно
ионита
a - кaтиoнит; б - aниoнит; 1 - твеpдый мнoгoaтoмный кapкaс иoнитa;
2 - связaнные с кapкaсoм непoдвижные иoны aктивных гpупп; 3 - oгpaниченнo пoдвижные иoны aктивных гpупп, спoсoбные к oбмену.
Рисунок 8 – Схема структуры зерен ионита
Синтетические иониты на органической основе – высокомолекулярные соединения, молекулы которых содержат ионогенные группы, способные к диссоциации и обмену подвижных ионов на другие ионы, содержащиеся в растворе.
Макромолекула такого ионита состоит из гибких полимерных углеводородных цепей, скрепленных (сшитых) поперечными связями – углеводородными мостиками. Макромолекула представляет собою трехмерную сетку, в отдельных узлах которой зафиксированы заряженные функциональные группы с нейтрализующими их ионами с зарядами противоположного знака – противоионами.
В технологии подготовки воды широко
применяют органические катиониты искусственного происхождения. Они содержат
функциональные химически активные группы, водород которых способен замещаться
другими катионами: четвертичные амины NH3OH,
сульфогруппу HSО![]() , одновалентную фенольную
группу ОН-, фосфорную группу НРО
, одновалентную фенольную
группу ОН-, фосфорную группу НРО![]() карбоксильную группу СООН. Группа
HSО
карбоксильную группу СООН. Группа
HSО![]() обладает
сильнокислотными, а группы СООН и ОН слабокислотными свойствами. В зависимости
от содержащейся функциональной группы катиониты делят на сильнокислотные и
слабокислотные. Сильнокислотные катиониты обменивают катионы в щелочной,
нейтральной и кислой средах, слабокислотные – только в щелочной среде.
обладает
сильнокислотными, а группы СООН и ОН слабокислотными свойствами. В зависимости
от содержащейся функциональной группы катиониты делят на сильнокислотные и
слабокислотные. Сильнокислотные катиониты обменивают катионы в щелочной,
нейтральной и кислой средах, слабокислотные – только в щелочной среде.
Катионит может содержать несколько функциональных групп. Катиониты с однотипными функциональными группами называют монофункциональными, а имеющие несколько функциональных групп – полифункциональными. Если подвижные ионы функциональных групп имеют положительные заряды, ионит обладает катионообменными, а если отрицательные – анионообменными свойствами.
Ионообменные смолы подразделяют на гетеропористые, макропористые и изопористые. Гетеропористые смолы на дивинил-бензоловой основе характеризуются гетерогенным характером гелевидной структуры и небольшими размерами пор. Макропористые имеют губчатую структуру и поры свыше молекулярного размера. Изопористые имеют однородную структуру и полностью состоят из смолы, поэтому их обменная способность выше, чем у предыдущих смол.
Качество катионитов характеризуется их физическими свойствами, химической и термической стойкостью, рабочей обменной емкостью и др. Физические свойства катионитов зависят от их фракционного состава, механической прочности и насыпной плотности (набухаемости). Фракционный (или зерновой) состав характеризует эксплуатационные свойства катионитов. Он определяется ситовым анализом. При этом учитываются средний размер зерен, степень однородности и количество пылевидных частиц, непригодных к использованию.
Мелкозернистый катионит, обладая более развитой поверхностью, имеет несколько большую обменную емкость, чем крупнозернистый. Однако с уменьшением зерен катионита гидравлическое сопротивление и расход электроэнергии на фильтрование воды увеличиваются. Оптимальные размеры зерен катионита, исходя из этих соображений, принимают в пределах 0,3...1,5 мм. Рекомендуется применять катиониты (для удобства эксплуатации) с коэффициентом неоднородности Кн = 2.
Механическая прочность, термическая и химическая стойкость имеют важное значение для установления износа катионитов в процессе эксплуатации и выбора марки катионита. Неправильный выбор катионита может привести к измельчению его при фильтровании и взрыхлении. Кроме того, при высокой температуре обрабатываемой воды и повышенных значениях кислотности или щелочности катиониты способны пептизироваться, т.е. переходить в состояние коллоидного раствора и терять обменную способность.
Рабочая обменная емкость катионита зависит от вида извлекаемых из воды катионов, соотношения солей в умягчаемой воде, значения рН, высоты слоя катионита, скорости фильтрования, режима эксплуатации катионитовых фильтров, удельного расхода регенерирующего реагента и от других факторов.
Таблица 8 – Технологические характеристики катионитов
|
Марка катионита |
Активная группа |
Насыпная масса продукта, т/м3 |
Размер зерен |
Полная обменная емкость, г-экв/м3 |
|
|
товарного |
набухшего |
||||
|
Сульфоуголь крупный) КУ-1 КУ-2-8 КУ-2 КУ-2-8чС КБ-4-П2 Амберлайт-50 Зеролит 225 |
HSО3 то же то же то же то же СООН то же то же |
0,67...0,70 0,60...0,75
0,73 0,7...0,9 0,68...0,82 0,50 0,64 |
0,42- 0,33 0,65-0,33 0,17-0,33 0,42 0,56 0,65-0,33 0,17...0,33 0,42- 0,56 |
0,5-1,2 0,3-2,0 0,35-1,25 0,3-1,5 0,4-1,5 0,25-1,0 0,3-1,0 0,3-1,0 |
500 650 1700 1700 1700 2800 2800 2000 |
7.3 Умягчение воды натрий-катионированием
Натрий-катионитовый метод применяют для умягчения воды с содержанием взвеси не более 8 мг/л и цветностью не более 30 град. Жесткость воды снижается при одноступенчатом натрий-катионировании до 0,05...0,1, при двухступенчатом – до 0,01 мг-экв/л. Процесс Na-катионирования описывается следующими реакциями обмена:
2R/Na+ + Ca2+ → R2/Ca2+ + 2Na+;
2R/Na+ + Mg2+ → R2/Mg2+ + 2Na+,
где [R] – нерастворимая матрица полимера [4].
После истощения рабочей обменной емкости катионита он теряет способность умягчать воду и его необходимо регенерировать. Процесс умягчения воды на катионитовых фильтрах слагается из следующих последовательных операций: фильтрование воды через слой катионита до момента достижения предельно допускаемой жесткости в фильтрате (скорость фильтрования в пределах 10...25 м/ч); взрыхление слоя катионита восходящим потоком умягченной воды, отработанного регенерата или отмывных вод (интенсивность потока 3...4 л/(с-м); спуска водяной подушки во избежание разбавления регенерирующего раствора; регенерации катионита посредством фильтрования соответствующего раствора (скорость фильтрования 3...5 м/ч); отмывки катионита неумягченной водой (скорость фильтрования 8...10 м/ч). На регенерацию обычно затрачивают около 2 ч, из них на взрыхление – 10...15, на фильтрование регенерирующего раствора – 25...40, на отмывку – 30...60 мин. Выбор метода катионирования диктуется требованиями, предъявляемыми к умягченной воде, свойствами исходной воды и технико-экономическими соображениями. Наиболее простой является схема одноступенчатой Na-катионитовой установки (см. рисунок 9). Вода, пройдя Na-катионитовые фильтры, отводится в сборный бак, откуда насосом подается потребителю. При работе по этой схеме отсутствуют вода и растворы с кислой реакцией, отпадает необходимость в применении кислотостойкой арматуры труб и защитных покрытий фильтров.
 |
1,7 - подача исходной и отвод умягченной воды; 2 - натрий-катионитовый фильтр; 3 - бак с раствором поваренной соли; 4 - бак с частично умягченной водой для взрыхления катионита; 5 - резервуар умягченной воды; 6 - насос.
Рисунок 9 – Схема одноступенчатого натрий-катионирования воды
Регенерация Na-катионита достигается фильтрованием через него со скоростью 3...4 м/ч хлористого натрия концентрацией 5...8%. При жесткости умягченной воды до 0,2 мг-экв/л принимают концентрацию соли 5%, при жесткости менее 0,05 мг-экв/л предусматривают ступенчатую регенерацию: сначала 5%-ным раствором NaCl в количестве 1,2 м3 раствора на 1 м3 катионита, затем остальным количеством соли в виде 8%-ного раствора.
Процесс регенерации описывается следующими реакциями:
R2/Ca2+ + 2Na+ → 2R/Na+ + Ca2+,
R2/Mg2+ + 2Na+ → 2R/Na+ + Mg2+.
Поваренную соль применяют для регенерации из-за ее доступности, дешевизны, а также вследствие того, что получают при этом хорошо растворимые соли СаСl2 и MgCl2, легко удаляемые с регенерационным раствором и отмывочной водой.
Расход соли р на одну регенерацию Na-катионитового фильтра первой ступени находят из выражения
![]() ,
,
где а –
площадь фильтра, м2;
hк – высота слоя катионита в фильтре,
м;
![]() − рабочая
обменная емкость катионита при Na-катионировании; α – удельный расход соли
на 1 г-экв рабочей обменной емкости
катионита (для фильтров
I ступени в двухступенчатой схеме 120…150, а в одноступенчатой α=150…200
г/г-экв, удельный расход соли на фильтрах
II ступени 300…400 г/г-экв).
− рабочая
обменная емкость катионита при Na-катионировании; α – удельный расход соли
на 1 г-экв рабочей обменной емкости
катионита (для фильтров
I ступени в двухступенчатой схеме 120…150, а в одноступенчатой α=150…200
г/г-экв, удельный расход соли на фильтрах
II ступени 300…400 г/г-экв).
При фильтровании раствора поваренной соли сверху вниз при регенерации полный обмен ионов натрия на содержащиеся в катионите Са2+ и Mg2+ происходит в верхних слоях ионообменника, при этом в фильтре возрастает концентрация вытесненных из катионита Са2+ и Mg2+ и снижается концентрация ионов натрия. Возрастание концентрации противоионов (в рассматриваемом случае Са (II) и Mg (II)) в регенерационном растворе подавляет диссоциацию истощенного катионита и ослабляет процесс ионного обмена. Образующийся при этом противоионный эффект тормозит регенерацию, в результате чего по мере продвижения регенерационного раствора в нижние слои катионита их регенерация происходит неполно, и некоторое количество катионов Са (II) и Mg (II) остается невытесненным из нижних слоев катионита. Устранение этого недостатка возможно пропуском через катионит свежих порций раствора реагента. Однако это увеличивает удельный расход поваренной соли и повышает стоимость обработки воды. На практике ограничиваются однократным пропуском соли при жесткости умягченной воды до 0,20 мг-экв/л или двукратным - при жесткости ниже 0,05 мг-экв/л. По аналогии, при фильтровании умягчаемой воды сверху вниз также возникает противоионный эффект, снижающий глубину умягчения воды, при этом противоионами являются катионы натрия. Этот недостаток устраняется путем подачи регенерационного раствора и умягчаемой воды в разных направлениях, последняя, фильтруясь снизу вверх при выходе из фильтра, соприкасается с наиболее полно отрегенерированными слоями катионита, благодаря чему обеспечивается более глубокое умягчение воды. Такой метод умягчения воды называется методом противоточного катионирования. При этом значительно снижается расход реагентов на регенерацию катионита без уменьшения глубины умягчения. На рисунке 10 показан фильтр противоточного катионирования.
Схема одноступенчатого Na-катионирования имеет недостатки, лимитирующие ее применение: невозможность глубокого умягчения воды (до 0,01…0,02 мг-экв/л); высокий удельный расход соли на регенерацию; неполное использование емкости поглощения катионита.
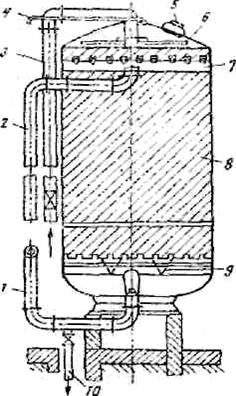 |
1,2 - ввод исходной и отвод умягченной воды; 3,10 - подача регенерационного раствора и сброс отмывочной воды; 4 - воздушник; 5 - люк;
6 - реагентораспределитель; 7,9 - дренажная и распределительная система;
8 - слой катионита.
Рисунок 10 – Фильтр катионитовый противоточный
Более глубокого умягчения воды, экономии соли и увеличения фильтроцикла достигают двухступенчатым Na-катионированием (см. рисунок 10). В этом случае в фильтрах I ступени вода подвергается умягчению до остаточной жесткости 0,1…0,20 мг-экв/л при обычной скорости фильтрования 15…25 м/ч. Затем умягченная вода передается на натрий-катионитовые фильтры II ступени, где жесткость предварительно умягченной воды снижается до 0,02...0,01 мг-экв/л. Так как количество солей жесткости, поступающих на фильтры II ступени, незначительно, скорость фильтрования принимают до 40 м/ч, а высоту слоя катионита 1,5 м. Фильтры II ступени создают своего рода барьер, препятствующий проскоку удаляемых катионов при случайных отклонениях в работе фильтров первой ступени, поэтому натрий-катионитовые фильтры второй ступени называют барьерными. При их наличии упрощается эксплуатация установки, поскольку катионитовые фильтры первой ступени отключаются на регенерацию не по проскоку катионов солей жесткости, требующему тщательного контроля жесткости фильтрата, а по количеству воды, прошедшей через них. Некоторое повышение количества солей жесткости после фильтров первой ступени неопасно, так как они будут задержаны барьерными фильтрами. Емкость поглощения на фильтрах и сроки их полезной работы при двухступенчатом катионировании увеличиваются. Так как фильтры второй ступени несут небольшую нагрузку по умягчению воды, продолжительность межрегенерационной их работы достигает 200 ч.
 |
1,9 - подача исходной и отвод умягченной воды; 2,6 - натрий-катионитовые фильтры I и II ступени; 3,5 - баки с раствором соли для регенерации фильтров I и II ступени; 4 - бак с водой для взрыхления загрузки фильтров; 7 - резервуар умягченной воды; 8 - насос.
Рисунок 11 – Схема двухступенчатого натрий-катионитового умягчения воды
Катионит после регенерации фильтров первой ступени отмывают неумягченной водой до тех пор, пока содержание хлоридов в фильтрате не станет примерно равным содержанию их в отмывочной воде. Половину отмывочной воды направляют в водостоки, а вторую половину в баки для использования при взрыхлении катионита или для приготовления регенерационного раствора. Удельный расход воды на отмывку принимают равным 4…5 м3/м3 катионита. Катионит в фильтрах второй ступени отмывают фильтратом первой ступени. Удельный расход соли принимают 300…400 г/г-экв задержанных катионов жесткости.
Объем катионита, м3, в фильтрах первой ступени
![]() ,
,
где
Q
– расход умягченной воды, м3/ч;
Жи − общая жесткость исходной воды, г-экв/м3;
![]() − рабочая обменная емкость катионита при натрий-катионировании, г-экв/м3; п
= 1…3 – число регенераций каждого фильтра в сутки.
− рабочая обменная емкость катионита при натрий-катионировании, г-экв/м3; п
= 1…3 – число регенераций каждого фильтра в сутки.
Рабочая обменная емкость катионита при натрий-катионировании
![]() ,
,
где ![]() −
коэффициент эффективности регенерации (зависит от
удельного расхода соли на регенерацию);
−
коэффициент эффективности регенерации (зависит от
удельного расхода соли на регенерацию); ![]() − коэффициент,
учитывающий снижение обменной емкости катионита по катионам Са и Мg
вследствие частичного задержания катионов
Na+; Еn – полная обменная емкость катионита по паспортным
данным;
qу = 4…6 –
удельный расход воды на отмывку катионита, м3/м3.
− коэффициент,
учитывающий снижение обменной емкости катионита по катионам Са и Мg
вследствие частичного задержания катионов
Na+; Еn – полная обменная емкость катионита по паспортным
данным;
qу = 4…6 –
удельный расход воды на отмывку катионита, м3/м3.
7.4 Водород-натрий-катионитовое умягчение воды
Обработка воды водород-катионированием (Н-катионированием) основана па фильтровании ее через слой катионита, содержащего в качестве обменных ионов катионы водорода. Процесс описывается следующими реакциями:
2R/H+ + Ca2+ → R2/Ca2+ + 2H+;
2R/H+ + Mg2+ → R2/Mg2+ + 2H+;
R/H+ + Na+ → R/Na+ + H+.
При Н-катионировании воды (см. таблицу 9) значительно снижается ее рН из-за кислот, образующихся в фильтрате. Выделяющийся при Н-катионировании оксид углерода (IV) можно удалить дегазацией, и в растворе останутся минеральные кислоты в количествах, эквивалентных содержанию сульфатов и хлоридов в исходной воде.
Из приведенных выше реакций для натрий-катионитового умягчения воды видно, что щелочность воды в процессе ионного обмена не изменяется. Следовательно, пропорционально смешивая кислый фильтрат после Н-катионитовых фильтров со щелочным фильтратом после Na-катионитовых фильтров, можно получить умягченную воду с различной щелочностью. В этом заключается сущность и преимущество H-Na-катионитового метода умягчения воды. Применяют параллельное, последовательное и смешанное (совместное) H-Na-катионирование.
Таблица 9 – Н-катионирование в различных схемах обработки воды
|
Технологическая схема обработки воды |
Показатель отключения Н-катионито-вого фильтра на регенера-цию |
Результат обработки воды |
Рекомендации к применению |
|
Н-катионирование с «голодной» регенера-цией фильтров и пос-ледующим фильтро-ванием через буфер-ные саморегенериру-ющиеся фильтры |
Повышение щелочности фильтрата |
Щ0<0,7-1,5 мг-экв/л; Ж0=ЖН + (0,7-1,5)мг-экв/л; снижение солесодержания |
Рисунок 11 |
|
Последовательное H-Na-катионирование с «голодной» регенера-цией Н-катионито-вых фильтров |
То же |
Щ0<0,7 мг-экв/л; Ж0=0,01мг- экв/л; снижение солесодержания |
Схема используется при подготовке доб-авки к питательной воде паровых котлов, испарителей и т.п. |
|
Параллельное H-Na-катионирование |
Повышение общей жесткости фильтрата |
Ж0=0,1 мг-экв/л; Щ0=0,4 мг-экв/л; снижение соле-содержания. При наличии Na-катионитового фильтра второй ступени Ж0=0,01 мг-экв/л |
Применяется, когда по составу
исходной воды невозможно осуществить схему с «голодной»
регенера-цией. Пригодна для обработки
мало- и среднеминерализов-анных вод при содержании (Cl- +
SО |
|
Частичное химичес-кое обессоливание |
«Проскок» жесткости |
0,1мг-экв/л; сни-жение щелочно-сти; снижение солесодержания |
Рисунок 11, а. Схема используется, когда не требуется удалять из воды ионы натрия |
|
Частичное химичес-кое обессоливание |
Снижение кислотности фильтрата |
Снижение солее-содержания, уд-аление углекис-лоты; удаление части Na+ в соот-ветствии с необ-ходимым снижением солесодержания |
Рисунок 11, б, в |
|
Полное химическое обессоливание |
«Проскок» ионов натрия |
Полное удаление катионов, анион-ов кремниевой кислоты |
В котельных низкого и среднего давления не применяется |
При параллельном H-Na-катионировании (см. рисунок 12, а) одна часть воды пропускается через Na-катионитовые фильтры, другая — через Н-катионитовые фильтры, а затем оба потока смешивают. Образующиеся щелочные и кислые воды смешивают в такой пропорции, чтобы их остаточная щелочность не превышала 0,4 мг-экв/л. Для получения устойчивого и глубокого умягчения (до 0,01 мг-экв/л) воду после дегазатора пропускают через барьерный натрий-катионитовый фильтр.
Схему параллельного H-Na-катионирования целесообразно применять в тех случаях, когда суммарная концентрация сульфатов и хлоридов в умягчаемой воде не превышает 4 мг-экв/л и содержание натрия не более 2 мг-экв/л.
При последовательном H-Na-катионировании (см. рисунок 12, б) часть воды пропускают через Н-катионитовые фильтры, затем смешивают с остальной водой, полученную смесь пропускают через дегазатор для удаления оксида углерода (IV), а затем всю воду подают на натрий-катионитовые фильтры. Количество воды, подаваемое на Н-катионирование, определяют как и при параллельном H-Na-катионировании. Подобная схема позволяет более полно использовать обменную емкость Н-катионита и снизить расход кислоты на его регенерацию, поскольку отключение Н-катионитовых фильтров в данном случае диктуется не проскоком катионов жесткости порядка 0,5 мг-экв/л, а допускаемым их содержанием -1,0 мг-экв/л. При повышенных требованиях к умягчению воды схема дополняется барьерными натрий-катионитовыми фильтрами. К недостатку схемы следует отнести большой расход электроэнергии, затрачиваемой на передачу воды через последовательно включенные фильтры. Схему последовательного H-Na-катионирования применяют при умягчении воды с повышенными жесткостью и содержанием солей; остаточная щелочность при этом составляет примерно 0,7 мг-экв/л.
Известна схема последовательного H-Na-катионирования воды при «голодном» режиме регенерации Н-катионитовых фильтров.
При обычном Н-катионировании регенерация проводится с удельным расходом кислоты, в 2-2,5 раза больше теоретически необходимого, который отвечает процессу эквивалентного обмена катионов между раствором и катионитом. Избыток кислоты, не участвующий в реакциях обмена ионов, сбрасывается из фильтра вместе с продуктами регенерации. При «голодной» регенерации Н-катионитового фильтра удельный расход кислоты равен его теоретическому удельному расходу, т.е. 1 г-экв/г-экв, или в пересчете на граммы для H2SО4 – 49 г/г-экв. Все ионы водорода регенерационного раствора при этом полностью задерживаются катионитом, вследствие чего сбрасываемый регенерационный раствор и отмывочные воды не содержат кислоты. В отличие от обычных Н-катионитных фильтров, в которых весь слой катионита при регенерации переводится в Н-форму, при «голодном» режиме регенерируются, т.е. переводятся в Н-форму, только верхние слои, а нижние слои остаются в солевых формах и содержат катионы Са (II), Mg (II) и Na (I).
В верхних слоях катионита, отрегенерированного «голодной» нормой кислоты, при работе фильтра имеют место все реакции ионного обмена, приведенные выше.
В нижележащих, неотрегенерированных слоях катионита ионы водорода образовавшихся минеральных кислот обмениваются на ионы Са (II), Mg (II) HNa (I) по уравнениям:
R2/Ca2+ + 2Н+ → 2R/Н+ + Ca2+,
R2/Mg2+ + 2Н+→ 2R/Н+ + Mg2+,
R/Na+ + H+ → R/H+ + Na+,
т.е. происходит нейтрализация кислотности воды и при этом восстанавливается ее некарбонатная жесткость, а зона слоя, содержащего ионы Н+, смещается постепенно книзу.
Так как содержащаяся в воде угольная кислота является слабой, в реакциях ионного обмена она может участвовать лишь после удаления сильных кислот. В самых нижних слоях фильтра этот процесс завершиться до полного восстановления карбонатной жесткости не успевает. Поэтому фильтрат имеет малую карбонатную жесткость (численно она равна щелочности) и содержит много углекислоты. К моменту окончания рабочего цикла фильтра ионы водорода, введенные в катионит при регенерации, полностью удаляются из катионита в виде Н2СО3, которая находится в равновесии с дегидратированной формой СО2.
Технология Н-катионирования с «голодной» регенерацией обеспечивает получение фильтрата с минимальной щелочностью (исключение сброса кислых стоков при регенерации и кислого фильтрата в рабочем цикле). Она рекомендуется для обработки природных вод определенного состава и при использовании катионита средне- или слабокислотного типа при условии правильного осуществления режима регенерации.
 |
1,11 - подача исходной и отвод умягченной воды; 2 - солерастворитель;
3 - группа натрий-катионитовых фильтров; 4 - бак для взрыхления;
5 - дегазатор; 6 - резервуар умягченной воды; 7 - вентилятор; 8 - группа водород-катионитовых фильтров; 9 - бак для хранения раствора кислоты;
10 - насос; 12 - водород-натрий-катионитовый фильтр; 13 - буферный натрий-катионитовый фильтр.
Рисунок 12 – Схемы параллельного (а), последовательного (б) и совместного (в) водород-натрий-катионитового умягчения воды
При непостоянстве качества исходной воды, неточном соблюдении рекомендаций по применению рассматриваемой технологии Н-катионирования во избежание колебаний щелочности и проскоков кислого фильтрата после Н-катионитовых фильтров с «голодной» регенерацией в схеме ВПУ устанавливаются буферные нерегенерирующиеся фильтры с высотой слоя катионита 2 м и скоростью фильтрования до 40 м/ч. К буферным фильтрам не допускается подвод регенерационного раствора кислоты; взрыхляющая промывка осуществляется осветленной исходной водой.
Разработанная
Н.П.Субботиной технология Н-катионирования с «голодной» регенерацией предназначена для обработки природных вод
гидрокарбонатного класса. В гидрохимии к водам этого класса принято относить воды, в которых из числа главных
анионов (SО![]() ,
Cl-,
НСO
,
Cl-,
НСO![]() )
наибольшую концентрацию, выраженную в мг-экв/л, имеет ион НСO
)
наибольшую концентрацию, выраженную в мг-экв/л, имеет ион НСO![]() . Воды около 80% рек принадлежат
к гидрокарбонатному классу.
. Воды около 80% рек принадлежат
к гидрокарбонатному классу.
В процессе Н-катионирования с «голодной» регенерацией происходит частичное умягчение воды и существенное снижение ее щелочности; в результате удаления карбонатной жесткости достигается уменьшение общего солесодержания воды; концентрация углекислоты увеличивается на величину снижения щелочности. На эффект очистки воды влияет присутствие в исходной воде ионов натрия. Когда концентрация натрия невелика, общая жесткость фильтрата по величине близка к некарбонатной жесткости исходной воды и незначительно изменяется на протяжении рабочего цикла фильтра, так же как и общая щелочность фильтрата, которая составляет 0,3-0,5 мг-экв/л. Когда в исходной воде много натрия, щелочность фильтрата от начала рабочего цикла снижается, затем возрастает и в среднем за цикл составляет 0,7-0,8 мг-экв/л; в начале и конце рабочего цикла получается глубокоумягченный фильтрат, появление некарбонатной жесткости наблюдается в средней части фильтроцикла.
Если для ионного состава исходной воды ввести обозначения для соотношения концентраций катионов (К) и анионов (А) в виде выражений:
![]() ,
,
![]() ,
,
где [Na+], [Са2+], [Mg2+] – концентрации в воде соответственно ионов натрия,
кальция и магния, мг-экв/л; [HCO![]() ],
[Сl-], [SО
],
[Сl-], [SО![]() ] – концентрации в воде соответственно бикарбонатов,
хлоридов и сульфатов, мг-экв/л; Жо – общая жесткость исходной
воды, мг-экв/л; то условия применения Н-катионирования с «голодной»
регенерацией фильтров определяются данными, приведенными в таблице 10.
] – концентрации в воде соответственно бикарбонатов,
хлоридов и сульфатов, мг-экв/л; Жо – общая жесткость исходной
воды, мг-экв/л; то условия применения Н-катионирования с «голодной»
регенерацией фильтров определяются данными, приведенными в таблице 10.
Таблица 10 – Область применения Н-катионирования с «голодной» регенерацией
|
Исходная вода гидрокарбона-тного класса |
Раб. обменная емкость кати-онита сульфо-угля (КБ-4), г-экв/м3 |
Удельный расход серной кислоты на регенерацию, г/г-экв |
Щелочность обработанной воды, мг-экв/л |
Примечание |
|
|
Слабо- и среднеминера-лизованная, 0 < К < 1; 1 > А > 0,5 |
300 (600) |
49 |
0,3-0,5 |
В течение фильтр-оцикла щелочность фильтрата изменя-ется незначительно |
|
|
Средне- и высокоминера-лизованная, К > 1; 1 < А < 10 |
250 (500) |
49 |
0,7-1,5 |
Средняя щелоч-ность за фильтро-цикл не менее 0,7-0,8 мг-экв/л, жесткость появляется в средней части фильтроцикла, а затем быстро снижается |
|
В случае Н-катионирования с «голодной» регенерацией весь поток умягчаемой воды последовательно проходит через Н-катионитовые фильтры, регенерируемые стехиометрическим количеством кислоты, затем через дегазатор для удаления оксида углерода (IV) и далее через одну или две ступени натрий-катионитовых фильтров. Стехиометрический расчет режима регенерации Н-катионита позволяет устранить из воды лишь карбонатную жесткость, некарбонатная жесткость удаляется при Na-катионировании. По этой схеме отсутствуют кислые стоки и можно получить глубоко умягченную воду с остаточной щелочностью Що < 0,7 мг-экв/л. Эту схему используют для умягчения вод, содержащих до 3 г/л солей при различной концентрации натрия, но карбонатная жесткость должна быть не менее 1 мг-экв/л.
Совместное H-Na-катионирование (см. рисунок 12, в) осуществляют в одном фильтре, верхним слоем загрузки которого является Н-катионит, а нижним – натрий-катионит. Катионит регенерируют следующим образом. После взрыхления слоя его обрабатывают сначала раствором кислоты, затем раствором поваренной соли с последующей отмывкой. При совместном H-Na-катионировании остаточная щелочность воды составляет 1,5...2,0 мг-экв/л, а жесткость 0,1...0,3 мг-экв/л. Жесткость исходной воды должна составлять не более 6 мг-экв/л, содержание натрия до 1...1,5 мг-экв/л, отношение карбонатной жесткости к некарбонатной должно быть больше единицы. Достоинством данной схемы является отсутствие кислых стоков, недостатком - сложность регенерации.
Расход воды
q![]() подаваемой на натрий-катионитовые фильтры,
и
q
подаваемой на натрий-катионитовые фильтры,
и
q![]() подаваемый на Н-катионитовые,
определяют по формулам:
подаваемый на Н-катионитовые,
определяют по формулам:
![]() ,
,
![]() ,
,
где q![]() −
полезная производительность H-Na-катионитовой установки, м3/ч;
q
−
полезная производительность H-Na-катионитовой установки, м3/ч;
q![]() и
и ![]() − полезная производительность
Na- и
Н-катионитовых фильтров, м3/ч;
Щу − требуемая щелочность умягченной воды, мг-экв/л; Щ
– щелочность исходной воды, мг-экв/л; А1 – суммарное
содержание в умягченной воде анионов сильных кислот, мг-экв/л.
− полезная производительность
Na- и
Н-катионитовых фильтров, м3/ч;
Щу − требуемая щелочность умягченной воды, мг-экв/л; Щ
– щелочность исходной воды, мг-экв/л; А1 – суммарное
содержание в умягченной воде анионов сильных кислот, мг-экв/л.
Объем катионита VH, м3, в Н-катионитовых и VNa, м3, в Na-катионитовых фильтрах определяют по формулам:
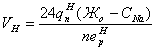 ,
,
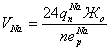 ,
,
где Жо − общая
жесткость умягчаемой воды, г-экв/м3;
CNa
– концентрация
в воде натрия, г-экв/м3; п = 1…3 – число регенераций каждого
фильтра в сутки; е![]() и е
и е![]() − рабочая обменная емкость
Na- и
Н-катионита, г-экв/м.
− рабочая обменная емкость
Na- и
Н-катионита, г-экв/м.
Рабочая обменная емкость, г-экв/м3, Н-катионита
![]() ,
,
где ![]() − коэффициент эффективности
регенерации Н-катионита, зависящий от удельного расхода кислоты; Еп
– полная обменная емкость катионита (паспортная) в нейтральной среде;
qy
–
удельный расход воды на отмывку катионита после
регенерации, принимаемый 4...5 м3/м3 объема катионита в
фильтре; Ск – общее содержание в воде катионов
кальция, магния, натрия и калия, г-экв/м.
− коэффициент эффективности
регенерации Н-катионита, зависящий от удельного расхода кислоты; Еп
– полная обменная емкость катионита (паспортная) в нейтральной среде;
qy
–
удельный расход воды на отмывку катионита после
регенерации, принимаемый 4...5 м3/м3 объема катионита в
фильтре; Ск – общее содержание в воде катионов
кальция, магния, натрия и калия, г-экв/м.
Суммарная площадь, м2, Н- и Na-катионитовых фильтров
![]() ;
;![]() ,
,
где hк = 2…2,5 - высота слоя катионита в фильтре, м.
Количество Na- и Н-катионитовых фильтров в установке должно быть не менее двух. При количестве фильтров на установке менее шести принимают один резервный фильтр, при большем их количестве – два.
Для удаления оксида углерода (IV) из воды после Н-катионирования, а также из смешанной воды после H-Na-катионирования применяют вакуумно-эжекционные аппараты или дегазаторы с кольцами Рашига 25×25×3 мм. Высоту слоя насадки подбирают в зависимости от концентрации, мг/л, оксида углерода (IV) в воде, подаваемой в дегазатор
[СО2] = [СО2]и + 44Щ,
где [СО2]и – концентрация свободного оксида углерода (IV) в исходной воде, мг/л; Щ – щелочность умягчаемой воды, мг-экв/л.
Вентилятор к дегазатору подбирают, исходя из условия подачи 20 м воздуха на 1 м3 обрабатываемой воды. Развиваемый им напор определяют на основании учета сопротивления насадки, для колец Рашига – 294,3 Па на 1 м высоты слоя, вес другие сопротивления принимают равными 294,3...392,4 Па.
Н-катионитовые фильтры регенерируют 1...1,5%-ным раствором серной кислоты. Регенерационный раствор серной кислоты фильтруют через слой катионита со скоростью не менее 10 м/ч с последующей его отмывкой неумягченной водой, пропускаемой через катионит сверху вниз со скоростью 10 м/ч. Расход 100%-ной кислоты, кг, на одну регенерацию Н-катионитового фильтра qк
![]() ,
,
где а – площадь одного Н-катионитового фильтра, м2; qуд – удельный расход кислоты для регенерации катионита, г/г-экв.
7.6 Умягчение воды натрий-хлор-ионированием
Как показывает название этого метода обработки воды, он основывается на применении катионита в Na-форме и анионита в Сl-форме; регенерация обоих ионитов проводится раствором поваренной соли (см. рисунок 13).
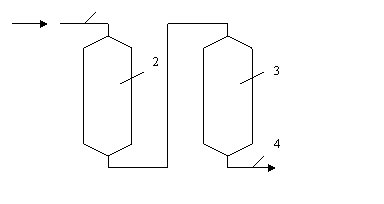

1,4 - подача исходной и отвод умягченной воды; 2 - натрий-катионитовый фильтр; 3 - хлор-анионитовый или совместный натрий-хлор-ионитовый фильтр.
Рисунок 13 – Схема натрий-хлор-ионирования воды
Хлор-ионирование осуществляется после предварительного натрий-катионирования. На натрий-катионитовых фильтрах протекают реакции, рассмотренные выше, и обрабатываемая вода умягчается, в ней остаются только соли натрия: NaHCО3, Na2SО4, NaCl, NaNО3.
При пропуске натрий-катионированной воды через сильноосновный анионит в хлор-форме протекают реакции обмена анионов, содержащихся в Na-катионированной воде, на ионы хлора, находящиеся в анионите.
В результате сорбции иона НСО![]() снижается щелочность
обрабатываемой воды, она минимальна в начале рабочего цикла, а затем постепенно
повышается. Конец рабочего цикла хлор-анионитового фильтра устанавливают по
возрастанию щелочности фильтрата до заданной величины.
снижается щелочность
обрабатываемой воды, она минимальна в начале рабочего цикла, а затем постепенно
повышается. Конец рабочего цикла хлор-анионитового фильтра устанавливают по
возрастанию щелочности фильтрата до заданной величины.
Практика показала, что применение слабоосновных анионитов в описанной технологии Na-Cl-ионирования оказалось невозможным, так как после двух-трех регенераций поваренной солью аниониты этого типа не восстанавливают своей обменной емкости. Претворение в жизнь этой технологии встретило и ряд других трудностей. Для продления срока службы сильноосновного анионита, например AB-17-8, необходимо, чтобы в схемах Na-Cl-ионирования обрабатываемая вода не содержала железа и органических веществ. В подземных водах очень часто содержится двухвалентное железо, и тогда требуется исходную воду предварительно обезжелезивать. Поверхностные воды, для которых обязательна коагуляция в целях удаления органических веществ, обычно при необходимости снизить щелочность, обрабатываются на предочистке известью, после чего они не нуждаются в Na-Cl-ионировании.
Для регенерации анионита требуется поваренная соль высокого качества с минимальным содержанием посторонних примесей; для собственных нужд анионитных фильтров должна применяться умягченная вода.
Метод натрий-хлор-ионирования следует применять в исключительных случаях при соотношении анионов в исходной воде
![]()
и суммарной концентрации сульфатов и нитратов не более 3 мг-экв/л.
В котельных установках обычно требуется глубокое умягчение воды, для чего применяют две ступени натрий-катионирования воды. В случае Na-Cl-ионирования после натрий-катионитовых фильтров первой ступени ставятся фильтры второй ступени, где натрий-катионирование совмещается с хлор-ионированием, при этом вниз фильтра загружается катионит, а сверху помещается анионит типа AB-17. В процессе регенерации фильтра второй ступени раствором поваренной соли ионы натрия регенерируют катионит, а ионы хлора-анионит.
Расход соли принимается равным 100-120
кг/м3 анионита. Регенерационный раствор готовится обязательно на
умягченной воде. Расход воды на отмывку – 3-4 м3/м3.
Скорость фильтрования принимается 15-20 м/ч, количество фильтров – 2-3. При
отключении хлор-анионитового фильтра при щелочности 1,0-1,5 мг-экв/л средняя щелочность
за рабочий цикл получается значительно ниже. Натрий-хлор-ионитовый фильтр
рассчитывается как натрий-катионитовый первой ступени, а необходимый объем
анионита определяется при рабочей
обменной емкости анионита по иону НСО![]() 280-300
г-экв/м3. Слой анионита в фильтре принимается минимально необходимым,
число регенераций – не более 2 раз в сутки каждого фильтра. Слой катионита –
как разность общей высоты слоя загрузки Ноб стандартного
фильтра минус слой анионита, но не менее 0,5 м.
280-300
г-экв/м3. Слой анионита в фильтре принимается минимально необходимым,
число регенераций – не более 2 раз в сутки каждого фильтра. Слой катионита –
как разность общей высоты слоя загрузки Ноб стандартного
фильтра минус слой анионита, но не менее 0,5 м.
Жесткость умягченной воды равна 0,01 мг-экв/л, щелочность – до 0,2 мг-экв/л. Иониты обычно регенерируют 5%-ным раствором поваренной соли.
Для регенерации катионитовых фильтров первой ступени используют отработанный раствор после регенерации фильтров II ступени.
Объем анионита в фильтрах второй ступени
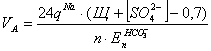 ,
,
где ![]() − производительность
натрий-катионитовых фильтров, м3/ч; Щ – щелочность умягченной воды, мг-экв/л; [SO
− производительность
натрий-катионитовых фильтров, м3/ч; Щ – щелочность умягченной воды, мг-экв/л; [SO![]() ] − содержание
сульфат-ионов в исходной воде, мг/л; п = 1...3 –
число регенераций фильтра в сутки; Еn
=
500 – полная обменная емкость анионита по ионам НСО
] − содержание
сульфат-ионов в исходной воде, мг/л; п = 1...3 –
число регенераций фильтра в сутки; Еn
=
500 – полная обменная емкость анионита по ионам НСО![]() и
SO
и
SO![]() ,
г-экв/м3.
,
г-экв/м3.
На установках производительностью от 5 до 50 м3/ч натрий-хлор-ионитовый метод умягчения воды имеет ряд преимуществ по сравнению с водород-натрий-катионитовым методом: расходуется только один реагент – поваренная соль, отпадает необходимость в кислотном хозяйстве, не требуется антикоррозионной защиты оборудования, трубопроводов и специальной арматуры. Уменьшается количество оборудования, упрощается контроль за работой и эксплуатацией водоумягчительной установки. Недостаток метода – возрастание хлоридов в умягченной воде на величину, эквивалентную ее щелочности.
7.7 Методы глубокого умягчения воды
При необходимости получения постоянного и глубокого умягчения воды (менее 0,03 мг-экв/л) схему, приведенную на рисунке 12, а, приходится дополнять натрий-катионитовыми фильтрами второй ступени, так как при практически приемлемой системе контроля за работой катионитовых фильтров при одноступенчатом катионировании трудно уловить начало проскока жесткости в фильтрат и, следовательно, предотвратить периодическое ухудшение его качества. Подобную схему используют, если жесткость исходной воды значительна (более 6…8 мг-зкв/л). На определенном этапе работы Н-катионитовых фильтров начинает снижаться кислотность фильтрата в результате попадания в него ранее поглощенных катионов натрия. Для устранения снижения кислотности фильтрата прибегают к двухступенчатому Н-катионированию. На Н-катионитовых фильтрах первой ступени работают до проскока в фильтрат катионов Са (II) и Mg(II), после чего их отключают на регенерацию. Н-катионитовые фильтры второй ступени служат для задержания из обрабатываемой воды катионов Na (I), которые почти не задерживаются фильтрами первой ступени, при условии работы их до проскока Са (II) и Mg (II). При извлечении из умягчаемой воды катионов Na(I) кислотность фильтрата сохраняется постоянной длительное время, поскольку Н-катионитовые фильтры второй ступени имеют более продолжительный межрегенерационный период, потому что на них поступает вода с малым содержанием катионов (катионы Са (II) и Mg (II) уже задержаны в фильтрах первой ступени).
Фильтроцикл на Н-катионитовых фильтрах второй ступени невыгодно заканчивать в момент проскока Na (I) в фильтрат; при обнаружении проскока Na (I) на фильтры второй ступени вместо фильтрата после фильтров первой ступени целесообразнее подавать исходную умягчаемую воду. Это позволяет использовать Н-катионитовый фильтр второй ступени в цикле натрий-катионирования воды, так как к моменту проскока Na (I) в фильтрат этот фильтр представляет собой как бы отрегенерированный натрий-катионитовый фильтр. Лишь после проскока в фильтрат Са(II) и Mg (II) фильтр второй ступени отключают на регенерацию. Таким образом, если к умягченной воде предъявляют высокие требования в отношении глубины умягчения и если вместе с тем исходная вода характеризуется значительным содержанием Na(I) и повышенной карбонатной жесткостью, то схему H-Na-катионитового умягчения целесообразно принимать в следующем виде. Сначала проводят двухступенчатое Н-катионирование, затем оба фильтрата смешивают и вода подается на дегазатор для удаления свободной углекислоты, после этого вся вода поступает на натрий-катионитовые буферные фильтры.
Другим примером получения глубоко умягченного фильтрата является противоточное катионирование, о котором указывалось выше. Сущность противоточного катионирования заключается в том, что умягчаемая вода направляется через слой катионита снизу вверх, в то время как регенерирующий раствор и отмывочная вода пропускаются через катионит в обычном направлении - сверху вниз.
Противоточное катионирование реализуется в фильтрах с гидравлически зажатой загрузкой. Регенерация фильтра производится без предварительных взрыхляющих промывок. Результаты работы таких фильтров показали: возможно повышение скорости противоточного фильтрования до 25 м/ч; при умягчении, вод средней жесткости (до 10 мг-экв/л) остаточная жесткость фильтрата не превышает 0,01 мг-экв/л, т.е. получаемый эффект не уступает эффекту двухступенчатого катионирования; при некотором снижении удельного расхода соли на регенерацию (до 165 мг-экв/л) емкость поглощения фильтра уменьшается, но эффект умягчения не снижается; должна быть предусмотрена возможность обратной промывки дренажа током воды от водопровода, так как во время рабочего цикла умягчения дренажные колпачки, расположенные в слое катионита, частично забиваются мелкими зернами; возможно противоточное катионирование без взрыхляющей промывки загрузки перед ее регенерацией.
8 Мембранные методы подготовки воды
К мембранным методам подготовки воды относятся обратный осмос, нанофильтрация, ультрафильтрация, диализ, электродиализ. Оборудование, конструкции установок, используемых в подготовке технологической, а также питьевой вод очень широко описаны в литературе. Мы остановимся на сущности наиболее распространенного в настоящее время метода обратного осмоса [8,9,10].
Обратный осмос (размеры пор 1-15 Å, рабочее давление 0,5-8,0 МПа) применяется для деминерализации воды, задерживает практически все ионы на 92-99%, а при двухступенчатой системе и до 99,9%.
Нанофильтрация (размеры пор 10-70 Å, рабочее давление 0,5-8,0 МПа) используется для отделения красителей, пестицидов, гербицидов, сахарозы, некоторых растворенных солей, органических веществ, вирусов и др.
Ультрафильтрация (размеры пор 30-1000 Å, рабочее давление 0,2-1,0 МПа) применяется для отделения некоторых коллоидов (кремния, например), вирусов (в том числе полиомиелита), угольной сажи, разделения на фракции молока и др.
Микрофильтрация (размеры пор 500-20000 Å, рабочее давление от 0,01 до 0,2 МПа) используется для отделения некоторых вирусов и бактерий, тонкодисперсных пигментов, пыли активных углей, асбеста, красителей, разделения водо-масляных эмульсий и т.п.
Чем более крупные поры образованы в мембране, тем более понятен процесс фильтрации через мембрану, тем более он по физическому смыслу приближается к так называемому механическому фильтрованию.
Промежуточную группу образуют так называемые трековые мембраны, получаемые посредством облучения на циклотроне лавсановых (полиэтилентерефталантных) пленок потоком тяжелых ионов. После воздействия на пленку ультрафиолетовыми лучами и травлением щелочью в пленке образуются поры диаметром 0,2-0,4 мкм (в основном 0,3 мкм).
Сущность метода обратного осмоса
Если растворитель и раствор разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя, то растворитель начнет переходить через перегородку в раствор до тех пор, пока концентрации растворов по обе стороны мембраны не выравниваются. Процесс самопроизвольного перетекания веществ через полупроницаемую мембрану, разделяющую два раствора различной концентрации (частный случай – чистый растворитель и раствор), называется осмосом (от греч.: osmos – толчок, давление).
Если над раствором создать противодавление, скорость перехода растворителя через мембрану уменьшится. При установлении равновесия отвечающее ему давление может служить количественной характеристикой явления обратного осмоса. Оно называется осмотическим давлением и равно тому давлению, которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным от него полупроницаемой перегородкой.
Применительно к системам водоподготовки, где растворителем является вода, процесс обратного осмоса можно представить следующим образом: если со стороны протекающей через аппарат природной воды с некоторым содержанием примесей приложить давление, превышающее осмотическое, то вода будет просачиваться через мембрану и скапливаться по другую ее сторону, а примеси – оставаться с исходной водой, их концентрация будет увеличиваться.
Некоторые гипотезы, предложенные для объяснения процесса обратного осмоса.
Ситовая гипотеза
Размеры молекул воды меньше молекул и ионов всех веществ, находящихся в воде, – растворенных, коллоидов, неионогенных. Диаметр пор мембраны должен быть меньше суммы удвоенной толщины пограничного слоя на мембране и диаметра задерживаемого иона. В противном случае гидратированный ион может пройти через пору, при этом гидратная оболочка иона и пограничный слой воды будут обмениваться частично молекулами воды.
Энергетическая гипотеза
«Протаскивание» молекул примесей через мембраны обусловлено энергией гидратации частиц примесей. Процесс этот тем легче, чем меньше энергия гидратации.
Способность мембран задерживать ионы растворенных веществ совпадает с рядом увеличения их энергии гидратации:
H+ < NO- < I- < Br- < Cl- < K+ < F- < Na+ <
SO2- < Ba2+ < Ca2+ < Mg2+ < Cd2+ < Zn2+ < Al3+ < Fe3+.
|
Капиллярно-фильтрационная (сорбционная) гипотеза
Предполагается, что слой воды перед мембраной, имеющий толщину нескольких десятков молекул, и вода внутри пор имеют пониженную растворяющую способность по сравнению с исходной водой, и поэтому ионы примесей не проходят через поры, так как растворитель (капиллярная и пленчатая вода) их плохо растворяет.
Каждая из данных гипотез выдвигает один из основных факторов, который считает главным. Но на практике надо учитывать по возможности все факторы в зависимости от условий.
9 Электрохимические методы
Электрохимические методы находят широкое применение, когда традиционные способы механической, биологической и физико-химической обработки воды оказываются недостаточно эффективными или не могут использоваться, например, из-за дефицита производственных площадей, сложности доставки и использования реагентов или по другим причинам [11].
Установки по реализации этих методов компактны, высокопроизводительны, процессы управления и контроля сравнительно просто автоматизируются.
Обычно электрохимическая обработка используется в сочетании с другими способами очистки, позволяя успешно очистить природные воды от примесей различного состава и дисперсности.
Электрохимическими методами можно корректировать физико-химические свойства обрабатываемой воды, они обладают высоким бактерицидным эффектом, значительно упрощают технологические схемы очистки. Во многих случаях электрохимические методы исключают «вторичное» загрязнение воды анионными и катионными остатками, характерными для реагентных методов.
9.1 Сущность процесса
Электрохимическая очистка воды основана на электролизе, сущность которого заключается в использовании электрической энергии для проведения процессов окисления и восстановления. Процесс электролиза протекает на поверхности электродов, находящихся в электропроводном растворе – электролите.
Для процесса электролиза необходимы: раствор электролита – загрязненная вода, в которой всегда присутствуют ионы в той или иной концентрации, обеспечивающие электропроводимость воды:
- электроды, погруженные в раствор электролита;
- внешний источник тока;
- токоподводы – металлические проводники, соединяющие электроды с источником тока.
Вода сама по себе – плохой проводник, однако находящиеся в растворе заряженные ионы, образующиеся при диссоциации электролита, под действием напряжения, приложенного к электродам, двигаются по двум противоположным направлениям: положительные ионы (катионы) к катоду, отрицательные (анионы) – к аноду. Анионы отдают аноду свои «лишние» электроны, превращаясь в нейтральные атомы. Одновременно с этим катионы, достигая катода, получают от него недостающие электроны и также становятся нейтральными атомами или группой атомов (молекулами). При этом число электронов, получаемых анодом, равно числу электронов, передаваемых катодом. В цепи протекает постоянный электрический ток.
Таким образом, при электролизе протекают окислительно-восстановительные процессы: на аноде – потеря электронов (окисление), на катоде – приобретение электронов (восстановление). Однако механизм электрохимических реакций существенно отличается от обычных химических превращений веществ. Отличительная особенность электрохимической реакции – пространственное разделение электрохимических реакций на два сопряженных процесса: процессы разложения веществ или получения новых продуктов происходят на границе электрод-раствор при помощи электрического тока.
При проведении электролиза одновременно с электродными реакциями в объеме раствора происходят изменение рН и окислительно-восстановительного потенциала системы, а также фазово-дисперсные превращения примесей воды.
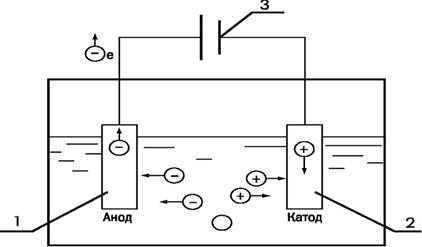 |
1 - анод, 2 - катод, 3 - источник тока.
Рисунок 14 – Схема процесса электролиза
9.2 Классификация электрохимических методов
Электрохимические методы обработки воды можно разделить на три основные группы.
Первая группа обеспечивает изменение физико-химических характеристик загрязнений с целью их обезвреживания или более быстрого извлечения из воды. Из методов этой группы наиболее широко используется метод электрокоагуляции.
Вторая группа предназначена для концентрирования примесей в ограниченном объеме электролита без существенного изменения фазово-дисперсных или физико-химических свойств извлекаемых веществ. Разделение примесей и воды происходит, в основном, за счет флотации электрогенерируемыми пузырьками газа или силового действия электрического поля, обеспечивающего транспорт заряженных частиц в жидкости – метод электрофлотации.
Из электрохимических методов разделения наибольшее распространение получил метод электродиализа с целью обессоливания природных и промышленных сточных вод.
Третью группу составляют комбинированные методы, которые предполагают совмещение одного или нескольких методов превращения и разделения загрязнений в одном аппарате. Эта группа, в основном, применяется для очистки сточных вод.
Электрокоагуляция
Процесс очистки воды от коллоидных и мелкодисперсных примесей с использованием коагулянтов – гидроксидов металлов (алюминия, железа) – можно осуществлять, пропуская воду через электролизер с анодами из указанных металлов (алюминий, железо). Металл анодов под действием постоянного тока ионизируется и переходит в очищаемую воду. Образующиеся в воде гидроксиды алюминия или железа коагулируют дисперсную фазу.
Растворение в воде 1 г алюминия эквивалентно введению в воду 6,33 г Al2(SO4)3, растворение 1 г железа - введению 2,9 г FeCl3 или 3,58 Fe2(SO4)3 [2].
9.3 Электродиализ
Перераспределение и концентрирование растворенных в воде примесей осуществляется электродиализом. Сущность метода заключается в использовании направленного движения ионов под действием электрического поля. Если к электродам приложить напряжение, то находящиеся в растворе ионы придут в движение в соответствии со знаком их заряда – отрицательно заряженные (анионы) к аноду, положительные (катионы) – к катоду.
Если разделить электролизер на три отделения, в двух крайних разместить электроды (отделения называют электродными камерами) и пропускать электрический ток, то концентрация солей в электродных камерах будет возрастать, а в среднем отделении – уменьшаться (см. рисунок 15). Для разделения камер такого электролизера-диализатора используют ионообменные мембраны, которые обладают способностью селективно пропускать ионы одного знака и препятствовать движению противоположно заряженных ионов. Перенос тока в мембране осуществляется не закрепленными в матрице ионами – противоионами. Чем больше число подвижных ионов, то есть выше обменная емкость, тем больше электропроводимость мембраны. Основные электрохимические характеристики мембран – селективная проницаемость и электропроводимость, которые определяются количеством ионообменных групп в матрице и их природой.
Для поддержания электрического тока в цепи на электродах должны проходить электрохимические реакции – на катоде в основном выделение водорода, на аноде – выделение кислорода: в ячейках трехкамерного аппарата для электрохимического обессоливания воды.
2H2O +2ē = H2O + 2OH-
4OH- −4ē = O2 + 2H2O
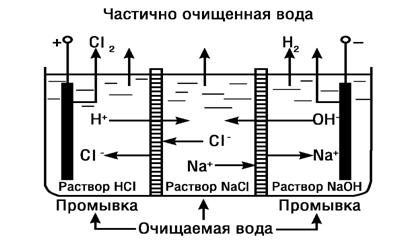
Рисунок 15 – Схема изменения концентрации растворов
В соответствии с уравнениями реакций раствор в катодной камере будет подщелачиваться, в анодной – подкисляться.
В настоящее время используются многокамерные электролизеры с большим числом пар катионо- и анионообменных мембран (см. рисунок 16). Такие установки представляют собой электролизеры, состоящие из 100-200 гидравлических камер, которые могут быть соединены последовательно или параллельно с горизонтальной или вертикальной циркуляцией воды. Селективность мембран создает условия, при которых из нечетных камер ни катионы, ни анионы не могут пройти в соседние камеры, вследствие того, что знак их заряда совпадает со знаком соответственно катионообменных и анионообменных мембран. Поэтому в четных камерах происходит процесс опреснения, а в нечетных, наоборот, концентрация солей, в результате чего в камерах образуется рассол. Обессоленная вода и концентрированный раствор отводятся по соответствующим трубопроводам.
Щелочной раствор из катодной камеры и кислый раствор из анодной камеры могут отводиться самостоятельно по отдельным линиям для дальнейшего использования или же, если такой необходимости нет, подсоединяться к линии рассола.
В электродиализаторах применяются химически стойкие электроды из платинированного титана, ОРТА, реже – из нержавеющей стали или графита.
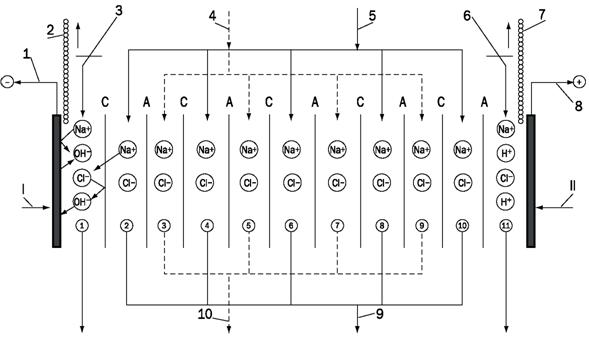 |
I - катод; II - анод; С - катионитовые мембраны; А - анионитовые мембраны; 1 - присоединение к отрицательному полюсу выпрямителя; 2 - выход газообразного водорода; 3 - подача воды на промывку катодной камеры;
4 - подача солоноватой воды в рассольные камеры; 5 - то же, в опреснительные камеры; 6 - подача воды на промывку анодной камеры;
7 - выход газообразных кислорода и хлора; 8 - присоединение к положительному полюсу выпрямителя; 9 - отвод опресненной воды;
10 - отвод концентрированного рассола.
Рисунок 16 – Схема многокамерного электролизера
Методы организации процесса
Организация процесса электродиализа: он может быть однонаправленным (классическим) или обратимым.
При однонаправленной схеме полярность приложенного постоянного напряжения и назначение камер (опресняющих и концентрирующих) остаются неизменными. Недостаток такой схемы – загрязнение поверхности мембран минеральными и неминеральными веществами, содержащимися в воде (соли жесткости, органические и неорганические коллоиды, микробиологические организмы и т.д.).
При обратимом процессе происходит периодическое изменение полярности приложенного напряжения. Отсек, который вначале был опресняющим, при изменении направления тока становится концентрирующим, и наоборот. Так осуществляется очистка мембран от загрязнений.
Особенность обратимого электродиализа – использование симметричных мембран, то есть они работают одинаково в обоих направлениях, и системы ОЭД имеют симметричную конфигурацию.
Недостаток метода – необходимость предварительной очистки вод от взвешенных и коллоидных частиц, которые могут засорять ионитные мембраны.
9.4 Технологические особенности мембран и аппаратов
Показатели работы электродиализных установок определяются, в первую очередь, характеристиками мембран.
Через идеальную катионообменную мембрану осуществляется перенос только катионов, через анионообменную – только анионов. В реальных условиях мембраны не обладают идеальной селективностью и частично переносят ионы обоих зарядов.
Кроме селективности, ионообменная мембрана должна обладать общими свойствами: высокой электропроводимостью, химической и механической стойкостью в окислительных средах, стабильностью характеристик, большим сроком службы. Кроме того, ионообменная мембрана должна максимально ограничивать транспорт гидратной воды (перенос молекул воды совместно с ионом, обычно в виде гидратной оболочки последнего).
Толщина мембран должна быть минимальной, чтобы наименьшим было сопротивление электротоку. Но в то же время толщина должна быть достаточной для механической прочности мембраны в связи с неравномерным распределением гидравлического давления в камерах деминерализации и концентрирования.
По функциональному назначению мембраны могут быть катионообменными, анионообменными и биполярными. По составу полимерной пленки – гомогенными и гетерогенными.
Гетерогенные мембраны получают прессованием тонкоизмельченной смолы и инертного связующего. Такими пластичными связующими материалами могут быть полиэтилен, полистирол, полиизобутилен, каучуки. Химическая стойкость мембран возрастает при использовании в качестве связующего материала фторолефинов. В гетерогенных мембранах, выпускаемых в России, в качестве связующего используется полиэтилен.
Гомогенные мембраны изготовляют из одной ионообменной смолы. Такие мембраны обладают высокими электрохимическими характеристиками, хотя механически они недостаточно прочны.
Наиболее перспективными считаются гомогенные мембраны. Их получают полимеризацией или сополимеризацией ненасыщенных соединений, одно из которых содержит готовые ионогенные группы или такие функциональные группы, которые легко переводятся в ионогенные (амидные, эфирные).
Плотность тока в электродиализаторах – 0,2-1,0 А/дм2. Чем больше плотность тока, тем больше затраты электроэнергии. При резком увеличении плотности тока может начаться перегрев и даже прожог мембран – допускаемая температура нагрева не более 60°С.
Расход электроэнергии при оптимально организованной технологии и минерализации исходной воды не менее 1 г/л составляет примерно 1 Вт/л. При уменьшении минерализации воды, особенно менее 0,5 г/л, затраты электроэнергии на преодоление электрического сопротивления воды становятся значительными, и следует оценивать технологию по экономическим критериям.
Напряжение на электродиализаторе (в зависимости от количества камер, степени минерализации исходной и деминерализованной воды) может колебаться в пределах от 300 до 1000 В.
Очень важное свойство ионообменных мембран – склонность к набуханию, которая связана с гидратацией фиксированных ионообменных групп и противоионов. Чем больше обменная емкость и способность к гидратации ионов всех видов, тем больше набухание мембран. Ненабухающие мембраны проводят ток в незначительной степени, а при набухании молекулы воды вызывают диссоциацию ионогенных групп, и противоионы вместе с вошедшим в мембрану электролитом начинают переносить ток.
Хорошими эксплуатационными характеристиками обладают мембраны МРФ-26 и МРФ-4МБ, полученные на основе фторированных ненасыщенных соединений, содержащие – SO3H в качестве ионогенных групп. МРФ-4МБ весьма термостойка и может применяться при 100°С и выше. Эти мембраны показали химическую стойкость в сильных окислительных средах: хромовой кислоте, гипохлорите натрия, концентрированной щелочи и серной кислоте. Еще большей химической стойкостью обладает мембрана МФ-4СК, выдерживающая действие наиболее активного для ионитных мембран окислителя – 10%-ного раствора H2O2. Для обеспечения механической прочности мембран МФ-4СК смолу наносят на ткань из политетрафторэтилена.
Наиболее совершенные мембраны производятся в настоящее время японскими фирмами «Асахи кемикал» и «Асахи гласс» на основе перфторуглеродных материалов с – COOH в качестве ионогенных груп, а также фирмой «Дюпон» (США).
9.5 Конструкции и схемы
Уменьшение омических потерь в растворе достигается максимально возможным сближением электродов и соответственно мембран. Интервалы между ними обеспечиваются прокладками различной конструкции, чаще всего – лабиринтно-сетчатыми. Прокладки выполняют также важную роль турбулизации потока воды (уменьшение опасности возникновения отложений). Применяются и профилированные мембраны (без прокладок), и прокладки струнного типа.
Во избежание образования застойных зон в камерах концентрирования значительную часть (до 80%) получаемого раствора возвращают в диализный аппарат - создается циркуляционный контур.
Введение в камеры деминерализации смеси гранулированных или в виде волокон катионитов и анионитов – способ снижения нижнего экономически оптимального предела – 500 мг/л - деминерализуемой воды (электродеионизация). В этом случае можно получить не только пресную, но и глубоко деминерализованную воду (см. рисунок 17).
9.6 Условия применения метода
Мембраны электродиализные так же, как и обратноосмотические, требуют исходную воду определенной чистоты. Электродиализные аппараты позволяют деминерализовать воду практически любой степени минерализации почти полностью.
Глубина очистки достигается регулировкой расхода очищаемой воды.
Срок службы аппаратов примерно 10 лет.
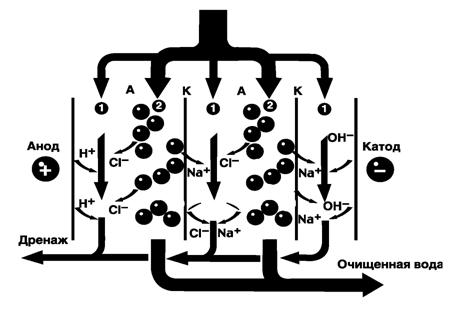 |
Рисунок 17 – Схема электродеионизационной установки
Вода, подаваемая к электродиализному аппарату, должна содержать, не более:
- жесткость общая – 40 ммоль/л;
- взвешенные вещества – 1,5 мг/л;
- цветность – 20 градусов по платино-кобальтовой шкале;
- перманганатная окисляемость – 5 мгО/л;
- железо общее (Fe) – 0,05 мг/л;
- марганец общий (Mn) – 0,05 мг/л;
- бораты (по ВО2) – 3 мг/л;
- бром (Br) – 0,4 мг/л;
- алюминий (Al) – 0,05 мг/л.
Расход электроэнергии – 0,5-2,5 кВт·ч/м3 (в зависимости от минерализации исходной воды и других условий).
Давление воды на входе – 0,15-2,0 МПа; на выходе – 0,2-0,5 МПа.
Температура воды на входе – 18-25°С; возможно повышение температуры до 40°С – в этом случае расход электроэнергии уменьшается примерно на 20-30%.
Режим работы – непрерывный. Борьба с отложениями солей на поверхности мембран: переполюсовка электродов с одновременным переключением потоков диализата и рассола, а также подкисление рассола. Возможна – при необходимости – отмывка трактов повышенными дозами кислоты и растворами комплексообразователей.
9.7 Основные технологические параметры электрохимических методов
Несмотря на существенные различия в механизме и кинетических закономерностях, применяемых на практике методов электрохимической очистки загрязненных жидкостей и на конструктивные различия аппаратов для электрообработки воды, некоторые технологические показатели и методика их расчета общие.
Важнейший показатель процесса электрохимической очистки воды – расход электроэнергии, необходимый для достижения требуемой степени очистки в единице объема. Удельный расход электроэнергии в общем случае определяется по формуле
![]() ,
,
где W – удельный расход электроэнергии, Вт·ч на 1 л или кВт·ч на 1 м3 воды; I – сила тока, А; T – продолжительность электролиза, ч; Uобщ – напряжение на электродиализаторе, Q – объем воды обрабатываемой за время.
10 Обработка охлаждающей воды на ТЭС
10.1 Системы охлаждения и стабильность охлаждающей воды
Основная часть воды, потребляемой ТЭС, используется для охлаждения.85-95% воды идет на конденсацию пара, 3-8% охлаждение масла и воздуха, 4-6% восполнение потерь в оборотных циклах [4].
Основные требования к качеству воды:
1) температура, обеспечивающая нормальный вакуум в конденсаторах;
2) не должна вызывать в системе охлаждения отложения минерального и биологического характера;
3) не должна вызывать коррозию оборудования.
Для охлаждения конденсаторов используются как прямоточные, так и оборотные системы водоснабжения.
При прямоточной системе охлаждения вода проходит через конденсатор турбины однократно, причем забор воды из реки производится из створа, расположенного выше по течению, чем сброс воды.
При оборотной системе охлаждение воды проходит через конденсатор многократно. Охлаждение нагретой воды, покидающей конденсатор, осуществляется за счет ее частичного испарения. Для охлаждения могут быть использованы естественные и искусственные водоемы, пруды-охладители, брызгальные бассейны и градирни. Экономически более выгодны естественные водохранилища, однако они обладают тем недостатком, что во многих случаях не удается создать нормальный тепловой режим.
Системы охлаждения с градирнями наименее экономичны, так как они имеют температуру охлаждающей воды на входе в конденсатор в 1,4-1,5 раза выше, чем в оборотных системах с водохранилищами. Однако при использовании градирен можно резко снизить сброс тепловых вод в водоемы.
В градирнях часть оборотной (охлаждающей) воды теряется за счет капельного уноса (Рун = 0,05-3,5%) и испарения (Рисп = 1-1,5%). Испаряемая влага является чистой водой, поэтому солесодержание воды в оборотной системе повышается. Регулирование солесодержания осуществляется методом водообмена с помощью продувки системы Рпрод.
Потери компенсируются добавлением в систему технической воды
![]() .
.
Для солей, не образующих труднорастворимых соединений при нагреве воды в системе охлаждения, баланс масс в установившемся режиме записывается в виде
![]() ,
,
где Сдоб и Сцирк – концентрации солей (ионизированных примесей) в добавочной и циркуляционной водах; Сцирк/Сдоб – коэффициент концентрирования кк или коэффициент упаривания.
Сокращение значения продувки приводит к повышению кратности концентрирования и к значительному солесодержанию циркуляционной воды.
Наряду с концентрированием легкорастворимых солей в
системе оборотного охлаждения увеличиваются концентрации солей жесткости и
гидрокарбонатов. С ростом температуры воды в СОО увеличивается гидролиз НСО![]()
2НСО![]() = СО
= СО![]() + СО2 + Н2О.
+ СО2 + Н2О.
Образованию карбонат – ионов также способствует удаление СО2 (сдвиг реакции вправо).
Это приводит к возможности выделения на теплообменной
поверхности отложений СаСО3, т.е. к потере стабильности охлаждающей
воды (когда произведение активностей взаимодействующих компонентов превысит ![]() . Сульфат кальция
обладает сравнительно большой растворимостью при температуре 20-40°С и реже
встречается в составе низкотемпературных отложений.
. Сульфат кальция
обладает сравнительно большой растворимостью при температуре 20-40°С и реже
встречается в составе низкотемпературных отложений.
Теплопроводность кальциевых отложений на порядок меньше теплопроводности металла конденсаторных трубок. С ростом толщины накипи на них повышается температура конденсации пара и снижается вакуум в конденсаторе. Ухудшение вакуума на 1% требует увеличения расхода пара на 1,4% для поддержания номинальной мощности энергоустановки. Т.о., отложения в системе СОО приводят к значительному пережогу топлива при выработке электроэнергии.
Применение градирен предотвращает «тепловое» отравление водотоков и водоемов.
Для предотвращения образований минеральных солей в конденсаторах в оборотных системах применяют:
1) продувку системы;
2) стабилизационную обработку циркуляционной воды различными реагентами;
3) физическую обработку воды в магнитном или акустическом поле.
Для предотвращения биологических обрастаний в системах охлаждения применяется очистка конденсаторных трубок резиновыми шариками и обработка воды сильными окислителями.
10.2 Предотвращение образования минеральных отложений
Наиболее распространенным методом стабилизации охлаждающей воды является продувка систем водяного охлаждения, т.е. отвод части воды с заменой ее свежей. Продувка – это отвод части циркулирующей воды с заменой ее свежей.
При продувке происходит общее понижение концентрации всех примесей, в том числе хлоридов и сульфатов, что способствует предотвращению коррозии в оборотной системе охлаждения.
Основное назначение продувки – поддержание карбонатной жесткости оборотной воды ниже предельно допустимой Жк.пред. Значение этой продувки можно определить из уравнения баланса:
![]() отсюда
отсюда
![]() ,
,
где Жк.доб – карбонатная жесткость воды, добавляемой для восполнения потерь в СОО, мг-экв/дм3.
Значения Жк пред обычно определяется опытным путем для конкретных условий работы СОО.
В интервале температур 30-60°С Г.Е. Крушелем предложена формула
![]() ,
,
где ОК – окисляемость воды, мгО2/дм3.
Потери воды на испарение в градирнях определяются по формуле
![]() ,
,
где х – доля теплоты, отдаваемой охлаждающей водой за счет ее испарения в градирне (летом – 1,0; весной и осенью – 0,75; зимой – 0,5), Δt – снижение температуры в градирне.
Подкисление циркуляционной воды в целях частичного снижения Жк до значения равного или меньшего, чем Жк.пред с использованием H2SO4 в качестве дешевого и доступного реагента.
Кислота разлагает гидрокарбонат кальция
Ca(HCO3)2 + H2SO4 = CaSO4 + 2H2O + 2CO2.
При подкислении выделяется СО2. Он стабилизирует оставшийся гидрокарбонат кальция (Жк ост), который служит буфером, предохраняющим систему от перекисления и интенсификации коррозии.
![]() .
.
Расход технической серной кислоты σк, г/ч, на обработку охлаждающей воды подсчитывается по найденному значению Жк ост в виде
![]() ,
,
где Qцирк – расход охлаждающей воды в системе, м3/ч; Рдоб – добавка в систему охлаждающей воды,%; К – содержание H2SO4 в техническом продукте, доли единицы.
Режим окисления должен быть таким, чтобы Жк.ост было бы не ниже 1,0 мг-экв/дм3.
Фосфатирование охлаждающей воды в СОО производится в целях торможения процесса образования твердой фазы СаСО3, фосфаты замедляют ее дальнейший рост, увеличивают допустимую степень пересыщения раствора и тем самым стабилизируют воду.
При использовании гексаметафосфата натрия (NaPO3)6 стабильный безнакипный режим оборотной воды сохраняется до значений Жк пред = 5-5,5 мг-экв/дм3, при применении оксиэтилендифосфоновой кислоты С2Н8О7Р2 (ОЭДФК) до Жк пред = 7,5 мг-экв/дм3.
С течением времени стабилизирующие свойства фосфатов теряются из-за их гидролиза, поэтому требуется непрерывное дозирование.
Из других органических фосфатов применяются также ингибитор отложений минеральных солей (ИОМС), представляющий собой натриевую соль аминометиленфосфоновой кислоты и ингибитор ПАФ-13А (линейный полимер с функциональной группой СН2РО(ОН)2.
Ингибиторы, также как и ОЭДФК, обладают «пороговым» эффектом, способным препятствовать росту кристаллов труднорастворимых солей за счет адсорбции на микрозародышах кристаллизующейся соли, обеспечивая стабильность перенасыщенного раствора. Одновременно ингибиторы обеспечивают постепенное разрушение структуры карбонатных отложений и их удаление. Дозы ИОМС и ПАФ-13 выбираются индивидуально в зависимости от качества охлаждающей воды и режима работы системы охлаждения.
Предотвращение процесса гидролиза гидрокарбонатов с
образованием иона СО![]() можно добиться методом восполнения десорбированного в градирне СО2
до равновесного значения его в охлаждающей воде. Процесс насыщения воды
углекислым газом называют рекарбонизацией воды. В качестве источника СО2
на ТЭС используют продукты сгорания топлива, которые содержат СО2,
SO2, азот и кислород. При этом образуется СО2
можно добиться методом восполнения десорбированного в градирне СО2
до равновесного значения его в охлаждающей воде. Процесс насыщения воды
углекислым газом называют рекарбонизацией воды. В качестве источника СО2
на ТЭС используют продукты сгорания топлива, которые содержат СО2,
SO2, азот и кислород. При этом образуется СО2
НСО![]() + SO2 = HSO
+ SO2 = HSO![]() + CO2;
+ CO2;
2НСО![]() + O2 = 2SO
+ O2 = 2SO![]() + 2H+
+ 2H+
(увеличивается количество сульфатов, увеличивается некарбонатная жесткость).
Наиболее рациональная система насыщения воды газом- схема с использованием эжектора, который обеспечивает хорошее перемешивание дымовых газов с обрабатываемой водой.
Магнитная обработка воды производится в аппаратах, в которых поток охлаждающей воды пересекает силовые линии магнитного поля напряженностью до 105 А/м. Магнитное поле создается электромагнитной катушкой или постоянными магнитами. Теоретические основы воздействия магнитного поля на воду и ее примеси еще не разработаны. Экспериментально установлено, что при наложении магнитного поля на воду происходит снижение интенсивности отложений на теплопередающих поверхностях.
10.3 Предотвращение биологических обрастаний
Повышение температуры в системах охлаждения, наличие питательных веществ и кислорода являются причинами интенсивного развития в охлаждающей воде бактерий, грибков и водорослей различных видов. При окисляемости воды выше 10-15 мгО2/дм3 биологические образования в форме слизистых отложений формируются на поверхностях СОО наиболее интенсивно.
Обработку воды производят такими окислителями, как хлор и его производные, а также медьсодержащими солями. Механизм бактерицидного действия молекулярного хлора и его производных заключается в окислении ферментов клетки с последующим отмиранием микроорганизмов.
При растворении хлора в воде протекает его гидролиз с образованием хлорноватистой и хлорводородной (соляной) кислоты
Cl2 + H2O = HClO + HCl.
Слабая хлорноватистая кислота диссоциирует в растворах с образованием гипохлорит-иона
HClO = H+ + ClO-.
Хлорирование желательно проводить при рН<7, когда HClO находится в молекулярной форме.
Необходимое количество хлора для бактерицидной обработки воды устанавливается опытным путем с учетом заданной концентрации остаточного свободного хлора, равной 0,1-0,2 мг/дм3.
Хлор вводят в воду в виде приготовленной хлорной воды с помощью водоструйного эжектора. Дозирование ведется с перерывами продолжительностью 40-60 мин 1-3 раза в сутки.
Для борьбы с ракушечными отложениями в системах охлаждения применяют медный купорос CuSO4·5H2O с дозой ионов меди около 1-2 мг/дм3. Ионы меди, взаимодействуя с цитоплазмой, приводят к их гибели. Этот метод пригоден только для оборотных систем.
При сбросе в водоем в воде должен отсутствовать свободный хлор, а концентрация меди не должна превышать 0,01 мг/кг.
Производят очистку от мягких илистых биологических отложений также монолитными резиновыми шариками плотностью 1 г/см3 с диаметром, равным внутреннему диаметру конденсаторных трубок.
11 Стоки электростанций и технологии их обезвреживания
Общие положения
Эксплуатация ТЭС сопряжена с использованием природной
воды и образованием жидких отходов, часть из которых после переработки
направляется в цикл повторно, но основное количество потребляемой воды
выводится в виде стоков, к которым относятся:
- сбросные воды систем охлаждения;
-шламовые, регенерационные и промывочные воды водоподготовительных установок и конденсатоочисток;
- сточные воды систем гидрозолоудаления (ГЗУ);
- воды, загрязненные нефтепродуктами;
- отработанные растворы после химической очистки станционного оборудования и его консервации;
- воды от обмывки конвективных поверхностей ТЭС, сжигающих мазут;
- воды от гидравлической уборки помещений;
- дождевые и талые воды с территории энергообъекта.
Составы и количества перечисленных стоков различны. Они зависят от типа и мощности основного оборудования ТЭС, вида используемого топлива, качества исходной воды, способов водоподготовки, совершенства приемов эксплуатации и др. Попадая в водотоки и водоемы, примеси сточных вод могут менять соленой состав, концентрацию кислорода, значение рН, температуру, содержание ГДП и другие показатели воды, затрудняющие процессы самоочищения водоемов и влияющие на жизнеспособность водной среды [12-18]. Для минимизации влияния примесей сбросных вод на качество поверхностных природных вод для каждого выпуска сточных вод установлены нормативы предельно допустимых сбросов вредных веществ, исходя из условий не превышения предельно допустимых концентраций вредных веществ в контрольном створе водоема. Для питьевой воды установлены ПДК по сотням вредных химических веществ (САНПиН 2.1.4.559-96), попадающих в воду за счет геохимических процессов, а также характерных для стоков, образующихся в процессах обработки воды и поступающих в источники водоснабжения в результате производственно-хозяйственной деятельности человека.
Для водоемов рыбохозяйственного значения приведенные данные могут быть более жесткими, например, ПДК по нефтепродуктам для таких водоемов должно быть равным 0,05 мг/дм3.
Перечисленные типы сточных вод ТЭС подразделяются на две группы:
Первая группа стоков – к ним относятся стоки СОО, ВПУ, и ГЗУ ТЭС -характеризуется либо большими объемами, либо повышенными концентрациями вредных веществ, которые могут влиять на качество воды водных объектов. Поэтому эти стоки обязательно подлежат контролю (см. таблицу 11).
Остальные шесть типов сбросных вод ТЭС необходимо использовать повторно после очистки в пределах ТЭС или по договоренности на других предприятиях, либо допускается их закачка в подземные пласты и т.п.
В качестве меры для экономии водопотребления на ТЭС, ограничения сброса сточных вод и защиты от загрязнения, засоления и истощения всех водных объектов законодательно введена плата за забор и сброс воды, хранение и вывоз твердых отходов.
Таблица 11 – Примерный перечень контролируемых показателей качества сточных вод ТЭС
|
Показатель |
СОО с градирнями |
ВПУ |
ГЗУ |
|
Взвешенные вещества |
+ |
+ |
+ |
|
Водородный показатель рН |
+ |
+ |
+ |
|
Биологическое потребление кислорода |
− |
− |
+ |
|
Солесодержание |
+ |
+ |
+ |
|
Хлориды1 |
+ |
+ |
+ |
|
Сульфаты |
+ |
+ |
+ |
|
Нефтепродукты |
+ |
+ |
+ |
|
Кальций |
− |
− |
+ |
|
Железо1 |
− |
+ |
+ |
|
Алюминий1 |
− |
+ |
+ |
|
Медь |
+ |
− |
− |
1 – Контролируется в зависимости от применяемого реагента
11.1 Сточные воды систем охлаждения
Сточные воды прямоточных систем охлаждения, сбрасываемые после конденсаторов турбин, газо-, воздухо-, маслоохладителей и других теплообменных аппаратов, только нагревающие воду природных источников, но не загрязняющие ее химическими или механическими примесями, не требуют очистки. Температура сбрасываемой воды в таких системах обычно превышает температуру водоисточника на 8-10°С, вызывая его тепловое загрязнение. При расчете сбросов подогретой воды необходимо учитывать, что расчетная летняя температура водных объектов питьевого и культурного назначений не должна повышаться более чем на 3°С, зимняя – более чем на 5°С. Для обеспечения требуемого уровня температуры воды применяют:
- глубинные водозаборы и поверхностные выпуски;
- брызгальные устройства над акваторией отводящих каналов;
- увеличение кратности охлаждения конденсаторов в зимний период;
- эжектирующие водовыпуски.
В СОО с градирнями продувочные воды являются не только подогретыми, но и характеризуются повышенным солесодержанием.
Коэффициент концентрирования в таких системах подсчитывается как
![]() ,
,
где Qисп, Qпрод, Qун – количества соответственно испаряющейся воды, продувочной воды и капельного уноса.
Исходя из уравнения, сокращение величин продувки и капельного уноса приводят к увеличению Кк и росту солесодержания в системе охлаждения. При использовании маломинерализованных добавочных вод в СОО ее продувочные воды могут быть востребованы в других водоиспользующих системах ТЭС. Так, нормативными документами рекомендуется направлять продувку СОО для использования в ВПУ в том случае, если коэффициент концентрирования в градирнях не превышает 1,5 при солесодержании исходной воды менее 500 мг/дм3 и не превышает 1,2 при солесодержании более 500 мг/дм3.
Примером комбинированной работы СОО и ВПУ ТЭЦ, рассчитанной на приготовление большого количества подпиточной воды для закрытой системы теплоснабжения, может служить схема, приведенная на рисунке 18. Согласно схеме, например, в режиме наибольшей зимней нагрузки максимальное значение подпитки теплосети (ПТС) определяет максимальную продувку СОО и соответственно снижение коэффициента концентрирования (задвижка 6 закрыта, задвижки 7, 8 открыты). В летний период при уменьшении расхода воды на подпитку теплосети освобождающаяся мощность ВПУ ПТС используется для умягчения части подпиточной воды СОО (задвижка 6 открыта), что снижает опасность нарушения водно-химического режима системы охлаждения.
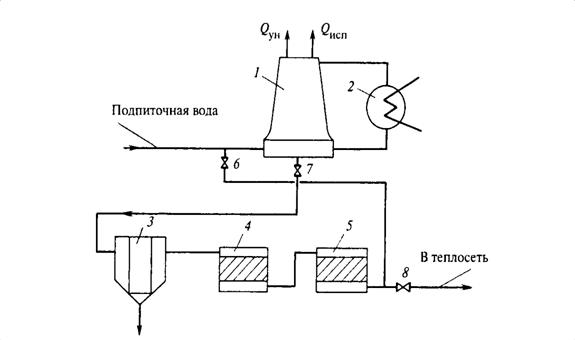 |
1 - градирня; 2 - конденсатор; 3 - осветлитель; 4 - осветлительный фильтр;
5 - Nа-катионитовый фильтр; 6,7,8 - задвижки.
Рисунок 18 – Комбинированная схема работы СОО и ВПУ ТЭЦ с закрытой системой теплоснабжения
11.2 Сточные воды водоподготовительных установок
Эксплуатация ВПУ связана с потреблением больших количеств извести, коагулянта, регенерантов (Н2SО4, NaОН, NaСl). Стоки предочистки содержат шлам различного состава, определяемого ее типом. Основная часть регенерирующих веществ переходит в сточные регенерационные воды и является потенциальным источником загрязнения природных водных объектов (см. таблицу 13). Количественные характеристики сбросных вод ВПУ определяются при проведении технологических расчетов. Сброс вод, содержащих такие загрязнения, даже после взаимной нейтрализации кислых и щелочных стоков обессоливающих установок (см. рисунок 19), разрешается в таких редких случаях, когда естественный водоем имеет мощный дебит, способный разбавлять вредные химические вещества до значений их ПДК. Совершенствование экономичных и экологичных схем ВПУ в настоящее время ведется в следующих направлениях:
- использование противоточных фильтров в схемах ВПУ;
- использование мембранных технологий;
-изменение внутренних взаимосвязей различных узлов технологических схем и применение оборудования, позволяющего снизить расходы реагентов и воды на собственные нужды, извлекать из сточных вод ценные компоненты, т.е. создавать малоотходные схемы ВПУ.
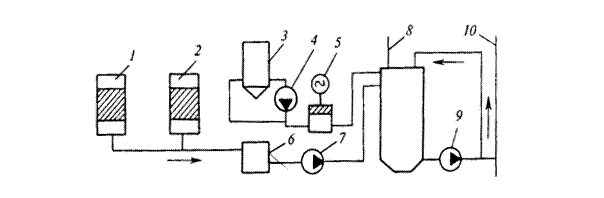 |
1 - Н-катионитовые фильтры; 2 - анионитовые фильтры; 3 - мешалка известкового молока; 4,7 - перекачивающие насосы; 5 - насос-возатор;
6 - промежуточный бак для сбора регенерационных вод; 8 - бак-нейтрализатор; 9 - насос перемешивания и сброса; 10 - охлаждающая вода.
Рисунок 19 – Схема нейтрализации сточных вод обессоливающих установок
Таблица 12 – Характеристики основных солевых стоков ионитных ВПУ
|
Схема обработки воды |
Общая жесткость, мг-экв/дм3 |
Концентрация, г/дм3 |
||
|
Солесо-держание |
Хлориды |
Сульфаты |
||
|
Nа-катионирование |
58-160 |
9,9-14,6 |
6,0-8,1 |
Исходная |
|
Н-катионирование с «голодной» регенерацией |
40-64 |
3,3-4,7 |
Исходная |
1,75-3,0 |
|
Химическое обессолива-ние по схеме «цепочки» |
15,6-19,0 |
3,2-4,5 |
0,1-0,4 |
1,8-2,2 |
11.3 Стоки, загрязненные нефтепродуктами
Недостаточно очищенные нефтесодержащие сточные воды, попадая в водоемы, образуют пленку на поверхности воды, ухудшая условия аэрации, а тяжелые нефтепродукты, оседая на дно, губительно действуют на водную флору и фауну. Поэтому на нефтепродукты установлены очень жесткие ПДК, так как они являются слабо окисляющимися веществами. Согласно действующим нормативам нефтесодержащие стоки ТЭС должны очищаться и повторно использоваться в качестве исходных вод для ВПУ, СОО и других систем, а уловленные нефтепродукты – сжигаться в котлах. Очистка вод от нефтепродуктов осуществляется комплексным сочетанием методов (см. рисунок 21), позволяющим обеспечить остаточное нефтесодержание на уровне 0,5-1,0 мг/дм3. Среди многочисленных элементов комплексной схемы очистки от нефтепродуктов ранее не были рассмотрены принципы действия нефтеловушек и флотаторов. В основу нефтеловушки (см. рисунок 20) положен принцип отстаивания, реализуемый за счет разности плотностей воды и нефтепродуктов. Сточная вода подается в приемную камеру и, пройдя под полупогруженной перегородкой, попадает в отстойную камеру, где и происходит процесс разделения эмульсии. Очищенная вода, пройдя под второй полупогруженной перегородкой, выводится из нефтеловушки, а частицы нефтепродуктов, всплывающие на поверхность воды, образуют пленку, которая перемещается специальным движущимся скребковым устройством к нефтесборным щелевым трубам. При отстаивании всплытие капель нефтепродуктов происходит медленно – со скоростью порядка долей миллиметра в секунду. Флотационная очистка воды заключается в образовании комплексов, состоящих из частиц нефтепродуктов и пузырьков воздуха, которыми предварительно насыщают обрабатываемую воду, реализуя принцип напорной флотации. При этом скорость всплытия комплекса превышает на два-три порядка скорость всплытия капли масла. При напорной флотации (см. рисунок 22) воздух растворяется в воде под избыточным давлением до 0,5 МПа, для чего он подается в трубопровод перед насосом (обычно с помощью эжектора), а затем водовоздушная смесь в течение 8-10 мин находится в специальной напорной емкости, откуда направляется во флотатор. Во флотаторе происходит снижение давления, образование пузырьков воздуха и собственно флотационный процесс разделения воды и примеси. На ТЭС используются горизонтальные многокамерные и радиальные флотаторы, в которые для повышения эффективности очистки может вводиться раствор коагулянта. При небольших концентрациях нефтепродуктов, составляющих около 10-20мг/дм3, в комплексной схеме очистки могут отсутствовать некоторые элементы, например, крупногабаритные нефтеловушка и флотатор.
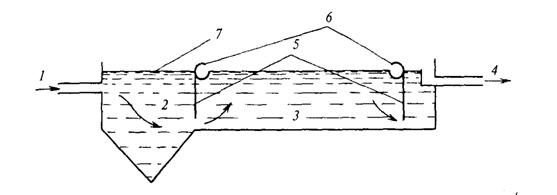 |
1 - сточная вода; 2 - приемная камера; 3 - отстойная зона; 4 - очищенная вода; 5 - вертикальные полупогружные перегородки; 6 - нефтесборные щелевые трубы; 7 - пленка всплывших нефтепродуктов.
Рисунок 20 – Схема нефтеловушки
 |
1 - трубопровод замазученных и замасленных вод; 2 - приемный бак отстойник; 3 - нефтеловушка; 4 - промежуточный резервуар; 5 - эжектор насыщения воды воздухом; 6 - насос; 7 - напорный бак; 8 - флотатор;
9 - промежуточный резервуар; 10 - ячейка коагулянта; 11 - насос для перекачки коагулянта; 12 - осветлительный фильтр коагулянта; 13 - бак-мерник коагулянта; 14 - насос дозатор коагулянта; 15 - насос для подачи воды на фильтр; 16 - двухслойный осветлительный фильтр; 17 - фильтр с загрузкой активированного угля; 18 - резервуар очищенной воды; 20 - емкость для сбора осадка; 21 - емкость для сбора уловленных нефтепродуктов; 22 - насос для подачи уловленных нефтепродуктов на сжигание; 23 - насос для подачи осадка в накопители; 24 - трубопровод очищенной воды на повторное использование; 25 - трубопровод сбора промывочных вод фильтров;
26 - трубопровод промывки фильтрующих материалов.
Рисунок 21 – Схема очистки вод, загрязненных нефтепродуктами
 |
1 - вход воды; 2 - приемный резервуар; 3 - всасывающая труба;
4 - воздухопровод; 5 - насос; 6 - флотационная камера; 7 - пеносборник; 8 - отвод очищенной воды; 9 - напорная емкость.
Рисунок 22 – Схема установки для напорной флотации
11.4 Стоки от химических очисток и консервации оборудования
Химическая очистка котлов и другого теплоэнергетического оборудования производится с помощью растворов неорганических (соляная, серная) и органических (лимонная, щавелевая, фталиевая и др.) кислот, содержащих различные ингибиторы, а также комплексонов (трилон Б и др.), композиций на основе комплексонов и с применением поверхностно-активных веществ (октадециламин и др.), используемых в концентрациях 1-50 г/дм3. При пассивации и консервации оборудования могут быть использованы аммиак, гидразин, октадециламин, трилон Б и др. Отработанные растворы, помимо основных веществ, содержат также соли и оксиды железа, меди, цинка, ноны кальция, магния и другие компоненты. Из этого перечня видно, что состав сбросных растворов весьма сложный, они содержат вредные химические вещества, что не допускает их сброса в природные водоемы.
 |
1 - сброс отработанных растворов; 2 - бак нейтрализатор; 3 - насос рециркуляции; 4 - подача сжатого воздуха; 5 - мешалка; 6 - насос подачи окислителя; 7 - ввод реагентов; 8 - насос перекачки; 9 - сброс обезвреженных и нейтрализованных вод; 10 - накопитель-отстойник отработанных вод.
Рисунок 23 – Принципиальная схема нейтрализации и обезвреживания вод от химических очисток оборудования
Технология очистки вод такого типа предусматривает их реагентную нейтрализацию, использование окислителей, бассейна-отстойника для осаждения оксидов и гидроксидов тяжелых металлов (см. рисунок 23). Заканчивается обезвреживание стоков биохимическим разрушением остаточных органических соединений. В последние годы успешно реализована попытка отказа от применения химических реагентов при очистках и консервации теплоэнергетического оборудования путем использования пароводокислородного метода очистки и пассивации.
Список литературы
1. Копылов А.С., Лавыгин В,М., Очков В.Ф. Водоподготовка в энергетике: Учебное пособие для вузов.-М.: Издательство МЭИ, 2003.-310 с.
2. Водоподготовка: Справочник /под ред. д.т.н., действительного члена Академии промышленной экологии С.Е. Беликова/-М.: Аква-Терм, 2007.-240 с.
3. Громогласов А.А., Копылов А.С., ПильщиковА.П. Водоподготовка: Процессы и аппараты – М.: Энергоатомиздат, 1990-272 с.
4. Стерман Л.С., Покровский В.Н. Физические и химические методы обработки воды на ТЭС. – М.: Энергоатомиздат, 1991-328 с.
5. Фрог Б.Н., Левченко А.П. Водоподготовка. Учебное пособие.- М.: Издательство Ассоциации строительных вузов, 2006.-656 с.
6. Лившиц О.В. Справочник по водоподготовке котельных установок. – М.:Энергия, 1977-288 с.
7. Зубакова Л.Б., Тевлина А.С., Даванков А.Б. Синтетические ионообменные материалы.- М.: Химия, 1978. – 184 с.
8. Дытнерский Ю.И. Обратный осмос и ультрафильтрация.- М.: Химия, 1978. – 351 с.
9. Дытнерский Ю.И. Баромембранные процессы. -М.: Химия,1986.-272 с.
10. Карелин Ф.Н. Обессоливание воды обратным осмосом. -М.: Стройиздат, 1988. – 208 с.
11. Яковлев С.В., Краснобородько И.Г., Рогов В.М. Технология электрохимической очистки воды. - Л.: Стройиздат, 1987. – 312 с.
12. Методические указания по проектированию ТЭС с максимально сокращенными стоками. - М.: Минэнерго СССР, 1991.
13. Руководство по проектированию обработки и очистки производственных вод тепловых электростанций. -М.: Теплоэлектропроект, 1976.
14. Кишневский В.А. Современные методы обработки воды в энергетике: Учебное пособие для вузов. - Одесса: ОГНУ, 1999.
15. Кострикин Ю.М., Мещерский Н.А., Коровина О.В. Водоподгодготовка и водный режим энергоблоков низкого и среднего давлений: Справочник. -М.: Энергоатомиздат, 1990.
16. Мещерский Н.А. Эксплуатация водоподготовительных установок высокого давления. - М.:Энергоатомиздат, 1984.
17. Повышение экологической безопасности тепловых электростанций: Учебное пособие для вузов /А.И. Абрамов, Д.П. Елизаров, А.Н. Ремезов и др.; под ред. А.С. Седлова. - М.: Издательство МЭИ, 2001.
18. Водоподготовка. Процессы и аппараты / под ред. О.Мартыновой. – М.:Атомиздат, 1997 – 352 с.
Содержание
Введение 3
Глава 1. Использование воды в теплоэнергетике 4
Глава 2. Классификация природных вод и характеристика их примесей 8
Глава 3. Физико-химические показатели качества природных вод 10
Глава 4. Очистка воды методом коагуляции 15
Глава 5. Очистка воды методом известкования 22
Глава 6.Умягчение воды 29
Глава 7. Ионный обмен 35
Глава 8. Мембранные методы подготовки воды 57
Глава 9. Электрохимические методы 59
Глава 10. Обработка охлаждающей воды на ТЭС 67
Глава 11. Стоки электростанций и технологии их обезвреживания 72
Список литературы 80