ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ
ҒЫЛЫМ ЖӘНЕ БІЛІМ МИНИСТРЛІГІ
«Алматы энергетика және байланыс университеті»
Коммерциялық емес акционерлік қоғамы
Б.М.Сұлтанбаева, А.А.Тұманова
ХИМИЯ
Оқу құралы
Алматы 2012
УДК 54 (075.81)
ББК 24Я73
С89 Химия:
Оқу құралы / Б.М.Султанбаева, А.А.Туманова.
-Алматы: АЭЖБИ, 2011.- 80 б.
ISBN 978-601-7307-03-5
Оқу құралының материалы техникалық мамандықтар студенттерінің оқу стандартына сәйкес құрастырылған. Оқу құралына химия курсының негізгі бөлімдерінің теориялық материалдары: атом құрылысы және Д.И.Менделеевтің периодтық жүйесі, химиялық кинетика және химиялық тепе-теңдік, ерітінділер, электрохимиялық процестер, металдар коррозиясы және одан қорғау, сонымен қатар есептер мен жаттығулар енгізілген. Типтік есептерді шығарудың әдістемесі келтірілген. Студенттердің өзіндік жұмысына көп вариантты тапсырмалар ұсынылған.
Кестелер - 6, әдебиет тізімі 15 атаудан тұрады.
ББК 24Я73
Пікір берушілер: Сәтбаев ат.ҚазҰТУ, хим. ғыл. докторы Г.Д Елигбаева
АЭЖБУ, хим. ғыл.канд. Идрисова К.С.
Қазақстан республикасының білім және ғылым министрлігінің 2011 жылға баспа жоспары бойынша басылады.
ISBN 978-601-7307-03-5
© «Алматы энергетика және байланыс университеті» КЕАҚ, 2012 ж.
Кіріспе
«Химия» пәнінен оқу құралы Қазақстан республикасының білім және ғылым министрлігі бекіткен жоғары оқу орындарының техникалық мамандықтарының бағдарламасына сәйкес дайындалған.
Бұл оқу құралы оқытудың кредиттік жүйесінің өзгеше ерекшеліктерін ескере отырып жазылған. Мұнда кітаптың әдістемесі, құрылымы және мазмұны анықталды, оның негізінде студенттердің өзіндік жұмысын белсендіру, студенттерге химиялық ойлауды қалыптастыру, сондай-ақ нақты химия есептерін шешу үшін теориялық білімдерін өздігінше қолдану дағдыларын дамыту қағидалары жатыр.
Оқу құралында жоғары оқу орындары студенттеріне арналған химия курсының негізгі тақырыптары қарастырылды.
Әрбір тақырыптың мазмұны:
- берілген тапсырманы шешуге қажетті қысқаша теория;
- типтік есептерді шешу әдістемесі;
- өзіндік жұмыстың көпвариантты тапсырмалары.
Тапсырмалар көбінесе есеп түрінде берілген. Кейбір тапсырмалар теориялық материалды бекітуге арналған. Есептердің жауаптары келтірілген.
Оқу құралы химияның ең күрделі бөлімдерін оқып үйрену кезінде студенттердің белсенді өзіндік жұмысына көмектесуге арналған.
1 тақырып
Атом құрылысы. Химиялық элементтер периодтық жүйесі
1 Элементарлы бөлшектер және атом ядросы
Атом – химиялық элементтің химиялық қасиеттерін сақтайтын ең кіші бөлшегі. Атом оң зарядталған ядродан және оның айналасында электрондық қабат түзетін теріс зарядталған бөлшектер – электрондардан тұрады. Химиялық реакцияларда атом ядросы өзгермейді, ал электрондық қабат өзгереді. Атомның геометриялық мөлшері ядро диаметрімен емес ( ≈10-12см), электрондық қабат мөлшерімен анықталады (≈10-8 см). Бөлшек ретіндегі электронның тыныштықтағы массасы m0(ē) = 9,1·10-31 кг; теріс электрлік заряды q(ē) = 1,6·10-19 Кл. Электрон заряды ең кіші болғандықтан элементарлы деп аталады да шартты түрде 1-ге тең деп саналады.
Ядро одан кіші бөлшектер – нуклондардан тұрады. Нуклондардың екі түрі бар: протон (р+) және нейтрон (n0). Протон (р+) - оң зарядталған бөлшек (g(p+) = 1,6 · 10-19 Кл); оның тыныштықтағы массасы m0(p+) = 1,6726 · 10-27 кг. Нейтрон (n0) бейтарап бөлшек болып келеді және оның m0(n0) = 1,6749 · 10-27 кг.
Массаның атомдық бірліктерінде Аr(p+)
= Аr(n0) = 1м.а.б., Аr(![]() ) = 1/1837 м.а.б., мұнда Ar – салыстырмалы масса немесе
протонның, нейтронның және электронның массалық
саны. Іс жүзінде массаның атомдық бірлігі ретінде бір нуклонның
массасы алынған ( р+, n0 ). Электронның
массасы нуклондікінен 1837 есе кіші. Осы себептен атомның массасын ядро
массасы құрайды деп айтуға болады. Химиялық элемент
атомының массалық саны (Аr) ондағы нуклондар
санына тең (N):
) = 1/1837 м.а.б., мұнда Ar – салыстырмалы масса немесе
протонның, нейтронның және электронның массалық
саны. Іс жүзінде массаның атомдық бірлігі ретінде бір нуклонның
массасы алынған ( р+, n0 ). Электронның
массасы нуклондікінен 1837 есе кіші. Осы себептен атомның массасын ядро
массасы құрайды деп айтуға болады. Химиялық элемент
атомының массалық саны (Аr) ондағы нуклондар
санына тең (N):
![]() . (1.1)
. (1.1)
2 Атомның электрондық қабатының құрылымы
2.1 Электронның екі дайлылық табиғаты
Атомның электрондық қабаты – бұл әр қайсысында корпускулалық-толқындық сипаттамасы бар электрондардың жиынтығы:
1) бір жағынан, электронның бөлшек ретінде:
- массасы бар: m0(ē) = 9,1 · 10-31 кг;
- белгілі электрлік заряды бар: g(ē) = 1,6 · 10-19 Кл;
- белгілі жылдамдықпен қозғалады: υ(ē) = 3 · 108 м/сек.
2) екінші жағынан, электронның толқындық қасиеттері болады, өйткені белгілі жылдамдықпен қозғалатын бөлшекке λ ұзындығы бар толқын тән келеді. Бұл қасиет эксперименталдық жолмен дәлелденген (дифракция), ал толқын ұзындығын есептеу Луи де Бройль теңдеуіне негізделеді:
![]() ,
(1.2)
,
(1.2)
мұнда h – Планк тұрақтысы , h = 6,62 · 10-34 Дж ∙ с;
m – ē массасы;
![]() – ē қозғалу жылдамдығы.
– ē қозғалу жылдамдығы.
λ = 3 · 10-10 м.
Толқындық қасиеттері бар тез қозғалатын электрон ядро айналасындағы кез келген бөлігінде бола алады. Мұндай орналасулар теріс зарядтың белгілі тығыздығы бар электрондық бұлт ретінде қарастырылады. Атомдық орбиталь (АО) – бөлшек ретінде электронның болу ықтималдығы 90 % құрайтын атомдық ядро айналасындағы кеңістіктің көлемі, сонымен қатар толқын ретінде электрон зарядының 90 % - дық тығыздығы.
2.2 Квант сандары
Атомдық орбиталь кванттық сандар деп аталатын үш параметрмен сипатталады (n, l, ml). Кванттық сандар белгілі, дискретті (үзілісті) мәндерді ғана қабылдап, атомдық орбитальдің мөлшерін (n), пішінін (l) және ориентациялануын (ml) анықтайды.
Атомдық орбитальда орналасу кезінде электрон электрондық бұлтты түзеді. Бұл электрондық бұлттың пішіні бір атомдағы электрондарда әртүрлі болуы мүмкін. Электрондық бұлт төрт квант сандарымен сипатталады (n, l, ml және ms).
1) Бас квант саны n сипаттайды:
- ē-ның атомдағы энергиясын;
- электрондық бұлт мөлшерін.
n 1-ден ∞-ке дейін бүтін сандар мәндерін қабылдайды (іс жүзінде 1-ден 7-ге дейін, периодтық жүйедегі периодтар санына сәйкес келеді).
n энергетикалық деңгейлер (электрондық қабаттар) санына дәл келеді.
Бас квант саны, n: 1 2 3 4 5 6 7.
Энергетикалық деңгейлердің белгіленуі: K L M N O P Q.
Энергетикалық күй n энергетикалық деңгей деп аталады. ē ядродан негұрлым алыс орналасқан сайын, электрондық бұлт мөлшері соғұрлым үлкен болады. n мәні артқан сайын ē энергиясы да артады.
2) Орбитальдік квант саны l сипаттайды:
- энергетикалық деңгейшедегі ē энергиясын;
- электрондық бұлт пішінін;
- l 0-ден (n-1)-ге дейінгі мәндерді қабылдайды.
Әрбір энергетикалық деңгей деңгейшелерден тұрады. Сондықтан электронның энергетикалық күйі l энергетикалық деңгейше деп аталады.
Орбитальдік квант саны l : 0 1 2 3 4 5.
Деңгейшенің белгіленуі: s p d f g h.
Деңгейшелер саны деңгей нөміріне тең болады.
n l
энергетикалық энергетикалық деңгейшелер деңгейше
деңгей деңгейше саны аталуы
1 0 1 s-деңгейше
2 0 1 2 s-, p-деңгейше
3 0 1 2 3 s-, p-, d-деңгейше
4 0 1 2 3 4 s-, p-, d-, f-деңгейше
s – электрондық бұлттар пішіні шар тәрізді;
p – электрондық бұлттар пішіні гантель тәрізді;
d – электрондық бұлттар пішіні гүл күлтелері тәрізді болады.
3) Магнит квант саны ml сипаттайды:
- атомдық орбитальдің кеңістікте ориентациясын;
- – l-ден + l-ге дейін бүтін сандар мәндерін қабылдайды (нөлді қоса).
s-, p-, d-, f-электрондарға сәйкес келетін орбитальдар (квант ұяшықтары) санын анықтайық:
Деңгейшелер Орбитальдік Магнит Орбитальдар
квант саны, ℓ квант саны, m (квант ұяшықтарының саны)
 |
s–электрондық бұлттардың симметриясы шар тәрізді болып келеді де атомдық кеңістікте бір ғана ориентациясы болады (1 квант ұяшығы).
 |
p–электрондық бұлттардың атомдық кеңістікте орналасуының үш түрі (ориентациясы) болады. Оның сұлбасы үш квант ұяшықтары түрінде көрсетіледі.
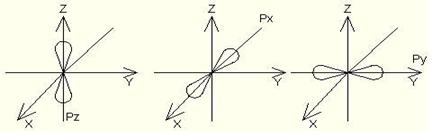 |
d–электрондық бұлттардың атомдық кеңістікте бес ориентациясы болады (бес квант ұяшықтары).
4) Спин квант саны ms электронның (ē) өз осінің айналасында айналуын сипаттайды. Паули қағидасына сәйкес атомдағы электрондардың кем болмаса бір квант санының мәні өзгеше болуы қерек. Осы себептен атомдық орбитальда спиндері қарама-қарсы (ms = +1/2; -1/2) болатын екі ғана электрон болуы мүмкін.
Типтік есеп № 1
Электрондық құрылымы 1s22s22p1 атомы үшін негізгі күйдегі әрбір электронды анықтайтын төрт кванттық сандар n, l, ml, ms мәндерін табыңыз.
Шығарылуы
Электрондық құрылымы 1s22s22p1 болатын элемент – бор. Бор атомы электрондары үшін квант сандарының мәндерін Паули қағидасын негізге алып анықтау қажет. Бұл қағидаға сәйкес, бір атомдағы екі электронның төрт квант сандарының төртеуі де бірдей болмайды.
Бор атомының 1-ші энергетикалық деңгейінде
s –күйіндегі екі электрон бар. Бұл электрондар квант
сандарының келесі мәндерімен сипатталады: 1, 0, 0,
![]() 1/2.
1/2.
s – күйіндегі 2-ші энергетикалық
деңгейіндің электрондарының квант сандарының
мәндері: 2, 0, 0, ![]() 1/2.
1/2.
2, 1, -1, +1/2 квант сандарының мәндері 2-ші энергетикалық деңгейіндің р – күйіндегі электрондарын сипаттайды. Бор атомының бес электронының квант сандарының мәндері келесі болады:
|
Квант саны |
электрон |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
n |
1 |
1 |
2 |
2 |
2 |
|
l |
0 |
0 |
0 |
0 |
1 |
|
ml |
0 |
0 |
0 |
0 |
-1 |
|
ms |
+1/2 |
-1/2 |
+1/2 |
-1/2 |
+1/2 |
3 Атомның электрондық формулалары
Электрондық формулалар атомдағы электрондардың энергетикалық деңгейлерде, деңгейшелерде (атомдық орбитальдарда) таралуын көрсетеді. Электрондық конфигурация символдар топтарымен белгіленеді:
![]() , (1.3)
, (1.3)
мұнда n - бас квант саны;
l - орбитальдік квант саны (оның орнына сәйкесінше әріппен белгіленетін s, p, d, f қолданылады );
х - берілген деңгейшедегі (орбитальдегі) электрондар саны.
Электрондық формуладағы үлкен араб сандары энергетикалық деңгейлерді (n), s, p, d, f әріптері энергетикалық деңгейшелерді, ал кіші араб сандары (х) әрбір энергетикалық деңгейшедегі электрондар санын сипаттайды.
Электрондық формуланы құрастырғанда электрондардың атомдық орбитальдар бойынша орналасуының қағидаларын ескеру қажет.
1) Паули қағидасы: атомда төрт кванттық сандарының төртеуі де бірдей екі электрон болуы мүмкін емес.
2) Минималды энергия қағидасы: атомдағы әрбір электрон ядромен мықты байланыс беретін ең төменгі энергиясы бар бос орбитальда орналасады.
Элементтің реттік нөмірі өскен сайын электрондар орбитальдар мен деңгейлерді энергияларының өсу ретімен толтырады. Минималды энергия қағидасы атомдардың тек негізгі күйлері үшін орындалады. Қозыған күйлерінде электрондар атомдардың кез келген орбитальдарында болуы мүмкін (Паули қағидасы орындалса).
3) Клечковский ережесі: энергияның артуы және орбитальдерді толтыру (n + l) квант сандары қосындысының өсу реті бойынша жүреді. Егер (n + l) қосынды мәні бірдей бірнеше деңгейшелер болса, онда алдымен бас квант санының кіші мәніндегі деңгейше электрондармен тола бастайды
Бұл ережеге сәйкес энергетикалық деңгейшелердің электрондармен толтырылу реттілігі келесі болады: 1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p < 7s және т.б.
Толық және жарым-жартылай толтырылған деңгейшелері бар d-, f- элементтер ерекше болады, өйткені оларда электрон ns –деңгейшесінен
(n-1)d -, (n-2)f –деңгейшесіне «секіреді».
Мысалы, хром атомының электрондық формуласы келесі болуы керек:
1s22s22p63s23p63d44s2.
Бірақ, хром атомының соңғы деңгейінде 2 электрон емес, бір электрон болады. Ал екінші электрон алдындағы деңгейдің d –деңгейшесіне, яғни (n-1) d –деңгейшесіне «секіріп кетеді». Хром атомының электрондары келесідей орналасады: 1s22s23s23p63d54s1.
Электронның «секіруі» Cu, Nb, Mo, Ru, Rh, Ag, Au, Pt элемент атомдарында байқалады. Палладий (Pd) электрондары былай орналасады: 2, 8, 18, 18, 0 (берілген жағдайда бесінші энергетикалық деңгей болмайды – электронның екеуі де көрші деңгейге «секіріп кетті»).
Электронның «секіруі» энергетикалық жағынан тиімді болады, өйткені тұрақтылығы жоғарырақ электрондық конфигурациялар түзіледі.
4) Гунд ережесі: берілген энергетикалық деңгейшедегі (p, d, f) электрондардың спин сандарының қосындысы максималды болуы шарт. Бұл жағдайда атом тұрақты күйде болады.
Яғни, бір энергетикалық деңгейшедегі атомдық орбитальдардың электрондармен толтырылуы былай жүреді: алдымен әрбір атомдық орбитальға спиндері параллельді болатын бір-бір электроннан, одан кейін спиндері қарама-қарсы болатын электрондар орналасады.
Атомның электрондық құрылымын атомдық орбитальдардың (АО) сұлбасы болып келетін электрондардың кванттық ұяшықтар бойынша орналасуының сұлбалары түрінде көрсетуге болады. Квант ұяшығын тік бұрыш, дөңгелек немесе сызық түрінде белгілейді, ал бұл ұяшықтардағы электрондарды тілмен (стрелкамен) белгілейді.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Әрбір квант
ұяшығында қарама-қарсы синдері бар екі ғана
электрон болуы мүмкін:
Әрбір квант
ұяшығында қарама-қарсы синдері бар екі ғана
электрон болуы мүмкін:
, ,
Типтік есеп № 2
Ванадий атомы электрондарын ( Z = 23) кванттық ұяшықтар бойынша орналастырыңыз.
Шығарылуы
Әрбір элемент атомындағы электрондар саны оның Д. И. Менделеев кестесіндегі реттік нөміріне тең. Ванадий төртінші периодта орналасқан. Электрондық формуласы келесі: 23V 1s22s22p63s23p63d34s2.
Атомның электрондық қауызының құрылымын электрондардың кванттық ұяшықтар бойынша таралу сұлбасы түрінде көрсетейік:
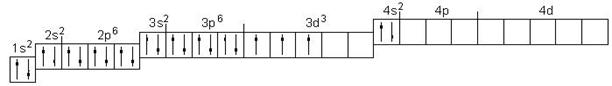
Электрондармен толтырылмаған ұяшықтар вакантты (бос) деп аталады. 3d3 деңгейшесін екі вариантта көрсету мүмкін:
![]()
Бірақ, Гунд ережесіне сәйкес болатын вариант дұрыс болып саналады: берілген энергетикалық деңгейшеде электрондар параллельді спиндері бар жұп емес электрондар саны максималды болатындай орналасады, немесе берілген деңгейшеде электрондардың спин сандарының қосындысы (Σms) максималды болуы қажет.
Бірінші вариантта: Σ ms = +1/2 +1/2 +1/2 = 3/2;
Екінші вариантта: Σ ms = +1/2 - 1/2 +1/2 = 1/2.
Гунд ережесіне бірінші вариант сәйкес келеді.
4 Элементтер периодтық жүйесінің құрылымы
Д. И. Менделеевтің периодтық заңының қазіргі кездегі тұжырымдамасы: жай заттың қасиеті, сол сияқты элементтер қосылыстарының қасиеті мен пішіні (формасы) атом ядросының зарядына (реттік нөміріне) периодтық тәуелділікте болады.
Период деп қасиеттері жүйелі (ретті) өзгеретін элементтер қатарларын айтады. Олар 7: бірінші, екінші және үшінші периодтар – кіші, ал төртінші, бесінші, алтыншы және жетінші – үлкен периодтар деп аталады.
Екінші және үшінші периодтар элементтерін Д.И.Менделеев типтік деп атады. Бұл элементтердің қасиеттері типтік металдан инертті элементке дейін заңдық түрде өзгереді.
Алтыншы периодта реттік нөмірлері 58-ден 71-ге дейін лантаноидтар деп аталатын 14 элемент орналасқан. Олардың қасиеттері лантанға өте ұқсас (тотығу дәрежесі +3, Н2О-мен әрекеттескенде Ме(ОН)3 пен Н2 түзеді).
Жетінші периодтың басталуы мен аяқталуы алтыншы периодқа сәйкес келеді, бірақ оның құралуы әлі аяқталмаған. Мұнда да d- элементтер мен актиноидтар деп аталатын он төрт 5 f- элементтер бар. Қазіргі кезде 110 элемент белгілі, оның ішінде жеті 6 d-элемент бар.
Атомның электрондық құрылымы тұрғысынан ең соңғы электрон қай энергетикалық деңгейшеде орналасуына байланысты, элементтердің барлығын электрондық ұяшықтардың төрт типіне бөледі: s-, p-, d-, f- элементтерге.
Периодтық жүйенің вертикаль қатарында топтар орналасады. Оларды А және В әріптері бар рим сандарымен белгілейді: А – негізгі топша, В – қосымша топша.
Периодтық жүйедегі элемент тобының нөмірі атомдар валентті электрондарының санымен анықталады (IB және VIIIB топтары элементтерінен басқалары).
|
Валентті электрондар |
ns |
n(s+p) |
ns + (n-1)d жұптаспаған ē |
|
Элемент типі |
s |
p |
d |
Валенттік электрондар деп атомдар арасында химиялық байланыстарды түзуге қатысатын электрондарды айтады. Бұл электрондар ядромен өте әлсіз байланысады.
Атомдар құрылымы мен элементтің Периодтық жүйеде орналасуының арасында келесі өзара байланысы:
1) Бір периодтағы барлық элементтер атомдарында энергетикалық деңгейлердің саны бірдей болады. Период нөмірі атомдағы энергетикалық деңгейлер санын және ең үлкен энергетикалық деңгейдің бас квант санының мәнін көрсетеді. Барлық белгілі элементтер атомдарында толығымен немесе жарым-жартылай жеті энергетикалық деңгей толтырылуына байланысты периодтық жүйеде жеті период бар.
2) Бір топтың элементтер атомдарында электрондық конфигурациясы бір типті және химиялық қасиеттері ұқсас болады. Топтардың А және В топшаларына бөлінуі элемент атомының қай энергетикалық деңгейі (ішкі немесе сыртқы) толтырылуына байланысты болады.
s- және p-элементтердің барлығы А-топшалары элементтеріне жатады, өйткені олардың атомдарында сыртқы энергетикалық деңгей толтырылады; d- және f-элементтер атомдарында ішкі энергетикалық деңгей толтырылуына байланысты барлығы В-топшаларында орналасады.
3) Әрбір периодта, төртіншіден бастап, s- және p- элементтер секциясы d – элементтер секциясымен бөлінген (алтыншы және жетінші периодтарда мұнымен қатар f – элементтер секциясы қосылады). Осы себептен d – элементтерді жиі ауыспалы деп атайды.
Типтік есеп № 3
Атомның электрондық құрылымы тұрғысынан марганец элементінің реттік нөмірі мен оның периодтық жүйеде орналасуына дәлелдеме беріңіз.
Шығарылуы
Марганец элементінің реттік нөмірі N(Mn) = 25. Бұл сан атом ядросының оң зарядына, атом ядросындағы протондар санына, атомдағы электрондар санына сәйкес келеді. Марганец атомы бейтарапты, өйткені ядродағы протондардың сомарлы заряды атомдағы электрондардың сомарлы зарядына тең, бірақ таңбалары қарама-қарсы болады.
Марганец элементі 4-ші периодта орналасқан, яғни марганец атомының 25 электрондары төрт энергетикалық деңгейлерде үлестірілген. Атомның электрондық формуласы келесі: 1s22s22p63s23p63d54s2.
Марганец элементі VII топқа жататындықтан, валентті электрондар саны 7-ге тең (яғни 3d54s2).
В топшасы (қосымша топша) соңғы 25-ші электрон алдыңғы (n - 1) – ші энергетикалық деңгейде орналасуын көрсетеді (n = 3).
Соңғы электрон алдыңғы энергетикалық деңгейдіің d-деңгейшесінде орналасуына байланысты, марганец элементі d – электрондық ұяшыққа жатады:
|
n = 3 |
|
|
|
|
|
|
|
|
n = 4 |
¯ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d-деңгейшесі s-деңгейшесі
5 Элементтер атомдарының қасиеттері және олардың өзгеруінің мерзімділігі
Периодтық жүйеде элементтер қасиеттері, олардың атомдық массасы, валенттілігі, химиялық сипаты горизонталды және вертикалды бағыттарда мезгілмен өзгереді.
1) Атомдық және иондық радиустар.
Радиус – атомның ең негізгі қасиеті. Электрондарының екідайлылығына байланысты атомдардың дәлме-дәл анықталған шектері болмайды. Осы себептен атом радиусының абсолюттік мәнін анықтау мүмкін емес. Атом радиусына тек шартты түрде жатады:
а) атомның орбитальдік радиусы – ең алыстағы электрондық тығыздылық максимумынан ядроға дейін ара қашықтықтың теориялық есептелген мәні; орбитальдік радиус бос атомның немесе ионның сипаттамасы болып, химиялық байланыс табиғаты және басқа факторларға тәуелді емес;
б) атомның эффективті радиусы, rэф – жай заттардың құрамына кіретін атомдар радиусы. Атомның сыртқы деңгейінен электрон бөлінгенде атомның эффективті радиусы азаяды, ал қосылғанда - атомның эффективті радиусы артады.
Бір периодтың ішінде Z артқан сайын атом мөлшері азаяды. Оны заряд артқан сайын сыртқы қабат электрондарының ядроға тартылуының артуымен түсіндіруге болады. Топтарда жоғарыдан төмен қарай атомдық радиус жаңа энергетикалық деңгейлердің түзілуіне байланысты артады.
2) Металдар мен бейметалдар.
Периодтық жүйенің барлық элементтерін шартты түрде металдарға және бейметалдарға бөледі. Бейметалдық элементтерге жатады: Не, Ne, Ar, Kr, Xe, Rn, F, CI, Br, I, At, O, S, Se, Te, B, N, P, As, C, Si, H. Қалғандарының барлығы металдарға жатады.
Периодтық жүйеде элементтер қасиеттерінің өзгеруінің шектері анық байқалады. I-А тобына типтік металдар кіреді, VIII-A топ элементтері (инертті газдар) – типтік бейметалдар, аралық топтар бейметалдар (элементтер кестесінің жоғарғы жағы) мен металдардан (элементтер кестесінің төменгі жағы) тұрады.
Металдар мен бейметалдардың арасындағы тағы бір шегі – диагональды шек - Be – AI – Ge – Sb – Po элементтеріне сәйкес келеді. Осы шектің бойында жататын және шектесіп жататын элементтер амфотерлі қасиеттерге ие, яғни металдық және бейметалдық қасиеттерге.
3) Иондану энергиясы.
Иондану энергиясы J, [кДж/моль] – негізгі күйіндегі
элемент атомынан ең әлсіз байланысқан электронды
![]() үзіп алу үшін қажетті минималды энергия:
үзіп алу үшін қажетті минималды энергия:
Э + J → Э+ +
![]() .
.
Электронның үзілуі өтетін электр өрісінің ең төменгі кернеуін иондану потенциалы деп атайды. Иондану потенциалының мөлшері элементтің металдық қасиетке қаншама ие екендігін көрсетеді: иондану потенциалының мөлшері негұрлым аз болса, соғұрлым электронды атомнан үзіп алу оңай болады да элементтің металдық қасиеттері соғұрлым жоғары болады.
4) Электронға тартқыштық.
Электронға тартқыштық - атомның теріс зарядталған иондарды түзуге қабілеттілігі Е, [кДж/моль]. Яғни бейтарап атомға электронды қосу арқылы элемент атомын теріс зарядталған ионға айналдыру процесінің энергетикалық эффекті:
Э + ![]() → Э- + E.
→ Э- + E.
Электронға тартқыштық энергиясы элементтердің бейметалдық және жанама тотықтырғыш қасиеттерінің мөлшері болып табылады. Электронға тартқыштықтың ең үлкен мәні VII топтың р-элементтеріне сәйкес келеді.
5) Электртерістілік.
Электртерістілік(![]() ) –
қосылыстың
құрамындағы басқа элементтерімен салыстырғанда
берілген элемент атомының электрондық тығыздықты
өзіне қарай тарту қабілеттілігі, элементтердің
металдық және бейметалдық қасиеттерінің
толық сипаттамасы.
) –
қосылыстың
құрамындағы басқа элементтерімен салыстырғанда
берілген элемент атомының электрондық тығыздықты
өзіне қарай тарту қабілеттілігі, элементтердің
металдық және бейметалдық қасиеттерінің
толық сипаттамасы.
Электртерістілік келесі факторларға тәуелді: электрондық құрылымға, ваканттық орбитальдерге, атомдардың саны мен түріне. Әр түрлі элементтердің салыстырмалы электртерістіліктерінің мәндерін анықтауда бірлігі ретінде литийдің электртерістілігі қолданылады.
Анықтамалардың біреуіне сәйкес
(Малликен) атомның![]() иондану энергиясы мен электронға
тартқыштықтың қосындысының жартысына тең
болады:
иондану энергиясы мен электронға
тартқыштықтың қосындысының жартысына тең
болады:
![]() . (1.4)
. (1.4)
Электртерістілік мәні неғұрлым жоғары
болса, соғұрлым элементтің бейметалдық қасиеттері
де артады. Ең үлкен электртерістілік мәні фторда (![]() = 4,0); ең төмені – цезийда, францийда (
= 4,0); ең төмені – цезийда, францийда (![]() = 0,7). Металдардың
= 0,7). Металдардың
![]() мәні ≈ 1,8 және одан да төмен болады.
мәні ≈ 1,8 және одан да төмен болады.
Типтік есеп № 4
(4s24p64d25s2) атомының n – және (n – 1) –энергетикалық деңгейінің электрондық құрылымы бойынша электрондық ұяшықтың типін анықтап, бұл элементтің максималды тотығу дәрежесіндегі оксидінің химиялық формуласын жазыңыз.
Шығарылуы
Берілген элемент атомында (n-1) – энергетикалық деңгейдің d –деңгейшесі электрондармен толтырыла бастады. Сондықтан бұл элемент - d – элемент.
|
|
N = 4 |
¯ |
|
¯ |
¯ |
¯ |
|
|
|
|
|
|
; n = 5 |
¯ |
Бұл элемент атомында 5 энергетикалық деңгей бар болғандықтан ол 5-ші периодқа жатады. Сыртқы және оның алдыңғы энергетикалық деңгейлердегі төрт валентті электрон элементтің IVB тобына жататынын көрсетеді. Периодтық жүйеде бұл орналасуға цирконий Zr элеметі сәйкес келеді.
Берілген электрондық формула бойынша атомда 4 валентті электрон бар (4d25s2), бұл элементтің +4 максималды тотығу дәрежесін көрсетеді. Сәйкесінше оксидтің формуласы былай жазылады: ZrO2.
6 Өзіндік жұмыс тапсырмалары
6.1 «б» массалық сандары бар «а» атом изотоптары ядроларындағы протондар мен нейтрондар санын анықтаңыз .
6.2 «в» электрондық құрылымы бар атом үшін соңғы электронды анықтайтын төрт кванттық сандардың (n, l, ml, ms) мәндерін табыңыз.
6.3 «г» элемент атомының электрондарын кванттық ұяшықтарына орналастырыңыз.
6.4 Атомның электрондық құрылымы көзқарасынан «д» элементтің реттік нөміріне, период нөміріне, топ нөміріне, Периодтық жүйеде А немесе В тобында орналасуына дәйектеме беріңіз.
6.5 Элемент атомының сыртқы және оның алдындағы деңгейінің түрі «е»-ға сәйкес. Бұл элемент қай электрондық ұяға жатады? Берілген элементтің максималды тотығу дәрежесіндегі оксидінің формуласы қандай?
|
Вт |
«а» |
«б» |
«в» |
«г» |
«д» |
«е» |
|
1 |
Zn |
65 және 66 |
1s22s2p2 |
Be |
Na |
4s2p6d25s2 |
|
2 |
Ca |
42 және 40 |
1s22s2p4 |
Mn |
Li |
2s2p63s2p1 |
|
3 |
K |
39 және 41 |
1s22s2p63s2 |
B |
V |
1s22s2p1 |
|
4 |
В |
10 және 11 |
1s22s2p63s2p2 |
Al |
Ca |
3s2p6d14s2 |
|
5 |
Sr |
87 және 88 |
1s22s2p63s2p4 |
C |
Ba |
5s2p6d16s2 |
|
6 |
Ba |
136 және 138 |
2s2p63s2p6d2 |
Si |
Sr |
3s2p6d24s2 |
|
7 |
С |
12 және 13 |
2s2p63s2p6d4 |
P |
Cs |
3s2p6d34s2 |
|
8 |
Sn |
116 және 118 |
2s2p63s2p6d104s2 |
S |
Rb |
4s2p6d35s2 |
|
9 |
N |
14 және 15 |
3s2p6d104s2p2 |
Cs |
Mn |
3s2p6d54s2 |
|
10 |
О |
16 және 18 |
3s2p6d104s2p4 |
Br |
Be |
4s2p65s2 |
|
11 |
Al |
26 және 27 |
3s2p6d104s2p65s2 |
Ge |
Al |
4s2p6d55s2 |
|
12 |
Ga |
68 және 70 |
3s2p6d104s2p65s1 |
Sn |
Br |
1s22s2p2 |
|
13 |
Br |
79 және 81 |
3s2p6d104s2p5 |
Ni |
Fe |
2s2p63s2p2 |
|
14 |
Tс |
97 және 98 |
3s2p6d104s2p3 |
Mg |
Co |
4s2p6d105s2p1 |
|
15 |
O |
16 және 18 |
3s2p6d104s2p1 |
B |
K |
5s2p6d106s2p2 |
|
16 |
Si |
28 және 30 |
2s2p63s2p6d104s1 |
As |
F |
1s22s2p3 |
|
17 |
СI |
35 және 37 |
1s22s2p63s2p6d5 |
Ga |
Mo |
2s2p63s2p3 |
|
18 |
S |
32 және 33 |
1s22s2p63s2p6d3 |
C |
Zn |
3s2p6d104s2p3 |
|
19 |
V |
50 және 52 |
1s22s2p63s2p6d1 |
Si |
Cl |
4s2p6d105s2p3 |
|
20 |
Ni |
58 және 60 |
1s22s2p63s2p5 |
Ge |
Pb |
2s2p63s2p4 |
|
21 |
Fe |
55 және 56 |
1s22s2p63s2p3 |
Sb |
Sn |
3s2p6d104s2p4 |
|
22 |
Ge |
72 және 73 |
1s22s2p63s2p1 |
Pb |
Ni |
4s2p6d105s2p4 |
|
23 |
Sb |
121 және 122 |
1s22s2p63s1 |
S |
N |
2s2p63s2p5 |
|
24 |
Cr |
51 және 52 |
1s22s2p5 |
Cl |
O |
3s2p6d104s2p5 |
|
25 |
Ti |
47 және 48 |
1s22s2p3 |
Br |
S |
2s2p63s2p2 |
2 тақырып
Химиялық кинетика. Химиялық тепе-теңдік
Химиялық кинетика химиялық реакция жылдамдығы мен оның өту механизмін зерттейді.
1 Химиялық реакция жылдамдығы туралы түсінік
Химиялық реакция жылдамдығы деп әрекеттесуші бөлшектердің бірлік уақытындағы қолайлы соқтығысулар санын айтады. Кез келген химиялық реакция – бір заттардан басқа заттар түзілетін сапалы өзгеру.
Әрекеттесуші заттардың әрекеттесуіне қарай реакциялар гомогенді және гетерогендіге бөлінеді.
Гомогенді реакцияларда әрекеттесуші заттардың арасында бөлу беті болмайды, яғни заттар бір фазалық күйде (қатты, сұйық, газ күйінде) болады; процесс жүйенің бүкіл көлемінде жүреді.
Гомогенді химиялық реакцияның жылдамдығы зат концентрациясының уақыт бірлігінде өзгеруімен анықталады, өлшем бірлігі - моль /л × с.
![]() , (2.1)
, (2.1)
мұнда ![]() -
х заты мөлшерінің
өгеруі ,
-
х заты мөлшерінің
өгеруі , ![]() ;
;
![]() - уақыттың
өзгеруі,
- уақыттың
өзгеруі, ![]() ;
; ![]() - жүйе
көлемі.
- жүйе
көлемі.
![]()
![]() ,
(2.2)
,
(2.2)
мұнда
![]() - зат концентрациясының өзгеруі
- зат концентрациясының өзгеруі ![]() ,
,
![]() .
.
Гетерогенді реакцияларда әрекеттесуші заттардың арасында бөлу беті болады, яғни заттардың фазалық күйлері әр түрлі болады; процесс реагенттердің арасындағы фазалардың бөлу бетінде жүреді.
Гетерогенді реакцияның жылдамдығы фазалардың бөлу бетіндегі реакция заты мөлшерінің уақыт бірлігінде өзгеруімен анықталады.
![]() =
=
![]() ,
(2.3)
,
(2.3)
мұнда ![]() –
реагенттер арасындағы фазалар бөлу беті
арасындағы аудан.
–
реагенттер арасындағы фазалар бөлу беті
арасындағы аудан.
Реакция механизмі бойынша жай және күрделі реакцияларды ажыратады.
Жай реакциялар деп «элементарлы» немесе бір стадияда өтетін реакцияларды айтады.
Күрделі деп бірнеше стадиядан өтетін реакцияларды айтады. Күрделі реакциялардың химиялық теңдеулерінде олардың өтуінің толық көрінісі емес, тек бастапқы заттар (реагенттер) мен процестің соңғы өнімдері бейнеленеді.
Мысалы,
H2 + I2 ![]() 2HI реакциясы бірнеше
стадияда өтеді:
2HI реакциясы бірнеше
стадияда өтеді:
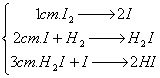 (аралық белсендірілген кешен),
(аралық белсендірілген кешен),
H2
+ I2 ![]() 2HI (қосынды теңдеуі).
2HI (қосынды теңдеуі).
Химиялық реакция жылдамдығына әсер ететін негізгі факторлар: әрекеттесуші заттар табиғаты, концентрациясы, қысым (егер реакцияға газ қатысса), температура, катализатор, фазалар бөлу бетінің ауданы (гетерогенді реакцияларда).
2 Әрекеттесуші заттар концентрациясының әсері
Элементарлы реакциялар үшін Гульдберг пен Вааге ашқан әрекеттесуші массалар заңы тура келеді: тұрақты температурада элементарлы гомогенді химиялық реакцияның жылдамдығы реакция теңдеуіндегі стехиометриялық коэффициенттерге тең болатын дәрежелердегі әрекеттесуші заттар концентрациялардың көбейтіндісіне тура пропорционал болады.
Егер реакция көп стадиялы механизм бойынша жүрсе және стадияның біреуі басқаларымен салыстырғанда баяу жүрсе, процестің жылдамдығын осы стадия анықтайтындықтан оны лимиттеуші стадия деп атайды.
Реакция жылдамдығын әрекеттесуші заттар концентрациясымен байланыстыратын теңдеуді реакцияның кинетикалық теңдеуі деп атайды.
![]()
жалпы түрінде жазылған элементарлы реакциясының кинетикалық теңдеуі
былай жазылады:
![]() ,
(2.4)
,
(2.4)
мұнда ![]() – әрекеттесуші
заттар молярлы концентрациялары;
– әрекеттесуші
заттар молярлы концентрациялары;
![]() – әрекеттесуші заттар стехиометриялық
коэффициенттері;
– әрекеттесуші заттар стехиометриялық
коэффициенттері;
![]() – пропорционалдық
коэффициент, жылдамдық тұрақтысы.
– пропорционалдық
коэффициент, жылдамдық тұрақтысы.
Жылдамдық тұрақтысының физикалық мағынасы келесі:
егер ![]() болса, .
болса, .![]()
Реакцияның жылдамдық тұрақтысы ![]() әрекеттесуші
заттар табиғатына, температураға, катализатор қатысына
және фазалардың бөлу бетінің ауданына (егер реакция
гетерогенді болса) тәуелді, бірақ реагенттердің
концентрациясына тәуелді емес. Әр бір реакция үшін
тұрақты температурада оның жылдамдық
тұрақтысы тұрақты шама болады.
әрекеттесуші
заттар табиғатына, температураға, катализатор қатысына
және фазалардың бөлу бетінің ауданына (егер реакция
гетерогенді болса) тәуелді, бірақ реагенттердің
концентрациясына тәуелді емес. Әр бір реакция үшін
тұрақты температурада оның жылдамдық
тұрақтысы тұрақты шама болады. ![]() мәнін біле тұра әр түрлі заттардың
химиялық әрекеттесуінің жылдамдықтарын
салыстыруға болады: k неғұрлым жоғары болса, берілген
заттар соғұрлым жылдам әрекеттеседі.
мәнін біле тұра әр түрлі заттардың
химиялық әрекеттесуінің жылдамдықтарын
салыстыруға болады: k неғұрлым жоғары болса, берілген
заттар соғұрлым жылдам әрекеттеседі.
Әрекеттесуші массалар заңында қатты күйдегі әрекеттесуші заттар, сонымен қатар реакция өту кезінде іс жүзінде концентрациялары өзгермейтін артық мөлшердеғі сұйықтықтар есепке алынбайды.
Химиялық реакциялардың молекулалығы және реакция реті бойынша келесі кинетикалық жіктелуі болады.
Химиялық реакцияның молекулалығы (М) элементарлы актке қатысқан молекулалар санымен анықталады.
Молекулалығы бойынша реакцияларды былай ажыратады:
а) мономолекулалы – элементарлы актке бір молекула қатысады:
А → В, А → В + Д…;
мұндай реакциялардың кинетикалық теңдеуі келесі: υ = k · c;
б) бимолекулалық реакциялар – элементарлы актке бірдей немесе әр түрлі екі молекула қатысады:
А + В → Д , 2А → Д + С…,
кинетикалық теңдеуі: υ = k · c1 · с2;
в) үшмолекулалы реакциялар – элементарлы актке үш молекула қатысады: А + В + С → Д , 2А + В → С …,
кинетикалық теңдеуі: υ = k · c1 · с2 · с3 .
Төрт және одан да көп молекулалы реакциялардың болу мүмкіндігі нөлге тең.
Химиялық кинетикада реакциялардың молекулалығы мен қатар реакцияның реті (n) түсінігін енгізеді. Химиялық реакцияның жалпы реті және бөлек реагент бойынша реті реакцияның кинетикалық теңдеуімен анықталады және бұл теңдеудегі концентрациялардың дәрежелерінің көрсеткіштерінің қосындысына тең. Бірінші ретті реакциялар үшін υ = k · c , екінші ретті реакциялар үшін υ = k · c1 · с2 . Кейбір жағдайларда реакцияның реті бөлшек санмен көрсетіледі (бірнеше стадияда өтетін реакциялар үшін) немесе нөлге тең болады (қатты заттар бетінде өтетін реакциялар үшін).
1 кесте – Химиялық реакция жылдамдығы теңдеулерін өрнектеу мысалдары
|
Химиялық реакция |
Кинетикалық теңдеу |
Реакция реті |
|
2А(Қ) + 2В(ag) = С А(Г) + Д(Қ) = В А(С) арт = Г 2А(г) + В(г) = С күрделі реакция |
υ = k · c2(В) υ = k · c (А) υ = k υ = k · c2(А) · с(В) |
n = 2, II-ші ретті реакция n = 1, I-ші ретті реакция n = 0, нөлдік ретті реакция n = 3, III-ші ретті реакция |
Реакция элементарлы (бір стадиялы) және гомогенді болса сандық жағынан реакцияның молекулалығы мен реті бір біріне тең болады. Реакцияның күрделі механизмінде олар бір біріне тең болмайды.
Типтік есеп №1
2NО(г) + О2(г) = 2NО2(г) химиялық реакциясы үшін молекулалығы мен ретін анықтап, реагенттер концентрациясын 3 есе арттырса реакция жылдамдығы қанша есе өзгеретінін есептеңіз.
Шығарылуы
а) Реакцияның молекулалығын анықтайық (М). Реакцияның стехиометриялық теңдеуінен химиялық әрекеттесу актіне бір кезде бірге үш молекуланың соқтығысуы әкелетіні көрініп тур (NО затының екі молекуласы мен О2-нің бір молекуласы), сондықтан бұл реакция үшмолекулалыға жатады, М = 3.
б) Реакцияның ретін анықтау үшін (n) әрекеттесуші массалар заңын қолданып, реакция жылдамдығы теңдеуін шығарамыз (2.4):
υ = k · c2(NO) · c(O2)
Берілген реакция үшінші реттіге жатады (n = 3), өйткені реагенттер концентрацияларының дәреже көрсеткіштерінің қосындысы 3-ке тең (2 + 1).
в) Реакция жылдамдығы қаншама өзгеретінін есептейік. Реакция жылдамдықтарының кинетикалық теңдеулерін жазайық:
υ1 = k · c2(NO) · c(O2), υ2 = k · (3c)2(NO) · 3c(O2) ;
![]() =
27.
=
27.
Жауабы: Реакция жылдамдығы 27 есе артады.
3 Реакция жылдамдығына температураның әсері
Көптеген тәжірибелер температураны жоғарлатқанда көпшілік химиялық реакциялардың жылдамдығы елеулі артатынын көрсетеді. Реакция жылдамдығының температураға тәуелділігі Вант-Гофф ережесімен анықталады: температураны әрбір 10 градусқа жоғарлату көптеген реакциялардың жылдамдығын 2 – 4 есе арттырады.
Математикалық тұрғыдан бұл тәуелділік келесі қатынаспен өрнектеледі:
![]() , (2.5)
, (2.5)
мұнда ![]() - бастапқы
- бастапқы ![]() және
соңғы
және
соңғы ![]() температураларда
сәйкесінше реакция жылдамдықтары,
температураларда
сәйкесінше реакция жылдамдықтары, ![]() ;
;
g - реакция жылдамдығының температуралық коэффициенті:
![]() . (2.6)
. (2.6)
Температуралық коэффициенттің физикалық
мағынасы: ![]() температура 10
градусқа жоғарлағанда реакция жылдамдығы қанша есе
артатынын көрсетеді.
температура 10
градусқа жоғарлағанда реакция жылдамдығы қанша есе
артатынын көрсетеді.
Вант-Гофф ережесі температураның реакция жылдамдығына әсерін жуықтап бағалауға жарамды.
Реакция жылдамдығының температураға тәуелділігін Аррениустың активтендіру теориясы дәлірек бейнелейді:
![]() , (2.7)
, (2.7)
мұнда ![]() –
тұрақты шама;
–
тұрақты шама;
![]() - универсалды
газ тұрақтысы, 8,31 Дж/моль∙К;
- универсалды
газ тұрақтысы, 8,31 Дж/моль∙К;
![]() - Кельвин
шкаласы бойынша температура;
- Кельвин
шкаласы бойынша температура;
![]() - активтендіу энергиясы.
- активтендіу энергиясы.
Температураның жоғарылауымен реакция жылдамдығының қатты артуын активтендіру энергиясы түсіндіреді. Мұнда химиялық әрекеттесуге тек берілген реакция өтуі үшін жеткілікті энергиясы бар белсенді бөлшектер ғана түседі. Химиялық реакцияға түсуі үшін зат бөлшегінің ең кіші энергиясы активтендіру энергиясы деп аталады. Оның мөлшері әдетте тәжірибелік жолмен анықталады, Еа әрпімен белгіленеді, өлшем бірлігі - кДж/моль.
Типтік есеп №2
Температуралық коэффициент 2-ге тең. Температураны 200С-ден 900С-ға дейін жоғарлатса, реакция жылдамдығы қалай өзгереді?
Шығарылуы
Химиялық реакция жылдамдығының температураға тәуелділігі Вант-Гофф теңдеуімен өрнектеледі (2.5):
![]() .
.
а) Реакция температурасын Кельвин шкаласы бойынша өрнектейік:
Т1 = t![]() C + 273 = 200C + 273 = 293K;
C + 273 = 200C + 273 = 293K;
T2 = t![]() C + 273 = 900C + 273 = 363K;
C + 273 = 900C + 273 = 363K;
![]() T = T2 – T1
= 363 -293 = 70K.
T = T2 – T1
= 363 -293 = 70K.
б) ![]() =
= ![]() .
.
Жауабы: Реакция жылдамдығы 128 есе артады.
4 Химиялық реакция жылдамдығына катализатордың әсері
Катализаторлар деп реакция жылдамдығын өзгертетін, өздері процесс аяқталғанда құрамы және массасы бойынша өзгермейтін заттарды айтады. Катализаторлардың қатысында химиялық реакциялардың жылдамдатылу құбылысы катализ деп, ал баяулатылуы – ингибирлеу деп аталады.
Катализдің екі түрі болады – гомогенді және гетерогенді: гомогенді катализде бастапқы реагенттер мен катализатор бір фазада (газ немесе сұйықта); гетерогендіде – газ тәрізді немесе сұйық реагенттер қатты катализатордың бетінде әрекеттеседі. Катализатордың әсері келесі: оның қатысында химиялық процестің активтендіру энергиясы азаяды. Катализатор процестің аралық элементарлы стадияларының біреуіне қатысып, реакция реагенттерінің біреуімен реакцияға түсіп, активтендіру энергиясы (Еа) төменірек болатын активтендірілген кешенді түзеді.
Катализатордың реакция жылдамдығына сандық
әсері Аррениус теңдеуімен анықталады. Бұл
теңдеудің математикалық түрлендірілуі катализатордың
қатысындағы ![]() және катализаторсыз
және катализаторсыз ![]() жылдамдық
тұрақтыларының мәндерінің арасындағы байланысын
көрсетеді:
жылдамдық
тұрақтыларының мәндерінің арасындағы байланысын
көрсетеді:
![]() ,
(2.8)
,
(2.8)
мұнда
![]() - катализатордың қатысындағы активтендіру
энергиясының азаюы;
- катализатордың қатысындағы активтендіру
энергиясының азаюы;
![]() және
және ![]() -
катализаторсыз және катализатордың қатысында
реакция жылдамдықтарының тұрақтылары.
-
катализаторсыз және катализатордың қатысында
реакция жылдамдықтарының тұрақтылары.
Типтік есеп №3
![]() катализаторсыз
және катализатордың қатысында сәйкесінше 184 және 108 кДж/моль тең. T = 1000K катализатордың қатысында реакция жылдамдығы
қанша есе артады?
катализаторсыз
және катализатордың қатысында сәйкесінше 184 және 108 кДж/моль тең. T = 1000K катализатордың қатысында реакция жылдамдығы
қанша есе артады?
Шығарылуы
а) Активтендіру энергиялардың айырымын анықтайық:
![]() .
.
б) (2.8) теңдеу бойынша реакция жылдамдықтары тұрақтыларының қатынасын есептейік:
![]() ;
; ![]() .
.
Жауабы: реакция жылдамдығы 9500 есе артты.
5 Химиялық тепе-теңдіктің негізгі түсініктері мен белгілері
Тек бір бағытта және аяғына дейін жүретін реакциялар қайтымсыз деп аталады.
2Na(қ) + 2НОН(с) ® Н2(г) + 2NaOH(еp-ді) ,
Бір мезгілде тура және кері бағыттарда өтетін реакцияларды қайтымды
деп атайды.
N2(г) + 3H2(г) Û 2NH3(г).
1) Қайтымды реакция кезінде тура және кері
процестердің жылдамдықтары теңесетін жылжымалы химиялық
тепе-теңдік орнайды: ![]() .
.
 |
2) Қайтымды жүйеде тепе-теңдік орнаған кезде тепе-тең жүйенің барлық заттарының концентрациялары өзгермейді. Мұндай концентрациялар әдетте тік жақшаға алынады (мысалы: [N2], [H2], [NH3]) және тепе-теңдік концентрациялар деп аталады.
 |
3) Химиялық тепе-теңдік динамикалық болады, яғни тура және кері реакциялар өте береді, бірақ жылдамдықтары бірдей болады.
4) Әрбір химиялық тепе-теңдік концентрацияның, температураның, қысымның белгілі мәндерінде орнайды. Осы жағдайлардың біреуін өзгерту химиялық тепе-теңдуктің ығысуына және жаңа химиялық тепе-теңдіктің орналасуына әкеледі.
6 Тепе-теңдік жүйе үшін әрекеттесуші массалар заңы
Реагенттер арасында фазалардың бөлу беті болмаса химиялық тепе-теңдік гомогенді деп аталады.
N2(г) + 3Н2(г)
![]() 2NH3(г).
2NH3(г).
Егер тепе-теңдік химиялық жүйенің реагенттері арасында фазалардың бөлу беті болса, мұндай тепе-теңдік гетерогенді деп аталады.
СаСО3(қ) ![]() СаО(қ) + СО2(г).
СаО(қ) + СО2(г).
Реагенттер мен реакция өнімдерінің тепе-теңдік концентрацияларының арасындағы байланысты әрекеттесуші массалар заңы өрнектейді: стехиометриялық коэффициенттерге тең болатын көрсеткіш дәрежесіндегі өнімдер тепе-теңдік концентрациялар көбейтіндісінің реагенттер тепе-теңдік концентрацияларының көбейтіндісіне қатынасы тұрақты температурада тұрақты шама болады.
Бұл тұрақты шама тепе-теңдік тұрақтысы (К) деп аталады.
mA + nB Û pC + gD гипотезалық қайтымды гомогенді реакциясы үшін әрекеттесуші массалар заңы математикалық тұрғыдаан келесі теңдеумен өрнектеледі:
![]() немесе
немесе ![]() , (2.9)
, (2.9)
мұнда [A], [B], [C], [Д] – заттардың тепе-теңдік молярлы концентрациялары (моль/л);
m, n, p, g – реакция теңдеуіндегі стехиометриялық коэффициенттер;
k1, k2 – тура және кері реакциялардың жылдамдық тұрақтылары.
Тепе-теңдік тұрақтысы теңдеуіне қатты фазадағы және артық мөлшерде алынған сұйықтықтардың концентрацияларын енгізбейді, себебі бұл концентрациялар тұрақты шамалар болып саналады.
Химиялық тепе-теңдік тұрақтысы әрекеттесуші заттар табиғатына және ортаның температурасына тәуелді, бірақ заттар концентрациясы мен катализатордың қатысына тәуелді емес.
Тепе-теңдік тұрақтысы жүйе тепе-теңдік күйіне жеткенде процестің өтуінің тереңдігін анықтайды. Бұл шама неғұрлым үлкен болса, соғұрлым реагенттердің өнімге айналу дәрежесі де жоғары болады.
Типтік есеп №4
Төменде келтірілген химиялық процестердің химиялық тепе-теңдік тұрақтысының математикалық теңдеуін жазыңыз:
а) 2CO(г)
+ О2(г) ![]() 2СО2(г);
2СО2(г);
б) Fe2O3(қ) +
СО(г) ![]() 2FeO(қ) +
СО2(г);
2FeO(қ) +
СО2(г);
в) Н2СО3(ер-ді) ![]() Н+(ер-ді) + НСО
Н+(ер-ді) + НСО![]() (ер-ді).
(ер-ді).
Шығарылуы
а) 2СО(г)
+ О2(г) ![]() 2СО2(г) – гомогенді қайтымды химиялық реакция.
2СО2(г) – гомогенді қайтымды химиялық реакция.
(2.9) тепе-теңдік жүйесі үшін әрекеттесуші массалар заңына сәйкес:
Kc = ![]() немесе К т-т =
немесе К т-т = ![]() .
.
Кс – заттардың тепе-теңдік концентрациялары арқылы өрнектелген химиялық тепе-теңдік тұрақтысы.
Кт-т – газдардың парциалды қысымдары арқылы өрнектелген химиялық тепе-теңдік тұрақтысы.
б)
Fe2O3(қ) + СО(г) ![]() 2FeO(қ) + СО2(г) – гетерогенді қайтымды химиялық реакция.
2FeO(қ) + СО2(г) – гетерогенді қайтымды химиялық реакция.
Химиялық тепе-теңдік тұрақтысының теңдеуінде қатты заттар концентрацияларын есепке алмаймыз:
Кс = ![]() немесе Кт-т =
немесе Кт-т = ![]() .
.
в) Н2СО3(ер-ді) ![]() Н+(ер-ді) + НСО
Н+(ер-ді) + НСО![]() (ер-ді) – электролиттік
диссоциациялану процессі.
(ер-ді) – электролиттік
диссоциациялану процессі.
Кез келген электролит ерітіндісінде электролиттік диссоциациялану процессінің арқасында диссоциацияланбаған молекулалар мен иондардың арасында гомогенді химиялық тепе-теңдік орнайды. Мұндай процестің тепе-теңдік тұрақтысын электролиттік диссоциациялану тұрақтысы (Кд) деп атайды:
Kд = ![]() .
.
7 Химиялық тепе-теңдіктің ығысуы. Ле-Шателье қағидасы
Химиялық тепе-теңдік күйіндегі жүйенің (υтура=υкері) жағдайын өзгерту (температура, қысым, концентрация) тура және кері реакциялар жылдамдықтарының бірдей емес өзгеруіне байланысты (υтура ≠ υкері) тепе-теңдіктің бұзылуына әкеледі. Біраз уақыттан кейін жүйеде жаңа шарттарға сәйкес келетін жаңа химиялық тепе-теңдік орнайды. Бір тепе-теңдік күйден басқасына ауысу химиялық тепе-теңдіктің ығысуы деп аталады.
Тепе-теңдік ығысуының бағыты Ле-Шателье қағидасымен анықталады: химиялық тепе-теңдік күйіндегі жүйеге сырттан әсер етілсе (Т, Р, С өзгерту), тепе-теңдік бұл әсерді азайту жағына қарай ығысады.
Ле-Шателье қағидасын әсердің барлық түрлеріне қолдануын қарастырайық.
1) Химиялық тепе-теңдіктің ығысуына заттар концентрациясы өзгеруінің әсері әрекеттесуші массалар заңымен анықталады (2.9). Бұл заң бойынша реагенттер концентрациясын арттыру немесе өнім заттары концентрациясын азайту тура реакцияның жылдамдығын арттырады, яғни тепе-теңдікті оң жаққа қарай ығыстырады. Керісінше, реагенттер концентрациясын азайту немесе өнім заттары концентрациясын арттыру тепе-теңдікті сол жаққа қарай ығыстырады.
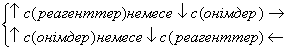 (2.10)
(2.10)
2) Химиялық тепе-теңдіктің ығысуына температураның өзгеруінің әсері реакцияның жылулық эффектісімен (DН) анықталады. Егер DН<0 болса, химиялық реакция – экзотермиялық (жылу қоршаған ортаға бөлінеді); ал егер DН>0 болса, химиялық реакция эндотермиялық болады (жылу қоршаған ортадан сіңіріледі).
Температураны жоғарлату химиялық тепе-теңдікті эндотермиялық реакция бағытында ығыстырады және, керісінше, температураны төмендету тепе-теңдікті экзотермиялық процесс бағытында ығыстырады.
 (2.11)
(2.11)
![]()
![]() N2 + 3H2
↔ 2NH3, ΔH
= – 22 кДж.
N2 + 3H2
↔ 2NH3, ΔH
= – 22 кДж.
![]()
3) Химиялық тепе-теңдіктің ығысуына қысымның әсері тек келесі жағдайда қарастырылады: егер тепе-теңдік жүйесіне қатысушының біреуі газ болса және газ қоспасының көлемі қайтымды реакцияның екі жағында бірдей болмаса.
Химиялық тепе-теңдіктің ығысуына қысымның әсері реакция кезінде газ тәрізді заттар көлемінің өзгеруімен анықталады. Қысымды жоғарлату тепе-теңдікті газдар көлемі азаятын жаққа қарай ығыстырады. Қысымды төмендету тепе-теңдікті газдар көлемі ұлғаятын бағытқа қарай ығыстырады.
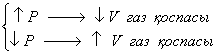 (2.12)
(2.12)
![]()
![]() N2 + 3H2
↔ 2NH3, ΔH
= - 22 кДж.
N2 + 3H2
↔ 2NH3, ΔH
= - 22 кДж.
V = 4 моль V = 2 моль
![]()
4) Катализатор тура және кері реакцияларды бірдей жылдамдататындықтан тепе-теңдіктің ығысуына әсер етпейді, тек оның тез орнауына әсер етеді.
Типтік есеп №5
СО(г) + Н2О(ж)изб ![]() СО2(г) + Н2(г),
СО2(г) + Н2(г), ![]() қайтымды
реакциясының
қайтымды
реакциясының
температурасын төмендету, жүйенің қысымын жоғарлату, реакция өнімдері концентрациясын азайту жүйенің тепе-теңдігін қай жаққа ығыстыратынын көрсетіңіз.
Шығарылуы
а) Температураны төмендету.
СО(г) + Н2О(с)артық ![]() СО2(г) + Н2(г),
СО2(г) + Н2(г),
![]() .
.
ΔН<0
Тура реакция - эндотермиялық (ΔН>0), ал кері реакция – экзотермиялық (ΔН<0). Ле-Шателье қағидасына сәйкес (2.11), температураны төмендету тепе-теңдікті экзотермиялық реакция бағытында ығыстырады, яғни сол жаққа (реагенттер жағына).
б) Жүйенің қысымын жоғарлату.
![]()
![]()
![]() ,
, ![]() .
.
Ле-Шателье қағидасына сәйкес (2.12), жүйенің қысымын жоғарлату тепе-теңдікті реагенттер жағына (солға қарай) - газ қоспасы көлемінің азаю жағына қарай ығыстырады (яғни газдың моль саны азырақ болатын жаққа).
в)
СО(г) + Н2О(ж)изб ![]() СО2(г) + Н2(г),
СО2(г) + Н2(г),
![]() реакциясы өнімдерінің
концентрациясын азайту (с(СО2),
с(Н2)),
Ле-Шателье қағидасына
сәйкес (2.10), тепе-теңдікті оңға
қарай, өнімдер концентрациясының артуы жағына
ығыстырады.
реакциясы өнімдерінің
концентрациясын азайту (с(СО2),
с(Н2)),
Ле-Шателье қағидасына
сәйкес (2.10), тепе-теңдікті оңға
қарай, өнімдер концентрациясының артуы жағына
ығыстырады.
8 Өзіндік жұмысқа тапсырмалар
8.1 «а» реакциясы жылдамдығының математикалық теңдеуін жазыңыз. Реагенттер концентрациясын «б» есе арттырса, «а» реакциясының жылдамдығы қалай өзгереді? Реакцияның реті мен молекулалығы деген не? «а» реакциясының реті мен молекулалығын анықтаңыз.
Жауабы: Реакция жылдамдығы «в» есе өзгереді.
8.2 Реакцияның температуралық коэффициенті «е»-ға тең. Температураны «г»-дан «д»0С-ға дейін өзгерткенде «а» реакциясы жылдамдығы қалай өзгереді?
Жауабы: Реакция жылдамдығы «ж» есе өзгереді.
|
Вт |
«а» |
«б» |
«в» |
«г» |
|
1 |
2Fе(қ) + 3Cl2(г) = 2FeCl3(қ) |
3 |
27 |
120 |
|
2 |
N2(г)+O2(г) = 2NO(г) |
2 |
4 |
60 |
|
3 |
CO2(г) + C(қ) = 2СО(г) |
3 |
3 |
70 |
|
4 |
Н2(г) +Cl2(г) = 2HCl(г) |
4 |
16 |
50 |
|
5 |
2NO(г) + О2(г) = 2NO2(г) |
2 |
8 |
100 |
|
6 |
3SO2(г) +Н2О(с)арт = 2H2SO4(ер-ді) + S(қ) |
2 |
8 |
110 |
|
7 |
Н2(г) + Br2(г) = 2HBr(г) |
3 |
9 |
10 |
|
8 |
2NO2(г) + 4Cu(қ) = N2(г) + 4CuO(қ) |
3 |
9 |
25 |
|
9 |
SO2(г) + PbO2(қ) = PbSO4(қ) |
3 |
3 |
18 |
|
10 |
H2SO4(ер-ді) + Zn(қ) = ZnSO4(ер-ді) + H2(г) |
4 |
4 |
100 |
|
11 |
NiO(қ) + Н2(г) = Ni(қ) + Н2О(бу) |
4 |
4 |
90 |
|
12 |
Сl2(г) + Н2(г) = 2HCl(г) |
4 |
16 |
80 |
|
13 |
HCl(г) + NH3(г) = NH4Cl(қ) |
4 |
16 |
70 |
|
14 |
2K(қ) + 2Н2О(с) = 2КОН(ер-ді) + Н2(г) |
3 |
9 |
60 |
|
15 |
Be(OH)2(қ) +2HCI(ер-ді)= BeCl2(ер-ді)+2Н2О(с) |
3 |
9 |
110 |
|
16 |
N2O5(г) + Н2О(с) = 2HNO3(ер-ді) |
4 |
16 |
120 |
|
17 |
H2O2(ер-ді) + Na2SO3(ер-ді) = Na2SO4(ер-ді) + Н2О |
4 |
16 |
100 |
|
18 |
CuO(қ) + 2НCl(ер-ді) = 2CuCl2(ер-ді) + Н2О(с) |
4 |
16 |
95 |
|
19 |
2NO(г) + О2(г) = 2NO2 |
3 |
27 |
85 |
|
20 |
PbO(қ) + СО(г) = Pb(қ) + СО2(г) |
3 |
3 |
75 |
|
21 |
3Н2(г) + N2(г) = 2NH3(г) |
3 |
81 |
65 |
|
22 |
СаС2(қ) + 2Н2О(с) = Са(ОН)2(қ) + С2Н2(г) |
3 |
9 |
68 |
|
23 |
2СО(г) + О2(г) = 2СО2(г) |
4 |
64 |
68 |
|
24 |
Н2СО3(ер-ді)+ NaOH(ер-ді) = Na2CO3(ер-ді)+ 2Н2О |
4 |
64 |
58 |
|
25 |
3NO2(г) + Н2О(с) = 2НNO3(ер-ді) + NO(г) |
4 |
256 |
48 |
8.3 Реакцияның активтендіру энергиясы «е» катализаторсыз және оның қатысында сәйкесінше «з», «и» кДж/моль тең; температура «к» Кельвинді құрайды. Катализатордың қатысында реакци жылдамдығы қанша есе артады.
Жауабы: реакция жылдамдығы «л» есе артады.
|
Вт |
«д» |
«е» |
«ж» |
«з» |
«и» |
«к» |
«л» |
|
1 |
80 |
2 |
16 |
180 |
140 |
600 |
3,1· 103 |
|
2 |
80 |
2 |
4 |
184 |
58 |
1000 |
3,9· 106 |
|
3 |
90 |
2 |
4 |
244 |
121 |
1000 |
2,7· 106 |
|
4 |
60 |
3 |
3 |
244 |
136 |
1000 |
4,5· 105 |
|
5 |
90 |
3 |
3 |
331 |
230 |
1000 |
1,9· 105 |
|
6 |
80 |
2 |
8 |
250 |
200 |
1000 |
4,1· 102 |
|
7 |
40 |
2 |
8 |
105 |
86 |
1000 |
9,9 |
|
Вт |
«д» |
«е» |
«ж» |
«з» |
«и» |
«к» |
«л» |
|
8 |
55 |
2 |
8 |
180 |
100 |
1000 |
1,5· 104 |
|
9 |
38 |
3 |
9 |
75 |
56 |
450 |
1,6· 102 |
|
10 |
80 |
2 |
4 |
120 |
80 |
720 |
8,1· 102 |
|
11 |
80 |
3 |
3 |
130 |
70 |
600 |
1,7· 105 |
|
12 |
90 |
3 |
3 |
95 |
60 |
500 |
4,6· 103 |
|
13 |
60 |
2 |
2 |
300 |
250 |
400 |
3,5· 106 |
|
14 |
80 |
2 |
4 |
200 |
150 |
1000 |
4,1· 102 |
|
15 |
80 |
2 |
8 |
250 |
210 |
430 |
7,4· 104 |
|
16 |
80 |
2 |
16 |
210 |
170 |
530 |
8,9· 103 |
|
17 |
80 |
3 |
9 |
170 |
120 |
580 |
3,2· 104 |
|
18 |
75 |
3 |
9 |
200 |
180 |
300 |
3,1· 103 |
|
19 |
75 |
3 |
3 |
180 |
150 |
300 |
1,7· 105 |
|
20 |
65 |
3 |
3 |
70 |
50 |
500 |
1,23· 102 |
|
21 |
45 |
2 |
4 |
200 |
170 |
400 |
8,4· 103 |
|
22 |
98 |
2 |
8 |
180 |
130 |
500 |
1,7· 105 |
|
23 |
88 |
3 |
9 |
260 |
240 |
500 |
1,23· 102 |
|
24 |
88 |
2 |
8 |
100 |
70 |
500 |
1,4· 103 |
|
25 |
68 |
3 |
9 |
120 |
80 |
298 |
1,05· 107 |
8.4 «м» тепе-теңдік жүйесі үшін химиялық тепе-теңдік тұрақтысының математикалық теңдеуін жазыңыз. Бұл теңдеудің алымы мен бөлімі нені өрнектейді?
8.5 Ле-Шателье қағидасын қолдана отырып,
«н» - температураны (Т);
«о» - жүйе қысымын (Р);
«п» - тепе-теңдік жүйесі қатысушыларының концентрацияларын (с) өзгерткенде (жоғарлатқанда [↑] немесе төмендеткенде [↓]) «м» химиялық тепе-теңдігінің ығысу бағытын анықтаңыз:
|
Вт |
«м» |
∆Н, [кДж] |
өзгеру |
||
|
«н» |
«о» |
«п» |
|||
|
1 |
HCIO(ер-ді)
|
+19,87 |
↓Т |
- |
↑с(HClО) |
|
2 |
N2(г) + 3Н2(г)
|
-92,4 |
↑Т |
↓Р |
↑с(NH3) |
|
3 |
AgCl(қ)
|
+65,48 |
↓Т |
- |
↑с(Cl-) |
|
4 |
S2-(ер-ді)
+ НОН(с)арт
|
+5,61 |
↓Т |
- |
↓с(ОН-) |
|
5 |
FeO(қ) + СО(г)
|
+19,33 |
↓Т |
↑Р |
↓с(СО) |
|
6 |
NH4OH(ер-ді)
|
+3,87 |
↑Т |
- |
↓с(NH4+) |
|
7 |
2SO2(г)+ О2(г)
|
-284,2 |
↑Т |
↓Р |
↑с(SO3) |
|
8 |
CaCO3(кр)
|
+12,47 |
↓Т |
- |
↑с(Са2+) |
|
9 |
СО32-(ер-ді)+НОН(с)арт |
+41,81 |
↑Т |
- |
↓с(ОН-) |
|
10 |
С(қ)+ СО2(г)
|
+172,5 |
↓Т |
↑Р |
↓с(СО2) |
|
11 |
Н2S(ер-ді)
|
+3,03 |
↑Т |
- |
↑с(Н2S) |
|
12 |
2СО(г)
+ О2(г)
|
-135,2 |
↑Т |
↓Р |
↑с(О2) |
|
13 |
AgJ(қ)
|
+113,0 |
↓Т |
- |
↑с(Ag+) |
|
14 |
NH4+(ер-ді)+НОН(с)арт |
+51,95 |
↑Т |
- |
↓с(ОН-) |
|
15 |
NH4Cl(қ)
|
+177,1 |
↓Т |
↑Р |
↓с(HCl) |
|
16 |
HS-(ер-ді)
|
+50,21 |
↑Т |
- |
↓с(НS-) |
|
17 |
СО(г)
+ 2Н2(г) |
-128,05 |
↓Т |
↓Р |
- |
|
18 |
СаСО3()
|
+178,0 |
↓Т |
↑Р |
↓с(СО2) |
|
19 |
SO32-(ер-ді)
+НОН(с)арт |
+66,11 |
↑Т |
- |
↑с(HSО3-) |
|
20 |
HCO-3(ер-ді)
|
+14,64 |
↑Т |
- |
↓с(СО22-) |
|
21 |
CdS(қ)
|
+114,3 |
↓Т |
- |
↑с(Сd2+) |
|
22 |
C(қ)
+ О2(г)
|
- 402,2 |
↓Т |
↓Р |
↓с(О2) |
|
23 |
Fe3O4(қ) + СО(г)
|
+34,55 |
↑Т |
↑Р |
↑с(СО) |
|
24 |
PCl5(г)
|
+92,59 |
↓Т |
↓Р |
↓с(РCl3) |
|
25 |
BaCO3(қ)
|
+10,16 |
↑Т |
- |
↑с(Ва2+) |
3 тақырып
Электролит ерітінділері
1 Күшті және әлсіз электролиттер
Еріткіштің полярлы молекулаларының әсерінен ерітілген заттың сольватталған иондарға толық немесе жарым-жартылай ыдырауы электролиттік диссоциация деп аталады (ЭД).
Электролиттік диссоциациялануға қабілеттілігі бойынша химиялық қосылыстарды электролиттер мен бейэлектролиттерге бөледі. Электролиттік диссоциация ерітінділердің иондық өткізгіштігін қамтамасыз етеді.
Бейэлектролиттер – ерітілген де, балқытылған да күйінде жүйелердің электр өткізгіштігін қамтамасыз етуге қабілеттілігі жоқ заттар. Оларға кейбір органикалық заттар жатады: спирттар, кетондар, эфирлер, қанттар және т.б.
Электролиттер деп суда немесе полярлы еріткіштерде иондарға ыдырайтын заттарды айтады. Электролиттер ерітінділері мен балқымалары электр тоғын өткізеді.
Электролиттік диссоциациялану процесі қаншама толық өтуіне байланысты күшті және әлсіз электролиттерді ажыратады.
2 кесте – Күшті және әлсіз электролиттер
|
Күшті электролиттер |
Әлсіз электролиттер |
|
Суда еритін негіздер (сілтілер): LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. (NH4OH-тан бақалары). Күшті қышқылдар: HNO3, H2SO4, H2S2O8, HClO4, HMnO4. Оттексіз қышқылдар: HCI, HBr, HI. Жай тұздардың барлығы (оларға жатпайды: ZnCI2, ZnI2, CdCl2, CdI2, HgCl2, Hg(CN)2, Fe(CNS)3). Сыртқы сферасы бар комплексті қосылыстар: [Cu(NH3)4]SO4, Na3[Al(OH)6] …
|
Суда нашар еритін негіздер: Mn(OH)2, Fe(OH)2, Co(OH)2, Ni(OH)2 ... Амфотерлі гидроксидтердің барлығы: Be(OH)2, Al(OH)3, Zn(OH)2 ... Әлсіз оксоқышқылдар: H2CO3, H2SiO3, H2S2O3, H3BO3, H3PO3, HNO2, HГалO, HГалO2. Оттексіз қышқылдар: HF, H2S, HCN, HSCN. Комплексті тұздардың ішкі сфералары: [Cu(NH3)4]2+, [Al(OH)6]3- ... |
|
H3PO4, H2SO3, Mg(OH)2 – орташа күші бар электролиттер H2O, CH3COOH - әлсіз электролиттер |
|
1.1 Электролиттік диссоциациялану дәрежесі
Электролиттік диссоциация – қайтымды процесс: электролит ерітінділерінде иондармен қатар диссоциацияланбаған молекулалар болады. Осы себептен электролит ерітінділерін сандық жағынан электролиттік диссоциациялану дәрежесі (α) сипаттайды.
α – иондарға ыдыраған молекулалар санының (n) еріген молекулалардың жалпы санына (N) қатынасы:
![]() немесе
немесе ![]() , (3.1)
, (3.1)
мұнда с – молярлы концентрация, моль/л.
Электролиттің диссоциациялану дәрежесі тәжірибелік жолмен анықталады және бірлік өлшеммен немесе пайызбен өрнектеледі.
1.2 Электролиттік диссоциациялану тұрақтысы
Күшті электролиттер суда еру кезінде иондарға толық ыдырайды, әлсіз электролиттер – тек жарым-жартылай ғана. Соңғы жағдайда диссоциация процесі қайтымды болады. Кез келген қайтымды процеске әрекеттесуші массалар заңын қолдануға болады.
Әлсіз электролит ерітіндісінде толық диссоциацияланбауына байланысты түзілген иондар мен молекулалар (немесе күрделі иондар) арасында химиялық тепе-теңдік орнайды. Мұндай процестің тепе-теңдік тұрақтысын электролиттік диссоциациялану тұрақтысы (Кд) деп атайды.
Электролиттік диссоциациялану тұрақтысы Кд иондар тепе-теңдік концентрациялар көбейтіндісінің диссоциацияланбаған молекулалар санының қатынасына тең:
![]() . (3.2)
. (3.2)
Мысалы, әлсіз екі негізді күкіртті сутек қышқылының электролиттік диссоциациялану тұрақтысының теңдеуі былай жазылады:
I сатысы: H2S = H+ + HS- II сатысы: HS- = H+ + S2-
[H+]×[HS-] [H+]×[S2-]
Kд’ = ¾¾¾¾ = 6×10-8; Kд’’ = ¾¾¾¾ = 1×10-14.
[H2S] [HS-]
Концентрациясы 0,1 моль/л H2S ерітіндісінің электролиттік диссоциациялану дәрежесі: a’ = 3,98×10-4; a’’ = 3,3×10-7.
Осылай диссоциациялану тұрақтысы әлсіз электролиттің иондарға ыдырау қабілеттілігін сипаттайды: Кд неғұрлым жоғары болса, ерітіндіде иондар саны да артады, соғұрлым әлсіз электролиттің диссоциациялану дәрежесі де жоғары болады.
Әлсіз электролиттің электролиттік диссоциациялануы бірнеше сатыда өтетін жағдайда келесі сатының Кд және a мәндері алдыңғы сатыдағыдан төмен болады:
a’’<a’; Кд’’<Кд’.
Күшті электролит ерітінділерінде гидратталған иондық жұптардың түзілуімен молекулалардың иондарға толық (қайтымсыз) электролиттік диссоциациялануы жүреді. Осы себептен әрекеттесуші массалар заңын күшті электролиттер ерітінділеріне қолдануға болмайды, яғни Кд-ның күшті электролит үшін мағынасы болмайды.
1.3 Оствальдтың сұйылту заңы
Диссоциациялану тұрақтысы Кд мен диссоциациялану дәрежесі α арасында келесі байланыс бар:
![]() (3.3)
(3.3)
Өте әлсіз электролиттер
үшін α<<1, сондықтан келесі теңдеу жиірек
қолданылады:
![]() (3.4)
(3.4)
Оствальдтың сұйылту заңы: ерітінді сұйылтылған сайын әлсіз электролиттің диссоциациялану дәрежесі артады.
Типтік есеп№ 1
H2CO3, Ba(OH)2 бейорганикалық қосылыстардың қай класына жатады? Бұл заттардың электролиттік диссоциациялану теңдеулерін жазып, Кд мағынасы бар электролит үшін электролиттік диссоциациялану тұрақтысының математическое өрнектелуін келтіріңіз.
Шығарылуы
а) H2CO3 – көмір қышқылы, қышқылдық гидроксид, әлсіз қышқыл, әлсіз электролит. Екі негізді қышқыл H2CO3 екі сатыда диссоциацияланады. Электролиттік диссоциациялану теңдеулерін жазамыз:
I саты: H2CO3 ![]() H+ + HCO
H+ + HCO![]() ; II
саты: HCO
; II
саты: HCO![]()
![]() H+ + CO
H+ + CO![]()
[H+]
× [HCO![]() ] [H+]×[CO
] [H+]×[CO![]() ]
]
Kд’ = ¾¾¾¾ , Kд’’ = ¾¾¾¾ ,
[H2СO3] [HCO3-]
мұнда [H+], [HCO![]() ], [CO
], [CO![]() ] – электролиттік диссоциациялану кезінде түзілген
иондардың тепе-теңдік молярлы концентрациялары;
] – электролиттік диссоциациялану кезінде түзілген
иондардың тепе-теңдік молярлы концентрациялары;
[H2CO3] – диссоциацияланбаған молекулалардың тепе-теңдік молярлы концентрациясы.
б) Ba(OH)2 – барий гидроксиді, негіздік гидроксид, күшті негіз, күшті электролит. Екі қышқылды негіз болғандықтан, Ва(ОН)2 екі сатыда диссоциацияланады:
I саты: Ba(OH)2 → BaOH+ + OH- ;
II саты: BaOH+ → Ba2+ + OH-.
Күшті электролиттер үшін Кд-ның мағынасы болмайды.
2 Бейорганикалық қосылыстардың әртүрлі кластарының электролиттік диссоциациялануы
Электролиттік диссоциациялануы кезінде түзілетін иондардың сипаты бұл электролит қандай класқа жататынына байланысты. Кейбір электролиттер сулы ерітінділерде сатылы электролиттік диссоциациялануға ұшыраса, басқаларыныкі тек бір сатыда өтеді.
Негіздердің сулы ерітіндіде диссоциациялануы гидроксид-анионының (ОН-) бөлінуімен өтеді. Электролиттік диссоциациялану сатыларының саны гидроксид-иондарының санымен анықталады.
3 кесте – Қосылыстардың электролиттік диссоциациялануы
|
Сатылы электролиттік диссоциация |
Бір сатылы электролиттік диссоциация |
|
1. Көп негізді қышқылдар: H2SO4, H3PO4, H2CO3 ... 2. Көп қышқылды негіздер: Ca(OH)2, Ba(OH)2 ... 3. Барлық амфотерлі гидроксидтер: Zn(OH)2, AI(OH)3, Sn(OH)2 … , KHS, Na2HPO4, NaH2PO4, NaHSO3, … 5. Негіздік тұздар: MgOHCl, AlOHCl2, CuOHNO3, FeOHSO4, (CuOH)2SO4 ... 6. Kомплексті қосылыстар: [Cu(NH3)4]SO4, K3[Al(OH)6] ... |
1. Бір негізді қышқылдар: HCI, HNO3, HCN, CH3COOH … 2. Бір қышқылды негіздер: KOH, NaOH, NH4OH … 3. Орта тұздар: Al2(SO4)3, FeCl3, Cu(NO3)2 … 4. Қос тұздар – екі әр түрлі катион мен қышқыл қалдығынан тұратын қосылыстар: NH4Al(SO4)2, K2CuCl4 ...
|
NH4OH <=> NH4+ + OH- ; I саты: Сa(OH)2 ® СaOH+ + OH- ;
II саты: СaOH+ ® Сa2+ + OH-.
Қышқылдар сулы ерітіндіде сутек иондарының бөлінуімен диссоциацияланады (қышқылдық иондар Н+). Көп негізді қышқылдар сатылы диссоциацияланады.
Азот қышқылы : HNO3 ® H+ + NO3-;
Көмір қышқылы: H2CO3 <=> H+ + HCO3- (I саты);
гидроанион
HCO3- <=> H+ + CO32- (II саты).
Орта тұздар металл катионы (немесе аммоний катионы) мен қышқыл қалдығының аниондарының түзілуімен бір сатыда диссоциацияланады.
AlCl3 ® Al3+ + 3Cl-; (NH4)2SO4 ® 2NH4+ + SO42-
Қышқылдық тұздар – молекулалар құрамына металл ионы мен қышқыл қалдығымен қатар сутегі иондар кіретін қосылыстар. Қышқылдық тұздар сатылы диссоциацияланады: алдымен молекула металл катионы (немесе NH4+- катионы) мен қышқыл қалдығының гидроанионына ыдырайды, одан кейін қышқыл калдығы гидроанионының диссоциациялануы жүреді.
NaHCO3 ® Na+ + HCO3- I сатысы ;
гидрокарбонат-ион
HCO3- <= > H+ + CO32- II сатысы.
карбонат-ион
Негіздік тұздар – молекулалар құрамына металл ионы мен қышқыл қалдығымен қатар гидроксотоптар кіретін қосылыстар. Негіздік тұздар алдымен қышқыл қалдығы мен металл гидроксокатионына ыдырайды, одан кейін металл гидроксокатионы да ыдырайды:
AlOHCl2 ® AlOH2+ + 2Cl- ; I сатысы
Al гидроксокатионы
AlOH2+ <=> Al3+ + OH- . II сатысы
Қос тұздардың комплексті қосылыстардан айырмашылығы – бұл заттардың ішкі сферасының тұрақтылығы төмен, сондықтан сулы ерітінділерінде олардың иондарға диссоциациялануы орта тұздардыкіндей өтеді.
K2CuCl4 ® 2K+ + Cu2+ + 4Cl-.
Комплексті қосылыстардың диссоциациялануы бірнеше сатыдан тұрады. Ішкі және сыртқы сфераларының арасындағы байланыс берік емес иондық химиялық байланыс болғандықтан, алдымен күшті электролит типі бойынша иондарға толық ыдырауы жүреді, одан кейін ішкі сферасының (комплексті ионның) жарым-жартылай ыдырауы өтеді.
K3[Al(OH)6] ® 3K+ + [Al(OH)6]3- I стадия;
[Al(OH)6]3- <=> Al3+ + 6OH- II – VII – стадиялар,
мұнда Al3+ - комплекстүзуші ион, OH- - лиганд.
3 Иондық реакциялар
Атомдардың тотығу дәрежелері өзгерусіз электролиттер арасында өтетін реакциялар ионалмасу реакциялары деп аталады.
Иондық реакциялар алмасу реакцияларына жатады. Теориялық жағынан алмасу реакциялары әрқашан қайтымды болады, әрбір жүйеге берілген жағдайда тепе-теңдіктің белгілі күйі сәйкес келеді. Бұл тепе-теңдік аз диссоциацияланатын (оған комплексті ион да жатады), нашар еритін немесе газ тәрізді заттың түзілу жағына қарай ығысады.
Типтік есеп № 2
Cu2+ + S2- → CuS↓ иондық теңдеуі бойынша реакцияның молекулалық теңдеуін құрастырыңыз.
Шығарылуы
Иондық теңдеуден құрамында Cu2+ және S2—иондары бар заттар молекулалары теңдеудің сол жағында болуы керек екендігі көрініп тұр. Бұл заттар суда еритін, яғни күшті электролиттер болуы қажет.
а) Иондық теңдеуден Cu2+ және S2--иондары бар бастапқы заттар молекулаларының химиялық құрамын анықтауға болмайды. Сондықтан ерігіштік кестесінен құрамында осы иондар бар кез келген еритін қосылыстарды табамыз, мысалы, CuSO4 және Na2S.
б) Теңдеулердің барлық түрін ескере отырып, ионалмасу реакциясын жазамыз:
CuSO4 + Na2S → CuS↓ + Na2SO4 ;
Cu2+ + SO42- + 2Na+ + S2- → CuS↓ + 2Na+ + SO42- ;
Cu2+ + S2- → CuS↓.
4 Судың диссоциациялануы. Судың иондық көбейтіндісі
Су - әлсіз амфотерлі электролит. Су молекулалары сутек иондарын (Н+) беруі және қосуы мүмкін. Молекулалар арасындағы әрекеттесудің нәтижесінде су ерітінділерінде әрқашан ОН- және Н+-иондар болады (дәлірек, оксоний катионы H3O+) :
H2O + H2O ↔ H3O+ + OH-
немесе
H2O ↔ H+ + OH- .
Сандық жағынан судың диссоциациялануы диссоциациялану тұрақтысымен өрнектеледі:
![]() (250С-де).
(3.5)
(250С-де).
(3.5)
Диссоциацияланбаған су молекулаларының концентрациясын судың жалпы молярлы концентрациясына тең деп алады:
 .
.
Бұл шаманы (3.5) теңдеуге қойса, келесі теңдеуді алуға болады
![]() ;
;
![]() -
судың
иондық көбейтіндісі, 250С-де таза суда немесе кез келген сулы
ерітіндідегі сутек және гидроксид-иондар концентрацияларының
көбейтіндісі болып келетін тұрақты шама.
-
судың
иондық көбейтіндісі, 250С-де таза суда немесе кез келген сулы
ерітіндідегі сутек және гидроксид-иондар концентрацияларының
көбейтіндісі болып келетін тұрақты шама.
![]()
![]() . (3.6)
. (3.6)
Егер Н+ және ОН- иондар:
а) [H+] =[OH-] =10-7 моль/л – ерітінді бейтарап;
б) [H+]> [OH-] – ерітінді қышқылды ;
в) [H+] < [OH-] – ерітінді сілтілік.
Температура жоғарлаған сайын судың диссоциациялануы артады. Судың диссоциациялану процесі эндотермиялық болатындықтан (ΔН>О), Ле-Шателье қағидасына сәйкес температураны жоғарлату тепе-теңдікті оң жаққа ығыстырады:
Н2О ↔ Н+ + ОН-, ∆Н = +56 кДж/моль.
Ортаны сипаттау үшін сутектік көрсеткіш мөлшері, яғни рН қолданған ыңғайлы болады.
рН - H+-катиондар концентрациясының теріс
таңбамен алынған ондық логарифмі
:
![]() .
(3.7)
.
(3.7)
рОН – гидроксильді көрсеткіш – ерітіндідегі гидроксид-иондар концентрациясының теріс таңбамен алынған ондық логарифмі:
![]() . (3.8)
. (3.8)
Ерітінділердің реакциясы pH мәндерімен былай сипатталады:
а) pH = 7 бейтарап орта;
б) pH < 7 қышқылдық орта;
в) pH > 7 сілтілік орта.
Типтік есеп №3
НСlO және НСl қышқылдарының 0,1 молярлы ерітінділерінде сутек иондардың концентрациясын салыстырыңыз. Kд(HClO)=5×10-8, a(HCl) =0,93.
Шығарылуы
Екі әртүрлі электролиттердің (әлсіз және күшті) бірдей молярлы концентрациядағы ерітінділері берілген. Күшті қышқыл ерітіндісінде (НС1) сутек иондарының концентрациясы жоғарырақ болуы керек деп болжамдауға болады. Оны есеп жолымен дәлелдейік.
а) Күшті электролит НС1
|
Күшті электролиттің электролиттік диссоциациялануы |
HCl ¾® H+ + Cl- |
||
|
Диссоциацияланған молекулалар мен түзілген иондар концентрациясы |
сдис=cжалпы×a= =0,93×10-1= =9,3×10-2М |
9,3×10-2М |
9,3×10-2М |
Жауабы: HCl ерітіндісінде с(H+) = 9,3 ×10-2M.
б) Әлсіз электролит HClO
|
Әлсіз электролиттің электролиттік диссоциациялануы |
HClO <==> H+ + ClO- |
||
|
Диссоциацияланған молекулалар мен түзілген иондар концентрациясы |
сдис=a×cжалпы= =a×10-1М |
a×10-1М |
a×10-1М |
Оствальдтың сұйылту заңына сәйкес: Kд=c жалпы×a2;
![]()
![]()
![]() a=
ÖKд/cжалпы
= Ö5×10-8/10-1 =
Ö50×10-8
= 7,06×10-4;
a=
ÖKд/cжалпы
= Ö5×10-8/10-1 =
Ö50×10-8
= 7,06×10-4;
cдисс(HClO)=7,06×10-4×10-1 = 7,06×10-5M.
Жауабы: [H+]=7,06×10-5M.
5 Өзіндік жұмысқа тапсырмалар
5.1 «а» заттары бейорганикалық қосылыстардың қандай класына жатады? «а» заттарының электролиттік диссоциациялану теңдеулері мен Кд мәнінің мағынасы бар электролит үшін электролиттік диссоциациялану тұрақтысының математикалық өрнектелуін жазыңыз.
5.2 «б» заттарының электролиттік диссоциациялану теңдеулерін құрастырыңыз. Сатылы диссоциацияланатын электролиттер үшін барлық жүйелі (бір ізді) стадияларын жазыңыз.
5.3 Қысқартылған иондық-молекулалық теңдеумен («в») өрнектелетін реакцияның молекулалық теңдеуін құрастырыңыз. Жауабыңызды бұл теңдеулерді иондық түрде жазып, дәлелдеңіз.
5.4 «г» заттарының арасында өтетін реакциялардың молекулалық және иондық теңдеулерін құрастырыңыз. «г» иондық реакциясының тепе-теңдігі өнім заттарының түзілу жағына қарай ығысуының белгісін анықтаңыз.
|
Вт |
«а» |
«б» |
«в» |
|
1 |
HNO3; NH4OH |
HCIO, Cu(OH)2, (NH4)2SO4 |
Cu2+ + 2OH- → Cu(OH)2¯ |
|
2 |
H2CO3; Ba(OH)2 |
H2CO3, Ba(OH)2, NaH2PO4 |
CO32- + 2H+ → H2CO3 |
|
3 |
HCl; HCN |
H3PO4, Ca(OH)2, Ca(HS)2 |
Ca2+ + C2O42- → CaC2O4¯ |
|
4 |
H2SO3; NaOH |
H2S, Mg(OH)2, Fe2(SO4)3 |
Sr2+ + SO42- → SrSO4¯ |
|
5 |
H3PO4; KCN |
H2SO4, NaOH, (ZnOH)2SO4 |
Ni2+ + S2- → NiS¯ |
|
6 |
HNO3; KHCO3 |
HCl, NH4OH, AIOH(NO3)2 |
Pb2+ + SO42- → PbSO4¯ |
|
7 |
H2SiO3; Sr(OH)2 |
H2SiO3, KOH, NaHCO3 |
Ba2+ + SO42- → BaSO4¯ |
|
8 |
HF; K2S |
HBr, LiOH, NaHSiO3 |
Ag+ + Br- → AgBr¯ |
|
9 |
HCN; RbOH |
HJ, Zn(OH)2, Al2(SO4)3 |
H+ + OH- → HOH |
|
10 |
CH3COOH; NaCl |
HClO4, AI(OH)3, MgOHCl |
NH4+ + OH- → NH4OH |
|
11 |
H2S; Na3PO4 |
H3AsO4, Hg(OH)2, CuCI2 |
CH3COO-+H+→CH3COOH |
|
12 |
HBr; KHS |
H2SO3, Fe(OH)3, Na3PO4 |
PbS↓ + 2H+ → H2S↑ + Pb2+ |
|
13 |
HNO2; KNO2 |
HNO2, Sn(OH)2, NaHSO4 |
Zn2+ + 2OH- → Zn(OH)2↓ |
|
14 |
HClO; KClO |
HMnO4, Ni(OH)2, FeOHNO3 |
H+ + NO2- → HNO2 |
|
15 |
HJ; H2S |
H3BO3, Cr(OH)3, Ca3(PO4)2 |
Mn2+ + 2I- → MnI2↓ |
|
16 |
K2SO3; H2SO3 |
HF, Pb(OH)2, Na2HPO4 |
Ba2+ + CrO42- → BaCrO4¯ |
|
17 |
KNO3; NH4OH |
CH3COOH, Be(OH)2, Na2SO4 |
Fe(OH)3↓+3H+→Fe3++3H2O |
|
18 |
H2Se; KCl |
H3AsO3, CuOH, MgOHBr |
Cd2+ + S2- → CdS¯ |
|
19 |
FeSO4; HF |
H2SeO4, Co(OH)2, Ca(HCO3)2 |
Mn2+ + S2- → MnS¯ |
|
20 |
Pb(NO3)2; HSCN |
HNO3, Fe(OH)2, ZnOHCI |
Fe3+ + 3OH- → Fe(OH)3 ¯ |
|
21 |
KMnO4; HClO |
H2CrO4, Sr(OH)2, Be(NO3)2 |
Mg2+ + 2OH- → Mg(OH)2 ¯ |
|
22 |
HClO4; HClO2 |
H2Cr2O7, CsOH, CuSO4 |
Cu2+ + S2- → CuS ¯ |
|
23 |
BaCl2; H2S |
H2S2O3, RbOH, AIOHCI2 |
CaCO3 +2H+→ Ca2++H2СО3 |
|
24 |
H3AsO3; FeCl3 |
HPO3, Cd(OH)2, AI(OH)2CI |
2H+ + SiO32- → H2SiO3 ¯ |
|
25 |
H2SiO3; K2SiO3 |
HPO2, Mn(OH)2, AICI3 |
2H+ + SO32- → H2SO3 |
5.5 Молярлы концентрациясы «ж» бірдей болатын «д» және «е» қосылыстарының ерітінділерінде сутек иондарының концентрациясын есептеңіз (көп негізді әлсіз қышқылдар үшін электролиттік диссоциацияланудың тек 1-ші сатысын назарға алыңыз).
Жауабы: Әлсіз электролит ерітіндісінде [Н+] = «з» моль/л; күшті электролит ерітіндісінде с(Н+) = «и» моль/л.
|
В-т |
«г» |
«д» |
«е» |
«ж» |
«з» |
«и» |
|
Kд |
a |
|||||
|
1 |
AICI3 Ca(OH)2 |
HNO2 5,1×10-4 |
HNO3 0,99 |
0,02 |
3,1×10-3 |
2,0×10-2 |
|
2 |
AgNO3 AICI3 |
CH3COOH 1,8×10-5 |
HJ 0,99 |
0,10 |
1,4×10-3 |
9,9×10-2 |
|
3 |
BaCI2 Fe2(SO4)3 |
H2S 1,0×10-7 |
HBr 0,97 |
0,10 |
1,0×10-4 |
9,7×10-2 |
|
4 |
FeCI3 KOH |
H2S 1,0×10-7 |
HNO3 0,98 |
0,02 |
4,5×10-5 |
1,9×10-2 |
|
5 |
Ba(NO3)2 Na2SO4 |
HCN 6,2×10-10 |
HCl 0,98 |
0,01 |
2,5×10-6 |
9,8×10-3 |
|
6 |
Na2SiO3 HCI |
HNO2 5,1×10-4 |
HNO3 0,95 |
0,10 |
7,1×10-3 |
9,5×10-2 |
|
7 |
Ba(CH3COO)2 KCI |
H3PO4 7,6×10-3 |
HCl 0,78 |
1,00 |
8,7×10-2 |
7,8×10-1 |
|
8 |
CuSO4 KOH |
H2C2O4 5,5×10-2 |
HClO4 0,99 |
0,10 |
7,4×10-2 |
9,9×10-2 |
|
9 |
Cu(NO3)2 Ca(OH)2 |
HF 6,8×10-4 |
HCl 0,88 |
0,50 |
1,8×10-2 |
4,4×10-1 |
|
10 |
CuCI2 H3PO4 |
H2CO3 4,5×10-7 |
HClO4 1,00 |
0,01 |
6,7×10-5 |
1,0×10-2 |
|
11 |
Cu(OH)2 HNO3 |
H2SeO3 2,4×10-3 |
HNO3 0,99 |
0,01 |
4,9×10-3 |
9,9×10-3 |
|
12 |
Zn(NO3)2 K2S |
H3AsO4 6,0×10-3 |
HJ 1,00 |
0,01 |
7,7×10-3 |
1,0×10-2 |
|
13 |
Fe2S3 HCI |
HCN 6,2×10-10 |
H2SO4 0,60 |
0,05 |
5,6×10-6 |
3,0×10-2 |
|
14 |
NH4OH H2SO4 |
NH4OH 1,8×10-5 |
KOH 0,95 |
0,10 |
1,3×10-3 |
9,5×10-2 |
|
15 |
AI(OH)3 HCI |
H3PO3 1,6×10-2 |
HNO3 0,95 |
0,10 |
4,0×10-2 |
9,5×10-2 |
|
16 |
K2SiO3 H2SO4 |
H2SO3 1,7×10-2 |
HNO3 0,96 |
0,05 |
2,9×10-2 |
4,8×10-2 |
|
17 |
Fe(NO3)2 Ca(OH)2 |
HVO3 3,0×10-5 |
HBr 0,99 |
0,01 |
5,5×10-4 |
9,9×10-3 |
|
18 |
Mg(NO3)2 Na2CO3 |
HClO 5,0×10-8 |
HCl 0,93 |
0,10 |
7,1×10-5 |
9,3×10-2 |
|
19 |
H3PO4 NH4OH |
H2B4O7 1,8×10-4 |
HNO3 0,98 |
0,04 |
2,7×10-3 |
3,9×10-2 |
|
20 |
Fe(OH)3 HNO3 |
HBrO 2,5×10-9 |
HNO3 0,97 |
0,06 |
1,2×10-5 |
5,8×10-2 |
|
21 |
KOH H2SO4 |
HJO 2,3×10-11 |
HNO3 0,96 |
0,08 |
1,3×10-6 |
7,7×10-2 |
|
22 |
Cr(OH)3 H2SO4 |
HCN 6,2×10-10 |
HCl 0,93 |
0,10 |
7,9×10-6 |
9,3×10-2 |
|
23 |
NaOH H3PO4 |
HF 6,8×10-4 |
HCl 0,98 |
0,01 |
2,6×10-3 |
9,8×10-3 |
|
24 |
Ca(HCO3)2 HNO3 |
H2CO3 4,5×10-7 |
HCl 0,97 |
0,02 |
9,5×10-5 |
1,9×10-2 |
|
25 |
(NH4)2S FeCI3 |
H3AsO4; 6,0×10-3 |
HCl 0,96 |
0,04 |
1,6×10-2 |
3,8×10-2 |
4 тақырып
Тотығу-тотықсыздану реакциялары
1 Тотығу дәрежесі
Әрбір элемент атомының валеттілігі жалпы электрондық жұптарды түзуге қатысатын электрондар санымен анықталады. Түзілген байланыстардың полярлығы ескерілмейтіндіктен валенттіліктің таңбасы болмайды.
Тотығу дәрежесі (Т.Д.) деп молекула тек иондардан ғана тұрады деген болжамның негізінде есептелген атомның шартты зарядын айтады.
Оң тотығу дәрежесі берілген атомнан ығысатын электрондар санын білдіреді, ал теріс тотығу дәрежесі – берілген атомға қарай ығысатын электрондар санын.
Элемент атомының тотығу дәрежесін анықтау үшін әдетте келесі тұрғыдан шығады:
1) Жай заттар элементтерінің тотығу дәрежесі
нөлге тең (N![]() , H
, H![]() , Cl
, Cl![]() , Al0, K0,Cu0….).
, Al0, K0,Cu0….).
2) Периодтық жүйеде орналасуына байланысты қосылыстың құрамындағы элементтің мүмкін болатын тотығу дәрежесі 4-ші кестеде келтірілген.
3) Молекуладағы барлық атомдар зарядтарының алгебралық қосындысы нөлге тең, ал күрделі ионның құрамындағы атомдар зарядтарының алгебралық қосындысы осы ионның зарядына тең.
Типтік есеп №1
Қосылыстарда асты сызылған элементтің тотығу дәрежесін анықтаңыз:
a) K2SO4,
б) SO![]() ,
,
в) K2Cr2O7,
г) Cr2О![]() .
.
Шығарылуы
а) K2SO4 – молекула. Молекуладағы атомдар зарядтарының алгебралық қосындысы нөлге тең екендігін, Т.Д.(К) = +1, Т.Д.(О) = −2 тең екендігін ескере отырып, күкірттің тотығу дәрежесін анықтаймыз:
K![]() S
S![]() O
O![]()
2 · (+1) + (1 · х) + (4 · (−2)) = 0 ,
+2 + х − 8 = 0 ,
х = +6, Т.Д.(S) = + 6.
б)
SO![]() –
ион. Күрделі ионның
құрамындағы атомдар зарядтарының алгебралық қосындысы
тең осы ионның зарядына деген тұрғыдан
күкірттің тотығу дәрежесін анықтаймыз:
–
ион. Күрделі ионның
құрамындағы атомдар зарядтарының алгебралық қосындысы
тең осы ионның зарядына деген тұрғыдан
күкірттің тотығу дәрежесін анықтаймыз:
(S![]() O
O![]() )
)![]()
1 · х + 4 · (−2) = −2 ,
+ х −8 = −2 ,
х = +6, Т.Д.(S) = + 6.
4 кесте - Элементтің қосылыстарындағы тотығу дәрежесі
|
Топ № |
Қосылыстарында (Э) мүмкін болатын тотығу дәрежесі |
|
Негізгі топшалар элементтері |
|
|
I – A H, Li, Na, K, Rb, Cs, Fr |
Т.Д.(Э) = +1 (тұрақты тотығу дәрежесі). Ерекшелік ретінде – сутек: әдетте, Т.Д.(Н) = +1, бірақ белсенді металдар гидридтерінде
Т.Д.(Н)
= −1 (Na |
|
II –A Be, Mg, Ca, Sr, Ba |
Т.Д.(Э) = +2 (тұрақты тотығу дәрежесі) |
|
III – A B, Al, Ga, Jn, Tl |
Т.Д.(Э) = +3 (тұрақты тотығу дәрежесі) |
|
IV – A C, Si, Ge, Sn, Pb |
от −4 минималды аралық максималды |
|
V – A N, P, As, Sb, Bi |
−3тен
минималды аралық максималды Ерекшелік ретінде –азот:
Т.Д.(N)
−3-тен
|
|
VI – A O, S, Sc, Te, Po |
−2ден
минималды аралық максималды
Ерекшелік ретінде –оттегі:
барлық қосылыстарында Т.Д.(О) = −2,
тек
асқын тотығы қосылыстарында:
Т.Д.(О) = −1 (Н
және фтор оксидінде:
Т.Д.(О) = +2 (F |
|
VII – A F, Cl, Br, I, At |
−1ден
минималды аралық максималды Ерекшелік ретінде –фтор: Т.Д.(F) = −1 (тұрақты) |
|
Қосымша топшалардың элементтері |
|
|
В топшалары |
(Э) минималды Т.Д. = +2 (кейде +1) (Э) максималды Т.Д. топ нөміріне тең |
|
I – B Cu, Ag, Au |
Топ элементтері қосылыстарында топ нөмірінен жоғары болатын Т.Д. көрсетуі мүмкін: Т.Д.(Сu) = +2 |
|
VIII – B Fe, Co, Ni |
Топ элементтері қосылыстарында топ нөмірінен кіші болатын максималды Т.Д. көрсетеді: Т.Д. (Fe) = +6 |
в) K2Cr2O7 – атомдар зарядтарының қосындысы нөлге тең болатын молекула.
Т.Д.(К) = +1, Т.Д.(О) = −2, күкірттің тотығу дәрежесін анықтаймыз:
K![]() Сr
Сr![]() O
O![]() 2 · (+1) + (2 · х) + (7 ·
(−2)) = 0,
2 · (+1) + (2 · х) + (7 ·
(−2)) = 0,
+2 + 2х −14 = 0,
2х = +12 , х = +6, Т.Д.(Cr) = + 6.
г)
Cr2O![]() – ионы.
Күрделі
ионның құрамындағы атомдар зарядтарының алгебралық қосындысы
осы ионның зарядына тең болады деген тұрғыдан
белгісіздері бар теңдеуді құрастырамыз:
– ионы.
Күрделі
ионның құрамындағы атомдар зарядтарының алгебралық қосындысы
осы ионның зарядына тең болады деген тұрғыдан
белгісіздері бар теңдеуді құрастырамыз:
(Cr2O![]() )
)![]() (2 · х) + (7 ·
(−2)) = −2,
(2 · х) + (7 ·
(−2)) = −2,
2 х −14 = −2,
2х = +12 ,
х = +6 , Т.Д.( Cr) = + 6.
2 Тотығу-тотықсыздану процестердің негізі
Тотығу-тотықсыздану процесі екі қарама-қарсы процестерден тұрады.
Тотығу процесінде электрондарды беру нәтижесінде тотықсыздандырғыштың тотығу дәрежесі жоғарылайды. Электрондарды беретін атом, молекула немесе ион тотықсыздандырғыш деп аталады
(Тсз-ш).
Тсз-ш 2J![]()
![]() J
J![]() ,
тотығу процесі.
,
тотығу процесі.
Тотықсыздану – электрондарды қосып алу процесі, тотықтырғыштың тотығу дәрежесінің төмендеуіне әкеледі. Электрондарды қосып алатын атом, молекула немесе ион тотықтырғыш деп аталады (Тт-ш).
Тт-ш
J2 ![]() 2J
2J![]() ,
тотықсыздану
процесі.
,
тотықсыздану
процесі.
Типтік тотықтырғыштарга жатады:
1) оттегі және галогендер (O![]() ,
F
,
F![]() ,
Cl
,
Cl![]() ,
Br
,
Br![]() ,
J
,
J![]() );
);
2)
жоғары тотығу
дәрежесіндегі оң зарядталған металл
иондары (Fe![]() Cl3,
Sn
Cl3,
Sn![]() Cl4);
Cl4);
3)
жоғары тотығу
дәрежесіндегі металл атомы бар күрделі иондар
мен молекулалар
(KMn![]() O4,
K2Cr
O4,
K2Cr![]() O
O![]() ,
KCl
,
KCl![]() O3,
KCl
O3,
KCl![]() O4,
HN
O4,
HN![]() O3,
H2S
O3,
H2S![]() O4).
O4).
Типтік тотықсыздандырғыштарға жатады:
1) металдар мен кейбір бейметалдар (Zn0,
Mn0,
C0,
H![]() );
);
2)
теріс зарядталған
бейметалдар иондары (HCl![]() ,
H2S
,
H2S![]() ,
HBr
,
HBr![]() ,
CaH
,
CaH![]() );
);
3)
төменгі тотығу
дәрежесіндегі металдардың оң зарядталған иондары (Fe![]() Cl2,
Sn
Cl2,
Sn![]() Cl2).
Cl2).
Жоғары тотығу дәрежесіндегі элемент атомы тотығу дәрежесін жоғарылата алмайды (яғни электрондарын бере алмайды) және тек қана тотықтырғыш қасиеттерін көрсетеді.
Төменгі тотығу дәрежесіндегі элемент атомы тотығу дәрежесін төмендете алмайды (яғни электрондарды қоса алмайды) және тек тотықсыздандырғыш қасиеттерді көрсетеді.
Аралық тотығу дәрежесі бар элемент атомы екідайлылық, яғни
тотықтырғыш та, тотықсыздандырғыш та қасиеттерді көрсете алады.
Типтік есеп №2
HCl, Cl2, HClO, HClO2, HClO3, HClO4 қосылыстарында хлордың тотығу дәрежесі бойынша қайсысы тек тотықтырғыш, тек тотықсыздандырғыш, тотықтырғыш та, тотықсыздандырғыш та қасиеттерін көрсетеді?
Шығарылуы
Берілген қосылыстарда хлордың тотығу дәрежесі сәйкесінше тең:
а) H![]() Cl
Cl![]() ; Т.Д.(Cl) = -1 – минималды тотығу
дәрежесін көрсететіндіктен тотығу-тотықсыздану
реакциясында (ТТР) НСI тек тотықсыздандырғыш болады.
; Т.Д.(Cl) = -1 – минималды тотығу
дәрежесін көрсететіндіктен тотығу-тотықсыздану
реакциясында (ТТР) НСI тек тотықсыздандырғыш болады.
б) Cl![]() ; Т.Д.(Cl) = 0 аралық тотығу
дәрежесінде болғандықтан ТТР-да Cl2 тотықтырғыш
та, тотықсыздандырғыш та болады.
; Т.Д.(Cl) = 0 аралық тотығу
дәрежесінде болғандықтан ТТР-да Cl2 тотықтырғыш
та, тотықсыздандырғыш та болады.
в) H![]() Cl
Cl![]() O
O![]() 1 · (+1) + 1 · x + 1 · (-2) = 0 ,
1 · (+1) + 1 · x + 1 · (-2) = 0 ,
+1 + x - 2 = 0 ,
x = +1.
Т.Д.(Cl) = +1 - аралық тотығу дәрежесінде болғандықтан ТТР-да HClO тотықтырғыш та, тотықсыздандырғыш та қасиеттерін көрсетеді.
г) H![]() Cl
Cl![]() O
O![]() 1 · (+1) + 1 · x + 2 · (-2) = 0 ,
1 · (+1) + 1 · x + 2 · (-2) = 0 ,
+1 + x - 4 = 0 ,
x = +3.
Т.Д.(Cl) = +3 - аралық тотығу дәрежесінде болғандықтан ТТР-да HClO2 тотықтырғыш та, тотықсыздандырғыш та қасиеттерін көрсетеді.
д) H![]() Cl
Cl![]() O
O![]() 1 · (+1) + 1 · x + 3 · (-2) = 0,
1 · (+1) + 1 · x + 3 · (-2) = 0,
+1 + x - 6 = 0,
x = +5.
Т.Д.(Cl) = +5 - аралық тотығу дәрежесі; реакцияның өту шартына байланысты HClO3 ТТР-да тотықтырғыш та, тотықсыздандырғыш та бола алады.
е) H![]() Cl
Cl![]() O
O![]() 1 · (+1) + 1 · x + 4 · (-2) = 0 ,
1 · (+1) + 1 · x + 4 · (-2) = 0 ,
+1 + x - 8 = 0 ,
x = +7.
Т.Д.(Cl) = +7 – максималды тотығу дәрежесі болғандықтан ТТР-да HClO4 тек тотықтырғыш болады.
3 Тотығу-тотықсыздану реакциялардың теңдеулерін құрастыру әдістері
Тотығу-тотықсыздану реакциялардың (ТТР) теңдеулерін құрастыру кезінде келесі реттілікті сақтау ыңғайлы болады: бастапқы заттарда алдымен тотықсыздандырғышты, одан кейін тотықтырғыш пен ортаны (қажет болса); өнім заттарында – алдымен тотығу өнімін, одан кейін тотықсыздану өнімі мен басқа заттарды жазады. Тотығу-тотықсыздану реакциялардың (ТТР) теңдеулерін құрастыруда екі әдіс қолданылады: электрондық баланс әдісі және иондық-электрондық баланс әдісі.
3.1 Электрондық баланс әдісі
Электрондық баланс әдісі бастапқы және өнім заттарында атомдардың тотығу дәрежелерін салыстыруға негізделген. Негізгі талап: тотықсыздандырғыштың берген электрондар саны тотықтырғыштың қосып алған электрондар санына тең болуы қажет. Мұнымен қатар, реакция нәтижесінде қандай зат түзілетінін білу қажет.
Типтік есеп № 3
Электрондық баланс әдісін қолдана отырып,
келесі сұлба бойынша өтетін H2S + KMnO4
+ H2SO4
![]() S + MnSO4 + K2SO4 + H2O
S + MnSO4 + K2SO4 + H2O
тотығу-тотықсыздану реакциясында тотықтырғыш пен тотықсыздандырғышты анықтап, коэффициенттерін табыңыз.
Шығарылуы
а) Реакцияға дейін және реакциядан кейін элемент атомдары тотығу дәрежелерінің өзгеруін анықтаймыз:
H![]() S
S![]() +K
+K![]() Mn
Mn![]() O
O![]() +H
+H![]() S
S![]() O
O![]()
![]() S0 + Mn
S0 + Mn![]() S
S![]() O
O![]() +K
+K![]() S
S![]() O
O![]() + H
+ H![]() O
O![]() .
.
Тотығу дәрежелері өзгеретін элементтер - күкірт пен марганец: тотықсыздандырғыш (Т-с-ш) Н2S (күкірттің тотығу дәрежесі минималды), тотықтырғыш (Т-т-ш) KMnO4 (молекулада марганец жоғарғы тотығу дәрежесінде).
б) Процестердің электрондық теңдеулерін құрастырамыз:
![]()
![]() Т-с-ш 5
S
Т-с-ш 5
S![]()
![]() S0
, тотығу
процесі;
S0
, тотығу
процесі;
Т-т-ш 2
Mn![]()
![]() Mn
Mn![]() ,
тотықсыздану процесі.
,
тотықсыздану процесі.
Берілетін және қосып алатын электрондар саны бірдей болу керек, сондықтан бірінші теңдеуді 5-ке, екіншісін – 2-ге көбейтеміз.
в) Тотықтырғыш, тотықсыздандырғыш және сәйкесінше реакция өнімдерінің алдына коэффициенттерді қоямыз: 5 молекула күкіртті сутек пен 2 молекула калий перманганатын алу қажет, сонда күкірттің 5 атомы мен марганец сульфатының 2 молекуласы түзіледі:
5H2S + 2KMnO4 + H2SO4 → 5S + 2MnSO4 + K2SO4 + H2O.
г) Теңдеудің оң және сол жақтарында тотығу-тотықсыздану процесіне қатыспайтын металл атомдарының саны (бұл металл - калий) тең.
д) Енді қышқыл қалдықтарын теңестіреміз. Оң жағында MnSO4 екі молекуласы мен K2SO4 бір молекуласының құрамында 3 қышқыл қалдығы бар (SO42-), сол жағында - H2SO4 қүрамында бір қышқыл қалдығы бар. Қшқыл қалдықтары бойынша теңдікті орнату үшін H2SO4 алдына 3 коэффициентін қою қажет:
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + H2O.
е) Сутек иондарының санын теңестіреміз: сол жағында 5 молекула H2S пен 3 молекула H2SO4 құрамында 16 сутегі ионы бар, сондықтан теңдіктің оң жағындағы Н2О-ң алдына 8 коэффициентін қою қажет:
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O.
ж) Теңдеудің дұрыс жазылуын дәлелдейміз:
теңдеудің сол жағында оттегі атомдарының саны 2 · 4 + 3 · 4 = 20, оң жағында 2 · 4 + 1 · 4 + 1 · 8 = 20.
3.2 Иондық-электрондық баланс әдісі (жартылай реакциялар әдісі)
Сулы ерітінділерде өтетін
тотығу-тотықсыздану реакцияларын (ТТР), иондық-электрондық
баланс әдісімен (жартылай реакциялар әдісімен) теңестіреді.
Электрондық баланс әдісімен салыстырғанда иондық-электрондық
баланс әдісінің артықшылығы келесі: мұнда Mn![]() , Cr
, Cr![]() , S
, S![]() иондары емес, MnO
иондары емес, MnO![]() , Cr2O
, Cr2O![]() , SO
, SO![]() -иондары бар. Мұнымен қатар,
тотығу-тотықсыздану реакцияларын осы әдіспен
теңестіргенде атомдардың тотығу дәрежелерін
анықтау қажет емес, бірақ процеске белсенді қатысушы
ортаның рөлі ескеріледі.
-иондары бар. Мұнымен қатар,
тотығу-тотықсыздану реакцияларын осы әдіспен
теңестіргенде атомдардың тотығу дәрежелерін
анықтау қажет емес, бірақ процеске белсенді қатысушы
ортаның рөлі ескеріледі.
Жартылай реакциялар әдісін қолданғанда ТТР кейбір қатысушылары (өнімдер, орта) реакцияның молекулалық теңдеуін шығарғанда анықталуы мүмкін.
Типтік есеп № 4
Жартылай реакциялар әдісін қолданып,
KNO2 + K2Cr2O7
+ … ![]() KNO3 + Cr2(SO4)3
+ …
KNO3 + Cr2(SO4)3
+ …
сұлбасы бойынша өтетін тотығу-тотықсыздану реакциясын құрастырып, теңестіріңіз.
Шығарылуы
а) Өзінің зарядын өзгертетін элементтің тотығу дәрежесін (Т.Д.) есептейік; берілген элементі бар бөлшектердің астын сызайық:
K![]() +
K2
+
K2![]() + …
+ … ![]() K
K![]() +
+
![]() (SO4)3 + …
(SO4)3 + …
б) Тотығу-тотықсыздану реакциясы сұлбасының қысқаша иондық теңдеуін құрастырайық:
![]() NO
NO![]() +
Cr2O
+
Cr2O![]()
![]() NO
NO![]() + 2Cr
+ 2Cr![]() .
.
в) Тотығу және тотықсыздану процестерінің екі жартылай реакцияларының бөлек теңдеулерін құрастырайық:
Т-т-с-ш
│ ![]()
![]()
![]() ,
тотығу процесі.
,
тотығу процесі.
Берілген жартылай реакцияда теңдеудің сол жағындағы оттек атомының кемдігі судың бір молекуласы арқылы толтырылады, онда теңдеудіің оң жағына баланс үшін екі Н+- катионын жазамыыз. Жартылай реакцияның сол және оң жақтары бөлшектерінің қосынды зарядын есептеп, тотығу процесіне екі электрон қатысатынын анықтаймыз (берілген электрондар саны n(ē) = 2).
Т-т-ш │ ![]()
![]()
![]() , тотықсыздану процесі.
, тотықсыздану процесі.
Бұл жағдайда алдымен
хром элемент атомын теңестіреміз:
сол жағында
Cr2O![]() дихромат – ионының құрамында екі атом хром болғандықтан
оң жағына екі ион Cr
дихромат – ионының құрамында екі атом хром болғандықтан
оң жағына екі ион Cr![]() жазамыз. Теңдеудің оң
жағындағы оттек атомының кемдігі судың жеті молекуласымен
толтырылады, теңдеудің сол жағына 14 Н+-катионын
жазамыз. Жартылай реакцияның сол және оң
жақтарындағы зарядтардың алгебралық қосындысын
есептеп, қабылданатын электрондар саны 6-ға тең екендігін
анықтаймыз.
жазамыз. Теңдеудің оң
жағындағы оттек атомының кемдігі судың жеті молекуласымен
толтырылады, теңдеудің сол жағына 14 Н+-катионын
жазамыз. Жартылай реакцияның сол және оң
жақтарындағы зарядтардың алгебралық қосындысын
есептеп, қабылданатын электрондар саны 6-ға тең екендігін
анықтаймыз.
г) Берілген тотығу-тотықсздану реакциясының толық иондық-олекулалық теңдеуін құрастырамыз. Сәйкес келетін көбейткішке көбейтіп екі құрастырылған жартылай реакциялар теңдеулерін қосамыз. Көбейткішті ең кіші еселегіш ережесі бойынша анықтаймыз: берілген және қабылданған электрондар үшін ең кіші жалпы еселегіші 6-ға тең. Бұл санды 2-ге бөлсек, тотықсыздандырғыш пен оның тотығуының өнімдері үшін 3 көбейткішін аламыз, ал 6-ға бөлсек – тотықтырғыш пен оның тотықсыздану өнімдері үшін көбейткішті аламыз.
![]()
![]()
![]() Т-т-с-ш 3
Т-т-с-ш 3 ![]()
![]()
![]() , тотығу
процесі
, тотығу
процесі
![]()
![]()
![]() 6
6
Т-т-ш 1 ![]()
![]()
![]() , тотықсыздану
процесі
, тотықсыздану
процесі
![]()
3NO![]() + 3H2O +
Cr2O
+ 3H2O +
Cr2O![]() + 14H
+ 14H![]() → 3NO
→ 3NO![]() + 6H
+ 6H![]() + 2Cr
+ 2Cr![]() +
7H2O.
+
7H2O.
д) Сол және оң жағында Н+-сутек иондары мен Н2О молекулаларын қысқартып, келесі иондық-молекулалық теңдеуді аламыз:
3NO![]() + Cr2O
+ Cr2O![]() + 8H
+ 8H![]() → 3NO
→ 3NO![]() + 2Cr
+ 2Cr![]() + 4H2O.
+ 4H2O.
е) Ле-Шателье қағидасы бойынша бұл ТТР өтуіне қандай орта қолайлы болатынын анықтаймыз: Н+-иондары реакцияның реагенттері болады, сондықтан қышқылды енгізу реакцияның тура бағытта толық өтуіне мүмкіндік туғызады.
ж) Молекулалық теңдеуге өту үшін теңдеудің сол жағындағы әрбір анионға сәйкес келетін катионды, ал әрбір катионға - анионды таңдаймыз. Тура осындай иондарды және осындай мөлшерде теңдеудің оң жағына да жазамыз. Иондарды молекулаларға біріктіреміз.
3NO![]() + Cr2O
+ Cr2O![]() +
8H
+
8H![]() →
3NO
→
3NO![]() + 2Cr
+ 2Cr![]() + 4H2O.
+ 4H2O.
3К![]() 2К
2К![]() 4SO
4SO![]() 3К
3К![]() 3SO
3SO![]() 2K
2K![]() SO
SO![]()
![]() 3KNO2 + K2Cr2O7
+ 4H2SO4 = 3KNO3 + Cr2(SO4)3
+ K2SO4 + 4H2O.
3KNO2 + K2Cr2O7
+ 4H2SO4 = 3KNO3 + Cr2(SO4)3
+ K2SO4 + 4H2O.
4 Тотықсыздандырғыш пен тотықтырғыш эквивалентінің молярлы массасы
Эквиваленттер заңына сәйкес тотықсыздандырғыштар мен тотықтырғыштар бір бірімен эквиваленттік мөлшерлерде әрекеттеседі:
![]() (4.1)
(4.1)
мұнда νэ – зат эквивалентінің мөлшері.
![]() ;
;
![]() .
.
Тотықсыздандырғыш (тотықтырғыш) эквивалентінің молярлы массасы (Мэ) тотықсыздандырғыш (тотықтырғыш) молярлы массасының берілген тотығу-тотықсыздану реакциясында тотықсыздандырғыштың (тотықтырғыштың) 1 молі беретін (қосып алатын) электрондар санына (n) қатынасымен анықталады:
![]() (4.2)
(4.2)
![]() (4.3)
(4.3)
Типтік есеп № 5
FeSO4 + HNO3 + H2SO4
![]() Fe2(SO4)3
+ NO + H2O
сұлбасы
Fe2(SO4)3
+ NO + H2O
сұлбасы
бойынша өтетін тотығу-тотықсыздану реакциясындағы тотықсыздандырғыш
пен тотықтырғыштың эквивалентінің молярлы массасын (Мэ) есептеңіз.
Шығарылуы
1 Тотығу-тотықсыздану реакциясының (ТТР) теңдеуін жартылай реакция әдісімен құрастырғанда тотықтырғыш пен тотықсыздандырғышты анықтаймыз, коэффициенттерді тауып, молекулалық теңдеуін жазамыз.
![]() SO4
+ H
SO4
+ H![]() +
H2SO4
+
H2SO4 ![]()
![]()
![]() (SO4)3 +
(SO4)3 +
![]() +
H2O
+
H2O
![]()
![]()
![]()
![]() Т-з-ш
3
Т-з-ш
3 ![]()
![]()
![]() ,
тотығу
процесі
,
тотығу
процесі
Т-ш
2 ![]()
![]()
![]() ,
тотықсыздану
процесі
,
тотықсыздану
процесі
6 Fe![]() + 2NO
+ 2NO![]() + 8H
+ 8H![]() → 6Fe
→ 6Fe![]() + 2NO +
4H2O
+ 2NO +
4H2O
6 SO![]() 3SO
3SO![]() 9SO
9SO![]()
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O.
2 Берілген тотығу-тотықсыздану реакциясына қатысатын тотықсыздандырғыш пен тотықтырғыштың эквивалентінің молярлы массасын (Мэ) анықтаймыз.
Мэ(Тотықсыздандырғыш) = Мэ(FeSO4) =
![]() =
=
![]() = 152
г/моль.
= 152
г/моль.
Мэ(Тотықтырғыш) = Мэ(HNO3) =
![]() =
=
![]() = 21
г/моль.
= 21
г/моль.
5 Өзіндік жұмыс тапсырмалары
5.1 «а» бөлшегінде асты сызылған элементтің тотығу дәрежесін есептеңіз.
5.2 «а» құрамындағы қандай зат немесе ион тотығу-тотықсыздану реакциясында тек қана тотықсыздандырғыш, тек қана тотықтырғыш рөлін атқарады, қандай зат немесе ион тотықтырғыш та, тотықсыздандырғышта болады (екі дайлылық қасиет көрсетеді)? Түсініктеме беріңіз.
5.3 «б» сұлбасы бойынша тотығу-тотықсыздану реакциясын электрондық баланс әдісімен теңестіріңіз.
5.4 «б» сұлбасы бойынша тотығу-тотықсыздану реакциясына қатысатын тотықсыздандырғыш пен тотықтырғыштың эквиваленттерінің молярлы массасын есептеңіз.
Жауабы: Мэ(Т-з-ш) = «в» г/моль; Мэ(Т-т-ш) = «г» г/моль.
5.5 Жартылай реакция әдісін қолдана отырып, «д» сұлбасы бойынша өтетін тотығу-тотықсыздану реакциясын құрастырып, теңестіріңіз. Бұл реакция жүруі үшін Ле-Шателье қағидасын қолданып, ортаның рөлін дәлелдеңіз.
Жауабы: Молекулалық теңдеудің сол жағындағы коэффициенттер қосындысы «е»-ға тең , оң жағындағы коэффициенттер қосындысы - «ж»-ға тең.
|
Нұсқа |
«а» |
«б»
|
|
1 |
KMnO4;H2SO4;CO2 |
Zn + HNO3 → Zn(NO3)2 + NH3 + H2O |
|
2 |
H2S; SO42- ; H2SO4 |
Cu2O + HNO3 → Cu(NO3)2 + NO2 + H2O |
|
3 |
NH3;
NO |
NaCrO2 + Br2 + NaOH→Na2CrO4 + NaBr + H2O |
|
4 |
HCl; Cl2;
ClО |
CuS + HNO3 → CuSO4 + NO2 + H2O |
|
5 |
KNO2; N2O5; NO3- |
H2S + K2Cr2O7 + H2SO4→S + Cr2(SO4)3 +K2SO4 |
|
6 |
NH4+; SiO32-; PbO2 |
C + H2SO4 → CO2 + H2O + SO2 |
|
7 |
KI; I2; MnO4- |
HJ + H2SO4 → J2 + SO2 + H2O |
|
8 |
KBr; Br2; CrO42- |
HCI + CrO3 → CrCI3 + CI2 + H2O |
|
9 |
PH3; SO3; PbO2 |
Ag + HNO3 → AgNO3 + NO2 + H2O |
|
10 |
HBr; NO2; H2SO4 |
SO2 + KMnO4 + H2O→H2SO4 + MnSO4 + K2SO4 |
|
11 |
N2O3; N2; KIO4 |
S + HNO3 → H2SO4 + NO |
|
12 |
Mg; CrO42-;K2CrO4 |
H2S + FeCl3 → S + FeCl2 + HCl |
|
13 |
K2S; K2SO3; Mn2O7 |
HCl + MnO2 → Cl2 + MnCl2 + H2O |
|
14 |
HI; I2; IO3- |
HCl + PbO2 → Cl2 + PbCl2 + H2O |
|
15 |
K; NO2-; ZnSO4 |
H2SO3 + HClO4 → H2SO4 + HCl |
|
16 |
Fe; CO32-; SnCl4 |
H2S + H2SO3 → S + H2O |
|
17 |
CaH2; РвO22-; CrO3 |
P + HNO3 + H2O → H3PO4 + NO |
|
18 |
Al203; CIO3- ; F2 |
PH3 + HNO3 → H3PO4 + NO |
|
19 |
K2S; Cl2; ClO4- |
NH3 + O2 → NO + H2O(пар) |
|
20 |
Na2S; H2O2; NO3- |
H2S + Cl2 + H2O → H2SO4 + HCl |
|
21 |
PH3; CO; AsO43- |
SO2 + Br2 + H2O → H2SO4 + HBr |
|
22 |
Cd; Fe2O3; SbO43- |
KJ + HNO3 + H2SO4 → J2 + NO + K2SO4 |
|
23 |
Ca; BiCl3; BiO33- |
J2 + HNO3 → HJO3 + NO + H2O |
|
24 |
Na; FeCl2; SbO3- |
As2O3 + HNO3 + H2O → H3AsO4 + NO |
|
25 |
K; KNO2; IO4- |
Cl2 + KOH → KClO3 + KCl + H2O |
Нұс-қа |
«в» |
«г» |
«д» |
«е» |
«ж»
|
|
1 |
32,5 |
7,9 |
KBiO3 + Cr2(SO4)3 + ...®Bi2(SO4)3 + K2Cr2O7 +... |
12 |
10 |
|
2 |
72,0 |
63,0 |
KJ + HNO2 + ... ® J2 + NO + K2SO4 + ... |
5 |
6 |
|
3 |
35,7 |
80,0 |
K2Cr2O7 + SO2 + ... ® Cr2(SO4)3 + SO3 + ... |
8 |
9 |
|
4 |
12,0 |
63,0 |
K2Cr2O7 + HC1 ® CrC13 + C12 + ... |
15 |
14 |
|
5 |
17,0 |
49,0 |
KJ + K2Cr2O7 + ... ® J2 + Cr2(SO4)3 + ... |
14 |
15 |
|
6 |
3,0 |
49,0 |
Zn + H3AsO3 + ... ® AsH3 + ZnSO4 + ... |
7 |
7 |
|
7 |
64,0 |
49,0 |
Te + H2O + ... ® K2TeO3 + K2Te + ... |
9 |
6 |
|
8 |
36,5 |
50,0 |
КAsO2 + J2 + ... ® K3AsO4 + KJ + ... |
6 |
5 |
|
9 |
108 |
63,0 |
BiC13 + Br2 + ... ® KBiO3 + KBr + ... |
8 |
9 |
|
10 |
32,0 |
31,6 |
KCrO2 + PbO2 + ... ® K2PbO2 + K2CrO4 + ... |
13 |
9 |
|
11 |
5,3 |
21,0 |
CrC13 + KBiO3 + ... ® Bi(OH)3¯ + K2CrO4 + ... |
13 |
11 |
|
12 |
17,0 |
162 |
HC1 + KMnO4 + … ® MnC12 + C12 + ... |
7 |
4 |
|
13 |
8,3 |
43,5 |
CrC13 + H2O2 + ... ® K2CrO4 + H2O + ... |
15 |
16 |
|
14 |
8,3 |
119 |
Fe(OH)3¯ + Br2 + ... ® K2FeO4 + KBr + ... |
15 |
16 |
|
15 |
41,0 |
12,6 |
KCrO2 + KC1O + ... ® K2CrO4 + KC1 + ... |
7 |
6 |
|
16 |
17,0 |
20,5 |
KCrO2 + H2O2 + ... ® K2CrO4 + H2O + ... |
5 |
4 |
|
17 |
6,2 |
21,0 |
K2SnO2 + BiC13 + ... ® Bi¯ + K2SnO3 + ... |
11 |
14 |
|
18 |
4,3 |
21,0 |
FeSO4 + KC1O3 + ... ® Fe2(SO4)3 + KC1 + ... |
10 |
7 |
|
19 |
3,4 |
8,0 |
K2Cr2O7 + KNO2 + ... ® Cr2(SO4)3 + KNO3 + ... |
8 |
9 |
|
20 |
4,3 |
35,5 |
KJO3 + FeSO4 + ... ® KJ + Fe2(SO4)3 + ... |
10 |
7 |
|
21 |
32,0 |
80,0 |
Zn + K3AsO3 + ... ® AsH 3+ ZnC12 |
13 |
10 |
|
22 |
83,0 |
21,0 |
Co(OH)2¯ + Br2 + ... ® Co(OH)3¯ + NaBr + ... |
5 |
4 |
|
23 |
25,4 |
21,0 |
HJ + H2SO4 ® J2 + H2S + ... |
9 |
9 |
|
24 |
49,5 |
21,0 |
Cr2(SO4)3 + Na2O2 +... ® Na2CrO4 + H2O + ... |
8 |
7 |
|
25 |
3,55 |
35,5 |
KBrO3 + HBr ® Br2 + КВr + ... |
7 |
7 |
5 тақырып
Электрохимия негіздері. Гальваникалық элементтер
1 Стандартты электродтық потенциал. Нернст теңдеуі
Электрохимия – химиялық және электрлік энергиялардың өзара бірінің біріне ауысу процестерін зерттейтін химия бөлімі.
Электролитпен контактілейтін металл электрод деп аталады. Өз тұзының ерітіндісіне батырылған металл пластинасы мен ерітінді арасында қос электрлік қабат (ҚЭҚ) түзілгенде электродтық потенциал (Е) деп аталатын потенциалдардың айырымы пайда болады.
Меn+-иондары ерітіндіге ауысқан сайын металл пластинасының теріс заряды мен ерітіндінің оң заряды артады.
Мұнымен қатар Меn+-иондарының Ме0-атомдарына дейін тотықсыздану кері реакциясы да жүреді. Бір мезгілде тура және кері процестердің жылдамдықтары теңеседі де тепе-теңдік орнайды. Тепе-теңдік жағдайында орнайтын электродтық реакцияның потенциалы тепе-теңдік электродтық потенциал деп аталады.
Мысалы, мырыш пластинасын мырыш хлориді ерітіндісіне батырғанда Zn2+-иондарының бір бөлігі пластинадан ерітіндіге ауысады. Бұл кезде пластина теріс зарядталады. Мырыш электродында келесі реакция өтеді:
Zn0 ![]()
![]() Zn2+.
Zn2+.
Мыс пластинасын мыс тұзы ерітіндісіне батырғанда ерітіндідегі мыс иондары пластина бетінде тотықсызданып, оны оң зарядтайды:
Cu2+ ![]() Cu0.
Cu0.
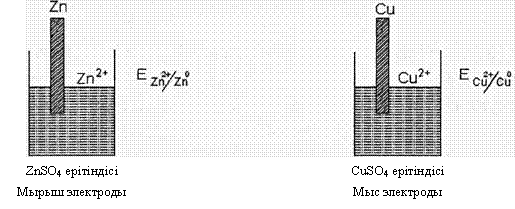 |
Фазалардың агрегаттық күйі әр түрлі, яғни қатты және сұйық болғандықтан, потенциалдың секіруінің абсолюттік мөлшерін тәжірибелік жолмен өлшеуге болмайды. Ол үшін салыстырушы электрод ретінде алынған және зерттелетін электрод арасындағы потенциалдарының айырымын өлшейді. Салыстырушы электрод ретінде стандартты сутектік электродты қолданады.
Стандартты сутектік электрод сутек иондарының концентрациясы с(Н+) = 1 моль/л қышқыл ерітіндісімен және қысымы 1 атм (101,3 кПа) сутегі газымен контактілейтін платина пластинасынан тұрады. Сутек электроды потенциалының абсолюттік мәні кез келген температурада нөлге тең деп саналады:
![]() =
± 0,00 В.
=
± 0,00 В.
Егер металл иондарының концентрациясы с(Меn+) = 1 моль/л тұз ерітіндісіне батырылған металл пластинасы мен стандартты сутек электродынан гальваникалық элементті құрастырса, оның электродтық потенциалдарының айырымын оңай өлшеуге болады.
Қалыпты жағдайда: Т = 298 К, Р = 1 атм (101,3 кПа), с(Меп+) = 1 моль/л өлшенген металдың электродтық потенциалы стандартты электродтық потенциал деп аталады және Е0 оф/вф = … В деп белгіленеді.
Сутек электроды бойынша металдардың стандартты электродтық потенциалдарын белсенденділігі бойынша Н.Н.Бекетов ұсынған белсенділік қатарына орналастыруға болады: K Ca Na Mg Al Mn Zn Fe Ni Sn Pb Н2 Cu Hg Ag Au. Е0оф/вф мәндері көптеген электрохимиялық жүйелер үшін анықталған және кестелерде берілген.
Кез келген жартылай элементте тотықтырғыш және тотықсыздандырғышпен қатар олардан түзілетін заттар болады. Олар тотыққан немесе тотықсызданған формалардан тұратын тотығу-тотықсыздану жүйелерін құрайды.
Тотығу-тотықсыздану жүйесінің потенциалы Нернст теңдеуі бойынша анықталады. Бұл теңдеу электродтық потенциалдың электродтық процестерге қатысатын заттар концентрациясына, ортаның температурасына, сутек иондарының концентрациясына (ерітінді рН-на) тәуелділігін анықтайды:
![]() =
=
![]() +
+ ![]() , (5.1)
, (5.1)
мұнда
![]() –
сәйкес ерітіндісіндегі тотығу-тотықсыздану
жүйесінің электродтық потенциалы;
–
сәйкес ерітіндісіндегі тотығу-тотықсыздану
жүйесінің электродтық потенциалы;
![]() –
тотығу-тотықсыздану
жүйесінің стандартты электродтық
потенциалы;
–
тотығу-тотықсыздану
жүйесінің стандартты электродтық
потенциалы;
![]() – универсал
газ тұрақтысы (8,314 Дж/моль∙К);
– универсал
газ тұрақтысы (8,314 Дж/моль∙К);
![]() –
Кельвин шкаласы бойынша температура;
–
Кельвин шкаласы бойынша температура;![]()
![]() –Фарадей саны
(96500 Кл/моль);
–Фарадей саны
(96500 Кл/моль);
![]() –
тотығу-тотықсыздану процесіне
қатысатын электрондар саны.
–
тотығу-тотықсыздану процесіне
қатысатын электрондар саны.
![]() ,
, ![]() –
ерітіндідегі тотыққан және
тотықсызданған формалардың активтілігі (концентрациясы).
–
ерітіндідегі тотыққан және
тотықсызданған формалардың активтілігі (концентрациясы).
R, F, Т = 298К мәндерін қойып, натуралды логарифмнен ондық логарифмге 2,3 санға көбейту арқылы көшіп, Нернст теңдеуін қысқартылған түрде жазамыз:
![]() =
= ![]() +
+ ![]() .
(5.2)
.
(5.2)
2 Электродтардың жіктелуі
Электродтар жіктелуінің негізін электролит ерітіндісі – электрод бөлу бетінде өтетін процестер құрайды. Электродтардың үш типі болады.
1) Металл электродтары
- Электродтық реакциясы келесі:
Ме0 ![]() Меп+.
Меп+.
- Металл электродының сұлбасы: Меn+ /Ме0.
- Металл электродының потенциалын есептейтін Нернст теңдеуі:
![]() . (5.3)
. (5.3)
Сұйылтылған
ерітінділер үшін активтіліктің концентрациядан
айырмашылығы өте аз болатындықтан (а ![]() с), активтіліктің орнына концентрацияны
қолдануға болады.
с), активтіліктің орнына концентрацияны
қолдануға болады.
Егер ![]() болса, онда
болса, онда ![]() .
.
2) Газ электродтары
Газ электродтары осы газдың иондары бар ерітіндімен және газбен контактілейтін металл өткізгішінен тұрады. Металл өткізгіші электрондарды тасымалдау үшін, сонымен қатар электродтық реакцияның катализаторы болып келеді (яғни электродта тепе-теңдікті орнатады). Металл өткізгіші ерітіндіге өзінің иондарын жібермеуі тиіс. Бұл шартқа газ электродтарын жасағанда ең жиі қолданылатын платина және платина металдары сәйкес келеді.
Газ электродтарының тепе-теңдік электродтық процестеріне газ тәрізді компоненттер қатысатындықтан, олардың электродтық потенциалдары газдардың парциалды қысымдарына тәуелді болады.
а) Сутектік электрод.
- Электрод сұлбасы: Н2, Pt / Н+.
-
Сутек электродында өтетін реакция: ![]() .
.
- Сутек электродының потенциалын есептейтін Нернст теңдеуі:
![]() ,
(5.4)
,
(5.4)
мұнда ![]() - Н+ электролиті иондарының активтілігі;
- Н+ электролиті иондарының активтілігі;
![]() -
сутектің салыстырмалы
парциалды
қысымы.
-
сутектің салыстырмалы
парциалды
қысымы.
298К-де
![]() =
= ![]() ,
, ![]() екендігін ескерсек,
келесі теңдеуді аламыз:
екендігін ескерсек,
келесі теңдеуді аламыз:
![]() . (5.5)
. (5.5)
Сутек газының қысымы мен ерітінді рН мәні жоғарлаған сайын сутек электродының потенциалы төмендейді.
б) Оттектік электрод
Оттектік электродты жасау үшін металл пластинасын (мысалы, платинаны) ОН--иондары бар ерітіндімен және оттегімен контактқа әкелу қажет.
- Электрод сұлбасы: О2, Pt / ОН- .
-
Электродта өтетін
реакция: О2 + 2Н2О
+ 4![]()
![]() 4ОН-
4ОН-
- Оттектік электродтың потенциалын есептейтін Нернст теңдеуі:
![]() ,
(5.6)
,
(5.6)
мұнда
![]() -
оттектік электродтың стандарттық
потенциалы, 0,401В
тең (
-
оттектік электродтың стандарттық
потенциалы, 0,401В
тең (![]() болғанда).
болғанда).
Н2О активтілігі реакция кезінде аз өзгеретіндіктен, оны тұрақты шама деп санайды да мәнін стандартты потенциалдың мәніне енгізеді
![]() - тұрақты шама,
- тұрақты шама,
![]() ,
,
![]() болатынын
ескерсек, келесі теңдеуге келеміз:
болатынын
ескерсек, келесі теңдеуге келеміз:
![]() . (5.7)
. (5.7)
Оттегі газының қысымы жоғарлап, рН мәні төмендеген сайын оттек электродының потенциалы жоғарлайды.
Газ электродтарымен қатар салыстырушы электродтар ретінде каломель және хлоркүміс электродтарын қолдануға болады.
3) Тотығу-тотықсыздану (редокс) электродтары
Тотығу-тотықсыздану электродтары деп реакцияларына металдар мен газдар қатыспайтын электродтарды айтады. Әдетте электрод ретінде электрондарды тасымалдаушы рөлін атқаратын, өзі реакцияға қатыспайтын Pt немесе Au пластинасы қолданылады. Ерітіндіде заттың тотыққан және тотықсызданған түрлері болады.
- Электрод сұлбасы: Pt / Ox, Red .
- Электродта өтетін реакция: Ох + ne Û Red.
- Редокс-электродтың потенциалын есептейтін Нернст теңдеуі:
![]() (5.8)
(5.8)
Тотығу-тотықсыздану электродтардың потенциалы жүйелердің тотықтырғыш немесе тотықсыздандырғыш қабілеттілігінің мөлшері болып табылады: потенциал оң мәндер жағына ығысқан сайын тотықтырғыш қабілеттілігі жоғарылайды, ал тотықсыздандырғыш қабілеттілігі - теріс мәндер жағына қарай.
Типтік есеп № 1
Темір иондарының
концентрациясы с(Fe2+) = 0,1моль/л
FeCI2
ерітіндісіне
батырылған темір электродының электродтық потенциалын
есептеңіз.
Жүйенің стандартты электродтық
потенциалы: ![]() = - 0,44
B.
= - 0,44
B.
Шығарылуы
а) Темір электродын FeCI2 ерітіндісіне батырғанда тотығу-тотықсыздану процесі өтеді:
Fe0
![]() Fe2+.
Fe2+.
б) Нернст теңдеуі бойынша (5.3) темір электродының реалды электродтық потенциалын есептейік:
![]() =
=
![]()
![]() +
+
![]() ℓg c(Fe2+).
ℓg c(Fe2+).
![]() =
- 0,44 + 0,0295 ∙ ℓg 10-1,
=
- 0,44 + 0,0295 ∙ ℓg 10-1, ![]() = - 0,44 – 0,0295 = -
0,47 В.
= - 0,44 – 0,0295 = -
0,47 В.
Жауабы:
![]() = - 0,47
B.
= - 0,47
B.
Типтік есеп № 2
Реакциясы MnO![]() + 8H+
+ 8H+
![]() Mn2+
+ 4H2O теңдеуі бойынша өтетін
Mn2+
+ 4H2O теңдеуі бойынша өтетін
электродтың тотығу-тотықсыздану потенциалын есептеңіз.
Жүйенің стандартты электродтық потенциалының
мәні: +1,51 В; Mn2+ және MnO![]() иондарының
концентрациялары 0,1 моль/л = 10-1 моль/л; pH = 5; T =
298 K.
иондарының
концентрациялары 0,1 моль/л = 10-1 моль/л; pH = 5; T =
298 K.
Шығарылуы
а) Нернст теңдеуі (5.8) бойынша берілген тотығу-тотықсыздану электродының потенциалы:
![]() =
=
![]() +
+
![]() .
.
Қатты фазадағы заттар концентрациялары және судың концентрациясы тұрақты шамалар және Е0 мәніне кіретіндіктен, потенциалдың теңдеуі оңайланады:
![]() =
=
![]() +
+![]() .
.
б) Есептің шартынан иондар концентрацияларының мәндерін теңдеуге енгізейік:
![]() = 1,51 + 0,0118·
= 1,51 + 0,0118·![]() ,
,
![]() = 1,51 + 0,0118·ℓg 10-1 + 0,0118·ℓg c8(H+)
– 0,0118·ℓg 10-1,
= 1,51 + 0,0118·ℓg 10-1 + 0,0118·ℓg c8(H+)
– 0,0118·ℓg 10-1,
![]() = 1,51 - 0,0118 + 0,0118 ∙ 8·ℓg c(H+) + 0,0118.
= 1,51 - 0,0118 + 0,0118 ∙ 8·ℓg c(H+) + 0,0118.
в) рН = -ℓg c(H+) болғандықтан, теңдеу келесі түрге келеді:
![]() = 1,51 + 0,018 ∙ 8 ∙(-5) = 1,04.
= 1,51 + 0,018 ∙ 8 ∙(-5) = 1,04.
Жауабы:
![]() = +1,04 B.
= +1,04 B.
Типтік есеп № 3
Сутек электродының потенциалы – 0,082 В тең ерітіндідегі Н+ -иондарының концентрациясын есептеңіз.
Шығарылуы
а) Нернст теңдеуін (5.4) негізге алып және рН = -ℓg c(H+) екендігін ескере отырып, сутек электродының электродтық потенциалын есептейтін Нернст теңдеуін жазамыз:
Е![]() = - 0,059 pH.
= - 0,059 pH.
Бұл теңдеуден шығарамыз: рН = -
![]() = -
= -
![]() = 1,39.
= 1,39.
б) Н+-иондарының концентрациясын есептейміз:
-ℓg c(H+) = 1,39; ℓg c(H+) = -1,39,
с(Н+) = 10-1,39 = 0,041 моль/л.
Жауабы: c(H+) = 0,041 моль/л.
Типтік есеп № 4
Зерттелетін ерітіндіде сутек электродының потенциалы – 0,590 В. Гидроксид-иондардың концентрациясы мен ерітіндінің рН есептеңіз.
Шығарылуы
а) Сутек электроды потенциалының формуласы бойынша ерітіндінің рН есептейміз:
Е![]() = E0
= E0![]()
![]() +
+![]() 0,059·ℓg c(H+),
0,059·ℓg c(H+),
Мұнда E0![]() = 0,
яғни Е
= 0,
яғни Е![]() = - 0,059
pH.
= - 0,059
pH.
Бұл теңдеуден: рН = - ![]() =
=
![]() =
10.
=
10.
б) рН = 10 мәнінен сутек иондарының концентрациясын анықтаймыз:
c(H+) = 10-10 моль/л.
в) Судың иондық көбейтіндісі теңдеуін қолдана отырып:
c(H+) ∙ c(OH-) = 10-14,
гидроксид-иондар концентрациясын есептейміз:
c(OH-) = ![]() = 10-4.
= 10-4.
Жауабы: рН = 10, с(ОН-) = 10-4моль/л.
Типтік есеп № 5
298 К-де иондар
концентрацияларының қатынасы 1:10,
![]() = - 0,407 В. Cr3+/Cr2+
жүйесінің
тотығу-тотықсыздану потенциалын есептеңіз.
= - 0,407 В. Cr3+/Cr2+
жүйесінің
тотығу-тотықсыздану потенциалын есептеңіз.
Шығарылуы
Нернст теңдеуі
(5.8)
бойынша тотығу-тотықсыздану жүйесінің потенциалын
есептейміз: ![]() =
= ![]() +
+ ![]() ;
;
![]() = -0,407 + 0,059·
= -0,407 + 0,059·![]() ;
;
![]() =
-0,407 + 0,059·ℓg10-1 = -0,466.
=
-0,407 + 0,059·ℓg10-1 = -0,466.
Жауабы: ![]() = - 0,466 В.
= - 0,466 В.
3 Гальваникалық элемент. Гальваникалық элементтің ЭҚК
Тотығу-тотықсыздану реакцияның энергиясы электр тоғына айналатын электролит ерітіндісіне батырылған екі электродтан тұратын жүйе гальваникалық элемент деп аталады.
3.1 Гальваникалық элемент туралы жалпы тұрғылар
1) Гальваникалық элементе өздігінен жүретін тотығу-тотықсыздану реакциясы іске асады.
2) Кез келген гальваникалық элементте электр тоғының түзілу себебі - электродтар арасындағы потенциалдар айырымы.
3) Гальваникалық элементте анодтың рөлін электродтық потенциалының мәні төменірек (терісірек) болатын электрод атқарады. Анодта әрқашан тотығу процесі жүреді. Анод – гальваникалық элементтің теріс полюсі.
4) Гальваникалық элементтің потенциалы жоғарырақ болатын электрод катодтың рөлін атқарады. Электрод батырылған электролиттің катиондары әрқашан катодта тотықсызданады. Катод – гальваникалық элементтің оң полюсі.
5) Гальваникалық элементтің екі электроды потенциалдарының айырымы неғұрлым үлкен шама болса, соғұрлым оның электрқозғаушы күші (ЭҚК) де үлкен болады.
ЭҚК (Г.Э.) = Е катод - Е анод > O, (5.9)
мұнда Е катод, Еанод – сәйкесінше катод пен анодтың электродтық потенциалдары.
6) Гальваникалық элементе тек өздігінен жүретін тотығу-тотықсыздану реакциясы іске асатындықтан, ∆G < O, мұнда ∆G – Гиббстің бос энергиясы.
7) Гальваникалық элемент электр тоғының көзі болғандықтан мұнда электр тоғының жұмысы деген түсінік енгізіледі:
А = n(ē) ∙ F ∙ ЭДС (Г.Э) = n(ē) ∙ F ∙ E, (5.10)
мұнда Е – гальваникалық элементтегі потенциалдардың айырымы (ЭҚК);
F – Фарадей саны (96500 Кл);
n(ē) – тотығу-тотықсыздану реакциясына қатысатын электрондар саны.
3.2 Гальваникалық элемент жұмысының сұлбасы
Гальваникалық элементтің құрылымын әдетте электрохимиялық сұлбамен өрнектейді.
Электрохимиялық сұлбада алдымен бір электродтың материалы, одан кейін – бұл электрод батырылған ерітіндісі, екінші электрод батырылған ерітінді, соңында – екінші электродтың материалы. Электрод пен электролит ерітіндісі арасындағы бөлу бетін бір таяқшамен көрсетеді (I). Қос таяқшаны екі ерітіндінің арасындағы бөлу бетін көрсету үшін қояды.
Мырыш-сутектік гальваникалық элементтің құрылымы келесі сұлбамен көрсетіледі:
(-) Zn│ZnSO4, ер-ді ║ ер-ді H2SO4 │Pt, Н2 (+).
3.3 Химиялық және концентрациялық гальваникалық элементтер
Электродтардың әр түрлі табиғатына байланысты химиялық энергиядан электр энергиясы түзілетін гальваникалық элементтер химиялық гальваникалық элементтер деп аталады. Мысалы, жоғарыда келтірілген цинк – сутектік гальваникалық элемент.
Мұнымен қатар концентрациялық гальваникалық элементтер де болады. Концентрациялық гальваникалық элемент иондарының активтілігі әр түрлі болатын тұздарының ерітінділеріне батырылған екі бірдей электродтан тұрады. Концентрациялық гальваникалық элементтің мысалы – мыс иондарының концентрациясы сI және сII мыс сульфаты ерітіндісіне батырылған мыс электродтары. Бұл элементтің сұлбасы келесі:
(-) Сu│CuSO4 , ер-ді ║ CuSO4 , ер-ді│Cu (+) сI < сII.
![]()
![]()
Концентрациялық гальваникалық тізбекте анод рөлін иондарының концентрациясы азырақ болатын ерітіндіге батырылған электрод атқарады. Гальваникалық тізбек жұмыс істегенде анодта мыстың тотығу процессі жүреді:
(-) А: Сu0 ![]() Сu2+,
Сu2+,
ал катодта – ерітіндідегі мыс иондарының тотықсыздануы:
(+) К: Сu2+ ![]() Сu0.
Сu0.
Концентрациялық гальваникалық элементтің электродтық потенциалы электролит иондары концентрацияларының қатынасына тәуелді болады.
сI < сII болған жағдайда
![]()
![]() =
=
![]() .
(5.11)
.
(5.11)
Типтік есеп № 6
Темір (ІІ) сульфаты ерітіндісіндегі темір пластинасы мен мыс (ІІ) сульфаты ерітіндісіндегі мыс пластинасынан құрастырылған гальваникалық элементтің жұмысының сұлбасын жазыңыз. Гальваникалық элементтің электродтарында қандай процестер өтеді? Реакция теңдеулерін жазыңыз.
Шығарылуы
а) Темір және мыс электродтарының стандартты электродтық потенциалдарының мәндерін кестеден табамыз (3 Қосымша):
![]() = -0,44 В;
= -0,44 В;
![]() =
+0,34 B.
=
+0,34 B.
Мыс электродының стандартты электродтық потенциалының мәні темірдікінен жоғары:
![]() = -0,44 В <
= -0,44 В <
![]() =
+0,34 B.
=
+0,34 B.
Олай болса, мыс электроды берілген гальваникалық элементте катодтың, ал темір электроды – анодтың рөлін атқарады.
б) Гальваникалық элементтің электрохимиялық сұлбасын келтірейік:
(-) Fe│FeSO4 ║ CuSO4│Cu (+).
в) Гальваникалық элементтің электродтарында өтетін процестерді жазайық.
![]() 1
х (-) А
Fe0
1
х (-) А
Fe0 ![]() Fe2+,
тотығу
процесі
Fe2+,
тотығу
процесі
1 х
(+) К Сu2+ ![]() Сu0 ,
тотықсыздану
процесі
Сu0 ,
тотықсыздану
процесі
Токтүзуші реакция: Fe0 + Cu2+ = Fe2+ + Cu0
Fe0 + CuSO4 = FeSO4 + Cu.
Типтік есеп № 7
Гальваникалық элемент кадмий (П) нитраты тұзының 0,1 М ерітіндісіне батырылған кадмий электроды мен сынап (П) нитраты тұзының 0,01 М ерітіндісіне батырылған сынап электродынан тұрады. Гальваникалық элементтің ЭҚК есептеп, электродтық процестердің теңдеулерін жазыңыз және гальваникалық элементтің сұлбасын құрастырыңыз.
Шығарылуы
а) Стандартты электродтық потенциалдардың
мәндерін кестеден табамыз (3 Қосымша):
![]() = -0,402 B;
= -0,402 B;
![]() = +0,850 B.
= +0,850 B.
б) Нернст теңдеуі бойнша электродтық потенциалдардың мәндерін есептейміз:
![]() =
=
![]() +
+
![]() ;
;
![]() = -0,402 + 0,0295 ∙ ℓg10-1 = -0,402- 0,0295 =
-0,432 B.
= -0,402 + 0,0295 ∙ ℓg10-1 = -0,402- 0,0295 =
-0,432 B.
![]() =
=
![]() +
+
![]() ;
;
![]() = +0,850 + 0,0295 ∙ ℓg10-2 = +0,850 - 0,059 =
+0,791 B.
= +0,850 + 0,0295 ∙ ℓg10-2 = +0,850 - 0,059 =
+0,791 B.
в) Гальваникалық элементтің ЭҚК Е мәні жоғарырақ болатын электродтан (катодтан) Е мәні төменірек электродтың (анодтың) айырымынан анықталады:
ЭҚК = ![]() -
-
![]() = +0,791 - (-0,432) = +1,224 В.
= +0,791 - (-0,432) = +1,224 В.
ЭҚК > 0 болғандықтан бұл гальваникалық элемент іске асады.
г) Сынап электродында (катодта) тотықсыздану процесі, ал кадмий электродында (анодта) – тотығу процесі жүреді.
![]() 1 х (-) А
Cd0
1 х (-) А
Cd0 ![]() Cd2+,
тотығу
процесі
Cd2+,
тотығу
процесі
1 х (+) К Hg2+ ![]() Hg0 ,
тотықсыздану
процесі
Hg0 ,
тотықсыздану
процесі
Токтүзуші реакция: Cd0 + Hg2+ = Cd2+ + Hg0
Cd0 + Hg(NO3)2 = Cd(NO3)2 + Hg0.
д) Гальваникалық элементтің сұлбасы:
(-) Cd│Cd(NO3)2 ║Hg(NO3)2│Hg (+).
4 Өзіндік жұмысқа тапсырмалар
4.1
Металл иондарының концентрациясы
с(Ме+п) =
«б» моль/л электролит ерітіндісіне батырылған
«а» металл
электродының потенциалын есептеңіз. Жүйенің
стандартты электродтық потенциалы
![]() = «в» В.
= «в» В.
Жауабы: ![]() = «г» В.
= «г» В.
4.2 «д» тотығу-тотықсыздану процесі өтетін электродтың потенциалын
есептеңіз. Жүйенің
стандартты электродтық потенциалының
мәні ![]() = «е»; Т = 298 К;
рН = «ж»;
с(Оx)
және с(Red) = «з» моль/л.
= «е»; Т = 298 К;
рН = «ж»;
с(Оx)
және с(Red) = «з» моль/л.
Жауабы:
![]() = «и» В.
= «и» В.
|
Вт |
«а» |
«б» |
«в» |
«г» |
«д» |
|
1 |
Zn+2/Zn |
0,10 |
-0,76 |
-0,79 |
MnO |
|
2 |
Cu+2/Cu |
0,01 |
+0,34 |
0,28 |
MnO2 + 4H+ |
|
3 |
Mg+2/Mg |
1,00 |
-2,36 |
-2,36 |
HBrO + H+ |
|
4 |
Ag+/Ag |
0,01 |
+0,80 |
0,68 |
BrO |
|
5 |
Cd+2/Cd |
0,10 |
-0,40 |
-0,43 |
IO |
|
6 |
Hg+2/Hg |
1,00 |
+0,85 |
0,85 |
AsO |
|
7 |
Fe+2/Fe |
0,01 |
-0,44 |
-0,49 |
Cr2O |
|
8 |
Au+3/Au |
0,10 |
+1,50 |
1,48 |
CIO |
|
9 |
Cr+3/ Cr |
1,00 |
-0,74 |
-0,74 |
HCIO + H+ |
|
10 |
Bi+3/ Bi |
0,01 |
+0,21 |
0,17 |
2IO |
|
11 |
Mn+2/Mn |
0,10 |
-1,19 |
-1,22 |
2HIO + 2H+ |
|
12 |
Ca+2/ Ca |
1,00 |
-2,87 |
-2,87 |
H2O2 + 2H+ |
|
13 |
Pd+2/ Pd |
0,01 |
+0,92 |
0,86 |
O2 + 2H+ |
|
14 |
Ni+2/ Ni |
0,10 |
-0,25 |
-0,28 |
O2 + 4H+ |
|
15 |
Pt+2/ Pt |
0,01 |
+1,19 |
1,13 |
H3PO4 + 2H+ |
|
16 |
Sn+2/ Sn |
0,10 |
-0,14 |
-0,17 |
NO |
|
17 |
Au+/ Au |
1,00 |
+1,69 |
1,69 |
S(қ)
+ 2H+ |
|
18 |
Pb+2/ Pb |
0,10 |
-0,13 |
-0,16 |
Se(қ) + 2H+ |
|
19 |
Cu+/ Cu |
0,01 |
+0,52 |
0,40 |
Te(қ) + 2H+ |
|
20 |
Fe+3/ Fe |
1,00 |
-0,04 |
-0,04 |
PbO2(қ)
+ 4H+ |
|
21 |
Mo+3/Mo |
0,01 |
-0,20 |
-0,24 |
NO |
|
22 |
Co+2/ Co |
0,10 |
-0,28 |
-0,31 |
NO |
|
23 |
Na+ / Na |
1,00 |
-2,71 |
-2,71 |
2HCIO + 2H+ |
|
24 |
Co+3/ Co2+ |
0,10 |
+1,81 |
1,79 |
2CIO |
|
25 |
AI+3/ AI |
0,01 |
-1,66 |
-1,70 |
SO |
4.3 Зерттелетін ерітіндіде сутек электродының потенциалы «к» В тең. Гидроксид-иондар концентрациясы мен рН мәнін есептеңіз.
Жауабы: рН = «л»; c(ОН-) = «м» моль/л.
4.4 Электродтарында өздігінен «н» тотығу-тотықсыздану реакциясы
өтетін гальваникалық элементтің электрохимиялық сұлбасын құрастырыңыз. Гальваникалық элементтің анодтық және катодтық процестерінің теңдеулерін келтіріңіз.
|
Вт |
«е» |
«ж» |
«з» |
«и» |
«к» |
«л» |
«м» |
|
1 |
1,51 |
10 |
1,00 |
0,57 |
-0,0590 |
1,0 |
10-13 |
|
2 |
1,23 |
5 |
0,01 |
0,70 |
-0,0649 |
1,1 |
1,3 ∙ 10-13 |
|
3 |
1,34 |
2 |
0,10 |
1,28 |
-0,0708 |
1,2 |
1,6 ∙ 10-13 |
|
4 |
1,44 |
5 |
0,01 |
1,15 |
-0,0767 |
1,3 |
2,0 ∙ 10-13 |
|
5 |
1,09 |
2 |
1,00 |
0,97 |
-0,0826 |
1,4 |
2,5 ∙ 10-13 |
|
6 |
0,56 |
4 |
0,10 |
0,09 |
-0,0885 |
1,5 |
3,2 ∙ 10-13 |
|
7 |
1,33 |
5 |
1,00 |
0,64 |
-0,0944 |
1,6 |
4,0 ∙ 10-13 |
|
8 |
1,45 |
5 |
0,10 |
1,16 |
-0,1003 |
1,7 |
5,0 ∙ 10-13 |
|
9 |
1,49 |
3 |
0,01 |
1,40 |
-0,1062 |
1,8 |
6,3 ∙ 10-13 |
|
10 |
1,19 |
5 |
1,00 |
0,84 |
-0,1121 |
1,9 |
7,9 ∙ 10-13 |
|
11 |
1,45 |
10 |
0,10 |
0,80 |
-0,1180 |
2,0 |
10-12 |
|
12 |
1,78 |
2 |
0,01 |
1,60 |
-0,1239 |
2,1 |
1,3 ∙ 10-12 |
|
13 |
0,68 |
3 |
1,00 |
0,50 |
-0,1298 |
2,2 |
1,6 ∙ 10-12 |
|
14 |
1,23 |
5 |
0,10 |
0,92 |
-0,1770 |
3,0 |
10-11 |
|
15 |
-0,28 |
10 |
0,01 |
-0,87 |
-0,2360 |
4,0 |
10-10 |
|
16 |
0,87 |
2 |
1,00 |
0,72 |
-0,2950 |
5,0 |
10-9 |
|
17 |
0,17 |
2 |
0,10 |
0,08 |
-0,3540 |
6,0 |
10-8 |
|
18 |
-0,4 |
5 |
0,01 |
-0,64 |
-0,4130 |
7,0 |
10-7 |
|
19 |
-0,72 |
10 |
0,10 |
-1,28 |
-0,4720 |
8,0 |
10-6 |
|
20 |
1,45 |
3 |
1,0 |
1,10 |
-0,5310 |
9,0 |
10-5 |
|
21 |
0,84 |
5 |
0,10 |
0,55 |
-0,5900 |
10,0 |
10-4 |
|
22 |
0,77 |
2 |
0,01 |
0,53 |
-0,6490 |
11,0 |
10-3 |
|
23 |
1,63 |
3 |
1,00 |
1,45 |
-0,7080 |
12,0 |
10-2 |
|
24 |
1,47 |
5 |
0,10 |
1,11 |
-0,7670 |
13,0 |
10-1 |
|
25 |
0,20 |
3 |
0,01 |
0,02 |
-0,8200 |
14,0 |
1,0 |
4.5 Әрбір электроды иондарының концентрациясы бірдей «п» моль/л
сәйкес электролиттің ерітіндісіне батырылған «о» гальваникалық элементінің ЭҚК есептеңіз. Берілген гальваникалық элементтің катоды мен анодын анықтап, электродтық процестердің теңдеулерін жазыңыз.
Жауабы: ЭҚК = «р» В.
|
Вт |
«н» |
«о» |
«п» |
«р» |
|
1 |
Li + AgNO3 = LiNO3 + Ag |
Mn | Mn+2 || Zn+2 | Zn |
0,001 |
0,43 |
|
2 |
AI + Cr(NO3)3 = AI(NO3)3 + Cr |
Zn│Zn+2║Cu+2│Cu |
0,010 |
1,10 |
|
3 |
Zn + SnSO4 = ZnSO4 + Sn |
Li│Li+║H+│H2, Pt |
0,100 |
3,04 |
|
4 |
Ba + Hg(NO3)2 = Ba(NO3)2 + Hg |
Fe│Fe+2║Ni+2│Ni |
1,000 |
0,19 |
|
5 |
2Bi +3CuCI2 = 2BiCI3 + 3Cu |
Cd│Cd+2║Ag+│Ag |
0,001 |
1,11 |
|
6 |
Ca + ZnSO4 = CaSO4 + Zn |
H2, Pt│H+║Cu+2│Cu |
0,010 |
0,40 |
|
7 |
Cd + SnCI2 = CdCI2 + Sn |
Zn│Zn+2║Ag+│Ag |
0,100 |
1,53 |
|
8 |
Co + Pt(NO3)2 = Co(NO3)2 + Pt |
Mg│Mg+2║Ni+2│Ni |
1,000 |
2,11 |
|
9 |
Cr + FeCI3 = CrCI3 + Fe |
Cd│Cd+2║H+│H2, Pt |
0,001 |
0,31 |
|
10 |
Cu + AgNO3 = CuNO3 + Ag |
AI│AI+3║Bi+3│Bi |
0,010 |
1,87 |
|
11 |
Fe + HgCI2 = FeCI2 + Hg |
Na│Na+║Hg+2│Hg |
0,100 |
3,59 |
|
12 |
Mo + Fe(NO3)3 = Mo(NO3)3 + Fe |
Ca│Ca+2║H+│H2, Pt |
1,000 |
2,87 |
|
13 |
Hg + PtCI2 = HgCI2 + Pt |
Pb│Pb+2║Au+│Au |
0,001 |
1,73 |
|
14 |
2K + Cu(NO3)2 = 2KNO3 + Cu |
Sn│Sn+2║Cu+│Cu |
0,010 |
0,60 |
|
15 |
2Ag + PtCI2 = 2AgCI + Pt |
H2, Pt│H+║Ag+│Ag |
0,100 |
0,80 |
|
16 |
Mg + MnSO4 = MgSO4 + Mn |
Cr│Cr+3║Co+2│Co |
1,000 |
0,47 |
|
17 |
Mn + FeSO4 = MnSO4 + Fe |
Ni│Ni+2║Pb+2│Pb |
0,001 |
0,13 |
|
18 |
Na + AgNO3 = NaNO3 + Ag |
Na│Na+║H+│H2, Pt |
0,010 |
2,71 |
|
19 |
Ni + CuCI2 = NiCI2 + Cu |
Mo│Mo+3║Fe+3│Fe |
0,100 |
0,16 |
|
20 |
Pb + Hg(NO3)2 = Pb(NO3)2 + Hg |
Co│Co+2║Sn+2│Sn |
1,000 |
0,14 |
|
21 |
Pd + Pt(NO3)2 = Pd(NO3)2 + Pt |
H2, Pt│H+║Au+│Au |
0,001 |
1,69 |
|
22 |
Sn + CuCI2 = SnCI2 + Cu |
Cu│Cu+2║Pd+2│Pd |
0,010 |
1,14 |
|
23 |
Zn +Co(NO3)2 = Zn(NO3)2 +Co |
Ag│Ag+║Co+3│Co |
0,100 |
2,53 |
|
24 |
Cu +2AgNO3 = Cu(NO3)2 + Ag |
AI│AI+3║H+│H2, Pt |
1,000 |
1,66 |
|
25 |
Fe + SnCI2 = FeCI2 + Sn |
K│K+║Hg+2│Hg |
0,001 |
3,86 |
6 тақырып
Электролиз
1 Электролиз туралы түсінік
Электролиз деп электролиттің ерітіндісі немесе балқымасы арқылы электр тоғы өткенде электродтарда пайда болатын тотығу-тотықсыздану процесін айтады.
1) Электролиз процесі өтетін аппараттар (немесе ыдыстар) электролизерлар немесе электролиздік ванналар деп аталады. Электролизер электролит ерітіндісі немесе балқымасы бар ыдыстан және тұрақты ток көзіне қосылған электродтардан тұрады.
 |
![]()
![]() Электролит КА
Кn+ + Аn-
электролизер
Электролит КА
Кn+ + Аn-
электролизер
(сулы ерітінді) Н2О
2) Тотығу (электрондарды беру) процесі өтетін электрод анод деп аталады. Анод электролиз кезінде тұрақты ток көзінің оң полюсіне қосылады. Электролизерда ол оң таңбалы «+» болады (электрондарды беріп, оң зарядталады).
Анодтар еритін (белсенді) және ерімейтін (инертті) болады. Ерімейтін анодтарды платина, палладий, графиттан жасайды, соңғы кездері оксидтік рутений-титанды анодтар қолданылады (ОРТА). Ерімейтін анодтар электролиз кезінде тотықпайды. Еритін анодтар (мыс, темір, никель, мырыш ж.т.б.) электролиз кезінде тотығады.
3) Тотықсыздану (электрондарды қосып алу) процесі өтетін электрод катод деп аталады. Катод электролиз кезінде тұрақты ток көзінің теріс полюсіне қосылады. Электролизерда ол теріс таңбалы «-» болады (электрондарды қосып алу нәтижесінде теріс зарядталады). Катодтар электролиз кезінде тотықсызданбайтындықтан, оларды кез келген ток өткізетін материалдан жасауға болады.
4) Электролизерда тотығу-тотықсыздану реакциясы өздігінен жүрмейді, сондықтан электролизерда өтетін тотығу-тотықсыздану реакциялардың ΔG (Гиббс энергиясы) әрқашан > 0; ал ЭҚК әрқашан < 0.
5) Электролизерда электролиттің ыдырауы өту үшін электродтарға ток көзінен потенциалдардың кез келген айырымын емес, берілген электролиттің ыдырауына қажетті мөлшерін ғана береді. Потенциалдардың мұндай айырымын электролиттің ыдырау кернеуі деп атайды.
2 Электродтық процестердің өту реттілігі
2.1 Электролит балқымасының электролизі
Тұздар балқымаларын электролиздегенде катодта белсенді және белсенділігі төменірек металдар катиондарының тотықсыздануы, ал анодта – оттексіз және оттекті қышқылдар аниондарының тотығуы жүреді. Оттекті қышқылдар аниондары тотыққанда әртүрлі өнімдер қоспасы түзіледі.
Мысалы, жоғары температураларда КВr балқып,
иондарға ыдырайды: KBr → K+ + Br![]() . Бұл иондар электродтарда разрядталады.ем разряжаются на
электродах. КВr
балқымасының электролиз
процесінің сұлбасы келесі:
. Бұл иондар электродтарда разрядталады.ем разряжаются на
электродах. КВr
балқымасының электролиз
процесінің сұлбасы келесі:
KBr
(С) К (-)
![]() (+)
A (С )
(+)
A (С )
← К+ + Вr![]() →
→
![]()
![]() (-)
K: К+
(-)
K: К+ ![]() К 2
К 2
(+)
A: 2Br![]()
![]() Br2
1
Br2
1
![]()
![]() 2К+
+ 2Вr
2К+
+ 2Вr![]() электролиз
2K +
Br2
электролиз
2K +
Br2
![]()
![]()
![]() 2KBr
электролиз 2K +
Br2.
2KBr
электролиз 2K +
Br2.
2.2 Электролит ерітіндісінің электролизі
Электролит ерітінділерінің электролизі әрқашан күрделі болады, өйткені ерітіндіде катиондар мен аниондардың бірнеше түрі және электрохимиялық белсенді заттардың диссоциацияланбаған молекулалары (мысалы, су) болады.
Егер электролит сулы ерітінді болса, онда катодта және анодта тек электролиттің иондары ғана емес, сонымен қатар Н2О молекулалары да разрядталады.
2.2.1 Катионның тотықсыздану реттілігі.
Реттілік электродтық потенциалдар мәндерімен анықталады: Е0Меn+/Ме: потенциал неғұрлым жоғары болса, соғұрлым катиондардың тотықсыздануы да оңайырақ өтеді.
1) Стандартты электродтық потенциалы сутектікінен жоғары болатын металл катиондары (Сu2+ - Аu3+ аралығындағы) электролиз кезінде катодта толық тотықсызданады.
2) Стандартты электродтық потенциалы аз болатын металдар катиондары
(Li+ - Al3+ арасында) катодта тотықсызданбайды, олардың орнына су молекулалары тотықсызданады, ал қышқылдық ортада – сутек иондары. Өндірісте бұл металдарды тұздар балқымаларынан электролиз әдісімен алады.
3) Стандартты электродтық потенциалы сутектікінен кіші, бірақ алюминийден жоғары болатын металдар катиондары (Мn2+ - Н2 аралығы). Электролизді өткізу шарттарына байланысты (ерітіндінің рН, ток тығыздығы, ыдырау кернеуі ж.т.б.) су молекулаларының металл катионына қарағанда басымырақ тотықсыздануы мүмкін (қышқылды ерітінділерде – сутек иондарының) немесе, кері жағдайда, катодта бір кезде бірге су молекулаларының да, металл катиондарының да тотықсыздануы жүреді.
5 кесте – Катионның катодта тотықсыздануының реттілігі
|
|
(сулы ерітінді) |
Катодтағы өнім
|
|
Оңай разрядталатын катиондар: Au+,Au3+,Pt2+,Hg2+,Ag+,Cu2+,Cu+,Bi3+ Е0Меn+/Ме
> 0
|
|
Ме0 - |
|
Разрядталуы қиын өтетін катиондар: Li+,Na+,K+,Ca2+,Al3+… Е0Меn+/Me< -0,828 В |
|
- Н2 Катод маңайында - 4Н+-иондар |
|
Аралық орын алатын катиондар Zn2+,Co2+,Fe2+,Ni2+… -0,828 В < E0Меп+/Ме <0 |
|
Ме0 Н2 ОН- - иондары катодтың маңайында |
Натрий сульфаты сулы
ерітіндісінің электролизін қарастырайық.
Жүйенің
стандартты электродтық
потенциалы бейтарап сулы
ортадағы сутек электродының потенциалынан едәуір кіші: Е![]() = -2,71В. Сондықтан катодта су
молекулаларының тотықсыздануы жүреді, ал катодқа
келетін Na+-иондары катодтың айналасындағы ерітіндіде
(катодтық кеңістікте) жиналады.
= -2,71В. Сондықтан катодта су
молекулаларының тотықсыздануы жүреді, ал катодқа
келетін Na+-иондары катодтың айналасындағы ерітіндіде
(катодтық кеңістікте) жиналады.
2Н2О ![]() Н2↑ + 2ОН-.
Н2↑ + 2ОН-.
Анодта SO![]() - иондарының разрядталуы неғұрлым қиын болатындықтан, су
молекулаларының тотығу процессі жүреді: SO
- иондарының разрядталуы неғұрлым қиын болатындықтан, су
молекулаларының тотығу процессі жүреді: SO![]() - иондарының стандартты электродтық ыдырау потенциалы (2,01
В) су молекулаларының стандартты электродтық ыдырау потенциалынан (1,23
В) едәуір жоғары. Электролиз кезінде анодқа қарай
бағытталған SO
- иондарының стандартты электродтық ыдырау потенциалы (2,01
В) су молекулаларының стандартты электродтық ыдырау потенциалынан (1,23
В) едәуір жоғары. Электролиз кезінде анодқа қарай
бағытталған SO![]() - иондары анодтық кеңістікте жиналады.
- иондары анодтық кеңістікте жиналады.
2Н2О ![]() О2↑ + 4Н+.
О2↑ + 4Н+.
Электролиз процесінің сұлбасы келесі:
Na2SO4
(С) К (-) ↓ (+) A (С)
← 2Na+ +
SO![]() →
→
H2O
![]()
![]()
![]() (-)
K: 2Н2О
(-)
K: 2Н2О
![]() Н2↑
+ 2ОН
Н2↑
+ 2ОН![]() 4 2
4 2
(+) A: 2Н2О ![]() О2↑ + 4Н+
2 1
О2↑ + 4Н+
2 1
![]()
![]() 6H2O электролиз Н2 + О2
+ 4ОН
6H2O электролиз Н2 + О2
+ 4ОН![]() + 4Н+
+ 4Н+
6H2O + 2Na2SO4 электролиз 2Н2↑ + О2 ↑ + 4NaOH + 2H2SO4.
![]() катод
анод катод маңайында
анод маңайында
катод
анод катод маңайында
анод маңайында
Катодтық кеңістікте Na+-иондары және ОН--иондары жиналады, яғни сілті түзіледі, ал анодтың қасындағы орта күкірт қышқылының түзілуіне байланысты қышқылдық болады. Нәтижесінде, натрий сульфаты сулы ерітіндісінің электролизі судың электролизіне әкеледі.
![]() 4) Қышқылдардың сулы ерітінділерін электролиздегенде
(НСl, H2SO4…) катодта сутек катиондары тотықсызданады:
2Н+ +2ē Н2.
4) Қышқылдардың сулы ерітінділерін электролиздегенде
(НСl, H2SO4…) катодта сутек катиондары тотықсызданады:
2Н+ +2ē Н2.
2.2.2 Анионның тотықсыздану реттілігі.
Реттілік су молекулаларының қатысуына, сонымен қатар анодтың қандай заттан жасалғанына байланысты болады.
1) Анодта Е0 OX/RED мәні төменірек (терісірек) болатын бөлшектердің тотығуы оңай өтеді.
2)
Ең бірінші потенциалы
1,5 В аспайтын стандартты потенциалдары өсу реттіліктегі жай аниондар
тотығады мәні (S![]() ,
I
,
I![]() ,
Br
,
Br![]() ,
CI
,
CI![]() ). HI, HBr, HCl және олардың
тұздарын элекролиздегенде (мұнда НF және фторидтер жатпайды)
анодта сәйкес галоген бөлінеді.
). HI, HBr, HCl және олардың
тұздарын элекролиздегенде (мұнда НF және фторидтер жатпайды)
анодта сәйкес галоген бөлінеді.
3) Егер ерітіндіде оттекті аниондар немесе фторид – иондар болса, онда анодта олардың орнына оттегінің бөлінуімен су молекулаларының тотығуы жүреді.
![]() 4) Сілтілердің сулы ерітінділерін электролиздегенде
(NaOH, KOH…) анодта гидроксид-иондардың тотығуы жүреді:
4ОН- - 4ē О2 ↑ +
Н2О.
4) Сілтілердің сулы ерітінділерін электролиздегенде
(NaOH, KOH…) анодта гидроксид-иондардың тотығуы жүреді:
4ОН- - 4ē О2 ↑ +
Н2О.
Мысалы, платина электродтарында КОН сулы ерітіндісінің электролизі. КОН диссоциацияланғанда түзілетін К+ және ОН--иондар, электр тоғын тасымалдайды, бірақ электродтық процеске (анодтық) иондардың тек бір түрі қатысады – ОН- , яғни электролиттің ыдырауына әкелмейді. Су молекулалары ғана ыдырайды.
KOH
(Pt) К (-) ↓ (+) A (Pt)
← K+ + OH- →
H2O
![]()
![]()
![]() (-)
K:
2Н2О
(-)
K:
2Н2О ![]() Н2↑
+ 2ОН- 4 2
Н2↑
+ 2ОН- 4 2
![]() (+)
A: 4OH-
(+)
A: 4OH-
![]() О2↑
+ 2Н2O 2 1
О2↑
+ 2Н2O 2 1
4 Н2О + 4OH- ![]() 2H2↑ + 4OH-
+ О2↑ + 2Н2O.
2H2↑ + 4OH-
+ О2↑ + 2Н2O.
2Н2О ![]() 2H2↑ + О2↑.
2H2↑ + О2↑.
6 кесте – Аниондардың анодта тотығу реттілігі
|
Аниондар |
Анодтағы реакция (ерітінді сулы) |
Анодтағы өнім |
|
Оңай разрядталатын аниондар: S2-,
Cl Кірмейді: F |
Аnn-
Н2О
|
Аn0 (Cl2, I2, Br2, S) - |
|
Қиын разрядталатын аниондар:
SO яғни оттекті қышқылдар аниондары. |
Аnn-
2Н2О
|
- О2 Ескеру: анодтың маңайында Н+- иондар |
2.2.3 Еритін анодпен электролиз.
Егер анод металдан жасалса (Cu, Fe, Al, Zn, .., мұнда кірмейді Pt, Pd, C), онда анодта электролит иондары да, су молекулалары да тотықпайды. Бұл жағдайда анодтың рөлін атқаратын металдың өзі тотығады.
Еритін аноды бар электролизерда анодтың өзінің тотығуы (еруі) жүреді; катодқа электролит металының катиондары бағытталады. Мысалы, мырыш сульфаты сулы ерітіндісін мырыш электродтарында электролиздегенде.
Платина немесе графит электродымен салыстырғанда мырыштың потенциалы терісірек (төменірек) болғандықтан, оның электрондары ток көзіне тартылады, ал оң зарядталған иондары ерітіндіге өтеді. Мырыш аноды ериді, Zn2+-иондары катодқа ауысып, разрядталып, оның бетінде бос металл түрінде бөлінеді. Тұздың ерітіндідегі мөлшері өзгермейді: анодта қанша мырыш еріп кетсе, катодта оның тура сондай мөлшері бөлінеді.
ZnSO4
(Zn) К (-) ↓ (+) А (Zn)
←
Zn2+ + SO![]() →
→
H2O
Zn2+
![]() Zn Zn
Zn Zn
![]() Zn2+
Zn2+
Белсенді анодпен электролизінің мысалына мыстың электрохимиялық рафинирлеуін (тазартуын) жатқызуға болады. Мұнда анод ретінде тазартуға тиіс қара мыс пластинасы қолданылады, ал катодтың рөлін химиялық таза мыс пластинасы атқарады. Электролит – мыс сульфатының сулы ерітіндісі. Рафинирлеу кезінде анодтағы мыс тотығып, ерітіндіге Cu2+ -иондары өтеді:
Cu
![]() Cu2+, ал катодта ерітіндіден таза мыс бөлінеді: Cu2+
Cu2+, ал катодта ерітіндіден таза мыс бөлінеді: Cu2+
![]() Cu0 .
Cu0 .
Типтік есеп №1
FeCl2 балқымасы мен сулы ерітіндісін платина электродтарында электролизге ұшыратқанда қандай өнімдер түзіледі?
Шығарылуы
а) FeCl2 балқымасында катиондардың бір түрі (Fe2+) және аниондардың бір түрі (Cl-) бар, электродтарда электролизге солар ұшырайды: Fe2+ - иондары катодта тотықсызданады, Cl- - ионы анодта тотығады.
Электролиз процесінің сұлбасын жазайық.
FeCl2
(Pt) K (-) ↓ (+) A (Pt)
← Fe2+ + 2Cl- →
![]()
![]()
![]() (-) K: Fe2+
(-) K: Fe2+
![]() Fe0 2 1
Fe0 2 1
(+) A: 2Cl-
![]() Cl2 2 1
Cl2 2 1
Fe2+ + 2Cl-
![]() Fe + Cl2
Fe + Cl2
FeCl2
![]() Fe + Cl2.
Fe + Cl2.
б) FeCl2 ерітіндісінде келесі иондар бар:
FeCl2
![]() Fe2+ + 2Cl-,
Fe2+ + 2Cl-,
H2O
![]() H+ + OH-.
H+ + OH-.
Fe2+-катиондары катодқа бағытталып, су молекулаларымен қатар тотықсызданады, өйткені Fe2+-иондары стандарттық электродтық потенциалдың аралық мәнімен сипатталадыа:
-0,828 < E![]() = -0,44 B < 0.
= -0,44 B < 0.
CI--аниондары оңай тотығатын иондар болып табылады, яғни су молекулаларымен салыстырғанда электрондарды ұстап қалу қабілеттілігі төменірек болғандықтан анодта разрядталады. Электролиз сұлбасы:
FeCl2
(Pt) K (-) ↓ (+)A (Pt)
← Fe2+ + 2Cl- →
H2O
![]()
![]()
![]() (-)K: Fe2+
(-)K: Fe2+
![]() Fe
2 1
Fe
2 1
2H2O
![]() H2↑ + 2OH-
H2↑ + 2OH-
(+)A: 2Cl-
![]() Cl2 4 2
Cl2 4 2
2Fe2+ + 2H2O + 4Cl-
![]() 2Fe + H2↑ + 2Cl2↑ + 2OH-
2Fe + H2↑ + 2Cl2↑ + 2OH-
2FeCl2 + 2H2
![]() Fe + H2↑ + 2Cl2↑ + Fe(OH)2↓.
Fe + H2↑ + 2Cl2↑ + Fe(OH)2↓.
Жауабы: а) FeCl2 балқымасы электролизінің өнімдері: Fe, Cl2↑.
б) FeCl2 ерітіндісі электролизінің өнімдері: катодта: Fe, H2↑,
катодтың маңайында Fe(OH)2; анодта: Cl2↑.
3 Электролиз заңдары
Электролиз процесінің сандық қатынастары Фарадейдің екі заңына негізделеді.
3.1 Электролиздің бірінші заңы
Электродта бөлінген заттың массасы электролит ерітіндісі немесе балқымасы арқылы өткізілген электр тоғының мөлшеріне тура пропорционал:
![]() ,
(6.1)
,
(6.1)
мұнда ![]() –
электролиз өнімінің
массасы, г;
–
электролиз өнімінің
массасы, г;
![]() –
ерітіндіден өткен электр
тоғының мөлшері, Кл.
–
ерітіндіден өткен электр
тоғының мөлшері, Кл.
Ерітіндіден өткен электр тоғының мөлшері ток күшінің I (ампермен) уақытқа τ (секундпен) көбейтіндісіне тең болғандықтан:
![]() ,
(6.2)
,
(6.2)
мұнда
![]() – электрохимиялық
эквивалент. Ол электролит
арқылы электр тоғының 1 Кл өткізсе электродта
бөлінетін зат массасын көрсетеді.
– электрохимиялық
эквивалент. Ол электролит
арқылы электр тоғының 1 Кл өткізсе электродта
бөлінетін зат массасын көрсетеді.
3.2 Электролиздің екінші заңы
Әр түрлі электролиттер арқылы электр тоғының бірдей мөлшерін өткізсе, екі әр түрлі электролиттердің электродтарында бөлінетін заттар массалары олардың эквиваленттерінің молярлы массаларына пропорционал болады.
Тәжірибелік
жолмен зат эквивалентінің молярлы массасын (![]() )
бөліп алу үшін 96500 Кл электр
тоғын өткізу қажет екендігі
анықталған. Бұл сан Фарадей саны
деп аталады және
)
бөліп алу үшін 96500 Кл электр
тоғын өткізу қажет екендігі
анықталған. Бұл сан Фарадей саны
деп аталады және
![]() әрпімен белгіленеді.
әрпімен белгіленеді.
![]() .
(6.3)
.
(6.3)
Электрохимиялық эквиваленттің Кэ теңдеуін Фарадей заңының (6.1) формуласына қойсақ келесі теңдеуді аламыз:
![]() . (6.4)
. (6.4)
Фарадей заңдарына сәйкес, электролиз кезінде бөлінетін заттар мөлшері температура мен ерітінді концентрациясына тәуелді емес.
Электролиз кезінде бөлінетін зат мөлшері Фарадей заңдары бойынша теориялық есептелгеннен азырақ молшерде бөлінеді. Іс жүзінде өнімнің түзілуіне шығындалатын ерітінді арқылы өткен электр тоғын есепке алу үшін ток бойынша шығым түсінігі енгізіледі.
Ток бойынша шығымды (![]() ) электролиздің берілген
жағдайында түзілген зат массасының (
) электролиздің берілген
жағдайында түзілген зат массасының (![]() ) Фарадей заңының негізінде теориялық есептелген
массасына қатынасына тең (
) Фарадей заңының негізінде теориялық есептелген
массасына қатынасына тең (![]() ):
):
![]() . (6.5)
. (6.5)
Типтік есеп № 2
Біріншісінде – CuSO4, екіншісінде – Hg(NO3)2, үшіншісінде – ZnCl2, электролиттерінің сулы ерітінділері бар үш ізді қосылған электролизерлардан тұрақты ток өтеді. Соңғы электролизердың анодында қалыпты жағдайда өлшенген 1,12 л сутегі бөлінсе, металдар катодтарында бөлінген металдар массасын анықтаңыз.
Шығарылуы
а) Қ.ж. сутегінің эквиваленттік көлемі Vэкв = 11,2 л/моль құрайтынын ескере отырып, оның бөлінген эквиваленттер моль санын есептейміз.
νэкв(Н2) = ![]() =
=
![]() = 0,1 моль.
= 0,1 моль.
б) Эквиваленттер заңына сәйкес никель, сынап және мырыштың да тура сондай мөлшері катодта бөлінді:
m(Cu) = Mэкв(Cu) ∙
νэкв(Cu)
= ![]() ∙
νэкв(Cu);
∙
νэкв(Cu);
m(Cu) = ![]() ∙ 0,1 моль = 3,2 г;
∙ 0,1 моль = 3,2 г;
m(Hg) = Mэкв(Hg) ∙
νэкв(Hg)
= ![]() ∙
νэкв(Hg);
∙
νэкв(Hg);
m(Hg) = ![]() ∙ 0,1 моль = 10,05 г;
∙ 0,1 моль = 10,05 г;
m(Zn) = Mэкв(Zn) ∙
νэкв(Zn)
= ![]() ∙
νэкв(Zn);
∙
νэкв(Zn);
m(Zn) =
![]() ∙ 0,1
моль = 3,25 г.
∙ 0,1
моль = 3,25 г.
Жауабы: m(Сu) = 3,20 г; m(Hg) = 10,05 г; m(Zn) = 3,25 г.
Типтік есеп № 3
CuSO4 ерітіндісінен 1 сағат ішінде 10 А күшімен ток жіберілді. Катодта 11,2 г мыс бөлінді. Ток бойынша шығымды есептеңіз.
Шығарылуы
а) Фарадей заңына (6.4) сәйкес :
m![]() (Cu) =
(Cu) =
![]() ;
;
m![]() (Cu) =
(Cu) =
![]() = 11,86 г.
= 11,86 г.
б) Ток бойынша шығым деп пайызбен көрсетілген іс жүзінде түзілген өнімнің теориялыққа қатынасын айтады:
η =
![]()
![]() % ;
η =
% ;
η = ![]() = 94,5%.
= 94,5%.
Жауабы: η = 94,5%
4 Өзіндік жұмысқа тапсырмалар
4.1 Графит электродтарында «а» затының балқымасы мен сулы ерітіндісінің электролизінің сұлбасын құрастырыңыз. Құрамы бойынша электролиз өнімдерін салыстырыңыз.
4.2 Біріншісінде - «б» затының сулы ерітінідісі, екіншісінде - «в» затының сулы ерітінідісі бар екі ізді қосылған электролизерлар арқылы ток жібереді. Жұмыс кезінде инертті анодтардың біреуінде қ.ж. өлшенген 0,112 л Cl2 бөлінді. Катодтарда бөлінген металдар массаларын есептеңіз.
Жауабы: m(«в» металдың) = «г» г; m(«г» металдың) = «д» г.
4.3 «е» ерітіндісін 1 сағат ішінде «ж» А ток күшімен электролиздегенде катодта бөлінетін металдың массасын есептеңіз. Металл бойынша ток шығымы η «з» % құрайды.
Жауабы: m(металл) = «и» г.
|
вт |
«а» |
«б» |
«в» |
«г» |
«д» |
«е» |
«ж» |
«з» |
«и» |
|
1 |
SrCI2 |
FeSO4 |
CdCI2 |
0,28 |
0,56 |
CuCI2 |
2,0 |
98,0 |
2,32 |
|
2 |
Rb2S |
CoCI2 |
AgNO3 |
0,30 |
1,08 |
ZnSO4 |
2,5 |
97,5 |
2,97 |
|
3 |
NaBr |
Sn(NO3)2 |
HgCI2 |
0,60 |
1,00 |
AgNO3 |
3,0 |
97,0 |
11,71 |
|
4 |
MnCl2 |
AuCl3 |
ZnSO4 |
0,66 |
0,33 |
HgCl2 |
3,5 |
96,5 |
12,64 |
|
5 |
MgI2 |
NiSO4 |
CuCI2 |
0,30 |
0,32 |
SnBr2 |
4,0 |
96,0 |
8,50 |
|
6 |
LiBr |
FeCI3 |
СrCI3 |
0,19 |
0,98 |
Pb(NO3)2 |
4,5 |
95,5 |
16,61 |
|
7 |
KI |
Hg2(NO3)2 |
CdSO4 |
2,01 |
0,17 |
FeSO4 |
5,0 |
95,0 |
4,95 |
|
8 |
CsCI |
SnCI2 |
Co(NO3)2 |
0,60 |
0,30 |
Cu(NO3)2 |
5,5 |
94,5 |
6,16 |
|
9 |
CrBr3 |
CdSO4 |
PtCI2 |
0,56 |
0,98 |
NiCI2 |
6,0 |
94,0 |
6,17 |
|
10 |
CaI2 |
SnCI2 |
CuSO4 |
0,59 |
0,32 |
ZnCI2 |
6,5 |
93,5 |
7,41 |
|
11 |
BeCI2 |
Au(NO3)3 |
TICI |
0,66 |
2,04 |
Hg(NO3)2 |
7,0 |
93,0 |
24,36 |
|
12 |
BaBr2 |
FeSO4 |
Hg2CI2 |
0,28 |
2,01 |
SnCI2 |
7,5 |
92,5 |
15,36 |
|
13 |
AICI3 |
ZnCI2 |
Ni(NO3)2 |
0,33 |
0,30 |
FeBr2 |
8,0 |
92,0 |
7,67 |
|
14 |
SrBr2 |
AgNO3 |
CoCI2 |
1,08 |
0,29 |
Zn(NO3)2 |
8,5 |
91,5 |
9,49 |
|
15 |
RbCI |
CuCI |
Pb(NO3)2 |
0,64 |
1,04 |
SnI2 |
9,0 |
91,0 |
18,14 |
|
16 |
NaI |
SnBr2 |
PtCI2 |
0,59 |
0,98 |
NiSO4 |
9,5 |
90,5 |
9,40 |
|
17 |
MnBr2 |
CdCI2 |
Fe(NO3)2 |
0,56 |
0,28 |
Cd(N03)2 |
10,0 |
90,0 |
18,87 |
|
18 |
MgCI2 |
CoSO4 |
NiCI2 |
0,30 |
0,29 |
ZnI2 |
10,5 |
89,5 |
11,46 |
|
19 |
Li2S |
AuCI3 |
SnI2 |
0,66 |
0,59 |
CuBr2 |
11,0 |
89,0 |
11,60 |
|
20 |
KCI |
Hg(NO3)2 |
FeCI3 |
1,00 |
0,19 |
SnSO4 |
11,5 |
88,5 |
22,54 |
|
21 |
CsBr |
ZnCI2 |
AgNO3 |
0,33 |
1,08 |
Ni(NO3)2 |
12,0 |
88,0 |
11,56 |
|
22 |
CrCI3 |
Pt(NO3)2 |
CoCI2 |
0,98 |
0,30 |
FeI2 |
12,5 |
87,5 |
11,39 |
|
23 |
CaS |
HgCI2 |
NiSO4 |
1,00 |
0,29 |
CoCI2 |
13,0 |
87,0 |
12,43 |
|
24 |
BaI2 |
SnBr2 |
CuCI2 |
0,59 |
0,32 |
ZnBr2 |
13,5 |
86,5 |
14,24 |
|
25 |
SrBr2 |
NiCI2 |
Cd(NO3)2 |
0,29 |
0,56 |
FeCI2 |
14,0 |
86,0 |
12,54 |
7 тақырып
Металдар коррозиясы. Металдарды коррозиядан қорғау
1 Коррозиялық процестердің жіктелуі
Коррозия деп қоршаған ортамен әрекеттесуі нәтижесінде металдың өздігінен бүлінуін айтады. Металдардың коррозиясы металдың электрондарды беріп тотығуына әкелетін бақылауға келмейтін неконтролирующим тотығу-тотықсыздану процесі болып табылады. Коррозия процесі энергияның бөлінуімен және металдың ыдырауымен қоса жүреді.
Өту механизмі бойынша (қоршаған ортамен әрекеттесу механизмі бойынша) коррозиялық процестер химиялыққа және электрохимиялыққа бөлінеді бөлінеді.
1) Химиялық коррозия электр тоғын өткізбейтін коррозиялық орталарда өтеді. Процесс өтетін агрессивті ортаның түріне қарай химиялық коррозия былай жіктеледі:
а) Газды коррозия – металдың газ тәріздес тотықтырғыштармен тотығуы: ауадағы оттегімен, тас көмірдің жану өнімдерімен, отынның басқа түрлерімен, мысалы:
Fe + CI2 = FeCI2 ; 2Mg + O2 = 2MgO.
б) Сұйықтық коррозия – металдың бейэлектролит ерітінділеріндегі коррозиясы (мұнай, бензин, керосин, майлайтын майлар).
Химиялық коррозияға реактивті қозғалтқыштардың соплолары, электрқыздырғыштардың элементтері, пештер арматурасы ж.т.б.
2) Электрохимиялық коррозия иондық өткізгіштігі бар орталарға тән келеді (тұздар, қышқылдар және сілтілер сулы ерітінділері, теңіз және тұщы су, топырақ, кез келген ылғалды газдың атмосферасы). Оның да негізін металдар мен құймалардың бетінде өтетін гетерогенді тотығу-тотықсыздану реакциясы құрайды.
2 Электрохимиялық коррозия
2.1 Электрохимиялық коррозияның механизмі
Электрохимиялық коррозияға ең басты металдың құрамындағы қоспалар, ластаушылар немесе металдың бетінің біртекті еместігі әкеледі. Г.В. Акимов және оның мектебінің электрохимиялық коррозиясы теориясына сәйкес бұл жағдайларда металл электролитпен жанасқанда (электролит ретінде ауадан адсорбцияланатын ылғал болуы мүмкін) оның бетінде көптеген қысқаша тұйықталған гальваникалық микроэлементтер түзіледі. Мұнда анодтың рөлін металл бөлшектері атқарады, ал катодтың – қоспалар, ластаушылар.
Гальваникалық элементтер жұмыс істеу кезінде поляризацияланады. Коррозия кезінде де электродтар поляризацияға ұшырайды. Электрондардың анодтан катодқа ауысуына байланысты катодтың потенциалы төмендейді, ал анодтың потенциалы – жоғарылайды, яғни потенциалдар теңеседі де коррозия процесі баяулау немесе мүлдем тоқтауы қажет. Бұл жағдайда поляризация – гальваножұптың электродтарының потенциалдарының өзгеруі – оң рөл атқарады. Электродтардың поляризациясы жүрмеген жағдайда коррозия үлкен жылдамдықпен жүруші еді.
Бірақ, коррозия кезінде деполяризация процесі де жүреді – катодтың потенциалы жоғарлайды. Катодтан электрондарды қабылдайтын тотықтырғыштар катодтық деполяризаторлар деп аталады. Олар поляризацияны төмендетеді. Катодтық деполяризаторларға Н+-сутек иондары (рН < 7) және су мен оның ерітінділерінде әрқашан болатын (рН = 7 және рН > 7) ауаның оттегісі жатады.
2.2 Электрохимиялық коррозияның сұлбасы
Мысалы, көміртегі қоспалары бар темірдің бетінде микогальваникалық элементтер бар. Олар жұмыс істегенде металдың бүлінуі жүреді. Теріс электродтық потенциалы бар учаскелері анодтың рөлін атқарады (темір), ал потенциалы оң болатындары – катодтың рөлін (көміртегі). Электрондар анодтық учаскелерден катодтыққа ауысады да, коррозиялық микрогальваникалық элементтің ішкі тізбегі электролит иондарымен тұйықталады.
Анодтық учаскелерде металдың тотығуы жүреді:
(-) А: Me0
![]() Men+.
Men+.
Катодтық учаскелерде – тотықтырғыштың тотықсыздану процесі:
а) қышқылдық орталарда – сутектік деполяризация:
(+) K: 2H+
![]() H2↑;
H2↑;
б) ылғалды ауада – оттектік деполяризация:
(+)
K:
O2 + 2H2O
![]() 4OH-
.
4OH-
.
Коррозия өнімі:
а) қышқылдық ортада – сәйкес келетін қышқылдың тұзы;
б) бейтарап ортада – металл гидроксиді: Men+ + n(OH-) → Me(OH)n.
Ең жиі кездесетін процесс – темірдің бүлінуі, яғни таттың түзілуі. Ылғалды ауа жағдайында татың тұзілу механизмі келесі теңдеулермен өрнектеледі:
![]()
![]() (-)
A:
Fe0
(-)
A:
Fe0
![]() Fe2+ 2
Fe2+ 2
(+) K: O2 + 2H2O
![]() 4OH-
1
4OH-
1
![]()
2Fe2+ + 4OH- → 2Fe(OH)2↓.
Коррозия өнімі - Fe(OH)2, ол ары қарай ауаның оттегі әсерінен FeO(OH) затына дейін тотығады. Бұл зат қоңыр таттың құрамына сәйкес келеді:
4Fe(OH)2 + O2 → 4FeO(OH) + 2H2O.
Электрохимиялық коррозияның жылдамдығына электролиттің құрамы мен оның қышқылдығы үлкен әсер етеді.
Сутек иондарының концентрациясын жоғарлату көптеген металдардың коррозиясын жылдамдатады. ОН--иондарының мөлшерін жоғар никель мен кадмийдің бүлінуіне әсер етпейді, темір мен магнийдің коррозиясын азайтады, алюминий, мырыш және қорғасынның коррозиясын жылдамдатады, өйткені бұд металдардың гидроксидтері сілтілерде ериді. Хлор иондары (коррозия активаторы) металдар бүлінуінің жылдамдығын жоғарлатады, ал фосфат-иондар (РО43-), хромат-иондар (СrO42-) - төмендетеді (коррозия ингибиторлары).
Коррозия жылдамдығына металды өңдеу тазалығы мен бетінің біртектілігі үлкен әсер етеді. Бөгде қоспалардың мөлшері неғұрлым аз және метал бетін өңдеудің тазалығы неғұрлым жоғары болса, соғұрлым коррозия жылдамдығы аз болады. Құрғақ және таза ауада коррозия баяу өтеді.
Типтік есеп № 1
Атмосфералық жағдайда мырыштың коррозиялану реакциясының теңдеулерін құрастырыңыз.
Шығарылуы
a) Металдар коррозияға ұшырағанда анодтық процестер
жалпы түрінде келесі теңдеумен өрнектеледі: Me0
![]() Men+.
Men+.
Атмосфералық жағдайда металл коррозияға ұшырағанда катодта суда еріген оттегінің тотықсыздануы өтеді (оттектік деполяризация).
б) Мырыш коррозияланғанда анодтық және катодтық процестердің теңдеулерін жазамыз:
![]()
![]() (-) A: Zn0
(-) A: Zn0 ![]() Zn2+
2
Zn2+
2
(+) K: O2 + 2H2O
![]() 4OH- 1
4OH- 1
Коррозия өнімі: 2Zn2+ + 4OH- → 2Zn(OH)2↓
Zn(OH)2 ыдырауы мүмкін: Zn(OH)2 → ZnO + H2O.
Типтік есеп № 2
Бейтарап және қышқыл ерітінділерінде кадмиймен контактідегі мырыштың коррозиясы қалай өтеді? Анодтық және катодтық процестердің теңдеулерін құрастырыңыз. Коррозия өнімдерінің құрамы қандай?
Шығарылуы
а)
Мырыштың
стандартты электродтық потенциалдың
мәні (Е![]() = - 0,76B) кадмийдікінен төмен (E
= - 0,76B) кадмийдікінен төмен (E![]() = - 0,40B) болғандықтан, мырыш анод болады да тотығу процесіне
ұшырайды, ал кадмий – берілген гальваножұптың катоды болады.
= - 0,40B) болғандықтан, мырыш анод болады да тотығу процесіне
ұшырайды, ал кадмий – берілген гальваножұптың катоды болады.
б) Коррозияның катодтық және анодтық процестерінің теңдеулерін жазамыз.
Бейтарап ерітіндіде
![]()
![]() (-) А (Zn): Zn0
(-) А (Zn): Zn0
![]() Zn2+ 2
Zn2+ 2
(+) K (Cd): O2 + 2H2O
![]() 4OH- 1
4OH- 1
2Zn2+ + 4OH- → 2Zn(OH)2↓.
Қышқылды ерітіндіде
![]()
![]() (-) A:
Zn0
(-) A:
Zn0 ![]() Zn2+ 1
Zn2+ 1
(+) K: 2Н+
![]() Н2 1
Н2 1
Zn0 + 2Н+ → Zn2+ + Н2↑.
в) Келтірілген электродтық процестерден коррозия өнімдері болып бейтарап ерітіндіде мырыш гидроксиді, қышқылды ерітіндіде газ тәрізбі сутек және сәйкес қышқылдың тұзы.
3 Металдарды коррозиядан қорғау
3.1 Металдардың беттік қорғаныс жабындары
Беттік жабындар металды сыртқы ортадан изоляциялайды. Оларды металдардан (мырыш, қалайы, қорғасын, никель, хром және басқа металдар) және бейметалдардан (лактар, бояулар, эмальдар ж.т.б.) заттардан жасауға болады.
Металдық жабындарды жиі гальваникалық
әдіспен жасайды. Егер жабынның электродтық потенциалы негізгі
металдікінен төмен болса, ол анодтық деп аталады, ал егер
жабынның потенциалы жоғарырақ болса – катодтық деп
аталады. Мысалы, темірді мырышпен қаптаса – жабын анодтық болады, өйткені
Е![]() = - 0,76B < E
= - 0,76B < E![]() = - 0,44B; егер темір қалайымен қапталса –
катодтық жабын болады, өйткені Е
= - 0,44B; егер темір қалайымен қапталса –
катодтық жабын болады, өйткені Е![]() = - 0,14B > E
= - 0,14B > E![]() = - 0,44B.
= - 0,44B.
Металдың тұтастығы бұзылғанда анодтық қаптау оны ары қарай коррозиядан қорғай береді. Мырыш белсенді металл болса да, оның қабаты темірді коррозиядан қорғайды. Оның себебі – мырыштың сыртында оксид қабыршағы болады. Мырыштың қорғаныс қабаты бұзылғанда (сызаттар, шатырлардың тесілуі ж.т.б.) ылғалдың қатысында темір-мырыш гальваникалық жұбы түзіледі. Мұнда катодтың рөлін темір, ал анодтың – мырыш атқарады. Электрондар мырыштан темірге ауысып оттегі молекулаларымен байланысады, мырыш ериді, мырыш толық еріп біткенше (оған көп уақыт қажет) темір коррозиядан қорғанып қала береді.
Катодтық жабынның тұтастығы бұзылғанда (мысалы, темірдің бетіндегі қалайы жабыны) негізгі металдың коррозиясы тездетіледі.
3.2 Коррозияға қарсы қабілеттілігі бар құймаларды жасау
Коррозиядан қорғаудың бұл әдісі арнайы легирлеуші қоспаларды енгізу арқылы металдың құрамын өзгертуде недізделген. Болаттың құрамына хромның 12% енгізу коррозияға тұрақты таттанбайтын болатты алуға мүмкіндік береді. Болаттың коррозияға тұрақтылығын никель, мырыш және мыс қоспалары жоғарлатады. Бұл жағдайда құймалардың пассивацияға қабілеттілігі жоғарлайды.
3.3 Электрохимиялық әдістер
1) Протекторлы қорғауды негізгі конструкция (кеме корпусы, бу қазандарының қабырғалары, болат конструкцияларының негіздері) электролит ортасында (теңіз суы, жер асты топырақ сулары ж.т.б.) болғанда қолданады. Қорғанатын конструкцияны потенциалы төменірек болатын металға – протекторға қосады. Болат бұйымдарын қорғағанда протектор ретінде әдетте магний, алюминий, мырыш және олардың құймаларын қолданады. Коррозиялану кезінде протектор анодтың рөлін орындап, бұзылады да конструкцияны бүлінуден қорғайды.
2) Электроқорғау (катодтық қорғау) протекторлы қорғау принципіне негізделген. Электр тоғын қолдануға негізделген бұл әдіс жер асты құбырларының, рельс жолдарының, ж.т.б. коррозиясын азайту үшін қолданылады. Мұнда негізгі металға белгілі ара қащықтықта тұрақты токтың катодтық стансалары орнатылады (аккумулятор батареялары). Қорғанатын металл бұл батареяның катодына қосылып, анод ретінде металлоломды қолданады.
3.4 Ортаның құрамын өзгерту
Металл бұйымдарының коррозиясын баяулату үшін электролитке ингибиторлар (коррозияны баяулатқыштар) деп аталатын заттарды қосады. Ингибиторлардың әсері келесі: металдың бетінде қорғаныс қабыршағын түзу немесе ортаның агрессивтілігін төмендету (дезактивация). Ингибиторлар бу қазандарын қақтан химиялық тазартуда, өңделген бұйымдардан қақты (окалинаны) бөліп алуда, сонымен қатар тұз қышқылын болат ыдысында сақтау және тасымалдау кезінде.
Бейорганикалық ингибиторларға нитриттар, хроматтар, фосфаттар, силикаттар жатады. Органикалық ингибиторлар металл бетінде берік адсорбцияланып, электродтық процестердің аса кернеулігін жоғарлатады.
Типтік есеп № 3
Ылғал ауада мырышталған темірдің бетінің тұтастығы бұзылғанда қандай процесс өтеді? Жауабыңызды коррозияның анодтық және катодтық процестердің электрондық теңдеулерімен дәлелдеңіз. Коррозия өнімін анықтаңыз.
Шығарылуы
а) Металдардың стандартты электродтық потенциалдарын
салыстыру (Е![]() = - 0,76B < E
= - 0,76B < E![]() = - 0,44B) бұл қаптау
анодтыққа жататынын көрсетеді. Сондықтан
қаптаудың тұтастығы бұзылғанда мырыш (Zn) коррозиялық
гальваножуптың аноды болып, тотығады, ал катодта (Fe) оттектік деполяризация
процесі өтеді.
= - 0,44B) бұл қаптау
анодтыққа жататынын көрсетеді. Сондықтан
қаптаудың тұтастығы бұзылғанда мырыш (Zn) коррозиялық
гальваножуптың аноды болып, тотығады, ал катодта (Fe) оттектік деполяризация
процесі өтеді.
б) Коррозияның электродтық процестерінің теңдеулерін жазамыз.
![]()
![]() (-) А
(Zn): Zn0
(-) А
(Zn): Zn0 ![]() Zn2+ 2
Zn2+ 2
![]() (+) K (Fe): O2
+ 2H2O
(+) K (Fe): O2
+ 2H2O ![]() 4OH- 1
4OH- 1
2Zn2+ + 4OH- → 2Zn(OH)2↓.
в) Коррозия өнімі - мырыш гидроксиді Zn(OH)2.
Типтік есеп № 4
Біріншісі – қалайымен, екіншісі – мыспен жарым-жартылай қапталған екі темір пластинасы ылғалды ауада болғанда қайсысында тат тезірек пайда болады? Жауабыңызды дәлелдеңіз. Электродтық процестердің теңдеулерін жазып, коррозия өнімдерінің құрамын анықтаңыз.
Шығарылуы
а) Металдардың стандартты электродтық потенциалдарын салыстырамыз:
E![]() = -
0,44B; Е
= -
0,44B; Е![]() = - 0,14B;
E
= - 0,14B;
E![]() = +
0,34B.
= +
0,34B.
Пластиналардың екеуінде де жабындар катодтыққа жатады, сондықтан екеуі де оттектік деполяризациямен атмосфералық коррозияға ұшырайды (катодтық процесс коррозиялық ортаның түрімен және құрамымен анықталады).
Түзілетін гальваникалық элементте темір анодтың рөлін, ал қалайы мен мыс катодтың рөлін атқарады.
б) Электродтық процестердің теңдеулері:
![]()
![]() (-)
A (Fe):
Fe0
(-)
A (Fe):
Fe0
![]() Fe2+
2
Fe2+
2
(+) К (Sn, Cu): O2 + 2H2O
![]() 4OH-
1
4OH-
1
2Fe + O2 + 2H2O → 2Fe(OH)2↓.
в) Коррозия өнімі - Fe(OH)2, ол ары қарай ауаның оттегісі әсерінен қоңыр тат затының құрамыга сәйкес келетін FeO(OH)-қа дейін тотығады:
4Fe(OH)2 + O2 → 4FeO(OH) + 2H2O.
Типтік есеп № 5
Ылғалды ауада алюминий бронзасынан жасалған бұйымды коррозиядан қорғау үшін протекторды ұсыныңыз. Өтетін процестердің теңдеулерін келтіріңіз.
Шығарылуы
а) Алюминий бронзасы – мыстың алюминиймен құймасы. Әсер
ету принципіне сәйкес протектордың потенциалы мыс потенциалынан
(E![]() = + 0,34
B) және алюминий потенциалынан (E
= + 0,34
B) және алюминий потенциалынан (E![]() = -1,70B)
төмен болуы қажет.
= -1,70B)
төмен болуы қажет.
Мысалы, магний (E![]() = -2,37B).
= -2,37B).
![]()
![]() (-) А (Mg):
Mg
(-) А (Mg):
Mg
![]() Mg2+ 2
Mg2+ 2
(+) K:
O2 + 2H2O
![]() 4OH- 1
4OH- 1![]()
![]() 2Mg2+ + 4OH-
→ 2Mg(OH)2↓.
2Mg2+ + 4OH-
→ 2Mg(OH)2↓.
в) Коррозия өнімі – магний гидроксиді Mg(OH)2↓.
4 Өзіндік жұмысқа тапсырмалар
4.1 «а» металының ылғалды ауадағы және әлсіз сірке қышқылының ерітіндісіндегі коррозиялануын қарастырыңыз. Электродтық процестердің теңдеулерін келтіріңіз. Коррозия өнімдері қандай заттар болады?
4.2 «б» жұбындағы қай металл атмосфералық жағдайда коррозияға ұшырайды? Түзілетін гальваникалық элементтің сұлбасын құрастырыңыз. Катодтық және анодтық процестердің теңдеулерін жазыңыз.
4.3 «б» металдар жұбы үшін анодтық және катодтық жабындарды ұсыныңыз.
4.4 Коррозиядан қорғау үшін темірді «в» металлымен қаптады. Қорғаныс қабатының тұтастығы бұзылғанда бейтарап ортада өтетін анодтық және катодтық процестерінің теңдеулерін жазыңыз.
4.5 Кабелдің қорғасын қабатын коррозиядан протекторлы әдіспен қорғау үшін «г» тобынан қандай металды қолдану тиімдірек болады? Протектордың коррозиялануы кезінде өтетін реакция теңдеулерін жазыңыз.
|
Вт |
«а» |
«б» |
«в» |
«г» |
|
1 |
Cu |
Pb - Sn |
Сг |
Cu - Sn - Cr |
|
2 |
Mn |
Mg - Co |
Sn |
Mg - Mn - Co |
|
3 |
Zn |
Sn - Cu |
Co |
Zn - Sn - Cu |
|
4 |
Sn |
Fe - Co |
Cd |
Fe - Cd - Co |
|
5 |
Pb |
Cu - Zn |
Ni |
Zn - Ni - Cu |
|
6 |
AI |
Fe - Ni |
Pb |
AI - Fe - Ni |
|
7 |
Ni |
Sn - Cd |
Mg |
Mg - Cd - Ni |
|
8 |
Cd |
Cd - Cu |
Zn |
Zn - Cd - Cu |
|
9 |
Co |
Zn - Ag |
Cu |
Co - Cu - Ag |
|
10 |
Fe |
Cd - Pb |
Mo |
Fe - Cd - Mo |
|
11 |
Mg |
Fe - Cu |
Mn |
Mg - Mn - Cu |
|
12 |
Cr |
Fe - Pb |
AI |
AI - Cr - Fe |
|
13 |
Mn |
Sn - Ag |
Cr |
Mn - Sn - Ag |
|
14 |
Mo |
Zn - Ni |
Mg |
Mg - Zn - Ni |
|
15 |
Cu |
Mg - Ni |
Co |
Co - Ni - Cu |
|
16 |
Zn |
Zn - Sn |
Cd |
Zn - Cd - Sn |
|
17 |
Cr |
Sn - Mg |
Ag |
Mg - Cr - Ag |
|
18 |
Pb |
Fe - Sn |
Ni |
Fe - Ni - Sn |
|
19 |
AI |
Fe - Cd |
Sn |
AI - Cd - Sn |
|
20 |
Ni |
Zn - Cu |
Zn |
Zn - Ni - Cu |
|
21 |
Cd |
Pb - Cu |
Mo |
Mo - Cd - Cu |
|
22 |
Co |
Cd - Ni |
Cu |
Cd - Co - Ni |
|
23 |
Fe |
Zn - Ag |
Mn |
Mn - Zn - Ag |
|
24 |
Mg |
Mg - Fe |
AI |
Mg - AI - Fe |
|
25 |
Sn |
Zn - Cd |
Pb |
Zn - Cd - Sn |
1 қосымша
Негізгі физика-химиялық тұрақтылар
|
№
|
Аталуы |
Өлшем бірліктері |
|
1 |
Вакумдағы жарық жылдамдығы |
С = 2,9979 · 108 м · с-1 |
|
2 |
Массаның атомдық бірлігі (м.а.б) |
1м.а.б =
m
u = m( |
|
3 |
Электрон заряды |
е = 1,6022 · 10-19 Кл |
|
4 |
Электрон массасы |
m e = 9,1094 · 10-31 кг = 5,4858 · 10-4 м.а.б. |
|
5 |
Протон массасы |
m р = 1,6726 · 10-27 кг = 1,0073 м.а.б. |
|
6 |
Нейтрон массасы |
m n = 1,6749 · 10-27 кг = 1,0087 м.а.б. |
|
7 |
Авогадро тұрақтысы |
N A = 6,0221 · 1023 моль-1 |
|
8 |
Универсал газ тұрақтысы |
R = 8,3145 Дж · моль-1 · К-1 = 0,0821л · атм · моль-1 · К-1 |
|
9 |
Больцман тұрақтысы |
K = R/NA = 1,3807 · 10-23 Дж · К-1 |
|
10 |
Фарадея тұрақтысы |
F = NA · e = 96485,3 Кл · моль-1 |
|
11 |
Планк тұрақтысы |
h = 6,6261 · 10-34 Дж · с |
|
12 |
Бор радиусы |
|
|
13 |
Ридберг тұрақтысы |
|
|
14 |
Қ.ж. идеал газының 1 молінің көлемі |
Р = 101325 Па = 1 атм = 760 мм.с.б.б. |
|
15 |
Стандартты термодинамикалық шарттар |
Р = 1 атм. Т = 298,15 К |
|
16 |
Электрон-вольт |
1 эВ = 1,6022 · 10-19 Дж |
|
17 |
Термохимиялық калория (калтх) |
1 кал. = 4,184 Дж |
2 қосымша
298,15 К-де әлсіз электролиттердің сулы ерітінділерінде
диссоциациялану тұрақтылары (Кд)
|
Зат |
Кд |
|
AgOH |
К = 9,77 · 10-3 |
|
Al(OH)3 |
K1 = 7,41 · 10-9 ; K2 = 2,14 · 10-9 |
|
Be(OH)2 |
K1 = 3,16 · 10-7 ; K2 = 5,01 · 10-9 |
|
Cd(OH)2 |
K1 = 8,13 · 10-4 ; K2 = 4,17 · 10-7 |
|
Co(OH)2 |
K1 = 7,94 · 10-5 ; K2 = 7,94 · 10-6 |
|
Cu(OH)2 |
K1 = 6,61 · 10-8 ; K2 = 2,19 · 10-7 |
|
Fe(OH)3 |
K1 = 4,79 · 10-11 ; K2 = 1,82 · 10-11 |
|
Ga(OH)3 |
K1 = 1,05 · 10-10 ; K2 = 3,24 · 10-11 |
|
NH4OH |
K = 1,74 · 10-5 |
|
Pb(OH)2 |
K1 = 5,01 · 10-4 ; K2 = 1,41 · 10-8 |
|
Sn(OH)2 |
K1 = 3,47 · 10-10 ; K2 = 1,26 · 10-12 |
|
Sn(OH)4 |
K1 = 1,66 · 10-13 ; K2 = 2,14 · 10-14 |
|
Ti(OH)4 |
K1 = 1,02 · 10-11 ; K2 = 3,09 · 10-13 |
|
Zn(OH)2 |
K1 = 1,32 · 10-5 ; K2 = 4,90 · 10-7 |
|
H2O |
K1 = 1,82 · 10-16 |
|
H2AsO4 |
K1 = 5,5 · 10-3 ; K2 = 1,07 · 10-7 ; K3 = 3 · 10-12 |
|
H2BO3 |
K1 = 5,75 · 10-10 ; K2 = 1,8 · 10-13 ; K3 = 1,6 · 10-14 |
|
HBrO |
K = 2,06 · 10-9 |
|
HCN |
K = 4,93 · 10-10 |
|
HCOOH |
K = 1,78 · 10-4 |
|
CH3COOH |
K = 1,74 · 10-5 |
|
H2CO3 |
K1 = 4,27 · 10-7 ; K2 = 4,68 · 10-11 |
|
H2C2O4 |
K1 = 6,46 · 10-2 ; K2 = 6,17 · 10-5 |
|
ClO |
K = 2,82 · 10-8 |
|
HF |
K = 6,67 · 10-4 |
|
HNO2 |
K = 5,13 · 10-4 |
|
H2O2 |
K = 2,40 · 10-12 |
|
H3PO4 |
K1 = 7,2 · 10-3 ; K2 = 6,2 · 10-8 ; K3 = 4,6 · 10-13 |
|
H2S |
K1 = 1,05 · 10-7 ; K2 = 1,23 · 10-13 |
|
H2SO3 |
K1 = 1,7 · 10-2 ; K2 = 6,31 · 10-8 |
3 қосымша
298,15 К-де металл және газ электродтарының сулы ерітінділеріндегі стандартты потенциалдары
|
Электрод |
Электродтық реакция |
E°, В |
|
Ag+ | Ag |
Ag+ + e = Ag |
+0,799 |
|
Al3+ | Al |
Al3+ + 3e = Al |
-1,700 |
|
Au+ | Au |
Au+ + e = Au |
+1,691 |
|
Au3+ | Au |
Au3+ + 3e = Au |
+1,498 |
|
Ba2+ | Ba |
Ba2+ + 2e = Ba |
-2,905 |
|
Be2+ | Be |
Be2+ + 2e = Be |
-1,847 |
|
Ca2+ | Ca |
Ca2+ + 2e = Ca |
-2,866 |
|
Cd2+ | Cd |
Cd2+ + 2e = Cd |
-0,404 |
|
Co2+ | Co |
Co2+ + 2e = Co |
-0,277 |
|
Cr3+ | Cr |
Cr3+ + 3e = Cr |
-0,744 |
|
Cr2+ | Cr |
Cr2+ + 2e = Cr |
-0,852 |
|
Cs+ | Cs |
Cs+ + e = Cs |
-2,923 |
|
Cu2+ | Cu |
Cu2+ + 2e = Cu |
+0,338 |
|
Cu+ | Cu |
Cu+ + e = Cu |
+0,521 |
|
Fe3+ | Fe |
Fe3+ + 3e = Fe |
-0,036 |
|
Fe2+ | Fe |
Fe2+ + 2e = Fe |
-0,440 |
|
Hg2+ | Hg |
Hg2+ + 2e = Hg (ж) |
+0,854 |
|
K+ | K |
K+ + e = K |
-2,924 |
|
Mg2+ | Mg |
Mg2+ + 2e = Mg |
-2,370 |
|
Mn2+ | Mn |
Mn2+ + 2e = Mn |
-1,192 |
|
Mo3+ | Mo |
Mo3+ + 3e = Mo |
-0,200 |
|
Na+ | Na |
Na+ + e = Na |
-2,711 |
|
Ni2+ | Ni |
Ni2+ + 2e = Ni |
-0,234 |
|
Pb2+ | Pb |
Pb2+ + 2e = Pb |
-0,126 |
|
Pd2+ | Pd |
Pd2+ + 2e = Pd |
+0,915 |
|
Rb+ | Rb |
Rb+ + e = Rb |
-2,925 |
|
Sn2+ | Sn |
Sn2+ + 2e = Sn |
-0,141 |
|
Sr2+ | Sr |
Sr2+ + 2e = Sr |
-2,888 |
|
Zn2+ | Zn |
Zn2+ + 2e = Zn |
-0,763 |
|
Br2 (с) | Br ¯ |
1/2Br2 + e = Br |
+1,065 |
|
S | S2- |
S + 2e = S2- |
-0,444 |
|
I2 (кр) | I¯ |
1/2I2 + e = I¯ |
+0,535 |
|
Cl2 | Cl¯ |
1/2Cl2 + e = Cl¯ |
+1,358 |
|
F2 | F ¯ |
1/2F2 + e = F¯ |
+2,866 |
|
H+ | H2 |
H+ + e = 1/2H2 |
0,000 |
|
O2 | OH ¯ |
1/2O2 + H2O +2e = 2OH¯ |
+0,401 |
|
H+ | O2 |
1/2O2 + 2H+ +2e = H2O |
+1,229 |
Әдебиеттер тізімі
1. Глинка Н.Л. Общая химия. / Под ред. А.И.Ермакова. – 28-е изд., перераб. и доп. - М.: Интеграл – Пресс, 2000.
2. Горбунов А.И. Теоретические основы общей химии – М.: Изд-во МГТУ им. Баумана, 2001.
3. Коровин Н.В. Курс общей химии. – М.: Высшая школа, 1998.
4. Кульман А.Г. Общая химия. - М.: Колос, 1997.
5. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 1998.
6. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. – М.: Химия, 1993.
7. Гельфман М.И., Юстратов В.П. Химия. Серия «Учебники для вузов. Специальная литература» - СПб.: Издательство «Лань», 2000.- 480 с.
8. Угай Я.А. Общая и неорганическая химия.- М.: Высшая школа, 1997.
9. Павлов Н.Н. Неорганическая химия. – М.: Высшая школа, 2006.
10. Князев Д.А., Смарыгин С.Н. Неорганическая химия. – М.: Высшая школа, 2000.
11. Зубович И.А. Неорганическая химия. – М.: Высшая школа, 1998.
12. Глинка Н.Л. Задачи и упражнения по общей химии. – М.: Химия, 2000.
13. Любимова Н.Б. Вопросы и задачи по общей и неорганической химии.– М.: Высшая школа, 2000.
14. Гурьевская Т.С., Султанбаева Б.М. и другие. Решение практических задач неорганической химии. – Усть-Каменогорск, изд-во ВКГУ, 1999.
15. Султанбаева Б.М. Химия. Учебное пособие для самостоятельной работы студентов.- Алматы: КазНАУ, 2006.- 194 с.
Мазмұны
Кіріспе 3
1 Тақырып. Атом құрылысы. Химиялық элементтердің периодтық жүйесі 4
1 Элементарлы бөлшектер мен атомдық ядро 4
2 Атомның электрондық қауызының құрылысы 4
3 Атомның электрондық формулалары 7
4 Элементтердің периодтық жүйесінің құрылымы 9
5 Элементтер атомдарының қасиеттері мен олардың өзгеруінің
периодтылығы 11
6 Өзіндік жұмысқа тапсырмалар 13
2 Тақырып. Химиялық кинетика. Химиялық тепе-теңдік 15
1 Химиялық реакция жылдамдығы туралы түсінік 15
2 Әрекеттесуші заттар концентрациясының әсері 16
3 Химиялық реакция жылдамдығына температураның әсері 18
4 Химиялық реакция жылдамдығына катализатордың әсері 19
5 Химиялық тепе-теңдіктің негізгі түсініктері мен белгілері 20
6 Тепе-теңдік жүйе үшін әрекеттесуші массалар заңы 21
7 Химиялық тепе-теңдіктің ығысуы. Ле-шателье қағидасы 23
8 Өзіндік жұмысқа тапсырмалар 24
3 Тақырып. Электролит ерітінділері 27
1 Күшті және әлсіз электролиттер 28
2 Бейорганикалық қосылыстардың әртүрлі кластарының электролиттік диссоциациясы 30
3 Иондық реакциялар 32
4 Судың диссоциациясы. Судың иондық көбейтіндісі 33
5 Өзіндік жұмысқа тапсырмалар 34
4 Тақырып. Тотығу-тотықсыздану реакциялары 37
1 Тотығу дәрежесі (Т.Д.) 37
2 Тотығу-тотықсыздану негіздері 39
3 Тотығу-тотықсыздану реакцияларын құрастыру әдістері 40
4 Тотықтырғыш пен тотықсыздандырғыш эквивалентінің молярлы
массасы (Мэ) 43
5 Өзіндік жұмысқа тапсырмалар 45
5 Тақырып. Электрохимия негіздері. Гальваникалық элементтер 47
1 Стандартты электродтық потенциал. Нернст теңдеуі 47
2 Электродтардың жіктелуі 49
3 Гальваникалық элемент. Гальваникалық элементтің ЭҚК 53
4 Өзіндік жұмысқа тапсырмалар 56
6 Тақырып. Электролиз 59
1 Электролиз туралы түсінік 59
2 Электродтық процестердің өту реттілігі 60
3 Электролиз заңдары 65
4 Өзіндік жұмысқа тапсырмалар 67
7 Тақырып. Металдар коррозиясы. Коррозиядан қорғау әдістері 68
1 Коррозиялық процестердің жіктелуі 68
2 Электрохимиялық коррозия 68
3 Металдарды коррозиядан қорғау 71
4 Өзіндік жұмысқа тапсырмалар 74
1 қосымша. Негізгі физика-химиялық тұрақтылар 76
2 қосымша. 298,15 К-де әлсіз электролиттердің сулы ерітінділерінде
диссоциациялану тұрақтылары (Кд) 77
3 қосымша. 298,15 К-де металл және газ электродтарының сулы
ерітінділеріндегі стандартты потенциалдары 78
Әдебиеттер тізімі 79