Коммерциялық емес акционерлік қоғам
Алматы энергетика және байланыс университеті
Өнеркәсіптік жылуэнергетика кафедрасы
ХИМИЯ
5В071600 - Аспап жасау мамандығының студенттеріне зертханалық жұмыстарды орындауға арналған әдістемелік нұсқаулар
Алматы 2013
Құрастырғандар: Туманова А.А., Идрисова К.С. Химия: 5В071600 - Аспап жасау мамандығының студенттеріне зертханалық жұмыстарды орындауға арналған әдістемелік нұсқаулар.–Алматы: АЭжБУ, 2013.–31 б.
Химия пәнінен зертханалық жұмыстарды орындауға арналған әдістемелік нұсқаулар 5В071600 – Аспап жасау мамандығының студенттеріне арналған. Әдістемелік нұсқаулар техникалық бағыттарының білім беру стандартына сәйкес құрастырылған.
Кесте - 4, сурет - 1, Әдебиет. атау - 13.
Пікір беруші: доцент Елеукулов Е.О.
«Алматы энергетика және байланыс университеті» коммерциялық емес акционерлік қоғамының 2012 жылғы баспа жоспары бойынша басылады.
© «Алматы энергетика және байланыс университеті» КЕАҚ, 2013 ж.
Кіріспе
Зертханалық жұмыстарды орындауға арналған әдістемелік нұсқаулар химияны 2 кредит көлемінде оқитын бакалаврларға ұсынылып отыр.
Мақсаты – тәжірибелерді орындаудың нәтижесінде студенттердің алған білімдердін ағымды және аралық бақылауларға, емтиханға дайындалу кезінде пайдалану.
Әдістемелік нұсқаулардың мазмұны химия курсының оқу бағдарламасына сәйкес келіп, бейорганикалық және полимерлі химияның, электрохимияның негізгі бөлімдерінен құрастырылған 6 зертханалық жұмыстан тұрады.
Зертханалық жұмыстар химия курсының негізгі құрама бөліктерінің бірі болып табылады. Жұмыстарды орындау үшін студент зертханалық жабдықтармен, өлшейтін аспаптармен және негізгі зертханалық операцияларды өткізудің техникасымен танысуы қажет.
Химиялық зертханада электр аспаптары, газ, улы және өртке қауіпті заттар болатындықтан, студенттер техника қауіпсіздігі мен ішкі тәртіп ережелерін міндетті түрде білуі керек.
Әрбір зертханалық жұмыстың алдында студент осы жұмысқа сәйкес тақырыпты кітаптардан, дәріс конспектілерінен оқып, зертханалық жұмыстың әдістемесімен танысуы тиіс.
Жасалған жұмыстың нәтижелерін қорытындылағанда журналға жұмыстың нөмірін, аталуын, жасалған күнін, тәжірибелік бөлімнің конспектісін, алынған нәтижелерін және бақылау сұрақтарына жауаптарды жазуы қажет.
1 Зертханалық жұмыс № 1. Бейорганикалық қосылыстардың кластары
Жұмыстың мақсаты: бейорганикалық қосылыстардың кластарымен, оларды алу әдістерімен және химиялық қасиеттерімен танысу.
1.1 Теориялық кіріспе
Бейорганикалық химияда күрделі заттар төрт класқа бөлінеді. Олар оксидтер, негіздер, қышқылдар және тұздар.
Оксидтер - екі химиялық элементтен тұратын, оның біреуі міндетті түрде оттегі болып келетін күрделі қосылыстар. Оксидтер тұз түзетін және тұз түзбейтіндерге бөленеді. Тұз түзбейтін оксидтерге N2O, NO, CO, SiO жатады. Қалған оксидтердің барлығы тұз түзетіндерге жатады да, химиялық қасиеттері бойынша негізгі, амфотерлі және қышқылдық болып бөлінеді.
Оксидтерді алудың үш негізгі әдісі бар:
а) жай заттың оттегімен қосылуы
С+О2=СО2;
б) күрделі заттардың жануы
СН4 +2О2 =СО2+2Н2О;
в) қыздырғанда оттекті қосылыстардың (карбонаттардың, нитраттардың, негіздердің және қышқылдардың) ыдырауы
2Ca(NO3)2=2CaO+4NO2+O2,
2Fe(OH)3=Fe2O3+3H2O,
H2CO3=CO2+H2O.
Тұз түзбейтіндерінен басқа бейметалдар оксидтерінің барлығында (SO2, SO3, CO2, P2O3, P2O5) қышқылдық қасиеттер бар.
Тотығу дәрежесі +1, +2 металл оксидтерінің қасиеттері – негіздік. Мысалы, Na2O, FeO, CaO, NiO, CuO (мұнда амфотерлік оксидтер болғандықтан BeO, ZnO, PbO жатпайды). Тотығу дәрежесі +3, +4 металдардың оксидтері амфотерлік болады, мысалы, Cr2O3, Al2O3, SnO2, PbO2 (Fe2O3, Ni2O3, Co2O3 - негіздік оксидтерінен басқалары); тотығу дәрежесі +5 және одан да көп оксидтердің қасиеттері қышқылдық болады, мысалы MnO3, Mn2O7, CrO3, V2O5 және т.б.
Амфотерлік оксидтер қышқылдармен, қышқылдық оксидтермен әрекеттескенде негіздік қасиеттерін көрсетеді де, негіздік оксидтермен және негіздермен әрекеттескенде қышқылдық қасиеттерін көрсетеді.
Оксидтердің сумен әрекеттесуінің өнімдері гидроксидтер деп аталады. Барлық тұз түзетін оксидтерге гидроксидтер сай келеді: негізгі оксидтерге – негіздер, амфотерліктерге - амфотерлі гидроксидтер, қышқылдық оксидтерге – қышқылдар.
Негіздер - металл катиондары мен гидроксотоп (ОН-) аниондарынан тұратын күрделі заттар. Негіздің құрамындағы ОН- - топтарының саны негіздің қышқылдығын анықтайды. Негіз құрамында бір ОН- тобы болса, ол бірқышқылды негізге жатады, ал бірнеше ОН- тобы болса – онда көпқышқылды негізге жатады.
Суда еритін негіздер сілті деп аталады (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2 және т.б.). Қалған негіздер суда ерімейді.
Амфотерлі гидроксидтер деп амфотерлі оксидтердің гидраттарын айтады. Олар қышқылдармен де, сондай-ақ негіздермен де әрекеттеседі. Амфотерлі гидроксидтер әдетте суда ерімейді
Al(OH)3+3HCl=AlCl3+3H2O,
Al(OH)3+NaOH=Na[Al(OH)4].
Қышқылдар – металл ионына ғана алмаса алатын сутегі катионымен (Н+) қышқыл қалдығынан тұратын күрделі заттар. Қышқылдар құрамы бойынша оттекті (HNO3, H2SO4, H2CO3 және т.б.) және оттексіз (HCl, H2S және т.б.) болады. Қышқылдың негізділігі қышқылдағы сутегі атомы санымен анықталады: HCl - бірнегізді қышқыл, H2SO4 - екінегізді қышқыл.
Тұздар – металл атомы мен қышқыл қалдығынан тұратын күрделі заттар. Әрекеттесу кезінде негіздің қышқылдығы мен қышқылдың негізділігіне байланысты құрамында Н+ және ОН- иондары жоқ орташа тұздар; ОН- топтары бар негіздік немесе гидроксотұздар; Н+-ионы бар қышқылдық немесе гидротұздар түзіледі. Гидротұз немесе қышқылдық тұз деп көп негіздік қышқылдағы сутек атомдарының орнын металл атомдары ішінара басқан кезде түзілетін тұздарды айтады. Гидроксотұз немесе негіздік тұз деп көпқышқылдық негіздегі гидроксотоптардың орнын қышқыл қалдықтары ішінара жарым-жартылай басқан кезде түзілетін өнімді айтады.
Тұздарды алу жолдары:
1) Негіздік және қышқылдық оксидтердің әрекеттесуі арқылы
CaO + CO2 = CaCO3.
нег. қышқ. орташа
оксид оксид тұз
2) Оксидтердің қышқылдармен, негіздермен әрекеттесуі арқылы
CuO + H2SO4 = CuSO4,
нег. қышқыл орташа
оксид тұз
Na2O + Zn(OH)2 = NaZnO2 + H2O,
нег. амфотерлі орташа
оксид гидроксид тұз
SO3 + Zn(OH)2 = ZnSO4 + H2O.
қышқ. амфотер. орташа
оксид гидроксид тұз
3) Гидроксидтердің әрекеттесуі арқылы
2NaOH + H2SO4 = Na2SO4 + H2O,
негіз қышқыл орташа
тұз
2NaOH + Zn(OH)2 = Na2ZnO2 + H2O.
негіз амфотерлі орташа
гидроксид тұз
4) Қышқылдық және негіздік тұздарды алу
H3PO4 + NaOH = NaH2PO4 + H2O,
көпнегіздік негіз гидротұз
қышқыл
Cu(OH)2 + HCl = CuOHCl + H2O,
көпқышқ. бірнег. гидрооксотұз
негіз қышқыл
Zn(OH)2 + HCl = ZnOHCl + H2O,
амфотер. бірнег. гидрооксотұз
гидроксид қышқыл
Zn(OH)2 + NaOH = NaHZnO2 + H2O.
амфотерлі негіз гидротұз су
гидроксид
1.2 Тәжірибелік бөлім
1.2.1 Негіздік оксидтерді гидратациялау.
Фарфор ыдыстың 1/3 көлеміне дейін сөндірілмеген әк (CaO) салып, су қосыңыз. Кальций оксиді суды сіңіреді, одан кейін реакция қатты қызумен жүреді. Реакция теңдеуін жазыңыз. Түзілген гидроксидті 1.2.7 тәжірибені өткізу үшін қалдырыңыз.
1.2.2 Негіздік оксидтің қышқылмен әрекеттесуі.
Пробиркадағы мыс оксидінің аз мөлшеріне (бір микрошпатель) сұйылтылған тұз немесе күкірт қышқылы ерітіндісін қосыңыз. Оған арласқан тұз немесе күкірт қышқылын қосыңыз. Пробирканы спиртовкада қыздырыңыз. Ерітінді түсінің өзгеруі суда еритін мыс тұзының түзілуін көрсетеді. Реакция теңдеуін жазыңыз.
1.2.3 Қышқылдық оксидтің негізбен әрекеттесуі.
Құрғақ колбаны Кипп аппаратынан алынған көміртегі (IV) оксидімен толтырыңыз. Газ әкететін түтікшенің ұшын суы бар ыдысқа салыңыз. Газ әкететін түтікшені қысқышпен жауып, колбаның тығынын ашыңыз да, үгітілген сілтінің (NaOH немесе KOH) 2-3 г салыңыз. Колбаны тығынмен тығыз жауып, сілкіңіз. Қандай өзгеріс байқалады? Реакция теңдеуін жазыңыз. Көмір қышқыл газының сілтімен әрекеттесуін дәлелдеу үшін газ әкету түтікшенің ұшын суға салып, қысқышты ашыңыз. Су колбаға тез сорылады. Байқалатын құбылысқа түсініктеме беріңіз.
1.2.4 Ерімейтін негіз алу.
Пробиркаға 3-4 тамшыдан мыс сульфаты ерітіндісі мен эквиваленттік концентрациясы 2 моль/л сілті ерітіндісін құйыңыз. Реакция теңдеуін жазыңыз. Алынған мыс гидроксиді тұнбасын 1.2.6 тәжірибені өткізу үшін қалдырыңыз.
1.2.5 Амфотерлік гидроксид алу.
Екі пробиркаға 3-4 тамшы мырыш тұзы ерітіндісін, ал басқа екі пробиркаға - осындай мөлшерде кадмий тұзы ерітіндісін құйыңыз. Әр пробиркаға гидроксидтердің ақ түсті қоймалжыңданған тұнбалар түзілгенше концентрациясы 2 моль/л күйдіргі сілті ерітіндісін тамшылатып қосыңыз. Түзілген гидроксидтердің қышқылдар мен сілтілерге қатынасын байқаңыз. Барлық алты реакция теңдеулерін жазыңыз.
1.2.6 Орташа тұз алу.
1.2.4 тәжірибеде алынған мыс гидроксиді тұнбасына эквиваленттік концентрациясы 2 моль/л күкірт қышқылы ерітіндісінің 5-6 тамшысын тамызыңыз. Реакция теңдеуін жазыңыз.
1.2.7 Қышқылдық тұзды алу.
Пробирканың 1/3 көлемін 1.2.1 тәжірибеде алынған әкті сумен толтырып, оған көміртегі диоксидін жіберіңіз. Кальций карбонаты тұнбасының пайда болуын байқаңыз. Көміртегі диоксидін тұнба ерігенге дейін жіберіңіз. Реакция теңдеуін жазыңыз.
1.2.8 Негіздік тұзды алу.
2-3 тамшы мыс(II) сульфаты ерітіндісі бар пробиркаға осындай мөлшерде сода ерітіндісін қосыңыз. Жасыл-көк түсті гидроксомыс карбонаты (CuOH)2CO3 тұнбасының түзілуін байқаңыз. Мыс тұздары сода ерітіндісімен әрекеттескенде мыс карбонатының тұнбасы неге түзілмейді? Судың қатысында мыс сульфатының содамен әрекеттесу реакциясының теңдеуін жазыңыз.
Бақылау сұрақтары
1. Түзілген негіздердің қайсысы күштірек болып келеді?
2. Қышқылдық тұз деген не?
3. Негіздік тұздардың анықтамасы. Мысалдарын келтіріңіз.
4. Күйдіргі натрий ерітіндісінен H2S, H2, Cl2, CO2 газдарын жібергенде қайсылары сіңіріледі? Сәйкес келетін реакция теңдеулерін жазыңыз.
5. Көміртегі диоксидін хлор немесе кальций нитраты ерітіндісі арқылы жібергенде карбонат тұнбасы түзілмейді, ал көміртегі диоксиді әк суымен әрекеттескенде тұнба түзіледі. Неліктен?
6. Кальций, бериллий, магний тұздары бар ерітіндіге натрий гидроксиді ерітіндісін қосты. Реакция теңдеулерін жазыңыз.
7. Алюминий гидроксидінің амфотерлі қасиеттерін іс жүзінде қалай дәлелдеуге болады? Сәйкесінше реакция теңдеулерін жазыңыз.
8. Калий гидроксиді мен аммоний гидроксидінің артық мөлшерімен алюминий сульфаты ерітіндісіне әсер еткенде басында түзілген тұнба тек бір жағдайда сақталады. Қай жағдай екенін анықтаңыз. Реакция теңдеулерін жазыңыз.
2 Зертханалық жұмыс № 2. Еру жылуы мен гидратациялану жылуын анықтау
Жұмыстың мақсаты: тұздардың суда еруі кезінде өтетін процестердің жылу эффектілерін анықтау.
2.1 Теориялық кіріспе
Еру процесін физикалық және химиялық құбылыстардың жиынтығы ретінде қарастыруға болады. Мұнда үш негізгі процесс жүреді:
1) еріп жатқан газдарда, сұйықтарда немесе қатты заттарда энергияның шығынын қажет ететін (∆Н1>0) молекулааралық және химиялық байланыстарды бұзу;
2) жаңа қосылыстардың (гидраттардың не сольваттардың) түзілуіне әкелетін және энергияның бөлінуімен жүретін (∆Н2<0) еритін заттың еріткішпен химиялық әрекеттесуі;
3) диффузияның нәтижесінде энергияның жұмсалуын талап ететін (∆Н3 > 0) ерітіндінің өздігінен араласуы.
Еру процесінің қосынды жылу эффектісі (∆Н = ∆Н1 + ∆Н2 + ∆Н3) оң (эндотермиялық еру) немесе теріс (экзотермиялық еру) болады. Суда газдар немесе сұйықтар ерігенде молекулааралық байланыстарды үзуге жұмсалатын энергия мөлшері ∆Н1 көп емес, еру процесі жылудың бөлінуімен жүреді (∆Н < 0). Суда кристалл күйіндегі зат ерігенде энергияның үлкен мөлшері қажет, сондықтан жылу сіңіріледі (∆Н > 0).
Кристалдық заттарға тұздар жатады. Тұздардың көбі кристаллогидраттарды түзеді, мысалы:
Сусыз тұз Кристаллогидрат
CuSО4 CuSО4 ∙ 5H2O
ВаСl2 ВаС12 ∙ 2Н2O
Na2SO4 Na2SO4 ∙ 10H2O
Сусыз тұздан кристаллогидраттың түзілуі әрқашан энергияның бөлінуімен жүреді, бұл экзотермиялық процесс. Процестің термохимиялық теңдеуін жалпы түрде былай жазуға болады:
КА(к) + nН2O(с) = КА∙ nН2O(к); ∆Hгидрат < 0,
мұнда КА(к) — кристалдық сусыз тұз; n — кристаллогидраттың бір моліндегі Н2O мольдерінің саны; ∆Hгидрат — гидратациялану жылуы, кДж/моль.
Сусыз тұздардың суда еруі әдетте жылудың бөлінуімен жүреді
(∆Hеру < 0), ал кристаллогидратардың суда еруі жиі жылудың сіңірілуімен жүреді ((∆Hеру > 0).
2.2 Тәжірибелік бөлім
2.2.1 Мыс(II) сульфатының гидратациялану жылуын анықтау.
Еру жылуын келесі формуламен есептейді:
∆Hеру (кДж/моль) = qM/m,
мұнда q – калориметрде бөлінген (сіңірілген) жылу, кДж; М – заттың бір молінің массасы, г/моль; m — тұз массасы, г.
Жылу (q) тәжірибе негізінде алынған мәндер бойынша келесі қатынастан анықталады:
q = (mстсст + mер-дісер-ді)∆Т,
мұнда mст – стақан массасы, г; m ер-ді – ерітінді массасы (стақандағы су мен тұз массаларының қосындысы), г; сст – шынының меншікті жылусыйымдылығы (0,753 Дж/(г-К)); сер-ді – ерітіндінің меншікті жылусыйымдылығы (сулар) 4,184 Дж/(г-К).
Мыс(II) сульфатының суда еру процесін екі сатыға бөлуге болады:
CuSO4(к) + 5Н2O(с) = CuSO4 ∙ 5Н2O(к); ∆H1, (I)
CuSO4 ∙ 5Н2O(к) + aq = CuS04 ∙ aq(as) + 5Н2O(с); ∆Н2. (II)
Бірінші сатысы — гидратациялану процесі, яғни мыс(II) сульфатының кристаллогидратының түзілуі, екінші сатысы — кристаллогидраттың суда еруі. Процестің қосынды жылу эффектісі ∆H1 + ∆Н2 сусыз тұздың еру жылуына тең ∆Н3 (Гесс заңы):
CuSO4(k) + aq = CuS04 ∙ aq(с); ∆Н3
Еру процесінің жылу эффектілерін ∆Н2 мен ∆Н3 өлшеп, гидратациялану жылуын ∆Н1 есептейді:
∆Н1 = ∆Н3 - ∆Н2.
Калориметрлік стақанның массасын өлшеңіз (немесе зертханашыдан біліңіз). Калориметрлік қондырғыны құрастырыңыз.
![]() Реакциялардың жылу эффектілерін өлшеу
үшін калориметрлерді немесе калориметрлік
қондырғыларды қолданады
(1 суретті қараңыз).
Көлемі
0,8 л стақанның ішіне көлемі кішірек (0,5 л) стақан салынады. Калориметрлік стақанның қабырғаларынан
жылудың шығынын болдырмау үшін сосудтардың арасында
пробкадан жасалған төз (пробковые) аралық қабатын салады.
Калориметрлік стақанды термометрді (шкала бөлігі 0,1 К),
араластырғышты және құйғышты орналастыруға
арналған тесіктері бар ағаштан жасалған
қақпақпен жабады. Араластырғышты электр моторға
қосады немесе қолмен қозғалтады.
Реакциялардың жылу эффектілерін өлшеу
үшін калориметрлерді немесе калориметрлік
қондырғыларды қолданады
(1 суретті қараңыз).
Көлемі
0,8 л стақанның ішіне көлемі кішірек (0,5 л) стақан салынады. Калориметрлік стақанның қабырғаларынан
жылудың шығынын болдырмау үшін сосудтардың арасында
пробкадан жасалған төз (пробковые) аралық қабатын салады.
Калориметрлік стақанды термометрді (шкала бөлігі 0,1 К),
араластырғышты және құйғышты орналастыруға
арналған тесіктері бар ағаштан жасалған
қақпақпен жабады. Араластырғышты электр моторға
қосады немесе қолмен қозғалтады.
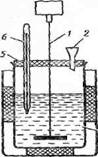
1 - араластырғыш;
2 - құйғыш;
3 - калориметрлік стақан;
4 - сыртқы сосуд;
5 - қақпақ;
6 – термометр
1 сурет – Калориметрлік қондырғы
Калориметрде бөлінетін не сіңірілетін жылуды мына формула бойынша есептейді: q =∑ c(T2 – T1),
мұнда Т2 және T1 — калориметрлік стақандағы ерітіндінің соңғы және бастапқы температуралары;
∑ с — жүйенің жылусыйымдылығы, ∑с=c1m1+c2m2 (m1 және m2 — калориметрлік стақан мен стақандағы сұйықтың массалары;
c1 және c2 — шыны мен сұйықтың меншікті жылусыйымдылықтары).
Құйғыш (2) арқылы стақанға (3) дистилленген судың 300 мл құйыңыз. Термометрмен (6) температураны (T1) өлшеңіз (0,1К дәлділікпен).
Сусыз мыс сульфатының 7,00 — 8,00 г өлшеңіз (0,01 г дәлділікпен). Өлшенген тұзды құйғыш (2) арқылы тез және мұқият калориметрлік стақанға (3) салыңыз. Араластырғыш (1) арқылы ерітіндіні үздіксіз араластыру кезінде термометр (6) көрсеткіштерін қадағалай отырып, ерітіндінің ең жоғарғы температурасын (Т2) анықтаңыз.
Тәжірибе нәтижелерін кестеге жазыңыз.
1 кесте
|
T1, K |
T2, K |
∆T, K |
mст, г |
m |
m |
m ер-ді, г |
|
|
|
|
|
|
|
|
Су тығыздығы - 1 г/см3.
Тәжірибе нәтижелері бойынша есептеңіз:
- жүйенің жылусыйымдылығын (mстсст + mер-дісер-ді), Дж/К;
- калориметрде бөлінген жылуды q, Дж;
- сусыз мыс сульфатының еру жылуын ∆H3, кДж/моль.
Тәжірибені кристаллогидратпен CuSO4-5H2O қайталаңыз (өлшенді
массасы 9,00—10,00 г). Нәтижелерін кестеде келтіріңіз. Жұмысты орындау барысында температураның төмендеуіне назарыңызды аударып, ерітіндінің ең төменгі температурасын (Т2) анықтаңыз.
Сусыз мыс сульфаты CuSO4 (∆H3) және кристаллогидрат CuSO4 ∙5H2O (∆Н2) анықталған еру жылулары бойынша мыс сульфаты(II) гидратациялану жылуын есептеңіз.
Мыс сульфаты(II) гидратациялану жылуын есептеп және кристаллогидраттың формуласын біле тұра, CuSO4(к) гидратациялану реакциясының термохимиялық теңдеуін құрастырыңыз.
2.2 Натрий карбонатының гидратациялану жылуын анықтау
Натрий карбонатының суда еру процесін екі сатыға бөлуге болады:
Na2CО3(к) + 10Н2О(с) = Na2CО3 • 10Н2О(к); ∆Н1, (I)
Na2CО3 • 10Н2О(к) + aq = Na2CО3 • aq (с) + 10Н2О(с); ∆Н2 (II)
Процестің бірінші сатысы — тұздың гидратациялануы (кристаллогидратты алу), екіншісі — кристаллогидраттың еруі. Гесс заңына сәйкес қосынды жылу эффекті (∆Н1 + ∆Н2) сусыз натрий карбонатының еру жылуына (∆Н3) тең:
Na2CО3(к) + aq = Na2CО3 • aq (с); ∆Н3.
Тәжірибелік жолмен ∆Н2 мен ∆Н3 анықтап, натрий карбонатының гидратациялану жылуын ∆Н1 есептеуге болады.
Калориметрлік стақан (3) массасын алдын ала өлшеп, калориметрлік қондырғыны құрастырыңыз. Құйғыш (2) арқылы стақанға дистилленген судың 300 мл құйыңыз. Термометрмен (6) судың температурасын (Т1) өлшеңіз (0,1 К дәлділікпен).
Сусыз натрий карбонатының Na2CО3 6,00—7,00 г өлшеп (0,01 г дәлділікпен), оны құйғыш (2) арқылы мұқият және тез стақанға (3) салыңыз. Ерітіндіні араластырғышпен (1) үздіксіз араластыра отырып, термометр (6) көрсеткіштерін байқаңыз. Ерітіндінің ең жоғарғы температурасын (Т2) анықтаңыз (0,1 К дәлділікпен).
Тәжірибе нәтижелерін кестеге жазыңыз.
2 кесте
|
T1, K |
T2, K |
∆T, K |
mст, г |
m |
m |
m ер-ді, г |
|
|
|
|
|
|
|
|
Тәжірибе нәтижелері бойынша есептеңіз:
- жүйенің жылусыйымдылығын (mстсст + mер-дісер-ді), Дж/К;
- калориметрде бөлінген жылуды q, Дж;
- сусыз натрий карбонатының еру жылуын ∆H3, кДж/моль.
Тәжірибені кристаллогидратпен Na2CO3 • 10Н2О қайталаңыз (өлшенді
массасы 14,00—15,00 г). Нәтижелерін кестеде келтіріңіз. Жұмысты орындау барысында температураның төмендеуіне назарыңызды аударып, ерітіндінің ең төменгі температурасын (Т2) анықтаңыз.
Сусыз натрий карбонаты Na2CО3 (∆H3) және кристаллогидрат Na2CO3 • 10Н2О (∆Н2) анықталған еру жылулары бойынша натрий карбонатының гидратациялану жылуын есептеңіз.
Натрий карбонатының гидратациялану жылуын есептеп және кристаллогидраттың формуласын біле тұра, Na2CO3(к) гидратациялану реакциясының термохимиялық теңдеуін құрастырыңыз.
Бақылау сұрақтары мен есептері
1. Энтальпия деген не? Экзотермиялық және эндотермиялық процестер.
2. Реакцияның жылулық эффектісі. Термохимиялық теңдеу деп нені айтады?
3. Гесс заңы мен оның салдары.
4. Заттың суда еру процесі жүйе энтальпиясының өсуімен жүре ме?
5. Заттардың суда еруін ∆Н < 0 шарты сипаттай ала ма?
6. Теңдеудің қайсысында реакцияның жылу эффектісінің таңбасы дұрыс жазылған? Жауабыңызды дәлелдеңіз.
а) CuSО4(k) + 5Н2O(с) = CuSO4 ∙5H2O(k); ∆Н > 0,
б) CuSO4(k) + 5Н2O(с) = CuSO4 ∙ 5Н2O(к); ∆Н < 0.
7. Нәтижесінде барий хлоридінің гидратациялану жылуын есептей алатын тәжірибе жолын ұсыныңыз.
ВаС12(к) + 2Н2O(с) = ВаС12 ∙ 2Н2O(к); ∆Hгидрат.
8.
Екі процестің
термохимиялық теңдеулерін
қолданып:
Na2SO4(K) +
aq* =
Na2SO4 ∙aq(ж);
∆Н![]() = -2,9 кДж/моль,
= -2,9 кДж/моль,
Na2SО4
∙10Н2О(к) + aq =
Na2SO4 ∙aq(ж)
+ 10Н2О(ж); ∆Н![]() = 78,8 кДж/моль.
= 78,8 кДж/моль.
Натрий сульфаты гидратациялану жылуын есептеңіз
∆Н![]() .
.
Жауабы: -81,6 кДж/моль.
aq — латын тілінен aqua — су.
3 Зертханалық жұмыс № 3. Химиялық реакциялардың кинетикасы. Химиялық тепе-теңдік
Жұмыстың мақсаты: химиялық реакцияның жылдамдығы мен оның әртүрлі факторларға: заттардың табиғатына, концентрацияға, температураға тәуелділігін зерттеу. Химиялық тепе-теңдік және оған әртүрлі факторлардың әсерін зерттеу.
3.1 Теориялық кіріспе
Химиялық реакциялар жылдамдығы деп бірлік уақытта әрекеттесуші зат концентрациясының өзгеруін айтады. Реакция жылдамдығы әрекеттесуші заттардың табиғатымен анықталады және процесс жүруінің шарттарына тәуелді болады (әрекеттесуші заттар концентрациясына, температураға, катализатордың қатысуына және т.б.).
Реакция жылдамдығының концентрацияға тәуелділігі әрекеттесуші массалар заңымен анықталады: тұрақты температурадағы химиялық реакцияның жылдамдығы реакция теңдеуіндегі стехиометриялық коэффициенттерге тең болатын көрсеткіш дәрежесіндегі әрекеттесуші заттар концентрацияларының көбейтіндісі тура пропорционалды. Мысалы:
2NO + O2 → 2NO2
реакциясы үшін әрекеттесуші массалар заңы былай жазылады:
![]() =k
=k![]() ,
,
мұндағы υ –химиялық реакцияның жылдамдығы;
k –жылдамдық тұрақтысы;
![]() мен
мен ![]() - әрекеттесуші заттар концентрациялары.
- әрекеттесуші заттар концентрациялары.
Гетерогенді жүйедегі реакция (мысалы, С(к) + О2(г) → СО2(г)) фазалар арасындағы бөлу бетінде жүзеге асырылады. Сондықтан тұрақты температурадағы гетерогенді реакциялардың жылдамдығы заттардың концентрациясына ғана емес, бөлу бетінің ауданына да тәуелді.
Бұл реакция үшін әрекеттесуші массалар заңы былай өрнектеледі:
![]() =k
=k![]() ,
,
мұндағы k – жылдамдық тұрақтысы;
![]() - оттегі концентрациясы;
- оттегі концентрациясы;
S - фазалар арасындағы бет ауданы.
Реакция жылдамдығының температураға тәуелділігі Вант–Гофф ережесімен сипатталады
![]() ,
,
мұндағы ![]() мен
мен ![]() - Т2 және Т1
температурадағы реакция жылдамдықтары;
- Т2 және Т1
температурадағы реакция жылдамдықтары;
γ – температура 10°С-ға өскенде реакция жылдамдығының қаншалықты артатынын көрсететін температуралық коэффициент.
Химиялық реакцияны жылдамдату әдістерінің бірі – реакция жылдамдығын арттыратын, бірақ өзі реакцияға түспейтін (шығындалмайтын) заттардың (катализаторлардың) көмегімен жүретін катализ процесі. Катализатор әсерінің механизмі: реакцияның активтендіру энергиясының шамасын азайтуда (яғни белсенді молекулалардың орташа энергиясымен бастапқы заттар молекулаларының орташа энергиясының арасындағы айырымның азаюына) негізделген. Бұл жағдайда химиялық реакция жылдамдығы артады.
«Химиялық тепе–теңдік» түсінігі тек қайтымды
реакцияларда ғана қолданылады. Химиялық тепе-теңдік
деп тура реакцияның жылдамдығы
![]() кері реакция жылдамдығына
кері реакция жылдамдығына
![]() тең
болғанда әрекеттесуші жүйенің күйін айтады.
тең
болғанда әрекеттесуші жүйенің күйін айтады.
![]() =
=
![]() теңдігі химиялық тепе–теңдіктің
кинетикалық шарты болып табылады.
теңдігі химиялық тепе–теңдіктің
кинетикалық шарты болып табылады.
Химиялық
тепе–теңдік жүйенің Гиббс энергиясы шамасының (GT)
тұрақтылығымен сипатталады.
![]() теңдігі химиялық
тепе-теңдіктің термодинамикалық шарты болып табылады.
теңдігі химиялық
тепе-теңдіктің термодинамикалық шарты болып табылады.
Берілген жағдайда химиялық тепе–теңдік әрекеттесуге қатысатын барлық заттардың тепе-теңдік концентрацияларының тұрақты қатынасымен сипатталады.
Стехиометриялық коэффициенттерге тең болатын көрсеткіш дәрежесіндегі реакция өнімдерінің тепе–теңдік концентрацияларының көбейтіндісінің бастапқы заттардың тепе–теңдік концентрацияларының көбейтіндісіне қатынасының шамасы тепе–теңдік тұрақтысы деп аталады.
Н2(г) + I2(г) = 2 НI(г)
қайтымды реакциясы үшін тепе–теңдік тұрақтысы былай өрнектеледі:
КC =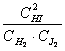 .
.
Тепе-теңдік тұрақтысы реагенттердің табиғатына, температураға тәуелді, ал жүйедегі заттардың бастапқы концентрациясына тәуелді емес. Тепе–теңдік тұрақтысының берілген реакцияның стандартты Гиббс энергиясымен (GT0) байланысы келесі қатынаспен сипатталады:
![]() ,
,
мұнда R – универсал газ тұрақтысы [8,31 Дж/моль.К];
Т – абсолюттік температура, К;
Кс – тепе–теңдік тұрақтысы.
Тепе-теңдік орнаған кездегі параметрлер тұрақты болғанға дейін химиялық тепе-теңдік өзгермейді. Шарттары өзгергенде тепе-теңдік бұзылады. Біраз уақыттан кейін жүйеде жылдамдықтардың жаңа тепе-теңдігімен және барлық заттардың жаңа тепе-теңдік концентрацияларымен сипатталатын тепе-теңдік қайта орнайды.
Шарттардың өзгеруі тура және кері реакциялардың жылдамдықтарына әртүрлі әсер ететіндіктен, тепе–теңдік тура немесе кері жаққа ығысады. Тепе-теңдіктің бұзылуы оны реакция жылдамдығы азырақ жаққа ығыстырады. Мысалы, сыртқы жағдайларды өзгерткенде тура реакцияның жылдамдығы керінікінен жоғары болса, онда тепе-теңдік оңға қарай ығысады.
Жалпы жағдайда тепе-теңдіктің ығысу бағыты Ле-Шателье қағидасымен анықталады: егер тепе–теңдікте тұрған жүйеге сырттан әсер етілсе, онда тепе-теңдік сыртқы әсерді төмендететін бағытқа қарай ығысады.
3.2 Тәжірибелік бөлім
3.2.1 Химиялық реакциялар жылдамдығының заттар концентрациясына тәуелділігі.
Реакция жылдамдығының заттар концентрациясына тәуелділігін натрий тиосульфатының күкірт қышқылымен әрекеттесу мысалында қарастырады
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S.
Реакция белгісі күкірттің бөлінуі нәтижесінде ерітіндінің лайлануы болып табылады.
Үш бюретканы толтырыңыз: біріншісін – эквиваленттік концентрациясы 1 моль/л H2SO4 ерітіндісімен, екіншісін – эквиваленттік концентрациясы 0,05 моль/л Na2S2O3 ерітіндісімен, үшіншісін - сумен. Бюреткаларды жұмыстық жағдайға келтіріңіз.
Үш пробиркаға бюреткадан 5 мл-ден H2SO4 ерітіндісін құйыңыз.
Үш конустық колбаға бюреткандан: біріншісіне – 5мл Na2S2O3 ерітіндісі мен 10 мл су; екіншісіне – 10 мл Na2S2O3 ерітіндісі мен 5 мл су; үшіншісіне – 15 мл Na2S2O3 ерітіндісін құйыңыз.
Уақытты белгілеп, бірінші колбаға пробиркадан 5 мл күкірт қышқылының ерітіндісін қосып, тез араластырыңыз. Ерітіндінің лайлану уақытын белгілеңіз.
Қалған екі колбаға да осылай жасаңыз. Тәжірибенің нәтижелерін кестеге жазыңыз.
3.1 кесте
|
Кол-ба № |
Көлем, мл |
Жалпы көлем, мл |
Салыс тыр-малы кон-цент-рация |
Тәжі-рибе темпе-рату- расы, 0С |
Лай-лану уақы-ты |
Реакцияның салыс-тырмалы жылдамдығы |
|||
|
H2SO4 |
Na2S2 О3 |
H2O |
υтеор |
υпрак |
|||||
|
1 |
5 |
5 |
10 |
20 |
1 |
|
|
1 |
1 |
|
2 |
5 |
10 |
5 |
20 |
2 |
|
|
2 |
|
|
3 |
5 |
15 |
- |
20 |
3 |
|
|
3 |
|
Милиметрлік қағазға
υтеор =
![]() координаталарында тәуелділік қисығын сызыңыз.
Графикте υпрак мәнін
белгілеңіз (салыстырмалы
бірліктерде).
координаталарында тәуелділік қисығын сызыңыз.
Графикте υпрак мәнін
белгілеңіз (салыстырмалы
бірліктерде).
Реакция теңдеуін жазып, берілген жағдайда реакция жылдамдығының Na2S2O3 концентрациясына тәуелділігі туралы қорытынды жасаңыз.
3.2.2 Реакция жылдамдығының температураға тәуелділігі.
Реакция жылдамдығының температураға тәуелділігін
Na2S2O3 + H2SO4 =Na2SO4 + SO2 + H2O + S
реакцияның мысалында анықтайды.
Ванг – Гофф ережесі бойынша (γ = 1,8)
![]()
температура 10 0Сге артқанда реакция жылдамдығы 1,8 есе артады, 20 0Сде - 3,24 есе, 30 0Сде - 5,832 есе және т.б.
H2SO4, Na2S2O3 және су ерітінділерімен толтырылған бюреткаларды жұмыстық жағдайға келтіріңіз. Екі пробиркаға 5 мл-ден H2SO4 ерітіндісін құйыңыз.
Екі конустық колбаға бюреткалардан 5 мл Na2S2O3 және 10 мл су құйыңыз.
Бір колба мен пробирканы температурасы бөлмеліктен 10 0С-ге жоғары суы бар стақанға қойыңыз. Қажетті температураға қыздырылғаннан кейін (5 – 7 мин кейін) ерітінділерді араластырып, лайлану уақытын анықтаңыз (2-тәжірибе).
Екінші колба мен пробирканы температурасы бөлмеліктен 20 0С-ге жоғары суы бар стақанға салыңыз, 5-7 минуттан кейін ерітінділерді араластырып, лайлану уақытын анықтаңыз.
Тәжірибе қорытындысын кестеге жазыңыз.
3.2 кесте
|
Кол-ба № |
Көлем, мл |
Жалпы көлем, мл |
Тәжірибе темпера-турасы, 0С |
Лайлану уақыты |
Реакцияның салы-стырмалы жылдам-дығы |
|||
|
H2SO4 |
Na2S2O3 |
H2O |
υтеор |
υпрак |
||||
|
1 |
5 |
5 |
10 |
20 |
|
|
1 |
1 |
|
2 |
5 |
5 |
10 |
20 |
|
|
1.8 |
|
|
3 |
5 |
5 |
10 |
20 |
|
|
3.24 |
|
Милиметрлік қағазға υтеор![]() тәуелділігін
тұрғызыңыз. Осы графикте
алдында есептелген
υпрак мәндерін белгілеңіз. Тәжірибенің нәтижелерін
қолдана отырып,
тәуелділігін
тұрғызыңыз. Осы графикте
алдында есептелген
υпрак мәндерін белгілеңіз. Тәжірибенің нәтижелерін
қолдана отырып,
![]() прак
температуралық
коэффициент мәнін есептеңіз.
прак
температуралық
коэффициент мәнін есептеңіз.
Реакция жылдамдығының температураға тәуелділігі қорытындысын жасаңыз.
3.2.3 Заттар концентрациясының химиялық тепе-теңдікке әсері (жартылай микроәдіс).
Бұл тәжірибеде аммонний роданидының темір үшхлоридімен әркеттесуінің қайтымды реакциясы зерттеледі. Темір үшроданиды Fe(SCN)3 ерітіндіні қызыл түске бояйды. Боялу қарқындылығының өзгеруі бойынша Fe(SCN)3 концентрациясының өзгеруі туралы айтуға болады, яғни тепе– теңдіктің тура немесе кері бағытқа ығысуы.
Төрт микропробиркаға темір үшхлориді (FeCl3) мен аммоний роданидының сұйылтылған ерітінділерінің 5–10 тамшысынан тамызыңыз. Пробиркалардағы ерітінділерді ақырын шайқап араластырыңыз. Барлық пробиркаларды штативке қойыңыз.
Пробиркалардың біреуіне микрошпательмен темір (III) хлоридінің бірнеше кристалын, екіншісіне аммоний роданидын, үшіншісіне аммоний хлоридін қосып, төртінші пробирканы салыстыру үшін қалдырыңыз.
Ерітіндіні тез шайқау немесе шыны таяқша арқылы араластырыңыз.
Есеп беруді дайындағанда: әрбір жағдайда боялу қарқындылығының өзгерісін көрсетіңіз; FeCl3 және NH4SCN арасындағы реакция теңдеуін және берілген реакцияның тепе-теңдік тұрақтысының кейіптемесін жазыңыз:
а) темір (III) хлоридін; б) аммоний роданидын; в) аммоний хлоридін қосқан кезде тепе–теңдік бағыты қай жаққа ығысады және әрбір компоненттің концентрациясы қалай өзгереді?
Бақылау сұрақтары мен есептер
1. Химиялық реакция жылдамдығы деген не? Ол қандай факторларға тәуелді?
2. Әрекеттесуші массалар заңы. Осы заң бойынша төменгі реакциялардың математикалық өрнегін жазыңыз:
а) N2O4(г) → 2NO2(г);
б) 2NO(г) + Br2(г) → 2NOBr(г);
в) CaO(к) + CO(г) → CaCO3(к).
3. Температура өзгергенде химиялық реакция жылдамдығы қалай өзгереді? Неліктен?
4. Активтендіру энергиясы деген не?
5. Гетерогенді жүйелерде химиялық реакция жылдамдығы қандай факторларға тәуелді?
6. Катализатор деген не? Катализатор химиялық реакция жылдамдығына қандай әсер етеді? Неліктен?
7. Қайтымды реакциясының қандай күйін химиялық тепе-теңдік деп атайды?
8. Келесі қайтымды процестердің әрқайсысы үшін тепе-теңдік тұрақтысының теңдеуін жазыңыз:
а) 2 NO2(г) = 2NO(г) + О2(г) ;
б) 3 H2(г)+ N2(г) = 2NH3(г);
в) H2(г) + CuO(k)=H2O(г)+Cu(k).
Қысымды жоғарлатқанда берілген жағдайдағы әрқайсысының тепе-теңдігі қай бағытта ығысады?
9. Келесі қайтымды реакцияларда температураны жоғарлатқанда, тепе-теңдік қай бағытқа ығысады? Реакциялардың жылу эффектісін кестелер мәндері бойынша есептеңіз:
а) SO2(г)+O(г)= 2SO3(г);
б) H2(г)+ Br2(г) = 2HBr(г);
в) N2(г)+O2(г) = 2NO(г).
4 Зертханалық жұмыс № 4. Тотығу-тотықсыздану реакциялары
Жұмыстың мақсаты: металдар, бейметалдар және олардың қосылыстарының тотығу-тотықсыздану қасиеттерімен танысу; тотығу- тотықсыздану процестерінің теңдеулерін құрастыру әдістемесін үйрену.
4.1 Теориялық кіріспе
Электрондардың бір атом немесе бір иондардан басқа атом мен иондарға ығысуымен немесе толық ауысуымен жүретін реакцияларды тотығу- тотықсыздану реакциялары деп атайды. Берілген элементтің атомынан (ионынан) немесе берілген элементтің қосылыстағы атомына (ионына) ығыстырылатын электрондар саны тотығу дәрежесі деп атайды. Тотығу дәрежесі оң (электрондар атомнан немесе ионнан ығыстырылды) және теріс (электрондар атом немесе ионға ығыстырылған) болуы мүмкін.
Электрондарды беру процесі, яғни элементтің тотығу дәрежесінің жоғарылауын тотығу деп, ал электрондарды беретін заттарды – тотықсыздандырғыштар деп атайды. Типтік тотықсыздандырғыштарға атомдарының электртерістілігі жоғары емес қарапайым заттар (металдар, сутегі, көміртегі), кейбір аниондар (Cl-, S2-, SO32- т.б.), тотығу дәрежесі жоғарылайтын катиондар (Fe3+, Sn2+ және т.б.), көміртегінің кейбір қосылыстары (көмірсутегілер, көміртегі оксиді), азоттың қосылыстары (азотсутегілер), бордың қосылыстары (борсутегілер) және т.б. жатады.
Электрондарды қосып алу процесі, яғни тотығу дәрежесінің төмендеуін тотықсыздану деп, ал электрондарды қабылдайтын заттарды тотықтырғыштар деп атайды. Типтік тотықтырғыштарға атомдары жоғары электртерістілікпен сипатталатын қарапайым заттар (VI және VII тобының негізгі топшаларының элементтері), жоғары тотығу дәрежесіндегі катиондар (Pb+4, Cr+6, Ce+4), электрлік оң элементі ең жоғары дәрежесінде болатын аниондар (N+5O-3, Cr2+6O72-, Mn+7O-4 және т.б.), жоғары оксидтер және пероксидтер жатады.
Тотығу–тотықсыздану реакциялары - бір кезде өтетін тотығу және тотықсыздану процестері. Тотықтырғыштары мен тотықсыздандырғыштары әртүрлі заттар болатын реакциялар молекулааралық деп аталады. Егер тотықтырғыш пен тотықсыздандырғыш ретінде бір молекуланың атомдары немесе иондары қызмет етсе, онда мұндай реакцияларды молекулаішілік деп атайды.
Тотығу–тотықсыздану реакцияларының бағыты термодинамиканың екінші заңымен анықталады. Егер процесс изобара- изотермиялық жағдайда өтетін болса, онда тура реакция оның Гиббс энергиясы нөлден төмен шарты орындалғанда мүмкін болады: ΔG<0.
Заттың тотығу–тотықсыздану қабілеттілігін реакцияның тотығу–тотықсыздану потенциалы (редокс-потенциал) анықтайды. Редокс-потенциал неғұрлым жоғары болған сайын, заттың тотығушылық қабілеттілігі соғұрлым жоғары болады.
4.2 Тәжірибелік бөлім
4.2.1 Тотығу–тотықсыздану реакцияларына ортаның рН-ның әсері.
Үш пробиркаға 3 мл-ден калий перманганаты ерітіндісін құйыңыз. Бірінші пробиркаға 2 мл 1 М H2SO4 ерітіндісін, екіншісіне 2 мл H2O, үшіншісіне 2 мл 2 М KOH ерітіндісін құйыңыз.
Әрбір пробиркаға 3 мл натрий сульфиті ерітіндісін қосыңыз.
Бақылауларыңызды жазып алыңыз. Тотығу–тотықсыздану реакциялардың теңдеулерін құрастырып, тәжірибе нәтижелерін түсіндіріңіз. MnO4--иондарының түсі көгілдір қызыл, Mn2+ - әлсіз қызғылт, MnO42- - жасыл, ал MnO2 және Mn(OH)4 тұңбаларына қоңыр түс сәйкес келеді.
4.2.2 Калий бихроматының тотығу қасиеттері
Калий бихроматының 2-3 түйіршегін ақшыл сарғыш түсті ерітіндісі пайда болатындай мөлшерде дистилленген суда ерітіңіз. Ерітіндіні күкірт қышқылының 2-3 тамшысымен қышқылдатып, оған темір(II) сульфатының түйіршегін салыңыз. Ерітінді қандай түске боялады?
Реакция теңдеуін жазып, тотықсыздандырғыш пен тотықтырғышты көрсетіңіз.
4.2.3 Асқын тотығының тотығу–тотықсыздану екіжақтылығы.
1. Асқын тотығының тотығушылық қасиеттері.
Күкірт қышқылының тең көлемімен қышқылдатылған эквиваленттік концентрациясы 0,5 моль/л калий иодиді ерітіндісінің 2-3 тамшысына асқын тотығының ерітіндісін, 1-2 тамшы крахмал ерітіндісін қосып, бос иодтың бар екенін дәлелдеңіз.
Реакция теңдеуін жазып, тотықтырғыш пен тотықсыздандырғышты көрсетіңіз.
2. Асқын тотығының тотықсыздану қасиеттері.
Пробиркаға калий перманганатының қаныққан ерітіндісінің 1 мл құйып, күкірт қышқылының ерітіндісімен қышқылдатыңыз да 1-2 мл асқын тотық ерітіндісін қосыңыз. Бөлінетін газды бықсыған шырпымен тексеріңіз. Бұл қандай газ? Реакция теңдеуін жазыңыз. Тотықтырғыш пен тотықсыздандырғышты көрсетіңіз.
Бақылау сұрақтары мен есептер
1. Тотығу-тотықсыздану реакцияларының жіктелуі.
2. Молекулааралық және молекулаішілік тотығу–тотықсыздану реакцияларының мысалдарын келтірініз.
3. Тотығу-тотықсыздану реакцияларын теңестіру әдістері. Олардың айырмашылығы неде?
4. H2S, Na2S2O3, H2SO3 және H2SO4 қосылыстарындағы күкірттің тотығу дәрежесін анықтаңыз.
5. CuO+H2 = Cu+H2O(с) реакциясы 298 К-де тура бағытта өтуі мүмкін бе?
6. Тотығу-тотықсыздану реакцияларының бағытын қандай әдістермен анықтауға болады?
7. HCl., Cl2, KClO4 қосылыстарындағы хлордың тотығу дәрежесін анықтаныз. Олардың қайсысы тек қана тотықтырғыш, қайсысы тек қана тотықсыздандырғыш, қайсысы тотықтырғыш та, тотықсыздандырғыш та болады?
8. Сілтілік металдардың тотығу дәрежесі нешеге тең? Неліктен?
5 Зертханалық жұмыс № 5. Металдардың кернеу қатары. Гальваникалық элементтердің жұмысы
Жұмыстың мақсаты: гальваникалық элементтердің кернеуі мен электр қозғаушы күшін өлшеудің әдістемесін игеру.
5.1 Теориялық кіріспе
Металдардың негізгі химиялық қасиеті – атомдардың валентті электрондарын беріп, оң зарядталған иондарға айналу қабілеттілігі. Бұл қабілеттілік металдардың электрон қауыздары мен кристалл торының ерекшеліктеріне байланысты әртүрлі болады. Металды суға батырғанда оның иондары жарым-жартылай ерітіндіге ауысып, фазалардың бөлу бетінде металл потенциалы деп аталатын потенциалдың секіруі пайда болады(φ).
Фазалардың
бөлу бетінде потенциалдың секіруін өлшеу мүмкін емес
болғандықтан, потенциалы нөлге тең
(![]() = 0) стандартты сутектік
электрод арқылы өлшенген салыстырмалы мәндерді пайдаланады.
= 0) стандартты сутектік
электрод арқылы өлшенген салыстырмалы мәндерді пайдаланады.
Стандартты сутектікпен салыстырғанда тотықсыздандырғыш болатын металдардың потенциалдары теріс таңбамен, тотықтырғыш болатын – оң таңбамен алынады. Стандартты (яғни қалыпты жағдайларда анықталған) электродтық потенциалдары өсу ретімен орналасқан металдар кернеу қатарын түзеді. Мұнда металл иондары сияқты оң зарядты иондар түзе алатын сутегі де орналасқан.
Кернеу қатарында сутегіге дейін орналасқан металдар оны қышқылдардың сұйытылған ерітінділерінен ығыстыра алады. Сол жағында тұрған металдың потенциалы неғұрлым кіші болса, соғұрлым металл оңай тотығады да иондарының тотықсыздануы қиындайды. Оң жағындағы металдың потенциалы неғұрлым жоғары болса, оның тотығуы қиындап, иондары оңай тотықсызданады.
Кернеу қатарының сол жағында орналасқан әрбір металл өзінен кейін орналасқан металдарды тұздар ерітінділерінен ығыстырады. Ығыстыратын металл тотығып, ерітіндіге ион түрінде ауысады, ал ығысатын металл тотықсызданып ерітіндіден металл түрінде бөлініп шығады.
Өз тұзының ерітіндісіне батырылған металдан тұратын жүйе металл электроды деп аталады. Әртүрлі электродтардың потенциалдары бірдей болмайтындықтан, олардан электр тізбегін құрастырып түйістірсе, онда өтетін тотығу-тотықсыздану процестердің нәтижесінде химиялық энергияны электрлікке айналдыратын жүйені алуға болады. Тотығу-тотықсыздану химиялық реакциясының энергиясын электрлікке айналдыратын жүйе гальваникалық элемент деп аталады. Тотығу процесі жүретін электрод – анод, ал тотықсыздану процесі жүретін – катод деп аталады.
Анод рөлін кернеу қатарында сол жағында орналасқан белсендірек металл атқарады (потенциалы терісірек мәндер жаққа ығысқан).
Мысал
ретінде 1 молярлы никель сульфаты ерітіндісіне батырылған никель
электроды (![]() = -0,25 В) мен 1 молярлы күміс нитраты ерітіндісіне
батырылған күміс электродынан (
= -0,25 В) мен 1 молярлы күміс нитраты ерітіндісіне
батырылған күміс электродынан (![]() = +0,80 В) тұратын гальваникалық элементті қарастырайық.
Ерітінділер өзара иондық электрөткізгіштікті қамтамасыз
ететін, ерітінділердің араласуына кедергі болатын электрлік кілт
(электролит ерітіндісімен толтырылған шыны түтікшесі) арқылы
контактілейді.
= +0,80 В) тұратын гальваникалық элементті қарастырайық.
Ерітінділер өзара иондық электрөткізгіштікті қамтамасыз
ететін, ерітінділердің араласуына кедергі болатын электрлік кілт
(электролит ерітіндісімен толтырылған шыны түтікшесі) арқылы
контактілейді.
Электродтарды сыртқы тізбегінде гальванометр арқылы металл өткізгішімен тұйықтағанда, электр тогының түзілуін көріп, оның бағытын анықтауға болады. Электродтарда келесі өзгерулер жүреді:
анод: Ni°-2e = Ni2+ (тотығу);
катод: Ag+ + е = Ag° (тотықсыздану).
Анод - теріс, ал катод – оң зарядталады.
Гальваникалық элементтің электр қозғаушы күші: Е= φк – φА.
Берілген жағдайда Е = +0,80 - (-0,25) = 1,05 В.
5.2 Тәжірибелік бөлім
5.2.1 Металдардың сутегіні қышқыл ерітінділерінен ығыстыру.
Бес пробиркаға 3-4 мл тұз қышқылы ерітіндісін құйып, әрқайсысына бір металдың түйіршегін салыңыз (магний, алюминий, мырыш, темір және мыс).
Металдардың қайсысы сутегіні қышқыл ерітіндісінен ығыстырады? Реакциялардың молекулалық, иондық және электрондық теңдеулерін жазыңыз.
5.2.2 Металдардың басқа металдармен ығысуы.
1. Пробиркаға 3-4 мл мыс сульфатын құйып, таттан тазаланған темір сымын салыңыз. Қандай құбылыс байқалады? Темір сымын мырыш пластинасына ауыстырып, тәжірибені қайталаңыз. Реакциялардың молекулалық, иондық және электрондық теңдеулерін жазыңыз.
2. Пробиркаға 3-4 мл сірке қышқылды қорғасын ерітіндісін құйып, мырыш пластинасын салыңыз. Қандай құбылыс байқалады? Реакциялардың молекулалық, иондық және электрондық теңдеулерін жазыңыз.
3. Сағат шыныға күміс нитраты ерітіндісінің 4-5 тамшысын құйып, жақсылап тазаланған мыс сымын салыңыз. Қандай құбылыс байқалады? Реакциялардың молекулалық, иондық және электрондық теңдеулерін жазыңыз.
5.2.3 Мыс-мырыш гальваникалық элементі.
Мыс пластинасын – 1 молярлы мыс сульфаты ерітіндісіне, ал мырыш пластинасын – 1 молярлы мырыш сульфаты ерітіндісіне батырыңыз. Екі ерітіндіні агар-агар және желім қосылған (ерітінді төгілмеу үшін) калий хлориді ерітіндісімен толтырылған бүгілген шыны түтікшесі арқылы қосыңыз.
Металл пластиналарының екеуіне де мыс сымдарын бекітіп, бос шеттерін фенолфталеиннің 2-3 тамшысы қосылған натрий сульфаты ерітіндісіне батырыңыз. Мырыш пластинасына бекітілген сымның айналасындағы ерітінді қызыл күрең түске боялады.
Анод пен катодта қандай тотығу-тотықсыздану процестері жүреді? Құрастырылған гальваникалық элементте өтетін реакциялардың иондық теңдеуін жазып, электр қозғаушы күшін есептеңіз.
Бақылау сұрақтары мен есептер
1. Стандартты электродтық потенциал деген не?
2. Тұз ерітінділерінен мырыш қорғасынды ығыстырады, ал қорғасын мырышты ығыстыра алмайды. Неліктен?
3. Темір металдарды қай ерітінділерден ығыстырады: Al2(SO4)3, Ag2SO4, SnSO4?
4. Металл потенциалына иондардың ерітіндідегі концентрациясы әсер етеді ме?
5. Сұйылтылған күкірт қышқылы ерітіндісінен металдардың қайсылары сутегін ығыстырады: Fe, Al, Zn, Cu, Cr, Ca, Hg?
6. Біреуінде темір катод, ал екіншісінде анод болатын екі гальваникалық элементтердің сүлбелерін құрастырыңыз. Бұл элементтерде өтетін реакция теңдеулерін құрастырыңыз.
7. (-) Fe/Fe2+//Ag+/Ag
(+) гальваникалық элементінде
![]() болғанда
электрондардың қозғалу бағытын анықтаңыз.
Электродтық реакциялардың теңдеулерін жазып, ЭҚК
мәнін есептеңіз.
болғанда
электрондардың қозғалу бағытын анықтаңыз.
Электродтық реакциялардың теңдеулерін жазып, ЭҚК
мәнін есептеңіз.
8. Концентрациялары
![]()
(-) Cd/Cd2+//Cu2+/Cu (+) гальваникалық элементінің ЭҚК есептеңіз.
9. Кернеу қатарын қолдана отырып, ЭҚК мәні ең жоғары болу үшін гальваникалық элементті қандай металдардан құрастыру қажет екендігін түсіндіріңіз.
10. Zn + 2Fe3+ -> Zn2+ + 2Fe2+ тотығу-тотықсыздану реакциясы жүруі үшін гальваникалық элементті қалай құрастыру қажет?
6 Зертханалық жұмыс № 6. Электролиз
Жұмыс мақсаты: электролиттердің сулы ерітінділерін электролиздегенде еритін және ерімейтін электродтарда өтетін процестермен танысу.
6.1 Теориялық кіріспе
Электролит ерітіндісі немесе балқымасы арқылы тұрақты ток өткен кезде электродтарда өтетін химиялық процестерді электролиз деп айтады. Бұл процестер электрлік энергияның химиялыққа айналуымен жүреді.
Электролиздің маңызы: электр тогының әсерінен анодта тотығу процесі, ал катодта тотықсыздану процесі жүреді. Сілтілік және сілтілік-жер металдар тұздарының сулы ерітінділерін электролиздегенде катодта сутегі иондары разрядталып, металл иондары ерітіндіде қалады. Кернеу қатарында алюминий мен сутегінің арасында орналасқан металл (мысалы, мырыш, никель) тұзының ерітіндісін электролизге ұшыратқанда сутегі бөлінуінің аса кернеулігімен түсіндірілетін катодта сутегі емес, металл бөлінеді.
Анод инертті материалдан (мысалы, графиттан) жасалса, электролиз кезінде анодта құрамында оттегі жоқ электролит аниондары (мысалы, Cl-, Br-, S2) разрядталады. Құрамында оттегі бар (мысалы, SO42-, РО43-, NO3- ) аниондар ерітіндіде қалып, судан бос оттегінің бөлінуімен ОН-- иондары разрядталады 4ОН- - 4е = 2H2O + O2.
Кернеу қатарында алюминийге дейін орналасқан металл мен оттекті қышқылдан түзілген тұздың сулы ерітіндісін электролиздегенде (мысалы, К2SO4) тұз иондары разрядталмайды. Бұл жағдайда электролизге су ұшырайды: катодта - сутегі, анодта – оттегі бөлінеді.
K2SO4 сулы ерітіндісі электролизінің сүлбесі
K2SO4= 2К+ + SO42-,
H2O= H+ + OH-.
![]()
![]()
![]()
![]() катод
анод
катод
анод
2Н++ 2е- = Н2 4ОН- - 4е- = 2Н2О + О2
Сутегі иондарының концентрациясының азаюына байланысты катодтық кеңістіктегі орта - сілтілік, ал анодтықта гидроксид-иондарының концентрациясының азаюына байланысты – қышқылдық болады.
NiSO4 сулы ерітіндісі электролизінің сүлбесі
NiSO4= Ni2+ + SO42-,
H2O= H+ + OH-.
![]()
![]()
![]()
![]() катод
анод
катод
анод
Ni2+ + 2е- =Ni0 4ОН- - 4е- = 2Н2О + О2
Анодтық кеңістіктегі орта – қышқылдық, катодтықта - сутегі мен гидроксид-иондар концентрацияларының қатынасы өзгермейтіндіктен ортаның қышқылдығы өзгермейді.
6.2 Тәжірибелік бөлім
6.2.1 Калий йодиді ерітіндісінің электролизі.
U – тәрізді түтікшеге ортасына дейін крахмал клейстерінің бірнеше тамшысы мен фенолфталеиннің 2-3 тамшысы қосылған калий йодиді ерітіндісін құйыңыз. Түтікшенің екі шетіне көмір электродтарын салып, тұрақты ток көзін қосыңыз. 1-2 минуттан кейін катод пен анод айналасындағы ерітінді бояуланады. Байқалатын құбылысты түсіндіріп, сулы ерітінді электролизінің сүлбесін құрастырыңыз.
6.2.2 Натрий сульфаты ерітіндісінің электролизі.
U – тәрізді түтікшеге лакмус ерітіндісі қосылған (немесе индикатор қағазы салынған) натрий сульфаты ерітіндісін құйыңыз. Электродтарды салып, тұрақты электр тогын қосыңыз. 1-2 минуттан кейін электродтардың маңайындағы ерітіндінің бояуы өзгереді. Натрий сульфаты сулы ерітіндісі электролизінің сүлбесін құрастырыңыз.
6.2.3 Мыс сульфаты ерітіндісінің электролизі.
U – тәрізді түтікшеге мыс сульфаты ерітіндісін құйыңыз. Көміртегі электродтары арқылы 4-5 минут ішінде ток жіберіңіз. Электродтарда не бөлінеді? Байқалатын құбылысты түсіндіріп, ерітінді электролизінің сүлбесін құрастырыңыз.
6.2.4 Еритін анодпен электролиз.
Алдыңғы тәжірибеде бөлінген мысы бар электродты ток көзінің оң полюсына, ал екінші электродты теріс полюсқа қосып, электр тогын өткізіңіз. Анодтағы мыс еріп бастайды. Неліктен? Мыс анодындағы мыс сульфаты сулы ерітіндісі электролизінің сүлбесін құрастырыңыз.
6.2.5 Мырыш хлориді сулы ерітіндісінің электролизі.
Электролизерға мырыш хлориді ерітіндісін құйып, графит электродтарын батырыңыз. Ток көзіне қосып, 5 минут ішінде электролизді жүргізіңіз. Тәжірибе уақыты біткеннен кейін катодты шығарып, мырыш қаптауының түзілгенін көріңіз. Анод кеңістігінде хлордың түзілуін калий йодиді мен крахмалдың бірнеше тамшысын қосып көк түсті бояудың пайда болуы бойынша анықтаңыз. Мырыш хлориді ерітіндісі электролизінің сүлбесін құрастырыңыз.
Бақылау сұрақтары мен есептері
1. Графит электродтарында AgNO3, К2СО3 сулы ерітінділері электролизінің сүлбелерін құрастырыңыз. Анодтық және катодтық кеңістіктердегі реакция ортасын анықтаңыз.
2. CuSO4, Na2S, Al2(SO4)3, Ag2SO4, MnSO4, ZnSO4 ерітінділерін электролиздегенде қайсыларында катодта сутегі бөлінеді?
3. К3РО4, NaJ, CaCl2, K3S ерітінділерін электролиздегенде қайсыларында анодта оттегі бөлінеді?
4. а) графит, б) темір электродтарында FeCl2 ерітіндісін электролиздегенде катод пен анодта қандай процестер жүреді?
5. CuSO4 ерітіндісі арқылы ішінде 8А ток күшімен 6 сағат ішінде ток жіберілсе, катодта қанша мыс бөлінеді? Инертті анодта қандай мөлшерде қандай зат бөлінеді?
6. Сынап хлориді балқымасы мен ерітіндісін электролиздегенде катодта және анодта қандай өнімдер түзіледі? Неліктен?
7. Еритін анодпен электролиз мысалдарын келтіріңіз.
8. Фарадей заңдары. Ток бойынша шығым.
7 Зертханалық жұмыс №7. Металдардың коррозиясы
Жұмыстың мақсаты: коррозионды микроэлементтер мен модельдерінің түзілу шарттарын, металдардың электрохимиялық коррозиясының жылдамдығына әртүрлі факторлардың әсерін зерттеу, металдарды коррозиядан қорғаудың маңызды әдістерімен танысу.
7.1 Теориялық кіріспе
Қоршаған ортаның химялық немесе электрохимиялық әсерінен металдың бұзылуын коррозия деп атайды. Коррозия жылдамдығын бірлік бетіндегі бірлік өлшем уақытында үлгінің массасын жоғалтуы немесе бірлік уақытында металл қалыңдығының азаюы бойынша анықтайды. Металдың бұзылу сипатына қарай коррозия бүтіндей (жалпы) және жергілікті бөлінеді. Бүтіндей коррозияда бұйымның беттік қабаты түгелдей бұзылады, жергіліктіде – беттік қабаттың жекеленген бөліктері ғана бұзылады.
Коррозиялық процестің механизмі бойынша химиялық және электрохимиялық коррозияны айырады. Химиялық коррозия электр тогын өткізбейтін орталарда жүреді. Химиялық коррозия кезінде металдың тотықтырғышпен тікелей әрекеттесуі жүреді. Электрохимиялық коррозия иондық өткізгіштігі бар орталарда жүреді. Мұнда коррозия тотықтырғыштың катодтық тотықсыздануының әсерінен металдың анодтық еруі болып табылады. Коррозиялық процестерде ең кеңінен таралған тотықтырғыштар: сутегі иондары мен оттегі молекулалары.
Сутегі иондарының қатысында жүретін коррозия сутегінің бөлінуімен (немесе сутектік деполяризациямен) жүретін коррозия деп аталады. Мұнда өтетін электродтық процестердің теңдеулері:
Me – ne- →Men+,
2Н+ + 2e- →H2.
Сутегінің бөлінуімен коррозия сутек электродының потенциалы металл потенциалынан жоғары болғанда жүреді. Коррозия жылдамдығы сутегі бөлінетін беттің түрі мен металл табиғатына байланысты сутегінің бөліну реакциясының жылдамдығына тәуелді. Коррозия жылдамдығы металл әрекеттесетін ерітіндінің рН мен температурасына тәуелді.
Оттегінің қатысымен коррозия оттегінің сіңірілуімен (оттектік деполяризациямен) жүретін коррозия деп аталады. Электродтық процестердің теңдеулері:
Me – ne- →Men+,
О2 + 2Н2О +4e- →4OH-.
Оттегінің сіңірілуімен коррозия оттегі электродының потенциалы металл потенциалынан жоғары болғанда жүреді. Бұл жағдайда коррозия жылдамдығы оттегінің дифузиялану жылдамдығымен анықталады. Ерітіндіні араластырғанда және еріген оттегінің концентрациясын жоғарлатқанда коррозия жылдамдығы өседі.
Кейбір жағдайларда коррозия жылдамдығы анодтық реакциялармен лимиттенеді. Әдетте, бұл құбылыс пассивтеуге қабілеттілігі бар металдарда (алюминий, титан, хром, никель, тантал т.б.) байқалады. Металдың пассивтілігі деп анодтық процестің баяулауына байланысты жоғары коррозиялық тұрақтылық күйін айтады. Пассивтеудің себебі - металдың бетінде қорғау қабыршақтың түзілуі.
Коррозияны пассивтену арқылы және металдың потенциалын өзгертіп, тотықтырғыштың концентрациясын азайтып, металдың бетін тотықтырғыштан оқшаулап, металдың құрамын өзгертіп баяулатуға болады. Қорғау әдісін таңдау бұл металды қолдану шарттары мен экономикалық пайдалылығымен анықталады.
Металдың коррозиялық қасиеттерін легірлеу арқылы өзгертуге болады. Легірлеу – құйманың құрамына коррозия жылдамдығын төмендететін немесе оны болдырмайтын компонентті енгізу. Әдетте, құймалар құрамына металдың пассивтенуіне (яғни бетінде қорғау қабыршақтың түзілуіне) әкелетін компоненттерді енгізеді. Мұндай компоненттерге хром, никель, титан, вольфрам т.б. жатады
Металл коррозиясының жылдамдығын төмендететін тиімді әдісіне металдарды қорғаныс жабындарымен қаптау жатады. Қорғаныс ретінде металдық, оксидтік, силикатты, лак-бояу т.б. жабындар қолданылады. Олардың әсер ету механизмі металды тотықтырғыштан оқшаулауда жатады. Металдық жабындар катодтық және анодтық болады. Жабын металдың потенциалы қорғанатын металдың потенциалынан төмен болса, коррозия кезінде жабын металл еріп (коррозияға ұшырап), негізгі металл бұзылмайды. Мұндай жабындар анодтық деп аталады (мысалы, мырышталған темір). Жабын металының потенциалы негізгі металдікінен жоғары болса, жабынның тұтастылығы бұзылғанда (қуыстар, жарықтар пайда болғанда) негізгі металл коррозияға ұшырауы мүмкін. Мұндай жабындар катодтық деп аталады (мысалы, мысталған темір).
Коррозия жылдамдығын реакциялардың потенциалын өзгерту арқылы катодтық және анодтық реакцияларды баяулатып азайтуға болады. Металды мұндай әдіспен қорғау электрохимиялық әдіс деп аталады. Электрохимиялық қорғау әдістеріне протекторлы, катодтық және анодтық әдістер жатады. Қорғанатын металл конструкциясына протекторды (яғни потенциалы терістеу металды) жалғастырғанда протектордың коррозиясы жүреді де негізгі металл сақтанып қалады. Катодтық қорғау әдісінде қорғанатын бұйым токтың сыртқы көзінің теріс полюсіне жалғанады. Бұл кезде қорғанатын бұйымның бетінде сутегі бөлінеді. Ал анодтық қорғауда қорғанатын бұйым токтың сыртқы көзінің оң полюсіне жалғанады да, қорғанатын металдың пассивтенуі жүреді.
Мұнымен қатар, коррозияны коррозиялық ортаға әсер етіп (тотықтырғыштың концентрациясын азайтып, арнайы ингибиторларды енгізіп) баяулатуға болады.
7.2 Тәжірибелік бөлім
7.2.1 Болат бетінің электрохимиялық әртектілігі.
Болаттың электрохимиялық әртектілігіне және тотықтырғыштың бар болуына байланысты оның бетінде коррозиялық микроэлементтер түзіледі. Бұл микроэлементтер жұмыс істегенде темірдің анодтық еруі жүреді. Темірдің еруін Fc2+ индикатормен әрекеттескенде турнбул көгінің түзілуінен анықтайды.
Тәжірибені өткізу үшін болат пластинасын егеуқұм қағазымен тазалап, сумен жуып, сүзгіш қағазымен сүртіңіз. Пластинаның бетін ферроксилиндикаторымен суланған сүзгіш қағазын жабыңыз. 2-3 минуттан кейін дақтардың пішіні мен таралуын, сүзгіш қағазы бояуының өзгеруін байқаңыз. Көрген құбылыстарды түсіндіріңіз. Электродтық реакциялардың потенциалдар мәндерін қолдана отырып, реакция теңдеулерін жазыңыз.
7.2.2 Темірдің графитпен байланысындағы коррозиясы.
U-тәрізді түтікшені көлемінің жартысына дейін 0,5 М натрий хлориді ерітіндісімен толтырыңыз. Болат және графит өзектерін (стерженьдерін) егеуқұм қағазымен тазалап, сумен жуыңыз. Түтікшенің бір жағына болат өзегін салып, 3-4 тамшы K3[Fe(CN)6] қосыңыз, екінші жағына графит өзегін салып, 3-4 тамшы фенолфталеин қосыңыз.
Милливольтметр арқылы сыртқы тізбекті тұйықтап, кернеуін жазып алыңыз. Вольтметрді айырып тастап, сыртқы тізбекті мыс өткізгішімен тұйықтаңыз. Элементтің жұмысы мен катодтық және анодтық кеңістіктеріндегі ерітінді бояуының өзгеруін байқаңыз.
Анодтық процестің теңдеулері мен электродтың стандарттық потенциалының мәнін жазып алыңыз. Анодтың маңайында бояудың өзгеруінің себебін түсіндіріңіз.
Тәжірибенің басында ортаның рН ескере отырып және газдар қысымын атмосфералыққа тең деп, мүмкін болатын катодтық процестердің потенциалдарын есептеңіз. Катодта өтетін процестердің теңдеулерін жазып, катод маңайында ерітінді бояуы өзгеруінің себебін түсіндіріңіз.
Коррозиялық процестің сомарлы теңдеуін жазып, коррозиялық элементтің сүлбесін құрастырыңыз.
7.2.3 Темір коррозиясының жылдамдығына жанасатын металдар табиғатының әсері.
Тәжірибеде болаттың әртүрлі металдармен жұптарындағы коррозиясы зерттеледі. Тәжірибенің бірінші бөлімінде темір никель және мыспен жұпта болады, екінші бөлімінде – қорғасын және кадмиймен.
U-тәрізді түтікшеге көлемінің жартысына дейін 0,1 молярлы H2SO4 ерітіндісін құйыңыз. Металл пластиналарын егеуқұм қағазымен жақсылап тазалап, сумен жуыңыз. Түтікшенің бір жағына болат пластинасын, екінші жағына никель (немесе мыс) пластинасын салыңыз. Милливольтметр арқылы элементтің кернеуін анықтаңыз. Тәжірибені кадмий немесе қорғасын пластинасымен қайталаңыз.
Тәжірибе қорытындыларына анодтық және катодтық процестердің теңдеулерін, реакцияның сомарлы теңдеуін жазыңыз. Коррозиялық элементтің сүлбесін келтіріңіз.
Катодтық реакцияның потенциалын есептеп, қолданған металдар табиғатының коррозия жылдамдығы мен коррозиялық элементтің кернеуіне әсерін түсіндіріңіз.
7.2.4 Металл пассивтілігі.
Натрий хлориді ерітіндісінде пассивті және белсенді металдың тәртібі.
Темірді белсендету үшін болат пластинасын молярлы концентрациясы 0,5 моль/л тең тұз қышқылы ерітіндісімен, ал пассивтендіру үшін түтінді азот қышқылымен өңдейді.
U-тәрізді шыны түтікшесін молярлы концентрациясы 0,5 моль/л натрий хлориді ерітіндісімен толтырыңыз. Болат және графит пластиналарын егеуқұм қағазымен тазалап, сумен жуыңыз. Болат пластинасын 2-3 минутқа 0,5 молярлы тұз қышқылы ерітіндісіне батырып, сумен жуыңыз. Түтікшенің бір жағына болат пластинасын салып, 3-4 тамшы K3[Fe(CN)6] қосыңыз, екінші жағына графит пластинасын салып, 3-4 тамшы фенолфталеин қосыңыз. Сыртқы тізбекті милливольтметр арқылы тұйықтап, кернеуін жазып алыңыз. Милливольтметрді айырып, сыртқы тізбекті мыс немесе алюминий өткізгішпен тұйықтаңыз. Элемент жұмыс істеген кезде катодтық және анодтық кеңістіктерде ерітінді бояуының өзгеруін байқаңыз.
Болат пластинасын шығарып алып, сумен жуыңыз да, 2-3 минутқа түтіндеп тұрған азот қышқылы ерітіндісіне (тығыздығы 1,5 г/см3) салып, одан кейін сумен жуыңыз. Қышқыл ерітіндісімен өңдеу процесін сорып алатын шкафта жүргізіңіз!
U-тәрізді түтікшедегі ерітіндіні төгіңіз де, тәжірибенің бірінші бөліміндегі индикаторлары бар жаңа дайындалған ерітінділерді құйыңыз. Болат және графит пластиналарын түтікшеге батырып, тәжірибелерді қайталаңыз.
Тәжірибені қорытындылағанда U-тәрізді түтікшедегі болат пластинасындағы мүмкін болатын анодтық процестерді жазып, анодтың маңайындағы ерітінді бояуының өзгеруінің себебін жазыңыз. Болат пластинасының сұйытылған тұз қышқылы мен концентрлі азот қышқылы бар ыдысындағы коррозиялық тәртіптерінің айырмашылығын түсіндіріңіз. Тәжірибенің басында ортаның рН ескере отырып және газдар қысымын атмосфералыққа тең деп, мүмкін болатын катодтық процестердің потенциалдарын есептеңіз. Катодта өтетін процестердің теңдеулерін жазып, катод маңайында ерітінді бояуы өзгеруінің себебін түсіндіріңіз.
Катод белсендірілген және пассивтелген темірмен жұп болғанда, оның әртүрлі тәртібін түсіндіріңіз. Коррозионды процестің сомарлы теңдеуін жазып, коррозиялық элементтің сүлбесін келтіріңіз. Тәжірибенің бірінші және екінші бөлімдеріндегі элементтің кернеуіндегі айырмашылығын түсіндіріңіз.
7.2.5 Хлор иондарының белсендету әсері.
Екі пробиркаға жартысына дейін күкірт қышқылы қосылған мыс сульфаты ерітінідісін құйыңыз. Бірінші пробиркаға натрий хлоридін қосыңыз. Пробиркалардың екеуіне алюминий сымын салыңыз. Пробиркалардың қайсысында газдың бөлінуі қарқынды жүреді? Анодтық, катодтық және сомарлы процестердің теңдеулерін жазып, коррозиялық элементтің сүлбесін келтіріңіз. Реакция жылдамдығына хлор-иондарының әсер ету механизмін түсіндіріңіз.
7.2.6 . Металды легірлеу.
Тоттанбайтын болаттың құрамына кіретіндіктен никель мен хром темірді легірлейтін қоспалар ретінде қолданылады.
Екі пробиркаға жартысына дейін су қосып, 2-4 мл H2SO4 ерітіндісі мен 2-4 тамшы K3[Fe(CN)6] ерітіндісін қосыңыз. Бірінші пробиркаға егеуқұм қағазымен тазаланып, сумен жуылған болат платинасын, екіншіге тазаланбаған тотталмайтын болат пластинасын салыңыз. 5 минуттан кейін ерітінді бояуының өзгеруі мен бірлік уақытында бөлінетін газ көпіршектерінің мөлшерін байқаңыз.
Потенциалдарын есептеп (ерітіндінің рН=1, темір иондарының белсенділігі 10-3 моль/л), анодтық және катодтық процестердің теңдеулерін жазып, байқаған құбылыстарыңызды түсіндіріңіз. Коррозиялық процестің сүлбесін келтіріңіз. Пластиналардың қышқыл ерітіндісіндегі тәртіптерінің айырмашылығын түсіндіріңіз.
7.2.7 Анодтық және катодтық қорғау жабындары.
Екі пробиркаға жартысына дейін су құйып, 1-2 мл H2SO4 пен 2-4 тамшы K3[Fe(CN)6] ерітінділерін қосыңыз. Бір пробиркаға – мырышталған темір платинасын, ал екіншіге – қалайыланған темір платинасын батырыңыз. 5 минуттан кейін пробиркалардағы ерітінділердің бояуларының өзгеруін байқаңыз.
Байқауларыңызды түсіндіріп, анодтық және катодтық процестердің теңдеулерін жазып, коррозиялық элементтердің жұмыс істеу сүлбелерін келтіріңіз. Зерттелген жабындардың қайсысы анодтық, қайсысы катодтық?
Пробиркалардағы ерітінділерді төгіп, темір пластиналарын кран астындағы сумен жақсылап жуып, тәжірибені сілті ерітіндісімен қайталаңыз. Байқаған құбылыстарды жазып алыңыз да, түсіндіріңіз.
Бақылау сұрақтары мен есептері
1. Металдардың коррозиясы деген не?
2. Коррозияның қандай түрлері болады?
3. Электрохимиялық коррозияның химиялықтан айырмашылығы.
4. Электрохимиялық коррозияның жылдамдығы.
5. Металл бетінің электрохимиялық әртектілігінің себептері.
6. Коррозиялық микрогальваникалық элементтер түзілуінің себептері.
7. Сутегінің бөлінуімен және оттегінің сіңірілуімен өтетін коррозияның жүру мүмкіндігін қалай анықтауға болады?
8. Сутегінің бөлінуімен өтетін коррозияға қандай факторлар әсер етеді?
9. Оттегінің сіңірілуімен өтетін коррозияның жылдамдығын қалай баяулатуға болады?
10. Fe2+-иондарының белсенділігі 10-4 моль/л, ортаның рН 2 болатын ерітіндіде сутегінің бөлінуімен коррозияның өтуі мүмкін бе?
11.Сu2+-иондарының белсенділігі 10-4 моль/л, ортаның рН бейтарап болатын ерітіндіде мыстың ауада оттегіні сіңірумен коррозиясы мүмкін бе?
12. Анодтық және катодтық қорғаныс жабындары деген не?
Әдебиеттер тізімі
1. Коровин Н.В. Общая химия.- М.: Высшая школа, 2005.
2. Харин А.Н., Катаева Н.А., Харина Л.Г. Курс химии.- М.: Высшая школа,1983.
3. Глинка Н.Л. Общая химия.- Л.: Химия, 1999.
4. Ахметов Н.С. Общая и неорганическая химия. - М.: Высшая школа, 1998.
5. Бірімжанов Б.А. Жалпы химия. –А.: Мектеп, 2001.
6. Пірәлиев С.Ж., Бутин Б.Н., Байназарова Г.М., Жайлау С.Ж. Жалпы химия. –Алматы, 2003.-т.1-2.
7. Аханбаев К.А. Жалпы және анорганикалық химия. – А.: Мектеп, 1987.
8. Дробашева Т.И. Общая химия. - Ростов-на-Дону: Феникс, 2004.
9. Сұлтанбаева Б.М., Тұманова А.А. Химия. Оқу құралы. Энергетикалық мамандықтары бойынша барлық оқу түрінің студенттері үшін. –Алматы, АЭжБУ, 2011.
10. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии.- М.: Астрель, 2004.
11. Глинка Н.Л. Задачи и упражнения по общей химии. М.: Интеграл-Пресс, 2004.
12. Задачи и упражнения по общей химии под ред. Коровина Н.В. - М.: Высшая школа, 2004.
13. Лидин Р.А., Молочко В.А., Андреева Л.Л. Задачи по неорганической химии.- М.: Высшая школа, 1990.
Мазмұны
Кіріспе 3
1 Зертханалық жұмыс №1. Бейорганикалық қосылыстардың кластары 4
2 Зертханалық жұмыс №2. Еру жылуы мен гидратациялану жылуын анықтау8
3 Зертханалық жұмыс №3. Химиялық реакциялардың кинетикасы. Химиялық тепе-теңдік 12
4 Зертханалық жұмыс №4. Тотығу-тотықсыздану реакциялары 17
5 Зертханалық жұмыс №5. Металдардың кернеу қатары және гальваникалық элементтердің жұмысы 20
6 Зертханалық жұмыс №6. Электролиз 22
7 Зертханалық жұмыс №7. Металдардың коррозиясы 25
Әдебиеттер тізімі 31
2012ж. негізгі жоспары, реті 81