Некоммерческое акционерное общество
АЛМАТИНСКИЙ УНИВЕРСИТЕТ ЭНЕРГЕТИКИ И СВЯЗИ
Кафедра методологии и научного природопользования Би Джи
ХИМИЯ
Конспект лекций
для студентов специальности
5В073100 - Безопасность жизнедеятельности и защита окружающей среды
Алматы 2013
СОСТАВИТЕЛИ: Ж.А. Каленова., Г.А. Колдасова. Химия. Конспект лекций (для студентов специальности 5В073100- Безопасность жизнедеятельности и защита окружающей среды. – Алматы: АУЭС, 2013. – 35с.
Конспект лекций по химии предназначены для студентов 1 курса бакалавриата специальности 5В073100 – Безопасность жизнедеятельности и защита окружающей среды.
Библиогр. 8 назв.
Рецензент: доцент каф. ЭПП М.В. Башкиров.
Печатается по плану издания некоммерческого акционерного общества «Алматинский университет энергетики и связи» на 2013 г.
ã НАО «Алматинский университет энергетики и связи», 201
Сводный план 2013 г. поз. 263
Введение
Химия – наука о превращениях веществ, связанных с изменением электронного окружения атомных ядер.
Прошедший XX век вполне заслуживает названия «века химии» – за сто лет была создана химическая промышленность, изменившая мир и сделавшая нашу жизнь гораздо более комфортной. Однако следует помнить, что «всемирная химизация» произошла отнюдь не из благородных побуждений. Химия начала бурно развиваться как наука еще в XIX веке в связи с потребностями производства, но прежде всего производства военного. Химия служит теоретической основой получения минеральных удобрений, аммиака, кислот, солей, полупроводниковых материалов, сплавов металлов и других многочисленных продуктов. В развитие неорганической химии Казахстана внесли огромный вклад отечественные ученые - Бектуров А.Б., Беремжанов Б.А., Усапович М.И., Сонгина О.А. Серазетдинов Д.З., Ильясова А.К., Нурахметов Н.И., Оспанов X.К.
Химия играет огромную роль в расширении наиболее актуальных проблем современного общества. К их числу относят:
а) синтез новых веществ и композиций, необходимых для решения технических задач;
б) увеличение эффективности искусственных удобрений для повышения урожайности сельскохозяйственных культур;
в) синтез продуктов питания из несельскохозяйственного сырья (искусственная пища);
г) разработка и создание новых источников энергии;
д) охрана окружающей среды;
е) выяснение механизма важнейших биохимических процессов;
ж) освоение огромных океанических источников сырья.
Изучая свойства веществ,
химия не ограничивается изучением только их внешних качественных или
количественных характеристик (температуры плавления и кипения, плотность и
т.д.). Главная задача химии - выявление и описание химических свойств веществ,
благодаря которым становится возможным превращение одних веществ в другие в
результате химических реакций. Знание природы веществ позволяет понять
превращения этих веществ с позиции основных законов, которым подчиняются эти
превращения. Наконец, познакомившись с основными понятиями и законами химии,
можно объяснить и даже пытаться прогнозировать принципы и условия работы
современных химических производств.
Глубокое знание химии совершенно необходимо специалистам всех отраслей
народного хозяйства.
Конспект лекций предназначен для бакалавров, изучающих химию в объеме двух кредитов.
Содержание конспекта соответствует учебной программе курса химии и состоит из 8 лекций.
Лекция 1. Основные понятия и законы химии
Цель лекции: изучение понятий о материи и движении, рассмотрение закона сохранения массы и энергии, ознакомление с понятием эквивалента и количества вещества.
Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами. Имеет постоянный состав (качественный и количественный) входящих в нее атомных ядер и фиксированное число электронов.
Атом(от греч. atomos – неделимый - наименьшая частица химического элемента, сохраняющая все его химические свойства.
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно более 110 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в котором сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре. Элемент водород имеет три изотопа: протий - 11Н, дейтерий - 21Н или D, тритий - 31Н или Т. Изотопы, имеющие одинаковые массовые числа, но различные заряды ядер, называются изобарами.
Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам. Простые вещества - молекулы, состоят из атомов одного и того же элемента. Углерод имеет аллотропные формы: алмаз, графит, карбин и фуллерен, молекулярный кислород О2 и озон О3.
Cложные вещества - молекулы, состоят из атомов различных химических элементов.
Ионы (от греч. ion – идущий) одноатомные или многоатомные частицы, несущие электрический заряд. Положительные ионы называют катионами, отрицательные – анионами. В свободном состоянии существуют в газовой фазе (в плазме).
Валентность (от лат. valentia – сила) способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Валентность элемента может быть определена и по другим атомам с известной валентностью.
Международная единица атомных масс равна 1/12 массы изотопа углерода-12 - основного изотопа природного углерода.
1 а.е.м = 1/12 · mа(12C) = 1,66057 · 10-24 г.
Относительная атомная масса (Ar) – безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Относительная молекулярная масса (Mr) – безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается ν, измеряется в моль. Моль - количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Молярная масса показывает массу 1 моля вещества (обозначается M).
M = m/ν.
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества. Молярная масса вещества численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая - безразмерная.
Закон сохранения массы веществ. (М.В. Ломоносов, 1748 г.; А. Лавуазье, 1789 г.).
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение - это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа. Реакция горения метана в кислороде, в результате которой образуется углекислый газ и вода:
CH4+2O2 →CO2 + 2H2O.
По закону сохранения массы:
m(CH4) + 2m(O2) → m(CO2) + 2m(H2O),
где m(CH4);
m(O2) – массы реагирующих веществ, m(CO2);
m(H2O) – массы продуктов реакции.
Закон постоянства состава.
Впервые сформулировал Ж.Пруст (1808 г).
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения. Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях. Оксид углерода (IV), полученный различными способами, состоит из атомов углерода (27,29%) и атомов кислорода (72,71%).
С + О2 = СО2,
2СО + О2 = 2СО2,
СаСО3 = СаО + СО2,
СаСО3 + 2НСl = CaCl2 + CO2 + H2O.
Закон кратных отношений (Д. Дальтон, 1803 г.).
Если два химических элемента образуют между собой несколько различных соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа.
N2O N2O3 N2O4 N2O5
1 : 3 : 4 : 5.
Закон объемных отношений (Гей-Люссак, 1808 г.).
Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества:
2CO + O2→ 2CO2.
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
Закон Авогадро (1811 г.).
В равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул. Закон справедлив только для газообразных веществ. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы. При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.Число Авогадро (NA) - количество частиц в 1 моль любого вещества одно и то же и равно 6,02 · 1023 моль-1.
Закон эквивалентов (И. Рихтер 1792-1800).
Закон эквивалентов - массы (объемы) реагирующих друг с другом веществ и пропорциональны их эквивалентным массам (объемам):
mА/mВ=ЭА/ЭВ.
Если одно из веществ находится в газообразном состоянии, тогда:
VА/VВ = ЭА/ЭВ.
Количество элемента или вещества, которое взаимодействует с 1 молем атомов водорода или замещает это количество водорода в химических реакциях называется эквивалентом данного элемента или вещества.
Эквивалентной массой - называется масса 1 эквивалента вещества. Эквивалентом гидроксида калия и соляной кислоты будут соответственно KOH и HCl, серной кислоты – ½ H2SO4, фосфорной кислоты – 1/3 H3PO4, хлорида алюминия – 1/3АlCl3, хлорида титана – ¼ TiCl4.
Моль эквивалентов содержит 6,022∙1023 эквивалентов. Соответственно, закон эквивалентов можно сформулировать иначе: моль эквивалентов одного вещества реагирует с одним молем эквивалентов другого вещества, в реакции:
1/3Аl + HCl = 1/3AlCl3 + 1/2H2,
один моль эквивалентов алюминия (1/3 моль Аl) реагирует с одним молем эквивалентов кислоты (1 моль HCl) с образованием одного моля эквивалентов хлорида алюминия (1/3 моль AlCl3) и одного моля эквивалентов водорода (1/2 моль H2).
Эквивалентным объемом называется объем, занимаемый при данных условиях 1 эквивалентном газообразного вещества. Так для водорода при н.у. эквивалентный объем равен 22,4 ⋅ 1/2 = 11,2 л/моль, для кислорода – 5,6 л/моль.
Объединенный газовый закон - объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта - уравнение, которое можно записать так:
PV/T = P0V0/T0,
где P0, V0, T0 – давление, объем газа и температура при н.у. Из объединенного газового закона при P = const (P = P0) можно получить:
V/T = V0/T0 (закон Гей-Люссака); при Т = const (T = T0):
PV = P0V0 (закон Бойля-Мариотта); при V = const;
P/T = P0/T0 (закон Шарля).
Уравнение Клайперона-Менделеева
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клайперона-Менделеева
РV = (m/M)RT,
где m – масса газа; M – молекулярная масса; p – давление; V – объем; T – абсолютная температура (°К); R – универсальная газовая постоянная (8,314 Дж/(моль·К).
Лекция 2. Строение вещества. Периодический закон и периодическая система. Химическая связь
Цель лекции: изучение электронной структуры атомов, основных видов связей, пространственной конфигурации, полярности молекул. Рассмотрение ядерных превращений и сопутствующих им процессов.
В 1897 г. Томсоном был открыт электрон и установлено, что электрон может быть выделен из любого элемента. В 1896 г. Беккерель открыл явление радиоактивности – способность атомов тяжелых элементов испускать b-частицы (электроны). В 1911 г. Резерфорд предложил планетарную модель атома, согласно которой электроны в атоме вращаются вокруг положительного ядра, в котором сосредоточена вся масса атома.
Квантовые числа. Энергетическое состояние электрона в атоме может быть полностью описано набором из четырех квантовых чисел.
Главное квантовое число n – принимает целые значения – 1, 2, 3….и соответствует номеру периода. Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака.
Орбитальное квантовое число l. При размещении электрона вдали от ядра происходит расщепление уровня энергии на подуровни. Чем дальше электрон от ядра, тем сильнее расщепление, больше подуровней у электрона данного уровня. Орбитальное квантовое число зависит от n и может принимать целочисленные значения от 0 до (n – 1). Сумма подуровней на уровне численно равна номеру уровня.
Электроны с орбитальным квантовым числом 0 называются s – электронами. Орбитали и соответственно электронные облака имеют сферическую форму.
Электроны с орбитальным квантовым числом 1 называются p– электронами. Орбитали и соответственно электронные облака имеют форму похожую на гантель.
Электроны с орбитальным квантовым числом 2 называются d– электронами. Орбитали имеют более сложную форму, чем p – орбитали.
Электроны с орбитальным квантовым числом 3 называются f– электронами. Орбитали имеют более сложную форму, чем d - орбитали.
Магнитное квантовое число ml характеризует положение электронной орбитали в пространстве и принимает целые значения от -1 до +1, включая 0.
Для s- орбитали (l = 0) такое положение одно и соответствует m = 0. Для p- орбитали (l = 1) - три равноценные ориентации в пространстве (2l + 1 = 3): m = -1,0, +1. Для d- орбитали (l = 2) - пять равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2.Таким образом, на s- подуровне - одна, на p- подуровне - три, на d- подуровне - пять, на f-подуровне - 7 орбиталей.
Спиновое число mS принимает значения +1/2 или –1/2. Характеризует собственный момент количества движения электрона.
Многоэлектронные атомы. Принцип Паули. Правило Гунда.
В многоэлектронном атоме каждый электрон не только притягивается ядром, но и отталкивается другими электронами. При построении электронной оболочки многоэлектронного атома руководствуются следующими принципами (правилами):
Принцип минимума энергии. Притяжение внешних электронных слоев к ядру меньше, чем внутренних. Электроны в атоме стремятся занять самое низкое из возможных энергетическое положение, что отвечает наибольшей устойчивости. Электронные слои заполняются от 1 к 7, а электронные оболочки от s- к p-, d- и т.д.
Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, ml, mS) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами) ¯. Математическое выражение принципа Паули Se=2n2.
Правило Гунда. Электроны в пределах данного подуровня распределяются таким образом, чтобы их суммарный спиновой момент был максимален.
Правило Клечковского. В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
1s<2s<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈5d≈4f<6p<7s.
Периодический закон. Периодическая система элементов.
Свойства элементов, а также состав и свойства их соединений находятся в периодической зависимости от заряда ядра.
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра. Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов. Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2np6).
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях. Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне). В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
Энергия ионизации и сродство к электрону.
Энергия ионизации J (эВ) – это энергия, которую необходимо затратить, чтобы отделить электрон от атома (нейтрального, невозбужденного, газообразного).
Способность атома присоединять электроны с образованием отрицательно заряженного иона характеризует энергия сродства к электрону- Е (эВ).
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами. Ковалентная связь - осуществляется за счет электронной пары, принадлежащей обоим атомам.
1) Ковалентная неполярная связь осуществляется общей электронной парой, образующей симметричное электронное облако. Этот вид связи возникает между атомами с одинаковой электроотрицательностью: H2, O2, N2, Cl2, Br2, I2, PH3, CS2. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
H∙ + ∙H →H ׃H![]() +
+![]() →
→![]() ׃
׃![]()
2) Ковалентная полярная связь образуется между двумя атомами, при этом электронное облако смещено к атому с наибольшей электроотрицательностью: HCl, H2O, H2S, CO2 и др.
Н∙ + ∙![]() ׃
→ H׃
׃
→ H׃![]() ׃
׃
Донорно-акцепторный механизм образования ковалентной связи:
![]() + H+→
+ H+→ + .
+ .
Ковалентная связь обладает следующими особенностями:
а) насыщаемостью, обусловленную тем, что при химическом взаимодействии участвуют электроны только внешних энергетических уровней, т.е. ограниченное число электронов;
б) направленностью – область перекрывания электронных облаков находится в определенном направлении по отношению к взаимодействующим атомам.
Ионная связь .Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью. Такая связь возникает между катионами s-металлов первой и второй групп периодической системы и анионами неметаллов VI и VII групп, например NaCl, (LiF, CsCl, K2O).
Na0-e →Na+
Сl0 + e → Cl-
Na∙ + ![]() → Na+
→ Na+![]() -
-
Водородная связь - это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородные связи характерны для таких веществ, как вода H2O, аммиак NH3, фтороводород HF:
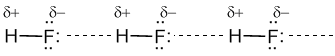
В водных растворах аммиака или HF эти молекулы образуют водородные связи не только между собой, но и с молекулами воды. Благодаря водородным связям, аммиак NH3 имеет фантастическую растворимость: в 1 л воды может растворяться 750 л газообразного аммиака!
Металлическая связь. Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу. Электроны в металле осуществляют связь между всеми атомами металла.
Радиоактивность - самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер (например, α- частиц). Радиоактивность, проявляемая природными изотопами элементов, называется естественной радиоактивностью. Радиохимия изучает химию ядерных превращений и сопутствующие им физико-химические процессы, а также химию радиоактивных веществ.
α - распад. Сопровождается потоком положительно заряженных ядер атома гелия 42Не (α-частиц) со скоростью 20000 км/с. При этом заряд Z исходного ядра уменьшается на 2 единицы (в единицах элементарного заряда), а массовое число А - на 4 единицы (в атомных единицах массы).
Z' = Z – 2, A' = A – 4,
т.е. образуется атом элемента, смещенного по периодической системе на две клетки влево, от исходного радиоактивного элемента, а его массовое число на 4 единицы меньше исходного:
22682Ra → 22280Rh + 42He.
β- распад. Излучение ядром атома потока электронов со скоростью 100000 - 300000 км/с. Электрон образуется при распаде нейтрона ядра. Нейтрон может распадаться на протон и электрон. При β- распаде массовое число изотопа не изменяется, поскольку общее число протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1. Химический элемент смещается в периодической системе на одну клетку вправо, а его массовое число не изменяется:
23490Th→ 23491Po + 0-1e.
γ- распад. Возбужденное ядро испускает электромагнитное излучение с очень малой длиной волны и высокой частотой, обладающее большой проникающей способностью, при этом энергия ядра уменьшается, массовое число и заряд остаются неизменными. Химический элемент не смещается в периодической системе, его массовое число не изменяется и лишь ядро его атома переходит из возбужденного состояния в менее возбужденное.Ядерные реакции - превращения ядер, происходящие при их столкновении друг с другом или с элементарными частицами. Первая искусственная ядерная реакция была осуществлена Э.Резерфордом (1919 г.) при бомбардировке ядер азота α- частицами:
147N + 42He → 178O + 11H.
Периодом полураспада (τ1/2) называется время, за которое распадается половина исходного количества радиоактивного изотопа. В течение первого периода полураспада распадается 1/2 часть от первоначального числа ядер изотопа N0 и остается ½ N0 = 2–1N0 ядер. В течение второго периода распадается половина от 2–1N0и остается ½ ⋅2–1N0= 22N0 ядер и т.д. В конце n-го периода полураспада остается 2–nN0 ядер исходного изотопа.
Лекция 3. Скорость химических реакций
Цель лекции: изучение зависимости скорости реакции от концентрации, молекулярности реакций, отличие кинетики гетерогенных реакций.
Химическая кинетика – наука о скоростях и механизмах протекания химических реакций.
Реакции могут быть гомогенными и гетерогенными. Гомогенные реакции протекают в однородной среде (в газовой фазе или жидком растворе). Гетерогенные реакции протекают в неоднородной среде – между веществами, которые находятся в разных фазах. Фазой называется часть системы, отделенная от других частей системы поверхностью раздела. В гомогенной системе все вещества перемешаны, молекулы реагентов сталкиваются в любой точке системы и реакция протекает равномерно по всему объему системы. За скоростью реакции можно проследить, если фиксировать изменение количества какого-либо из исходных веществ или продуктов реакции в единице объема за единицу времени, тогда:
u = Dn/(V×Dt) =DC/Dt, моль/(л×с),
где С – молярная концентрация (моль/л).
Молекулярность реакции. В реакции могут принимать участие одна, две или три молекулы. По этому признаку различают одномолекулярные, двухмолекулярные и трехмолекулярные (тримолекулярные) реакции.
Скорость реакции возрастает по мере возрастания концентраций реагирующих веществ. Скорость гомогенных реакций зависит от числа встреч реагирующих частиц в единицу времени в единице объема - закон действующих масс (Гульдберг и Вааге, 1867 г.):
- одномолекулярная реакция I2(г) = 2Iu = k×C(I2);
- двухмолекулярная реакция H2 + I2 = 2HIu = k×C(H2)×C(I2);
- трехмолекулярная реакция О2+2NO = 2NO2u = k×C2(NO) ×C(О2).
При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Коэффициент k называется константой скорости реакции, не зависит от концентрации реагирующих веществ, зависит от природы реагирующих веществ, температуры и наличия в системе катализатора.
Закон действующих масс применим только к элементарным реакциям. Сложные реакции протекают через ряд промежуточных стадий и стехиометрическое уравнение не соответствует молекулярности реакции, а отражает суммарный процесс:
2Н2О2 = 2Н2О + О2,
по закону действующих масс u = k×C2(Н2О2), что не соответствует экспериментальным данным, согласно которым u = k×C(Н2О2). Дело в том, что процесс идет в две стадии: 1) Н2О2=Н2О+О и 2) О+О=О2. Первая стадия, как более медленная, определяет скорость суммарного процесса. Зависимость скорости реакции от концентрации реагирующих веществ, установленная опытным путем, называется кинетическим уравнением.
В гетерогенных системах скорость реакции относится к единице поверхности и не зависит от концентрации твердой фазы.
2Mg + O2 = 2MgO, u = k×C(O2) – реакция первого порядка.
СаСО3(к) = СаО(к) + СО2, u = k = const – реакция нулевого порядка.
Зависимость скорости реакции от температуры. Энергия активации.
Правило Вант-Гоффа –для большинства химических реакций скорость возрастает примерно в 2¸4 раза при повышении температуры на каждые 10 градусов.
ut =u0×γDt/10, где γ=2¸4 – температурный коэффициент реакции.
При повышении температуры резко возрастает число активных молекул, обладающих достаточной энергией для перегруппировки связей в момент столкновения. Только при столкновении активных молекул происходит перераспределение электронной плотности и образование новых молекул, т.е. столкновения являются эффективными. Этот процесс требует затраты времени и энергии. Любая система в ходе химических превращений переходит из начального состояния в конечное через какое-то промежуточное (переходное) состояние:
[начальное] ¾¾¾¾¾® [переходное] ¾¾¾¾¾® [конечное]
ослабление перераспределение образование новых
химических связей электронной плотности химических связей
Для реакции H2 + I2 = 2HI, путь реакции можно представить следующим образом:
H I H………I H¾I
½ + ½ ¾¾¾¾® MM ¾¾¾¾® +
H I H………I H¾I
активированный комплекс
Переходное состояние системы отвечает образованию так называемого активированного комплекса. В активированном комплексе как бы объединены “полуразрушенные “ молекулы H2, I2 и “полуобразовавшиеся” молекулы HI. Активированный комплекс существует очень короткое время (~10-13 с). Его распад приводит к образованию молекул HI либо молекул H2, I2. Образование активированного комплекса требует определенной затраты энергии, но затраты гораздо меньшей, чем в случае полного разрыва химических связей в исходных молекулах и образования отдельных атомов. Затем при распаде активированного комплекса энергия выделяется. Если выделяется больше, чем было затрачено на образование активированного комплекса, то реакция экзотермическая (DН <0), в противном случае – эндотермическая (DН >0).
Энергия, необходимая для перехода веществ в состояние активированного комплекса, называется энергией активации Еа. Энергия активации – это своеобразный энергетический барьер реакции, который должны преодолеть молекулы, чтобы произошло взаимодействие между ними. Молекулы, обладающие избыточным количеством энергии (по сравнению со средней величиной при данной температуре), достаточным для преодоления энергетического барьера реакции, называются активными. Чем больше активных молекул в реакционной системе, тем выше скорость реакции.
Зависимость скорости реакции от температуры и энергии активации определяется выражением константы скорости реакции:
k = k0×e -Ea/RT (уравнение Аррениуса),
k–константа скорости реакции;
k0 – предэкспоненциальный множитель;
е – основание натурального логарифма;
Ea –постоянная, называемая энергией активацией, определяемая природой реакции.
Влияние катализатора на скорость химической реакции.
Катализ – это ускорение химической реакции веществом катализатором, активно участвующим в промежуточных стадиях реакции, но выходящим из этой реакции химически неизменным.
В зависимости от агрегатного состояния катализатора и реагирующих веществ различают катализ гомогенный и гетерогенный.
В случае гомогенного катализа реагирующие вещества и катализатор представляют гомогенную систему (реагирующие вещества газообразные и катализатор – газ). Реакция получения серного ангидрида:
2SO2 + O2 = 2SO3, катализатор– NO,
1 стадия O2 + 2NO = 2 NO2;
2 стадия SO2 + NO2 = SO3 + NO.
В случае гетерогенного катализа реагирующие вещества и катализатор представляют разные фазы, реакция идет на поверхности катализатора. Реакция получения серного ангидрида:
2SO2 + O2 = 2SO3, катализатор – V2O5 или Pt.
Химическое равновесие.
Химические реакции бывают обратимые и необратимые. Подавляющее большинство химических реакций – обратимые, т.е. начиная протекать в одном направлении, затем идут в обоих направлениях (за счет взаимодействия как исходных веществ, так и продуктов реакции). Обратимые реакции не протекают до конца.
Совершенно необратимых реакций очень мало, например: 2H2O2 = 2H2O + O2 – разложение пероксида водород,
2KClO3 = 2KCl + 3O2 – разложение бертолетовой соли.
Вопросы химического равновесия могут быть рассмотрены только для обратимых реакций. Рассмотрим обратимую реакцию в общем виде:
aA + bB = dD + eE.
Скорость прямой реакции: uпрямой = k1CAaCBb. По мере расходования исходных веществ скорость прямой реакции уменьшается.
Скорость обратной реакции: uобратной = k2CDdCEe. По мере накопления продуктов реакции скорость возрастает. Через некоторое время t скорости прямой и обратной реакций станут равны, что соответствует состоянию химического равновесия.
Концентрации веществ в условиях равновесия (моль/л) называют равновесными концентрациями и обозначают в квадратных скобках.
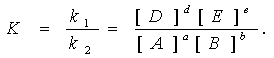 |
В условиях равновесия uпрямой = uобратной, из чего следует, что отношение констант скоростей прямой и обратной реакций есть величина постоянная:
Величину К – называют константой равновесия. Она характеризует глубину протекания реакции. Зависит от природы реагирующих веществ и температуры. Она связана с изменением стандартной энергии Гиббса уравнением:
DG0 = -RTlnK.
Большим отрицательным значениям DG0<0 отвечают большие значения К>1, т.е. прямая реакция протекает в значительной степени и в равновесной смеси преобладают продукты реакции. При больших положительных значениях DG0>0 константа равновесия К<1, что означает, что прямая реакция практически не протекает.
В случае гетерогенных реакций концентрация твердой фазы в выражение константы равновесия не входит.
Для выражения состояния равновесия в реакциях с участием газообразных веществ часто вместо концентраций используют равновесные парциальные давления реагентов:
N2 + 3H2 = 2NH3,
CaCO3(т) = CaO(т) + CO2, K = [CO2].
Смещение равновесия.
Поскольку химическое равновесие подвижное, то при внешних воздействиях (изменении С, р, Т) оно нарушается, концентрация всех веществ в системе будет изменяться до тех пор, пока не установится новое положение равновесия. Если внешнее воздействие убрать, то система возвращается в исходное равновесное состояние.
Принцип Ле-Шателье. Если изменить одно из условий, при которых система находится в равновесии (С, р, Т), то равновесие смещается в сторону протекания той реакции, которая ослабляет воздействие.
Лекция 4. Энергетика химических процессов
Цель лекции: изучение энергетических эффектов, сопровождающие химические процессы, их направление и пределы самопроизвольного протекания реакций.
Энергетические эффекты реакций изучает термохимия (раздел химический термодинамики).
Термохимические расчеты позволяют судить о принципиальной возможности и направленности химического процесса, рассчитывать энергетические балансы технологических процессов.
Тепловой эффект реакции. Внутренняя энергия системы. Энтальпия.
Любая система описывается с помощью параметров:
р - давление,
V – объем,
Т – температура и n (или n) – число молей.
Энергетическое состояние системы можно описать с помощью термодинамических функций состояния (производных от параметров):
U – внутренняя энергия, Н – энтальпия,
G – изобарно-изотермический потенциал или свободная энергия Гиббса, S – энтропия.
Изменение функции состояния при переходе системы из одного состояния в другое не зависит от пути перехода.
Внутренняя энергия системы – это общий запас энергии системы за исключением кинетической энергии системы как целого и потенциальной энергии положения. Она складывается из энергии движения и взаимодействия молекул, энергии движения и взаимодействия ядер и электронов в атомах, молекулах и кристаллах, внутриядерной энергии и т.п.
Химические реакции обычно протекают при постоянном давлении или при постоянном объеме, т.е. являются соответственно изобарными или изохорными процессами
Предположим, что некоторая система за счет поглощения теплоты Q переходит из состояния 1 в состояние 2. В общем случае эта теплота расходуется на изменение внутренней энергии системы DU и на совершение работы против внешних сил: Q = DU + A. Приведенное уравнение выражает закон сохранения энергии (первый закон термодинамики).
Так, если теплота сообщается газу в цилиндре с подвижным поршнем, то газ, во-первых, нагревается, т.е. его внутренняя энергия возрастает, а во-вторых, расширяется и производит работу по подъему поршня.
В химических реакциях под работой против внешних сил в основном подразумевают работу против внешнего давления. В первом приближении (при р=const) она равна произведению давления на изменение объема системы:
A =p(V2 –V1) =pDV.
Тогда тепловой эффект изобарного процесса Qp =DU+pDV:
Qp =(U2 –U1) +p(V2 –V1),
Qp = (U2+pV2) –(U1+pV1)=H2–H1.
Величину Н называют энтальпией. В случае изобарного процесса энергетический эффект реакции равен изменению энтальпии системы:
Qp = DH.
При изохорном процессе (V=const) изменение объема системы не происходит, А=0. Тогда переходу системы из состояния 1 в состояние 2 отвечает равенство: Qv=U2-U1=DU, т.е. энергетический эффект реакции равен изменению внутренней энергии системы.
В экзотермических реакциях теплота выделяется, т.е. внутренняя энергия и энтальпия системы уменьшаются: Q>0, DH<0 (DU<0).
В эндотермических реакциях теплота поглощается, т.е. внутренняя энергия и энтальпия системы возрастают: Q<0, DH>0(DU>0).
Сравнение энергетических эффектов различных процессов проводят для равного количества веществ, обычно 1 моль, и при одинаковых стандартных условиях. Тепловой эффект реакций при стандартных условиях обозначают DH°298.
В справочниках приводятся значения стандартных энтальпий образования различных соединений ΔН°обр. (кДж/моль) – это тепловой эффект реакции образования 1 моля соединения из простых веществ при стандартных условиях. Стандартные энтальпии образования простых веществ равны нулю:
Ca(к) + C(т) + 3/2O2(г) = CaCO3(т),
DH° = DH°обр. CaCO3 = -1207 кДж/моль.
Уравнение химической реакции с указанием теплового эффекта называют термохимическим уравнением.
Закон Гесса.
Тепловой эффект зависит только от состояния исходных и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
Следствия из закона Гесса. Тепловой эффект любой реакции можно рассчитать, зная энтальпии образования или энтальпии сгорания всех веществ реакции:
DH=åniDHобр. продуктов - ånjDHобр. исх. веществкДж/моль;
DH =åniDHсгор. исх.веществ - ånjDH сгор. прод.кДж/моль,
где n – число молей каждого вещества в уравнении реакции (стехиометрические коэффициенты).
Энтальпия сгорания – это тепловой эффект реакции окисления соединения в атмосфере кислорода (О2) с образованием устойчивых оксидов.
Возможность и направленность процесса. Энтропия. Свободная энергия Гиббса.
При любой химической реакции молекулы исходных веществ разрушаются, что требует определенной затраты энергии. При образовании новых веществ энергия выделяется. Очевидно, что самопроизвольное протекание процесса наиболее вероятно в том случае, когда выделяется энергии больше, чем затрачивается, т.е. DH< 0.
Понижение энергии системы назовем энергетическим или энтальпийным фактором. Однако утверждать, что только экзотермические реакции (DH< 0) могут протекать самопроизвольно, нельзя. Среди реакций, протекающих самопроизвольно, действительно большая часть – это экзотермические процессы, но есть также эндотермические (например, испарение воды) и те, у которых тепловой эффект близок к нулю (например, процессы диффузии газов).
Дело в том, что большинство процессов представляют собой два одновременно происходящих явлений – передачу энергии и изменение в упорядоченности расположения частиц относительно друг друга. Вот эту вторую тенденцию - стремление системы к наиболее вероятному состоянию - также необходимо учитывать.
Молекулы газа, жидкости в результате броуновского движения рассеиваются, смешиваются, отталкиваются друг от друга. Причем, процессы диффузии, смешения, рассеивания проходят самопроизвольно, т.е. система стремится перейти из более упорядоченного состояния в менее упорядоченное. Переход же системы в “обратную” сторону, в более упорядоченное состояние, требует затрат энергии, и самопроизвольное протекание подобного процесса менее вероятно.
Количественной мерой вероятности состояния, неупорядоченности, беспорядка является энтропия S. Для всех веществ, в том числе для простых, находящихся в любом агрегатном состоянии S>0.
Энтропия любого вещества при стандартных условиях называется стандартной энтропией - S0298Дж/(моль∙К).
Одно и то же вещество в различных агрегатных состояниях характеризуется различными значениями энтропии S0, причем, по мере увеличения степени беспорядка (т ®ж®г), энтропия возрастает.
Изменение энтропии в ходе реакции можно рассчитать. Энтропия является функцией состояния (так же, как энтальпия), и изменение энтропии в ходе реакции определяется только начальным и конечным состоянием системы и не зависит от пути реакции:
DS =åniS продуктов -ånjSисходных веществ Дж/(моль∙К).
Возрастание энтропии в системе назовем энтропийным фактором. Этот фактор проявляется тем сильнее, чем выше температура. Количественно энтропийный фактор можно оценить произведением TDS.
Итак, в химических процессах одновременно действуют две тенденции: стремление молекул при столкновении прореагировать, объединиться за счет прочных связей в более устойчивые частицы, что уменьшает энтальпию системы, и стремление частиц рассеяться, разъединиться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов – энтальпийного (DН) и энтропийного (ТDS). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение термодинамической функции - энергии Гиббса G (или изобарно-изотермического потенциала):
DG =DH - TDS.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса.
Самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии больше, чем в конечном, т.е. система стремится к минимуму энергии - DG<0.
Увеличение энергии Гиббса - DG>0 - свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях. Возможен обратный процесс.
Если DG=0, система находится в состоянии термодинамического равновесия.
Изменение сводной энергии Гиббса для любого процесса можно рассчитать по закону Гесса:
DG=åniDGобр. продуктов - ånjDGобр.исходных веществ кДж/моль.
При расчете DG0 любой реакции при стандартных условиях пользуются справочными значениями стандартной энергии Гиббса DG0298 образования (кДж/моль) участвующих в реакции веществ.
Влияние температуры. Все термодинамические функции зависят от температуры. Для приближенных расчетов, в пределах температур до 1000°С, этой зависимостью можно пренебречь.
Проанализируем зависимость DG = DH - TDS:
1) DH<0, DS>0, DG<0 - при любой температуре возможен только прямой процесс.
2) DH>0, DS<0, DG>0 - при любой температуре возможен только обратный процесс. Примером именно такой реакции является рассмотренная выше реакция получения пероксида водорода из воды и кислорода (убедитесь в этом сами, рассчитав DHо и DSо).
3) DH>0, DS>0 - поскольку энтальпийный фактор неблагоприятный, то такие реакции при стандартных условиях (низких температурах), как правило невозможны (DG>0)
4) DH<0, DS<0 - энтропийный фактор неблагоприятный, поэтому возможными оказваются те процессы, в которых преобладает энтальпийный фактор, т.е. экзотермические. Это, как правило, реакции с участием конденсированных фаз при низких температурах.
Лекция 5. Растворы
Цель лекции: знать общие свойства растворов, законы Рауля, влияние осмотического давления, концентрации на свойства растворов, степень диссоциации электролитов, уметь рассчитывать концентрации растворов.
Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов).
Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией).
Способность одного вещества растворяться в другом характеризует количественное выражение, называемое растворимостью. Кристаллические вещества подразделяются на:
P- хорошо растворимые (более 1,0 г на 100 г воды);
M- малорастворимые (0,1 г - 1,0 г на 100 г воды);
Н- нерастворимые (менее 0,1 г на 100 г воды).
Чтобы при растворении образовались новые связи, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот.
Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании. Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.
С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Важнейшей характеристикой раствора является концентрация (С) растворенного вещества. Концентрация выражается содержанием растворенного вещества в единице массы или объема раствора или растворителя.
Способы выражения концентрации растворов.
Массовая доля растворённого вещества w (процентная концентрация) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m. Единицы измерения; %:
w= mв-ва/mр-ра..
Молярная концентрация C(М) показывает, сколько моль растворённого вещества содержится в 1 литре раствора:
C(М) = n/V.
Измеряется в моль/л и обозначается "M".
Эквивалентная концентрация СН или нормальность Н раствора– отношение числа эквивалентов растворенного вещества к объему раствора (моль/л):
СН=n/V.
Моляльная концентрация (моляльность) растворенного вещества cm показывает отношение количества растворенного вещества к массе (1 кг) растворителя (моль/кг):
cm=n/m2=m1/M ∙m2,
где n - число молей растворенного вещества;
m1 – масса растворенного вещества;
m2 – масса растворителя;
M – молярная масса растворенного вещества.
Титр Т показывает отношение массы растворенного вещества к объему раствора, (г/мл),
Т= m/ V.
Теория электролитической диссоциации (С.Аррениус, 1887 г.).
При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы - подвергаются электролитической диссоциации. Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N):
α = n/N.
Процесс электролитической диссоциации принято записывать в виде схемы:
CaCl2→Ca2+ + 2Cl-,
HNO3→H+ + NO3-.
Сильные электролиты - это вещества, которые при растворении в воде практически полностью распадаются на ионы. К сильным электролитам относятся вещества с ионными или полярными связями: кислоты - HCl, HBr, HI, HClO4, H2SO4,HNO3 и основания - LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2
Слабые электролиты- вещества, частично диссоциирующие на ионы. К слабым электролитам относятся: почти все органические кислоты -CH3COOH, C2H5COOH и др.; некоторые неорганические кислоты -H2CO3, H2S и др.; почти все малорастворимые в воде соли, основания и гидроксид аммония - Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH; вода.
Неэлектролиты - вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы. Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения -сахароза, бензин, спирт.
Ионное произведение воды
Вода является слабым электролитом и в незначительной степени диссоциирует на ионы по реакции:
H2O →H+ + OH-;
K= ([H+][OH-])/[H2O] = 1,8·10-16 (при 22°С).
В знаменателе дроби - концентрация недиссоциированных молекул воды, которую можно считать постоянной и определить в 1 л, приняв массу 1 л воды за 1000 г:
[H2O]=1000/18 =55,56 молей, тогда
K=([H+][OH-])/55,56=1,8 · 10-16
или ([H+][OH -]=1·10-14 (ионное произведение воды).
Величина pH используется для характеристики кислотности раствора. Если концентрация ионов водорода равна [H+], то pH = -lg [H+]. В чистой воде [H+] = [OH-] = 10-7, рН = 7 среда нейтральная.
В кислых растворах[H+] > [OH-] и pH < 7, например, в 10-3 М растворе HCl pH = 3, среда кислая. В щелочных растворах [H+] < [OH-] и pH > 7, например, в 10-2 М растворе NaOH, pOH = -lg2· 10-2 = 2 - lg2 = 1,7, pH = 14 - pOH = 14 - 1,7 = 12,3, среда щелочная
Гидролиз - это химическая реакция ионного обмена между водой и растворённым в ней веществом с образованием слабого электролита.
Гидролизу подвергаются соли, содержащие в своем составе: анион слабой кислоты; катион слабого основания; анион слабой кислоты и катион слабого основания.
Соли, образованные катионом сильного основания и анионом сильной кислоты, гидролизу не подвергаются.
Степень гидролиза (αгидр.) - отношение числа гидролизованных молекул к общему числу растворённых молекул (выражается в процентах):
αгидр. = (Cгидр./Cраств.) · 100%.
Степень гидролиза зависит от химической природы, образующейся при гидролизе кислоты (основания), и будет тем больше, чем слабее кислота (основание).
Свойства разбавленных растворов неэлектролитов.
Давление пара растворителя над раствором. При данной температуре давление насыщенного пара над любой жидкостью – величина постоянная. При растворении в жидкости нелетучего вещества давление насыщенного пара растворителя уменьшается, так как понижается доля молекул растворителя как во всем объеме, так и на поверхности раздела фаз. Таким образом, давление (упругость) насыщенного пара растворителя надраствором всегда меньше, чем над чистым растворителем.
Закон Рауля: относительное понижение давления насыщенного пара: растворителя над раствором
равно молярной (мольной) доле растворенного вещества,
где ро – давление насыщенного пара растворителя при данной температуре;
р –давление пара растворителя над раствором;
Dр = р0 – р понижение давления насыщенного пара растворителя;
n - число молей растворенного вещества;
N - число молей растворителя.
Присутствие растворенного вещества понижает температуру замерзания и повышает температуру кипения.
Повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов пропорциональны моляльной концентрации растворенного вещества и не зависят от природы вещества.
DТкип=Е × сm,
DTзам=К×сm,
где сm – моляльная концентрация растворенного вещества, (моль/кг растворителя),
DТкип=Tкип.раствора - Ткип. растворителя,
DТзам =Tзам.растворителя – Тзам. раствора.
E, K – эбулиоскопическая и криоскопическая константы, характеризуют свойства растворителя, (кг∙К∙моль-1), их значения для некоторых растворителей приведены в справочниках.
Особенности растворов сильных электролитов.
Чтобы отразить специфику растворов сильных электролитов, вводят понятие активность ионов - а - это условная (эффективная) концентрация ионов, в соответствии с которой они действуют в реальных растворах, a < С,
а =f×С,
где f – коэффициент активности. Он учитывает электростатическое взаимодействие между данным ионом и полем других ионов, f£ 1.
Ионная сила раствора m, учитывающая воздействие поля всех ионов на данный ион, вычисляется по формуле:
где Zi и Ci – заряд истинная концентрация каждого иона в растворе
Произведение растворимости.
Любая соль может растворяться в воде до тех пор, пока не установится равновесие между осадком и раствором, пока не получится насыщенный раствор.
АnBm![]() nAm+ + mBn-.
nAm+ + mBn-.
кристаллизация
Если растворимость соли очень велика, то это равновесие устанавливается только при очень большой концентрации соли. Если растворимость соли мала, то равновесие устанавливается практически всегда и растворимость может быть вычислена по значению константы равновесия. Поскольку система гетерогенная, то выражение константы равновесия имеет вид, приведенный ниже, и называется произведением растворимости:
K=[A+m]n[B-n]m=ПРAnBmAnBm или ПРAnBm=аnA+m×amB-n – произведение активностей.
Лекция 6. Окислительно-восстановительные реакции
Цель лекции: рассмотрение основных закономерностей протекания, особенностей и применение окислительно-восстановительных процессов.
Реакции, протекающие с изменением степеней окисления участвующих в реакции элементов, называются окислительно-восстановительными реакциями (ОВР). Как минимум, два элемента меняют свою степень окисления: один – повышает, другой – понижает. В ходе процесса происходит переход электронов от одних частиц (молекул, атомов, ионов) к другим.
Рассмотрим реакцию:
0¯ -1 0 -1
Cl2+2KI = I2 + 2KCl,
Cl2+2ē=2Cl- - присоединение электронов, восстановление окислителя,
2I- - 2ē = I2 -отдача электронов, окисление восстановителя.
Атомы, молекулы, ионы, принимающие электроны, называют окислителями (окислитель – “грабитель”).
Атомы, молекулы или ионы, которые отдают электроны, называются восстановителями.
По величине стандартного электродного потенциала можно судить об окислительно-восстановительных свойствах систем. Более высокий по своей алгебраической величине потенциал указывает на более высокую окислительную способность окислителя. Более низкий потенциал свидетельствует о более высокой восстановительной способности восстановителя.
Типичные окислители.
Из простых веществ только окислительными свойствами обладают F2 и O2, атомы которых имеют наивысшую электроотрицательность. Сильными окислителями являются также Cl2 и I2, но, в отличие от фтора и кислорода, в некоторых реакциях они могут проявлять и восстановительные свойства. Из соединений только окислительными свойствами обладают те, которые содержат элементы в высших степенях окисления: Mn+7, Cr+6, Bi+5, Pb+4, Fe3+, Sn+4, S+6, N+5, Cl+7.
Типичные восстановители.
Активными восстановительными свойствами обладают металлы, стоящие в ряду напряжений левее водорода (чем левее, тем активнее). Из соединений только восстановительными свойствами обладают те, которые содержат элементы в низших степенях окисления – это соединения, содержащие, например, ионы Cl-, Br-, I-, S2-, азот в степени окисления (-3), кислород в степени окисления(-2).
Соединения, обладающие двойственностью.
Если элемент в составе соединения находится в промежуточной степени окисления (ни высшей, ни низшей), то он может проявлять как окислительные, так и восстановительные свойства. Это зависит от второго участника реакции.
Электрохимические процессы.
1). Процессы превращения энергии химической реакции в электрическую - это процессы, протекающие в гальванических и топливных элементах.
2). Процессы превращения электрической энергии в химическую – это процессы, протекающие при прохождении постоянного тока через раствор или расплав (электролиз).
Понятие об электродном потенциале.
Рассмотрим электродную систему: металлический электрод, погруженный в электролит – раствор соли. При погружении достаточно активных металлов (Zn, Fe и др.) в водный раствор на их поверхности происходит взаимодействие ионов металла с диполями воды. В итоге ионы металла гидратируются и переходят в раствор, а электроны остаются в металле и заряжают пластину металла отрицательно. Ионы металла остаются в прилежащем слое раствора около поверхности металла. В результате образуется двойной электрический слой.
Возникновение двойного электрического слоя на границе Zn – раствор
[ Zn2+ . . .2e] + mH2O = Zn2+×mH2O
кристалл ¯ гидратированный ион,
остаются в кристаллич. решетке,
нескомпенсированный отрицат. заряд
Zn0 – 2e = Zn2+.
По мере увеличения концентрации ионов металла в растворе у его поверхности, выход их из металла уменьшается, а вероятность обратного процесса возрастает. Устанавливается подвижное динамическое равновесие. Возникшая на границе металл-раствор в условиях равновесия разность потенциалов называется равновесным электродным потенциалом системы
Е(Men+/Me). Активные металлы (цинк, железо и др.) продолжают посылать свои ионы даже в концентрированные растворы своих солей и всегда заряжаются отрицательно – их называют электроотрицательными, а скачок потенциала на границе металл-раствор условно считается отрицательной величиной, например:
Zn - 2e = Zn2+, E (Zn2+/Zn) <0.
При погружении малоактивных металлов, например, меди, в раствор своей соли (CuSO4), не ионы меди переходят в раствор, а наоборот, часть катионов из раствора переходит на медный электрод, заряжая его положительно. Раствор же около поверхности металла за счет избытка анионов SO42- имеет избыточный отрицательный заряд. На границе металл-раствор возникает двойной электрический слой. Возникновение двойного электрического слоя на границе Cu – раствор:
Cu2+ + 2e = Cu , E (Cu2+/Cu) >0,
Среди малоактивных металлов особое положение занимает платина, которая никогда, ни при каких условиях не посылает своих ионов в раствор (очень прочная кристаллическая решетка). Наоборот, она может извлекать любые катионы из раствора, а ее кристаллическая решетка служит как бы резервуаром электронов, и на поверхности платины протекают процессы:
Fe3+ + e = Fe2+или Sn2+ -2e = Sn4+.
В этом случае потенциал, возникающий на границе металл-раствор, будет определяться свойствами ионов, участвующих в данном процессе, например, Е (Fe3+/Fe2+) >0, E(Sn4+/Sn2+) >0.
Такие электродные системы называются редокси-электродами (Red – восстановленная форма, Ox - окисленная форма).
Если платину покрыть платиновой чернью (слоем мелкодисперсной платины), то она приобретает свойства растворять и атомизировать газы (водород, кислород). Если платину погрузить в раствор кислоты и насытить газообразным водородом, то на границе раздела пойдет процесс:
2Н++ 2е → Н2, Е(Н+/Н2).
Равновесный потенциал такой системы при стандартных условиях (р=101,3 кПа,Т=298К, активная концентрация ионов водорода в растворе серной кислоты 1 моль/л) принимают условно равным нулю, а саму систему называют стандартным водородным электродом: Е0(Н+/Н2)=0 вольт.
Нормальный или стандартный окислительно-восстановительный потенциал.
Потенциал любой электродной системы, находящейся при стандартных условиях и измеренный относительно стандартного водородного электрода, называется нормальным или стандартным потенциалом, и обозначается ± Е° (Ox/Red), вольт (или j°).
Каждый металл вытесняет из солей другие металлы, находящиеся в ряду напряжений правее него; чем левее в ряду напряжений находится металл, тем он активнее, тем более сильным восстановителем он выступает и тем труднее восстанавливаются его ионы.
Зависимость потенциала от концентрации ионов в растворе. Уравнение Нернста:
R = 8,315 Дж/(К×моль) –газовая постоянная,
F = 96500 Кл - константа Фарадея,
Т- абсолютная температура,
n – число электронов, участвующих в процессе, [Ox] и [Red] – молярные концентрации окисленной и восстановленной форм, моль/л (x и у – коэффициенты в уравнении реакции).
При 25°С (298 К) уравнение Нернста принимает вид:
Гальванический элемент.
Устройство, в котором энергия химической реакции преобразуется в электрическую энергию. Состоит из двух электродных систем. Электроды соединены проводником. Внутренняя цепь замыкается за счет перемещения ионов через пористую перегородку или с помощью электролитического ключа.
На электродах протекают процессы:
(-) Zn - 2e = Zn2+ - отдача электронов, окисление, анод;
(+) Cu2+ + 2e = Cu - прием электронов, восстановление, катод;
Zn + Cu2+ = Zn2++ Cu - cуммарная реакция, энергия которой превращается в электрический ток.
Постоянное протекание процессов на электродах способствует сохранению постоянной разности потенциалов, а следовательно, постоянному переходу электронов с Zn на Cu (электрический ток).
Условная запись гальванического элемента:
(-) Zn½ZnSO4½½CuSO4½Cu (+).
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой элемента (ЭДС):
ЭДС = Ек – Еа.
Топливные элементы.
Это гальванические элементы, в которых реакция горения непосредственно превращается в электрический ток: топливо - Н2, СО, природные и искусственные горючие газы и др.; oкислитель – кислород или воздух (реже фтор и хлор). В топливных элементах, как и в обычных ГЭ, анод, к которому подается восстановитель (топливо) и катод, к которому подается окислитель, разделены ионопроводящим электролитом (кислотами и щелочами, расплавленными солями, твердыми оксидами).
Электроды в случае применения газообразных продуктов делают обычно из полых пористых графитовых трубок и пластин. На электроды наносят катализаторы – платиновые металлы, серебро, никель, кобальт и др. Токообразующий процесс совершается на границе соприкосновения электрода с электролитом.
Водородно-кислородный топливный элемент.
Топливо - Н2, окислитель - О2, электролит – раствор щелочи: Анод: 2H2 + 4OH- - 4e = 4H2O.
Катод: О2 + 2Н2О + 4е = 4ОН-.
Суммарная реакция: 2Н2 + О2 = 2Н2О, энергия которой в данном случае не выделяется в виде тепла, а непосредственно превращается в электрическую.
Высокий коэффициент использования топлива, непрерывность действия, большой температурный диапазон позволяют уже сейчас использовать топливные элементы в спутниках и космических кораблях, а также для военных целей.
Лекция 7. Электролиз и коррозия металлов
Цель лекции: определение и классификация электролиза и коррозионных процессов, ознакомление со способами защиты от коррозии.
Электролиз – совокупность химических процессов, проходящих при протекании постоянного тока через расплав или раствор электролита. При этом энергия электрического тока превращается в энергию химической реакции. Установка для электролиза называется электролизером или электролитической ячейкой (ванной). Внешний источник постоянного тока выполняет роль своеобразного насоса: «нагнетает» электроны на электрод, подключенный к (-) полюсу, и «откачивает» электроны с электрода, подключенного к (+).
Электролиз расплавов
MgCl2¾®Mg2+ + 2Cl-.
Электродные процессы:
(-) Mg2+ + 2e = Mg -окислитель, процесс восстановления, катод;
(+) 2С1- - 2е = С12–восстановитель, процесс окисления, анод.
Перенапряжение электродов.
Для того чтобы процессы протекали с заметной скоростью, необходимо приложить такой потенциал, который обеспечит определенную плотность тока на катоде (jк) и аноде (jа). Чем больше плотность тока, тем больше скорость реакции (до определенного предела). На Pt - электродах при рН=7 будет протекать с заметной скоростью, если потенциал катода сместить в более отрицательную область по отношению к теоретическому (-0,41 вольт), а потенциал анода – в более положительную область по отношению к теоретическому значению (+0,815 вольт). Смещение реального потенциала разряда ионов на данном электроде от теоретического значения называется перенапряжением электрода.
Электролиз водных растворов солей. Соли диссоциируют в растворе на катионы и анионы (кислотные остатки), которые могут участвовать в конкурирующих процессах на катоде и аноде.
Катодные процессы – процессы восстановления, протекают на электроде (-). Из водных растворов солей восстанавливаться могут:
а) катионы металлов, Men+ + ne = Me0¯ - катодный осадок металла;
б) ионы водорода 2Н+ + 2е = Н2↑ (при рН < 7)
2Н2О + 2е = Н2↑ + 2ОН- (при рН ³ 7).
При наложении минимальной разности потенциалов к электродам в первую очередь пойдет процесс, который характеризуется наибольшим потенциалом.
Анодные процессы – процессы окисления, протекают на (+). Из водных растворов солей окисляться могут:
а) анионы соли (бескислородные), 2Cl- - 2e = Cl2, 2I- - 2e = I2, 2Br- - 2e = Br2;
б) ионы кислорода из воды или гидроксильных ионов,
2Н2О –4е =О2↑+4Н+ (рН £ 7),
4ОН- - 4е = О2↑ + 2Н2О (рН > 7);
в) материал анода. Различают аноды нерастворимые (инертные) – угольные и Pt-электроды, и растворимые – металлические электроды, которые при окислении растворяются, например,
Cu – 2e = Cu2+.
На аноде в первую очередь идут те реакции, которые характеризуются наименьшими электродными потенциалами.
Кислородсодержащие анионы NO3-, SO42- и др. при электролизе разбавленных водных растворов не участвуют в анодных процессах, поскольку характеризуются очень высокими потенциалами. Вместо них идет процесс разложения воды с выделением кислорода.
Рассмотрим анодные процессы, протекающие при электролизе раствора NaCl, если анод:
а) из Pt, 2Cl- - 2e = Cl2, E0= +1,36 В, 2Н2О – 4е =О2↑ + 4Н+, E0= +0,815В - будет выделяться кислород;
б) угольный, 2Cl- - 2e = Cl2, E0 = +1,36В – будет выделяться хлор, 2Н2О – 4е = О2↑ + 4Н+, E0 = +1,8В;
в) цинковый (среда нейтральная), 2Cl- - 2e = Cl2, E0 = +1,36В, 2Н2О – 4е = О2 + 4Н+, Е0=+1,8В, Zn – 2e = Zn2+, E0= -0,76В – будет растворяться электрод.
Коррозия и защита металлов.
Коррозия- это самопроизвольный процесс разрушения металлов и сплавов в результате взаимодействия их с окружающей средой. Коррозионные процессы делятся на химическую, электрохимическую и биологическую.
По характеру коррозионных поражений: 1) равномерная;
2) неравномерная;
3) структурно-избирательная;
4) пятнами;
5) язвами;
6) питтинг или точками;
7) межкристаллитная;
8) транскристаллитная или ножевая;
9) подповерхностная.
Химическая коррозия - это самопроизвольное разрушение металлов под
действием окислителей - неэлектролитов, обычно газов и органических жидкостей, не проводящих электрический ток. Газовая коррозия – это разрушение металла при контакте с сухими газами при высоких температурах. Она имеет место при работе двигателей внутреннего сгорания, при химической обработке металлов, горячей прокатке, ковке, в энергетических установках и др. При газовой коррозии происходит химическое взаимодействие металла с активными средами (CO2; H2S; O2; SO2; галогенами). Продуктами коррозии могут быть оксиды, хлориды, сульфиды, например:
4Fe + 3O2→ 2Fe2O3;
2Al + 3Cl2→ 2AlCl3;
4Ag + O2 + H2S → 2Ag2S + 2H2O.
Коррозия в жидкостях - неэлектролитах. К неэлектролитам относятся жидкости органического происхождения - спирт, бензол, хлороформ, керосин, нефть, бензин и др., а также ряд жидкостей неорганического происхождения - расплавленная сера, жидкий бром и др.
Электрохимическая коррозия возникает при соприкосновении металла с электропроводящей средой. Раньше электрохимическую коррозию называли гальванической коррозией, поскольку разрушение металла происходит за счет образования на поверхности металла так называемых гальванических пар (микрогальванических элементов). На аноде происходит окисление и растворение металла по схеме:
(−)А: Me0 - nē → Men+.
Водородная деполяризация сопровождается восстановлением на катодных участках водорода:
1). в кислой среде: (+)К: 2Н+ + 2ē = Н2↑;
2). в нейтральной или щелочной среде: (+)К: Н2О+2ē = Н2↑ + 2ОН−.
Кислородная деполяризация обусловлена восстановлением атмосферного кислорода, растворённого в коррозионной среде, и протекает по схеме:
(+)К: О2↑ + 2Н2О +4ē =4OH−.
Защита металлов от коррозии.
Легирование металлов - один из способов повышения коррозионной стойкости металлов и сплавов путем введения в их состав компонентов, обра-
зующих на поверхности металлов плотные защитные пленки оксидов. К таким
компонентам относятся: хром, никель, кремний, молибден, вольфрам, магний и др. Защитные покрытия создаются на поверхности изделий и сооружений
для защиты от коррозии, окисления, насыщения газами и других вредных воздействий. Металлические покрытия. Для покрытия применяют металлы, образующие на своей поверхности защитные пленки. К таким металлам относятся хром, цинк, никель, алюминий, олово и другие. Катодное покрытие - это покрытие более активного металла менее активным. Примером катодного покрытия может служить железо, покрытое оловом (луженое железо). Анодное покрытие - это покрытие менее активного металла более активным, например, железо - цинком (оцинкованное железо). При нарушении целостности покрытия в образовавшемся гальваническом элементе металл покрытия (цинк) становится анодом и разрушается.
Диффузионная металлизация - это процесс насыщения стали алюминием, хромом и др. с целью упрочнения или придания особых физико-химических свойств поверхностному слою изделия. Наиболее распространенными способами металлизации являются алитирование, хромирование, плакирование и метод окунания. Алитирование - насыщение алюминием поверхности стальных и других металлических изделий. Хромирование - это процесс насыщения поверхности металла хромом. Он аналогичен процессу алитирования, но осуществляется при более высоких температурах (1000 - 10500 С). Метод окунания, или горячий метод, состоит в том, что изделие погружают в расплав металла, температура плавления которого должна быть ниже температуры плавления самого изделия.
Неметаллические покрытия. Лакокрасочные покрытия - это покрытия поверхности изделий лаками, красками, эмалями, олифами, шпаклевками и др. Многие из них термо - и химически стойкие, обладают электроизоляционными свойствами. Покрытия полимерами применяют для защиты от воздействия внешней среды. Они обладают высокими электроизоляционными и механическими свойствами. Гуммирование - покрытие резиной и эбонитом химических аппаратов, трубопроводов, цистерн, ёмкостей для перевозки и хранения химических веществ. Покрытия силикатными эмалями - это стеклообразные вещества, обладающие кислотоупорными и жаростойкими свойствами. Покрытия смазками и пастами. Антикоррозионные смазки готовят на основе минеральных масел (машинного, вазелинового и др.) и воскообразных веществ (парафина, жирных кислот и др.). Защитные пасты готовят из суспензий минерального воска или парафина и каучука в уайт-спирте. Их наносят на поверхность изделия чаще всего распылением.
Химическая защита.
Оксидирование - процесс создания на поверхности металла плотной оксидной пленки. Оксидированию обычно подвергают изделия из железа, стали, алюминия и его сплавов. Фосфатирование - создание на поверхности металла защитной пленки, состоящей из нерастворимых в воде фосфатов железа и марганца. Азотирование - оно основано на образовании в поверхностном слое соединений азота и металла - нитридов металла, повышающих коррозионную устойчивость металлических изделий, твёрдость и износостойкость. Пассивация металлов - это переход металла или сплава в пассивное состояние в результате образования на его поверхности беспористых нерастворимых плёнок (оксидов, гидроксидов и др.). Такие плёнки свободно пропускают электроны, но не пропускают ионы металла в раствор, т.е. резко тормозят процессы окисления и скорость коррозии существенно уменьшается.
Электрохимическая защита.
Протекторная защита состоит в том, что к защищаемой конструкции
присоединяется более активный металл (протектор). Защита внешним током или катодная защита - защита металла от коррозии с помощью постоянного тока от внешнего источника. Защищаемый объект (трубопровод) присоединяется к отрицательному полюсу источника тока, т.е. в качестве катода, а к положительному, аноду - железный лом (или старый рельс), который разрушается, сохраняя тем самым трубопровод
Обработка коррозионной среды.
Это достигается соответствующей обработкой или введением в коррози-
онную среду специальных веществ, так называемых замедлителей (ингибиторов). Агрессивность среды можно уменьшить удалением растворенного в воде кислорода или её подщелачиванием. Механизм действия ингибиторов коррозии в большинстве случаев носит электрохимический характер, т.е. одни ингибиторы замедляют анодный, а другие катодный процесс или одновременно обе стадии процесса.
Лекция 8. Химия элементов и их важнейших соединений.
Цель лекции: рассмотрение химии наиболее применяемых металлов, неметаллов и полупроводников, их общих свойств по группам и семействам.
К металлам относятся s-элементы (кроме H, He), все d-элементы, все f-элементы и р-элементы: Al, Ga, In, Tl, Pb, Sn, Bi, Po.
Все металлы имеют характерные физические свойства, которые связаны с особенностями металлического типа связи. В узлах металлической кристаллической решетки Å ионы, связь между которыми осуществляют делокализованные валентные электроны («электронный газ»).
Все металлы электропроводны, теплопроводны, ковки, пластичны, т.е. смещение слоев друг относительно друга до определенного предела не приводит к разрушению кристаллической решетки. Электропроводность уменьшается с повышением температуры и увеличивается при понижении температуры (сверхпроводимость).
Цвет металлических кристаллов – серый (за исключением Au, Cu). Кристаллы непрозрачные, свободные электроны частично поглощают падающий свет, большую часть – отражают (металлический блеск). Большинство металлов имеют высокие температуры плавления. Низкие температуры плавления имеют: Hg (-390C), Ga (+300C), щелочные металлы.
По периоду ® радиус атома уменьшается, но неодинаково, d-и f-электроны, расположенные во внутренних слоях атомов, экранируют ядро, уменьшают его эффективный положительный заряд и уменьшает влияние ядра на внешний электронный слой, радиус атома меняется незначительно – d- сжатие, f- сжатие (или лантаноидное сжатие).
По группе сверху вниз радиусы атомов увеличиваются. У s-, p-элементов при переходе от периода к периоду радиус увеличивается существенно, максимальное увеличение радиуса атома при переходе от 4 к 5 периоду; практически одинаковые радиусы атомов d-металлов одной подгруппы 5 и 6 периодов. Эти пары элементов особенно близки по химическим свойствам:Zr – Hf, Nb – Ta, Mo –W и т.д.
В зависимости от поведения металлов в магнитном поле различают металлы:
a) диамагнетики - оказывают большее сопротивление магнитным силовым линиям, чем вакуум, выталкиваются из магнитного поля, ориентируются перпендикулярно линиям магнитного поля (Be, Zn, Cu, Hg, Au, Cd, Zr, Ga, Pb и др.);
б) парамагнетики – хорошо проводят магнитные силовые линии, втягиваются в магнитное поле, ориентируются вдоль силовых линий (щелочные и щелочноземельные металлы, большинство d-, f-элементов);
в) ферромагнетики – это парамагнетики, которые сохраняют намагниченность и после ликвидации поля (Fe, Co, Ni, Gd, Dy, сплав Sm-Co). Ферромагнетизм – это свойство особых кристаллических структур (наличие доменов). Ферромагнитные свойства сохраняются лишь до определенной критической температуры (точка Кюри).
Химические свойства. Взаимодействие с неметаллами. При взаимодействии металлов с кислородом образуются оксиды MexOy. При взаимодействии с галогенами – галогениды (AlI3, TiI4, ZrI4,UF6 и др.). При взаимодействии с углеродом – карбиды: MeC (Ti,Nb, W,V,Ta) и Me2C (Nb,V,Ta) - по твердости подобны алмазу, температура плавления >30000С; Me3C (Fe3C –цементит, входит в состав углеродистых сталей) и другие карбиды.
При взаимодействии с азотом – нитриды: MeN (Ti, V, Nb, Ta) – химически устойчивы, нерастворимы в царской водке, температуры плавления выше 25000С, придают металлам твердость, но и хрупкость!
При взаимодействии с серой – сульфиды, например, MoS2 – смазочный материал для поверхностей скольжения при больших нагрузках и повышенных температурах.
Нахождение в природе. Самый распространенный – алюминий – массовая доля 7,5% и железо – 4,8%. Самый редкий – радий - 2×10-10 %.
В свободном состоянии встречаются только малоактивные металлы – Au, Pt, платиноиды Os, Ir, Rh, очень редко – Cu, Hg, Ag. В основном металлы находятся в природе в окисленном состоянии, в виде различных соединений.
Комплексные соединения.
Среди сложных веществ, образованных из трех или более различных атомов, особую группу составляют комплексные соединения. Они образуются из более простых валентнонасыщенных соединений:
Cu(OH)2¯ + 4NH3 = [Cu(NH3)4](OH)2;
FeF3 + 3KF = K3 [FeF6].
Комплексными называют соединения, содержащие сложный комплексный ион (заключен в квадратные скобки), способный к самостоятельному существованию. В центре комплексного иона находится центральный ион (редко атом), который называется комплексообразователем (КО). В данных примерах это Cu2+, Fe3+. Молекулы или отрицательные ионы, тесно связанные с комплексообразователем, называются лигандами (L). В данных примерах это NH3, F-. Число лигандов называют координационным числом (к.ч.).
Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения – комплексный ион. Все остальные ионы составляют внешнюю сферу. Комплексный ион может иметь положительный или отрицательный заряд (может быть катионом или анионом):
[Cu(NH3)4](OH)2
123
внутренняя сфера внешняя сфера.
Комплексный ион можно разрушить, если вывести из сферы равновесия лиганды или комплексообразователь за счет перевода их в малодиссоциирующие соединения (новый комплексный ион или осадок).
Природа химической связи в комплексных соединениях. Связь между комплексным ионом и ионами внешней сферы комплексного соединения носит ионный характер, что подтверждается диссоциацией комплексного соединения по типу сильного электролита. Между лигандами и комплексообразователем в комплексном ионе образуются ковалентые связи по донорно-акцепторному механизму.
Общая характеристика неметаллов. В периодической системе неметаллы в основном располагаются в главных подгруппах IV–VIII групп. Благородные газы в виде простых веществ существуют как одноатомные частицы (Не, Nе, Аr и т. д.). Галогены, азот, кислород, водород как простые вещества существуют в виде газа. У углерода, бора и кремния атомные кристаллические решетки, поэтому они обладают большой твердостью и очень высокими температурами плавления. Эти элементы в виде простых веществ существуют в нескольких аллотропных модификациях, кроме того, они могут существовать в кристаллическом и аморфном состоянии. Например, для углерода хорошо известны такие формы, как алмаз, графит, карбин и поликумулен. Карбин и поликумулен – линейные изомеры, которые были получены искусственным путем. Кристаллические формы углерода (алмаз), кремния и бора обладают большой твердостью, высокими температурами плавления и полупроводниковыми свойствами. Все эти элементы образуют соединения с металлами – карбиды (СаС2,Fе3С), силициды (Мg2Si) и бориды (ТаВ, ТаВ2). Электропроводность бора с повышением температуры значительно увеличивается, что дает возможность широко использовать его в полупроводниковой технике.
Неметаллы, в отличие от металлов, плохо проводят теплоту и электрический ток. Неметаллы характеризуются более высокими значениями энергии ионизации, сродства к электрону и электроотрицательности по сравнению с атомами металлов, и минимально возможным радиусом атома. По мере заполнения наружной электронной оболочки число электронов на внешнем слое у неметаллов растет, а радиус – уменьшается, поэтому они в большей степени стремятся присоединять электроны. Неметаллические свойства элементов определяются способностью атомов «принимать» электроны, т. е. проявлять при взаимодействии с атомами других элементов окислительные свойства. Склонность неметаллов присоединять электроны связана с тем, что на внешнем энергетическом уровне у этих элементов располагается от четырех до семи электронов. Присоединяя недостающие электроны, атомы неметаллов превращаются в отрицательно заряженные одноатомные анионы. Поэтому у неметаллов в свободном состоянии преобладают окислительные свойства, т. е. способность атомов присоединять электроны. Особенно ярко окислительные свойства выражены у атомов неметаллов VI-А и VII-А групп второго и третьего периодов. Самый сильный окислитель – фтор. Он окисляет даже воду и некоторые благородные газы:
2F2 + 2H2O =4HF + O2;
2F2 + Xe = XeF4.
Окислительные свойства неметаллов зависят от численного значения электроотрицательности атома и увеличиваются в следующем порядке:
Si, B, H, P, C, S, I, Br, N, Cl, O, F.
Полупроводниковые материалы. Полупроводниковые свойства обусловлены особым состоянием электронов в кристаллической решетке полупроводников. Каждый атом в кристаллах кремния и германия связан с другим атомом ковалентной связью. Валентные электроны при нагревании или облучении, при приложении разности потенциалов могут уходить в междоузлие решетки в зону проводимости. У атома остается свободная орбиталь – “дырка”. Она может заполняться валентным электроном другого атома и таким образом перемещаться по кристаллу наряду с электронами. При приложенном напряжении электроны движутся к “+”, а дырки – к “-“ источника тока. Электронная проводимость называется n-проводимостью (negative, отрицательный), а дырочная – р-проводимостью (positive, положительный).
Электропроводность полупроводников, в отличие от металлов, увеличивается с повышением температуры.
Полупроводники. Все полупроводниковые материалы делятся на простые полупроводники (ПП) или элементы, полупроводниковые химические соединения и полупроводниковые комплексы. В последнее время также изучаются стеклообразные и жидкие полупроводники. Простых ПП существует около десяти. В современной технике особое значение приобрели кремний, германий и, частично, селен (Se).
Кремний Si. Второй после кислорода элемент по распространенности в природе. В свободном виде не встречается, находится в виде силикатов или алюмосиликатов (солей кремниевой кислоты) – гранит, глина, песок и т.д. Является основой неживой природы. Конечным продуктом выветривания горных пород является песок SiO2. Кремний известен в двух аллотропических модификациях: кристаллической – очень твердые и хрупкие кристаллы темно-серого цвета с металлическим блеском, и аморфной – бурый порошок.
Кремний не образует ни положительных, ни отрицательных ионов, хотя имеет степени окисления (+4) SiO2 и (-4) SiH4. Это достаточно активный элемент. Кремний не растворяется в большинстве кислот, кроме смеси HF и HNO3:
Si + 4HNO3 + 6HF = H2SiF6 + 4NO2 + 4H2O.
SiO2 – основа строительных материалов –стекло, цемент, керамика. Феррокремний (сплав с железом) используют в металлургии для связывания кислорода в сплавах. Кремний особой чистоты – в полупроводниковой технике.
Германий Ge. В природе очень рассеян, добывается из зол некоторых углей, отходов коксохимического производства. По своим свойствам похож на кремний, но отличается меньшим значением ЭО, т.е. более металлическими свойствами. В своих соединениях имеет степени окисления (+2), (+4) и очень редко (-4).
Список литературы
1. Коровин Н.В., Масленникова Г.Н., Мингулина Э.И., Филиппов Э.Л. Общая химия. – М.: Высшая школа, 2005.
2. Харин А.Н., Катаева Н.А., Харина Л.Г. Курс химии. – М.: Высшая школа,1983.
3. Глинка Н.Л. Общая химия. – Л.: Химия, 2002.
4. Некрасов Б.В. Основы общей химии. – М.: Химия, 2004 (т.1,2)
5. Богатиков А.Н., Красицкий В.А., Лапко К.Н. Сборник задач, вопросов и упражнений по общей и неорганической химии. – Минск: Электронная книга БГУ, 2002.
6. Задачи и упражнения по общей химии. Под.ред. Коровина Н.В. – М.: Высшая школа, 2004.
7. Ахметов Н.С. Общая и неорганическая химия.- М.: Высшая школа, 2008.
8. Лебедева М.И., Анкудимова И.А. Сборник задач и упражнений по химии с решением типовых и усложненных задач. – М.: Машиностроение, 2002.
Содержание
|
Введение Лекция 1. Основные законы и понятия химии Лекция 2.Строение вещества. Химическая связь Лекция 3.Скорость химических реакций Лекция 4. Энергетика химических процессов Лекция 5. Растворы Лекция 6. Окислительно-восстановительные реакции Лекция 7. Электролиз и коррозия металлов Лекция 8. Химия элементов и их важнейшие соединения |
1 2 5 10 14 18 22 26 30 |