Коммерциялық емес акционерлік қоғам
АЛМАТЫ ЭНЕРГЕТИКА және БАЙЛАНЫС УНИВЕРСИТЕТІ
Би Джи кафедрасы
ХИМИЯ
5В074600 – «Ғарыштық техника және технологиялар»
мамандығының
студенттері үшін
есеп-сызба жұмыстарын орындауға
арналған әдістемелік нұсқаулар
Алматы 2013
ҚҰРАСТЫРҒАНДАР: Каленова Ж.А., Колдасова Г.А. Химия: 5В074600 – «Ғарыштық техника және технологиялар» мамандығының студенттері үшін есеп-сызба жұмыстарын орындауға арналған әдістемелік нұсқаулар. – Алматы: АЭжБУ, 2013 – 30 б.
Химиядан ЕСЖ арналған осы әдістемелік нұсқау 5В074600 – «Ғарыштық техника және технологиялар» мамандығы бойынша бакалавриатта оқитын 1-курс студенттері үшін «Химия» курсы бойынша өзіндік жұмыстарға арналған тапсырмалардан тұрады.
Әдебиет көр. – 10 атау.
Пікір беруші: ИК кафедрасының профессоры Ибраева Л.К.
«Алматы энергетика және байланыс университетінің» КЕАҚ 2013 ж. жоспары бойынша басылады.
![]() © «Алматы
энергетика және байланыс университеті» КЕАҚ,
2013 ж.
© «Алматы
энергетика және байланыс университеті» КЕАҚ,
2013 ж.
Кіріспе
Қазіргі өмірде, әсіресе адамның өндірістік қызметінде химия тек қана маңызды қызмет атқарады. Химияны қолданусыз бірде бір өндіріс саласы жоқ. Бізге табиғат тек бастапқы өнімді – ағаш, руда, мұнай және т.б. береді. Табиғи материалдарды химиялық өңдеуде пайдаланғанда ауыл- шаруашылығына, өнеркәсіптік бұйымдарын дайындауға, үй шаруашылығына арналған тыңайытқыштар, металдар, пластикалық массалар, дәрі-дәрмектер, жанармай материалдары т.б. қажетті әртүрлі заттар алады. Табиғи өнімді химиялық өңдеу үшін заттардың түрленуінің жалпы заңдарын білу қажет, ал мұндай білімді химия береді.
Осы тапсырмалар химияны 3 кредит көлемінде оқитын «Ғарыштық техника және технологиялар» мамандығының 1- курс студенттеріне арналған, яғни әр студент белгіленген мерзімде 3 ЕСЖ әрқайсысын жеке-жеке орындап, тапсырады. Жұмыстар ҚР 10352-1910-У-е-001-2002 ФС АЭжБУ «Оқу жұмыстары» фирмалық стандартының талаптарына сәйкес жасалады.
Тапсырмалар теорияның, заңдарының, процестерінің, қасиеттерінің, заттардың және химиялық реакцияның жүру шартының түсініктемелерін, сондай-ақ реакция теңдеулерін және химиялық формуланы құрастыра алуды қарастырады.
Әр студент тапсырма нұсқасын оқытушының келісімімен (журналдағы тізім бойынша да болады) орындайды.
Бірінші өзіндік жұмыстың (есеп-сызба жұмысының) тапсырмалары келесі тақырыптардан тұрады: «Химияның негізгі заңдары мен түсініктері», «Эквиваленттер заңы бойынша есептеулер», «Атомдар құрылысы»,
«Д.И. Менделеевтің периодтық заңы мен элементтердің периодтық жүйесі», «Ядролық реакциялар. Радиоактивтілік».
Екінші өзіндік жұмыстың тапсырмалары келесі тақырыптардан тұрады: «Химиялық байланыс», «Термохимия. Термохимия заңдары», «Химиялық реакциялардың жылдамдығы», «Химиялық тепе-теңдік. Химиялық тепе-теңдіктің ығысуы».
Үшінші өзіндік жұмыстың тапсырмалары келесі тақырыптардан тұрады: «Ерітінділердің физика-химиялық қасиеттері», «Судың иондық туындысы. Сутектік көрсеткіш. Тұздар гидролизі», «Тотығу-тотықсыздану реакциялары», «Электродтық потенциалдар. Гальваникалық элемент», «Электролиз».
1 №1 есеп-сызба жұмысы. Негізгі заңдар және атом құрылысы
№1 ЕСЖ мақсаты атом, молекула, моль, эквивалент және т.б. сияқты фундаментальды түсініктерді қарастыру, қосылыстардың физикалық және химиялық қасиеттерін оқып үйрену, химиялық теңдеу бойынша, химияның негізгі түсініктері мен заңдары бойынша, сонымен қатар атомдық ядро мен атом құрылысы бойынша, химиялық элементтердің периодтық жүйесі бойынша және молекула құрылысы бойынша есептеуді білу болып табылады. [Әдеб. – 1,3,6,9,10].
Химияның негізгі заңдары мен түсініктері
Мысал: массасы 6,4 г болатын бромдағы Br2 молекула санын есептеңдіз.
Шешуі: бромның молярлық массасы ![]() екендігін ескере отырып, Br2- дегі заттың санын
формула бойынша есептейді:
екендігін ескере отырып, Br2- дегі заттың санын
формула бойынша есептейді:
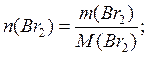
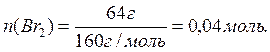
Заттағы молекула (құрылымдық бірлік) санын есептейді:
![]()
![]()
1. Келесі заттардың мольдік массасы қандай: HNO3, Al(OH)3, Cr2O3, K2CO3? Әрбір 200 г заттың құрамындағы моль санын анықтаңыз.
2. Келесі заттардың мольдік массасы қандай: FeSO4, K2SO4, Na3PO4, NaCl? Әрбір 200 г заттың құрамындағы моль санын анықтаңыз.
3. а) 6,02·1024 метан молекулаларын; б) 1,8·1028 хлор атомдарын;
в) 3,01·1023 көміртегі диоксидінің молекулаларын мольмен өрнектеңіз.
4. а) 30,1·1025 фосфин молекулаларын; б) 19,6 г күкірт қышқылын;
в) 1,5·1023 көміртегі диоксидінің молекулаларын мольмен өрнектеңіз.
5. Массасы 2 г аммиак пен көміртегі диоксидінің құрамындағы молекулалар санын салыстырыңыз.
6. Көлемі 2 см3 (қ. ж.) сутегіде қанша молекула бар?
7. Массасы 1,0 г сутегінің, метанның, көміртегі (ІІ) оксидінің, азот (ІІ) оксидінің және оттегінің (қ. ж.) көлемін анықтаңыз.
8. Көлемі 1 м3 (қ. ж.) кез келген газда қанша молекула бар?
9. Сәйкесінше, массалары 56, 640, 110, 70 г тең, азот, оттегі, көміртегі (IV) оксиді, көміртегі (IІ) оксиді газдары (қ. ж.) қанша көлемді құрайды?
10. Егер температурасы 91°С және қысымы 98642 Па кезінде газ көлемі 608 см3 болғандағы газдың (қ. ж.) көлемін есептеңіз.
11. Температурасы 25°С және қысымы 85312 Па кезінде газ көлемі
820 см3 тең. Газдың (қ. ж.) көлемін есептеңіз.
12. Егер температурасы 15°С және қысымы 95976 Па кезінде газ көлемі 912 см3 болғандағы газдың (қ. ж.) көлемін есептеңіз.
13. Температурасы 91°С және қысымы 98,7 кПа кезінде кейбір газ көлемі 0,4 дм3 тең. Газдың (қ. ж.) көлемін есептеңіз.
14. Температурасы 7°С кезінде жабық ыдыстағы газдың қысымы
96,0 кПа-ға тең. Егер ыдысты -33°С дейін салқындатса, қысымы қандай болады?
15. Егер температурасы 0°С және қысымы 93,3 кПа болғанда қ. ж. көлемі 773 см3 тең болса, ауаның көлемі қандай болады?
Эквивалент заңы бойынша есептеулер
Мысал: массасы 4,14 г металды өртеген кезде оның 4,46 г оксиді алынды. Егер оттектің эквиваленті 8-ге тең болса, металдың эквивалентін анықтаңыз.
Шешуі: металдың тотығуына жұмсалған оттектің массасын табамыз:
![]()
Эквиваленттер заңына сәйкес:
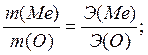
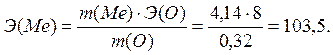
16. а) гидрофосфаттың; б) дигидрофосфаттың; в) ортофосфаттың түзілу реакциясындағы фосфор қышқылының эквивалентін және эквиваленттік массасын есептеңіз.
17. H2S, P2O5, CO2 қосылыстарындағы күкірттің, фосфордың және көміртегінің эквиваленттік массаларын анықтаңыз.
18. Калий гидроксидінің артық мөлшері мына ерітінділерге әсер етті:
а) калий дигидрофосфаты; б) висмут (ІІІ) дигидроксонитраты. Осы заттардың калий гидроксидімен реакция теңдеуін жазыңыз және олардың эквиваленті мен эквиваленттік массаларын анықтаңыз.
19. Келесі темір қосылыстары: а) темір дигидроксохлориді; б) темір гидроксодихлориді; в) темір трихлориді түзілетін темір (ІІІ) гидроксидінің хлорлысутек (тұз) қышқылымен реакция теңдеуін жазыңыз. Келтірілген әр реакциядағы темір (ІІІ) гидроксидінің эквиваленті мен эквиваленттік массасын есептеңіз.
20. а) сульфаттың; б) гидросульфаттың түзілу реакциясындағы күкірт қышқылының эквиваленттік массасын есептеңіз.
21. Оттегінің, сутегінің және хлордың (қ. ж.) эквиваленттік көлемі нешеге тең?
22. Егер эквиваленттік массасы 12 г/мольге тең, массасы 24 г магниймен массасы 98 г H2SO4 әрекеттескені белгілі болғандағы күкірт қышқылының эквиваленттік массасын анықтаңыз.
23. Массасы 4,8 г магний жанғанда, массасы 8,0 г оксид түзілді. Магнийдің эквиваленттік массасын анықтаңыз.
24. Массасы 2,20 г металл сутегімен әрекеттескенде, массасы 2,52 г гидрид түзілді. Металдың эквиваленттік массасын анықтаңыз және гидридтің формуласын жазыңыз.
25. Массасы 0,44 г металл реакциясына эквиваленттік массасы 79,9 г/мольге тең, массасы 3,91 г бром қажет болды. Металдың эквиваленттік массасын анықтаңыз.
26. Массасы 1,25 г металдан массасы 5,22 г нитрат алынады. Осы металдың эквиваленттік массасын есептеңіз.
27. Егер массасы 10,1 г алюминий жанған кезде, массасы 18,9 г оксид түзіледі, алюминийдің эквиваленттік массасын есептеңіз.
28. Массасы 0,464 г металл оксиді ыдырағанда, массасы 0,432 г металл алынды. Металдың эквиваленттік массасын анықтаңыз.
29. Массасы 3,08 г гидроксидін бейтараптауға массасы 3,04 г хлорлысутек қышқылы жұмсалды. Гидроксидтің эквиваленттік массасын есептеңіз.
30. Массасы 14,7 г ортофосфор қышқылын бейтараптауға массасы 12,0 г NaОH жұмсалды. Ортофосфор қышқылының эквиваленттік массасы мен негізділігін есептеңіз. Сәйкес келетін реакция теңдеуін жазыңыз.
Атомдар құрылысы
Мысал: табиғи литий тұрақты ![]() Li (7,3%) және
Li (7,3%) және ![]() Li (92,7%) екі изотоптан тұрады. Литийдің
атомдық массасын осы мәліметтерден есептеңіз.
Li (92,7%) екі изотоптан тұрады. Литийдің
атомдық массасын осы мәліметтерден есептеңіз.
Шешуі:
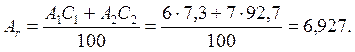
31. Берілген энергетикалық деңгейдегі энергетикалық деңгейшелер саны қаншаға тең? Егер энергетикалық деңгейде 4 деңгейшесі болса, оның бас квант саны қандай мәнмен сипатталады? Олардың әріптік белгіленуін көрсетіңіз.
32. Реттік нөмірлері 12, 13, 23 болатын элементтер атомындағы сыртқы электрондардың n және l квант санының мәндерін көрсетіңіз.
33. Реттік нөмірлері 18, 63 болатын атомдардың электрондық және электронды-сызбалық формулаларын жазыңыз. Олар электрондық түрдің қайсысына жатады?
34. Реттік нөмірлері 27, 83 болатын атомдардың электрондық және электронды-сызбалық формулаларын жазыңыз. Осы элементтер атомында қанша бос f-орбитальдары бар?
35. Алюминий атомындағы электрондар күйін сипаттайтын n, l, ml және ms квант сандары қандай мәндерді қабылдайды.
36. s-, p-, d-, f- деңгейшелеріндегі электрондардың максимал саны қанша болады? Реттік нөмірі 51 болатын атомның электрондық және электронды-сызбалық формулаларын жазыңыз.
37. К, L, M, N, O, P деңгейлерінде электрондардың максимал саны қанша болуы мүмкін? Квант саны дегеніміз не?
38. Кейбір элементтер атомдарының сыртқы энергетикалық деңгейіндегі электрондардың квант сандары келесі мәндерден тұрады: n = 5, l = 0, ml = 0, ms = +1/2. Осы элемент атомында қанша бос 4d-орбитальдары бар? Осы атомның электрондық және электронды-сызбалық формулаларын жазыңыз.
39. Бас квант саны 3 және 4-ке тең электрондардың l, ml, ms квант сандарының мәнін жазыңыз.
40. а) электрондармен толтыру 3d-орбиталінде бітетін;
б) электрондармен толтыру 4s-орбиталінде бітетін; в) электрондармен толтыру 4p-орбиталінде басталатын; г) электрондармен толтыру 4f-орбиталінде басталатын элементтің реттік нөмірін көрсетіңіз.
41. Қозған күйдегі атомдар: а) күкірттің; б) хлордың; в) фосфордың;
г) ванадийдің қанша бос 3d-орбитальдары бар?
42. Реттік нөмірлері 10, 15, 33 болатын элементтер атомындағы сыртқы электрондардың n және l квант санының мәндерін көрсетіңіз.
43. Қозбаған күйдегі атомдар: а) магнийдің; б) алюминийдің;
в) көміртегінің; г) бордың; д) күкірттің қанша жұптаспаған электрондары бар?
44. Реттік нөмірлері 39 және 41 болатын элемент атомдарының электрондық және электронды-сызбалық формулаларын жазыңыз. Осы элементтер атомында қанша бос d-орбитальдары бар?
45. Бірінші элементте 4s-электронның біреуі 3d-деңгейшесіне «құлауын» ескере отырып, реттік нөмірлері 24 және 33 болатын элемент атомының электрондық және электронды-сызбалық формулаларын жазыңыз. Бірінші атомның d-электронының және екінші элемент атомының p-электронының максимальды спині нешеге тең?
Д.И. Менделеевтің периодтық заңы мен элементтердің периодтық жүйесі
Мысал: қандай элементтің – натрий немесе цезий – металдық қасиеті айқындау байқалады?
Шешуі: натрий мен цезий атомының электрондық қауыз құрылысы мына төмендегідей жазады:
11Na 1s2 2s2 2p6 3s1 немесе [Ne] 3s1;
55Cs 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s1 немесе [Xe] 6s1.
Екі элементтің де сыртқы энергетикалық деңгейінде бір электроннан бар. Бірақ та цезий атомының сыртқы энергетикалық деңгейіндегі электрон ядродан алыстау орналасқан (цезийде алтыншы энергетикалық деңгейде, ал натрийде – үшіншіде). Ендеше, электрон (цезийден) жеңіл бөлінеді. Металдық қасиет электронды беру қабілеттілігімен байланысты болғандықтан, ол цезийде айқындау байқалады.
46. Периодтық заңның қазіргі тұжырымын беріңіз. Оның
Д. И. Менделееев берген тұжырымнан айырмашылығы неде? Периодтағы реттік нөмірдің жоғарлауымен атомдық радиустың төмендеуінің және топтағы реттік нөмірдің жоғарлауымен атомдық радиустың жоғарлауының жалпы үрдісін немен түсіндіруге болады?
47. Не себептен периодтық жүйеде фосфор мен ванадий бір топта орналасқан? Неге оларды әртүрлі топшаларға орналастырады?
48. Атом құрылысы туралы оқып үйрену химиялық элементтердің қасиетінің өзгеруіндегі периодтылықты қалай түсіндіреді? Не себептен периодтық жүйеде хром мен күкірт бір топта орналасқан? Неге оларды әртүрлі топшаларға орналастырады?
49. Реттік нөмірдің физикалық мәні қандай және неге элементтің химиялық қасиеті ақырында оның атомының ядро зарядымен анықталады? Элементтердің қайсы қатары атомдық радиусының өсуі бойынша орналасқан: а) Na, Mg, Al, Si; б) C, N, O, F; в) O, S, Sc, Fe; г) I, Br, Cl, F?
50. Периодтық жүйенің құрылымы қандай? Периодтар, топтар және топшалар. Топ және период нөмірлерінің физикалық мағынасы.
51. Период нөмірі қандай квант санының мәніне сәйкес келеді? Атом құрылысы туралы оқып үйренуден периодқа анықтама беріңіз. а) F және Cl;
б) N және P атомдарының ұқсастығы мен өзгешелігі неде?
52. Периодтық жүйедегі периодтардың қайсысы кіші, қайсысы үлкен деп аталады? Олардың әрқайсысындағы элементтер саны немен анықталады? Әр периодтағы элементтер санын біле отырып, периодтық жүйедегі элемент орнын және реттік нөмірлері 35, 42, 56 бойынша негізгі химиялық қасиетін анықтаңыз.
53. Асыл газдар периодтық жүйенің қай жерінде орналасқан? Неге бұрын олар нөлдік топты құраған және оларды қалай атаған?
54. Неліктен сутегіні периодтық жүйенің I және VII топтарына орналастырған? Осы екі жағдайға қандай түсініктеме беруге болады?
55. Период пен топ бойынша негізгі топша элементтерінің қасиеті қалай өзгереді? Бұл өзгерістердің себебі неде?
56. Электрондардың «құлауы» қандай элементтердің атомында жүзеге асады? Бұл әсердің себебін түсіндіріңіз.
57. Қалыпты жағдайда бос күйінде тек 11 химиялық элемент газ және бос күйінде 2 элемент сұйық болып табылады. Осы элементтердің аталуын және символын көрсетіңіз.
58. Екі элемент атомындағы валенттік электрондар конфигурациясы мына формулалар бойынша өрнектеледі: а) 3s23p2 және 4s23d2; б) 4s23d3 және 4s23d104p3. Бұл элементтер қайсы периодтарда және топтарда орналасқан? Олар валенттік электрондар саны бірдей бола тұра, өз қасиеттері бойынша ерекшеленуі керек пе?
59. Әр периодтағы элементтер санын біле отырып, периодтық жүйедегі элемент орнын және реттік нөмірлері 17, 24 және 38 бойынша негізгі химиялық қасиетін анықтаңыз.
60. Д. И. Менделеев өз тұжырымына сүйене отырып, жүйеде теллурды йодтың алдына қойған, ал кобальтты никельдің алдына қойған. Осыны түсіндіріңіз.
Ядролық реакциялар. Радиоактивтілік
Мысал: фосфордың ![]() Р изотопы позитронды шығарған
кезде қандай элемент түзіледі? Осының ядролық
реакциясын жазыңыз.
Р изотопы позитронды шығарған
кезде қандай элемент түзіледі? Осының ядролық
реакциясын жазыңыз.
Шешуі: позитронда бірліктік оң заряд β+ болатындықтан, ондағы ыдырау процесінде бастапқы изотоптан (15 – 1 = 14) гөрі, бір бірлікке кем заряды бар элемент түзіледі. Ол кремнийдің изотопы. Оның массасы өзгеріссіз қалады.
Ядролық реакция келесі теңдеумен өрнектелді:
![]() Р =
Р = ![]() Si + β+.
Si + β+.
61. Қандай реакциялар ядролық деп аталады? Олардың химиялық реакциядан ерекшелігі неде? Ядролық реакция бірінші рет кіммен және қашан жасалды?
62. Сутегінің үш изотобын атаңыз. Олардың ядроларының құрамын көрсетіңіз. Ауыр су дегеніміз не? Ол қалай алынады және оның қасиеті қандай?
63. Массаның сақталу заңының шектелуі немен көрсетіледі? Ядролық реакцияға қандай заңды бұзбай қолдануға болады?
64. Табиғи кремний үш изотоптан тұрады: 28Si, 29Si, 30Si, пайыздық массалық үлестері, сәйкесінше, 0,923; 0,047; 0,030. Табиғи кремнийдің атомдық массасын есептеңіз.
65. Табиғи хлор екі изотоптан тұрады: 35Cl және 37Cl. Хлордың салыстырмалы атомдық массасы 35,5-ке тең. Пайыздық массалық үлес бойынша хлор изотоптарының құрамын анықтаңыз.
66. 10B және 11B изотоптан тұратын, массалық үлесі, сәйкесінше, 19,6% және 80,4% -ға тең бордың атомдық массасын анықтаңыз.
67. Изотоптар мен изобарлар дегеніміз не? Көптеген элементтердің атомдық массасы бөлшек сандармен өрнектелетіні немен түсіндіріледі?
68. Табиғи неон изотоптардан тұрады: 20Ne және 22Ne массалық үлесі, сәйкесінше, 90% және 10%. Неонның атомдық массасын есептеңіз.
69. ![]() B нейтронымен бор атомының ядросын бомбалау кезінде, литий
B нейтронымен бор атомының ядросын бомбалау кезінде, литий
![]() Li изотопы алынды. Аралық ядро мен тасталған
бөлшекті анықтаңыз. Реакция теңдеуін жазыңыз.
Li изотопы алынды. Аралық ядро мен тасталған
бөлшекті анықтаңыз. Реакция теңдеуін жазыңыз.
70. Кейбір бөлшектермен неон ![]() Ne изотопын бомбалау нәтижесінде фтор
және α-бөлшек
түзіледі. Бомбалаушы бөлшекті анықтаңыз.
Ne изотопын бомбалау нәтижесінде фтор
және α-бөлшек
түзіледі. Бомбалаушы бөлшекті анықтаңыз.
71. 24Mg-ге α-бөлшектің қозғалысы кезінде, электрон және басқа элементтің тұрақсыз изотопы түзіледі. Осы ядролық реакция теңдеуін құрастырыңыз және оның қысқартылған түрін жазыңыз.
72. Ядролық реакцияның қысқартылған
теңдеуіне қарап, оның толық теңдеуін
жазыңыз: а) ![]() Сu
(p, n)
Сu
(p, n) ![]() Zn; б)
Zn; б) ![]() Mo (n, ē)
Mo (n, ē) ![]() Tc; в) 27Al (p, α) 24Mg;
Tc; в) 27Al (p, α) 24Mg;
г) 59Co (n, α) 56Mn.
73. Протондармен: а) ![]() Ne изотоптың ядросын бомбалау кезінде α-бөлшектер; б)
Ne изотоптың ядросын бомбалау кезінде α-бөлшектер; б) ![]() Cu изотоптың ядросын бомбалау кезінде нейтрондар
түзіледі. Осының нәтижесінде қандай
элементтердің және қандай изотоптары түзілді?
Cu изотоптың ядросын бомбалау кезінде нейтрондар
түзіледі. Осының нәтижесінде қандай
элементтердің және қандай изотоптары түзілді?
74. Егер нәтижесінде қорғасын ![]() Pb изотопы түзілетін болса, радон
атомының ядросы қанша α-бөлшектерді
жоғалтады?
Pb изотопы түзілетін болса, радон
атомының ядросы қанша α-бөлшектерді
жоғалтады?
75. Мына атомдар ядросының α-ыдырауы
кезінде қандай элементтер түзіледі: ![]() B;
B; ![]() Si;
Si; ![]() Po?
Po?
Сұрақтар
1. Химиялық формула нені көрсетеді? Формула бойынша қандай есептеулер жүргізуге болады?
2. Авогадро саны нені көрсетеді?
3. Зат массасының сақталу заңының тәжірибелік мәні неде?
4. «Эквивалент» түсінігіне анықтама беріңіз. Мысалдар келтіріңіз.
5. Атомдық ядро қандай элементарлы бөлшектерден тұрады?
6. Элементтің реттік нөмірінің, оның массалық санынан өзгешелігі неде?
7. Ядроның бөлінуінің, оның радиоактивті ыдырауынан айырмашылығы неде?
8. Спин квант саны нені сипаттайды?
9. Бір периодта орналасқан элементтер немен ортақтасады?
10. Бір топтың әртүрлі топшасында орналасқан элементтердің ұқсастығы мен айырмашылығы неде?
2 №2 есеп-сызба жұмысы. Термохимия және кинетика
Бұл есептерді шығарудың мақсаты: химиялық және физика-химиялық процестердің бағыты мен мүмкіндігін оқып үйрену, энергия шығындарын және энергетикалық эффектісін есептеуді, реакция өнімін алу жылдамдығы мен шығынын есептеуді, химиялық процестердің жылдамдығына әсер етуді білу, сонымен қатар сол және басқа құрылғылардағы, қондырғылардағы және аспаптардағы қажетсіз реакциялар туралы ескерту. [әдеб. – 1,2,4-10].
Химиялық байланыс
Мысал: неліктен көміртек көп жағдайда төрт валентті?
Шешуі: қоздырылмаған (негізгі) күйдегі көміртекте электрондар сыртқы деңгейдегі орбитальдар бойынша тарала орналасады:

6С 2p2
2s2
Бұған сәйкес көміртек екі валентті, өйткені ең қарапайым жағдайдағы валенттілік жұптаспаған электрондар санымен анықталынады. Бірақ көміртек атомында бос бір 2р-орбиталь бар, оған салыстырмалы түрдегі өте аз энергия жұмсалғанда бір 2s-электрон ауысады. Нәтижеде жұптаспаған электрондар саны төртке дейін артады (жетеді):

6С* 2p3
2s1
Электронның 2р-орбитальға ауысуы үшін жұмсалатын энергиясы, қосымша екі байланыс пайда болған тұстағы бөлінетін энергиямен теңестіріледі.
1. Мына байланыстардың ішінде Сa – H, C – Cl, Br – Cl қайсысы ең полярлы және неге?
2. Неге фосфордың максимальды коваленттілігі 5-ке тең, ал азоттың мұндай валенттік күйі жоқ? Түсіндіріңіз.
3. Салыстырмалы электртерістілік мәнін пайдалана отырып, молекулалардағы байланыстың иондық дәрежесін анықтаңыз: а) CH4, CCl4, CO2; б) NH3, NO, Mg3N2; в) LiCl, LiI, Li2O; г) HF, HCl, HBr; д) SO2, SeO2, TeO2.
4. Мына байланыстардың ішінде K – S, H – S, Br – S, C – S қайсысы ең полярлы және неге?
5. H2O, NaH, HI, CH4 молекуласындағы электрондық тығыздық қай атомға қарай ығысады?
6. Қандай коваленттік байланыс полярлы деп аталады? Коваленттік байланыстың полярлығының сандық өлшемі ретінде не қызмет етеді? Мысал келтіріңіз. Қандай химиялық байланысты сутектік деп атайды? Ол қандай заттардың молекулаларының арасында түзіледі? Мысал келтіріңіз.
7. Қандай кристалдық құрылымдар иондық, атомдық, молекулалық және металдық деп аталады? Айтылған құрылымдар қай заттардың кристалында бар: алмаз, натрий хлориді, көміртегі диоксиді, мырыш?
8. Қандай химиялық байланысты иондық деп атайды? Оның түзілу механизмі қандай? Иондық байланыстың қандай қасиеті коваленттік байланыстан өзгеше етіп тұр? Типтік иондық қосылыстарға мысал келтіріңіз.
9. Молекулалық әрекеттесудің қандай күштерін бағытталушы, индукциялық және дисперсиялық деп атайды? Бұл күштер қай кезде пайда болады және олардың табиғаты қандай?
10. Жалпы атомдар немесе атомдық орбитальдар электронының
қандай күйін валенттік деп атайды? Оттегі және
күкірт, фтор және хлор атомдары үшін қанша валенттік күй
мүмкін? Коваленттік байланыстың түзілуінің қандай
тәсілі донорлы-акцепторлы деп аталады?
NH![]() және
BF
және
BF![]() иондарында қандай химиялық
байланыстар бар? Донор мен акцепторды көрсетіңіз.
иондарында қандай химиялық
байланыстар бар? Донор мен акцепторды көрсетіңіз.
11. Этилен мен ацетилен молекуласындағы байланыс энергиясы, сәйкесінше, 383,2 және 433,7 кДж/мольге тең. Қайсы молекуладағы байланыс өте мықты?
12. Бор хлориді мен аммиак молекуласының кеңістіктегі әртүрлі құрылымының себебі неде?
13. Қандай химиялық байланысты коваленттік деп атайды? Оның негізгі қасиеттерін сипаттаңыз. Неге коваленттік байланыс түзілу кезінде атомдар арасындағы арақашықтық дәлме-дәл белгілі? Ол қалай аталады?
14. Байланыстың еселілігі дегеніміз не? Байланыстың еселілігінің өсуі оның ұзындығы мен энергиясына қалай әсер етеді?
15. а) C2H6, C2H5OH, CH3COOH, CH3Cl молекулаларындағы көміртегінің; б) NaCl, NaClO3, NaClO4, Ca(ClO)2 молекулаларындағы хлордың коваленттілігі мен тотығу дәрежесін анықтаңыз.
Термохимия. Термохимия заңдары
Осы бөлімнің есептерін шығару кезінде заттардың термодинамикалық сипаттамасы берілген кестені пайдаланыңыз.
Мысал: егер 1,12 л (қ. ж.) ацетиленді жаққан кезде 67,5 кДж жылу бөлінетіндігі белгілі болғандағы, ацетиленнің жану реакциясының жылу эффектісін есептеңіз және осы реакцияның термохимиялық теңдеуін құрастырыңыңыз.
Шешуі: жалпы түрдегі теңдеуді құрастырамыз:
2С2Н2 + 5О2 = 4СО2 + 2Н2О + Q кДж.
С2Н2 санын (мөлшерін) есептейміз:
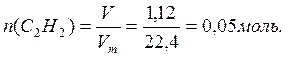
Теңдеуден алынады, ол 2 моль С2Н2 жаққанда Q кДж бөлінеді.
Онда:
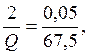
![]() (реакцияның жылу эффектісі)
(реакцияның жылу эффектісі)
Термохимиялық теңдеудің түрі:
2С2Н2 + 5О2 =4СО2+2Н2О + 2700 кДж.
16. Мыс сульфаты (CuSO4) мен мыс купоросының (CuSO4·5H2O) еру жылуы, сәйкесінше, -66,11кДж және 11,72 кДж-ге тең. Мыс сульфатының гидратация жылуын есептеңіз.
17. Нәтижесінде су буы мен көміртегі диоксиді түзілетін, бір моль C2H6(г) этанның жану реакциясының термохимиялық теңдеуін жазыңыз және жылу эффектісін есептеңіз. Көлемі 1 м3 (қ. ж.) этан жанған кезде қанша жылу бөлінеді?
18. Этилен мен су буының әрекеттесуінің нәтижесінде газ тәріздес этил спиртін алуға болады. Осы реакцияның термохимиялық теңдеуін жазып, оның жылу эффектісін есептеңіз.
19. Нәтижесінде газ тәріздес метан мен су түзілетін, көміртегі (ІІ) оксиді мен сутегі әрекеттескендегі реакцияның термохимиялық теңдеуін жазыңыз. Егер көлемі 67,2 дм3 (қ. ж.) метан алынған кезде, реакция нәтижесінде қанша жылу бөлінеді?
20. Метил спиртінің жану реакциясы мына термохимиялық теңдеумен өрнектеледі:
CH3OH(с) + 3/2O2(г) = CO2(г) + 2H2O(с).
Осы реакцияның жылу эффектісін есептеңіз.
21. Газ тәріздес күкіртті сутек пен көміртегі диоксиді әрекеттескенде, су буы мен газ тәріздес күкіртті көміртегі (CS2) түзіледі. Осы реакцияның термохимиялық теңдеуін жазыңыз және оның жылу эффектісін есептеңіз.
22. 1 моль сутегі мен 1 моль селен әрекеттескенде, 77,4 кДж жылу сіңірілді. Селенді сутектің түзілу энтальпиясын есептеңіз.
23. 2 моль мышьяк пен 3 моль сутегі әрекеттескенде, 370 кДж жылу сіңірілді. Арсиннің түзілу энтальпиясын есептеңіз.
24. 1 моль сутегі мен 1 моль хлор әрекеттескенде, 184 кДж жылу бөлінді. Хлорлы сутектің түзілу энтальпиясын есептеңіз.
25. Жай заттардан 1 моль су түзілгенде, 242 кДж жылу бөлінді. Судың түзілу энтальпиясы нешеге тең?
26. 1 моль азот пен 3 моль сутегі әрекеттескенде, 93 кДж жылу бөлінді. Аммиактың түзілу энтальпиясы нешеге тең?
27. Егер массасы 335,1 г темір алынған болса, темір (ІІІ) оксидінің металдық алюминиймен тотықсыздануы кезінде қанша мөлшерде жылу бөлінетінін есептеңіз.
28. Графитті жағу кезінде, массасы 8,86 г көміртегі диоксиді түзілді және 79,2 кДж жылу бөлінді. Көміртегі диоксидінің түзілу жылуын есептеңіз.
29. Магний карбонатының магний оксиді мен көміртегі диоксидіне ыдырауы кезінде 100,7 кДж жылу сіңіріледі. Магний карбонатының түзілу жылуын есептеңіз.
30. Массасы 11,5 г сұйық этил спиртінің жануы кезінде 308,71 кДж жылу бөлінді. Нәтижесінде су буы мен көміртегі диоксиді түзілетін реакцияның термохимиялық теңдеуін жазыңыз. C2H5OH(с) түзілу жылуын есептеңіз.
31. Массасы 80,0 г темір (ІІІ) оксидінің алюминиймен (алюмотермия реакциясы) тотықсыздануы кезінде 426,3 кДж жылу бөлінеді. Массасы 5,4 г металдық алюминийдің жануы кезінде 167,3 кДж жылу бөлінеді. Осы мәліметтерді негізге ала отырып, темір (ІІІ) оксидінің түзілу жылуын есептеңіз.
32. Аммиактың жану реакциясы мына термохимиялық теңдеумен өрнектеледі:
4NH3(г) + 3O2(г) = 2N2(г) + 6Н2О(с); ΔH0 = -1530,28 кДж.
Аммиактың түзілу жылуын есептеңіз.
33. Массасы 6,3 г темір күкіртпен әрекеттескенде, 11,31 кДж жылу бөлінді. Темір (ІІ) сульфидінің түзілу жылуын есептеңіз.
34. Көлемі 1 дм3 (қ. ж.) ацетиленнің жануы кезінде 56,053 кДж жылу бөлінеді. Нәтижесінде су буы мен көміртегі диоксиді түзілетін реакцияның термохимиялық теңдеуін жазыңыз. Газ тәріздес ацетиленнің түзілу жылуын есептеңіз.
35. Келесі термохимиялық теңдеулерге сүйене отырып, NO(г) түзілу жылуын есептеңіз:
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(с); ΔH0 = -1168,80 кДж;
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(с); ΔH0 = -1530,28 кДж.
36. Келесі термохимиялық теңдеулерге сүйене отырып, газ тәріздес метанның түзілу жылуын есептеңіз:
H2(г) + 1/2O2(г) = H2O(с); ΔH0 = -285,84 кДж;
С(графит) + O2(г) = CO2(г); ΔH0 = -393,51 кДж;
CH4(г) + 2O2(г) = 2H2O(с) + CO2(г); ΔH0 = -890,31 кДж.
37. Реакциялардың ΔG0 табыңыз:
а) CO(г) + 1/2O2(г) = CO2(г);
б) 1/2N2(г) + 3/2H2(г) = NH3(г);
в) C6H6(с) + NH3(г) = H2(г) + C6H5NH2(с).
38. Қандай температурада жүйенің тепе-теңдігі орнайды:
4HCl(г) + O2(г) = 2H2O(г) + 2Сl2(г); ΔH0 = -114,42 кДж?
39. Fe3O4-ң көміртегі оксидімен тотықсыздануы мына теңдеу бойынша жүреді:
Fe3O4(кр) + CO(г) = 3FeO(кр) + СO2(г).
ΔG0 есептеңіз және қалыпты жағдайдағы осы реакцияның өздігінен жүру мүмкіндігі туралы қорытынды жасаңыз. Осы реакцияның ΔS0 қаншаға тең?
40. Ацетиленнің жану реакциясының ΔG0 және ΔS0 табыңыз:
C2H2(г) + 5/2O2(г) = 2СO2(г) + H2O(с).
41. Қалыпты жағдайда экзотермиялық реакцияның мүмкін еместігін немен түсіндіруге болады:
H2(г) + CO2(г) = CO(г) + H2O(с); ΔH0 = -2,85 кДж?
Сәйкес келетін заттардың ΔΗ0 және S0 стандартты мәндерін негізге ала отырып, осы реакцияның ΔG0 анықтаңыз.
42. Сәйкес келетін заттардың абсолютті стандартты энтропиясының және түзілу жылуының стандартты мәндеріне сүйене отырып, мына теңдеулер бойынша жүретін реакциялардың ΔG0 табыңыз:
а) CS2(г) + 3O2(г) = CO2(г) + 2SO2(г);
б) Al2O3(кр) + 2Cr(кр) = Сr2O3(кр) + 2Al(кр);
в) CaO(кр) + CO2(г) = CaCO3(кр).
43. а) судың буға; б) графиттің алмазға айналуы кезінде энтропия төмендей ме немесе жоғарлай ма? Неге? Әр айналуға ΔS0 табыңыз. Фазалық және аллотропиялық айналу кезіндегі энтропияның өлшемдік өзгеруі туралы қорытынды жасаңыз.
44. Есептеуді орындамай-ақ, келтірілген процестердің қайсысында энтропияның өзгеруі оң болатынын көрсетіңіз:
а) MgO(кр) + H2(г) = Mg(кр) + H2O(с);
б) C(графит) + CO2(г) = 2CO(г).
45. Есептеуді орындамай-ақ, келтірілген процестердің қайсысында энтропияның өзгеруі оң болатынын көрсетіңіз:
а) 4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г);
б) NH4NO3(кр) = N2O(г) + 2H2O(г).
Химиялық реакциялардың жылдамдығы. Химиялық тепе-теңдік. Химиялық тепе-теңдіктің ығысуы
Мысал: Азот (IV)оксидінің түзілу реакциясы тендеумен өрнектеледі:
2NO + O2 ↔ 2NO2.
Тура және кері реакцияның жылдамдығы қалай өзгереді, егер қысымды 3 есе көтерсе, ал температураны тұрақты қалдырса? Реакция жылдамдығының бұл өзгерісі тепе-тендіктің ығысуын туындата ма?
Шешуі: қысымды көтергенге дейін азот (II) оксидінің, оттектің және азот (IV) оксидінің тепе-теңдіктік концентрациялары келесідей болады делік:
[NO] = а; [O2] = b; [NO2] = с.
Мұндайда тура реакцияның жылдамдығы:
υ1 = k1∙а2b,
ал кері реакцияның жылдамдығы:
υ2 = k2∙с.
Қысымды 3 есеге жоғарылатқан кезде барлық реагенттердің концентрациялары сонша есе көбейеді:
[NO] = 3а; [O2] = 3b; [NO2] = 3с.
Ондайда тура реакцияның жылдамдығы болмақ:
υ1 = k1∙ (3а)2∙3b,
ал кері реакцияның жылдамдығы:
υ2 = k2∙(3с)2 = k2∙9с2-ге тең болады.
Демек, тура реакцияның жылдамдығы 27 есеге, ал керінікі – 9 есеге өскені. Тепе-теңдік тура реакция жағына қарай ығысады, бұл Ле-Шателье ұстанымымен сәйкес.
46. Тура реакция жылдамдығының өрнектелуін жазыңыз:
а) 2А + B ↔ A2B;
б) N2(г) + 3H2(г) ↔ 2NH3(г).
Бастапқы заттардың концентрациясын екі есе жоғарлатқанда, (а) және (б) тура реакциясының жылдамдығы қалай өзгереді?
47. Тура реакция жылдамдығының өрнектелуін жазыңыз:
а) CO2(г) + С(кp) ↔ 2CO(г);
б) Fe3O4(кp) + 4СO(г) ↔ 3Fe(кp) + 4СO2(г).
Бастапқы заттардың концентрациясын екі есе жоғарлатқанда, (а) және (б) тура реакциясының жылдамдығы қалай өзгереді?
48. Егер бастапқы заттардың концентрацияларын 2 есе жоғарлатса,
H2(г) + Br2(г) ↔2HBr(г)
сутегі мен бромның әрекеттесу реакциясының жылдамдығы неше есе артады?
49. Егер жүйенің қысымын екі есе жоғарлатса,
4NH3(г) + 5O2(г) ↔ 4NO(г) + 6H2O(г)
тура реакцияның жылдамдығы қалай өзгереді?
50. Егер жүйенің қысымын үш есе жоғарлатса,
2CO(г) + O2(г) ↔ 2CO2(г)
тура реакцияның жылдамдығы қалай өзгереді?
51. Егер жүйенің көлемін 5 есе төмендетсе,
S(г) + O2(г) ↔ SO2(г)
күкірттің жану реакциясының жылдамдығы қалай өзгереді?
52. Егер жүйенің қысымы 2 есе жоғарласа,
2Al(кр) + 3Cl2(г) = 2AlCl3(кр)
химиялық реакцияның жылдамдығы қалай өзгереді?
53. Егер температура 30° жоғарласа, ал температуралық коэффициент 3-ке тең болғанда, реакция жылдамдығы қанша есе артады?
54. Егер температураның а) 283 – 323 К дейін өсуі кезінде реакция жылдамдығының 16 есе артқандағы; б) 323 – 373 К дейін өсуі кезінде реакция жылдамдығы 1200 есе артқандағы, кейбір реакциялар жылдамдығының температуралық коэффициентін есептеңіз.
55. Егер жылдамдықтың температуралық коэффициенті 3-ке тең болғанда, реакция жылдамдығы 81 есе өсуі үшін температураны қанша градусқа жоғарлату керек?
56. Егер температураны 30 градусқа жоғарлатқанда, жылдамдық 27 есе артады, реакция жылдамдығының температуралық коэффициенті неге тең?
57. Егер γ = 2, температураны 50° жоғарлатқанда, реакция жылдамдығы неше есе өседі?
58. Жылдамдық 729 есе өсуі үшін реакцияның температурасын қанша градусқа жоғарлату керек (γ = 3)?
59. Реакция температурасы 60° жоғарлағанда, реакция жылдамдығы 64 есе өсті. Температуралық коэффициентті анықтаңыз (γ).
60. Температураны 20° жоғарлатқанда, реакция жылдамдығы 9 есе өсті. Осы реакцияның температуралық коэффициенті нешеге тең және температураны 30° және 100° жоғарлатқанда, оның жылдамдығы қанша есе артады?
61. Егер жүйедегі қысымды екі есе төмендетсе,
2CO(г) + 2H2(г) ↔ CH4(г) + CO2(г)
реакция тепе-теңдігі қай жаққа қарай ығысады?
62. Егер жүйенің көлемі үш есе жоғарлағанда,
CH4(г) + H2O(г) ↔ CO(г) + 3H2(г)
реакция тепе-теңдігі қай жаққа қарай ығысады?
63. Мына реакцияның:
N2 + 3H2 ↔ 2NH3
тепе-теңдік концентрациялары (моль/дм3): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4.
Егер қысымды 5 есе жоғарлатса, тура реакцияның жылдамдығы қалай өзгереді? Сол кезде тепе-теңдік қай жаққа қарай ығысады?
64. Келесі гомогенді реакциялардың тепе-теңдігіне температура мен қысымның төмендеуі қалай әсер етеді:
а) 3O2 ↔ 2O3, ΔH0 = +184,6 кДж;
б) 2CO + O2 ↔ 2CO2, ΔH0 = -566,0 кДж;
в) N2 + 3H2 ↔ 2NH3, ΔH0 = -92,4 кДж?
65. Келесі гомогенді реакциялардың тепе-теңдігіне температура мен қысымның төмендеуі қалай әсер етеді:
а) N2 + 3H2 ↔ 2NH3, ΔH0 = -92,4 кДж;
б) 2SO2 + O2 ↔ 2SO3, ΔH0 = -196,6 кДж;
в) 4HCl + O2 ↔ 2H2O + 2Cl2, ΔH0 = -114,5 кДж?
66. Жүйеде:
CaCO3(кр) ↔ CaO(кр) + CO2(г), ΔH0 = +179 кДж
тепе-теңдік орнады. Температураны жоғарлатқанда, ол қай жаққа қарай ығысады?
67. Жүйеде:
3Fe2O3(кр) + H2(г) ↔ 2Fе3O4(кр) + H2O(г)
тепе-теңдік орнады. Қысымды жоғарлатқанда, ол қай жаққа қарай ығысады?
68. Қысымды өзгерту арқылы келесі реакциялардың өнімінің шығуын қалай жоғарлатуға болады:
а) 2NO(г) + O2(г) ↔ 2NO2(г);
б) N2O4(г) ↔ 2NO2(г);
в) 2SO2(г) + O2(г) ↔ 2SO3( г)?
69. Қысымды өзгерту арқылы келесі реакциялардың өнімінің шығуын қалай жоғарлатуға болады:
а) 2SO2(г) + O2(г) ↔ 2SO3( г);
б) PCl5(г) ↔ PCl3(г) + Сl2(г);
в) CO2(г) + С(графит) ↔ 2CO(г)?
70. Қандай факторлардың әсерімен келтірілген реакциялардың тепе-теңдігін оң жаққа қарай ығыстыруға болады:
а) C(графит) + H2O(г) ↔ CO(г) + H2(г), - 129,89 кДж;
б) N2O4 ↔ 2NO2, - 54,47 кДж;
в) 2SO2 + O2 ↔ 2SO3, + 192,74 кДж?
71. Егер концентрациялары [CO2] = 0,30 моль/дм3; [H2] = 0,02 моль/дм3; k = 1 болса,
CO(г) + H2O(г) ↔ CO2(г) + H2(г)
кері реакцияның жылдамдығы қаншаға тең?
72. Жүйедегі:
CO(г) + Cl2(г) ↔ CОCl2(г)
бастапқы заттардың алғашқы концентрациялары (моль/дм3): [CO] = 0,3; [Cl2] = 0,2. Егер CO концентрациясын 0,6 моль/дм3 дейін, ал Cl2 концентрациясын 1,2 моль/дм3 дейін жоғарлатса, реакция жылдамдығы неше есе артады?
73. NO2 түзетін NO және O2 концентрациялары, сәйкесінше, 0,03 және 0,05 моль/дм3 тең. Реакция жылдамдығы неге тең?
74. Реакцияға қатысып жатқан заттардың:
N2(г) + 3H2(г) ↔ 2NH3(г),
бастапқы концентрациялары (моль/дм3): [N2] = 1,5; [H2] = 2,5; [NH3] = 0. Аммиактың концентрациясы 0,5 моль/дм3 тең болған кезеңде, азот пен сутегінің концентрациялары қандай болды?
75. Реакцияның жүруінің алғашқы кезеңінде:
CO(г) + H2O(г) ↔ CO2(г) + H2(г)
концентрациялар (моль/дм3): [CO] = 0,30; [H2O] = 0,40; [CO2] = 0,40; [H2] = 0,05 болды. 50% су әсер еткен кезеңдегі, барлық заттардың концентрацияларын табыңыз.
Сұрақтар:
1. Электрондық бұлттардың қайта жабылу аймағы нені білдіреді?
2. Валенттік бұрыш дегеніміз не?
3. Дипольдік момент дегеніміз не? Ол қандай өлшем бірлігімен өлшенеді?
4. Қатты металдардың жылуөткізгіштігі мен электрлік өткізгіштігін немен түсіндіруге болады?
5. Термодинамиканың екінші басының теңдеуі қандай тәуелділікті өрнектейді?
6. Судың қатуы кезінде энтальпияның өзгеруінің белгісі қандай?
7. Қарапайым жағдайда көміртегінің – алмаз немесе графитке қандай түр өзгеруі көбіне тұрақты болып келеді?
8. Процестің энтальпиясының өзгеруі мен ішкі энергияның өзгеруінің арасында қандай айырмашылық бар?
9. Химиялық реакцияның жылдамдығы қандай факторларға тәуелді?
10. Активтендіру энергиясы деп нені айтады? Ол химиялық реакцияның жылдамдығына қандай фактордың әсерін сипаттайды?
3 №3 есеп-сызба жұмысы. Ерітінділер және электрохимия
№3 есеп-сызба жұмысының мақсаты: ерітінділердегі алмасу және тотығу-тотықсыздану реакцияларын қарастыру, сондай-ақ тотығу және тотықсызданудың (электрохимиялық процестер) бөлек жүруін оқып үйрену, себебі бұл процестер кеңінен тараған және ғылым мен техника үшін үлкен маңызы бар [әдеб. – 1-10].
Ерітінділердің физика-химиялық қасиеттері
Осы бөлімнің есептерін шығару үшін эбуллиоскопиялық және криоскопиялық константа өлшемдерінің мәндерін пайдалану керек.
Мысал: 100,0 г суда 2,501 г заты бар ерітінді 100,21°С қайнайды. Еріген заттың молярлық массасын табыңыз.
Шешуі:
∆Тқайнау = 100,21 – 100 = 0,21°С,
∆Тқайнау = 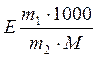
формуланы қолданып, еріген заттың молярлық массасын анықтаймыз:

1. Егер 500 см3 ерітіндіде 0,6 моль зат болатын болса, 27°С кезінде бейэлектролит ерітіндісінің осмостық қысымы нешеге тең?
2. 250 см3 ерітіндінің құрамында массасы 11,5 г бейэлектролит бар. 17°С кезінде бұл ерітіндінің осмостық қысымы 12,04·105 Па-ға тең. Бейэлектролиттің мольдік массасын анықтаңыз.
3. а) массасы 90,0 г судағы массасы 2,4 г несепнәр (мочевина); б) 360 см3 судағы массасы 27 г глюкоза ерітіндісінің бу қысымы қаншаға тең? Сол температурадағы су буының қысымы 157,3 кПа-ға тең.
4. Кристалдау температурасы 0,465° төмендеуі үшін, массасы 75 г суда несепнәрдің (NH2)2CO қандай массасын еріту керек?
5. Температурасы 70°С кезінде су буының қысымы 31,173 кПа-ға тең. Массалық үлесі 11,86% глюкоза ерітіндісіне арналған бу қысымының төмендеуін табыңыз.
6. Сулы ерітіндідегі C6H12O6 глюкоза 100,26°С қайнайтынын біле отырып, осы ерітіндінің массалық үлесін (%) табыңыз.
7. Массасы 40,2 г эфирде массасы 3,1 г C6H5NH2 анилин ерітілді. Алынған ерітіндінің бу қысымы 813,9 кПа-ға тең, ал сол температурадағы таза эфирдің бу қысымы 863,8 кПа-ға құрайды. Эфирдің молекулалық массасын есептеңіз.
8. Массасы 300,00 г судағы массасы 25,65 г кейбір бейэлектролиті бар ерітінді -0,465°С кезінде кристалданады. Бейэлектролиттің мольдік массасын табыңыз.
9. Ерітіндінің кристалдау температурасы -0,93°С екенін біле отырып, С12Н22О11 қанттың сулы ерітіндісінің массалық үлесін (%) есептеңіз.
10. Массасы 150 г суда массасы 5 г несепнәрі бар (NH2)2CO несепнәрдің сулы ерітіндісін кристалдау температурасын табыңыз.
11. Массасы 100,00 г бензолда массасы 3,04 г C10H16O камфоры бар ерітінді 80,714°С қайнайды. Бензолдың қайнау температурасы 80,200°С. Бензолдың эбуллиоскопиялық тұрақтысын есептеңіз.
12. Бұл ерітінді 100,39°С қайнайтынын біле отырып, С3Н8О3 глицериннің сулы ерітіндідегі массалық үлесін (%) табыңыз.
13. Массасы 250,00 г судағы массасы 2,25 г бейэлектролиті бар ерітіндінің -0,279°С кезінде кристалданатынын біле отырып, осы бейэлектролиттің мольдік массасын есептеңіз.
14. Қайнау температурасы 0,26° көтерілуі үшін, массасы 250 г суда қанша есепнәрді (NH2)2CO еріту қажет?
15. Массасы 125,0 г судағы массасы 2,3 г кейбір бейэлектролитті еріту кезінде кристалдау температурасы 0,372° төмендейді. Бейэлектролиттің мольдік массасын табыңыз.
Судың иондық туындысы. Сутектік көрсеткіш. Тұздар гидролизі
Мысал: 0,01 М КОН ерітіндісінің рН анықтаңыз.
Шешуі: КОН – күшті электролит, сондықтан [ОН-] концентрациясы сілтінің концентрациясына тең болады, яғни [ОН-] = 0,01 = 10-2 моль/л.
Онда рН = -lg [Н+] = -lg10-12 = 12.
16. Сутектік көрсеткіші 11 тең 10 дм3 ерітіндіде қанша грамм калий гидроксиді бар?
17. Бір ерітіндінің сутектік көрсеткіші рН – 2-ге тең, ал екіншінікі – 6. 1 дм3 қандай ерітіндіде сутегі иондарының концентрациясы көп және қанша есе?
18. рН мәндері а) 1,6; б) 10,5 тең болатын ерітіндінің [Н+] және [ОН-]-иондарының концентрациясын табыңыз және реакцияның ортасын көрсетіңіз.
19. [Н+] - иондарының концентрациясы (моль/дм3): а) 2,0·10-7; б) 8,1·10-3; в) 2,7·10-10 тең ерітіндінің рН мәнін есептеңіз.
20. [OH-] иондарының концентрациясы (моль/дм3): a) 4,6·10-4; б) 8,1·10-6; в) 9,3·10-9 тең ерітіндінің рН мәнін есептеңіз.
21. Диссоциациялану дәрежесі 0,042-ге тең, 0,01 н сірке қышқылы ерітіндісінің рН мәнін есептеңіз.
22. Келесі әлсіз электролит ерітінділерінің рН мәнін есептеңіз: а) 0,02 М NH4OH; б) 0,1 М HCN; в) 0,05 н HCOOH; г) 0,01 М CH3COOH.
23. Ni(NO3)2 және Na2SO3 тұздар гидролизінің молекулалық және ионды-молекулалық теңдеуін құрастырыңыз. Бұл ерітінділердің рН мәні қандай?
24. FeCl3, Na2CO3 және KCl тұздар гидролизінің молекулалық және ионды-молекулалық теңдеуін құрастырыңыз. Бұл ерітінділердің рН мәні қандай?
25. AlCl3, K2CO3 және NaNO3 тұздар гидролизінің молекулалық және ионды-молекулалық теңдеуін құрастырыңыз. Бұл ерітінділердің рН мәні қандай?
26. K2S, ZnSO4 және NaCl тұздар гидролизінің молекулалық және ионды-молекулалық теңдеуін құрастырыңыз. Бұл ерітінділердің рН мәні қандай?
27. Pb(NO3)2, KCN және NaNO3 тұздар гидролизінің молекулалық және ионды-молекулалық теңдеуін құрастырыңыз. Бұл ерітінділердің рН мәні қандай?
28. Na3PO4, CuSO4 және CH3COOK тұздар гидролизінің молекулалық және ионды-молекулалық теңдеуін құрастырыңыз. Бұл ерітінділердің рН мәні қандай?
29. BaS, FeSO4 және NaCN тұздар гидролизінің молекулалық және ионды-молекулалық теңдеуін құрастырыңыз. Бұл ерітінділердің рН мәні қандай?
30. Бірдей жағдайда мына тұздардың ішінен қайсысы гидролизге бұрын ұшырайды: а) К2СО3 немесе K2S; б) FeCl3 немесе FeCl2; в) Nа3ВО3 немесе Na3PO4; г) MgCl2 немесе ZnCl2. Неліктен?
Тотығу-тотықсыздану реакциялары
Мысал: бром мен күкіртті сутек арасында жүретін реакцияны қарастырайық:
Br2 + H2S + H2O → HBr + H2SO4.
Шешуі: реакция теңдеуін жазып және ондағы өзінің тотығу дәрежесін өзгерткен элементтерді бөліп алған соң, бром қабылдаған және күкірт берген электрондар санын анықтайды:
Br2 +2ē → 2Br- тотықтырғыш, тотықсыздану процесі;
S-2 –8ē → S+6 тотықсыздандырғыш, тотығу процесі.
Бұл жағдайда бром өзіне екі электронды қосып алды (ол екеуінде күкірттен алады), ал күкірт болса 8 электронды береді. Демек, сегізді екіге бөлсек (кейде көбейтеді) бір де төрт болады, яғни бромға 4 коэффициентін енгізеді:
Br2 +2ē → 2Br- |8 |4
S-2 –8ē → S+6 |2 |1
Енді берілген және қосылған электрондар саны бойынша теңестірілген қосынды теңдеуді жазамыз:
4Br2 + S-2 → 8Br- + S+6
Әуелгі теңдеуге алынған коэффициенттерді енгізіп, реакцияға қатысқан басқалар үшін де коэффициенттерді таңдап алған соң, мына теңдеу алынады:
4Br2 + H2S + 4H2O → 8HBr + H2SO4.
31. Келтірілген заттардың ішінде қайсысы тек тотықтырғыш қасиет, тек тотықсыздандырғыш қасиет және тотықтырғыш та, тотықсыздандырғыш та қасиет көрсетеді: MnO2, KMnO4, P2O5, Na2S. Электрондық теңдеуін құрастырып, тотықтырғыш пен тотықсыздандырғышты көрсетіңіз. Қандай зат тотығады, қандай зат тотықсызданады?
32. Келтірілген заттардың ішінде қайсысы тек тотықтырғыш қасиет, тек тотықсыздандырғыш қасиет және тотықтырғыш та, тотықсыздандырғыш та қасиет көрсетеді: K2SO3, HNO3, H2S, NO2. Электрондық теңдеуін құрастырып, тотықтырғыш пен тотықсыздандырғышты көрсетіңіз. Қандай зат тотығады, қандай зат тотықсызданады?
33. Келтірілген заттардың ішінде қайсысы тек тотықтырғыш қасиет, тек тотықсыздандырғыш қасиет және тотықтырғыш та, тотықсыздандырғыш та қасиет көрсетеді: Cr, Na2CrO4, KCrO2, K2Cr2O7. Электрондық теңдеуін құрастырып, тотықтырғыш пен тотықсыздандырғышты көрсетіңіз. Қандай зат тотығады, қандай зат тотықсызданады?
34. Келтірілген заттардың ішінде қайсысы тек тотықтырғыш қасиет, тек тотықсыздандырғыш қасиет және тотықтырғыш та, тотықсыздандырғыш та қасиет көрсетеді: NH3, KClO2, N2, KNO3, K2MnO4. Электрондық теңдеуін құрастырып, тотықтырғыш пен тотықсыздандырғышты көрсетіңіз. Қандай зат тотығады, қандай зат тотықсызданады?
35. Келесі өзгерістердің электрондық теңдеуін құрастырып, қайсы процесс – тотығу немесе тотықсыздану екенін көрсетіңіз:
а) NH3 →
NO0, NO![]() → NH3, S2-
→ S0, SO
→ NH3, S2-
→ S0, SO![]() → S0;
→ S0;
б) Mn+2 →
MnO![]() → MnO
→ MnO![]() →
Mn0 → MnO2.
→
Mn0 → MnO2.
36. Реакциялар мына түрде өрнектеледі:
а) Na2SO3 + KIO3 + H2SO4 → Na2SO4 + I2 + K2SO4 + H2O;
б) CrCl3 + H2O2 + NaOH → Na2CrO4 + NaCl + H2O;
в) MnSO4 + PbO2 + HNO3 → HMnO4 + PbSO4 + Pb(NO3)2 + H2O;
г) K2Cr2O7 + K2S + H2SO4 → K2SO4 + Cr2(SO4)3 + S + H2O.
Тотығу-тотықсыздану реакцияларына коэффициенттерін қойып шығыңыз. Тотықтырғышты және тотықсыздандырғышты көрсетіңіз. Қандай зат тотығады, қандай зат тотықсызданады?
37. Нәтижесінде мына өзгерістерді алуға болатын реакция теңдеулерін жазыңыз: көміртегі → кальций карбиді → кальций гидроксиді → хлорлы әк → хлор → калий хлораты → оттегі.
Электрондық балансын құрып, осы өзгерістер кезінде қайсы процесс – тотығу немесе тотықсыздану екенін көрсетіңіз.
38. Нәтижесінде мына өзгерістерді алуға болатын реакция теңдеулерін жазыңыз: күкірттісутек → күкірт → күкірт диоксиді → күкіртті қышқыл → натрий сульфиті → натрий сульфаты.
Электрондық балансын құрып, осы өзгерістер кезінде қайсы процесс – тотығу немесе тотықсыздану екенін көрсетіңіз.
39. Құрамында: кремний, сутегі, оттегі, натрий болғанда қандай күрделі заттар алуға болады? Реакция теңдеуін жазыңыз, электрондық баланс құрыңыз және алынған өнімдерді атаңыз.
40. Құрамында: азот, оттегі, күміс және сутегі болғанда қандай күрделі заттар алуға болады? Реакция теңдеуін жазыңыз, электрондық баланс құрыңыз және алынған өнімдерді атаңыз.
41. Темір, күкірт және оттегі арасындағы реакцияларды іске асырғанда, сонымен қатар осы реакциялардың өнімдерімен қандай химиялық қосылыстар алуға болады? Теңдеуін, электрондық балансты және реакцияның жүру шартын жазыңыз.
42. Тотығу-тотықсыздану реакциясының теңдеуін аяқтаңыз және коэффициенттерін қойып шығыңыз. Тотықтырғыш пен тотықсыздандырғышты көрсетіңіз.
KI + H2O2 + HCl → … + ...?
43. Тотығу-тотықсыздану реакциясының теңдеуін аяқтаңыз және коэффициенттерін қойып шығыңыз. Тотықтырғыш пен тотықсыздандырғышты көрсетіңіз.
H2O2 + K2Cr2O7 + H2SO4→ … + ...?
44. Тотығу-тотықсыздану реакциясының теңдеуін аяқтаңыз және коэффициенттерін қойып шығыңыз. Тотықтырғыш пен тотықсыздандырғышты көрсетіңіз.
NaClO + KI + H2SO4→ … + …?
45. Тотығу-тотықсыздану реакциясының теңдеуін аяқтаңыз және коэффициенттерін қойып шығыңыз. Тотықтырғыш пен тотықсыздандырғышты көрсетіңіз.
PbO2 + NaCrO2 + NaOH→ … + …?
Электродтық потенциалдар. Гальваникалық элементтер
Осы бөлімнің есептерін шығыру үшін стандартты электродтық потенциалдар мәндерін пайдаланыңыз.
Мысал: гальваникалық элемент 0,1 М мырыш нитратының ерітіндісіне енгізілген мырыш металынан және 0,02 М қорғасын нитратының ерітіндісіне енгізілген металдық қорғасыннан тұрады. Элементтің ЭҚК есептеңіз. Электродтық реакциялардың теңдеуін жазып, элемент сұлбасын құрастырыңіз.
Шешуі: анықтамалық кестеден стандартты электродтық потенциал мәнін табады:
![]()
![]()
Нернст теңдеуі бойынша есептейді:
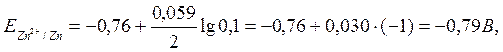
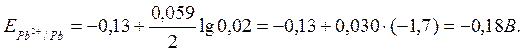
Элементтің ЭҚК табады: Е = ЕPb – ЕZn= –0,18 – (–0,79) = 0,61 В.
ЕPb > ЕZn болғандықтан, қорғасын электродында тотықсыздану реакциясы жүреді, яғни ол катод болады: Pb2+ +2ē = Pb.
Ал мырыш электродында тотығу реакциясы жүреді: Zn –2ē = Zn2+, яғни ол – анод. Соңында, гальваникалық элементтің жалпы сұлбасы болады:
(–) Zn / Zn(NO3)2 (0,1 M) // Pb(NO3)2 (0,02 M) / Pb (+).
46. Егер мыс купоросының ерітіндісі бар үш пробиркаға сәйкесінше, алюминий, қорғасын, күміс металдарының кішкене бөліктерін салғанда қандай сыртқы өзгерістер байқауға болады? Сәйкес келетін реакцияларға электрондық және молекулалық теңдеуін құрастырыңыз.
47. Мына ерітінділермен әрекеттескенде мырыш пластинкасының массасы көбейе ме, азая ма немесе өзгеріссіз қала ма: а) CuSO4; б) MgSO4;
в) Pb(NO3)2; г) AgNO3; д) NiSO4; е) BaCl2? Неге? Сәйкес келетін реакцияларға электрондық және молекулалық теңдеуін құрастырыңыз.
48. Мырыш элетродының потенциалы Zn2+ ионының қандай концентрациясында (моль/дм3) өзінің стандартты электродтық потенциялынан 0,015 В-қа аз болады?
49. Хром электродының потенциалының мәні Cr3+ ионының қандай концентрациясында (моль/дм3) мырыш электродының стандартты потенциалына тең болады?
50. Магний хлориді ерітіндісінің концентрациялары (моль/дм3): а) 0,1;
б) 0,01; в) 0,001 болғандағы магнийдің электродтық потенциалын есептеңіз.
51. Массасы 10,0 г мырыш пластинкасы мыс (ІІ) сульфаты ерітіндісіне батырылды. Реакция соңында пластинканың массасы 9,9 г болды. Пластинка массасының өзгеруін түсіндіріңіз және реакцияға түскен мыс (ІІ) сульфатының массасын анықтаңыз.
52. Темір стерженьнің массасы мыс (ІІ) нитраты ерітіндісінде ұстағаннан кейін 1,6 г-ға көбейді, сөйтіп 23,2 г болды. Мыс нитраты ерітіндісіне батырғанға дейінгі темір стерженьнің массасын, сондай-ақ реакциядан кейінгі мыс массасын есептеңіз.
53. [Cd2+] = 0,80 моль/дм3, ал [Cu2+] = 0,01моль/дм3 болатын мыс-кадмий гальваникалық элементінің ЭҚК есептеңіз, электродтық процестердің электрондық теңдеуін жазыңыз және сұлбасын құрастырыңыз.
54. Қандай гальваникалық элемент концентрациялық деп аталады?
0,01 моль/л және 0,1 моль/л күміс нитратының ерітіндісіне батырылған күміс электродтарынан тұратын гальваникалық элементтің сұлбасын құрастырыңыз, электродтық процестердің электрондық теңдеуін жазыңыз және гальваникалық элементтің ЭҚК есептеңіз.
55. 0,005 М өз тұздарының ерітінділеріне батырылған темір мен қорғасыннан тұратын гальваникалық элементтің жұмысының сұлбасын құрастырыңыз. Осы элементтің ЭҚК есептеңіз.
56. Концентрациялары [Pb2+] = [Mg2+] = 0,01 моль/дм3 тұздарының ерітінділеріне батырылған қорғасын және магний пластинкаларынан тұратын гальваникалық элементтің ЭҚК есептеңіз, электродтық процестердің электрондық теңдеуін жазыңыз және сұлбасын құрастырыңыз. Егер әр ионның концентрациясын бірдей мөлшерде жоғарлатса, осы элементтің ЭҚК өзгере ме?
57. Концентрациялары [Cd2+] = [Mg2+] = 1 моль/дм3 өз тұздарының ерітінділеріне батырылған кадмий және магний пластинкаларынан тұратын гальваникалық элементтің ЭҚК есептеңіз, электродтық процестердің электрондық теңдеуін жазыңыз және сұлбасын құрастырыңыз. Егер әр ионның концентрациясын 0,01 моль/дм3 дейін төмендетсе, ЭҚК мәні өзгере ме?
58. 0,05 М өз тұздарының ерітінділеріне батырылған мырыш пен қорғасыннан тұратын гальваникалық элементтің жұмысының сұлбасын құрастырыңыз. Осы элементтің ЭҚК есептеңіз.
59. Темір және күміс пластиналары сыртқы өткізгішпен жалғанған және күкірт қышқылының ерітінділеріне батырылған. Осы гальваникалық элементтің сұлбасын құрастырыңыз және электродтарда жүретін процестердің электрондық теңдеуін жазыңыз.
60. Никель біреуінде – катод болатын, ал екіншісінде – анод болатын екі гальваникалық элементтің электродтық процестерінің электрондық теңдеуін жазып, сұлбасын құрастырыңыз.
Электролиз
Мысал: Ni(NO3)2 сулы ерітіндісінің электролиз реакциясының теңдеуін жаз (электродтары инертті).
Шешуі:
Ni(NO3)2 ↔ Ni2+ + 2NO![]()
Катод (–) (+) Анод
Ni2+ +2ē → Ni0
2H2O +2ē → H2↑ + 2OH- 2H2O –4ē → O2↑ + 4H+
(тотықсыздану) (тотығу)
Ni2+ + 2H2O + 2H2O ![]() Ni0 + H2↑ + 2OH- + O2↑
+ 4H+,
Ni0 + H2↑ + 2OH- + O2↑
+ 4H+,
Ni(NO3)2 + 2H2O ![]() Ni0 + H2↑ + O2↑ + 2НNO3.
Ni0 + H2↑ + O2↑ + 2НNO3.
61. Құрамында Cr3+, Pb2+, Hg2+, Mn2+ иондары бар сулы ерітінділердің электролизі кезінде катиондар қандай кезекпен тотықсызданады, егер оларға сәйкес тұздардың молярлы концентрациясы бірдей, ал катодтағы кернеуі олардың әр қайсысының тотықсыздануына жеткілікті болса?
62. а) қорғасын (ІІ) нитратының; б) күкірт қышқылының сулы ерітінділерінің электролизі кезінде графит электродтарында жүретін катодтық және анодтық процестерінің реакция теңдеулерін жазыңыз.
63. NaNO3 ерітіндісі арқылы 1 сағ бойы ток күші 3 А ток өткен кезде пайда болатын оттегі мен сутегінің массасын есептеңіз.
64. 1 сағ бойы темір (ІІ) сульфаты мен темір (ІІІ) хлоридінің ерітінділері арқылы ток күші 1,5 А ток өткенде бөлінетін темірдің массасын анықтаңыз (инертті электродтар).
65. Электролит ерітіндісі арқылы 1 сағ ішінде ток күші 0,5 А ток өткен кезде 0,55 г металл бөлінеді. Металдың эквиваленттік массасын анықтаңыз.
66. а) CuSO4 мыс анодымен; б) NiSO4 никель анодымен; в) AgNO3 күміс анодымен ерітінділерінің электролизі кезінде электродтарда жүретін реакциялардың электрондық теңдеуін жазыңыз.
67. 50 мин бойы 3 А ток күшімен күміс нитратының сулы ерітіндісін электролиздегенде, катодта массасы 9,6 г күміс бөлінді. Ток бойынша шығынды анықтаңыз (η, %).
68. 3 сағ бойы 5 А ток күшімен калий сульфатының сулы ерітіндісін электролиздеді. Электродтарда жүретін процестердің электрондық теңдеуін құрастырыңыз. Нәтижесінде судың қандай массасы ыдырады және катод пен анодта бөлінген газдардың көлемі (қ. ж.) қаншаға тең?
69. 5 сағ бойы мырыш сульфатының сулы ерітіндісін электролиздеді, соның нәтижесінде анодта көлемі 6 дм3 (қ. ж.) оттегі бөлінді. Ток күшін есептеңіз (инертті электродтар).
70. 4 сағ бойы 2 А ток күшімен күміс нитратының сулы ерітіндісін электролиздеді. Инертті электродтарда жүретін процестердің электрондық теңдеуін құрастырыңыз. Катодта металдың қандай массасы бөлінді және анодта бөлінген газдың көлемі (қ. ж.) қандай?
71. 45 мин бойы 6 А ток күшімен кейбір металдар сульфатының сулы ерітіндісін электролиздеді, нәтижесінде катодта массасы 5,49 г металл бөлінді. Металдың эквиваленттік массасын есептеңіз.
72. Егер 33 мин 20 с бойы 2 А ток күшімен күміс нитратының сулы ерітіндісін электролиздегенде, күміс анодының массасы қалай өзгереді? Күміс нитратының сулы ерітіндісінің электролизі кезінде жүретін процестердің электрондық теңдеуін құрастырыңыз.
73. 2,5 сағ бойы 6 А ток күшімен натрий иодидінің сулы ерітіндісін электролиздеді. Көмір электродтарында жүретін процестердің электрондық теңдеуін құрастырыңыз, электродтарда бөлінетін заттардың массасын есептеңіз.
74. 15 мин бойы 2,5 А ток күшімен мыс (ІІ) сульфатының сулы ерітіндісінің электролизі кезінде массасы 0,72 г мыс бөлінді. Анодтары мыс және көмір электродтарында жүретін процестердің электрондық теңдеуін құрастырыңыз. Ток бойынша шығынды есептеңіз (η, %).
75. Массасы 8 г белгісіз заттың балқымасының электролизі кезінде анодта көлемі 11,2 дм3 (қ. ж.) сутегі бөлінді. Бұл қандай зат? Оның сулы ерітіндісінің электролизін жүргізуге бола ма?
Сұрақтар:
1. Ерітінділер қалай жіктеледі?
2. Ерудің жылу эффектісі нешеге тең?
3. Барлық сұйытылған судағы ерітінділер үшін судың иондық көбейтіндісі тұрақты шама бола ала ма?
4. Қандай тұздар жарым-жартылай гидролизденеді? Неге?
5. Кез келген сулы ерітіндінің ортасын қалай сипаттауға болады?
6. Қандай заттар тотықтырғыш та, тотықсыздандырғыш та қасиеттер көрсетеді?
7. Тотығу-тотықсыздану реакциясын алдынала тұжырымдауға бола ма? Мысал келтіріңіз.
8. Металл-ерітінді аймағында потенциалдың пайда болу механизмі қандай?
9. Электролиз процестерін жүргізгенде электродтар үшін материалды қандай факторлар таңдап алуды алдынала анықтайды?
10. Неліктен стандартты электродтық потенциалдар қатарындағы металдар белсенділігінің өзгеру тізбектілігі периодтық жүйенің тобындағы және периодтағы металл белсенділігінің өзгеру тізбектілігімен сәйкес келмейтінін түсіндіріңіз.
Бақылау тапсырмаларының нұсқалары
|
Нұсқа нөмірі |
Берілген тапсырмаларға сәйкес есептердің нөмірлері |
|
01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 |
1 15 31 46 61 2 17 32 47 62 3 18 33 48 63 4 19 34 49 64 5 20 35 50 65 6 21 36 51 66 7 22 37 52 67 8 23 38 53 68 9 24 39 54 69 10 25 40 55 70 11 26 41 56 71 12 27 42 57 72 13 28 43 58 73 14 29 44 59 74 15 30 45 60 75 1 29 44 59 74 2 28 43 47 73 3 17 42 48 62 4 19 41 51 67 5 25 37 54 65 6 19 35 50 66 7 18 40 57 64 8 30 43 47 70 9 27 41 55 65 10 24 42 49 68 11 21 39 60 69 12 23 43 53 73 13 24 44 57 74 14 15 31 52 61 15 16 32 53 62 |
Әдебиеттер тізімі
1. Коровин Н.В., Масленникова Г.Н., Мингулина Э.И., Филиппов Э.Л. Общая химия. – М.: Высшая школа, 2005.
2. Харин А.Н., Катаева Н.А., Харина Л.Г. Курс химии. – М.: Высшая школа,1983.
3. Глинка Н.Л. Общая химия. – Л.: Химия, 1999.
4. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. – М.: АСТ-Астрель, 2004.
5. Богатиков А.Н., Красицкий В.А., Лапко К.Н. Сборник задач, вопросов и упражнений по общей и неорганической химии. – Минск: Электронная книга БГУ, 2002.
6. Задачи и упражнения по общей химии. Под.ред. Коровина Н.В. – М.: Высшая школа, 2004.
7. Задачник по химии. Под ред. Амирхановой Н.А. – Уфа: ООО «ДизайнПолиграфСервис», 2002.
8. Лебедева М.И., Анкудимова И.А. Сборник задач и упражнений по химии с решением типовых и усложненных задач. – М.: Машиностроение, 2002.
9. Пірәлиев С.Ж., Бутин Б.М., Байназарова Г.М., Жайлау С.Ж. Общая химия. – Алматы, 2003.
10. Байназарова Г.М., Бутин Б.М., Жайлау С.Ж., Қуатбеков Қ.М. Общая химия. Решебник. – Алматы, 2006.
Мазмұны
|
Кіріспе 1 №1 ЕСЖ. Химияның негізгі заңдары мен түсініктері 2 №2 ЕСЖ. Термохимия және кинетика 3 №3 ЕСЖ. Ерітінділер және электрохимия Бақылау тапсырмаларының нұсқалары Әдебиеттер тізімі |
3 4 10 18 28 29 |
2013 ж. негізгі жоспары, реті 92