МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РЕСПУБЛИКИ КАЗАХСТАН
Некоммерческое акционерное общество
«Алматинский университет энергетики и связи»
Б.М.Султанбаева
ХИМИЯ
Алматы 2011
УДК 54 (075.81)
ББК 24Я73
С89 Химия:
Учебное пособие / Б.М.Султанбаева.-
Алматы: АУЭС, 2010.- 81с.
ISBN 9965-850-24-0
Материал учебного пособия составлен в соответствии с образовательным стандартом для студентов технических специальностей. В пособие включены теоретический материал, задачи и упражнения по основным разделам курса химии: строение атома и периодическая система Д.И.Менделеева, химическая кинетика и химическое равновесие, растворы, электрохимические процессы, коррозия металлов и защита металлов от коррозии. Приведена методика решения типовых задач. Предложены многовариантные задания для самостоятельной работы студентов.
Таблиц 6, библиогр.- 15 назв.
ББК 24Я73
Рецензенты: КазНТУ им. Сатпаева, д-р хим.наук Г.Д Елигбаева АУЭС, канд.хим.наук Идрисова К.С.
Печатается по плану издания Министерства образования и науки РК на 2010 год
ISBN 9965-850-24-0
© НАО «Алматинский университет энергетики и связи», 2011г.
Введение
Учебное пособие «Химия» подготовлено в соответствии с действующей программой по химии для технических специальностей высших учебных заведений, утвержденной Министерством образования и науки Республики Казахстан.
Настоящее пособие составлено с учетом специфических особенностей кредитной системы обучения, что и определило методику, структуру и содержание учебника, в основе которого лежат принципы всемерной активации самостоятельной работы студентов, формирования у них химического мышления, а также развитие навыков самостоятельного применения теоретических знаний для решения конкретных химических задач.
В пособии рассматриваются основные темы курса химии для студентов вузов. Каждая тема включает:
- краткую теорию, необходимую для решения индивидуального контрольного задания;
- методику решения типовых задач;
- многовариантные задания для самостоятельной работы.
В пособии преобладают задачи вычислительного характера. Задачи, не требующие расчетов, предназначены для закрепления теоретического материала. К расчетным задачам приведены ответы.
Учебное пособие призвано помочь активной самостоятельной работе студентов при изучении наиболее сложных разделов химии.
Тема 1
Строение атома. Периодическая система химических элементов
1 Элементарные частицы и атомное ядро
Атом – мельчайшая частица химического элемента, сохраняющая его химические свойства. В центре атома находится положительно заряженное ядро, вокруг которого движутся отрицательные частицы – электроны, образующие электронную оболочку. При химических реакциях ядро атома не изменяется, а изменяется электронная оболочка. Геометрический размер атома определяется не диаметром ядра ( ≈10-12см), а размером электронной оболочки ( ≈10-8 см). Электрон как частица обладает массой покоя m0(ē) = 9,1·10-31 кг; несет отрицательно электрический заряд, равный q(ē) = 1,6·10-19 Кл, заряд электрона является наименьшим, поэтому называется элементарным и условно принимается за единицу.
Ядро состоит из еще более мелких частиц – нуклонов. Существует два вида нуклонов: протон (р+) и нейтрон (n0). Протон (р+) является положительно заряженной частицей (g(p+) = 1,6 · 10-19 Кл); имеет массу покоя m0(p+) = 1,6726 · 10-27 кг. Нейтрон (n0) является нейтральной частицей и имеет m0(n0) = 1,6749 · 10-27 кг.
В атомных единицах массы (а.е.м.) Аr(p+) = Аr(n0) = 1а.е.м., Аr(![]() ) =
1/1837, где Ar – относительная масса или массовое число
соответственно протона, нейтрона и электрона. Фактически за единицу атомной
массы принята масса одного нуклона ( р+,
n0 ). Масса электрона в 1837 раз меньше массы нуклона,
поэтому можно утверждать, что масса атома сосредоточена в его ядре.
Следовательно, массовое число (Аr) атома химического
элемента равно числу (N) содержащихся в нем нуклонов:
) =
1/1837, где Ar – относительная масса или массовое число
соответственно протона, нейтрона и электрона. Фактически за единицу атомной
массы принята масса одного нуклона ( р+,
n0 ). Масса электрона в 1837 раз меньше массы нуклона,
поэтому можно утверждать, что масса атома сосредоточена в его ядре.
Следовательно, массовое число (Аr) атома химического
элемента равно числу (N) содержащихся в нем нуклонов:
![]() .
(1.1)
.
(1.1)
2 Строение электронной оболочки атома
2.1 Двойственная природа электрона
Электронная оболочка атома - это совокупность электронов, каждому из которых присущ корпускулярно-волновой характер:
1) с одной стороны, электрон как частица:
- обладает массой: m0(ē) = 9,1 · 10-31 кг;
- несет на себе определенный электрический заряд: g(ē) = 1,6 · 10-19 Кл;
- движется с определенной скоростью: υ(ē) = 3 · 108 м/сек.
2) с другой стороны, электрон обладает волновыми свойствами, так как любой частице, движущейся с определенной скоростью, характерна своя волна с длиной λ. Это свойство было доказано экспериментально (дифракция), а расчет длины волны основывается на уравнении Луи де Бройля:
λ =
![]() , (1.2)
, (1.2)
где h – постоянная Планка , h = 6,62 · 10-34 Дж ∙ сек;
m – масса ē;
![]() – скорость
движения ē.
– скорость
движения ē.
λ = 3 · 10-10 м.
Быстро движущийся электрон, обладающий свойствами волны, может находиться в любой части пространства, окружающего ядро, и различные положения его рассматриваются как электронное облако с определенной плотностью отрицательного заряда. Атомная орбиталь (АО) – это некоторый объем пространства вокруг атомного ядра, который соответствует 90 % - ной вероятности нахождения электрона (как частицы) и одновременно 90 % - ной плотности заряда электрона (как волны).
2.2 Квантовые числа
Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получивших название квантовых чисел (n, l, ml). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Квантовые числа определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали.
Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму. Электронное облако характеризуется четырьмя квантовыми числами (n, l, ml и ms).
1) Главное квантовое число n характеризует:
- энергию ē в атоме;
- размер электронного облака.
n принимает целочисленные значения от 1 до ∞ (практически от 1 до 7, совпадает с числом периодов в периодической системе).
n cовпадает с числом энергетических уровней (электронных слоев).
Главное квантовое число, n: 1 2 3 4 5 6 7.
Обозначение энергетических уровней: K L M N O P Q.
Энергетическое состояние n называется энергетическим уровнем. Чем дальше ē находится от ядра, тем больше размер электронного облака. Чем больше значение n, тем больше энергия ē.
2) Орбитальное квантовое число l характеризует:
- энергию ē в энергетическом подуровне;
- форму электронного облака;
- l принимает значения от 0 до (n-1).
Каждый энергетический уровень группируется из подуровней. Поэтому энергетическое состояние ē l называется энергетическим подуровнем.
Орбитальное квантовое число l : 0 1 2 3 4 5.
Обозначение подуровня: s p d f g h.
Число подуровней равно номеру уровня.
n l число обозначение
энергетический энергетический подуровня подуровня
уровень подуровень
1 0 1 s-подуровень
2 0 1 2 s-, p-подуровень
3 0 1 2 3 s-, p-, d-подуровень
4 0 1 2 3 4 s-, p-, d-, f-подуровень
s – электронные облака имеют форму шара;
p – электронные облака имеют форму гантели;
d – электронные облака имеют форму лепестков.
3) Магнитное квантовое число ml характеризует:
- ориентацию атомной орбитали в пространстве;
- принимает целочисленное значение от – l до + l, включая 0.
Например, определим число орбиталей (квантовых ячеек), соответствующее s-, p-, d-, f-электронам:

s – электронные облака, имея шаровую симметрию, характеризуются одной ориентацией в атомном пространстве (1 квантовая ячейка).
p - электронные облака принимают 3 ориентации в атомном пространстве, что схематично изображают тремя квантовыми ячейками.

d – электронные облака принимают пять ориентаций в атомном пространстве (пять квантовых ячеек).
4) Спиновое квантовое число ms характеризует собственное вращение ē вокруг своей оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали могут находиться не более двух электронов, отличающихся своими спинами
(ms = +1/2; -1/2).
Типовая задача № 1
Для атома с электронной структурой 1s22s22p1 найдите значения четырех квантовых n, l, ml, ms, определяющие каждый из электронов в нормальном состоянии.
Решение
Электронную структуру 1s22s22p1 имеет атом бора. Значения квантовых чисел для электронов атома бора надо определять с учетом принципа Паули, согласно которому в атоме не может быть даже двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
1-ый энергетический уровень атома бора содержит два электрона в
s – состоянии. Эти электроны
характеризуются следующим набором квантовых чисел: 1, 0, 0,
![]() 1/2.
1/2.
Электроны в s-состоянии второго энергетического уровня имеют
значения квантовых чисел: 2, 0, 0, ![]() 1/2.
1/2.
Квантовые числа: 2, 1, -1, +1/2 описывают электроны второго энергетического уровня в р – состоянии. Значения квантовых чисел пяти электронов атома бора следующие:
|
Квантовое число |
электрон |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
n |
1 |
1 |
2 |
2 |
2 |
|
l |
0 |
0 |
0 |
0 |
1 |
|
ml |
0 |
0 |
0 |
0 |
-1 |
|
ms |
+1/2 |
-1/2 |
+1/2 |
-1/2 |
+1/2 |
3 Электронные формулы атома
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов:
![]() , (1.3)
, (1.3)
где n - главное квантовое число;
l - орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение s, p, d, f );
х - число электронов в данном подуровне (орбитали).
Большие арабские цифры в электронной формуле обозначают энергетические уровни (n), буквы s, p, d, f обозначают энергетические подуровни, а малые арабские цифры (х) соответствуют числу электронов на каждом энергетичеком подуровне.
При составлении электронной формулы следует учитывать принципы, согласно которым идет расселение электронов по атомным орбиталям.
1) Принцип Паули: в атоме не может быть двух электронов с одинаковым значением всех четырех квантовых чисел.
2) Принцип минимальной энергии: каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией, отвечающей его прочной связи с ядром.
С ростом порядкового номера элемента электроны заполняют орбитали и уровни в порядке возрастания их энергий. Принцип минимальной энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
3) Правило Клечковского: увеличение энергии и сосответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел (n + l), а при равной сумме (n + l) в порядке возрастания числа n.
Соответственно этому правилу последовательность заполнения энергетических подуровней следующая: 1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p < 7s и т.д.
Исключение составляют d-, f- элементы с полностью и наполовину заполненными подуровнями, у которых наблюдается так называемый «провал» электрона из ns - подуровня в (n-1)d -, (n-2)f – подуровень
Так, электронная формула атома хрома должна быть:
1s22s22p63s23p63d44s2.
Однако, на внешнем уровне атома хрома не два электрона, а один: второй электрон «провалился» на d – подуровень второго снаружи уровня, то есть на (n-1)d – подуровень. В таком случае расположение электронов у атомов хрома таково:
1s22s23s23p63d54s1.
«Провал» электрона имеет место у Cu, Nb, Mo, Ru, Rh, Ag, Au, Pt. У палладия (Pd) электроны располагаются следующим образом: 2, 8, 18, 18, 0 (в данном случае пятый энергетический уровень вообще отсутствует – оба электрона «провалились» на соседний уровень).
«Провал» электрона энергетически выгоден, так как образуются более устойчивые электронные конфигурации.
4) Правило Гунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня (p, d, f), при котором абсолютное значение суммарного спина атома максимально.
Это означает, что заселение электронами атомных орбиталей одного и того же энергетического подуровня происходит следующим образом: вначале на каждую атомную орбиталь поступает по одному электрону с одинаково направленными спинами, затем электрон с противоположным спином.
Электронная структура атома может быть изображена в виде схем размещения
электронов в квантовых (энергетических) ячейках, которые являются схематическим
изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде
прямоугольника, кружка или
![]() линейки , а электроны в этих ячейках обозначают стрелками.
линейки , а электроны в этих ячейках обозначают стрелками.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() В каждой квантовой ячейке может быть не
более двух электронов с противоположными спинами: , ,
В каждой квантовой ячейке может быть не
более двух электронов с противоположными спинами: , ,
.
В данном пособии применяют прямоугольники.
Типовая задача № 2
Как распределяются электроны в атоме ванадия ( Z = 23) по квантовым ячейкам?
Решение
Число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И.Менделеева. Ванадий расположен в четвертом периоде. Электронная формула атома ванадия следующая:
23V 1s22s22p63s23p63d34s2
Изобразим структуру электронной оболочки атома в виде схемы распределения электронов по квантовым ячейкам (электронная схема):
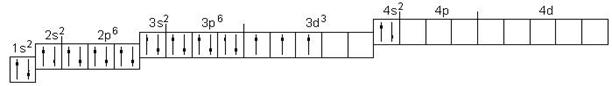
Ячейки, не заполненные электронами, называются вакантными. Подуровень 3d3, казалось бы, можно представить в двух вариантах:
![]()
Однако, правильным является тот вариант, который соответствует правилу Гунда: в пределах данного подуровня электроны располагаются так, чтобы число непарных электронов с параллельными спинами было максимальным, или суммарное спиновое число (Σms) у электронов данного подуровня должно быть максимальным.
В первом варианте: Σ ms = +1/2 +1/2 +1/2 = 3/2;
во втором варианте: Σ ms = +1/2 - 1/2 +1/2 = 1/2.
Правилу Гунда удовлетворяет первый вариант.
4 Структура периодической системы элементов
Современная формулировка периодического закона Д.И.Менделеева такова: свойства химических элементов и образуемых ими простых и сложных соединений находятся в периодической зависимости от заряда ядра их атомов.
Периодами называют ряды элементов, в пределах которых свойства изменяются последовательно. Их семь, из них первый, второй и третий называются малыми, а четвертый, пятый, шестой и седьмой – большими.
Элементы второго и третьего периодов Д.И.Менделеев назвал типическими. Свойства их закономерно изменяются от типичного металла до инертного элемента.
В шестом периоде располагаются 14 элементов с порядковыми номерами 58 - 71, называются лантаноидами, которые очень сходны с лантаном (имеют степень окисления +3, в реакциях с Н2О образуют Ме(ОН)3 и Н2) .
В седьмом периоде из двадцати трех элементов четырнадцать с порядковыми номерами 90-103 составляют семейство актиноидов. Свойства актиноидов и лантаноидов сходны.
С позиции электронного строения атома в зависимости от того, на какой энергетический подуровень поступает последний электрон атома, все элементы делят на четыре типа электронных семейств: s-, p-, d-, f- элементы.
В периодической системе по вертикали расположены группы, которые нумеруют римскими цифрами с буквами А и В: А – главная подгруппа, В – побочная.
Номер группы элемента в периодической системе определяется числом валентных электронов атомов (кроме элементов группы IB и VIIIB).
|
Валентные электроны |
ns |
n(s+p) |
ns + (n-1)d неспаренные ē |
|
Тип элемента |
s |
p |
d |
Валентными называются электроны, которые участвуют в образовании химических связей между атомами. Это наиболее слабо связанные ядром электроны.
Между положением элемента в Периодической системе и строением их атомов существует следующая взаимосвязь:
1) Атомы всех элементов одного и того же периода имеют одинаковое число энергетических уровней. Номер периода показывает число энергетических уровней в атоме и значение главного квантового числа для высшего энергетического уровня. Поскольку в атомах всех известных элементов в предельном случае заполняется (полностью или частично) семь энергетических уровней, в Периодической системе имеется семь периодов.
2) Атомы элементов одной и той же группы обладают однотипной электронной конфигурацией и сходными химическими свойствами. Деление групп на главные (группы А) и побочные (группы В) зависит от того, какой энергетический уровень (внешний или внутренний) заполняется в атоме соответствующего элемента.
Все s- и p-элементы относятся к элементам А-групп, так как в их атомах заполняется внешний энергетический уровень; все d- и f-элементы располагаются в В-группах, так как в атомах этих элементов заселяется внутренний энергетический уровень.
3) В каждом периоде, начиная с четвертого, секции s- и p- элементов разделены секцией d - элементов (в шестом и седьмом периодах еще и секцией f - элементов), поэтому d – элементы часто называют переходными.
Типовая задача № 3
С позиции электронного строения атома дайте обоснование порядковому номеру элемента марганца и его положению в Периодической системе.
Решение
Порядковый номер элемента марганца N(Mn) = 25, что совпадает с положительным зарядом ядра атома, числом протонов в ядре атома, числом электронов в атоме. Атом марганца электронейтрален, так как суммарный заряд протонов в ядре равен суммарному заряду электронов в атоме, но знаки их противоположны.
Элемент марганец находится в 4-ом периоде, то есть 25 электронов атома марганца распределены на четырех энергетических уровнях; электронная формула атома следующая: 1s22s22p63s23p63d54s2.
Элемент марганец принадлежит VII группе, что совпадает с числом валентных электронов в атоме марганца: 3d54s2.
Группа В (побочная подгруппа) указывает на то, что последний (25-ый электрон) заселяет предвнешний, (n - 1) - ый энергетический уровень
(n = 3).
Элемент марганец принадлежит d – электронному семейству, так как последний электрон поступает на d-подуровень предвнешнего энергетического уровня:
|
n = 3 |
|
|
|
|
|
|
|
|
n = 4 |
¯ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d-подуровень s-подуровень
5 Свойства атомов элементов и периодичность их изменения
В периодической системе свойства элементов, их атомная масса, валентность, химический характер изменяются периодически в известной последовательности как в горизонтальном, так и в вертикальном направлениях.
1) Атомные и ионные радиусы.
Радиус – наиболее важное свойство атома. Из-за двойственного характера электронов атомы не имеют строго определенных границ. Поэтому абсолютное значение радиуса атома определить невозможно. Можно лишь условно принять за радиус атома:
а) орбитальный радиус атома – это теоретически рассчитанное значение расстояния от ядра до наиболее удаленного от него максимума электронной плотности; орбитальный радиус является характеристикой свободного атома или иона и не зависит от природы химической связи и других факторов;
б) эффективный радиус атома, rэф – это радиус, который имеют атомы, входящие в состав реальных простых веществ. При отрыве электрона с внешнего уровня атома происходит уменьшение rэф, а в случае присоединения электрона – увеличение rэф.
В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атома, что объясняется увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда. В группах сверху вниз атомный радиус возрастает за счет возникновения новых энергетических уровней.
2) Металлы и неметаллы.
Все элементы в периодической системе делят условно на металлы и неметаллы. К неметаллическим элементам относят: Не, Ne, Ar, Kr, Xe, Rn, F, CI, Br, I, At, O, S, Se, Te, B, N, P, As, C, Si, H. Все остальные элементы считаются металлическими.
В периодической системе отчетливо видны естественные границы, относительно которых наблюдается изменение свойств элементов. I-А группа содержит типичные металлы, элементы VIII-A группы (благородные газы) – типичные неметаллы, промежуточные группы включают неметаллы (вверху таблицы элементов) и металлы (внизу таблицы элементов).
Другая граница между металлами и неметаллами соответствует элементам Be – AI – Ge – Sb – Po – это диагональная граница. Элементы самой этой границы, и примыкающие к ней, обладают одновременно как металлическими, так и неметаллическими свойствами, им свойственно амфотерное поведение.
3) Энергия ионизации.
Энергия ионизации, J, [кДж/моль] – минимальная энергия, необходимая для
отрыва наиболее слабо связанного электрона ![]() от невозбужденного атома элемента Э:
от невозбужденного атома элемента Э:
Э
+ J → Э+ +
![]() .
.
Наименьшее напряжение электрического поля, при котором происходит отрыв электрона, называется потенциалом ионизации. Величина потенциала ионизации может служить мерой большей или меньшей «металличности» элемента: чем меньше потенциал ионизации, тем легче оторвать электрон от атома, тем сильнее должны быть выражены металлические свойства элемента.
4) Сродство к электрону.
Способность атома образовывать отрицательно заряженные ионы характеризуется сродством к электрону, Е, [кДж/моль], под которым подразумевается энергетический эффект процесса присоединения электрона к нейтральному атому с превращением атома элемента Э в отрицательный ион:
Э
+ ![]() →
Э- + E.
→
Э- + E.
Энергия сродства к электрону является мерой неметаллических и косвенно окислительных свойств элементов. Наибольшим сродством к электрону обладают р – элементы VII группы.
5) Электроотрицательность.
Наиболее полную характеристику металлических и неметаллических свойств
элементов, а также способность атома данного элемента к оттягиванию на себя
электронной плотности по сравнению с другими элементами соединения, дает
величина, называемая электроотрицательностью (![]() ).
).
Электроотрицательность зависит от многих факторов: электронной структуры, наличия вакантных орбиталей, числа и вида атомов и т.д. При определении значений относительной электроотрицательности различных элементов за единицу принята электроотрицательность лития.
Согласно одному из определений (Малликен) ![]() атома может быть
выражена как полусумма его энергии ионизации и сродства к электрону:
атома может быть
выражена как полусумма его энергии ионизации и сродства к электрону:
![]() . (1.4)
. (1.4)
Чем больше электроотрицательность, тем в большей степени элемент проявляет неметаллические свойства. Наибольшей электроотрицательностью обладает фтор (ЭО(F)) = 4,0; наименьшей – цезий, франций (ЭО = 0,7). Значение ЭО металлов ≈ 1,8 и меньше.
Типовая задача № 4
По электронному строению n – го и (n – 1) – го энергетического
уровня атома (4s24p64d25s2)
установите тип электронного семейства, а также запишите химическую формулу
оксида данного элемента в его максимальной степени окисления.
Решение
В атоме данного элемента происходит заселение d – подуровня (n-1) – го энергетического уровня, следовательно, это d – элемент.
|
|
N = 4 |
¯ |
|
¯ |
¯ |
¯ |
|
|
|
|
|
|
; n = 5 |
¯ |
В атоме данного элемента 5 энергетических уровней, что указывает на его принадлежность 5 периоду, а четыре валентных электрона на внешнем и предвнешнем энергетических уровнях означают группу IVB. Эти данные соответствуют положению элемента циркония Zr в Периодической системе.
Согласно данной электронной формуле, в атоме 4 валентных электрона (4d25s2), следовательно, максимальная степень окисления элемента равна +4.
На основании приведенных данных запишем формулу оксида: ZrO2.
6 Задания для самостоятельной работы
6.1 Сколько протонов и нейтронов содержат ядра изотопов атома «а» с соответствующими массовыми числами «б».
6.2 Для атома с электронной структурой «в» найдите значения четырех квантовых чисел n, l, ml, ms, определяющие его последний электрон.
6.3 Распределите электроны по квантовым ячейкам в атоме элемента «г».
6.4 С позиции электронного строения атома дайте обоснование порядковому номеру элемента «д» , номеру периода, номеру группы, группе А или В нахождения его в Периодической системе.
6.5 Внешний и предвнешний уровень атома элемента имеет вид «е».
К какому электронному семейству относится данный элемент? Какова формула оксида данного элемента в его максимальной степени окисления?
|
Вт |
«а» |
«б» |
«в» |
«г» |
«д» |
«е»
|
|
1 |
Zn |
65 и 66 |
1s22s2p2 |
Be |
Na |
4s2p6d25s2 |
|
2 |
Ca |
42 и 40 |
1s22s2p4 |
Mn |
Li |
2s2p63s2p1 |
|
3 |
K |
39 и 41 |
1s22s2p63s2 |
B |
V |
1s22s2p1 |
|
4 |
В |
10 и 11 |
1s22s2p63s2p2 |
Al |
Ca |
3s2p6d14s2 |
|
5 |
Sr |
87 и 88 |
1s22s2p63s2p4 |
C |
Ba |
5s2p6d16s2 |
|
6 |
Ba |
136 и 138 |
2s2p63s2p6d2 |
Si |
Sr |
3s2p6d24s2 |
|
7 |
С |
12 и 13 |
2s2p63s2p6d4 |
P |
Cs |
3s2p6d34s2 |
|
8 |
Sn |
116 и 118 |
2s2p63s2p6d104s2 |
S |
Rb |
4s2p6d35s2 |
|
9 |
N |
14 и 15 |
3s2p6d104s2p2 |
Cs |
Mn |
3s2p6d54s2 |
|
10 |
О |
16 и 18 |
3s2p6d104s2p4 |
Br |
Be |
4s2p65s2 |
|
11 |
Al |
26 и 27 |
3s2p6d104s2p65s2 |
Ge |
Al |
4s2p6d55s2 |
|
12 |
Ga |
68 и 70 |
3s2p6d104s2p65s1 |
Sn |
Br |
1s22s2p2 |
|
13 |
Br |
79 и 81 |
3s2p6d104s2p5 |
Ni |
Fe |
2s2p63s2p2 |
|
14 |
Tс |
97 и 98 |
3s2p6d104s2p3 |
Mg |
Co |
4s2p6d105s2p1 |
|
15 |
O |
16 и 18 |
3s2p6d104s2p1 |
B |
K |
5s2p6d106s2p2 |
|
16 |
Si |
28 и 30 |
2s2p63s2p6d104s1 |
As |
F |
1s22s2p3 |
|
17 |
СI |
35 и 37 |
1s22s2p63s2p6d5 |
Ga |
Mo |
2s2p63s2p3 |
|
18 |
S |
32 и 33 |
1s22s2p63s2p6d3 |
C |
Zn |
3s2p6d104s2p3 |
|
19 |
V |
50 и 52 |
1s22s2p63s2p6d1 |
Si |
Cl |
4s2p6d105s2p3 |
|
20 |
Ni |
58 и 60 |
1s22s2p63s2p5 |
Ge |
Pb |
2s2p63s2p4 |
|
21 |
Fe |
55 и 56 |
1s22s2p63s2p3 |
Sb |
Sn |
3s2p6d104s2p4 |
|
22 |
Ge |
72 и 73 |
1s22s2p63s2p1 |
Pb |
Ni |
4s2p6d105s2p4 |
|
23 |
Sb |
121 и 122 |
1s22s2p63s1 |
S |
N |
2s2p63s2p5 |
|
24 |
Cr |
51 и 52 |
1s22s2p5 |
Cl |
O |
3s2p6d104s2p5 |
|
25 |
Ti |
47 и 48 |
1s22s2p3 |
Br |
S |
2s2p63s2p2 |
Тема 2
Химическая кинетика. Химическое равновесие
Химическая кинетика изучает скорость химической реакции и механизм ее протекания.
1 Понятие о скорости химической реакции
Скоростью химической реакции называется число благоприятных столкновений реагирующих частиц, произошедших в единицу времени. Любая химическая реакция это качественный скачок, когда из одних веществ образуются другие.
По характеру взаимодействия реагирующих веществ различают гомогенные и гетерогенные реакции.
Гомогенные реакции – это реакции, при которых реагирующие вещества не разделены граничной поверхностью, т.е. находятся в одном фазовом состоянии (твердое, жидкое, газообразное); процесс осуществляется по всему объему системы.
Скорость гомогенной химической реакции определяется изменением концентрации одного из веществ реакции в единицу времени, выражается в моль /л × сек.
![]() ,
(2.1)
,
(2.1)
где ![]() - изменение количества
вещества х ,
- изменение количества
вещества х , ![]() ;
;
![]() - изменение времени,
- изменение времени, ![]() ;
; ![]() - объем
системы.
- объем
системы.
![]()
![]() ,
(2.2)
,
(2.2)
где ![]() - изменение
концентрации вещества
- изменение
концентрации вещества ![]() ,
, ![]() .
.
Гетерогенные реакции – это реакции, при которых реагирующие вещества разделены граничной поверхностью, т.е. вещества находятся в разных фазовых состояниях; процесс осуществляется на поверхности раздела фаз между реагентами.
Скорость гетерогенной реакции определяется изменением количества вещества реакции, произошедшего в единицу времени на поверхности раздела фаз.
![]() =
=
![]() , (2.3)
, (2.3)
где ![]() – площадь поверхности
раздела фаз между реагентами.
– площадь поверхности
раздела фаз между реагентами.
Механизм реакции отражает подробную картину её протекания. По механизму различают простые и сложные реакции.
Простыми называют реакции, протекающие в одну стадию, или «элементарные реакции».
Сложными называют реакции, протекающие через несколько стадий. В химических уравнениях сложных реакций отражается не подробная картина ее протекания, а лишь фиксируются исходные вещества (реагенты) и конечные продукты этого процесса. Большинство химических реакций протекает по многостадийному механизму.
Например, даже
такая реакция, как H2 + J2
![]() 2HJ протекает через ряд стадий:
2HJ протекает через ряд стадий:
 (промежуточный
активированный комплекс),
(промежуточный
активированный комплекс),
H2
+ J2 ![]() 2HJ (суммарное уравнение).
2HJ (суммарное уравнение).
Основными факторами, влияющими на скорость химической реакции, являются природа реагирующих веществ, их концентрация, давление (если в реакции участвует газ), температура, катализатор, площадь поверхности раздела фаз (гетерогенные реакции).
2 Влияние концентрации реагирующих веществ
Для элементарных реакций справедлив закон действующих масс, открытый Гульдбергом и Вааге: при постоянной температуре скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Если реакция протекает по многостадийному механизму и, одна из стадий много медленнее других, то она и определяет скорость процесса в целом, потому её называют лимитирующей стадией.
Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называют кинетическим уравнением реакции. Для элементарной реакции, записанной в общем виде:
![]()
кинетическое уравнение имеет вид:
![]() ,
(2.4)
,
(2.4)
где ![]() –
молярные концентрации реагирующих веществ;
–
молярные концентрации реагирующих веществ;
![]() –
стехиометрические коэффициенты реагирующих веществ;
–
стехиометрические коэффициенты реагирующих веществ;
![]() – коэффициент
пропорциональности, константа скорости.
– коэффициент
пропорциональности, константа скорости.
Физический смысл
константы скорости: ![]() если
если
![]()
Константа
скорости реакции ![]() зависит
от природы реагирующих веществ, температуры среды, присутствия
катализатора, а также площади поверхности раздела фаз (если реакция
гетерогенная), но не зависит от концентрации реагентов. Очевидно, что для
каждой реакции при постоянной температуре её константа скорости будет величиной
постоянной. Следовательно, зная k, можно сравнить
скорости химического взаимодействия различных веществ: чем больше k, тем быстрее реагируют данные вещества.
зависит
от природы реагирующих веществ, температуры среды, присутствия
катализатора, а также площади поверхности раздела фаз (если реакция
гетерогенная), но не зависит от концентрации реагентов. Очевидно, что для
каждой реакции при постоянной температуре её константа скорости будет величиной
постоянной. Следовательно, зная k, можно сравнить
скорости химического взаимодействия различных веществ: чем больше k, тем быстрее реагируют данные вещества.
Закон действующих масс не учитывает реагирующие вещества, находящиеся в твердом состоянии, а также жидкости, взятые в избытке, так как в ходе реакции изменения концентрации этих веществ практически не происходит.
Химические реакции подвергают кинетической классификации по признаку молекулярности и по порядку реакции.
Молекулярность (М) химической реакции определяется числом молекул, участвующих в элементарном акте. По молекулярности различают:
а) мономолекулярные – в элементарном акте участвует одна молекула:
А → В, А → В + Д…;
кинетическое уравнение таких реакций имеет вид: υ = k · c;
б) бимолекулярные реакции – в элементарном акте участвуют две молекулы различного или одинакового вида:
А + В → Д , 2А → Д + С…,
кинетическое уравнение: υ = k · c1 · с2;
в) тримолекулярные реакции – в элементарном акте участвуют три молекулы: А + В + С → Д , 2А + В → С …,
кинетическое уравнение: υ = k · c1 · с2 · с3 .
Вероятность тетрамолекулярных реакций и более практически равна нулю.
В химической кинетике наряду с молекулярностью вводят понятие порядка реакции (n). Порядок химической реакции в целом, а также порядок по каждому отдельному реагенту, определяется кинетическим уравнением реакции и равен сумме показателей степеней при концентрациях реагентов в этом уравнении. Для реакций первого порядка υ = k · c , для реакции второго порядка υ = k · c1 · с2 . В ряде случаев порядок реакции выражается дробным числом (для реакций, протекающих в несколько стадий) или равен нулю (для реакций, протекающих на поверхности твердых тел).
Таблица 1 - Примеры записи уравнений скорости химических реакций
|
Химическая реакция |
Кинетическое уравнение |
Порядок реакции |
|
2А(ТВ) + 2В(ag) = С А(Г) + Д(ТВ) = В А(Ж) ИЗБ = Г 2А(г)+В(г)=С сложная реакция |
υ = k · c2(В) υ = k · c (А) υ = k υ = k · c2(А) · с(В) |
n = 2, реакция II-го порядка n = 1, реакция I-го порядка n = 0 , реакция нулевого порядка n = 3, реакция III-го порядка |
Численно молекулярность и порядок реакции совпадают, если реакция является элементарной (одностадийной) и гомогенной. Чаще всего они не совпадают вследствие сложного механизма реакции.
Типовая задача №1
Для химической реакции 2NО(г) + О2(г) = 2NО2(г) установить молекулярность, порядок и вычислить во сколько раз изменится скорость реакции, если концентрацию реагентов увеличить в три раза.
Решение
а) Установим молекулярность реакции (М). Из стехиометрического уравнения реакции, следует, что к акту химического взаимодействия приводит одновременное соударение трех молекул (две молекулы вещества NО и одна молекула вещества О2), следовательно, данная реакция является тримолекулярной, М = 3.
б) Определим порядок реакции (n). Для этого необходимо вывести уравнение скорости реакции, применив закон действующих масс (2.4):
υ = k · c2(NO) · c(O2)
Данная реакция является реакцией третьего порядка (n = 3), так как в кинетическом уравнении сумма показателей степеней при концентрациях реагентов равен трем (2 + 1).
в) Вычислим во сколько раз изменится скорость реакции. Для этого запишем кинетические уравнения скоростей реакции:
υ1 = k · c2(NO) · c(O2), υ2 = k · (3c)2(NO) · 3c(O2).
Тогда ![]() = 27.
= 27.
Ответ: Скорость реакции увеличится в 27 раз.
3 Влияние температуры на скорость реакции
Многочисленные опыты показывают, что при повышении температуры скорость большинства химических реакций существенно увеличивается. Зависимость скорости реакции от температуры определяется правилом Вант–Гоффа: при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2 - 4 раза.
Математически эта зависимость выражается соотношением:
![]() , (2.5)
, (2.5)
где ![]() - скорости реакции
соответственно при начальной
- скорости реакции
соответственно при начальной ![]() и конечной
и конечной ![]() температурах,
температурах, ![]() ;
;
g - температурный коэффициент скорости реакции:
![]() . (2.6)
. (2.6)
Физический смысл
температурного коэффициента: ![]() показывает во сколько раз увеличится
скорость реакции с повышением температуры на 10 градусов.
показывает во сколько раз увеличится
скорость реакции с повышением температуры на 10 градусов.
Правило Вант-Гоффа является приближенным и применимо для ориентировочной оценки влияния температуры на скорость реакции.
Более точное описание зависимости скорости реакции от температуры осуществимо в рамках теории активации Аррениуса:
![]() , (2.7)
, (2.7)
где ![]() – постоянная величина;
– постоянная величина;
![]() - универсальная газовая
постоянная, равная 8,31 Дж/моль∙К;
- универсальная газовая
постоянная, равная 8,31 Дж/моль∙К;
![]() - температура по шкале
Кельвина;
- температура по шкале
Кельвина;
![]() - энергия активации.
- энергия активации.
Сильное увеличение скорости реакции с возрастанием температуры объясняет теория активации, согласно которой в химическое взаимодействие вступают только активные частицы, обладающие энергией, достаточной для осуществления данной реакции. Наименьшая энергия, которой должна обладать частица вещества для вступления в химическую реакцию, называется энергией активации. Ее величина определяется опытным путем, обозначается буквой Еа и обычно выражается в кДж/моль.
Типовая задача №2
Во сколько раз изменится скорость реакции при изменении температуры от 200С до 900С, если температурный коэффициент равен 2?
Решение
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа (3.5):
![]() ,
,
а) Запишем температуру реакции по шкале Кельвина:
Т1
= t![]() C + 273 = 200C + 273 = 293K;
C + 273 = 200C + 273 = 293K;
T2 = t![]() C + 273 = 900C + 273 = 363K;
C + 273 = 900C + 273 = 363K;
![]() T = T2 – T1 = 363 -293 = 70K.
T = T2 – T1 = 363 -293 = 70K.
б) Следовательно, ![]() =
= ![]() .
.
Ответ: Скорость реакции увеличится в 128 раз.
4 Влияние катализатора на скорость химической реакции
Катализаторы – это вещества, которые изменяют скорость реакции, а сами к концу процесса остаются неизменными как по составу, так и по массе. Явление ускорения химических реакции благодаря присутствию катализаторов носит название катализа, а замедления – ингибирования.
Существует два вида катализа – гомогенный и гетерогенный: при гомогенном катализе исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой); при гетерогенном – газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Действие катализатора, как теперь установлено, связано с понижением энергии активации химического процесса в присутствии катализатора: катализатор участвует в одной из промежуточных элементарных стадий полного процесса, вступая в реакцию с одним из реагентов этой реакции, образуя с ним активированный комплекс, обладающий меньшим значением Еа.
Количественное
влияние катализатора на скорость реакции определяется уравнением Аррениуса,
математическое преобразование которого отражает взаимосвязь между значениями
констант скоростей в присутствии катализатора ![]() и без него
и без него ![]() :
:
![]() ,
(2.8)
,
(2.8)
где ![]() - уменьшение энергии
активации в присутствии катализатора;
- уменьшение энергии
активации в присутствии катализатора;
![]() и
и ![]() - константы скоростей реакции без
катализатора и в его присутствии.
- константы скоростей реакции без
катализатора и в его присутствии.
Типовая задача №3
Во сколько раз
возрастет скорость некоторой реакции в присутствии катализатора, если ![]() без катализатора и в
присутствии катализатора соответственно равна 184 и 108 кДж/моль; T = 1000K.
без катализатора и в
присутствии катализатора соответственно равна 184 и 108 кДж/моль; T = 1000K.
Решение
а) Определим разность энергий активации:
![]() .
.
б) Рассчитаем по уравнению (3.8) отношение констант скоростей реакций:
![]() , следовательно,
, следовательно, ![]() .
.
Ответ: скорость реакции возросла в 9500 раз.
5 Основные понятия и признаки химического равновесия
Реакции, которые протекают только в одном направлении и идут до конца, называются необратимыми.
2Na(тв) + 2НОН(ж) ® Н2(г) + 2NaOH(p-p)
Реакции, идущие одновременно в двух противоположных направлениях (прямом и обратном) называются обратимыми.
N2(г) + 3H2(г) Û 2NH3(г)
1) В ходе обратимой реакции устанавливается подвижное химическое равновесие, при котором скорости прямого и обратного процессов равны:
![]() .
.
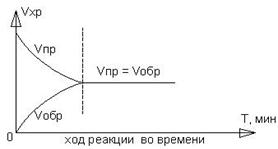
2) В момент наступления равновесия в обратимой системе концентрации всех веществ равновесной системы остаются неизменными. Такие концентрации называются равновесными, обычно их обозначают при помощи квадратных скобок, например, [N2], [H2], [NH3].

3) Химическое равновесие является динамическим, то есть продолжают протекать как прямая, так и обратная реакция, но с равными скоростями.
4) Каждое химическое равновесие устанавливается при определенных значениях концентрации, температуры, давления. Изменение одного из этих условий влечет за собой смещение химического равновесия и установление нового химического равновесия.
6 Закон действующих масс для равновесной системы
Химическое равновесие называют гомогенным, если между его участниками нет граничной поверхности раздела фаз.
N2(г) + 3Н2(г) ![]() 2NH3(г).
2NH3(г).
Если между участниками равновесной химической системы есть граница раздела, то такое равновесие называется гетерогенным.
СаСО3(тв) ![]() СаО(тв) + СО2(г).
СаО(тв) + СО2(г).
Связь между равновесными концентрациями реагентов и продуктов реакции выражает закон действующих масс для равновесной системы: отношение произведения равновесных концентраций продуктов к произведению равновесных концентраций реагентов, возведенных в степени стехиометрических коэффициентов, является постоянной величиной при неизменной температуре. Эта постоянная величина называется константой равновесия К.
Для гипотетической обратимой гомогенной реакции:
mA + nB Û pC + gD
закон действующих масс математически описывается следующим выражением:
![]() или
или ![]() ,
(2.9)
,
(2.9)
где [A], [B], [C], [Д] – равновесные молярные концентрации соответствующих веществ (моль/л);
m, n, p, g – стехиометрические коэффициенты в уравнении реакции;
k1, k2 – константы скоростей прямой и обратной реакций.
В выражение константы равновесия К не включают концентрации веществ, находящихся в твердой фазе, а также концентрации жидкостей, взятых в избытке, так как их концентрации являются постоянными величинами.
Константа химического равновесия зависит от природы реагирующих веществ и температуры среды, но не зависит от концентрации веществ и присутствия катализатора.
Константа равновесия определяет глубину протекания процесса к моменту достижения равновесного состояния. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
Типовая задача №4
Запишите математическое выражение константы химического равновесия для следующих химических процессов:
а) 2CO(г)
+ О2(г) ![]() 2СО2(г);
2СО2(г);
б) Fe2O3(тв) + СО(г) ![]() 2FeO(тв)
+ СО2(г);
2FeO(тв)
+ СО2(г);
в) Н2СО3(р-р)
![]() Н+(р-р)
+ НСО
Н+(р-р)
+ НСО![]() (р-р).
(р-р).
Решение
а) 2СО(г)
+ О2(г) ![]() 2СО2(г)
– гомогенная обратимая химическая реакция.
2СО2(г)
– гомогенная обратимая химическая реакция.
В соответствии с законом действующих масс для равновесной системы (3.9):
Kc = ![]() или Кр =
или Кр =
![]() .
.
Кс – константа химического равновесия, выраженная через равновесные концентрации веществ.
Кр – константа химического равновесия, выраженная через парциальные давления газов.
б) Fe2O3(тв) + СО(г) ![]() 2FeO(тв)
+ СО2(г) – гетерогенная обратимая химическая реакция.
2FeO(тв)
+ СО2(г) – гетерогенная обратимая химическая реакция.
В выражении константы химического равновесия не учитываем концентрации твердых веществ:
Кс = ![]() или
Кр =
или
Кр = ![]() .
.
в) Н2СО3(р-р)
![]() Н
Н![]() + НСО
+ НСО![]() – процесс
электролитической диссоциации.
– процесс
электролитической диссоциации.
В растворе любого электролита за счет процесса электролитической диссоциации устанавливается гомогенное химическое равновесие между недиссоциированными молекулами и ионами. Константу равновесия такого процесса называют константой электролитической диссоциации Кд:
Kд = ![]() .
.
7 Смещение химического равновесия. Принцип Ле-Шателье
Изменение условий (температура, давление, концентрация), при которых система находится в состоянии химического равновесия (υпр=υобр), вызывает нарушение равновесия в результате неодинакового изменения скоростей прямой и обратной реакции (υпр ≠ υобр). С течением времени в системе устанавливается новое химическое равновесие, соответствующее новым условиям. Переход из одного равновесного состояния в другое называется сдвигом или смещением химического равновесия.
Направление, в котором смещается равновесие, определяется принципом Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменение Т, Р, С), то равновесие смещается в направлении, ослабляющим данное воздействие.
Рассмотрим применение принципа Ле-Шателье к различным типам воздействия.
1) Влияние изменения концентрации веществ на смещение химического равновесия определяется законом действующих масс (2.9). Из него следует, что увеличение концентрации реагентов или уменьшение концентрации продуктов увеличивает скорость прямой реакции, т.е. смещает равновесие вправо и, наоборот, уменьшение концентрации реагентов или увеличение концентрации продуктов смещает равновесие влево.
 (2.10)
(2.10)
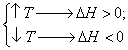
2) Влияние изменения температуры на смещение химического равновесия определяется тепловым эффектом реакции DН. Напомним, что если DН<О, химическая реакция – экзотермическая (теплота выделяется в окружающую среду); если DН>О, то химическая реакция эндотермическая (теплота поглощается из окружающей среды).
Повышение температуры смещает химическое равновесие в направлении эндотермической реакции и, наоборот, понижение температуры смещает равновесие в направлении экзотермического процесса.
 (2.11)
(2.11)
![]()
![]() N2 + 3H2
↔ 2NH3, ΔH
= – 22 кДж.
N2 + 3H2
↔ 2NH3, ΔH
= – 22 кДж.
![]()
3) Влияние давления на смещение химического равновесия рассматривается в тех случаях, если один из участников равновесной системы является газообразным веществом и объем газовой смеси неодинаков в обеих частях обратимой реакции.
Влияние давления на смещение химического равновесия определяется изменением объема газообразных веществ в ходе реакции. А, именно, повышение давления смещает равновесие в сторону той реакции, в ходе которой уменьшается объем газов и, наоборот, уменьшение давления приводит к смещению равновесия в том направлении, в ходе которого увеличивается объем газов.
 (2.12)
(2.12)
![]()
![]() N2 + 3H2
↔ 2NH3, ΔH
= - 22 кДж.
N2 + 3H2
↔ 2NH3, ΔH
= - 22 кДж.
V = 4 моль V = 2 моль
![]()
4) Влияние катализатора одинаково ускоряет как прямую, так и обратную реакцию, поэтому на смещение равновесия влияния не оказывает, а только способствует более быстрому его достижению.
Типовая задача №5
На примере обратимой реакции:
СО(г) + Н2О(ж)изб ![]() СО2(г) + Н2(г),
СО2(г) + Н2(г),
![]()
покажите, в каком направлении смещается равновесие системы при понижении температуры среды, повышении давления системы, уменьшении концентрации продуктов реакции.
Решение
а) Понижение температуры среды.
СО(г) + Н2О(ж)изб ![]() СО2(г) + Н2(г),
СО2(г) + Н2(г), ![]() .
.
ΔН<0
Прямая реакция является эндотермической реакцией (ΔН>0), тогда обратная реакция – экзотермическая (ΔН<0). Согласно принципа Ле-Шателье (2.11) понижение температуры сместит равновесие по направлению экзотермической реакции, то есть влево, в сторону реагентов.
б) Повышение давления системы.
![]()
![]()
![]() ,
, ![]() .
.
Согласно принципа Ле-Шателье (2.12), повышение давления системы сместит равновесие в сторону уменьшения объема газовой смеси (в сторону меньшего числа моль газов), то есть влево, в сторону реагентов.
в) Уменьшение концентрации продуктов реакции:
СО(г) + Н2О(ж)изб ![]() СО2(г) + Н2(г),
СО2(г) + Н2(г),
![]() .
.
В соответствии с принципом Ле-Шателье (2.10) уменьшение концентрации продуктов (с(СО2), с(Н2)) реакции приведет к смещению равновесия вправо, в сторону повышения концентрации продуктов.
8 Задания для самостоятельной работы
8.1 Запишите математическое выражение скорости реакции «а». Во сколько раз изменится скорость реакции «а», если концентрацию каждого реагента увеличивать в «б» раз. Что такое молекулярность и порядок реакции? Чему они равны для реакции «а»?
Ответ: Скорость реакции изменится в «в» раз.
8.2 Во сколько раз изменится скорость некоторой реакции «а» при изменении температуры от «г» до «д»0С, если температурный коэффициент реакции равен «е». Ответ: Скорость реакции изменится в «ж» раз.
|
Вт |
«а» |
«б» |
«в» |
«г»
|
|
1 |
2Fе(тв) + 3Cl2(г) = 2FeCl3(тв) |
3 |
27 |
120 |
|
2 |
N2(г)+O2(г) = 2NO(г) |
2 |
4 |
60 |
|
3 |
CO2(г) + C(тв) = 2СО(г) |
3 |
3 |
70 |
|
4 |
Н2(г) +Cl2(г) = 2HCl(г) |
4 |
16 |
50 |
|
5 |
2NO(г) + О2(г) = 2NO2(г) |
2 |
8 |
100 |
|
6 |
3SO2(г) +Н2О(ж)изб = 2H2SO4(р-р) + S(тв) |
2 |
8 |
110 |
|
7 |
Н2(г) + Br2(г) = 2HBr(г) |
3 |
9 |
10 |
|
8 |
2NO2(г) + 4Cu(тв) = N2(г) + 4CuO(тв) |
3 |
9 |
25 |
|
9 |
SO2(г) + PbO2(тв) = PbSO4(тв) |
3 |
3 |
18 |
|
10 |
H2SO4(р-р) + Zn(тв) = ZnSO4(р-р) + H2(г) |
4 |
4 |
100 |
|
11 |
NiO(тв) + Н2(г) = Ni(тв) + Н2О(пар) |
4 |
4 |
90 |
|
12 |
Сl2(г) + Н2(г) = 2HCl(г) |
4 |
16 |
80 |
|
13 |
HCl(г) + NH3(г) = NH4Cl(тв) |
4 |
16 |
70 |
|
14 |
2K(тв) + 2Н2О(ж) = 2КОН(р-р) + Н2(г) |
3 |
9 |
60 |
|
15 |
Be(OH)2(тв) +2HCI(р-р)= BeCl2(р-р)+2Н2О(ж) |
3 |
9 |
110 |
|
16 |
N2O5(г) + Н2О(ж) = 2HNO3(р-р) |
4 |
16 |
120 |
|
17 |
H2O2(р-р) + Na2SO3(р-р) = Na2SO4(р-р) + Н2О |
4 |
16 |
100 |
|
18 |
CuO(тв) + 2НCl(р-р) = 2CuCl2(р-р) + Н2О(ж) |
4 |
16 |
95 |
|
19 |
2NO(г) + О2(г) = 2NO2 |
3 |
27 |
85 |
|
20 |
PbO(тв) + СО(г) = Pb(тв) + СО2(г) |
3 |
3 |
75 |
|
21 |
3Н2(г) + N2(г) = 2NH3(г) |
3 |
81 |
65 |
|
22 |
СаС2(тв) + 2Н2О(ж) = Са(ОН)2(тв) + С2Н2(г) |
3 |
9 |
68 |
|
23 |
2СО(г) + О2(г) = 2СО2(г) |
4 |
64 |
68 |
|
24 |
Н2СО3(р-р)+ NaOH(р-р) = Na2CO3(р-р)+ 2Н2О |
4 |
64 |
58 |
|
25 |
3NO2(г) + Н2О(ж) = 2НNO3(р-р) + NO(г) |
4 |
256 |
48 |
8.3 Во сколько раз увеличится скорость некоторой реакции в присутствии катализатора, если Еа без катализатора и в присутствии катализатора соответственно равны «з», «и» кДж/моль; температура среды «к» Кельвина. Ответ: скорость реакции возросла в «л» раз.
|
Вт |
«д» |
«е» |
«ж»
|
«з» |
«и» |
«к» |
«л» |
|
1 |
80 |
2 |
16 |
180 |
140 |
600 |
3,1· 103 |
|
2 |
80 |
2 |
4 |
184 |
58 |
1000 |
3,9· 106 |
|
3 |
90 |
2 |
4 |
244 |
121 |
1000 |
2,7· 106 |
|
4 |
60 |
3 |
3 |
244 |
136 |
1000 |
4,5· 105 |
|
5 |
90 |
3 |
3 |
331 |
230 |
1000 |
1,9· 105 |
|
6 |
80 |
2 |
8 |
250 |
200 |
1000 |
4,1· 102 |
|
7 |
40 |
2 |
8 |
105 |
86 |
1000 |
9,9 |
|
8 |
55 |
2 |
8 |
180 |
100 |
1000 |
1,5· 104 |
|
9 |
38 |
3 |
9 |
75 |
56 |
450 |
1,6· 102 |
|
10 |
80 |
2 |
4 |
120 |
80 |
720 |
8,1· 102 |
|
11 |
80 |
3 |
3 |
130 |
70 |
600 |
1,7· 105 |
|
12 |
90 |
3 |
3 |
95 |
60 |
500 |
4,6· 103 |
|
13 |
60 |
2 |
2 |
300 |
250 |
400 |
3,5· 106 |
|
14 |
80 |
2 |
4 |
200 |
150 |
1000 |
4,1· 102 |
|
15 |
80 |
2 |
8 |
250 |
210 |
430 |
7,4· 104 |
|
16 |
80 |
2 |
16 |
210 |
170 |
530 |
8,9· 103 |
|
17 |
80 |
3 |
9 |
170 |
120 |
580 |
3,2· 104 |
|
18 |
75 |
3 |
9 |
200 |
180 |
300 |
3,1· 103 |
|
19 |
75 |
3 |
3 |
180 |
150 |
300 |
1,7· 105 |
|
20 |
65 |
3 |
3 |
70 |
50 |
500 |
1,23· 102 |
|
21 |
45 |
2 |
4 |
200 |
170 |
400 |
8,4· 103 |
|
22 |
98 |
2 |
8 |
180 |
130 |
500 |
1,7· 105 |
|
23 |
88 |
3 |
9 |
260 |
240 |
500 |
1,23· 102 |
|
24 |
88 |
2 |
8 |
100 |
70 |
500 |
1,4· 103 |
|
25 |
68 |
3 |
9 |
120 |
80 |
298 |
1,05· 107 |
8.4 Для равновесной системы «м» запишите математическое выражение константы химического равновесия. Укажите, что собой представляют числитель и знаменатель этого выражения .
8.5 Пользуясь принципом Ле-Шателье, определите направление смещения химического равновесия «м» при изменении (повышении [↑] или понижении [↓]):
«н» - температуры среды (Т);
«о» - давления системы (Р);
«п» - концентрации участников равновесной системы (с).
|
Вт |
«м» |
∆Н, [кДж] |
изменение |
||
|
«н» |
«о |
«п»
|
|||
|
1 |
HCIO(р-р)
|
+19,87 |
↓Т |
- |
↑с(HClО) |
|
2 |
N2(г) + 3Н2(г)
|
-92,4 |
↑Т |
↓Р |
↑с(NH3) |
|
3 |
AgCl(тв)
|
+65,48 |
↓Т |
- |
↑с(Cl-) |
|
4 |
S2-(р-р)
+
НОН(ж)иэб
|
+5,61 |
↓Т |
- |
↓с(ОН-) |
|
5 |
FeO(тв) + СО(г)
|
+19,33 |
↓Т |
↑Р |
↓с(СО) |
|
6 |
NH4OH(р-р)
|
+3,87 |
↑Т |
- |
↓с(NH4+) |
|
7 |
2SO2(г)+ О2(г)
|
-284,2 |
↑Т |
↓Р |
↑с(SO3) |
|
8 |
CaCO3(кр)
|
+12,47 |
↓Т |
- |
↑с(Са2+) |
|
9 |
СО32-(р-р)+НОН(ж)изб |
+41,81 |
↑Т |
- |
↓с(ОН-) |
|
10 |
С(тв)+
СО2(г) |
+172,5 |
↓Т |
↑Р |
↓с(СО2) |
|
11 |
Н2S(р-р)
|
+3,03 |
↑Т |
- |
↑с(Н2S) |
|
12 |
2СО(г)
+ О2(г)
|
-135,2 |
↑Т |
↓Р |
↑с(О2) |
|
13 |
AgJ(тв)
|
+113,0 |
↓Т |
- |
↑с(Ag+) |
|
14 |
NH4+(р-р)+НОН(ж)изб |
+51,95 |
↑Т |
- |
↓с(ОН-) |
|
15 |
NH4Cl(тв)
|
+177,1 |
↓Т |
↑Р |
↓с(HCl) |
|
16 |
HS-(р-р)
|
+50,21 |
↑Т |
- |
↓с(НS-) |
|
17 |
СО(г)
+ 2Н2(г) |
-128,05 |
↓Т |
↓Р |
- |
|
18 |
СаСО3(тв)
|
+178,0 |
↓Т |
↑Р |
↓с(СО2) |
|
19 |
SO32-(р-р)
+НОН(ж)изб |
+66,11 |
↑Т |
- |
↑с(HSО3-) |
|
20 |
HCO-3(р-р)
|
+14,64 |
↑Т |
- |
↓с(СО22-) |
|
21 |
CdS(тв)
|
+114,3 |
↓Т |
- |
↑с(Сd2+) |
|
22 |
C(тв)
+ О2(г)
|
- 402,2 |
↓Т |
↓Р |
↓с(О2) |
|
23 |
Fe3O4(тв) + СО(г)
|
+34,55 |
↑Т |
↑Р |
↑с(СО) |
|
24 |
PCl5(г)
|
+92,59 |
↓Т |
↓Р |
↓с(РCl3) |
|
25 |
BaCO3(тв)
|
+10,16 |
↑Т |
- |
↑с(Ва2+) |
Тема 3
Растворы электролитов
1 Сильные и слабые электролиты
Полный или частичный распад растворенного вещества на сольватированные ионы под действием полярных молекул растворителя называется электролитической диссоциацией (ЭД).
По способности к электролитической диссоциации химические соединения делят на электролиты и неэлектролиты. Электролитическая диссоциация обуславливает ионную проводимость растворов.
Неэлектролиты – вещества, неспособные обуславливать электропроводность систем ни в растворенном, ни в расплавленном состоянии. К неэлектролитам относятся очень немногие органические вещества: спирты, кетоны, эфиры, сахара и т.д.
Электролитами называются вещества, диссоциирующие на ионы в воде или других полярных растворителях. Растворы и расплавы электролитов проводят электрический ток.
В зависимости от того, насколько полно протекает процесс электролитической диссоциации различают сильные электролиты и слабые электролиты.
Таблица 2 - Сильные и слабые электролиты
|
Сильные электролиты |
Слабые электролиты |
|
Растворимые в воде основания (щелочи): LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2. Исключение: NH4OH. Сильные кислоты: HNO3, H2SO4, H2S2O8, HClO4, HMnO4. Бескислородные кислоты: HCI, HBr, HI. Практически все простые соли. Исключение: ZnCI2, ZnI2, CdCl2, CdI2, HgCl2, Hg(CN)2, Fe(CNS)3. Комплексные соединения, содержащие внешнюю сферу: [Cu(NH3)4]SO4, Na3[Al(OH)6] …
|
Малорастворимые в воде основания: Mn(OH)2, Fe(OH)2, Co(OH)2, Ni(OH)2 ... Все амфотерные гидроксиды: Be(OH)2, Al(OH)3, Zn(OH)2 ... Слабые оксокислоты: H2CO3, H2SiO3, H2S2O3, H3BO3, H3PO3, HNO2, HГалO, HГалO2. Бескислородные кислоты: HF, H2S, HCN, HSCN. Внутренние сферы комплексных солей: [Cu(NH3)4]2+, [Al(OH)6]3- ... |
|
H3PO4, H2SO3, Mg(OH)2 - электролиты средней силы H2O, CH3COOH - слабые электролиты |
|
1.1 Степень электролитической диссоциации
Электролитическая диссоциация – процесс обратимый: в растворах электролитов наряду с их ионами присутствуют и непродиссоциированные молекулы. Поэтому растворы электролитов количественно характеризуются степенью электролитической диссоциации α, которая представляет собой отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N):
![]() или
или ![]() , (3.1)
, (3.1)
где с – молярная концентрация, моль/л.
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах.
1.2 Константа электролитической диссоциации
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы, слабые электролиты диссоциируют частично. В последнем случае процесс диссоциации является обратимым. А к любому обратимому процессу применим закон действующих масс.
В растворе слабого электролита (мд.с) из-за его частичной электролитической диссоциации (ЭД) устанавливается химическое равновесие между образовавшимися ионами и оставшимися непродиссоциированными частицами ( молекулами или сложными ионами ). Константу равновесия такого процесса называют константой электролитической диссоциации Кд, которая равна отношению произведения равновесных концентраций ионов к концентрации непродиссоциированных молекул:
![]() . (3.2)
. (3.2)
Например, константа электролитической диссоциации слабой двухосновной сероводородной кислоты будет иметь следующий вид:
I ступень: H2S = H+ + HS- II ступень: HS- = H+ + S2-
[H+]×[HS-] [H+]×[S2-]
Kд’ = ¾¾¾¾ , Kд’ = 6×10-8; Kд’’ = ¾¾¾¾ , Kд’’ = 1×10-14.
[H2S] [HS-]
Степень электролитической диссоциации 0,1 молярного раствора H2S:
a’ = 3,98×10-4; a’’ = 3,3×10-7.
Таким образом, константа диссоциации характеризует способность слабого электролита диссоциировать на ионы: чем больше Кд, тем больше ионов в растворе, тем в большей степени диссоциирует слабый электролит.
В случае ступенчатой электролитической диссоциации слабого электролита Кд и a каждой последующей ступени всегда меньше, чем предыдущей ступени, так как увеличение заряда диссоциирующей частицы затрудняет выход из него иона с противоположным зарядом:
a’’<a’; Кд’’<Кд’.
В растворах сильных электролитов происходит практически полная (необратимая) электролитическая диссоциация молекул на ионы с образованием гидратированных ионных пар. Этим объясняется неприменимость закона действующих масс к растворам сильных электролитов, то есть Кд для сильного электролита не имеет смысла.
1.3 Закон разбавления Оствальда
Между константой диссоциации Кд и степенью диссоциации α существует следующая связь:
![]() (3.3)
(3.3)
Для очень слабых электролитов α<<1, поэтому чаще используют:
![]() (3.4)
(3.4)
Закон разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора.
Типовая задача № 1
К какому классу неорганических соединений относятся вещества H2CO3, Ba(OH)2? Запишите уравнения электролитической диссоциации веществ и математическое выражение константы электролитической диссоциации Кд для того электролита, для которого Кд имеет смысл.
Решение
а) H2CO3 – угольная кислота, кислотный гидроксид, слабая кислота, слабый электролит. Являясь двухосновной кислотой, H2CO3 диссоциирует в две ступени. Запишем уравнения электролитической диссоциации:
I
ступень: H2CO3 ![]() H+ + HCO
H+ + HCO![]() ; II
ступень:
HCO
; II
ступень:
HCO![]()
![]() H+ + CO
H+ + CO![]()
[H+]
× [HCO![]() ] [H+]×[CO
] [H+]×[CO![]() ]
]
Kд’ = ¾¾¾¾ , Kд’’ = ¾¾¾¾ ,
[H2СO3] [HCO3-]
где [H+], [HCO![]() ], [CO
], [CO![]() ] – равновесные молярные концентрации ионов,
полученных при электролитической диссоциации;
] – равновесные молярные концентрации ионов,
полученных при электролитической диссоциации;
[H2CO3] – равновесная молярная концентрация непродиссоциированных молекул.
б) Ba(OH)2 – гидроксид бария, основной гидроксид, сильное основание, сильный электролит. Являясь двухкислотным основанием, Ва(ОН)2 диссоциирует в две ступени:
I ступень: Ba(OH)2 → BaOH+ + OH-
II ступень: BaOH+ → Ba2+ + OH-.
Константа электролитической диссоциации для сильного электролита не имеет смысла.
2 Электролитическая диссоциация различных классов неорганических соединений
Характер ионов, образующихся при электролитической диссоциации, зависит от того, к какому классу неорганического соединения относится данный электролит. Одни электролиты в водном растворе подвергаются ступенчатой электролитической диссоциации, а другие диссоциируют в одну ступень.
Основания диссоциируют в водном растворе с отщеплением гидроксид-аниона ОН-. Число ступеней электролитической диссоциации основания определяется числом гидроксильных групп.
Таблица 3 - Электролитическая диссоциация соединений
|
ступенчатая электролитическая диссоциация |
электролитическая диссоциация в одну ступень |
|
1. Многоосновные кислоты: H2SO4, H3PO4, H2CO3 ... 2. Mногокислотные основания: Ca(OH)2, Ba(OH)2 ... 3. Bсе амфотерные гидроксиды: Zn(OH)2, AI(OH)3, Sn(OH)2 … 4. Кислые соли: NaHCO3 , KHS, Na2HPO4, NaH2PO4, NaHSO3, … 5. Oсновные соли: MgOHCl, AlOHCl2, CuOHNO3, FeOHSO4, (CuOH)2SO4 ... 6. Kомплексные соединения: [Cu(NH3)4]SO4, K3[Al(OH)6] ... |
1. Одноосновные кислоты: HCI, HNO3, HCN, CH3COOH … 2. Однокислотные основания: KOH, NaOH, NH4OH … 3. Средние соли: Al2(SO4)3, FeCl3, Cu(NO3)2 … 4. Двойные соли - соединения, содержащие при одном кислотном остатке два разных катиона: NH4Al(SO4)2, K2CuCl4 ...
|
NH4OH <=> NH4+ + OH- ; I ступень: Сa(OH)2 ® СaOH+ + OH-
II ступень: СaOH+ ® Сa2+ + OH-
Кислоты диссоциируют в водном растворе с отщеплением катионов водорода (кислых ионов Н+). Причем, многоосновные кислоты диссоциируют ступенчато.
HNO3 ® H+ + NO3-; I ступень: H2CO3 <=> H+ + HCO3-
гидроанион
II ступень: HCO3- <=> H+ + CO32-
Средние соли диссоциируют в одну ступень с образованием катионов металла (или катиона аммония) и анионов кислотного остатка.
AlCl3 ® Al3+ + 3Cl-; (NH4)2SO4 ® 2NH4+ + SO42-
Кислые соли – это соединения, в состав молекул которых кроме ионов металла и кислотного остатка входят ионы водорода. Кислые соли диссоциируют ступенчато: вначале молекула распадается на катион Ме (или катион NH4+) и гидроанион кислотного остатка, а затем идет диссоциация гидроаниона кислотного остатка.
NaHCO3 ® Na+ + HCO3- ; I ступень
гидрокарбонат-ион
HCO3- <= > H+ + CO32- . II ступень
карбонат-ион
Основные соли – это соединения, молекулы которых кроме ионов металла и кислотного остатка содержат гидроксогруппы. Основные соли вначале диссоциируют на анион кислотного остатка и гидроксокатион металла, а затем диссоциирует гидроксокатион металла.
AlOHCl2 ® AlOH2+ + 2Cl- ; I ступень
гидроксокатион Al
AlOH2+ <=> Al3+ + OH- . II ступень
Двойные соли в отличие от комплексных соединений - это вещества с малоустойчивой внутренней сферой, поэтому в водных растворах они диссоциируют на ионы, также как и средние соли.
K2CuCl4 ® 2K+ + Cu2+ + 4Cl-.
Комплексные соединения диссоциируют ступенчато. Внешняя и внутренняя сферы связаны ионно, поэтому вначале по месту ионной (непрочной) химической связи протекает полный распад на ионы, а затем частично диссоциирует внутренняя сфера (комплексный ион).
K3[Al(OH)6] ® 3K+ + [Al(OH)6]3-; I стадия
[Al(OH)6]3- <=> Al3+ + 6OH- . II – VII - стадии
компл-ль лиганды
3 Ионные реакции
Реакции, протекающие в растворах между электролитами, без изменения степени окисления атомов, называются ионообменными.
Ионные реакции относятся к реакциям обмена. Теоретически реакции обмена всегда обратимы, и каждой системе при данных условиях отвечает определенное состояние равновесия. Это равновесие смещено в сторону образования того вещества, которое является слабодиссоциирующим (в том числе комплексный ион), малорастворимым или газообразным соединением.
Типовая задача № 2
По ионному уравнению: Cu2+ + S2- → CuS↓ cоставьте молекулярное уравнение реакции.
Решение
Ионное уравнение показывает, что в левой части уравнения должны быть молекулы веществ, имеющих в своем составе ионы Cu2+ и S2-. Эти вещества должны быть растворимыми в воде, то есть сильными электролитами.
а) Из ионного уравнения нельзя определить химический состав молекул исходных веществ, содержащих ионы Cu2+ и S2-, поэтому по таблице растворимости находим любые растворимые соединения, содержащие эти ионы, например, CuSO4 и Na2S.
б) Запишем ионообменную реакцию, учитывая все виды уравнений:
CuSO4 + Na2S → CuS↓ + Na2SO4
Cu2+ + SO42- + 2Na+ + S2- → CuS↓ + 2Na+ + SO42-
Cu2+ + S2- → CuS↓.
4 Диссоциация воды. Ионное произведение воды
Вода - слабый амфотерный электролит. Молекулы воды могут как отдавать, так и присоединять катионы Н+. В результате взаимодействия между молекулами в водных растворах всегда присутствуют ионы ОН- и Н+, точнее, катионы оксония H3O+:
H2O + H2O ↔ H3O+ + OH-
или проще
H2O ↔ H+ + OH- .
Количественно диссоциация воды описывается константой диссоциации:
![]() при 250С.
(3.5)
при 250С.
(3.5)
Концентрацию непродиссоциированных молекул воды принимают равной общей молярной концентрации воды:
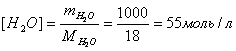 .
.
Подставляя эту величину в уравнение (4.5), получим
![]() ;
;
![]() -
ионное произведение воды, постоянная
величина, представляющая собой произведение концентраций ионов водорода и
гидроксид-ионов в чистой воде или любом водном растворе при 250С.
-
ионное произведение воды, постоянная
величина, представляющая собой произведение концентраций ионов водорода и
гидроксид-ионов в чистой воде или любом водном растворе при 250С.
![]()
![]() . (3.6)
. (3.6)
Если концентрации Н+ и ОН- ионов равны:
а) [H+] =[OH-] =10-7 моль/л – раствор нейтральный;
б) [H+]> [OH-] – раствор кислый;
в) [H+] < [OH-] – раствор щелочной.
Диссоциация воды усиливается с повышением температуры. Процесс диссоциации воды является эндотермическим (ΔН>О), следовательно, повышение температуры сместит равновесие вправо по принципу
Ле – Шателье:
Н2О ↔ Н+ + ОН-, ∆Н = +56 кДж/моль.
Для характеристики среды удобнее пользоваться величиной водородного показателя среды рН.
рН - отрицательный десятичный логарифм концентрации катионов H+ :
![]() . (3.7)
. (3.7)
рОН – гидроксильный показатель – отрицательный десятичный логарифм концентрации гидроксид-ионов в растворе:
![]() . (3.8)
. (3.8)
С помощью значений pH реакция растворов характеризуется так:
а) pH = 7, нейтральная среда;
б) pH < 7, кислая среда;
в) pH > 7, щелочная среда.
Типовая задача №3
Сравните концентрацию ионов водорода в 0,1 молярных растворах хлорноватистой НСlO и хлороводородной НСl кислот. Kд(HClO)=5×10-8, a(HCl) =0,93.
Решение
Даны растворы двух различных электролитов ( сильного и слабого) в одинаковой молярной концентрации, поэтому естественно ожидать, что в растворе сильной кислоты (НС1) концентрация водородных ионов должна быть много выше. Докажем это расчетным путем.
а) Сильный электролит НС1
|
электролитическая диссоциация сильного электролита |
HCl ¾® H+ + Cl- |
||
|
концентрация диссоциированных молекул и образовавшихся ионов |
сдис=cобщ×a= =0,93×10-1= =9,3×10-2М |
9,3×10-2М |
9,3×10-2М |
Ответ: с(H+) = 9,3 ×10-2M в растворе HCl.
б) Слабый электролит HClO
|
электролитическая диссоциация слабого электролита |
HClO <===> H+ + ClO- |
||
|
концентрация диссоциированных молекул и образовавшихся ионов |
сдис=a×cобщ= =a×10-1М |
a×10-1М |
a×10-1М |
Согласно закона разбавления Оствальда: Kд=cобщ×a2;
![]()
![]()
![]() a=
ÖKд/cобщ =
Ö5×10-8/10-1 =
Ö50×10-8
= 7,06×10-4;
a=
ÖKд/cобщ =
Ö5×10-8/10-1 =
Ö50×10-8
= 7,06×10-4;
cдисс(HClO)=7,06×10-4×10-1 = 7,06×10-5M.
Ответ: [H+]=7,06×10-5M.
5 Задания для самостоятельной работы
5.1 К какому классу неорганических соединений относятся вещества «а»? Запишите уравнения электролитической диссоциации веществ «а» и математическое выражение константы электролитической диссоциации Кд для того электролита, для которого Кд имеет смысл.
5.2 Составьте уравнения электролитической диссоциации веществ «б».
Для электролитов, диссоциирующих ступенчато, запишите все последовательные стадии.
5.3 Cоставьте молекулярное уравнение реакции, которое выражается сокращенным ионно-молекулярным уравнением «в». Подтвердите свой ответ записью этих уравнений в ионном виде.
5.4 Составьте молекулярные и ионные уравнения реакций, протекающих между веществами «г». Определите признак, согласно которому равновесие ионной реакции «г» смещено в сторону образования продуктов.
|
Вт |
«а» |
«б» |
«в» |
|
1 |
HNO3; NH4OH |
HCIO, Cu(OH)2, (NH4)2SO4 |
Cu2+ + 2OH- → Cu(OH)2¯ |
|
2 |
H2CO3; Ba(OH)2 |
H2CO3, Ba(OH)2, NaH2PO4 |
CO32- + 2H+ → H2CO3 |
|
3 |
HCl; HCN |
H3PO4, Ca(OH)2, Ca(HS)2 |
Ca2+ + C2O42- → CaC2O4¯ |
|
4 |
H2SO3; NaOH |
H2S, Mg(OH)2, Fe2(SO4)3 |
Sr2+ + SO42- → SrSO4¯ |
|
5 |
H3PO4; KCN |
H2SO4, NaOH, (ZnOH)2SO4 |
Ni2+ + S2- → NiS¯ |
|
6 |
HNO3; KHCO3 |
HCI, NH4OH, AIOH(NO3)2 |
Pb2+ + SO42- → PbSO4¯ |
|
7 |
H2SiO3; Sr(OH)2 |
H2SiO3, KOH, NaHCO3 |
Ba2+ + SO42- → BaSO4¯ |
|
8 |
HF; K2S |
HBr, LiOH, NaHSiO3 |
Ag+ + Br- → AgBr¯ |
|
9 |
HCN; RbOH |
HJ, Zn(OH)2, AI2(SO4)3 |
H+ + OH- → HOH |
|
10 |
CH3COOH; NaCl |
HCIO4, AI(OH)3, MgOHCI |
NH4+ + OH- → NH4OH |
|
11 |
H2S; Na3PO4 |
H3AsO4, Hg(OH)2, CuCI2 |
CH3COO-+H+→CH3COOH |
|
12 |
HBr; KHS |
H2SO3, Fe(OH)3, Na3PO4 |
PbS↓ + 2H+ → H2S↑ + Pb2+ |
|
13 |
HNO2; KNO2 |
HNO2, Sn(OH)2, NaHSO4 |
Zn2+ + 2OH- → Zn(OH)2↓ |
|
14 |
HClO; KClO |
HMnO4, Ni(OH)2, FeOHNO3 |
H+ + NO2- → HNO2 |
|
15 |
HJ; H2S |
H3BO3, Cr(OH)3, Ca3(PO4)2 |
Mn2+ + 2I- → MnI2↓ |
|
16 |
K2SO3; H2SO3 |
HF, Pb(OH)2, Na2HPO4 |
Ba2+ + CrO42- → BaCrO4¯ |
|
17 |
KNO3; NH4OH |
CH3COOH, Be(OH)2, Na2SO4 |
Fe(OH)3↓+3H+→Fe3++3H2O |
|
18 |
H2Se; KCl |
H3AsO3, CuOH, MgOHBr |
Cd2+ + S2- → CdS¯ |
|
19 |
FeSO4; HF |
H2SeO4, Co(OH)2, Ca(HCO3)2 |
Mn2+ + S2- → MnS¯ |
|
20 |
Pb(NO3)2; HSCN |
HNO3, Fe(OH)2, ZnOHCI |
Fe3+ + 3OH- → Fe(OH)3 ¯ |
|
21 |
KMnO4; HClO |
H2CrO4, Sr(OH)2, Be(NO3)2 |
Mg2+ + 2OH- → Mg(OH)2 ¯ |
|
22 |
HClO4; HClO2 |
H2Cr2O7, CsOH, CuSO4 |
Cu2+ + S2- → CuS ¯ |
|
23 |
BaCl2; H2S |
H2S2O3, RbOH, AIOHCI2 |
CaCO3 +2H+→ Ca2++H2СО3 |
|
24 |
H3AsO3; FeCl3 |
HPO3, Cd(OH)2, AI(OH)2CI |
2H+ + SiO32- → H2SiO3 ¯ |
|
25 |
H2SiO3; K2SiO3 |
HPO2, Mn(OH)2, AICI3 |
2H+ + SO32- → H2SO3 |
5.5 Вычислите концентрацию ионов водорода в растворах соединений «д» и «е» при одинаковой их молярной концентрации «ж». (Для многоосновных слабых кислот примите во внимание только 1-ую ступень электролитической диссоциации). Ответ: В растворе слабого электролита [Н+] = «з» моль/л; в растворе сильного электролита с(Н+) = «и» моль/л.
|
В-т |
«г» |
«д»
|
«е» a |
«ж» |
«з» |
«и» |
|
1 |
AICI3 Ca(OH)2 |
HClO 5,0×10-8 |
HCl 0,93 |
0,10 |
7,1×10-5 |
9,3×10-2 |
|
2 |
AgNO3 AICI3 |
CH3COOH 1,8×10-5 |
HJ 0,99 |
0,10 |
1,4×10-3 |
9,9×10-2 |
|
3 |
BaCI2 Fe2(SO4)3 |
H2S 1,0×10-7 |
HBr 0,97 |
0,10 |
1,0×10-4 |
9,7×10-2 |
|
4 |
FeCI3 KOH |
H2S 1,0×10-7 |
HNO3 0,98 |
0,02 |
4,5×10-5 |
1,9×10-2 |
|
5 |
Ba(NO3)2 Na2SO4 |
HCN 6,2×10-10 |
HCl 0,98 |
0,01 |
2,5×10-6 |
9,8×10-3 |
|
6 |
Na2SiO3 HCI |
HNO2 5,1×10-4 |
HNO3 0,95 |
0,10 |
7,1×10-3 |
9,5×10-2 |
|
7 |
Ba(CH3COO)2 KCI |
H3PO4 7,6×10-3 |
HCl 0,78 |
1,00 |
8,7×10-2 |
7,8×10-1 |
|
8 |
CuSO4 KOH |
H2C2O4 5,5×10-2 |
HClO4 0,99 |
0,10 |
7,4×10-2 |
9,9×10-2 |
|
9 |
Cu(NO3)2 Ca(OH)2 |
HF 6,8×10-4 |
HCl 0,88 |
0,50 |
1,8×10-2 |
4,4×10-1 |
|
10 |
CuCI2 H3PO4 |
H2CO3 4,5×10-7 |
HClO4 1,00 |
0,01 |
6,7×10-5 |
1,0×10-2 |
|
11 |
Cu(OH)2 HNO3 |
H2SeO3 2,4×10-3 |
HNO3 0,99 |
0,01 |
4,9×10-3 |
9,9×10-3 |
|
12 |
Zn(NO3)2 K2S |
H3AsO4 6,0×10-3 |
HJ 1,00 |
0,01 |
7,7×10-3 |
1,0×10-2 |
|
13 |
Fe2S3 HCI |
HCN 6,2×10-10 |
H2SO4 0,60 |
0,05 |
5,6×10-6 |
3,0×10-2 |
|
14 |
NH4OH H2SO4 |
NH4OH 1,8×10-5 |
KOH 0,95 |
0,10 |
1,3×10-3 |
9,5×10-2 |
|
15 |
AI(OH)3 HCI |
H3PO3 1,6×10-2 |
HNO3 0,95 |
0,10 |
4,0×10-2 |
9,5×10-2 |
|
16 |
K2SiO3 H2SO4 |
H2SO3 1,7×10-2 |
HNO3 0,96 |
0,05 |
2,9×10-2 |
4,8×10-2 |
|
17 |
Fe(NO3)2 Ca(OH)2 |
HVO3 3,0×10-5 |
HBr 0,99 |
0,01 |
5,5×10-4 |
9,9×10-3 |
|
18 |
Mg(NO3)2 Na2CO3 |
HNO2 5,1×10-4 |
HNO3 0,99 |
0,02 |
3,1×10-3 |
2,0×10-2 |
|
19 |
H3PO4 NH4OH |
H2B4O7 1,8×10-4 |
HNO3 0,98 |
0,04 |
2,7×10-3 |
3,9×10-2 |
|
20 |
Fe(OH)3 HNO3 |
HBrO 2,5×10-9 |
HNO3 0,97 |
0,06 |
1,2×10-5 |
5,8×10-2 |
|
21 |
KOH H2SO4 |
HJO 2,3×10-11 |
HNO3 0,96 |
0,08 |
1,3×10-6 |
7,7×10-2 |
|
22 |
Cr(OH)3 H2SO4 |
HCN 6,2×10-10 |
HCl 0,93 |
0,10 |
7,9×10-6 |
9,3×10-2 |
|
23 |
NaOH H3PO4 |
HF 6,8×10-4 |
HCl 0,98 |
0,01 |
2,6×10-3 |
9,8×10-3 |
|
24 |
Ca(HCO3)2 HNO3 |
H2CO3 4,5×10-7 |
HCl 0,97 |
0,02 |
9,5×10-5 |
1,9×10-2 |
|
25 |
(NH4)2S FeCI3 |
H3AsO4; 6,0×10-3 |
HCl 0,96 |
0,04 |
1,6×10-2 |
3,8×10-2 |
Тема 4
Окислительно-восстановительные реакции
1 Степень окисления
Валентность атома того или иного элемента определяется числом электронов, идущих на образование общих электронных пар. При этом не учитывается полярность образовавшихся связей и, следовательно, валентность не имеет знака.
Под степенью окисления (С.О.) понимают тот условный заряд атома, который вычисляется исходя из предположения, что молекула состоит только из ионов.
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная – число электронов, которые смещаются к данному атому.
Для определения степени окисления атома того или иного элемента обычно исходят из следующих положений:
1)
Степень окисления элементов в простых веществах равна нулю (N![]() ,
H
,
H![]() ,
Cl
,
Cl![]() ,
Al0,
K0,Cu0….)
,
Al0,
K0,Cu0….)
2) Возможная степень окисления элемента в соединении, исходя из его положения в Периодической системе, представлена в таблице 7.
3) Алгебраическая сумма зарядов всех атомов в молекуле равна нулю, а алгебраическая сумма зарядов атомов в сложном ионе равна заряду этого иона.
Типовая задача №1
Определить степень окисления подчеркнутого элемента в соединениях:
a) K2SO4,
б) SO![]() ,
,
в) K2Cr2O7,
г) Cr2О![]() .
.
Решение
а) K2SO4 – молекула. Учитывая, что алгебраическая сумма зарядов атомов в молекуле равна нулю, С.О.(К) = +1, С.О.(О) = −2, определим степень окисления серы:
K![]() S
S![]() O
O![]() 2
· (+1) + 1 · х + 4 · (−2) = 0
2
· (+1) + 1 · х + 4 · (−2) = 0
+2 + х − 8 = 0
х = +6 С.О.(S) = + 6.
б)
SO![]() –
ион. Исходя из положения, что сумма зарядов атомов в сложном ионе равна заряду
этого иона, определим степень окисления серы:
–
ион. Исходя из положения, что сумма зарядов атомов в сложном ионе равна заряду
этого иона, определим степень окисления серы:
(S![]() O
O![]() )
)![]() (+1)
· х + 4 · (−2) = −2
(+1)
· х + 4 · (−2) = −2
+ х −8 = −2
х = +6 С.О.(S) = + 6.
Таблица 4 - Степень окисления элемента в соединениях
|
№ группы |
Возможная степень окисления (Э) в егосоединениях |
|
Элементы главных подгрупп |
|
|
I – A H, Li, Na, K, Rb, Cs, Fr |
С.О.(Э) = +1 (постоянная степень окисления). Исключение составляет водород: как правило, С.О.(Н) = +1, но в гидридах активных металлов С.О.(Н) = −1 (Na |
|
II –A Be, Mg, Ca, Sr, Ba |
C.O.(Э) = +2 (постоянная степень окисления) |
|
III – A B, Al, Ga, Jn, Tl |
C.O.(Э) = +3 (постоянная степень окисления) |
|
IV – A C, Si, Ge, Sn, Pb |
от −4 минимальная промежуточная максимальная |
|
V – A N, P, As, Sb, Bi |
от −3 минимальная промежуточная максимальная Исключение составляет азот: С.О.(N) меняется от −3 |
|
VI – A O, S, Sc, Te, Po |
от −2 минимальная промежуточная максимальная Исключение составляет кислород: во всех
соединенияхС.О.(О) = −2, кроме перекисных соединений: С.О.(О) = −1 (Н и оксида фтора: С.О.(О) = +2 (F |
|
VII – A F, Cl, Br, I, At |
от −1 минимальная промежуточная максимальная Исключение составляет фтор: С.О.(F) = −1 (постоянная) |
|
Элементы побочных подгрупп |
|
|
Группы В |
Минимальная С.О.(Э) = +2 (реже +1) Максимальная С.О.(Э) равна номеру группы |
|
I – B Cu, Ag, Au |
Элементы группы могут проявлять в своих соединениях C.O., превышающую номер группы: С.О.(Сu) = +2 |
|
VIII – B Fe, Co, Ni |
Элементы группы проявляют в своих соединениях max C.O., не достигающую номера группы: С.О.(Fe) = +6 |
в) K2Cr2O7 – молекула, сумма зарядов атомов которой равна нулю.
С.О.(К) = +1, С.О.(О) = −2, определим степень окисления серы:
K![]() Сr
Сr![]() O
O![]() 2 · (+1) + 2 · х
+ 7 · (−2) = 0
2 · (+1) + 2 · х
+ 7 · (−2) = 0
+2 + 2х −14 = 0
2х = +12
х = +6 С.О.(Cr) = + 6.
г)
Cr2O![]() – ион. Составим уравнение с неизвестными, учитывая,
что сумма зарядов атомов в сложном ионе равна заряду данного иона:
– ион. Составим уравнение с неизвестными, учитывая,
что сумма зарядов атомов в сложном ионе равна заряду данного иона:
(Cr2O![]() )
)![]() (+
2) · х + 7 · (−2) = −2
(+
2) · х + 7 · (−2) = −2
2 х −14 = −2
2х = +12
х = +6 С.О.( Cr) = + 6.
2 Сущность процессов окисления-восстановления
Окислительно-восстановительный процесс есть единство двух противоположных процессов: окисления и восстановления.
Окисление есть процесс отдачи электронов, приводит к повышению степени окисления восстановителя. Атом, молекула или ион, отдающие электроны, называются восстановителями (В-ль).
В-ль
2J![]()
![]() J
J![]() , процесс окисления.
, процесс окисления.
Восстановление – процесс присоединения электронов, приводит к понижению степени окисления окислителя. Атом, молекула или ион, присоединяющие электроны, называются окислителями (Ок-ль).
Ок-ль
J2 ![]() 2J
2J![]() , процесс восстановления.
, процесс восстановления.
Типичными окислителями являются:
1)
кислород и галогены (O![]() ,
F
,
F![]() ,
Cl
,
Cl![]() ,
Br
,
Br![]() ,
J
,
J![]() );
);
2)
положительно заряженные ионы металлов в высшей степени окисления (Fe![]() Cl3,
Sn
Cl3,
Sn![]() Cl4);
Cl4);
3) сложные ионы и молекулы, содержащие атом металла в высшей степени окисления
(KMn![]() O4, K2Cr
O4, K2Cr![]() O
O![]() , KCl
, KCl![]() O3, KCl
O3, KCl![]() O4, HN
O4, HN![]() O3, H2S
O3, H2S![]() O4).
O4).
Типичными восстановителями являются:
1)
металлы и некоторые неметаллы (Zn0,
Mn0,
C0,
H![]() );
);
2)
отрицательно заряженные ионы неметаллов (HCl![]() ,
H2S
,
H2S![]() ,
HBr
,
HBr![]() ,
CaH
,
CaH![]() );
);
3)
положительно заряженные ионы металлов в низшей степени окисления (Fe![]() Cl2,
Sn
Cl2,
Sn![]() Cl2).
Cl2).
Атом того или иного элемента в высшей степени окисления не может её повысить (отдать электроны) и проявляет только окислительные свойства.
Атом того или иного элемента в низшей степени окисления не может её понизить (принять электроны) и проявляет только восстановительные свойства.
Атом же элемента, имеющий промежуточную степень окисления, может проявлять окислительно-восстановительную двойственность(ОВД).
Типовая задача №2
Исходя из степени окисления хлора в соединениях HCl, Cl2, HClO, HClO2, HClO3, HClO4, определить какое из них является только окислителем, только восстановителем, какое может проявлять окислительно-восстановительную двойственность (ОВД).
Решение
Степень окисления хлора в указанных соединениях соответственно равна:
а)
H![]() Cl
Cl![]() ;
С.О.(Cl) = -1 – минимальная степень окисления, следовательно,
в окислительно-восстановительной реакции (ОВР) НСI является
только восстановителем.
;
С.О.(Cl) = -1 – минимальная степень окисления, следовательно,
в окислительно-восстановительной реакции (ОВР) НСI является
только восстановителем.
б)
Cl![]() ; С.О.(Cl) = 0 промежуточная степень окисления; в
окислительно-восстановительной реакции (ОВР)
Cl2 может быть как окислителем, так и восстановителем.
; С.О.(Cl) = 0 промежуточная степень окисления; в
окислительно-восстановительной реакции (ОВР)
Cl2 может быть как окислителем, так и восстановителем.
в)
H![]() Cl
Cl![]() O
O![]() 1 · (+1) + 1 · x + 1 · (-2) = 0
1 · (+1) + 1 · x + 1 · (-2) = 0
+1 + x - 2 = 0
x = +1
С.О.(Cl) = +1 - промежуточная степень окисления; в окислительно-восстановительной реакции (ОВР) HClO проявляет окислительно-восстановительную двойственность (ОВД).
г)
H![]() Cl
Cl![]() O
O![]() 1
· (+1) + 1 · x + 2 · (-2) = 0
1
· (+1) + 1 · x + 2 · (-2) = 0
+1 + x - 4 = 0
x = +3
С.О.(Cl) = +3 - промежуточная степень окисления; в окислительно-восстановительной реакции (ОВР) HClO2 может проявлять как окислительные, так и восстановительные свойства.
д)
H![]() Cl
Cl![]() O
O![]() 1 · (+1) + 1 ·
x + 3
· (-2) = 0
1 · (+1) + 1 ·
x + 3
· (-2) = 0
+1 + x - 6 = 0
x = +5
С.О.(Cl) = +5 - промежуточная степень окисления; в зависимости от условий проведения реакции HClO3 может быть в окислительно-восстановительной реакции (ОВР) как окислителем, так и восстановителем.
е)
H![]() Cl
Cl![]() O
O![]() 1 · (+1) + 1 ·
x + 4
· (-2) = 0
1 · (+1) + 1 ·
x + 4
· (-2) = 0
+1 + x - 8 = 0
x = +7
С.О.(Cl) = +7 - максимальная степень окисления; следовательно, в окислительно-восстановительной реакции (ОВР) HClO4 является только окислителем.
3 Методы составления уравнений окислительно-восстановительных реакций
При составлении уравнения окислительно-восстановительной реакции (ОВР) условимся для удобства соблюдать такую последовательность: в исходных веществах записывать сначала восстановитель, затем окислитель и среду (если это необходимо); в продуктах реакции – сначала продукт окисления, затем продукт восстановления и другие вещества. Применяются два метода составления уравнения окислительно-восстановительной реакции: электронного баланса и ионно-электронного баланса (полуреакций).
3.1 Метод электронного баланса
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. Основное требование состоит в том, что число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Необходимо также знать, какие вещества образуются в результате реакции.
Типовая задача № 3
Используя метод электронного баланса, подобрать коэффициенты, указать окислитель и восстановитель в окислительно-восстановительной реакции, протекающей по схеме:
H2S + KMnO4 + H2SO4
![]() S + MnSO4 + K2SO4 + H2O.
S + MnSO4 + K2SO4 + H2O.
Решение
а) Определим изменение степеней окисления атомов элементов до и после реакции:
H![]() S
S![]() +K
+K![]() Mn
Mn![]() O
O![]() +H
+H![]() S
S![]() O
O![]()
![]() S0 + Mn
S0 + Mn![]() S
S![]() O
O![]() +K
+K![]() S
S![]() O
O![]() + H
+ H![]() O
O![]() .
.
Степени окисления изменяются у серы и марганца: восстановитель (В-ль) Н2S (сера проявляет минимальную степень окисления), окислитель (Ок-ль) KMnO4 (марганец в молекуле в высшей степени окисления).
б) Составим электронные уравнения процессов:
![]()
![]() В-ль 5
S
В-ль 5
S![]()
![]() S0
, процесс окисления
S0
, процесс окисления
Ок-ль 2 Mn![]()
![]() Mn
Mn![]() , процесс восстановления.
, процесс восстановления.
Количество отдаваемых и принимаемых электронов должно быть одинаково, поэтому первое уравнение умножим на 5, а второе на 2.
в) Исходя из электронных уравнений, расставим коэффициенты перед окислителем, восстановителем и соответствующими продуктами реакции: нужно взять 5 молекул сероводорода и 2 молекулы перманганата калия, тогда получим 5 атомов серы и 2 молекулы сульфата марганца:
5H2S + 2KMnO4 + H2SO4 → 5S + 2MnSO4 + K2SO4 + H2O.
г) Количество атомов металла, не принимающего участия в окислении-восстановлении (таким металлом является калий), одинаково в правой и левой частях уравнения.
д) Перейдем к уравниванию кислотных остатков. В правой части уравнения имеется 3 кислотных остатка SO42- в составе двух молекул MnSO4 и молекулы K2SO4, в левой части – 1 кислотный остаток в составе H2SO4. Таким образом, для достижения равенства по кислотным остаткам перед формулой H2SO4 нужно поставить коэффициент 3:
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + H2O.
е) Уравняем количество ионов водорода, начиная с левой части уравнения: в составе 5 молекул H2S и 3 молекул H2SO4 имеется 16 ионов водорода, поэтому перед формулой Н2О в правой части равенства нужно поставить коэффициент 8:
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O.
ж) Правильность записи уравнения подтверждаем тождеством: в левой части уравнения 2 · 4 + 3 · 4 = 20 атомов кислорода и в правой части
2 · 4 + 1 · 4 + 1 · 8 = 20 атомов кислорода.
3.2 Метод ионно-электронного баланса (полуреакций)
Окислительно-восстановительные реакции (ОВР), протекающие в водных растворах,
уравнивают, как правило, методом ионно-электронного баланса (полуреакций).
Преимущество метода полуреакций по сравнению с методом электронного баланса
состоит в том, что в нем применяются не гипотетические ионы, а реально
существующие: в растворе нет ионов Mn![]() ,
Cr
,
Cr![]() ,
S
,
S![]() , а присутствуют ионы
MnO
, а присутствуют ионы
MnO![]() ,
Cr2O
,
Cr2O![]() ,
SO
,
SO![]() .
Кроме того, при составлении уравнений окислительно-восстановительной реакции
(ОВР) методом полуреакции не требуется определения степеней окисления атомов,
но учитывается роль среды как активного участника всего процесса.
.
Кроме того, при составлении уравнений окислительно-восстановительной реакции
(ОВР) методом полуреакции не требуется определения степеней окисления атомов,
но учитывается роль среды как активного участника всего процесса.
Наконец, при использовании метода полуреакции некоторые участники окислительно-восстановительной реакции (ОВР) (среда, продукты) могут быть определены при выводе окончательного молекулярного уравнения реакции.
Типовая задача № 4
Используя метод полуреакций, составить и уравнять окислительно-восстановительную реакцию, протекающую по схеме:
KNO2 + K2Cr2O7
+ … ![]() KNO3 + Cr2(SO4)3
+ …
KNO3 + Cr2(SO4)3
+ …
Решение
а) Рассчитаем степень окисления (С.О.) элемента, изменяющего свой заряд; подчеркнем реальные частицы, содержащие данный элемент:
K![]() +
K2
+
K2![]() +
…
+
… ![]() K
K![]() +
+
![]() (SO4)3 + …
(SO4)3 + …
б) Составим краткое ионное уравнение схемы окислительно-восстановительной реакции:
![]() NO
NO![]() +
Cr2O
+
Cr2O![]()
![]() NO
NO![]() +
2Cr
+
2Cr![]() .
.
в) Составим раздельно уравнения двух полуреакций процессов окисления и восстановления:
В-ль │ ![]()
![]()
![]() , процесс окисления.
, процесс окисления.
В данной полуреакции недостаток атома кислорода в левой части уравнения восполним за счет одной молекулы Н2О, тогда в правую часть уравнения для баланса атомов записали два катиона Н+. Далее, рассчитав суммарный заряд частиц левой и правой частей полуреакии, определили, что в процессе окисления участвуют два электрона (число отданных электронов n(ē) = 2).
Ок-ль │ ![]()
![]()
![]() , процесс восстановления.
, процесс восстановления.
В данном случае вначале уравниваем атом элемента Сr: в левой части
уравнения в составе дихромат - иона Cr2O![]() два атома
хрома, поэтому в правой части полуреакции запишем два иона
Cr
два атома
хрома, поэтому в правой части полуреакции запишем два иона
Cr![]() .
Недостаток атомов кислорода в правой части уравнения восполним семью молекулами
Н2О, записав четырнадцать катионов Н
.
Недостаток атомов кислорода в правой части уравнения восполним семью молекулами
Н2О, записав четырнадцать катионов Н![]() в левую часть полуреакции. Рассчитав
алгебраическую сумму зарядов левой и правой частей полуреакции, определили, что
число принимаемых электронов равно 6.
в левую часть полуреакции. Рассчитав
алгебраическую сумму зарядов левой и правой частей полуреакции, определили, что
число принимаемых электронов равно 6.
г) Составим полное ионно-молекулярное уравнение данной окислительно-восстановительной реакции. Для этого просуммируем оба составленных уравнения полуреакций, причем, каждое из них умножаем на соответствующий множитель, определяемый по правилу наименьшего кратного: общее наименьшее кратное для отданных и принятых электронов равно 6. Разделив это число на 2, получаем множитель 3 для восстановителя и продуктов его окисления, а при делении на 6 – множитель для окислителя и продуктов его восстановления.
![]()
![]()
![]() В-ль 3
В-ль 3 ![]()
![]()
![]() , процесс окисления
, процесс окисления
![]()
![]()
![]() 6
6
Ок-ль
1 ![]()
![]()
![]() , процесс восстановления
, процесс восстановления
3NO![]() + 3H2O + Cr2O
+ 3H2O + Cr2O![]() + 14H
+ 14H![]() → 3NO
→ 3NO![]() + 6H
+ 6H![]() + 2Cr
+ 2Cr![]() + 7H2O.
+ 7H2O.
д) Выделив катионы Н+ и молекулы Н2О в левой и правой частях уравнения, сократив их, получили ионно-молекулярное уравнение следующего вида:
![]() 8 4
8 4
![]()
![]()
![]() 3NO
3NO![]() + 3
+ 3![]() + Cr2O
+ Cr2O![]() + 14
+ 14![]() → 3NO
→ 3NO![]() + 6
+ 6![]() + 2Cr
+ 2Cr![]() + 7
+ 7![]() .
.
3NO![]() + Cr2O
+ Cr2O![]() + 8H
+ 8H![]() → 3NO
→ 3NO![]() + 2Cr
+ 2Cr![]() + 4H2O.
+ 4H2O.
е) Определяем по принципу Ле-Шателье какая среда благоприятствует протеканию данной ОВР: ионы Н+ являются реагентами реакции, поэтому введение кислоты способствует наиболее полному протеканию реакции в прямом направлении.
ж) Для перехода к молекулярному уравнению к каждому аниону в левой части уравнения подбираем соответствующий катион, а к каждому катиону – анион. Затем такие же ионы в таком же количестве записываем и в правую часть уравнения, после чего ионы объединяем в молекулы.
3NO![]() + Cr2O
+ Cr2O![]() + 8H
+ 8H![]() →
3NO
→
3NO![]() +
2Cr
+
2Cr![]() + 4H2O.
+ 4H2O.
3К![]() 2К
2К![]() 4SO
4SO![]() 3К
3К![]() 3SO
3SO![]() 2K
2K![]() SO
SO![]()
3KNO2 + K2Cr2O7 + 4H2SO4 = 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
4 Молярная масса эквивалента восстановителя и окислителя
В соответствии с законом эквивалентов восстановители и окислители реагируют друг с другом в эквивалентных количествах:
![]()
![]() (4.1)
(4.1)
где νэ – количество эквивалентов вещества.
![]() ;
;
![]() .
.
Молярная масса эквивалента (Мэ) восстановителя (окислителя) определяется отношением молярной массы восстановителя (окислителя) к числу электронов (n), отдаваемых (принимаемых) 1 моль восстановителя (окислителя) в данной окислительно-восстановительной реакции:
![]() . (4.2)
. (4.2)
![]() .
(4.3)
.
(4.3)
Типовая задача № 5
Рассчитайте молярную массу эквивалента (Мэ) восстановителя и окислителя в окислительно-восстановительной реакции, протекающей по схеме:
FeSO4 + HNO3 + H2SO4
![]() Fe2(SO4)3
+ NO + H2O.
Fe2(SO4)3
+ NO + H2O.
Решение
1 Придерживаясь последовательности при составлении уравнения окислительно-восстановительной реакции (ОВР) методом полуреакции, определим окислитель и восстановитель, подберем множители, запишем молекулярное уравнение.
![]() SO4 +
H
SO4 +
H![]() +
H2SO4
+
H2SO4
![]()
![]()
![]() (SO4)3 +
(SO4)3 +
![]() +
H2O
+
H2O
![]()
![]()
![]()
![]() В-ль 3
В-ль 3
![]()
![]()
![]() , процесс окисления
, процесс окисления
Ок-ль 2 ![]()
![]()
![]() , процесс восстановления
, процесс восстановления
6
Fe![]() + 2NO
+ 2NO![]() + 8H
+ 8H![]() → 6Fe
→ 6Fe![]() + 2NO + 4H2O
+ 2NO + 4H2O
6 SO![]() 3SO
3SO![]() 9SO
9SO![]()
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O.
2 Вычислим молярную массу эквивалента (Мэ) восстановителя и окислителя, участвующих в данной окислительно-восстановительной реакции (ОВР).
Мэ(Восстановителя) = Мэ(FeSO4) = ![]() =
= ![]() = 152 г/моль.
= 152 г/моль.
Мэ(Окислителя) = Мэ(HNO3) = ![]() =
= ![]() = 21 г/моль.
= 21 г/моль.
5 Задания для самостоятельной работы
5.1 Рассчитайте степень окисления подчеркнутого элемента в частице «а».
5.2 Какое вещество или ион состава «а» может в окислительно-восстановительной реакции (ОВР) выполнять роль только восстановителя, только окислителя, а какое вещество или ион может выполнять окислительно-восстановительную двойственность (ОВД)? Дайте пояснение.
5.3 Используя метод электронного баланса уравняйте окислительно-
восстановительную реакцию в соответствии со схемой «б».
|
В-т |
«а» |
«б»
|
|
1 |
KMnO4;H2SO4;CO2 |
Zn + HNO3 → Zn(NO3)2 + NH3 + H2O |
|
2 |
H2S; SO42- ; H2SO4 |
Cu2O + HNO3 → Cu(NO3)2 + NO2 + H2O |
|
3 |
NH3;
NO |
NaCrO2 + Br2 + NaOH→Na2CrO4 + NaBr + H2O |
|
4 |
HCl; Cl2;
ClО |
CuS + HNO3 → CuSO4 + NO2 + H2O |
|
5 |
KNO2; N2O5; NO3- |
H2S + K2Cr2O7 + H2SO4→S + Cr2(SO4)3 +K2SO4 |
|
6 |
NH4+; SiO32-; PbO2 |
C + H2SO4 → CO2 + H2O + SO2 |
|
7 |
KI; I2; MnO4- |
HJ + H2SO4 → J2 + SO2 + H2O |
|
8 |
KBr; Br2; CrO42- |
HCI + CrO3 → CrCI3 + CI2 + H2O |
|
9 |
PH3; SO3; PbO2 |
Ag + HNO3 → AgNO3 + NO2 + H2O |
|
10 |
HBr; NO2; H2SO4 |
SO2 + KMnO4 + H2O→H2SO4 + MnSO4 + K2SO4 |
|
11 |
N2O3; N2; KIO4 |
S + HNO3 → H2SO4 + NO |
|
12 |
Mg; CrO42-;K2CrO4 |
H2S + FeCl3 → S + FeCl2 + HCl |
|
13 |
K2S; K2SO3; Mn2O7 |
HCl + MnO2 → Cl2 + MnCl2 + H2O |
|
14 |
HI; I2; IO3- |
HCl + PbO2 → Cl2 + PbCl2 + H2O |
|
15 |
K; NO2-; ZnSO4 |
H2SO3 + HClO4 → H2SO4 + HCl |
|
16 |
Fe; CO32-; SnCl4 |
H2S + H2SO3 → S + H2O |
|
17 |
CaH2; РвO22-; CrO3 |
P + HNO3 + H2O → H3PO4 + NO |
|
18 |
Al203; CIO3- ; F2 |
PH3 + HNO3 → H3PO4 + NO |
|
19 |
K2S; Cl2; ClO4- |
NH3 + O2 → NO + H2O(пар) |
|
20 |
Na2S; H2O2; NO3- |
H2S + Cl2 + H2O → H2SO4 + HCl |
|
21 |
PH3; CO; AsO43- |
SO2 + Br2 + H2O → H2SO4 + HBr |
|
22 |
Cd; Fe2O3; SbO43- |
KJ + HNO3 + H2SO4 → J2 + NO + K2SO4 |
|
23 |
Ca; BiCl3; BiO33- |
J2 + HNO3 → HJO3 + NO + H2O |
|
24 |
Na; FeCl2; SbO3- |
As2O3 + HNO3 + H2O → H3AsO4 + NO |
|
25 |
K; KNO2; IO4- |
Cl2 + KOH → KClO3 + KCl + H2O |
5.4 Рассчитайте молярную массу эквивалента (Мэ) восстановителя и окислителя, участвующих в окислительно-восстановительной реакции (ОВР) по схеме «б». Ответ: Мэ(В-ля) = «в» г/моль; Мэ(Ок-ля) = «г» г/моль.
5.5 Используя метод полуреакций, составьте и уравняйте окислительно-восстановительную реакцию, протекающую в соответствии со схемой «д». Обоснуйте принципом Ле-Шателье роль среды для осуществления данной реакции.
Ответ: Сумма коэффициентов левой части молекулярного уравнения равна «е», сумма коэффициентов правой части - «ж».
В-т |
«в» |
«г» |
«д» |
«е» |
«ж»
|
|
1 |
32,5 |
7,9 |
KBiO3 + Cr2(SO4)3 + ...®Bi2(SO4)3 + K2Cr2O7 +... |
12 |
10 |
|
2 |
72,0 |
63,0 |
KJ + HNO2 + ... ® J2 + NO + K2SO4 + ... |
5 |
6 |
|
3 |
35,7 |
80,0 |
K2Cr2O7 + SO2 + ... ® Cr2(SO4)3 + SO3 + ... |
8 |
9 |
|
4 |
12,0 |
63,0 |
K2Cr2O7 + HC1 ® CrC13 + C12 + ... |
15 |
14 |
|
5 |
17,0 |
49,0 |
KJ + K2Cr2O7 + ... ® J2 + Cr2(SO4)3 + ... |
14 |
15 |
|
6 |
3,0 |
49,0 |
Zn + H3AsO3 + ... ® AsH3 + ZnSO4 + ... |
7 |
7 |
|
7 |
64,0 |
49,0 |
Te + H2O + ... ® K2TeO3 + K2Te + ... |
9 |
6 |
|
8 |
36,5 |
50,0 |
КAsO2 + J2 + ... ® K3AsO4 + KJ + ... |
6 |
5 |
|
9 |
108 |
63,0 |
BiC13 + Br2 + ... ® KBiO3 + KBr + ... |
8 |
9 |
|
10 |
32,0 |
31,6 |
KCrO2 + PbO2 + ... ® K2PbO2 + K2CrO4 + ... |
13 |
9 |
|
11 |
5,3 |
21,0 |
CrC13 + KBiO3 + ... ® Bi(OH)3¯ + K2CrO4 + ... |
13 |
11 |
|
12 |
17,0 |
162 |
HC1 + KMnO4 + … ® MnC12 + C12 + ... |
7 |
4 |
|
13 |
8,3 |
43,5 |
CrC13 + H2O2 + ... ® K2CrO4 + H2O + ... |
15 |
16 |
|
14 |
8,3 |
119 |
Fe(OH)3¯ + Br2 + ... ® K2FeO4 + KBr + ... |
15 |
16 |
|
15 |
41,0 |
12,6 |
KCrO2 + KC1O + ... ® K2CrO4 + KC1 + ... |
7 |
6 |
|
16 |
17,0 |
20,5 |
KCrO2 + H2O2 + ... ® K2CrO4 + H2O + ... |
5 |
4 |
|
17 |
6,2 |
21,0 |
K2SnO2 + BiC13 + ... ® Bi¯ + K2SnO3 + ... |
11 |
14 |
|
18 |
4,3 |
21,0 |
FeSO4 + KC1O3 + ... ® Fe2(SO4)3 + KC1 + ... |
10 |
7 |
|
19 |
3,4 |
8,0 |
K2Cr2O7 + KNO2 + ... ® Cr2(SO4)3 + KNO3 + ... |
8 |
9 |
|
20 |
4,3 |
35,5 |
KJO3 + FeSO4 + ... ® KJ + Fe2(SO4)3 + ... |
10 |
7 |
|
21 |
32,0 |
80,0 |
Zn + K3AsO3 + ... ® AsH 3+ ZnC12 |
13 |
10 |
|
22 |
83,0 |
21,0 |
Co(OH)2¯ + Br2 + ... ® Co(OH)3¯ + NaBr + ... |
5 |
4 |
|
23 |
25,4 |
21,0 |
HJ + H2SO4 ® J2 + H2S + ... |
9 |
9 |
|
24 |
49,5 |
21,0 |
Cr2(SO4)3 + Na2O2 +... ® Na2CrO4 + H2O + ... |
8 |
7 |
|
25 |
3,55 |
35,5 |
KBrO3 + HBr ® Br2 + КВr + ... |
7 |
7 |
Тема 5
Основы электрохимии. Гальванические элементы
1 Стандартный электродный потенциал. Уравнение Нернста
Электрохимия – это раздел химии, изучающий процессы взаимного превращения химической и электрической форм энергии.
Металл, находящийся в контакте с электролитом, называется электродом. Между металлической пластиной, опущенной в раствор собственной соли, и раствором при образовании двойного электрического слоя (ДЭС) возникает разность потенциалов, называемая электродным потенциалом (Е).
По мере перехода ионов Меn+ в раствор растет отрицательный заряд металлической пластины и положительный заряд раствора.
Параллельно с этим протекает обратная реакция – восстановление ионов Меn+ до атомов Ме0. В некоторый момент скорости прямого и обратного процессов выравниваются, и устанавливается равновесие. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Например, при погружении цинковой пластины в раствор хлорида цинка часть ионов цинка Zn2+ с пластины переходит в раствор, при этом пластина заряжается отрицательно. На цинковом электроде происходит реакция:
Zn0 ![]()
![]() Zn2+.
Zn2+.
В случае медной пластинки, опущенной в раствор соли меди, ионы меди будут осаждаться на пластинке, заряжая ее положительно, по реакции:
Cu2+ ![]() Cu0.
Cu0.

Абсолютную величину скачка потенциала нельзя измерить экспериментально, так как мы имеем дело с разными фазами: твердая и жидкая. Для этого измеряют разность потенциалов между исследуемым электродом и другим электродом, который взят в качестве электрода сравнения. Таким электродом сравнения является стандартный водородный электрод.
Стандартный водородный электрод состоит из платинированной пластины, контактирующей с газообразным водородом, находящимся под давлением в 1 атм (101,3 кПа) и раствором кислоты с концентрацией ионов водорода с(Н+) = 1 моль/л. Абсолютное значение потенциала водородного электрода условно принимается равным нулю при любой температуре:
Е02Н+/
Н![]() = ± 0,00 В.
= ± 0,00 В.
Если пластинку металла, погруженную в раствор его соли с концентрацией ионов металла равной единице (с(Меn+) = 1 моль/л), соединить со стандартным водородным электродом, то получится гальванический элемент, разность электродных потенциалов которого легко измерить.
Электродный потенциал, измеренный при стандартных условиях:
Т = 298 К, Р = 1 атм (101,3 кПа), с(Меп+) = 1 моль/л, является стандартным электродным потенциалом металла и обозначается Е0оф/вф = … В.
Определив стандартные электродные потенциалы металлов относительноводородного электрода, можно расположить их по активности в ряд напряжений, предложенный Н.Н.Бекетовым: K Ca Na Mg AI Mn Zn Fe Ni Sn Pb Н2 Cu Hg Ag Au. Значения Е0оф/вф определены для большинства других электрохимических систем и являются табличными величинами.
В любом полуэлементе наряду с окислителем или восстановителем имеются вещества, ими образуемые. Они составляют окислительно-восстановительные системы или пары, состоящие из окисленной или восстановленной форм.
Реальный потенциал окислительно-восстановительной пары рассчитывается по уравнению Нернста, которое определяет зависимость электродного потенциала от концентрации веществ, участвующих в электродных процессах, от температуры среды, а также от концентрации ионов водорода, то есть рН раствора:
![]() =
= ![]() +
+ ![]() ,
(5.1)
,
(5.1)
где ![]() –
реальный электродный потенциал окислительно-восстановительной системы в
соответствующем растворе;
–
реальный электродный потенциал окислительно-восстановительной системы в
соответствующем растворе;
![]() –
стандартный электродный потенциал окислительно-восстановительной системы;
–
стандартный электродный потенциал окислительно-восстановительной системы;
![]() –
универсальная газовая постоянная (8,314 Дж/моль∙К);
–
универсальная газовая постоянная (8,314 Дж/моль∙К);
![]() –
температура по шкале Кельвина;
–
температура по шкале Кельвина;![]()
![]() – число
Фарадея (96500 Кл/моль);
– число
Фарадея (96500 Кл/моль);
![]() – число
электронов, участвующих в окислительно-восстановительном процессе.
– число
электронов, участвующих в окислительно-восстановительном процессе.
![]() ,
, ![]() – активность (концентрация)
окисленной и восстановленной форм в растворе.
– активность (концентрация)
окисленной и восстановленной форм в растворе.
Подставляя значения R, F, Т = 298К, множитель 2,3 перехода от натурального логарифма к десятичному, перепишем уравнение Нернста в сокращенном виде:
![]() =
= ![]() +
+ ![]() .
(5.2)
.
(5.2)
2 Классификация электродов
В основу классификации электродов положены процессы, происходящие на границе раздела электрод – раствор электролита. Различают три типа электродов.
1) Металлические электроды
- Электродная реакция для них запишется следующим уравнением:
Ме0
![]() Меп+.
Меп+.
- Схема металлического электрода: Ме0 / Меп+.
- Уравнение Нернста для расчета потенциала металлического электрода:
![]() . (5.3)
. (5.3)
Для разбавленных растворов, где активности мало отличаются от концентрации (а
![]() с),
активность можно заменить на концентрацию.
с),
активность можно заменить на концентрацию.
Если ![]() , то
, то
![]() .
.
2) Газовые электроды
Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащем ионы этого газа. Металлический проводник служит для подвода и отвода электронов, а также является катализатором электродной реакции (ускоряет установление равновесия на электроде). Металлический проводник не должен посылать в раствор собственные ионы. Лучше всего удовлетворяют этому условию платина и платиновые металлы, которые чаще всего используются при создании газовых электродов.
В равновесных электродных процессах газовых электродов участвуют газообразные компоненты, поэтому их электродные потенциалы зависят от парциальных давлений газов.
а) Водородный электрод.
- Схема электрода: Н2, Pt / Н+ .
-
Реакция, протекающая на водородном электроде: ![]() .
.
- Уравнение Нернста для расчета потенциала водородного электрода:
![]() ,
(5.4)
,
(5.4)
где ![]() -
активность ионов Н+ электролита;
-
активность ионов Н+ электролита;
![]() -
относительное парциальное давление водорода.
-
относительное парциальное давление водорода.
Учитывая, что ![]() =
=
![]() ,
, ![]() получаем при 298К
получаем при 298К
![]() .
(5.5)
.
(5.5)
Потенциал водородного электрода принимает более отрицательное значение с увеличением давления водорода и значения рН.
б) Кислородный электрод
Для того, чтобы создать кислородный электрод, необходимо металлическую пластину, например платину, привести в контакт с кислородом и раствором, содержащим ионы, образующиеся при восстановлении кислорода (ионы ОН-).
- Схема электрода: О2, Pt / ОН- .
-
Реакция, протекающая на электроде: О2 + 2Н2О + 4![]()
![]() 4ОН-
4ОН-
- Уравнение Нернста для расчета потенциала кислородного электрода:
![]() ,
(5.6)
,
(5.6)
где ![]() -
стандартный потенциал кислородного электрода, равный 0,401В (при
-
стандартный потенциал кислородного электрода, равный 0,401В (при ![]() ).
).
Так как активность Н2О в ходе реакции меняется мало, ее считают
постоянной величиной и значение вводят в величину стандартного потенциала.
Учитывая, что ![]() -
постоянная величина,
-
постоянная величина, ![]() ,
, ![]() , получаем
, получаем
![]() .
(5.7)
.
(5.7)
Потенциал кислородного электрода принимает более положительное значение с увеличением давления кислорода и уменьшением рН.
Наряду с газовыми электродами в качестве электродов сравнения можно использовать каломельные и хлорсеребряный электроды.
3) Окислительно-восстановительные (редокси) электроды.
Окислительно-восстановительные электроды – электроды, в реакциях которых не принимают участия металлы и газы. В качестве электрода обычно используется Pt или Au пластинка, которая играет роль проводника электронов и в самой реакции не участвует. Раствор содержит одновременно окисленную и восстановленную формы вещества.
- Схема электрода: Pt / Ox, Red .
- Реакция, протекающая на электроде: Ох + ne Û Red.
- Уравнение Нернста для расчета потенциала редокси-электрода:
![]() ,
(5.8)
,
(5.8)
Потенциал окислительно-восстановительных электродов служит мерой окислительной или восстановительной способности систем: окислительная способность возрастает со сдвигом потенциала в сторону положительных значений, восстановительная активность- в сторону отрицательных значений.
Типовая задача № 1
Вычислить электродный потенциал железного электрода, погруженного в раствор
FeCI2
c концентрацией ионов с(Fe2+) = 0,1моль/л. Стандартный электродный потенциал
системы: ![]() = -
0,44 B.
= -
0,44 B.
Решение
а) При погружении железного электрода в раствор FeCI2 происходит окислительно-восстановительный процесс:
Fe0
![]() Fe2+.
Fe2+.
б) Рассчитаем реальный электродный потенциал железного электрода
по уравнению Нернста (6.2):
![]() =
=
![]()
![]() +
+
![]() Ig c(Fe2+).
Ig c(Fe2+).
![]() =
- 0,44 + 0,0295 ∙ Ig 10-1
=
- 0,44 + 0,0295 ∙ Ig 10-1 ![]() = - 0,44 – 0,0295 = -
0,47.
= - 0,44 – 0,0295 = -
0,47.
Ответ:
![]() = - 0,47
B.
= - 0,47
B.
Типовая задача № 2
Рассчитайте значение реального потенциала электрода, на котором протекает реакция по уравнению:
MnO![]() +
8H+
+
8H+
![]() Mn2+
+ 4H2O
.
Mn2+
+ 4H2O
.
Значение стандартного электродного потенциала системы: +1,51 В; концентрации
ионов Mn2+ и
MnO![]() равны 0,1 моль/л = 10-1 моль/л; pH = 5;
T =
298 K.
равны 0,1 моль/л = 10-1 моль/л; pH = 5;
T =
298 K.
Решение
а) Согласно уравнения Нернста (5.3) потенциал данного окислительно-восстановительного электрода равен:
![]() =
= ![]() +
+ ![]() .
.
Концентрации веществ в твердой фазе и концентрация воды принимаются величинами постоянными и входят в значение Е0, поэтому уравнение потенциала упрощается:
![]() =
= ![]() +
+![]() .
.
б) Подставив величины концентраций ионов из условия задачи, перепишем уравнение:
![]() = 1,51 + 0,0118
= 1,51 + 0,0118![]()
![]() = 1,51 + 0,0118 Ig 10-1 + 0,0118 Ig c8(H+)
– 0,0118Ig 10-1
= 1,51 + 0,0118 Ig 10-1 + 0,0118 Ig c8(H+)
– 0,0118Ig 10-1
![]() = 1,51 - 0,0118 + 0,0118 ∙ 8 Ig c(H+) + 0,0118.
= 1,51 - 0,0118 + 0,0118 ∙ 8 Ig c(H+) + 0,0118.
в) Так как рН = -Ig c(H+), то уравнение приобретает вид:
![]() = 1,51 + 0,018 ∙ 8 ∙(-5)
= 1,04.
= 1,51 + 0,018 ∙ 8 ∙(-5)
= 1,04.
Ответ: ![]() = +1,04
B.
= +1,04
B.
Типовая задача № 3
Вычислите концентрацию ионов Н+ в растворе, в котором потенциал водородного электрода равен – 0,082 В.
Решение
а) На основании уравнения Нернста (5.4) и учитывая то, что рН = -Ig c(H+), запишем уравнение для определения электродного потенциала водородного электрода:
Е![]() = - 0,059
pH.
= - 0,059
pH.
Следовательно, рН = - ![]() = -
= - ![]() = 1,39.
= 1,39.
б) Рассчитаем концентрацию ионов Н+: -Ig c(H+) = 1,39; Ig c(H+) = -1,39, отсюда
с(Н+) = 10-1,39 = 0,041 моль/л.
Ответ: c(H+) = 0,041 моль/л.
Типовая задача № 4
Найдите величину рН раствора и концентрацию гидроксид-ионов, если потенциал водородного электрода в исследуемом растворе равен – 0,590 В.
Решение
а) Рассчитаем рН раствора на основании формулы потенциала водородного электрода:
Е![]() = E0
= E0![]()
![]() +
+![]() 0,059
Ig c(H+),
0,059
Ig c(H+),
где
E0![]() = 0, то есть Е
= 0, то есть Е![]() = - 0,059
pH.
= - 0,059
pH.
Отсюда: рН = - ![]() =
=
![]() =
10.
=
10.
б) По величине рН = 10 определим концентрацию ионов водорода:
c(H+) = 10-10 моль/л.
в) Используя выражение ионного произведения воды:
c(H+) ∙ c(OH-) = 10-14,
найдем концентрацию гидроксид-ионов:
c(OH-) = ![]() = 10-4.
= 10-4.
Ответ: рН = 10, с(ОН-) = 10-4моль/л.
Типовая задача № 5
Вычислите окислительно-восстановительный потенциал системы Cr3+/Cr2+ в растворе с отношением концентраций ионов 1: 10, если
![]() = - 0,407 В при 298 К.
= - 0,407 В при 298 К.
Решение
Рассчитаем потенциал окислительно-восстановительной системы согласно
уравнения Нернста (6.2): ![]() =
= ![]() +
+ ![]() ;
;
![]() = -0,407 + 0,059
= -0,407 + 0,059
![]() ;
;
![]() =
-0,407 + 0,059 Ig10-1 = -0,466.
=
-0,407 + 0,059 Ig10-1 = -0,466.
Ответ: ![]() = - 0,466 В.
= - 0,466 В.
3 Гальванический элемент. ЭДС гальванического элемента
Система, состоящая из двух электродов, помещенных в раствор электролита, в которой энергия окислительно - восстановительной реакции преобразуется в электрический ток, называется гальваническим элементом.
3.1 Общие положения о гальваническом элементе
1) В гальваническом элементе можно осуществить ту окислительно-восстановительную реакцию, которая протекает самопроизвольно.
2) Причиной возникновения электрического тока в любом гальваническом элементе является разность потенциалов между электродами.
3) Анодом гальванического элемента является тот электрод, который обладает меньшим значением электродного потенциала (более отрицательным). На аноде всегда идет процесс окисления. Анод – отрицательный полюс гальванического элемента.
4) Катодом гальванического элемента является тот электрод, который
обладает более электроположительным значением потенциала. На катоде всегда идет процесс восстановления катионов электролита, в котором находится данный электрод. Катод – положительный полюс гальванического элемента.
5) Чем больше разность потенциалов двух электродов гальванического элемента, тем больше его электродвижущая сила (ЭДС).
ЭДС (Г.Э.) = Е катода - Е анода > O, (5.9)
где Е катода , Еанода – электродный потенциал соответственно катода и анода.
6) Поскольку в любом гальваническом элементе можно осуществить только самопроизвольно протекающую окислительно-восстановительную реакцию, то ∆G < O, где ∆G – свободная энергия Гиббса.
7) Так как гальванический элемент – это источник электрического тока, то для него вводится понятие работы электрического тока:
А = п(ē) ∙ F ∙ ЭДС (Г.Э) = п(ē) ∙ F ∙ E, (5.10)
где Е – разность потенциалов (ЭДС) гальванического элемента;
F – число Фарадея (96500 Кл);
п(ē) – число электронов, участвующих в окислительно-восстановительной реакции.
3.2 Схема работы гальванического элемента
Для удобства устройство гальванического элемента изображают не рисунком, а электрохимической схемой.
В соответствии с электрохимической схемой сначала указывается материал одного из электродов, далее – раствор, в который помещен этот электрод, затем раствор, в который погружен второй электрод, и, наконец, материал другого электрода. Одну сплошную вертикальную черту (I) используют для указания границы раздела фаз между электродом и растворм электролита, двойную вертикальную черту (П) – для границы раздела фаз между соприкасающимися жидкостями.
Состав цинк-водородного электрода может быть описан схемой:
(-) Zn│ZnSO4, р-р ║ р–р H2SO4 │Pt, Н2 (+).
3.3 Химические и концентрационные гальванические элементы
Гальванические элементы, в которых электрическая энергия получается за счет химической энергии вследствие различной природы электродов, называются химическими. Например, описанный выше цинк - водородный гальванический электрод.
Существуют концентрационные гальванические элементы. Концентрационный гальванический элемент состоит из двух одинаковых металлов, опущенных в растворы солей с различной активностью ионов. Примером концентрационных гальванических элементов может служить гальванический элемент с медными электродами, погруженными в растворы сульфата меди (П) с концентрацией ионов меди сI и сII . Схематически такой элемент может быть представлен:
(-) Си│CuSO4 , р-р ║ CuSO4 , р-р│Cu (+) при сI < сII.
![]()
![]()
В концентрационной гальванической цепи анодом является электрод, погруженный в раствор с меньшей концентрацией ионов. При работе гальванической цепи на аноде идет окисление меди:
(-) А : Си0 ![]() Си2+
Си2+
на катоде – восстановление ионов меди из раствора:
(+) К : Си2+ ![]() Си0.
Си0.
Электродный потенциал концентрационного гальванического элемента зависит от соотношения концентраций ионов электролита; при сI < сII
![]()
![]() =
= ![]() .
(5.11)
.
(5.11)
Типовая задача № 6
Записать схему работы гальванического элемента, составленного из железной пластинки в растворе сульфата железа (П) и медной пластинки в растворе сульфата меди (П). Какие процессы протекают на электродах гальванического элемента? Привести уравнения реакций.
Решение
а) Находим значения стандартных электродных потенциалов систем (см.приложение 3) железного и медного электродов:
![]() = -0,44 В;
= -0,44 В;
![]() =
+0,34 B.
=
+0,34 B.
Значение стандартного электродного потенциала медного электрода больше, чем железного:
![]() = -0,44 В <
= -0,44 В <
![]() =
+0,34 B.
=
+0,34 B.
Следовательно, медный электрод является катодом, а железный – анодом данного гальванического элемента.
б) Приведем электрохимическую схему данного гальванического элемента:
(-) Fe│FeSO4 ║ CuSO4│Cu (+).
в) Запишем процессы (полуреакции), протекающие на электродах данного гальванического элемента.
![]() 1 х (-) А
Fe0
1 х (-) А
Fe0 ![]() Fe2+, процесс окисления
Fe2+, процесс окисления
1 х (+) К Си2+ ![]() Си0 ,
процесс восстановления
Си0 ,
процесс восстановления
Токообразующая реакция: Fe0 + Cu2+ = Fe2+ + Cu0
Fe0 + CuSO4 = FeSO4 + Cu.
Типовая задача № 7
Гальванический элемент состоит из металлического кадмия, погруженного в 0,1 М раствор нитрата кадмия (П) и металлической ртути, погруженной в 0,01 М раствор нитрата ртути (П). Вычислите ЭДС данного гальванического элемента, напишите уравнения электродных процессов, составьте схему гальванического элемента.
Решение
а)
Находим значения стандартных электродных потенциалов систем (см.
приложение 3): ![]() = -0,402
B;
= -0,402
B; ![]() = +0,850
B.
= +0,850
B.
б) Рассчитаем значения электродных потенциалов по уравнению Нернста:
![]() =
= ![]() +
+
![]() ;
;
![]() = -0,402 + 0,0295 ∙
Ig10-1
= -0,402- 0,0295 = -0,432 B.
= -0,402 + 0,0295 ∙
Ig10-1
= -0,402- 0,0295 = -0,432 B.
![]() =
= ![]() +
+
![]() ;
;
![]() = +0,850 + 0,0295 ∙
Ig10-2
= +0,850 - 0,059 = +0,791 B.
= +0,850 + 0,0295 ∙
Ig10-2
= +0,850 - 0,059 = +0,791 B.
в) Электродвижущая сила гальванического элемента определяется как разность электродных потенциалов электрода с большим значением Е (катода) и электрода с меньшим значением Е (анода):
ЭДС = ![]() -
- ![]() = +0,791 - (-0,432) = +1,224 В.
= +0,791 - (-0,432) = +1,224 В.
ЭДС > 0, следовательно, данный гальванический элемент будет работать.
г) На ртутном электроде будет проходить процесс восстановления, то есть он будет служить катодом, а кадмиевый электрод – анодом.
![]() 1 х (-) А
Cd0
1 х (-) А
Cd0 ![]() Cd2+, процесс окисления
Cd2+, процесс окисления
1 х (+) К Hg2+ ![]() Hg0 , процесс восстановления
Hg0 , процесс восстановления
Токообразующая реакция: Cd0 + Hg2+ = Cd2+ + Hg0
Cd0 + Hg(NO3)2 = Cd(NO3)2 + Hg0.
д) Схема гальванического элемента примет следующий вид:
(-) Cd│Cd(NO3)2 ║Hg(NO3)2│Hg (+).
4 Задания для самостоятельной работы
4.1 Рассчитайте значение реального потенциала металлического электрода «а»,
погруженного в раствор электролита с концентрацией ионов металла с(Ме+п)
= «б» моль/л, если стандартный электродный потенциал системы ![]() = «в» В.
Ответ:
= «в» В.
Ответ: ![]() = «г» В.
= «г» В.
4.2 Рассчитайте значение реального потенциала электрода, на котором
протекает окислительно-восстановительный процесс «д». Значение
стандартного электродного потенциала системы ![]() = «е»; Т = 298 К;
рН = «ж»;
с(ОФ) и с(ВФ) = «з» моль/л. Ответ:
= «е»; Т = 298 К;
рН = «ж»;
с(ОФ) и с(ВФ) = «з» моль/л. Ответ:
![]() = «и»
В.
= «и»
В.
|
Вт |
«а» |
«б» |
«в» |
«г» |
«д» |
|
1 |
Zn+2/Zn |
0,10 |
-0,76 |
-0,79 |
MnO |
|
2 |
Cu+2/Cu |
0,01 |
+0,34 |
0,28 |
MnO2 + 4H+ |
|
3 |
Mg+2/Mg |
1,00 |
-2,36 |
-2,36 |
HBrO + H+ |
|
4 |
Ag+/Ag |
0,01 |
+0,80 |
0,68 |
BrO |
|
5 |
Cd+2/Cd |
0,10 |
-0,40 |
-0,43 |
IO |
|
6 |
Hg+2/Hg |
1,00 |
+0,85 |
0,85 |
AsO |
|
7 |
Fe+2/Fe |
0,01 |
-0,44 |
-0,49 |
Cr2O |
|
8 |
Au+3/Au |
0,10 |
+1,50 |
1,48 |
CIO |
|
9 |
Cr+3/ Cr |
1,00 |
-0,74 |
-0,74 |
HCIO + H+ |
|
10 |
Bi+3/ Bi |
0,01 |
+0,21 |
0,17 |
2IO |
|
11 |
Mn+2/Mn |
0,10 |
-1,19 |
-1,22 |
2HIO + 2H+ |
|
12 |
Ca+2/ Ca |
1,00 |
-2,87 |
-2,87 |
H2O2 + 2H+ |
|
13 |
Pd+2/ Pd |
0,01 |
+0,92 |
0,86 |
O2 + 2H+ |
|
14 |
Ni+2/ Ni |
0,10 |
-0,25 |
-0,28 |
O2 + 4H+ |
|
15 |
Pt+2/ Pt |
0,01 |
+1,19 |
1,13 |
H3PO4 + 2H+ |
|
16 |
Sn+2/ Sn |
0,10 |
-0,14 |
-0,17 |
NO |
|
17 |
Au+/ Au |
1,00 |
+1,69 |
1,69 |
S(тв)
+
2H+ |
|
18 |
Pb+2/ Pb |
0,10 |
-0,13 |
-0,16 |
Se(тв) + 2H+ |
|
19 |
Cu+/ Cu |
0,01 |
+0,52 |
0,40 |
Te(тв) + 2H+ |
|
20 |
Fe+3/ Fe |
1,00 |
-0,04 |
-0,04 |
PbO2(тв)
+ 4H+ |
|
21 |
Mo+3/Mo |
0,01 |
-0,20 |
-0,24 |
NO |
|
22 |
Co+2/ Co |
0,10 |
-0,28 |
-0,31 |
NO |
|
23 |
Na+ / Na |
1,00 |
-2,71 |
-2,71 |
2HCIO + 2H+ |
|
24 |
Co+3/ Co2+ |
0,10 |
+1,81 |
1,79 |
2CIO |
|
25 |
AI+3/ AI |
0,01 |
-1,66 |
-1,70 |
SO |
4.3 Определите величину рН и концентрацию гидроксид-ионов, если потенциал водородного электрода в исследуемом растворе равен «к» В.
Ответ: рН = «л»; c(ОН-) = «м» моль/л.
4.4 Составьте электрохимическую схему гальванического элемента, на электродах которого самопроизвольно протекает окислительно-восстановительная реакция «н». Приведите уравнения анодного и катодного процессов данного гальванического элемента.
|
Вт |
«е» |
«ж» |
«з» |
«и» |
«к» |
«л» |
«м»
|
|
1 |
1,51 |
10 |
1,00 |
0,57 |
-0,0590 |
1,0 |
10-13 |
|
2 |
1,23 |
5 |
0,01 |
0,70 |
-0,0649 |
1,1 |
1,3 ∙ 10-13 |
|
3 |
1,34 |
2 |
0,10 |
1,28 |
-0,0708 |
1,2 |
1,6 ∙ 10-13 |
|
4 |
1,44 |
5 |
0,01 |
1,15 |
-0,0767 |
1,3 |
2,0 ∙ 10-13 |
|
5 |
1,09 |
2 |
1,00 |
0,97 |
-0,0826 |
1,4 |
2,5 ∙ 10-13 |
|
6 |
0,56 |
4 |
0,10 |
0,09 |
-0,0885 |
1,5 |
3,2 ∙ 10-13 |
|
7 |
1,33 |
5 |
1,00 |
0,64 |
-0,0944 |
1,6 |
4,0 ∙ 10-13 |
|
8 |
1,45 |
5 |
0,10 |
1,16 |
-0,1003 |
1,7 |
5,0 ∙ 10-13 |
|
9 |
1,49 |
3 |
0,01 |
1,40 |
-0,1062 |
1,8 |
6,3 ∙ 10-13 |
|
10 |
1,19 |
5 |
1,00 |
0,84 |
-0,1121 |
1,9 |
7,9 ∙ 10-13 |
|
11 |
1,45 |
10 |
0,10 |
0,80 |
-0,1180 |
2,0 |
10-12 |
|
12 |
1,78 |
2 |
0,01 |
1,60 |
-0,1239 |
2,1 |
1,3 ∙ 10-12 |
|
13 |
0,68 |
3 |
1,00 |
0,50 |
-0,1298 |
2,2 |
1,6 ∙ 10-12 |
|
14 |
1,23 |
5 |
0,10 |
0,92 |
-0,1770 |
3,0 |
10-11 |
|
15 |
-0,28 |
10 |
0,01 |
-0,87 |
-0,2360 |
4,0 |
10-10 |
|
16 |
0,87 |
2 |
1,00 |
0,72 |
-0,2950 |
5,0 |
10-9 |
|
17 |
0,17 |
2 |
0,10 |
0,08 |
-0,3540 |
6,0 |
10-8 |
|
18 |
-0,4 |
5 |
0,01 |
-0,64 |
-0,4130 |
7,0 |
10-7 |
|
19 |
-0,72 |
10 |
0,10 |
-1,28 |
-0,4720 |
8,0 |
10-6 |
|
20 |
1,45 |
3 |
1,0 |
1,10 |
-0,5310 |
9,0 |
10-5 |
|
21 |
0,84 |
5 |
0,10 |
0,55 |
-0,5900 |
10,0 |
10-4 |
|
22 |
0,77 |
2 |
0,01 |
0,53 |
-0,6490 |
11,0 |
10-3 |
|
23 |
1,63 |
3 |
1,00 |
1,45 |
-0,7080 |
12,0 |
10-2 |
|
24 |
1,47 |
5 |
0,10 |
1,11 |
-0,7670 |
13,0 |
10-1 |
|
25 |
0,20 |
3 |
0,01 |
0,02 |
-0,8200 |
14,0 |
1,0 |
4.5 Рассчитайте электродвижущую силу (ЭДС) гальванического элемента «о», каждый электрод которого погружен в раствор соответствующего электролита с одинаковой концентрацией ионов «п» моль/л. Определите катод, анод, запишите уравнения электродных процессов для данного гальванического элемента. Ответ: ЭДС = «р» В.
|
Вт |
«н» |
«о» |
«п» |
«р»
|
|
1 |
Li + AgNO3 = LiNO3 + Ag |
Mn | Mn+2 || Zn+2 | Zn |
0,001 |
0,43 |
|
2 |
AI + Cr(NO3)3 = AI(NO3)3 + Cr |
Zn│Zn+2║Cu+2│Cu |
0,010 |
1,10 |
|
3 |
Zn + SnSO4 = ZnSO4 + Sn |
Li│Li+║H+│H2, Pt |
0,100 |
3,04 |
|
4 |
Ba + Hg(NO3)2 = Ba(NO3)2 + Hg |
Fe│Fe+2║Ni+2│Ni |
1,000 |
0,19 |
|
5 |
2Bi +3CuCI2 = 2BiCI3 + 3Cu |
Cd│Cd+2║Ag+│Ag |
0,001 |
1,11 |
|
6 |
Ca + ZnSO4 = CaSO4 + Zn |
H2, Pt│H+║Cu+2│Cu |
0,010 |
0,40 |
|
7 |
Cd + SnCI2 = CdCI2 + Sn |
Zn│Zn+2║Ag+│Ag |
0,100 |
1,53 |
|
8 |
Co + Pt(NO3)2 = Co(NO3)2 + Pt |
Mg│Mg+2║Ni+2│Ni |
1,000 |
2,11 |
|
9 |
Cr + FeCI3 = CrCI3 + Fe |
Cd│Cd+2║H+│H2, Pt |
0,001 |
0,31 |
|
10 |
Cu + AgNO3 = CuNO3 + Ag |
AI│AI+3║Bi+3│Bi |
0,010 |
1,87 |
|
11 |
Fe + HgCI2 = FeCI2 + Hg |
Na│Na+║Hg+2│Hg |
0,100 |
3,59 |
|
12 |
Mo + Fe(NO3)3 = Mo(NO3)3 + Fe |
Ca│Ca+2║H+│H2, Pt |
1,000 |
2,87 |
|
13 |
Hg + PtCI2 = HgCI2 + Pt |
Pb│Pb+2║Au+│Au |
0,001 |
1,73 |
|
14 |
2K + Cu(NO3)2 = 2KNO3 + Cu |
Sn│Sn+2║Cu+│Cu |
0,010 |
0,60 |
|
15 |
2Ag + PtCI2 = 2AgCI + Pt |
H2, Pt│H+║Ag+│Ag |
0,100 |
0,80 |
|
16 |
Mg + MnSO4 = MgSO4 + Mn |
Cr│Cr+3║Co+2│Co |
1,000 |
0,47 |
|
17 |
Mn + FeSO4 = MnSO4 + Fe |
Ni│Ni+2║Pb+2│Pb |
0,001 |
0,13 |
|
18 |
Na + AgNO3 = NaNO3 + Ag |
Na│Na+║H+│H2, Pt |
0,010 |
2,71 |
|
19 |
Ni + CuCI2 = NiCI2 + Cu |
Mo│Mo+3║Fe+3│Fe |
0,100 |
0,16 |
|
20 |
Pb + Hg(NO3)2 = Pb(NO3)2 + Hg |
Co│Co+2║Sn+2│Sn |
1,000 |
0,14 |
|
21 |
Pd + Pt(NO3)2 = Pd(NO3)2 + Pt |
H2, Pt│H+║Au+│Au |
0,001 |
1,69 |
|
22 |
Sn + CuCI2 = SnCI2 + Cu |
Cu│Cu+2║Pd+2│Pd |
0,010 |
1,14 |
|
23 |
Zn +Co(NO3)2 = Zn(NO3)2 +Co |
Ag│Ag+║Co+3│Co |
0,100 |
2,53 |
|
24 |
Cu +2AgNO3 = Cu(NO3)2 + Ag |
AI│AI+3║H+│H2, Pt |
1,000 |
1,66 |
|
25 |
Fe + SnCI2 = FeCI2 + Sn |
K│K+║Hg+2│Hg |
0,001 |
3,86 |
Тема 6
Электролиз
1 Понятие об электролизе
Электролиз - это окислительно-восстановительный процесс, возникающий на электродах при прохождении электрического тока через раствор или расплав электролита.
1) Аппараты (или сосуды), в которых проводят электролиз, называются электролизерами или электролизными ваннами. Электролизер состоит из сосуда с раствором или расплавом электролита и электродов, соединенных с источником постоянного тока.
![]()
![]() Электролит КА
Кn+ + Аn-
электролизер
Электролит КА
Кn+ + Аn-
электролизер
(водный раствор) Н2О
2) Электрод, на котором протекает процесс окисления (отдача электронов), называют всегда анодом. Анод при электролизе соединен с положительным полюсом источника постоянного тока. В электролизере он имеет «+» знак (отдает электроны, заряжается положительно).
Аноды бывают растворимые (активные) и нерастворимые (инертные). Нерастворимые аноды изготовляют из платины, палладия, графита, а в последнее время используются оксидные рутениево-титановые аноды (ОРТА). Нерастворимые аноды в процессе электролиза не окисляются. Растворимые аноды – из меди, железа, никеля, цинка и других металлов – в процессе электролиза окисляются.
3) Электрод, на котором протекает процесс восстановления (присоединение электронов), называют катодом. Катод при электролизе соединен с отрицательным полюсом источника постоянного тока. В электролизере он имеет « - » знак (принимает электроны, заряжается отрицательно). Катоды можно изготовить из любого проводящего ток материала, так как катоды при электролизе не восстанавливаются.
4) В электролизере окислительно-восстановительная реакция не протекает самопроизвольно, поэтому ΔG (ОВР), протекающей в электролизере, всегда > 0; ЭДС (ОВР), протекающей в электролизере, всегда < 0.
5) Для того, чтобы в электролизере на его электродах могло протекать разложение электролита, на электроды подают не любую разность потенциалов от источника тока, а необходимую для разложения данного электролита. Эту разность потенциалов называют напряжением разложения электролита.
2 Последовательность протекания электродных процессов
2.1 Электролиз расплава электролита
При электролизе в расплавах солей на катоде происходит восстановление катионов активных и малоактивных металлов, а на аноде – окисление анионов бескислородных и кислородсодержащих кислот, причем, при окислении анионов кислородсодержащих кислот получается смесь различных продуктов.
Например, при высоких температурах КВr плавится и
одновременно диссоциирует на ионы: KBr →
K+ +
Br![]() , которые затем разряжаются на электродах.
Cхема
процесса электролиза расплава КВr такова:
, которые затем разряжаются на электродах.
Cхема
процесса электролиза расплава КВr такова:
KBr
(С) К (-)
![]() (+)
A (С )
(+)
A (С )
← К+ + Вr![]() →
→
![]()
![]() (-)
K: К+
(-)
K: К+ ![]() К 2
К 2
![]() (+) A: 2Br
(+) A: 2Br![]()
![]() Br2
1
Br2
1
![]() 2К+
+ 2Вr
2К+
+ 2Вr![]() электролиз 2K +
Br2
электролиз 2K +
Br2
![]()
![]()
![]() 2KBr
электролиз 2K +
Br2
2KBr
электролиз 2K +
Br2
2.2 Электролиз раствора электролита
Электролиз растворов электролитов всегда сложен, так как в электролите присутствуют несколько видов катионов и анионов, а также недиссоциированных молекул электрохимически активных веществ (например, воды).
Если электролит является водным раствором, то на катоде и аноде могут разряжаться не только ионы электролита, но и конкурирующие с ними молекулы Н2О.
2.2.1 Последовательность восстановления катиона.
Последовательность определяется значениями электродных потенциалов Е0Меп+/Ме: чем положительнее этот потенциал, тем легче идет восстановление катионов.
1) Катионы металлов, у которых стандартный электродный потенциал больше, чем у водорода (от Си2+ до Аи3+), при электролизе практически полностью восстанавливаются на катоде.
2) Катионы металлов с малой величиной стандартного электродного потенциала (от Li+ до AI3+ включительно) не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды, а в кислой среде – ионы водорода. В промышленности эти металлы получают электролизом их расплавленных солей.
3) Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от Мп2+ до Н2). В зависимости от условий проведения электролиза (рН раствора, плотности тока, потенциала разложения и др.) возможно преимущественное восстановление молекул воды (в кислотных растворах – ионов водорода) или катионов металла, в противном случае, протекает одновременное восстановление на катоде и молекул воды, и катионов металла.
Таблица 5 - Последовательность восстановления катиона на катоде
|
Разряжаемые катионы
Легко разряжаемые катионы: Au+,Au3+,Pt2+,Hg2+,Ag+,Cu2+,Cu+,Bi3+ Е0Меn+/Ме
> 0
|
(раствор водный)
Меn+ + nē Me0
|
Продукт на катоде
Ме0 - |
|
Трудно разряжаемые катионы: Li+,Na+,K+,Ca2+,Al3+… Е0Меn+/Me< -0,828 В |
2Н2О +2ē 2ОН- + Н2 |
- Н2 ОН- - ионы около катода. |
|
Катионы, занимающие промежуточное положение: Zn2+,Co2+,Fe2+,Ni2+… -0,828 В < E0Меп+/Ме <0 |
|
Ме0 Н2 ОН- - ионы около катода. |
Рассмотрим электролиз водного раствора сульфата натрия с инертными
электродами. Стандартный электродный потенциал системы Е![]() = -2,71В значительно
отрицательнее потенциала водородного электрода в нейтральной водной среде.
Поэтому на катоде будет происходить восстановление молекул воды, а ионы
Na+, приходящие к катоду, будут накапливаться в
прилегающей к нему части раствора (катодное пространство).
= -2,71В значительно
отрицательнее потенциала водородного электрода в нейтральной водной среде.
Поэтому на катоде будет происходить восстановление молекул воды, а ионы
Na+, приходящие к катоду, будут накапливаться в
прилегающей к нему части раствора (катодное пространство).
2Н2О ![]() Н2↑ + 2ОН-.
Н2↑ + 2ОН-.
На аноде будет происходить окисление
молекул воды, приводящее к выделению кислорода, так как
SO![]() -
ионы являются трудноразряжаемыми: стандартный электродный потенциал разложения
SO
-
ионы являются трудноразряжаемыми: стандартный электродный потенциал разложения
SO![]() -
ионов (2,01 В) значительно выше, чем стандартный электродный потенциал
разложения молекул воды (1,23 В). Ионы SO
-
ионов (2,01 В) значительно выше, чем стандартный электродный потенциал
разложения молекул воды (1,23 В). Ионы SO![]() ,
движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
,
движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
2Н2О ![]() О2↑ + 4Н+.
О2↑ + 4Н+.
Схематически процесс электролиза можно представить следующим образом:
Na2SO4
(С) К (-) ↓ (+) A (С)
← 2Na+ +
SO![]() →
→
H2O
![]()
![]()
![]() (-)
K: 2Н2О
(-)
K: 2Н2О
![]() Н2↑
+ 2ОН
Н2↑
+ 2ОН![]() 4 2
4 2
(+) A: 2Н2О ![]() О2↑ + 4Н+
2 1
О2↑ + 4Н+
2 1
![]()
![]() 6H2O электролиз Н2 + О2
+ 4ОН
6H2O электролиз Н2 + О2
+ 4ОН![]() + 4Н+
+ 4Н+
6H2O + 2Na2SO4 электролиз 2Н2↑ + О2 ↑ + 4NaOH + 2H2SO4.
![]() катод анод около катода около анода
катод анод около катода около анода
В катодном пространстве накапливаются ионы Na+ и ионы ОН-, то есть образуется щелочь, а около анода среда становится кислой за счет образования серной кислоты. Следовательно, электролиз водного раствора сульфата натрия сводится к электролизу воды.
![]() 4) При электролизе водных растворов кислот (НСI,
H2SO4…) на катоде идет процесс восстановления катионов
водорода: 2Н+ +2ē Н2.
4) При электролизе водных растворов кислот (НСI,
H2SO4…) на катоде идет процесс восстановления катионов
водорода: 2Н+ +2ē Н2.
2.2.2 Последовательность окисления аниона.
Последовательность зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод.
1) На аноде легче будут окисляться те частицы, для которых Е0ОВ/ВФ меньше (более отрицательное).
2)
В первую очередь окисляются простые анионы в порядке возрастания величины
их стандартных потенциалов, не превышающих 1,5 В (S![]() ,
I
,
I![]() ,
Br
,
Br![]() ,
CI
,
CI![]() ).
При электролизе растворов HI,
HBr,
HCI и их солей (кроме НF и фторидов) у
анода выделяется соответствующий галоген.
).
При электролизе растворов HI,
HBr,
HCI и их солей (кроме НF и фторидов) у
анода выделяется соответствующий галоген.
3) Если же раствор содержит анионы кислородcодержащих кислот или фторид - ионы, то на аноде вместо них окисляются молекулы воды с выделением кислорода.
![]() 4) При электролизе водных растворов щелочей (NaOH,
KOH…) на аноде идет процесс окисления гидроксид-ионов: 4ОН-
- 4ē О2 ↑ + Н2О.
4) При электролизе водных растворов щелочей (NaOH,
KOH…) на аноде идет процесс окисления гидроксид-ионов: 4ОН-
- 4ē О2 ↑ + Н2О.
К примеру, электролиз водного раствора КОН с платиновыми электродами. Ионы К+ и ОН-, образующиеся при диссоциации КОН, переносят электричество, но в электродном процессе (анодном) участвует только один вид ионов – ОН- , что не ведет к разложению электролита. Разложению подвергаются молекулы воды.
KOH
(Pt) К (-) ↓ (+) A (Pt)
← K+ + OH- →
![]()
![]()
![]() H2O
H2O
(-) K: 2Н2О ![]() Н2↑ + 2ОН-
4 2
Н2↑ + 2ОН-
4 2
(+) A: 4OH- ![]() О2↑
+ 2Н2O 2 1
О2↑
+ 2Н2O 2 1
4 Н2О + 4OH- ![]() 2H2↑ + 4OH-
+ О2↑ + 2Н2O
2H2↑ + 4OH-
+ О2↑ + 2Н2O
2 Н2О ![]() 2H2↑ + О2↑
2H2↑ + О2↑
Таблица 6 - Последовательность окисления анионов на аноде
|
Анионы |
Реакция на аноде (раствор водный) |
Продукт на аноде |
|
Легко разряжаемые анионы:
S2-,
CI Исключение:
F |
Аnn-
Н2О
|
Аn0 (CI2, I2, Br2, S) - |
|
Трудно разряжаемые анионы:
SO то есть анионы кислородсодержащих кислот. |
Аnn-
2Н2О
|
- О2 Примечание: Н+- ионы около анода |
2.2.3 Электролиз с растворимым анодом.
Если анод изготовлен из металла (Cu, Fe, AI, Zn .., кроме Pt, Pd, C), то на аноде идет процесс окисления не ионов электролита и не молекул воды, а окисляется сам металл, из которого изготовлен анод.
В электролизере с растворимым анодом идет окисление (растворение) самого анода; к катоду перемещаются катионы металла электролита. Например, электролиз водного раствора сульфата цинка с применением электродов из цинка.
У цинка более отрицательный электродный потенциал, чем у платины или угольного электрода, поэтому электроны с него будут откачиваться источником тока, а положительные ионы – переходить в раствор. Цинковый анод растворяется, ионы Zn2+ перемещаются к катоду, там разряжаются и выделяется свободный металл. Количество соли в растворе остается неизменным: сколько цинка растворяется на аноде, столько же его выделяется на катоде.
ZnSO4
(Zn) К (-) ↓ (+) А (Zn)
← Zn2+ +
SO![]() →
→
H2O
Zn2+
![]() Zn
Zn
Zn
Zn
![]() Zn2+
Zn2+
Примером электролиза с активным анодом может служить электрохимическое
рафинирование (очистка) меди. При этом анод представляет собой пластинку черной
меди, подлежащую очистке, а катод – пластинку из химически чистой меди.
Электролитом служит водный раствор сульфата меди. При рафинировании медь
окисляется на аноде с переходом ионов Cu2+ в раствор:
Cu ![]() Cu2+, а на катоде выделяется чистая медь из раствора:
Cu2+
Cu2+, а на катоде выделяется чистая медь из раствора:
Cu2+ ![]() Cu0 .
Cu0 .
Типовая задача №1
Будут ли отличаться по составу продукты электролиза расплава и водного раствора FeCI2, осаждающиеся на платиновых электродах?
Решение
а) В расплаве FeCI2 имеется один вид катионов (Fe2+) и один вид анионов (CI-), которые и будут разряжаться на электродах при электролизе: Fe2+ - ионы восстанавливаются на катоде, CI- - ионы окисляются на аноде.
Запишем схему процесса электролиза.
FeCI2
(Pt) K (-) ↓ (+) A (Pt)
← Fe2+ + 2CI- →
![]()
![]()
![]() (-) K: Fe2+
(-) K: Fe2+
![]() Fe0
2 1
Fe0
2 1
(+) A: 2CI- ![]() CI2
2 1
CI2
2 1
Fe2+ + 2CI- ![]() Fe + CI2
Fe + CI2
FeCI2 ![]() Fe + CI2
Fe + CI2
б) В растворе FeCI2 находятся следующие ионы:
FeCI2 ![]() Fe2+ + 2CI-
Fe2+ + 2CI-
H2O ![]() H+ + OH-
H+ + OH-
Катионы Fe2+ направляются к катоду и восстанавливаются одновременно с молекулами воды, так как Fe2+ -ионы характеризуются промежуточным значением стандартного электродного потенциала:
-0,828 <
E![]() = -0,44
B < 0.
= -0,44
B < 0.
Анионы CI- являются легкоокисляемыми ионами, то есть слабее удерживают электроны по сравнению с молекулами воды, поэтому разражаются на аноде. Схему электролиза можно представить так:
FeCI2
(Pt) K (-) ↓ (+)A (Pt)
← Fe2+ + 2CI- →
H2O
![]()
![]()
![]() (-)K: Fe2+
(-)K: Fe2+ ![]() Fe
2 1
Fe
2 1
2H2O ![]() H2↑ + 2OH-
H2↑ + 2OH-
(+)A: 2CI- ![]() CI2 4
2
CI2 4
2
2Fe2+ + 2H2O + 4CI-
![]() 2Fe + H2↑
+ 2CI2↑ + 2OH-
2Fe + H2↑
+ 2CI2↑ + 2OH-
2FeCI2 + 2H2 ![]() Fe + H2↑
+ 2CI2↑ + Fe(OH)2↓
Fe + H2↑
+ 2CI2↑ + Fe(OH)2↓
Ответ: а) Электролиз расплава FeCI2 дает продукты: Fe, CI2↑.
б) При электролизе раствора FeCI2 получаем на катоде: Fe, H2↑,
около катода Fe(OH)2; на аноде: CI2↑.
3 Законы электролиза
Количественные соотношения при электролизе основываются на двух законах Фарадея.
3.1 Первый закон электролиза
Масса вещества, выделившегося на электроде, прямо пропорциональна количеству электричества, пропущенного через раствор или расплав электролита:
![]() ,
(6.1)
,
(6.1)
где ![]() – масса
продукта электролиза, г;
– масса
продукта электролиза, г;
![]() – количество
прошедшего через раствор электричества, Кл.
– количество
прошедшего через раствор электричества, Кл.
Так как количество электричества, прошедшего через раствор, равно произведению силы тока I в амперах на время τ в секундах, то
![]() ,
(6.2)
,
(6.2)
где ![]() –
электрохимический эквивалент. Он показывает, какая масса вещества выделится на
электроде, если через электролит пропустить 1 Кл электричества.
–
электрохимический эквивалент. Он показывает, какая масса вещества выделится на
электроде, если через электролит пропустить 1 Кл электричества.
3.2 Второй закон электролиза![]()
Если через разные электролиты пропускать одно и то же количество электричества, то массы веществ, выделяющихся на электродах двух различных электролитов, прямо пропорциональны молярным массам их эквивалентов.
Экспериментально установлено, для выделения молярной массы эквивалента
вещества (![]() )
требуется пропустить 96500 Кл электричества. Это число называется числом
Фарадея и обозначается буквой
)
требуется пропустить 96500 Кл электричества. Это число называется числом
Фарадея и обозначается буквой ![]() .
.
![]() .
(6.3)
.
(6.3)
Подставим выражение электрохимического эквивалента Кэ в формулу (7.1) закона Фарадея:
![]() . (6.4)
. (6.4)
Согласно законам Фарадея при электролизе количество выделяющихся веществ не зависит от температуры и концентрации раствора.
При электролизе во многих случаях выделяется меньше вещества, чем должно получиться согласно законам Фарадея. Для учета той части прошедшего через раствор электричества, которая расходуется на получение желаемого продукта, введено понятие выход по току.
Выход по току ![]() можно
определить как отношение массы вещества, полученного в данных условиях
электролиза (
можно
определить как отношение массы вещества, полученного в данных условиях
электролиза (![]() ),
к массe, теоретически вычисленной на основании закона Фарадея
(
),
к массe, теоретически вычисленной на основании закона Фарадея
(![]() ):
):
![]() .
(6.5)
.
(6.5)
Типовая задача № 2
Через три последовательно соединенных электролизера, в каждом из которых находятся водные растворы следующих электролитов: в первом – CuSO4, во втором – Hg(NO3)2, в третьем – ZnCI2, проходит постоянный ток. Определите массы выделившихся на катодах металлов, если на аноде последнего электролизера выделилось 1,12л водорода, измеренного при нормальных условиях (н.у.).
Решение
а) Рассчитываем число выделившихся моль эквивалентов водорода, зная, что его эквивалентный объем при н.у. составляет Vэкв = 11,2 л/моль.
νэкв(Н2) = ![]() =
= ![]() = 0,1 моль.
= 0,1 моль.
б) Согласно закону эквивалентов такое же количество никеля, ртути и цинка выделилось на катодах:
m(Cu) =
Mэкв(Cu)
∙ νэкв(Cu) =
![]() ∙
νэкв(Cu);
∙
νэкв(Cu);
m(Cu) =
![]() ∙ 0,1
моль = 3,2 г;
∙ 0,1
моль = 3,2 г;
m(Hg) =
Mэкв(Hg)
∙ νэкв(Hg) =
![]() ∙
νэкв(Hg);
∙
νэкв(Hg);
m(Hg) =
![]() ∙ 0,1
моль = 10,05 г;
∙ 0,1
моль = 10,05 г;
m(Zn) =
Mэкв(Zn)
∙ νэкв(Zn) =
![]() ∙
νэкв(Zn);
∙
νэкв(Zn);
m(Zn) =
![]() ∙ 0,1
моль = 3,25 г.
∙ 0,1
моль = 3,25 г.
Ответ: m(Сu) = 3,20 г; m(Hg) = 10,05 г; m(Zn) = 3,25 г.
Типовая задача № 3
Через раствор CuSO4 в течение 1 часа пропустили ток силой 10 А. На катоде выделилось 11,2 меди. Вычислите выход по току.
Решение
а) Согласно закону Фарадея (7.4):
m![]() (Cu)
=
(Cu)
= ![]() ;
;
m![]() (Cu) =
(Cu) =
![]() = 11,86 г.
= 11,86 г.
б) Выходом по току называется выраженное в процентах отношение массы практически полученного продукта электролиза к теоретической:
η =
![]()
![]() % ;
η =
% ;
η =
![]() = 94,5%.
= 94,5%.
Ответ: η = 94,5%
4 Задания для самостоятельной работы
4.1 Составьте схему электролиза расплава и водного раствора вещества «а» с использованием графитовых электродов. Сравните по составу продукты электролиза.
4.2 Через два последовательно соединенных электролизера: один – с водным раствором вещества «б», другой – с водным раствором вещества «в», пропускают постоянный ток. За время их работы на одном из инертных анодов выделилось 0,112 л CI2 , измеренного при нормальных условиях (н.у.). Рассчитайте массу металлов, выделившихся на катодах при электролизе.
Ответ: m(металла «в») = «г» г; m(металла «г») = «д» г.
4.3 Определите массу металла, которая выделяется на катоде при электролизе раствора «е» в течение 1 часа при силе тока «ж» А. Выход металла по току η составляет «з» %. Ответ: m(металла) = «и» г.
|
вт |
«а» |
«б» |
«в» |
«г» |
«д» |
«е» |
«ж» |
«з» |
«и» |
|
1 |
SrCI2 |
FeSO4 |
CdCI2 |
0,28 |
0,56 |
CuCI2 |
2,0 |
98,0 |
2,32 |
|
2 |
Rb2S |
CoCI2 |
AgNO3 |
0,30 |
1,08 |
ZnSO4 |
2,5 |
97,5 |
2,97 |
|
3 |
NaBr |
Sn(NO3)2 |
HgCI2 |
0,60 |
1,00 |
AgNO3 |
3,0 |
97,0 |
11,71 |
|
4 |
MnCl2 |
AuCl3 |
ZnSO4 |
0,66 |
0,33 |
HgCl2 |
3,5 |
96,5 |
12,64 |
|
5 |
MgI2 |
NiSO4 |
CuCI2 |
0,30 |
0,32 |
SnBr2 |
4,0 |
96,0 |
8,50 |
|
6 |
LiBr |
FeCI3 |
СrCI3 |
0,19 |
0,98 |
Pb(NO3)2 |
4,5 |
95,5 |
16,61 |
|
7 |
KI |
Hg2(NO3)2 |
CdSO4 |
2,01 |
0,17 |
FeSO4 |
5,0 |
95,0 |
4,95 |
|
8 |
CsCI |
SnCI2 |
Co(NO3)2 |
0,60 |
0,30 |
Cu(NO3)2 |
5,5 |
94,5 |
6,16 |
|
9 |
CrBr3 |
CdSO4 |
PtCI2 |
0,56 |
0,98 |
NiCI2 |
6,0 |
94,0 |
6,17 |
|
10 |
CaI2 |
SnCI2 |
CuSO4 |
0,59 |
0,32 |
ZnCI2 |
6,5 |
93,5 |
7,41 |
|
11 |
BeCI2 |
Au(NO3)3 |
TICI |
0,66 |
2,04 |
Hg(NO3)2 |
7,0 |
93,0 |
24,36 |
|
12 |
BaBr2 |
FeSO4 |
Hg2CI2 |
0,28 |
2,01 |
SnCI2 |
7,5 |
92,5 |
15,36 |
|
13 |
AICI3 |
ZnCI2 |
Ni(NO3)2 |
0,33 |
0,30 |
FeBr2 |
8,0 |
92,0 |
7,67 |
|
14 |
SrBr2 |
AgNO3 |
CoCI2 |
1,08 |
0,29 |
Zn(NO3)2 |
8,5 |
91,5 |
9,49 |
|
15 |
RbCI |
CuCI |
Pb(NO3)2 |
0,64 |
1,04 |
SnI2 |
9,0 |
91,0 |
18,14 |
|
16 |
NaI |
SnBr2 |
PtCI2 |
0,59 |
0,98 |
NiSO4 |
9,5 |
90,5 |
9,40 |
|
17 |
MnBr2 |
CdCI2 |
Fe(NO3)2 |
0,56 |
0,28 |
Cd(N03)2 |
10,0 |
90,0 |
18,87 |
|
18 |
MgCI2 |
CoSO4 |
NiCI2 |
0,30 |
0,29 |
ZnI2 |
10,5 |
89,5 |
11,46 |
|
19 |
Li2S |
AuCI3 |
SnI2 |
0,66 |
0,59 |
CuBr2 |
11,0 |
89,0 |
11,60 |
|
20 |
KCI |
Hg(NO3)2 |
FeCI3 |
1,00 |
0,19 |
SnSO4 |
11,5 |
88,5 |
22,54 |
|
21 |
CsBr |
ZnCI2 |
AgNO3 |
0,33 |
1,08 |
Ni(NO3)2 |
12,0 |
88,0 |
11,56 |
|
22 |
CrCI3 |
Pt(NO3)2 |
CoCI2 |
0,98 |
0,30 |
FeI2 |
12,5 |
87,5 |
11,39 |
|
23 |
CaS |
HgCI2 |
NiSO4 |
1,00 |
0,29 |
CoCI2 |
13,0 |
87,0 |
12,43 |
|
24 |
BaI2 |
SnBr2 |
CuCI2 |
0,59 |
0,32 |
ZnBr2 |
13,5 |
86,5 |
14,24 |
|
25 |
SrBr2 |
NiCI2 |
Cd(NO3)2 |
0,29 |
0,56 |
FeCI2 |
14,0 |
86,0 |
12,54 |
Тема 7
Коррозия металлов. Защита металлов от коррозии
1 Классификация коррозионных процессов
Коррозией называется самопроизвольное разрушение металлов, происходящее в результате взаимодействия с окружающей средой. Коррозия металлов является неконтролирующим окислительно-восстановительным процессом, при котором металл, теряя электроны, окисляется. Процесс коррозии сопровождается выделением энергии и рассеиванием металла.
По механизму протекания (по механизму взаимодействия с окружающей средой) коррозионные процессы подразделяются на химическую и электрохимическую коррозию.
1) Химическая коррозия протекает в коррозионных средах, не проводящих электрический ток. По виду агрессивной среды, в которой протекает процесс химической коррозии, различают:
а) газовую коррозию – окисление металла газообразными окислителями: кислородом воздуха, продуктами сгорания каменного угля, а также других видов топлива, например:
Fe + CI2 = FeCI2 2Mg + O2 = 2MgO;
б) жидкостную коррозию – коррозия металла в растворах неэлектролитов (нефть, бензин, керосин, смазочные масла).
Химической коррозии подвергаются лопатки газовых турбин, сопла реактивных двигателей, элементы электронагревателей, арматура печей и т.д.
2) Электрохимическая коррозия характерна для сред с ионной проводимостью (водных растворов солей, кислот и щелочей, морской и пресной воды, почвы, атмосферы любого влажного газа). В ее основе также лежит гетерогенная окислительно-восстановительная реакция, протекающая на поверхности металлов и сплавов.
2 Электрохимическая коррозия
2.1 Механизм электрохимической коррозии
Электрохимическую коррозию вызывают главным образом загрязнения, примеси, содержащиеся в металле, или неоднородность его поверхности. Согласно теории электрохимической коррозии Г.В.Акимова и его школы, в этих случаях при соприкосновении металла с электролитом (электролитом может быть влага, адсорбируемая из воздуха) на его поверхности возникает множество короткозамкнутых гальванических микроэлементов. При этом анодами являются частицы металла, катодами – загрязнения, примеси.
Как известно, гальванические элементы при работе поляризуются. В процессе коррозии электроды также поляризуются. В результате перехода электронов с анода на катод потенциал катода становится более отрицательным, а потенциал анода более положительным, т.е. происходит выравнивание потенциалов, и коррозия должна замедляться или вовсе прекратиться. В этом случае поляризация – изменение потенциалов электродов гальванопары – играет положительную роль. Если бы не происходило поляризации электродов, то коррозия протекала бы с очень большой скоростью.
Однако, при коррозии происходит и процесс деполяризации – повышается потенциал катода. Окислители, принимающие электроны у катода, называются катодными деполяризаторами. Они уменьшают поляризацию. Катодными деполяризаторами служат ионы водорода Н+ (при рН < 7) и кислород воздуха, всегда содержащийся в воде и ее растворах (при рН = 7 и рН > 7).
2.2 Схема электрохимической коррозии
К примеру, на поверхности железа, содержащего включения углерода, образуются микрогальванические элементы, в результате работы которых и происходит разрушение металла. Участки с отрицательным электродным потенциалом являются анодными (железо), а с положительным потенциалом – катодными (углерод). Электроны переходят с анодных к катодным участкам, а внутренняя цепь коррозионного микрогальванического элемента замыкается ионами электролита.
На анодных участках идет окисление металла:
(-) А: Me0
![]() Men+.
Men+.
На катодных участках – процесс восстановления окислителя:
а) в кислых средах – водородная деполяризация:
(+) K: 2H+
![]() H2↑;
H2↑;
б) в условиях влажного воздуха – кислородная деполяризация:
(+)
K:
O2 + 2H2O
![]() 4OH-
.
4OH-
.
Продукт коррозии:
а) в кислой среде – соль металла соответствующей кислоты,
б) в нейтральной среде – гидроксид металла: Men+ + n(OH-) → Me(OH)n
Наиболее часто мы встречаемся с процессом разрушения железа, т.е. с образованием ржавчины. В простейшем случае механизм образования ржавчины в условиях влажного воздуха может быть описан уравнениями:
![]()
![]() (-)
A: Fe0
(-)
A: Fe0 ![]() Fe2+
2
Fe2+
2
(+) K: O2
+ 2H2O ![]() 4OH-
1
4OH-
1
![]()
2Fe2+ + 4OH- → 2Fe(OH)2↓.
Продуктом коррозии является Fe(OH)2, который под действием кислорода воздуха окисляется до FeO(OH), вещества, отвечающему составу бурой ржавчины: 4Fe(OH)2 + O2 → 4FeO(OH) + 2H2O.
На скорость электрохимической коррозии большое влияние оказывают состав электролита и его кислотность.
Увеличение концентрации ионов водорода ускоряет коррозию большинства металлов. Повышение содержания ионов ОН- не влияет на скорость разрушения никеля и кадмия, уменьшает коррозию железа и магния, ускоряет коррозию алюминия, цинка и свинца, так как гидроксиды этих металлов растворимы в щелочах. Ионы хлора (активатор коррозии) увеличивают, а фосфат-ионы РО43-, хромат-ионы СrO42- уменьшают скорость разрушения металлов (ингибиторы коррозии).
На скорость коррозии большое влияние оказывают также чистота обработки и однородность поверхности металла. Чем меньше посторонних включений содержит металл и чем выше чистота обработки его поверхности, тем меньше скорость коррозии. В сухом и чистом воздухе коррозия идет медленно.
Типовая задача № 1
Составьте уравнения реакций, которые протекают при коррозии цинка в атмосферных условиях.
Решение
a) Анодные
процессы при коррозии металлов выражаются следующим уравнением в общем виде:
Me0
![]() Men+.
Men+.
При коррозии металла в атмосферных условиях на катоде происходит восстановление кислорода, растворенного в воде (кислородная деполяризация).
б) Запишем уравнения анодного и катодного процессов при коррозии цинка:
![]()
![]() (-) A: Zn0
(-) A: Zn0 ![]() Zn2+ 2
Zn2+ 2
(+) K: O2 + 2H2O ![]() 4OH- 1
4OH- 1
Продукт коррозии: 2Zn2+ + 4OH- → 2Zn(OH)2↓
Возможно разложение Zn(OH)2: Zn(OH)2 → ZnO + H2O.
Типовая задача № 2
Как протекает коррозия цинка, находящегося в контакте с кадмием, в нейтральном и кислом растворах? Составьте уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение
а)
Цинк имеет более отрицательное значение стандартного электродного потенциала (Е![]() = - 0,76B), чем
кадмий (E
= - 0,76B), чем
кадмий (E![]() = - 0,40B), следовательно, цинк является анодом и будет
подвергаться окислению, а кадмий – катодом данной коррозионной гальванопары.
= - 0,40B), следовательно, цинк является анодом и будет
подвергаться окислению, а кадмий – катодом данной коррозионной гальванопары.
б) Запишем уравнения катодного и анодного процессов коррозии.
В нейтральном растворе
![]()
![]() (-) А (Zn):
Zn0
(-) А (Zn):
Zn0
![]() Zn2+
2
Zn2+
2
(+)
K (Cd):
O2 + 2H2O
![]() 4OH- 1
4OH- 1
2Zn2+ + 4OH- → 2Zn(OH)2↓.
В кислом растворе
![]()
![]() (-)
A:
Zn0
(-)
A:
Zn0
![]() Zn2+ 1
Zn2+ 1
(+)
K: 2Н+
![]() Н2 1
Н2 1
Zn0 + 2Н+ → Zn2+ + Н2↑
в) Как видно из приведенных электродных процессов продуктами коррозии являются гидроксид цинка в нейтральном растворе; газообразный водород и соль соответствующей кислоты в кислом растворе.
3 Защита металлов от коррозии
3.1 Защитные поверхностные покрытия металлов
Поверхностные покрытия изолируют металл от внешней среды и могут быть как металлические (цинк, олово, свинец, никель, хром и другие металлы), так и неметаллические (лаки, краски, эмали и другие вещества).
Металлические покрытия часто наносят гальваническим путем. Если электродный потенциал
покрытия более отрицателен, чем защищаемого металла, оно называется анодным,
а если потенциал покрытия более положителен, - катодным. Например,
железо покрыто цинком – покрытие анодное, так как Е![]() = - 0,76B <
E
= - 0,76B <
E![]() = - 0,44B; если
железо покрыто оловом – катодное покрытие, так как Е
= - 0,44B; если
железо покрыто оловом – катодное покрытие, так как Е![]() = - 0,14B
> E
= - 0,14B
> E![]() = - 0,44B.
= - 0,44B.
Анодное покрытие защищает металл и в том случае, когда оно нарушено. Так, слой цинка предохраняет железо от коррозии, хотя цинк – активный металл. Это обусловлено тем, что цинк всегда покрыт снаружи оксидной пленкой. При повреждениях цинкового защитного слоя (царапины, пробои крыш и т.д.) в присутствии влаги возникает гальваническая пара железо – цинк, где катодом служит железо, анодом – цинк. Электроны переходят от цинка к железу и связываются молекулами кислорода, цинк растворяется, но железо остается защищенным до тех пор, пока не будет разрушен весь слой цинка, на что потребуется довольно много времени.
При нарушении катодного покрытия (например, железо покрыто оловом) коррозия защищаемого металла ускоряется.
2.3 Создание сплавов с антикоррозионными свойствами
Этот способ защиты от коррозии заключается в изменении состава металлов добавлением специальных легирующих добавок. Введением в состав стали 12% хрома получают нержавеющую сталь, устойчивую к коррозии. Усиливают антикоррозионные свойства стали добавки никеля, кобальта и меди. В этом случае повышается склонность сплавов к пассивации.
3.3 Электрохимические методы
1) Протекторная защита применяется в тех случаях, когда защищаемая конструкция ( корпус судна, стенки паровых котлов, основания стальных конструкций) находится в среде электролита (морская вода, подземные почвенные воды и т.д.). Защищаемую конструкцию соединяют с протектором – металлом, имеющим более отрицательный электродный потенциал, чем у защищаемого металла. В качестве протектора при защите стальных изделий обычно используют магний, алюминий, цинк и их сплавы. В процессе коррозии протектор служит анодом и разрушается, тем самым предохраняя от разрушения конструкцию.
2) Электрозащита (катодная защита) основана на том же принципе, что и протекторная защита. Защита электрическим током практикуется для уменьшения коррозии подземных трубопроводов, рельсовых путей и т.д., по ходу которых на определенной дистанции устанавливаются катодные станции постоянного тока (аккумуляторные батареи.). Защищаемый участок присоединяется к катоду такой батареи, а в качестве анода служит металлолом.
3.4 Изменение состава среды
Для замедления коррозии металлических изделий в электролит вводят вещества (чаще всего органические), называемые замедлителями коррозии, или ингибиторами. Действие ингибиторов сводится либо к созданию на поверхности металла защитной пленки, либо к уменьшению агрессивности среды (дезактивация). Ингибиторы широко применяются при химической очистке от накипи паровых котлов, снятии окалины с обработанных изделий, а также при хранении и перевозке соляной кислоты в стальной таре.
К числу неорганических ингибиторов относятся нитриты, хроматы, фосфаты, силикаты. Органические ингибиторы прочно адсорбируются на поверхности металла и повышают перенапряжение электродных процессов.
Типовая задача № 3
Что будет происходить при нарушении целостности покрытия оцинкованного железа во влажном воздухе? Ответ мотивируйте электронными уравнениями анодного и катодного процессов коррозии. Определите продукт коррозии.
Решение
а)
Из сравнения значений стандартных электродных потенциалов металлов (Е![]() = - 0,76B <
E
= - 0,76B <
E![]() = - 0,44B)
следует, что данное покрытие является анодным, поэтому при нарушении его
целостности Zn
окисляется,
являясь анодом образующейся коррозионной гальванопары, а на катоде (Fe) наблюдается кислородная деполяризация.
= - 0,44B)
следует, что данное покрытие является анодным, поэтому при нарушении его
целостности Zn
окисляется,
являясь анодом образующейся коррозионной гальванопары, а на катоде (Fe) наблюдается кислородная деполяризация.
б) Запишем уравнения электродных процессов коррозии.
![]()
![]() (-)
А (Zn):
Zn0
(-)
А (Zn):
Zn0 ![]() Zn2+
2
Zn2+
2
(+) K (Fe): O2
+ 2H2O ![]() 4OH-
1
4OH-
1
![]()
2Zn2+ + 4OH- → 2Zn(OH)2↓
в) Продуктом коррозии является гидроксид цинка Zn(OH)2.
Типовая задача № 4
Две железные пластинки, частично покрытые одна – оловом, другая – медью, находятся во влажном воздухе. На какой из них быстрее появится ржавчина? Ответ обоснуйте. Приведите уравнения электродных процессов и определите состав продуктов коррозии.
Решение
а) Из сравнения значений стандартных электродных потенциалов металлов:
E![]() = - 0,44B; Е
= - 0,44B; Е![]() = - 0,14B;
E
= - 0,14B;
E![]() = + 0,34B,
= + 0,34B,
следует, что покрытия на обеих пластинках являются катодными, поэтому обе будут подвергаться атмосферной коррозии с кислородной деполяризацией (катодный процесс определяется видом и составом коррозионной среды).
Следовательно, железо играет роль анода, а олово и медь являются катодом в образующемся гальваническом элементе.
б) Уравнения электродных процессов:
![]()
![]() (-)
A (Fe):
Fe0
(-)
A (Fe):
Fe0
![]() Fe2+ 2
Fe2+ 2
(+) К
(Sn, Cu): O2 + 2H2O ![]() 4OH- 1
4OH- 1
2Fe + O2 + 2H2O → 2Fe(OH)2↓;
в) Продуктом коррозии является Fe(OH)2, который под действием кислорода воздуха окисляется до FeO(OH), вещества, отвечающему составу бурой ржавчины: 4Fe(OH)2 + O2 → 4FeO(OH) + 2H2O.
Типовая задача № 5
Предложите протектор для защиты изделия из алюминиевой бронзы от коррозии во влажной атмосфере. Приведите уравнения протекающих процессов.
Решение
а)
Алюминиевая бронза – это сплав меди с алюминием. Протектор, согласно принципу
его действия, должен иметь потенциал более отрицательный, чем потенциал меди (E![]() = + 0,34B) и
потенциал алюминия (E
= + 0,34B) и
потенциал алюминия (E![]() = -1,70B).
= -1,70B).
К примеру, магний (E![]() = -2,37B).
= -2,37B).
![]()
![]() (-) А (Mg):
Mg
(-) А (Mg):
Mg
![]() Mg2+ 2
Mg2+ 2
(+) K :
O2 + 2H2O
![]() 4OH- 1
4OH- 1![]()
![]() 2Mg2+ + 4OH-
→ 2Mg(OH)2↓;
2Mg2+ + 4OH-
→ 2Mg(OH)2↓;
в) Продуктом коррозии является гидроксид магния Mg(OH)2↓.
4 Задания для самостоятельной работы
4.1 Рассмотрите коррозию металла «а» в условиях влажного воздуха и в растворе слабой уксусной кислоты. Приведите уравнения электродных процессов. Какие вещества являются продуктами коррозии?
4.2 Какой металл в паре «б» подвергается коррозии в атмосферных условиях. Составьте схему гальванического элемента, образующегося при этом; напишите уравнения реакций катодного и анодного процессов.
4.3 Предложите для пары металлов «б» анодное и катодное покрытие.
4.4 Для защиты от коррозии железо покрыли металлом «в». Составьте уравнения анодных и катодных процессов, которые будут происходить в нейтральной среде при нарушении целостности защитного слоя.
4.5 Какой металл из группы «г» целесообразнее выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля? Напишите уравнения реакций, происходящих при коррозии протектора.
|
Вт |
«а» |
«б» |
«в» |
«г»
|
|
1 |
Cu |
Pb - Sn |
Сг |
Cu - Sn - Cr |
|
2 |
Mn |
Mg - Co |
Sn |
Mg - Mn - Co |
|
3 |
Zn |
Sn - Cu |
Co |
Zn - Sn - Cu |
|
4 |
Sn |
Fe - Co |
Cd |
Fe - Cd - Co |
|
5 |
Pb |
Cu - Zn |
Ni |
Zn - Ni - Cu |
|
6 |
AI |
Fe - Ni |
Pb |
AI - Fe - Ni |
|
7 |
Ni |
Sn - Cd |
Mg |
Mg - Cd - Ni |
|
8 |
Cd |
Cd - Cu |
Zn |
Zn - Cd - Cu |
|
9 |
Co |
Zn - Ag |
Cu |
Co - Cu - Ag |
|
10 |
Fe |
Cd - Pb |
Mo |
Fe - Cd - Mo |
|
11 |
Mg |
Fe - Cu |
Mn |
Mg - Mn - Cu |
|
12 |
Cr |
Fe - Pb |
AI |
AI - Cr - Fe |
|
13 |
Mn |
Sn - Ag |
Cr |
Mn - Sn - Ag |
|
14 |
Mo |
Zn - Ni |
Mg |
Mg - Zn - Ni |
|
15 |
Cu |
Mg - Ni |
Co |
Co - Ni - Cu |
|
16 |
Zn |
Zn - Sn |
Cd |
Zn - Cd - Sn |
|
17 |
Cr |
Sn - Mg |
Ag |
Mg - Cr - Ag |
|
18 |
Pb |
Fe - Sn |
Ni |
Fe - Ni - Sn |
|
19 |
AI |
Fe - Cd |
Sn |
AI - Cd - Sn |
|
20 |
Ni |
Zn - Cu |
Zn |
Zn - Ni - Cu |
|
21 |
Cd |
Pb - Cu |
Mo |
Mo - Cd - Cu |
|
22 |
Co |
Cd - Ni |
Cu |
Cd - Co - Ni |
|
23 |
Fe |
Zn - Ag |
Mn |
Mn - Zn - Ag |
|
24 |
Mg |
Mg - Fe |
AI |
Mg - AI - Fe |
|
25 |
Sn |
Zn - Cd |
Pb |
Zn - Cd - Sn |
Приложение 1
Основные физико-химические константы
|
№ п/п |
Наименование |
Единицы измерения |
|
1 |
Скорость света в вакууме |
С = 2,9979 · 108 м · с-1 |
|
2 |
Атомная единица массы (а.е.м) |
1а.е.м
= m
u = m( |
|
3 |
Заряд электрона |
е = 1,6022 · 10-19 Кл |
|
4 |
Масса электрона |
m e = 9,1094 · 10-31 кг = 5,4858 · 10-4 а.е.м. |
|
5 |
Масса протона |
m р = 1,6726 · 10-27 кг = 1,0073 а.е.м. |
|
6 |
Масса нейтрона |
m n = 1,6749 · 10-27 кг = 1,0087 а.е.м |
|
7 |
Постоянная Авогадро |
N A = 6,0221 · 1023 моль-1 |
|
8 |
Универсальная газовая постоянная |
R = 8,3145 Дж · моль-1 · К-1 = 0,0821л · атм · моль-1 · К-1 |
|
9 |
Постоянная Больцмана |
K = R/NA = 1,3807 · 10-23 Дж · К-1 |
|
10 |
Постоянная Фарадея |
F = NA · e = 96485,3 Кл · моль-1 |
|
11 |
Постоянная Планка |
h = 6,6261 · 10-34 Дж · с |
|
12 |
Радиус Бора |
|
|
13 |
Постоянная Ридберга |
|
|
14 |
Объем моля идеального газа при нормальных условиях (н.у) |
Р = 101325 Па = 1 атм = 760 мм.рт.ст. |
|
15 |
Стандартные термодинамические условия |
Р = 1 атм. Т = 298,15 К |
|
16 |
Электрон-вольт |
1 эВ = 1,6022 · 10-19 Дж. |
|
17 |
Калория термохимическая (калтх) |
1 кал. = 4,184 Дж. |
Приложение 2
Константы диссоциации (Кд) слабых электролитов
в водных растворах (при 298,15 К)
|
Вещество |
Кд |
|
AgOH |
К = 9,77 · 10-3 |
|
Al(OH)3 |
K1 = 7,41 · 10-9 ; K2 = 2,14 · 10-9 |
|
Be(OH)2 |
K1 = 3,16 · 10-7 ; K2 = 5,01 · 10-9 |
|
Cd(OH)2 |
K1 = 8,13 · 10-4 ; K2 = 4,17 · 10-7 |
|
Co(OH)2 |
K1 = 7,94 · 10-5 ; K2 = 7,94 · 10-6 |
|
Cu(OH)2 |
K1 = 6,61 · 10-8 ; K2 = 2,19 · 10-7 |
|
Fe(OH)3 |
K1 = 4,79 · 10-11 ; K2 = 1,82 · 10-11 |
|
Ga(OH)3 |
K1 = 1,05 · 10-10 ; K2 = 3,24 · 10-11 |
|
NH4OH |
K = 1,74 · 10-5 |
|
Pb(OH)2 |
K1 = 5,01 · 10-4 ; K2 = 1,41 · 10-8 |
|
Sn(OH)2 |
K1 = 3,47 · 10-10 ; K2 = 1,26 · 10-12 |
|
Sn(OH)4 |
K1 = 1,66 · 10-13 ; K2 = 2,14 · 10-14 |
|
Ti(OH)4 |
K1 = 1,02 · 10-11 ; K2 = 3,09 · 10-13 |
|
Zn(OH)2 |
K1 = 1,32 · 10-5 ; K2 = 4,90 · 10-7 |
|
H2O |
K1 = 1,82 · 10-16 |
|
H2AsO4 |
K1 = 5,5 · 10-3 ; K2 = 1,07 · 10-7 ; K3 = 3 · 10-12 |
|
H2BO3 |
K1 = 5,75 · 10-10 ; K2 = 1,8 · 10-13 ; K3 = 1,6 · 10-14 |
|
HBrO |
K = 2,06 · 10-9 |
|
HCN |
K = 4,93 · 10-10 |
|
HCOOH |
K = 1,78 · 10-4 |
|
CH3COOH |
K = 1,74 · 10-5 |
|
H2CO3 |
K1 = 4,27 · 10-7 ; K2 = 4,68 · 10-11 |
|
H2C2O4 |
K1 = 6,46 · 10-2 ; K2 = 6,17 · 10-5 |
|
ClO |
K = 2,82 · 10-8 |
|
HF |
K = 6,67 · 10-4 |
|
HNO2 |
K = 5,13 · 10-4 |
|
H2O2 |
K = 2,40 · 10-12 |
|
H3PO4 |
K1 = 7,2 · 10-3 ; K2 = 6,2 · 10-8 ; K3 = 4,6 · 10-13 |
|
H2S |
K1 = 1,05 · 10-7 ; K2 = 1,23 · 10-13 |
|
H2SO3 |
K1 = 1,7 · 10-2 ; K2 = 6,31 · 10-8 |
Приложение 3
Стандартные потенциалы металлических и газовых электродов
в водных растворах (при 298,15 К)
|
Электрод |
Электродная реакция |
E°, В |
|
Ag+ | Ag |
Ag+ + e = Ag |
+0,799 |
|
Al3+ | Al |
Al3+ + 3e = Al |
-1,700 |
|
Au+ | Au |
Au+ + e = Au |
+1,691 |
|
Au3+ | Au |
Au3+ + 3e = Au |
+1,498 |
|
Ba2+ | Ba |
Ba2+ + 2e = Ba |
-2,905 |
|
Be2+ | Be |
Be2+ + 2e = Be |
-1,847 |
|
Ca2+ | Ca |
Ca2+ + 2e = Ca |
-2,866 |
|
Cd2+ | Cd |
Cd2+ + 2e = Cd |
-0,404 |
|
Co2+ | Co |
Co2+ + 2e = Co |
-0,277 |
|
Cr3+ | Cr |
Cr3+ + 3e = Cr |
-0,744 |
|
Cr2+ | Cr |
Cr2+ + 2e = Cr |
-0,852 |
|
Cs+ | Cs |
Cs+ + e = Cs |
-2,923 |
|
Cu2+ | Cu |
Cu2+ + 2e = Cu |
+0,338 |
|
Cu+ | Cu |
Cu+ + e = Cu |
+0,521 |
|
Fe3+ | Fe |
Fe3+ + 3e = Fe |
-0,036 |
|
Fe2+ | Fe |
Fe2+ + 2e =| Fe |
-0,440 |
|
Hg2+ | Hg |
Hg2+ + 2e = Hg (ж) |
+0,854 |
|
K+ | K |
K+ + e = K |
-2,924 |
|
Mg2+ | Mg |
Mg2+ + 2e = Mg |
-2,370 |
|
Mn2+ | Mn |
Mn2+ + 2e = Mn |
-1,192 |
|
Mo3+ | Mo |
Mo3+ + 3e = Mo |
-0,200 |
|
Na+ | Na |
Na+ + e = Na |
-2,711 |
|
Ni2+ | Ni |
Ni2+ + 2e = Ni |
-0,234 |
|
Pb2+ | Pb |
Pb2+ + 2e = Pb |
-0,126 |
|
Pd2+ | Pd |
Pd2+ + 2e = Pd |
+0,915 |
|
Rb+ | Rb |
Rb+ + e = Rb |
-2,925 |
|
Sn2+ | Sn |
Sn2+ + 2e = Sn |
-0,141 |
|
Sr2+ | Sr |
Sr2+ + 2e = Sr |
-2,888 |
|
Zn2+ | Zn |
Zn2+ + 2e = Zn |
-0,763 |
|
Br2 (ж) | Br ¯ |
1/2Br2 + e = Br |
+1,065 |
|
S | S2- |
S + 2e = S2- |
-0,444 |
|
I2 (кр) | I¯ |
1/2I2 + e = I¯ |
+0,535 |
|
Cl2 | Cl¯ |
1/2Cl2 + e = Cl¯ |
+1,358 |
|
F2 | F ¯ |
1/2F2 + e = F¯ |
+2,866 |
|
H+ | H2 |
H+ + e = 1/2H2 |
0,000 |
|
O2 | OH ¯ |
1/2O2 + H2O +2e = 2OH¯ |
+0,401 |
|
H+ | O2 |
1/2O2 + 2H+ +2e = H2O |
+1,229 |
Список литературы
1. Глинка Н.Л. Общая химия. / Под ред. А.И.Ермакова. – 28-е изд., перераб. и доп. - М.: Интеграл – Пресс, 2000.
2. Горбунов А.И. Теоретические основы общей химии – М.: Изд-во МГТУ им. Баумана, 2001.
3. Коровин Н.В. Курс общей химии. – М.: Высшая школа, 1998.
4. Кульман А.Г. Общая химия.- М.: Колос, 1997.
5. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 1998.
6. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. – М.:
Химия, 1993.
7. Гельфман М.И., Юстратов В.П. Химия. Серия «Учебники для вузов.
Специальная литература» - СПб.: Издательство «Лань», 2000.- 480 с.
8. Угай Я.А. Общая и неорганическая химия.- М.: Высшая школа, 1997.
9. Павлов Н.Н. Неорганическая химия. – М.: Высшая школа, 2006.
10. Князев Д.А., Смарыгин С.Н. Неорганическая химия. – М.: Высшая школа, 2000.
11. Зубович И.А. Неорганическая химия. – М.: Высшая школа, 1998.
12. Глинка Н.Л. Задачи и упражнения по общей химии. – М.: Химия, 2000.
13. Любимова Н.Б. Вопросы и задачи по общей и неорганической химии.– М.: Высшая школа, 2000.
14. Гурьевская Т.С., Султанбаева Б.М. и другие. Решение практических задач неорганической химии. – Усть-Каменогорск, изд-во ВКГУ, 1999.
15. Султанбаева Б.М. Химия. Учебное пособие для самостоятельной работы работы студентов.- Алматы: КазНАУ, 2006.- 194 с.
Содержание
Введение 3
Тема 1. Строение атома. Периодическая система химических элементов 4
1 Элементарные частицы и атомное ядро 4
2 Строение электронной оболочки атома 4
3 Электронные формулы атома 7
4 Структура периодической системы элементов 9
5 Свойства атомов элементов и периодичность их изменения 11
6 Задания для самостоятельной работы 14
Тема 2. Химическая кинетика. Химическое равновесие 15
1 Понятие о скорости химической реакции 15
2 Влияние концентрации реагирующих веществ 16
3 Влияние температуры на скорость химической реакции 18
4 Влияние катализатора на скорость химической реакции 19
5 Основные понятия и признаки химического равновесия 20
6 Закон действующих масс для равновесной системы 21
7 Смещение химического равновесия. Принцип Ле-Шателье 23
8 Задания для самостоятельной работы 25
Тема 3. Растворы электролитов 28
1 Сильные и слабые электролиты 28
2 Электролитическая диссоциация различных классов неорганических соединений 31
3 Ионные реакции 32
4 Диссоциация воды. Ионное произведение воды 33
5 Задания для самостоятельной работы 35
Тема 4. Окислительно-восстановительные реакции 37
1 Степень окисления (С.О.) 37
2 Сущность окисления - восстановления 39
3 Методы составления уравнений окислительно-восстановительных реакций 40
4 Молярная масса эквивалента (Мэ) окислителя и восстановителя 43
5 Задания для самостоятельной работы 45
Тема 5. Основы электрохимии. Гальванические элементы 47
1 Стандартный электродный потенциал. Уравнение Нернста 47
2 Классификация электродов 49
3 Гальванический элемент. ЭДС гальванического элемента 53
4 Задания для самостоятельной работы 56
Тема 6. Электролиз 59
1 Понятие об электролизе 59
2 Последовательность протекания электродных процессов 60
3 Законы электролиза 65
4 Задания для самостоятельной работы 67
Тема 7. Коррозия металлов. Защита металлов от коррозии 68
1 Классификация коррозионных процессов 68
2 Электрохимическая коррозия 68
3 Защита металлов от коррозии 71
4 Задания для самостоятельной работы 74
Приложение 1.Основные физико-химические константы 75
Приложение 2.Константы диссоциации (Кд) слабых электролитов 76
Приложение 3.Стандартные электродные потенциалы 77
Список литературы 78