АЛМАТЫ ЭНЕРГЕТИКА және БАЙЛАНЫС ИНСТИТУТЫ
Өнеркәсіптік
жылуэнергетика кафедрасы
ХИМИЯДАН ТЕСТ
ТАПСЫРМАЛАРЫ
(050718 – Электрэнергетика және 050719 – Радиотехника, электроника, телекоммуникациялар мамандығының студенттеріне арналған)
Алматы 2005
 ҚҰРАСТЫРУШЫЛАР:
А.А.Тұманова, Қ.С.Идрисова . Химиядан тест тапсырмалары (050718
– Электрэнергетика және 050719 – Радиотехника, электроника, телекоммуникациялар мамандығының студенттеріне арналған)– Алматы: АЭжБИ, 2005. – 26
б.
ҚҰРАСТЫРУШЫЛАР:
А.А.Тұманова, Қ.С.Идрисова . Химиядан тест тапсырмалары (050718
– Электрэнергетика және 050719 – Радиотехника, электроника, телекоммуникациялар мамандығының студенттеріне арналған)– Алматы: АЭжБИ, 2005. – 26
б.
Жинақта
электрэнергетика, радиотехника, электроника, телекоммуникациялар
мамандықтарының 1 курс студенттеріне арналған химиядан тест
тапсырмалары ұсынылады.
Библиогр.
4 атау.
Пікірші: хим.ғыл.канд., ҚазҰТУ проф. Н.И.Чугунова.
Алматы энергетика және
байланыс институтының 2005 ж.
жоспары
бойынша басылды.
© Алматы энергетика және байланыс институты, 2005ж
Кіріспе
Ұсынылып отырған химия пәнінен тест сұрақтары
I курс студенттеріне арналған.
Мақсаты – студенттерге
химиядан аралық және
ағымды бақылауға, сонымен қатар емтиханға
дайындалуға көмек көрсету.
Бейорганикалық және жалпы химияның негізгі
тақырыптарының 10 бөлімінен тұратын тест
тапсырмаларының мазмұны химия курсының оқу
бағдарламасына сәйкес келеді.
Тестілер оқу материалын жүйелеу және біршама оңай
есептерді шығарғанда негізгі түсініктер мен заңдарды
қолданып білуді ұйғарады.
Осы тест тапсырмалары бойынша студенттер
оқу бағдарламасының материалына кіретін
өздерінің химиядан білім деңгейлерін тексере алады.
1 Атом құрылысы
1. 4d деңгейшенің алдында келесі деңгейше толтырылады:
1) 5s;
2) 5p;
3) 4f;
4) 4s.
2. 4f деңгейшенің алдында келесі деңгейше толтырылады:
1) 5s;
2) 5d;
3) 6s;
4) 6d.
3. 4p деңгейшенің алдында келесі деңгейше толтырылады:
1) 4s;
2) 4d;
3) 3d;
4) 5s.
4. Атомдық орбиталь - ол:
1) төрт кванттық сандардың жиынтыгы;
2) кеңістіктегі атом орналасатын ықтималдығы мол
аймақ;
3) кеңістіктегі электрон орналасатын ықтималдығы мол
аймақ ;
4) электронның жүру траекториясы.
5. Электронның атомдағы күйі келесі кванттық сандармен
сипатталады:
1) ![]()
2) ![]()
3) ![]()
4) ![]()
6.Сутегі атомы ядросының массасы:
1) 1,32·10-31
кг;
2) 1,67·10-27
кг;
3) 6,02·10-23
кг;
4) 3,01·10-23
кг.
7. Сутегі атомы ядросының заряды:
1) 3,2·10-19
Кл;
2) 1,6·10-19
Кл;
3) 96500 Кл;
4) 1·10-19
Кл.
8. Электронға ынтықтылық деп:
1) электронның атомға, молекулаға немесе радикалға
қосылғанда бөлінетін энергияны айтады;
2) электронды атомнан, ионнан, молекуладан аулақтандыруға
қажетті минимальді энергияны айтады;
3) электронның бір орбитальдан басқасына өту үшін
қажетті энергияны айтады;
4) атомдардың немесе молекулалардың
соғысуы үшін қажетті артық энергияны айтады.
9. №11 натрийдің электрондық формуласы:
1) 1s2 2s2 2p6 3s2;
2) 1s2 2s2 2p6 3s1;
3) 1s2 2s2 2p6;
4) 1s2 2s2 2p5.
10. Бас кванттық сан n=2-ге тең болғанда
электрондық қабаттағы электрондардың максимальді саны
тең:
1) 2; 2) 4; 3) 6; 4) 8.
11. Бас кванттық сан n=3-ке тең
болғанда электрондық қабаттағы электрондардың
максимальді саны тең:
1) 18; 2) 8;
3) 6; 4) 32.
12. Атомдар тұрады:
1) протондар мен
нейтрондардан;
2) молекулалардан;
3) атомдық ядролар мен электрондардан;
4) нуклондардан.
2 Бейорганикалық
қосылыстардың негізгі кластары
1. Қышқылдық оксидті таңдаңыз:
1) К2О;
2) Al2O3;
3)
P2O5;
4)
Cr2O3.
2. Негіздік оксидті таңдаңыз:
1) NO;
2)
СaO;
3)
Fe2O3;
4)
SiO.
3. Амфотерлі оксидті таңдаңыз:
1)
Сr2O3;
2) BaO;
3) SiO;
4) N2O5.
4. Орта тұзды таңдаңыз:
1) BaSO4;
2) Ba(HSO4)2;
3) (BaOH)2SO4;
4) Ba(OH)2.
5. Амфотерлі гидроксидті таңдаңыз:
1) Ca(OH)2;
2) Cr(OH)3;
3) Sr(OH)2;
4) Mg(OH)2.
6. Негіздік гидроксидті таңдаңыз:
1) NaOH;
2) Cr(OH)3;
3)Al(OH)3;
4) Pb(OH)2.
7. Күкіртті қышқылының тұздары аталады:
1) сульфаттар;
2) сульфиттер;
3) сульфидтер;
4) гидросульфаттар.
8. Фосфин деп фосфордың келесі затпен қосылысын атайды:
1) күкіртпен;
2) оттегімен;
3) қышқылдық қалдықпен;
4) сутегімен.
9. Хлорлы мыстың қышқылдық тұзы аталады:
1) гидрохлорид;
2) гидрохлорит;
3) гидроксохлорит;
4) гидроксохлорид.
10. Темір(III) оксиді жатады:
1) қышқылдық оксидтерге;
2) тұз түзбейтін оксидтерге;
3) негіздік оксидтерге;
4) амфотерлі оксидтерге.
11. Қате аталған тұзды табыңыз:
1) мыс хлориді;
2) темір сульфаты;
3) натрий ортофосфиті;
4) алюминий нитраты.
12. Формуласы қате жазылған тұзды
таңдаңыз:
1) FeCl3;
2) CuSO4;
3) NaCl2;
4) Cr2(SO4)3.
3 Ерітінділер
1. Ерітіндінің молярлы концентрациясы – ол:
1) зат мөлшерінің ерітіндінің массасына қатынасы;
2) 1 мл ерітіндіде ерітілген граммен алынған зат массасы;
3) 1 л ерітіндіде ерітілген зат мөлшері;
4) зат массасының еріткіш массасына қатынасы.
2. Ерітіндінің эквиваленттік молярлы концентрациясы
– ол:
1) зат мөлшерінің ерітіндінің массасына
қатынасы;
2) 1 мл ерітіндіде ерітілген граммен алынған зат массасы;
3) 1 л ерітіндіде ерітілген зат мөлшері;
4) 1 л ерітіндіде ерітілген зат эквивалентінің
мөлшері.
3. Ерітіндінің массалық үлесі
– ол:
1) еріген зат массасының ерітіндінің массасына
қатынасы;
2) еріген зат массасының еріткіштің массасына
қатынасы;
3) еріген зат массасының ерітіндінің 1 мл
қатынасы;
4) еріген зат массасының еріткіштің 1 мл
қатынасы.
4. Ерітіндінің
титрі – ол:
1) зат мөлшерінің ерітіндінің массасына
қатынасы;
2) 1 мл ерітіндіде ерітілген граммен алынған зат массасы;
3) 1 л ерітіндіде ерітілген зат мөлшері;
4) зат массасының еріткіш массасына қатынасы.
5. Тұздардың эквиваленттік факторы тең:
1) бірдің метал зарядының қатынасына;
2) бірдің метал иондарының санының
қатынасына;
3) бірдің метал иондарының санымен
зарядының көбейтіндісінің
қатынасына;
4) бірдің қышқыл қалдықтары санының
қатынасына.
6. Оксидтердің эквиваленттік факторы тең:
1) бірдің метал зарядының қатынасына;
2) бірдің метал иондарының санының қатынасына;
3) бірдің метал иондарының санымен зарядының
көбейтіндісінің қатынасына;
4) бірдің оттегі атомдары санының қатынасына.
7.Күкірт қышқылы эквивалентінің молярлы массасы
тең:
1) 98 г/мольге;
2) 49 г/мольге;
3) 24,5 г/мольге;
4) 73,5 г/мольге.
8. Фосфор қышқылының молярлы массасы
тең:
1) 32,6 г/мольге;
2) 98 г/мольге;
3) 49 г/мольге;
4) 65,2 г/мольге.
9. Хром(III) сульфатының
эквиваленттік факторы тең:
1) 1 / 2;
2) 1 / 3;
3) 1 / 4;
4) 1 / 6.
10. Эквиваленттік факторлары бірдей
заттар тобын таңдаңыз:
1) Ca(OH)2, Na2CO3, H2SO3;
2) Ca(OH)2, H2SO4, KCl;
3) HNO3, NaOH, CaCl2;
4) KJ, NaCl, H3PO4.
11. Эквиваленттік факторлары бірдей
заттар тобын таңдаңыз:
1) NaOH, HCl, K2CO3;
2) CuSO4, Cd(OH)2,
KBr;
3) CrCl3, Al(OH)3,
H3PO4;
4) Al2(SO4)3,
Cr(OH)3, HClO.
12. Қышқылдық-негіздік реакцияларында химиялық эквивалент деп заттың бөлігінің:
1) сутегінің бір молекуласына эквиваленттілігін атайды;
2) бір электронға эквиваленттілігін атайды;
3) сутегінің бір ионына эквиваленттілігін атайды;
4) реакцияға қатысатын сутегі иондарының санына
эквиваленттілігін атайды.
4 Электролиттік диссоциация. Тұздардың гидролизі
1. Диссоциация процесін сипаттайтын сандық мөлшер:
1) гидролиздену дәрежесі:
2) диссоциациялану дәрежесі;
3) дисперстік дәрежесі;
4) бөліп алу дәрежесі.
2. 298 Кельвиндегі таза судағы сутек иондарының концентрациясы
тең:
1) 10-14 моль/л;
2) 10-7
моль/л;
3) 107
моль/л;
4) 1014 моль/л.
3. 298 Кельвиндегі таза судағы гидроксид
иондарының концентрациясы тең
1) 10-14 моль/л;
2) 10-7
моль/л;
3) 107
моль/л;
4) 1014
моль/л.
4. Әлсіз электролит ерітінділері үшін
қолданылатын Оствальдтің сұйылту заңының
формуласы:
1) Kд = ![]() ;
;
2) Kд
= ![]() ;
;
3) Kд
= ![]() ;
;
4) Kд = ![]() .
.
5. Гидроксил-иондарының концентрациясы ![]() моль/л тең болғанда ерітіндінің реакция ортасы:
моль/л тең болғанда ерітіндінің реакция ортасы:
1) негіздік;
2) қышқылдық;
3) нейтрал;
4) қатты негіздік.
6.Сутек иондарының концентрациясы ![]() моль/л тең болғанда ерітіндінің реакция ортасы:
моль/л тең болғанда ерітіндінің реакция ортасы:
1) негіздік;
2) қышқылдық;
3) нейтрал;
4) қатты негіздік.
7. Сутектік көрсеткіш рН деп келесі шаманы атайды:
1) - ![]() ;
;
2) - ![]() ;
;
3) ![]() ;
;
4) - ![]() .
.
8. Ерітіндінің иондық күші келесі формула
бойынша есептеледі:
1) ![]()
![]()
![]() ;
;
2) ![]() =
= ![]()
![]()
![]() ;
;
3) ![]()
![]() ;
;
4) ![]()
![]() .
.
9. Сұйылтылған электролит ерітінділерінің
осмостық қысымы келесі теңдеу арқылы есептеледі:
1) π = ![]() ;
;
2) π = ![]()
![]() ;
;
3) P = ![]() ;
;
4) ![]() .
.
10. Әлсіз негізбен әлсіз қышқылдан
түзілген тұздың гидролиздену константасын есептейтін формуланы
таңдаңыз:
1) ![]() ; 2)
; 2) ![]() ; 3)
; 3) ![]() ; 4)
; 4) ![]()
11. Әлсіз негізбен күшті қышқылдан
(және керісінше) түзілген тұздың гидролиздену
константасын есептейтін формуланы таңдаңыз:
1) ![]() ; 2)
; 2) ![]() ; 3)
; 3) ![]() ; 4)
; 4) ![]()
12. Тұздың гидролиздену дәрежесін есептейтін формуланы
таңдаңыз:
1) ![]() ; 2)
; 2) ![]() 3) h=
3) h=![]() 4)
h=
4)
h= ![]() .
.
5 Тотығу-тотықсыздану реакциялары
1. Диспропорционирлеу реакцияларында:
1) бір элементтің тотыққан және
тотықсызданған формалары түзіледі;
2) бір молекуладағы әр түрлі атомдардың
тотығу дәрежелері өзгереді;
3) әр түрлі молекулалардағы әр
түрлі атомдардың тотығу дәрежелері өзгереді;
4) элементтердің тотығу дәрежесі
өзгермейді.
2. Молекулааралық тотығу-тотықсыздану
реакцияларында:
1) бір элементтің
тотыққан және тотықсызданған формалары
түзіледі;
2) бір молекуладағы әр түрлі атомдардың
тотығу дәрежелері өзгереді;
3) әр түрлі молекулалардағы әр түрлі
атомдардың тотығу дәрежелері өзгереді;
4) элементтердің тотығу дәрежесі өзгермейді.
3. Молекула ішіндегі тотығу-тотықсыздану реакцияларында:
1) бір элементтің
тотыққан және тотықсызданған формалары
түзіледі;
2) бір молекуладағы әр түрлі атомдардың
тотығу дәрежелері өзгереді;
3) әр түрлі молекулалардағы әр түрлі
атомдардың тотығу дәрежелері өзгереді;
4) элементтердің тотығу дәрежесі өзгермейді.
4. Тотығу-тотықсыздану реакцияларында метал атомдары:
1) электрондардың донорлары болады;
2) электрондардың акцепторлары болады;
3) электрондардың донорлары да,
акцепторлары да болады;
4) электрондардың донорлары да,
акцепторлары да болмайды.
5. Галогендер тотығу-тотықсыздану реакцияларында:
1) электрондардың донорлары болады;
2) электрондардың акцепторлары болады;
3) электрондардың донорлары да, акцепторлары да болады;
4) электрондардың донорлары да, акцепторлары да болмайды.
6. Берілген қосылыстардың қайсысында хлор
тек қана тотықсыздандырғыш бола алады:
1) NaCl;
2) NaClO;
3) NaClO3;
4) NaClO4.
7. Берілген қосылыстардың қайсысында хлор
тек қана тотықтырғыш бола алады:
1) NaCl;
2) NaClO;
3) NaClO3;
4) NaClO4.
8. Химиялық элементтердің қайсысы
тотықтыру-тотықсыздандыру қасиеттерді бірдей игере алады:
1) тотығу
дәрежесі аралық болса;
2) тотығу дәрежесі жоғары болса;
3) тотығу дәрежесі төмен болса;
4) тотығу дәрежесі нольге тең болса.
9. Күкірт қышқылының
қышқылдық қалдығының заряды тең:
1) 1+;
2) 2+;
3) 3+;
4) 2–.
10. CaO, MgO, BaO қосылыстарындағы
металдардың валенттілігі:
1) 1;
2) 2; 3) 3; 4) 4.
11. Темірдің тотығу дәрежелері:
1) +3,
+4;
2) +1,
-1;
3) +2,
+3;
4) +1,
+3.
12. BaS, K2S, Al2S3 қосылыстарындағы
бейметалдың валенттілігі:
1) -2; 2)
4; 3) 2; 4) 1.
6 Химиялық кинетика және
катализ
1. Химиялық реакциялардың жылдамдығымен механизмін
зерттейтін химия бөлімі аталады:
1) химиялық термодинамика;
2) физикалық химия;
3) химиялық кинетика;
4) электрохимиялық кинетика.
2. Ерітіндідегі химиялық реакциялардың
жылдамдығы тәуелді емес:
1) әрекеттесуші заттардың табиғатына;
2) температураға;
3) әрекеттесуші заттардың концентрациясына;
4) реакция жүргізілетін ыдыстың көлеміне.
3. aА + вВ = сС реакциясын өрнектейтін әрекеттесуші массалар
заңының математикалық теңдеуін табыңыз:
1) υ = k [A][B];
2) υ = k [C];
3) υ = ![]() ;
;
4) υ = k [A]a [B]b.
4. Вант – Гофф теңдеуін таңдаңыз:
1) 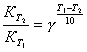 ;
;
2) ![]() ;
;
3) 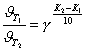 ;
;
4) ![]() .
.
5. Аррениус теңдеуінің логарифмдік формасы:
1) ln K = ![]() ;
;
2) K = ln A + Ea / RT;
3) ln K = ln A – Ea / RT;
4) ln K = – Ea / RT – ln A.
6. Ингибирлегенде химиялық реакцияның жылдамдығы:
1) жылдамдайды;
2) баяулайды;
3) жылдамдайды да, баяулайды да;
4) өзгермейді.
7. Химиялық реакцияның жылдамдық тұрақтысы
тәуелді емес:
1) реагенттердің табиғатына;
2) температураға;
3) әрекеттесуші заттардың бастапқы концентрациясына;
4) катализаторлардың қатысуына.
8. Активтендіру энергиясы келесі формула бойынша есептеледі:
1) ![]() ;
;
2) ![]() ;
;
3) ![]() ;
;
4) ![]() .
.
9. Қысымның өзгеруі
тепе-теңдіктің ығысуына әсер етпейтін теңдеуді
таңдаңыз:
1) 2 SO2 + O2 = 2 SO3;
2) C + 2 H2 = CH4;
3) H2 + I2 = 2 HI;
4) CO + H2O = CO2 + H2.
10. ![]() теңдеуі келесі реакцияның жылдамдығын
сипаттайды:
теңдеуі келесі реакцияның жылдамдығын
сипаттайды:
1) нольдік ретті;
2) бірінші ретті;
3) екінші ретті;
4) үшінші ретті.
11. Нольдік ретті реакцияның жылдамдығы:
1) T= const жағдайда артады;
2) T= const жағдайда азаяды;
3) реагенттің концентрациясына тәуелді;
4) реагенттің концентрациясына тәуелді емес.
12. Химиялық реакцияның жылдамдығы деп
келесі фактордың уақыт аралығында өзгеруін айтады:
1) бастапқы заттың концентрациясының;
2) катализатордың концентрациясының;
3) реакция өнімдерінің концентрациясының;
4) реакция ингибиторының концентрациясының.
7 Электродтық потенциалдар. ЭҚК
![]()
1. Метал электродының потенциалын есептейтін Нернст теңдеуін таңдаңыз:
1) ![]() =
= ![]() -
- ![]() . lg
. lg ![]() ;
;
2) ![]() =
= ![]() +
+ ![]() . lg
. lg ![]() ;
;
3) ![]() =
= ![]() +
+ ![]() . lg
. lg ![]() ;
;
4) ![]() =
= ![]() +
+ ![]() . lg
. lg ![]() .
.
2. Оттектік электродының потенциалын есептейтін Нернст теңдеуін таңдаңыз:
1) ![]() = – 1,23 + 0,0147 lg
= – 1,23 + 0,0147 lg ![]() – 0,059
– 0,059![]() ;
;
2) ![]() = – 1,23 + 0,0147 lg
= – 1,23 + 0,0147 lg ![]() + 0,059
+ 0,059![]() ;
;
3) ![]() = 1,23 + 0,0147 lg
= 1,23 + 0,0147 lg ![]() + 0,059
+ 0,059![]() ;
;
4) ![]() = 1,23 + 0,0147 lg
= 1,23 + 0,0147 lg ![]() – 0,059
– 0,059![]() .
.
3. Сутектік электродының потенциалын есептейтін Нернст теңдеуін таңдаңыз:
1) ![]()
![]() ;
;
2) ![]()
![]() ;
;
3) ![]()
![]() ;
;
4) ![]()
![]()
4. Якоби-Даниэль элементінің жалпы электродтық реакциясын
таңдаңыз:
1) Cu0 + Zn0 = Cu2+ + Zn2+ ;
2) Cu2+ + Zn0 = Cu0 + Zn2+;
3) Cu2+ + Zn2+ = Cu0 + Zn0;
4) Cu0 + Zn2+ = Cu2+ + Zn2+.
5. Тотығу-тотықсыздану потенциалын есептейтін Нернст
теңдеуін таңдаңыз:
1) ![]() =
= ![]() +
+ ![]()
![]()
![]() ;
;
2) ![]() =
= ![]() –
– ![]()
![]()
![]() ;
;![]()
3) ![]() =
= ![]() +
+ ![]()
![]()
![]() ;
;![]()
4) ![]() =
= ![]() −
− ![]()
![]()
![]()
6. Концентрациялық элемент деп келесі жүйені айтады:
1) метал және сутектік электродтан тұратын;
2) концентрациялары
бірдей тұздарының ерітінділеріне батырылған бірдей
электродтардан тұратын;
3) сутектік және оттектік электродтарынан
тұратын;
4) концентрациялары
әр түрлі өз тұздарының ерітінділеріне
батырылған екі бірдей электродтардан тұратын.
7. Якоби-Даниэль гальваникалық элементінің
схемасын таңдаңыз:
1) А Zn2+ / Zn // Cu2+ / Cu K;
2) A Zn / Zn2+ // Cu / Cu2+ K;
3) A Zn / Zn2+ // Cu2+ / Cu K;
4) A Cu2+ / Cu // Zn2+ / Zn K.![]()
8. Гальваникалық элементтің электрқозғауыш күші
келесі формула бойынша есептеледі:
1) E = ![]() ;
;
2) E = ΔG0 – ![]()
![]() ;
;
3) E = –![]() G / nF;
G / nF;
4) E = ![]() G / nF.
G / nF.
9. Өз тұздарының ерітінділеріне (С1 < С2) батырылған мыс
электродтарынан тұратын концентрациялық элементтің схемасын таңдаңыз:
1) А Cu / Cu2+
// Cu2+ / Cu K;
C1 C2
2) A Cu2+ / Cu // Cu2+ /
Cu K;
C1 C2
3) A Cu2+ / Cu // Cu / Cu2+ K;
C2 C1
4) A Cu / Cu2+ // Cu2+ /
Cu K.
C2 C1
10. ![]() = 1 атм, Т= 298 K,
= 1 атм, Т= 298 K, ![]() жағдайда өлшенген электродтық потенциал
аталады:
жағдайда өлшенген электродтық потенциал
аталады:
1) сутектік потенциал;
2) мембраналық потенциал;
3) стандартты потенциал;
4) диффузиялық потенциал.
11. Заттың тотыққан және тотықсызданған
формалары бар ерітіндіде пайда болатын потенциал аталады:
1) мембраналық потенциал;
2) диффузиялық потенциал;
3) редокс-потенциал;
4) стандартты потенциал.
12. Электр тоғының сыртқы тізбекте пайда болуы
келесі факторға байланысты:
1) иондардың қозғалысына;
2) молекулалардың қозғалысына;
3) электрондардың қозғалысына;
4) протондардың қозғалысына.
8 Электролиз
1. Натрий сульфиді сулы ерітіндісін электролиздегенде анодта бөлінеді:
1) сутегі;
2) оттегі;
3) натрий;
4) күкірт.
2. Калий бромиді сулы ерітіндісін ерімейтін анодта
электролиздегенде электродтарда келесі өнімдер түзіледі:
1) катодта – калий, анодта
– бром;
2) катодта – сутегі,
анодта
– оттегі;
3) катодта – сутегі,
анодта
– бром;
4) катодта – калий, анодта
– оттегі.
3. Кадмий хлориді сулы ерітіндісін еритін кадмий
электродтарда электролиздегенде келесі өнімдер түзіледі:
1) катодта – кадмий, анодта – хлор;
2) катодта –сутегі, анодта – хлор;
3) катодта – кадмий, анодта – оттегі;
4) катодта – кадмий, анодта – кадмий.
4. Балқымасымен сулы ерітіндісін электролиздегенде
бірдей өнім беретін затты таңдаңыз:
1) натрий иодиді;
2) кальций гидроксиді;
3) күміс хлориді;
4) магний сульфаты.
5. Фарадей заңдарын біріктіретін формуланы
таңдаңыз:
1) m = ![]() ;
;
2) m = ![]() ;
;
3) m = ![]() ;
;
4) m = ![]() .
.
6. Калий сульфиді сулы ерітіндісін электролиздегенде
катодтағы реакция ортасы:
1) нейтрал;
2) негіздік;
3) қышқылдық;
4) әлсіз қышқылдық.
7. Натрий сульфаты сулы ерітіндісін электролиздегенде
анодтағы реакция ортасы:
1) негіздік;
2) нейтрал;
3) қышқылдық;
4) әлсіз негіздік.
8. Электролизде пассивтендіру деп
келесі
құбылысты айтады:
1) метал еруінің катодтық тежелуін;
2) метал еруінің
анодтық тежелуін:
3) метал еруінің катодтық жылдамдауын;
4) метал еруінің анодтық жылдамдауын.
9. Ерімейтін анодты таңдаңыз:
1) Sb;
2) Pd;
3) Cd;
4) Sn.
10. Сілтілік металдарды тек қана электролиз арқылы алу себебі:
1) олар электрохимиялық қатарда сутегінің оң
жағында орналасқан;
2) олар активтілігі төмен металдарға жатады;
3) олар ең активті металдарға жатады;
4) олар активтілігі орташа металдарға жатады.
11. Натрий хлориді сулы ерітіндісін электролиздегенде келесі
өнімдер түзіледі:
1) натрий және сутегі;
2) сутегі және хлор;
3) оттегі және сутегі;
4) натрий және оттегі.
12. Таза мысты алу үшін мыс хлориді ерітіндісін
электролиздегенде қолданылатын анод жасалады:
1) платинадан;
2) графиттен;
3) мыстан;
4) болаттан.
9 Металдардың коррозиясы
1. Коррозияда қорытпаның құрамына
пассивтендіретін компоненттерді енгізу процесі аталады:
1) протекторлы қорғау;
2) легирлеу;
3) қорғау қабығы;
4) ингибирлеу.
2. Коррозиядан
қорғау үшін металдың бетіндегі жасанды қабат
аталады:
1) протекторлы қорғау;
2) легирлеу;
3) қорғау қабығы;
4) ингибирлеу.
3. Татты
кетіру үшін металдардың өңдеу процестерінде
қолданылатын баяулатқыш аталады:
1) катализатор;
2) ингибитор;
3) протектор;
4) промотор.
4. Ауадағы
оттегінің әсерінен мырышталған темір коррозияға ұшырағанда
катодта жүретін процесті таңдаңыз:
1) темірдің тотықсыздануы;
2) темірдің тотығуы;
3) мырыштың тотықсыздануы;
4) оттегінің тотығуы.
5. Қалайыланған
темір коррозияға ұшырағанда анодта жүретін процесті
таңдаңыз:
1) оттегінің тотықсыздануы;
2) темірдің тотығуы;
3) темірдің тотықсыздануы;
4) қалайының тотығуы.
6. Химиялық
коррозияда металдардың тотығу процесінің Гиббс энергиясын
келесі теңдеу бойынша есептеуге болады:
1) ![]() G
= −
G
= − ![]() G0 / nF;
G0 / nF;
2) ![]() G = ∑
G = ∑![]() G түз.өнім
– ∑
G түз.өнім
– ∑![]() G түз.баст.зат
G түз.баст.зат
3) ![]() G = ΔG0
–
G = ΔG0
– ![]()
![]() ;
;
4) ![]() G = ΔG0
+
G = ΔG0
+ ![]()
![]() .
.
7. Коррозиядағы
жұқа қабыршақтың жуандығы:
1) < 40 нм;
2)
40 – 50 нм;
3)
> 50 нм;
4) > 60 нм.
8. Электрхимиялық коррозияның жылдамдығын
есептейтін теңдеуді таңдаңыз:
1) ішекті = ![]() ;
;
2) ![]() ;
;
3) ![]() ;
;
4) ![]() .
.
9. Коррозиядағы ең жоғары
қорғаныш қасиеттері бар қабыршақты
таңдаңыз:
1) тұтас жұқа;
2) тұтас орташа;
3) тұтас жуан;
4) жұқасы да, орташасы да, жуаны да.
10. Темірді коррозиядан қорғағанда
катодтық қаптама жасау үшін қолданылатын металды
таңдаңыз:
1) мырыш;
2) сынап;
3) магний;
4) литий.
11. Никельді коррозиядан қорғағанда
анодтық қаптама жасау үшін қолданылатын металды
таңдаңыз:
1) темір;
2) қорғасын;
3) мыс;
4) күміс.
12. Металдан жасалған конструкция коррозияға тез ұшырайды, егер электролиттің құрамында:
1) жоғары температурада қышқылдық
ортада тотықтырғыш болса;
2) орташа (біркелкі)температурада қышқылдық ортада
тотықсыздандырғыш болса;
3) төменгі температурада қышқылдық
ортада тотықтырғыш болса;
4) төменгі температурада қышқылдық
ортада тотықсыздандырғыш болса.
10 Металдар, қорытпалар, олардың қасиеттері
1. d-элементтерге жатады:
1) типтік бейметалдар;
2) ерекше металдық жалтыры бар металдар;
3) жартылай өткізгіштер;
4) изоляторлар (айырушы заттар).
2. Ауыспалы металдарға жатады:
1) ауыспалы валенттілікті көрсететін металдар;
2) комнаттық
температурада жай зат түріндегі элементтер;
3) валентті d- немесе f-электронды элементтер;
4) бірнеше оксид түзетін элементтер.
3. Әр түрлі валенттілікті көрсетеді:
1) s-металдар;
2) р-металдар;
3) d-металдар;
4) барлық металдар.
4.Металдар жиынтығын таңдаңыз:
1) Sc, Hg, Tb, Re;
2) Sn, B, Ti, Rn;
3) Sm, Hf, Te, Rh;
4) As, Mo, In, Au.
5. Қосымша
топшалардың металдары ғана орналасқан топты
таңдаңыз:
1) B, Al, Ga, In;
2) Li, K, Na, Pb;
3) Mn, Tc, Re, Rh;
4) Be, Ca, Mg, Sr.
6. Металдар балқымаларын бір бірімен
араластырғанда түзілетін химиялық қосылыстар аталады:
1) қатты ерітінділер;
2) интерметалидтер;
3) қорытпалар;
4) аралас қосылыстар.
7. Болат – келесі заттардың қорытпасы:
1) темірдің никельмен;
2) темірдің кадмиймен;
3) темірдің көміртегімен;
4) темірдің мыспен.
8. Қорытпа деп келесі жүйені айтады:
1) балқытылған бейметалдардың қатып
қалған қоспасын;
2) балқытылған металдардың қатып қалған
қоспасын;
3) электролит ерітінділерін араластырғанда түзілетін
жүйені;
4) бейэлектролит ерітінділерін араластырғанда түзілетін
жүйені.
9. Қара металдарға жатады:
1) мыс;
2) қорғасын;
3) мырыш;
4) темір.
10. Электротехникада қызу лампыларындағы метал жібі жасалады:
1) темірден;
2) титаннан;
3) вольфрамнан;
4) мырыштан.
11. Келтірілген металдардың ішінен ең
қиын балқитын металды таңдаңыз:
1) темір;
2) платина;
3) вольфрам;
4) никель.
12. Келтірілген металдардың ішінен ең оңай
балқитын металды таңдаңыз:
1) магний;
2) сынап;
3) алтын;
4) титан.
Әдебиеттер тізімі
1. Бірімжанов Б.А. Жалпы химия. – А.: Мектеп, 2001.
2. Коровин Н.В., Масленникова Г.Н., Мингулина Э.И.,
Филиппов Э.Л. Курс общей химии. - М.: Высшая
школа, 2000.
3. Харин А.Н., Катаева Н.А., Харина
Л.Г. Курс химии. - М.: Высшая школа,1983.
4. Глинка Н.Л. Общая химия. - Л.:
Химия, 1999.
Мазмұны
Кіріспе
.................................................................................. 3
1 Атом құрылысы ……………………………………………. 4
2 Бейорганикалық
қосылыстардың негізгі кластары
……… 6
3 Ерітінділер
…………………………………………………. 7
4 Электролиттік диссоциация.
Тұздардың гидролизі
……... 9
5 Тотығу-тотықсыздану
реакциялары ……………………… 12
6 Химиялық кинетика
және катализ ………………………... 14
7 Электродтық потенциалдар.
ЭҚК ………………………… 17
8 Электролиз …………………………………………………. 19
9 Металдардың коррозиясы ………………………………… 21
10 Металдар, қорытпалар, олардың қасиеттері ……………..
24
Әдебиеттер тізімі ................................................................... 25
2005 ж. жиынтық жоспары, реті 13
Айтбала Айтеновна
Тұманова
Қарлыгаш Садыровна
Идрисова
ХИМИЯДАН
ТЕСТ ТАПСЫРМАЛАРЫ
(050718 – Электрэнергетика және 050719-Радиотехника,
электроника, телекоммуникациялар мамандығының
студенттеріне арналған)
Редакторы Ж. А. Байбураева
Басуға қол қойылды__________ Пішімі 60х84 1/16
Тиражы 50 дана. №1 типография
қағазы
Көлемі 1,6 оқу-басп.т. Тапсырыс______.
Бағасы 52 теңге.
Алматы энергетика және байланыс
институтының
көшірмелі-көбейткіш бюросы
![]()
050013 Алматы, Байтұрсынов к., 126