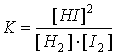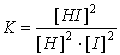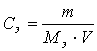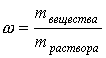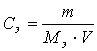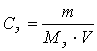АЛМАТИНСКИЙ ИНСТИТУТ ЭНЕРГЕТИКИ
И СВЯЗИ
Кафедра промышленной
теплоэнергетики
ТЕСТОВЫЕ ЗАДАНИЯ ПО ХИМИИ
(для студентов специальности
050717- Теплоэнергетика)
Алматы 2005
СОСТАВИТЕЛИ: А.А.Туманова, К.С.Идрисова.
Тестовые задания по химии (для студентов специальности 050717-
Теплоэнергетика).- Алматы: АИЭС, 2005.- 32 с.
Тестовые
задания по химии предназначены для
студентов 1 курса специальности 050717- Теплоэнергетика и содержат тестовые
вопросы по курсу «Химия».
Библиогр. - 3 назв.
Рецензент: канд.хим.наук, доц. КазНТУ им.К.И. Сатпаева
Г.Ж.
Елигбаева
Печатается по плану издания Алматинского
института энергетики и связи на 2005 г.
© Алматинский институт энергетики и связи,
2005 г.
Введение
Настоящие тестовые задания предназначены для студентов
1 курса. Цель - оказать помощь в подготовке к экзамену, промежуточному и
текущему контролю по химии.
Содержание тестовых заданий соответствует учебной
программе курса химии и состоит из 11 блоков, включающих основные разделы
неорганической и общей химии.
Тесты соответствуют уровню, предполагающему знание
основных понятий, законов, умению применять их для решения относительно
простых задач и систематизировать
учебный материал.
С помощью предлагаемых тестовых заданий студент может
самостоятельно выявить свой уровень знания материала учебной программы по
химии.
1 Строение атома. Основные законы химии
1. Численное значение постоянной Авогадро равно:
1)
6,02·1023 моль
2)
6,02·1023 моль-1
3)
6,02·1023 молекул
4) 22,4
л/моль
2. 6,02·1023 молекул содержит количество
вещества, равное:
1) 1
молю
2) 2
молям
3) 0,5
молям
4) 4
молям
3. Количество вещества в 34 г сероводорода:
1) 2
моля
2) 1
моль
3) 0,5
моля
4) 0,1
моль
4. Максимальное число электронов в электронном слое с
главным квантовым числом n=2:
1) 2
2) 4
3) 6
4) 8
5. 3,01 1023 молекул газа при н.у. занимают
объем:
1) 22,4
л
2) 11,2
л
3) 44,8
л
4) 1,12
л
6. Единица измерения относительной молекулярной массы:
1)
г/моль
2) г/мл
3) г
4)
безразмерная величина
7. Плотность газа по водороду:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
8. Молярный объем газа измеряется в:
1)
моль/л
2)
г/моль
3)
л/моль
4) л
9. Количество вещества в 36 г H2O:
1) 1
моль
2) 0,5
моля
3) 2
моля
4) 0,2
моля
10. Единица измерения молярной массы вещества:
1) г
2)
моль/л
3)
г/моль
4)
безразмерная величина
11. Плотность газа по воздуху:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
12. После заполнения подуровня 5 d заполняется следующий подуровень:
1) 6 s
2) 4 f
3) 6 p
4) 5 f
13. Атомная орбиталь- это:
1)
область наиболее вероятного нахождения электрона в пространстве
2)
траектория, по которой движется электрон
3) набор
четырех квантовых чисел
4)
область наиболее вероятного нахождения атома в пространстве
14. Уравнение Менделеева-Клайперона:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
15. Максимальное число электронов в электронном слое с
главным квантовым числом 4:
1) 6
2) 8
3) 18
4) 32
16. В атомах после заполнения подуровня 5 f
заполняется подуровень:
1) 6 d
2) 7 p
3). 6 s
4) 6 p
17. Орбитальное квантовое число характеризует:
1)
ориентацию орбиталей в пространстве
2) форму
атомной орбитали
3)
собственное движение электрона
4)
энергию и размер электронных орбиталей
18. Максимальное число электронов в электронном слое с
главным квантовым числом n=3:
1)
6 2) 18 3) 8 4) 32
19. Состояние электрона в атоме описывается следующими
квантовыми числами:
1) n
2) n, l, ml
3) n, l, ml, s
4) n, l, ml, ms
20. Величину R в
уравнении Менделеева-Клайперона называют:
1) постоянной Авогадро
2) постоянной Больцмана
3) энергией активации
4) универсальной газовой постоянной
2 Химический эквивалент
1. Химический эквивалент- частица вещества,
эквивалентная в кислотно-основной реакции:
1) одной
молекуле водорода
2)
одному электрону
3)
одному иону водорода
4) числу
ионов водорода, участвующему в реакции
2. Укажите группу веществ, имеющих одинаковое значение
фактора эквивалентности:
1) Ca(CH3COO)2,
BaCl2, HNO3
2) CH3COOH, NaOH,
Mg(NO3)2
3) CH3COONa, LiOH, HI
4) Al(OH)3, Ca3(PO4)2, K2CO3
3. Молярная масса эквивалента гидроксида натрия равна:
1) 40
г/моль
2) 20
г/моль
3) 40 моль/л
4) 20
г/мл
4. Молярная масса эквивалента хлорида меди равна:
1) 135
г/моль
2) 67,5
моль/л
3) 67,5
г/моль
4) 135
моль/л
5. Единица измерения молярной массы эквивалента
вещества:
1) г
2)
моль/л
3)
г/моль
4)
безразмерная величина
6. Укажите группу веществ, имеющих одинаковое значение
фактора эквивалентности:
1) Ca(OH)2,
Na2CO3, H2SO3
2) Ca(OH)2, H2SO4,
KCl
3) HNO3, NaOH, CaCl2
4) KI, NaCl, H3PO4
7. Основность (z) хлорида натрия равна:
1) 1 2)
2 3) 3 4) 4
8. Укажите группу веществ, имеющих одинаковое значение
фактора эквивалентности:
1) Ca(OH)2,
Na2CO3, H2SO3
2) Ca(OH)2, H2SO4,
KCl
3) HNO3, NaOH, CaCl2
4) KI, NaCl, H3PO4
9. Укажите группу веществ, имеющих одинаковое значение
фактора эквивалентности:
1) NaOH, HCl, K2CO3
2) H2SO4, Ca(OH)2,
NaBr
3) CrCl3, Al(OH)3,
H3PO4
4) Al2(SO4)3,
Cr(OH)3, CaI2
10. Укажите группу веществ, имеющих одинаковое
значение фактора эквивалентности:
1) NaOH, HCl, K2CO3
2) H2SO4, Ca(OH)2,
NaBr
3) CrCl3, Al(OH)3,
H3PO4
4) Al2(SO4)3,
Cr(OH)3, CaI2
11. Основность (z) фосфорной кислоты равна:
1)
3 2) 1 3) 2 4) 4
12. Основность (z) сульфата меди равна:
1)
1 2) 2 3) 3 4) 4
13. Химический эквивалент- частица вещества,
эквивалентная в окислительно-восстановительной реакции:
1)
одному иону водорода
2) числу
ионов водорода, участвующих в реакции
3) числу
электронов, участвующих в реакции
4)
одному электрону
14. Основность (z) гидроксида хрома равна:
1)
2 2) 3 3) 4 4) 6
15. Укажите группу веществ, имеющих одинаковое
значение фактора эквивалентности:
1) Ba(OH)2,
SrSO4, NaBr
2) CaBr2, K2C2O4,
LiOH
3) Li2CO3, Cr(OH)2,
HNO3
4) Fe2S3, Al2(SO4)3,
Ca3(PO4)2
3 Основные
классы неорганических соединений
1. Выберите кислотный оксид:
1) оксид
натрия
2) оксид
магния
3) оксид
углерода (IV)
4) оксид
хрома
2. Укажите формулу средней соли:
1) KHSO4
2) Mg(OH)Cl
3) MgSO4
4) Na[Al(OH)4]
3. Оксид железа (II) относится к:
1)
кислотным оксидам
2)
несолеобразующим оксидам
3)
основным оксидам
4)
амфотерным оксидам
4. Выберите солеобразующий оксид:
1) оксид
марганца
2) оксид
азота
3) оксид
углерода
4) оксид
азота (IV)
5. Основную соль хлорида меди называют:
1)
гидрохлорид
2)
гидрохлорит
3)
гидроксохлорид
4)
гидроксохлорит
6. Неправильно составлена формула соли:
1) FeCl3
2) CuCl2
3) NaCl
4) FeCl
7. Выберите
формулу соли:
1) CH3COOH
2) NaOH
3) CH3COONa
4) CuO
8. Выберите кислую соль:
1) Cu(OH)SO4
2) CaCl2
3) Na2HPO4
4) Na2B4O7
9. Неверно предложено название соли:
1)
ортофосфит натрия
2)
хлорид меди
3)
сульфат железа (II)
4)
нитрат алюминия
10. Выберите амфотерный оксид:
1) оксид
хрома
2) оксид
цинка
3) оксид
железа
4) оксид
углерода
11. Выберите гидроксид:
1) Na2O
2)
Ca(OH)2
3) H2SO4
4) CuCl2
12. Выберите кислоту:
1) HСООН
2) BaCl2
3) Cr2(SO4)3
4)
Zn(OH)2
4 Комплексные соединения
1. Степень окисления иона-комплексообразователя в
комплексном соединении [Co(NH3)5Br]SO4:
1)
+2 2) +3 3)
-3 4) +4
2. Разрыв ионной связи при диссоциации произойдет в
соединении:
1) [Pt(NH3)2Cl2]
2) [Ni(CO)4]
3) K3[Fe(CN)6]
4) [Co(NH3)3Cl3]
3. Лиганд связан с комплексообразователем:
1)
ионной связью
2)
водородной связью
3).
донорно-акцепторной связью
4)
ковалентной полярной связью
4. Центральный ион-комплексообразователь с лигандом
составляет:
1)
внешнюю сферу
2)
внутреннюю сферу
3)
комплексное соединение
4) нейтральную молекулу
5. Бидентатным лигандом является:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
6. Число связей
между ионом- комплексообразователем и лигандом называется:
1)
зарядом комплексного иона
2)
дентатностью
3)
координационным числом
4) зарядом
лиганда
7. Число лигандов, координируемых вокруг
иона-комплексообразователя, называется:
1)
зарядом комплексного иона
2)
дентатностью
3)
зарядом лиганда
4)
зарядом лиганда
8. Донором электронных пар при образовании химической
связи в комплексном соединении
является:
1)
катион внешней сферы
2) анион
внешней сферы
3)
лиганд
4)
ион-комплексообразователь
9. Акцептором электронных пар при образовании
химической связи в комплексном соединении является:
1)
катион внешней сферы
2) анион
внешней сферы
3) лиганд
4)
ион-комплексообразователь
10. Полидентатным лигандом является:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
11. Заряд
комплексного аниона в соединении
Na3[Co(NO2)6] равен:
1)
+3 2) -3 3) +6 4) -6
12. Степень окисления иона-комплексообразователя в
комплексном соединении [Pt(NH3)4SO4](OH)2:
1)
+2 2) +3 3) +4 4) -4
5 Химическая кинетика и катализ
1. Определите
изменение скорости химической реакции при повышении температуры на 200С,
если температурный коэффициент γ = 4 :
1)
увеличится в 8 раз
2)
уменьшится в 16 раз
3)
увеличится в 16 раз
4) не
изменится
2. Уравнение v = k ּc2 описывает скорость реакции:
1) нулевого
порядка
2)
первого порядка
3)
второго порядка
4)
третьего порядка
3. Константа равновесия для реакции H2(г) + I2(г) = 2HI(г)
выражается уравнением:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
4. Константа равновесия для реакции 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(пар)
выражается уравнением:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
5. Скорость химической реакции описывается изменением
в единицу времени концентрации:
1)
исходного вещества
2)
катализатора
3)
фермента
4)
ингибитора
6. Скорость химической реакции при повышении
температуры на 400С и температурном коэффициенте γ = 2:
1) не
изменится
2)
увеличится в 16 раз
3)
уменьшится в 16 раз
4)
уменьшится в 8 раз
7. Изменение давления не оказывает влияния на смещение
равновесия в системе:
1) 2SO2 +
O2 = 2SO3
2) COCl2 = CO + Cl2
3) 2NO + Cl2 = 2NOCl
4) H2 + F2 = 2HF
8. Для реакции нулевого порядка скорость реакции:
1)
увеличивается при постоянной температуре
2)
уменьшается при постоянной температуре
3)
зависит от концентрации реагента
4) не
зависит от концентрации реагента
9. Изменение давления не оказывает влияния на смещение
равновесия в системе:
1) N2 +
3H2 = 2NH3
2) CO + Cl2 = COCl2
3) 4HCl + O2 = 2H2O
+ 2Cl2
4) N2 + O2 = 2NO
10. Для реакции 2NO + O2 = 2NO2 закон действующих масс выражается формулой:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
6 Энергетика химических процессов. Химическая
термодинамика
1. Открытая система с окружающей средой:
1)
обменивается энергией, но не обменивается веществом
2) не
обменивается ни веществом, ни энергией
3)
обменивается веществом, но не обменивается энергией
4)
обменивается и энергией, и веществом
2. В экзотермической реакции:
1)
ΔH<0 2) ΔH>0 3)
ΔH=0 4)
ΔU>0
3. Единица измерения энтропии:
1)
кДж/моль
2) кДж
3)
Дж/моль·К
4) Дж/К
4. К экстенсивным параметрам относятся:
1) V, S, U, H, G
2) V, T, H, τ, U
3) T, P, C, τ, ρ
4)
P, S, C, V, G
5.
Стехиометрические коэффициенты в термодинамических уравнениях указывают:
1) на
соотношение между количествами веществ
2) на
реальные количества реагирующих и образующихся веществ
3) на
массу веществ
4) на
скорость расходования и образования веществ
6. Степень беспорядка в термодинамической системе
характеризует физическая величина:
1)
S 2) H 3) G 4) V
7. Закрытая система с окружающей её средой:
1)
обменивается энергией, но не обменивается веществом
2) не
обменивается ни веществом, ни энергией
3)
обменивается веществом, но не обменивается энергией
4)
обменивается и энергией, и веществом
8. Тепловой эффект химической реакции при ![]() - это:
- это:
1)
количество выделившейся или поглощенной теплоты
2)
изменение энтальпии в результате химической реакции
3)
изменение внутренней энергии в результате химической реакции
4)
работа, выполненная в ходе химической реакции
9. Стандартными условиями в термодинамических реакциях
называют
1)
давление 1 атм и температуру 00С
2)
давление 101325 Па и температуру 298 К
3)
давление 100 Па и температуру 100 К
4)
давление 100 кПа
10. К интенсивным параметрам относятся:
1) V, S,
U, H, G
2) V, T, H, τ, U
3) T, P, C, τ, ρ
4) P, S, C, V, G
11. В
эндотермической реакции:
1)
ΔH<0 2)
ΔH>0 3)
ΔH=0 4)
ΔU>0
12. Единица измерения свободной энергии Гиббса:
1)
кДж/моль 2) кДж 3) Дж/моль·К 4) Дж/К
13. Стандартные энтальпии образования простых веществ
равны:
1) 1 кДж
2) 298
Дж
3) нулю
4) 273
кДж
14. Выберите вещество, теплота образования которого не
равна нулю:
1) Cl2 2) Br2 3) N2 4) CO
15. Изолированная система с окружающей её средой:
1)
обменивается энергией, но не обменивается веществом
2) не
обменивается ни веществом, ни энергией
3)
обменивается веществом , но не обменивается энергией
4)
обменивается и энергией, и веществом
16. Стандартный тепловой эффект химической реакции
обозначается следующим образом:
1)
ΔUст
2) Δ Н0298
3)
Q273101.3
4)
ΔHст
7 Способы выражения концентрации растворов
1. Массовая доля раствора выражается в:
1) г
2) мл
3) %
4) моль/л
2. Молярная концентрация раствора-это:
1)
отношение количества вещества к 1 л раствора
2) масса
вещества в граммах, растворенная в 1 мл раствора
3)
количество вещества, растворенное в 1 л раствора
4)
отношение массы вещества к массе растворителя
3. Массовую долю раствора рассчитывают по формуле:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
4. Молярная масса азотной кислоты равна:
1) 63
моль/л 2) 63 3) 63
моль/г 4) 63 г/моль
5. Единица измерения молярной концентрации раствора:
1) г/мл
2)
моль/л
3) г
4)
л/моль
6. Титр раствора выражается в:
1)
моль/л
2) г/мл
3)
л/моль
4) г
7. Молярная
эквивалентная концентрация- это:
1)
отношение количества вещества к 1 л раствора
2) масса
вещества в граммах, растворенная в 1 мл раствора
3)
количество вещества, растворенное в 1 л раствора
4)
количество эквивалента вещества, растворенное в 1 л раствора
8. Молярную эквивалентную концентрацию раствора
рассчитывают по формуле:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
9. Молярную концентрацию раствора рассчитывают по
формуле:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
10.Титр раствора- это:
1)
отношение количества вещества к 1 л раствора
2) масса
вещества в граммах, растворенная в 1 мл раствора
3)
количество вещества, растворенное в 1 л раствора
4)
отношение массы вещества к массе растворителя
8 Растворы электролитов. Гидролиз солей
1. Закон разведения Оствальда для слабых электролитов
выражается в виде:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
2. рН раствора с концентрацией Н+ - ионов,
равной 1·10-8 моль/л:
1) –
8 2) 8 3) 6
4) – 6
3. Количественно процесс диссоциации характеризуется
величиной:
1)
степени диссоциации
2)
степени дисперсности
3)
степени гидролиза
4) степени
извлечения
4. Водородным показателем рН называют величину,
численно равную:
|
1) |
- |
|
2) |
- |
|
3) |
|
|
4) |
- |
5. В нейтральной среде концентрация ионов водорода ![]() и рН равны
соответственно:
и рН равны
соответственно:
1) 10-14,
14
2) 10-4,
4
3) 10-7,
7
4) 10-8,
8
6. рН раствора с концентрацией ионов ОН- ,
равной 10-4 моль/л:
1)
4 2) 10 3) – 4 4) 7
7. Постоянная
Кw называется:
1) константой
скорости
2)
константой диссоциации
3)
константой гидролиза
4)
ионным произведением воды
8. Реакция среды, если ![]() моль/л:
моль/л:
1)
щелочная
2)
кислая
3)
нейтральная
4)
слабокислая
9. Гидроксильным показателем рОН называют величину,
численно равную:
|
1) |
- |
|
2) |
- |
|
3) |
- |
|
4) |
|
10. Концентрация ионов водорода в чистой воде при 298
К составляет:
1) 10-14 2) 10-7 3) 107 4) 1014
11. Ионную силу раствора можно рассчитать по формуле:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
12. рН воды равен:
1) 10-14
2) 14 3) 7 4) 2
13. Жесткость воды обусловлена присутствием ионов:
1) Ca2+ и Mg2+
2) Ba2+ и SO42-
3) Ca2+ и Cl-
4) Mg2+ и CO32-
14. Некарбонатную жесткость воды можно устранить:
1) кипячением
2) отстаиванием
3) фильтрованием
4) действием соды
15. Для устранения жесткости воды можно использовать следующее вещество:
1) NaOH
2) CaCl2
3) Na2CO3
4) H2SO4
16. При гидролизе хлорида меди реакция среды:
1)
щелочная
2)
кислая
3)
нейтральная
4) слабощелочная
17. Процесс гидролиза обратен:
1)
процессу
диссоциации
2)
процессу
нейтрализации
3)
процессу
электролиза
4)
процессу
коррозии
18. Степень гидролиза соли с повышением температуры
раствора:
1)
увеличивается
2)
уменьшается
3)
и
увеличивается, и уменьшается
4)
не
меняется
19. При гидролизе карбоната натрия на I
ступени образуется:
1)
гидрокарбонат
натрия
2)
угольная
кислота
3)
гидроксокарбонат
натрия
4)
гидролиз
не идет
20. Выберите вещество, которое подвергается
гидролизу
1) KCl; 2) Na2SO4; 3) Al2S3; 4) СsNO3
21. Осмотическое давление разбавленных растворов электролитов
рассчитывается по уравнению:
1) π = ![]()
2) π = ![]()
![]()
3) P = ![]()
4) ![]()
22. Выберите формулировку
первого закона Рауля:
1)
относительное
понижение давления насыщенного пара растворителя над раствором равно мольной
доле растворенного вещества
2)
масса
газа, растворяющегося при T=const в данном объеме жидкости,
прямо пропорциональна парциальному давлению газа
3)
понижение
температуры замерзания и повышение температуры кипения для разбавленных растворов
неэлектролитов пропор-циональны концентрации растворов
4)
для
растворов электролитов опытные величины осмотического давления, температур
кипения и замерзания всегда больше теоретически вычисленных
9 Окислительно-восстановительные реакции
1. Степень окисления
кислорода в перекисных соединениях равна:
1)
+2 2) -2 3) +1 4) -1
2. В какой молекуле степень окисления хлора
наименьшая:
1.
KClO 2. NaCl 3. KClO3 4. NaClO2
3. В соединениях CaO, MgO, BaO валентность металлов равна:
1)
2 2) 1 3) 4 4) 3
4. Для железа характерны степени окисления:
1) +3,
+4
2) +1,
-1
3) +2,
+3
4) +1,
+3
5. Степень окисления азота (-3) характерна для
соединения:
1) NO2 2) N2O 3) NH3 4) N2O4
6. Для марганца характерны степени окисления:
1) +1,
+3, +5
2) +2,
+3, +6
3) +2,
+4, +7
4) +3,
+4, +5
7. Заряд кислотного остатка ортофосфорной кислоты
равен:
1) 2+ 2) 3- 3) 3+ 4) 2-
8. Максимальная степень окисления серы:
1)
+2 2) +3 3) +4 4) +6
9. Степень окисления хрома в сульфате хрома равна:
1)
+6 2) -6 3) +3 4) -3
10. Для азота
характерны степени окисления:
1) +2,
+3, +5
2) +4,
+5, -3
3) +3,
+6, -2
4) +2,
-3, +6
11. Связь между степенью окисления и валентностью
атома:
1)
степень окисления всегда меньше валентности
2)
степень окисления может быть больше валентности
3)
степень окисления может быть равна валентности
4) это
одно и то же
12. Степень окисления водорода в солеобразных гидридах
равна:
1)
+1 2) 0 3) -1 4) +2
10 Электрохимические
процессы. Коррозия металлов
1. Суммарная электродная реакция элемента
Якоби-Даниэля выражается уравнением:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
2. Концентрационным элементом называется система,
состоящая:
1) из
металлического и водородного электродов
2) из 2
одинаковых электродов, опущенных в растворы своих солей
3) из
медного и цинкового электродов
4) из
кадмиевого и цинкового электродов
3. Уравнение Нернста для расчета потенциала
металлического электрода:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
4. Уравнение Нернста для расчета потенциала
водородного электрода:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
5. Потенциал, возникающий в растворе, содержащем
окисленную и восстановленную формы вещества, называется:
1) водородным потенциалом
2) редокс-потенциалом
3) кислородным потенциалом
4) гальвани-потенциалом
6. Максимальная полезная работа, совершаемая системой
при протекании реакции при р=const:
1) А= nFE
2) A= -ΔG
3) A= Q + ΔU
4) A= q (U1+U2)
7. Совокупность ОВР, протекающих на катоде и аноде в
растворах или расплавах электролитов при пропускании электрического тока
называется:
1)
гидролизом
2)
этерификацией
3)
электролизом
4)
диссоциацией
8. При электролизе водного раствора сульфата меди с
нерастворимым анодом образуются следующие продукты:
1) на
катоде - медь, на аноде - кислород
2) на
катоде - водород, на аноде - кислород
3) на
катоде - медь, на аноде - сера
4) на
катоде - водород, на аноде – сера
9. Ёмкость, в которой проводится электролиз,
называется:
1)
конвертор
2)
диализатор
3)
электролизер
4)
термостат
10. Законы электролиза сформулировал:
1) Э.
Резерфорд
2) Д. И.
Менделеев
3) М.
Фарадей
4)
Аристотель
11. При электролизе водного раствора хлорида натрия
кислотность среды у катода:
1)
нейтральная
2)
кислая
3)
щелочная
4)
слабокислая
12. При электролизе водного раствора хлорида кальция на
аноде выделяется:
1)
водород
2)
кислород
3) хлор
4)
кальций
13. При электролизе водного раствора нитрата калия с
нерастворимым анодом образуются следующие продукты:
1) на
катоде - калий, на аноде - кислород
2) на
катоде - водород, на аноде - кислород
3) на
катоде - калий, на аноде - азот
4) на
катоде - водород, на аноде - оксид азота (IV)
14. Вещество, дающее одинаковые продукты при электролизе
водного раствора и расплава:
1)
хлорид меди (II) (CuCl2)
2)
бромид калия (KBr)
3)
гидроксид натрия (NaOH)
4) таких
веществ не бывает
15. Выражение, объединяющее законы Фарадея:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
16. Для химического превращения 1моль эквивалентов
вещества надо пропустить через раствор 96500 Кл электричества, которые
соответствуют:
1) 1,0 А/ ч 2) 26,8 А/ ч 3) 13,4 А/ ч 4)
10,0 А /ч
17. При коррозии оцинкованного железа кислородом
воздуха на катоде протекает процесс:
1)
восстановления Fe
2)
окисления Fe
3)
восстановления Zn
4)
восстановления кислорода
18. Энергия Гиббса окисления металлов при коррозии
рассчитывается по уравнению:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
19. Электрохимическая коррозия представляет собой:
1) взаимодействие металла с
кислородом воздуха
2) разрушение металла в
среде электролита
3) взаимодействие металла с
оксидами азота
4) взаимодействие металла с
оксидами углерода
20. Лимитирующей стадией при электрохимической
коррозии является:
1) реакция анодного
окисления металла
2) реакция катодного
восстановления металла
3) реакция анодного
окисления окислителя
4) реакция катодного
восстановления металла и анодного окисления окислителя
11 Металлы,
сплавы и их свойства
1. Набор, содержащий только металлы:
1) Sc, Hg, Tb, Re
2) Sn, B, Ti, Rn
3) Sm, Hf, Te, Rh
4) As, Mo, In, Au
2. Химические соединения металлов друг с другом,
образующиеся при смешивании их расплавов называются:
1) твердыми растворами
2) интерметаллидами
3) сплавами
4) смешанными соединениями
3. Сталь - это сплав:
1) Fe с Ni
2) Fe с Cd
3) Fe с C
4) Fe с Cu
4. Сплав - это система, образующаяся:
1) при
затвердевании расплавленной смеси неметаллов
2) при
затвердевании расплавленной смеси металлов
3) при
смешивании растворов электролитов
4) при
смешивании растворов неэлектролитов
5. Группа, в которой расположены только металлы
побочных подгрупп:
1) B, Al, Ga, In,
Tl
2) Li, Na, K, Pb, Cs, Fr
3) Mn, Tc, Re, Rh
4) Be, Mg, Ca, Sr, Ba, Ra
6. Наиболее тугоплавким металлом является:
1)
цинк 2) железо 3)
свинец 4) вольфрам
7. В самородном состоянии встречается металл:
1)
серебро
2)
кадмий
3)
натрий
4)
магний
8. Сплав, широко используемый в авиационной технике
благодаря лёгкости и высокой твердости:
1) чугун
2)
латунь
3)
дюралюмин
4) сталь
9. Для получения хрома алюминотермическим способом
используют следующие вещества:
1) Cr, Al
2) Cr2O3, Al2O3
3) Cr, Al2O3
4)
Cr2O3, Al
Список литературы
1. Коровин Н.В.,
Масленникова Г.Н., Мингулина Э.И., Филиппов Э.Л. Курс общей химии. -
М.: Высшая школа, 2000.
2. Харин А.Н., Катаева Н.А., Харина
Л.Г. Курс химии. - М.: Высшая школа,1983.
3. Глинка Н.Л. Общая химия. - Л.:
Химия, 1999.
Содержание
Введение…………………………………………………………………….3
1 Строение атома. Основные законы химии …………………………….4
2 Химический эквивалент ………………………………………………. 7
3 Основные классы неорганических соединений ……………………… 9
4 Комплексные соединения ………………………………………………11
5 Химическая кинетика и катализ ……………………………………….13
6 Энергетика химических процессов. Химическая
термодинамика …..16
7 Способы выражения концентрации растворов ……………………….18
8 Растворы электролитов. Гидролиз солей …………………………….. 20
9 Окислительно-восстановительные реакции …………………………. 24
10 Электрохимические
процессы. Коррозия металлов
......................... 25
11 Металлы,
сплавы и их свойства ……………………………………..29
Список литературы………………………………………………………...31
Св.план 2005 г., поз 12
Айтбала Айтеновна
Туманова
Карлыгаш Садыровна
Идрисова
ТЕСТОВЫЕ ЗАДАНИЯ ПО
ХИМИИ
(для студентов
специальности 050717 – Теплоэнергетика)
Редактор Ж.М. Сыздыкова
Подписано в печать ___________ Формат 60х84 1/16
Тираж 50 экз Бумага
типографская № 1
Объем 2,0 уч.- изд. л. Заказ _____. Цена 44 тг.
Копировально-множительное
бюро
Алматинского
института энергетики и связи
050013 Алматы, ул.
Байтурсынова,126