Некоммерческое акционерное общество
Алматинский университет энергетики и связи
Кафедра промышленной теплоэнергетики
КОНСТРУКЦИОННЫЕ МАТЕРИАЛЫ ТЕПЛОЭНЕРГЕТИКИ
Конспект лекций для студентов всех форм обучения
специальности 5В071700 - Теплоэнергетика
Алматы 2011
СОСТАВИТЕЛЬ: Н.О.Джаманкулова. Конспект лекций по дисциплине «Конструкционные материалы теплоэнергетики» для студентов всех форм обучения специальности 5В071700 – Теплоэнергетика. - Алматы: АУЭС, 2011. -60 с.
Конспект лекций по дисциплине «Конструкционные материалы теплоэнергетики» содержит краткие теоретические сведения по строению металлов, процессам кристаллизации и пластической деформации, теории двойных сплавов и термической обработке сталей, а также приведены сведения о конструкционных материалах из цветных металлов.
Конспект лекций по дисциплине «Конструкционные материалы теплоэнергетики» предназначен для студентов всех форм обучения специальности 5В071700 – Теплоэнергетика.
Ил. 41, библиогр. - 15назв.
Рецензент: канд. техн. наук, доц. Мусабеков Р.А.
Печатается по плану издания Некоммерческого акционерного общества
"Алматинский университет энергетики и связи" на 2010 г.
© НАО "Алматинский университет энергетики и связи", 2011 г
Сводный план 2010г., поз. _224_
1 Лекция. Цели и задачи изучения дисциплины
Содержание лекции: металловедение -составная часть материаловедения. Роль конструкционных материалов для современной техники, технологии и энергооборудования. Наука о взаимосвязи электронного строения, структуры металлов и сплавов с их составом, физическими, химическими, технологическими и другими свойствами.
Введение
В настоящих лекциях рассмотрены физические основы строения и свойств конструкционных материалов, приводятся широко используемые методы определения механических свойств материалов при различных видах нагружения, излагаются основы термической обработки, даются характеристики основных групп конструкционных материалов.
Задачи изучения дисциплины.
Установление взаимосвязи свойств конструкционных материалов с их химическим составом и структурой, изучение механических свойств и структурных составляющих сплавов.
Знание свойств, которыми должен обладать материал промышленных установок и умение получать заданные свойства с помощью различных видов обработки - термической, термохимической, химико-термической.
Уяснить влияние условий эксплуатации промышленных установок на изменение свойств конструкционных материалов и причины изменения этих свойств.
Научиться выбирать конструкционные материалы для теплоэнергетического оборудования с учетом эксплуатационных свойств и экономических показателей, научиться работать с оборудованием, используемым для исследования структуры и свойств металлов и сплавов.
Иметь представление о современных методах обработки металлов, формирование диалектического мышления в процессе изучения дисциплины.
Умение самостоятельно пользоваться современной технической и справочной литературой, в том числе Internet -ресурсами, для выбора новых современных материалов с целью повышения надежности и долговечности энергетического оборудования.
Знание основ материаловедения необходимо специалисту, работающему в сфере эксплуатации современного энергетического оборудования.
Особенности металловедения в теплоэнергетике и его задачи
Основу современной теплоэнергетики составляют тепловые электрические станции, оснащенные мощными парогенераторами и турбинами. Базовыми конструкционными материалами теплоэнергетических установок являются стали и сплавы, которые обладают высокими эксплуатационными свойствами. К таким свойствам относятся способность металла длительно противостоять воздействию высокой температуры, давлению, коррозии и эрозии.
Длительная эксплуатация энергоустановок в течение десятков тысяч часов приводит к изменению структуры металла, накоплению в нем повреждений и, как следствие, ухудшению его основных служебных свойств и снижению надежности работы оборудования и трубопроводов.
Для замедления этих негативных процессов повышаются требования к качеству металла, обследованию его структурно-механического состояния и обоснованию оценки остаточного ресурса. Поэтому долговечность, надежность и эффективность работы энергоблоков неразрывно связаны с качеством металла, их структурой и уровнем служебных свойств. В связи с этим прогресс в развитии теплоэнергетики зависит от обеспечения энергомашиностроительных предприятий жаропрочными, жаростойкими и коррозионно-стойкими сталями и сплавами высокого и особого качества.
Основные задачи металловедения для теплоэнергетики состоят в изучении - структуры и комплекса физико-механических свойств металла,
изменений, происходящих в структуре и свойствах на стадиях изготовления и эксплуатации оборудования и трубопроводов, обосновании выбора металла и технологий его обработки для изготовления деталей и конструкций энергоблоков, использовании эффективных способов оперативной диагностики структурно-механического состояния металла и разработке надежных методик оценки его остаточного ресурса.
1.1 Металлы
Основными материалами, используемыми в энергетике, являются, и еще долго будут оставаться металлы и их сплавы. Поэтому основной частью материаловедения является металловедение.
Металл и сейчас остается фундаментом мирового научно-технического прогресса. Металлы, созданные природой, и многочисленные металлические сплавы, полученные человеком, являются основными конструкционными материалами для всех отраслей промышленности.
Теоретическими основами металловедения являются такие науки, как физика, химия, кристаллография, физика твердого тела, физическая химия.
Металловедение - наука, изучающая строение и свойства металлов и их сплавов, устанавливающая связь между их составом, строением и свойствами и разрабатывающая пути воздействия на их свойства.
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
В 1873-1876 г.г Гиббс изложил основные законы фазового равновесия и, в частности, правило фаз, основываясь на законах термодинамики. Для решения практических задач знание фазового равновесия в той или иной системе необходимо, но не достаточно для определения состава и относительного количества фаз. Обязательно знать структуру сплавов, то есть атомное строение фаз, составляющих сплав, а также распределение, размер и форму кристаллов каждой фазы.
Определение атомного строения фаз стало возможным после открытия Лауэ (1912 г), показавшего, что атомы в кристалле регулярно заполняют пространство, образуя пространственную дифракционную решетку, и что рентгеновские лучи имеют волновую природу. Дифракция рентгеновских лучей на такой решетке дает возможность исследовать строение кристаллов.
В последнее время для структурного анализа, кроме рентгеновских лучей, используют электроны и нейтроны. Соответствующие методы исследования называются электронографией и нейтронографией. Электронная оптика позволила усовершенствовать микроскопию. В настоящее время на электронных микроскопах полезное максимальное увеличение доведено до 100000 раз.
В пятидесятых годах, когда началось исследование природы свойств металлических материалов, было показано, что большинство наиболее важных свойств, в том числе сопротивление пластической деформации и разрушению в различных условиях нагружения, зависит от особенностей тонкого кристаллического строения. Этот вывод способствовал привлечению физических теорий о строении реальных металлов для объяснения многих непонятных явлений и для конструирования сплавов с заданными механическими свойствами. Благодаря теории дислокаций, удалось получить достоверные сведения об изменениях в металлах при их пластической деформации.
Особенно интенсивно развивается металловедение в последние десятилетия. Это объясняется потребностью в новых материалах для исследования космоса, развития электроники, атомной энергетики. Использование быстро развивающихся нанотехнологий способствует появлению новых энергосберегающих материалов.
Главной задачей материаловедения является создание материалов с заранее рассчитанными свойствами применительно к заданным параметрам и условиям работы. Большое внимание уделяется изучению металлов в экстремальных условиях (низкие и высокие температуры и давление).
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место. Причина этого - в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы один из классов конструкционных материалов, характеризующийся определенным набором свойств. Основные признаки металлов:
- наличие кристаллической решетки в твердом состоянии;
- «металлический блеск» (высокая отражательная способность);
- пластичность;
- высокая теплопроводность;
- высокая электропроводность;
- прочность.
Металлы можно разделить на две большие группы: черные и цветные.
Черные металлы имеют темно-серый цвет, большую плотность (кроме щелочноземельных), высокую температуру плавления, относительно высокую твердость и во многих случаях обладают полиморфизмом. Наиболее типичным металлом этой группы является железо.
Цветные металлы чаще всего имеют характерную окраску: красную, желтую, белую. Обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления, для них характерно отсутствие полиморфизма. Наиболее типичным металлом этой группы является медь.
Черные металлы в свою очередь можно подразделить следующим образом:
Железные металлы - железо, кобальт, никель (так называемые ферромагнетики) и близкий к ним по свойствам марганец. Кобальт, никель и марганец часто применяют как добавки к сплавам железа, а также в качестве основы для соответствующих сплавов, похожих по своим свойствам на высоколегированные стали.
Тугоплавкие металлы, температура плавления которых выше чем железа (то есть выше 1539° С). Применяют как добавки к легированным сталям, а также в качестве основы для соответствующих сплавов.
Урановые металлы - актиниды, имеющие преимущественное применение в сплавах для атомной энергетики.
Редкоземельные металлы (Р3М) - лантан, церий, неодим, празеодим и другие, объединяемые под названием лантаноидов, и сходные с ними по свойствам иттрий и скандий. Эти металлы обладают весьма близкими химическими, но различными физическими свойствами (температура плавления и другие). Их применяют как присадки к сплавам других элементов.
Щелочноземельные металлы в свободном металлическом состоянии не применяются, за исключением особых случаев, например, как теплоноситель в атомных ректорах.
Цветные металлы подразделяются на:
Легкие металлы - бериллий, магний, алюминий, обладающие малой плотностью.
Благородные металлы - серебро, золото, платина, палладий, иридий, родий, осмий, рутений. К ним может быть отнесена и «полублагородная» медь. Обладают высокой устойчивостью против коррозии.
Легкоплавкие металлы - цинк, кадмий, ртуть, олово, свинец, висмут, таллий, сурьма. Галлий и германий (элементы с ослабленными металлическими свойствами).
1.2 Методы изучения строения металлов
Изучение строения металлов и сплавов производится методами макро- и микроанализа, рентгеновского, а также дефектоскопии (рентгеновской, магнитной, ультразвуковой).
Макроанализ изучает макроструктуру, т.е. структуру, видимую невооруженным глазом или с помощью лупы, при этом выявляются крупные дефекты: трещины, усадочные раковины, газовые пузыри и т. д., а также неравномерность распределения примесей в металле. Макроструктуру определяют по изломам металла, по макрошлифам. Макрошлиф - образец металла или сплава, одна из сторон которого отшлифована, тщательно обезжирена, протравлена и рассматривается с помощью лупы.
Микроанализ выявляет структуру металла или сплава по микрошлифам, приготовленным так же, как и для макроанализа, но дополнительно отполированным до зеркального блеска. Шлифы рассматриваются в отраженном свете под оптическим микроскопом. Из-за различной ориентации зерен металла они травятся в различной степени, и под микроскопом свет также отражается по-разному. Границы зерен, благодаря примесям, травятся сильнее, чем основной металл, и выявляются более рельефно. В сплаве структурные составляющие травятся также различно. В электронном микроскопе рассматривают реплику - слепок с особо тонкой структуры металла при больших увеличениях. Определяют размеры и форму зерен, структурные составляющие, неметаллические включения и их характер — трещины, пористость и т. д., качество термической обработки. Знание микроструктуры позволяет объяснить причины изменения свойств металла.
Рентгеновский анализ позволяет изучать атомную структуру металлов, типы и параметры кристаллических решеток, а также дефекты, лежащие в глубине. Этот анализ, основанный на дифракции рентгеновских лучей рядами атомов кристаллической решетки, позволяет, не разрушая металла, обнаружить дефекты: пористость, трещины, газовые пузыри, шлаковые включения. В местах дефектов рентгеновские лучи поглощаются в меньшей степени, чем в сплошном металле, и поэтому на фотопленке такие лучи образуют темные пятна, соответствующие форме дефекта. Гамма-лучи, проникающие в изделие на большую глубину, чем рентгеновские, применяют для исследования структуры металла и дефектов изделий.
Магнитный метод применяют для исследования дефектов в магнитных металлах (сталь, никель и др.) на глубине до 2 мм (трещины различного происхождения, неметаллические включения и т.д.). Для этого испытуемое изделие намагничивают, покрывают его поверхность порошком железа; осматривают его поверхность и размагничивают изделие. Вокруг дефекта образуется неоднородное поле, вследствие чего магнитный порошок повторяет очертания дефекта. Метод магнитной индукции используют для оценки полноты структурных превращений в сплавах (изделиях) после их термической обработки.
Ультразвуковой метод позволяет осуществлять эффективный контроль качества металла изделий и заготовок практически любых размеров. В импульсных ультразвуковых дефектоскопах ультразвуковая волна от щупа-излучателя распространяется в тестируемом изделии и при встрече с каким-либо дефектом отражается от него. Отраженные волны принимаются, усиливаются и передаются на показывающий индикатор. Ультразвук используют для контроля качества роторов, рельсов, поковок, проката и других изделий при необходимости сохранения целостности изделий.
2 Лекция. Строение и свойства материалов
Содержание лекции: элементы кристаллографии. Особенности кристаллического строения вещества. Основные типы и параметры кристаллических решеток металлов. Механизм процесса кристаллизации и перекристаллизации. Полиморфные превращения. Для самостоятельного изучения: Реальное строение металлических кристаллов и их дефекты.
2.1 Элементы кристаллографии и особенности кристаллического строения вещества.
В твердых телах атомы могут размещаться в пространстве двумя способами:
- беспорядочное расположение атомов, когда они не занимают определенного места друг относительно друга. Такие тела называются аморфными.
Аморфные вещества обладают формальными признаками твердых тел, т.е. они способны сохранять постоянный объем и форму. Однако они не имеют определенной температуры плавления или кристаллизации.
- Упорядоченное расположение атомов, когда атомы занимают в пространстве вполне определенные места, такие вещества называются кристаллическими.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком - периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
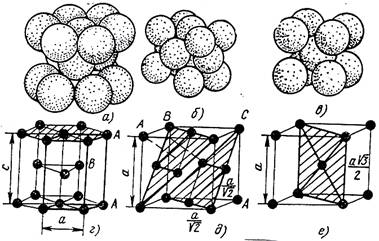
Кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело. На рисунке 2.1 приведена модель кристаллической решетки.
2.1.1 Основные типы и параметры кристаллических решеток металлов.
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа:
- примитивный - узлы решетки совпадают с вершинами элементарных ячеек;
- базоцентрированный - атомы занимают вершины ячеек и два места в противоположных гранях;
- объемно-центрированный - атомы занимают вершины ячеек и ее центр;

Элементарная ячейка
- гранецентрированный - атомы занимают вершины ячейки и центры всех шести граней.
Рисунок 2.1- Схема кристаллической решетки
Основными типами кристаллических решеток металлов являются:
Объемно - центрированная кубическая (ОЦК) (см. рисунок 2.2,в,е), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Fеα)
Гранецентрированная кубическая (ГЦК) (см. рисунок 2.2,б,д), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Ag, Au, Fеγ)
Гексагональная, в основании которой лежит шестиугольник:
- простая - атомы располагаются в вершинах ячейки и по центру двух оснований (углерод в виде графита);
- плотноупакованная (ГПУ) - имеется 3 дополнительных атома в средней плоскости (см. рисунок 2.2,а,г) (цинк).
|
|
Рисунок 2.2 - Основные типы кристаллических решеток металлов
Элементарная ячейка - элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл (см. рисунок 2.1).
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
- размеры ребер элементарной ячейки, а, b, с - периоды решетки - расстояния между центрами ближайших атомов. Период решетки - это расстояние между атомами по ребру элементарной ячейки, измеряется в нанометрах (1 нм = 10-9 м = 10 Ǻ).
Периоды кубических решеток характеризуются длиной ребра куба и обозначаются буквой а. Для характеристики гексагональной решетки принимают два параметра - сторону шестигранника а и высоту призмы с. Когда отношение с/а = 1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (см. рисунок 2.2,а,г),
- углы между осями обозначены как (α, β, χ) (см. рисунок 2.1).
-координационное число определяет число ближайших равноудаленных элементарных частиц. Например, в решетке объемно-центрированного куба
(ОЦК) для каждого атома число таких соседей будет равно восьми (К 8). Для простой кубической решетки координационное число будет 6 (К 6). Для
гранецентрированной кубической решетки (ГЦК) координационное число равно 12 (К 12).
- базис решетки - количество атомов, приходящихся на одну элементарную ячейку решетки.
- плотность упаковки атомов в кристаллической решетке - объем, занятый атомами, которые условно рассматриваются как жесткие шары. Величина плотности упаковки для объемно-центрированной кубической решетки равна 68%, для гранецентрированной кубической решетки равна 74%.
2.2 Кристаллографические направления и плоскости
Упорядоченность кристаллического строения в пространственной решетке позволяет выделить отдельные кристаллографические направления и плоскости. Кристаллографические направления - это характерные прямые линии, выходящие из точки отсчета, вдоль которых в кристаллической решетке располагаются атомы. Точками отсчета, могут служить вершины куба, а кристаллографическими направлениями - его ребра и диагонали, а также диагонали граней (см. рисунок 2.3 а).
Кристаллографическими плоскостями являются, например, плоскости граней кубов (см. рисунок 2.3 б), а также их различные диагональные плоскости вместе с находящимися на них атомами (см. рисунок 2.3 в,г).
Индексы направления ОХ и параллельных ему направлений обозначаются [100]. Соответственно направления OY и OZ обозначаются [010] и [001]. Кристаллографические направления вдоль диагоналей граней
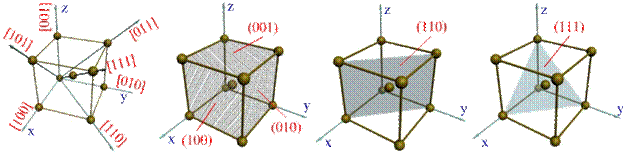
а) 6) в) г)
Рисунок 2.3 - Кристаллографические направления и плоскости в кристаллической решетке (основные направления и их обозначение)
XOZ, XOY и YOZ обозначают [101], [110] и [011]. Пользуясь указанной методикой, можно определить индекс любого направления. Например, индекс направления вдоль диагонали куба выразится как [111].
2.3 Кристаллизация металлов
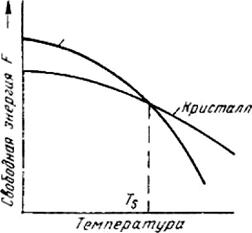
Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
|
|
Жидкость
Рисунок 2.4 - Изменение свободной энергии в зависимости от температуры
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рисунке 2.4.
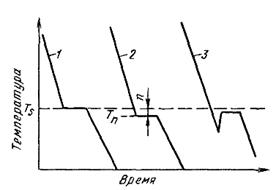
Рисунок 2.5 - Кривые охлаждения при кристаллизации
В соответствии с этой схемой выше температуры TS вещество должно находиться в жидком состоянии, а ниже TS - в твердом. При температуре равной TS жидкая и твердая фаза обладают одинаковой энергией FЖ = FKp, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура TS - равновесная или теоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры TS
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения n (степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации ( n = Tn - TS ).
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждения).
Кристаллизация - это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров. Теоретически процесс кристаллизации изображается кривой 1 (см. рисунок 2.5). Кривая 2 показывает реальный процесс кристаллизации. Жидкость непрерывно охлаждается до температуры переохлаждения Tn, лежащей ниже теоретической температуры кристаллизации TS. При охлаждении ниже температуры TS создаются энергетические условия, необходимые для протекания процесса кристаллизации.
У некоторых металлов из-за большого переохлаждения скрытая теплота плавления выделяется в первый момент кристаллизации настолько бурно, что температура скачкообразно повышается, приближается к теоретической (кривая 3, на рисунке 2.5). Так кристаллизуется, например, сурьма.
2.4.1 Механизм процесса кристаллизации.
Процесс образования кристаллов путем зарождения центров кристаллизации и их роста можно изучать с помощью рассмотрения моделей (схем). Подобная модель кристаллизации представлена на рисунке 2.8. К концу первой секунды образовалось пять зародышей, к концу второй секунды они выросли, и одновременно с этим возникло еще пять новых зародышей будущих кристаллов. Так, в результате возникновения зародышей и их роста происходит процесс кристаллизации, который, как видно в данном примере, заканчивается на седьмой секунде.
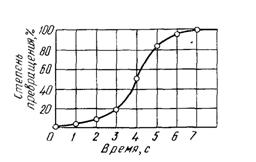
Качественная схема процесса кристаллизации, изображенная на рисунке 2.8, может быть представлена количественно кинетической кривой (см. рисунок 2.9). Рассмотрение подобных схем кристаллизации позволяет объяснить два важных момента.
По мере развития процесса кристаллизации в нем участвует все большее и большее число кристаллов. Поэтому процесс вначале ускоряется, пока в какой-то момент взаимное столкновение растущих кристаллов не начинает заметно препятствовать их росту; рост кристаллов замедляется, тем более, что и жидкости, в которой образуются новые кристаллы, становится все меньше.
В процессе кристаллизации, пока кристалл окружен жидкостью, он часто имеет правильную форму, но при столкновении и возрастании кристаллов их правильная форма нарушается, внешняя форма кристалла оказывается зависимой от условий соприкосновения растущих кристаллов. Вот почему кристаллы металла, зерна (кристаллиты) не имеют правильной формы.
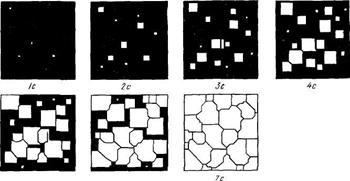
Рисунок 2.8 - Модель процесса кристаллизации
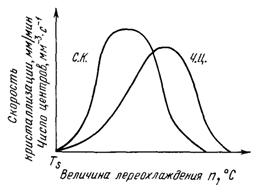
Скорость всего процесса кристаллизации количественно определяется двумя величинами: скоростью зарождения центров кристаллизации и скоростью роста кристаллов. Обе эти величины можно изменить для разных условий кристаллизации (см. рисунок 2.10).
Число зарождающихся в единицу времени кристаллов, которые обозначаются буквами ч. ц., имеет размерность 1/мм3 с-1 (число центров кристаллизации, возникших в 1 мм3 за одну секунду). Скорость роста кристаллов, обозначаемая через с. к., есть скорость увеличения линейных размеров кристалла, выраженная в миллиметрах в единицу времени. Размерность этой величины — мм/с; мм/мин.
 |
2.4 Превращения в твердом состоянии. Полиморфизм
Атомы данного элемента могут образовать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивым, а, следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии. Так, например, существует железо с решетками объемноцентрированного и гранецентрированного кубов; обнаружен кобальт с гранецентрированной и с гексагональной решетками. В различных решетках кристаллизуются также олово, марганец, титан и некоторые другие металлы.
Существование одного металла (вещества) в нескольких кристаллических формах носит название полиморфизма, или аллотропии. Различные кристаллические формы одного вещества называются полиморфными, или аллотропическими модификациями. Небольшие изменения давления, которые могут возникать в практике, обычно не приведут к полиморфным превращениям. Поэтому для практического металловедения важна главным образом температурная аллотропия.
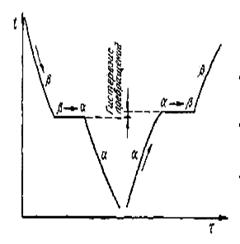
Аллотропические формы обозначаются греческими буквами α, β, γ, которые в виде индексов добавляют к символу, обозначающему элемент. Аллотропическая форма, существующая при самой низкой температуре, обозначается через α, следующая — через β и так далее. На рисунке 2.11 приведена термическая кривая (в координатах температура — время), где превращение отмечается горизонтальным участком.
 |
 |
||
Рисунок 2.11 - Кривая охлаждения и нагрева металла, имеющего аллотропические превращения
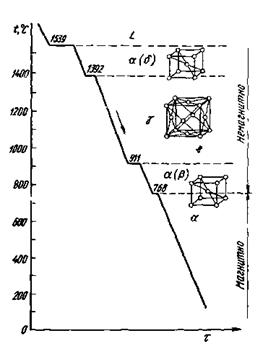
Рисунок 2.12 - Кривая охлаждения железа
Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом энергии. Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является модификация α, а в другом — модификация β. Температура, при которой осуществляется переход из одной модификации в другую, носит название температуры полиморфного (аллотропического) превращения. Так, железо имеет две температуры полиморфного превращения: 911 и 1392°С (см. рисунок 2.12).
3 Лекция. Конструкционные материалы и их механические свойства
Содержание лекции: классификация конструкционных материалов. Общие требования, предъявляемые к конструкционным материалам. Механические свойства металлов. Методы изучения свойств металлов. Конструкционная прочность материалов и способы ее оценки. Для самостоятельного изучения: Надежность материалов в работе, долговечность, износ, коррозия.
3.1 Общие требования, предъявляемые к конструкционным материалам
Конструкционными называют материалы, предназначенные для изготовления деталей машин, приборов, инженерных конструкций и энергооборудования, подвергающиеся механическим нагрузкам. Детали машин, приборов и оборудования характеризуются большим разнообразием форм, размеров, условий эксплуатации. Они работают при статических, циклических и ударных нагрузках, при низких и высоких температурах, в контакте с различными средами. Эти факторы определяют требования к конструкционным материалам, основные из которых эксплуатационные, технологические и экономические.
Эксплуатационные свойства это свойства, которые определяют работоспособность детали. Работоспособность в первую очередь оценивается механическими характеристиками, во-вторых, способностью сопротивляться воздействию агрессивных сред (жаростойкость, коррозионная стойкость), в-третьих, физические свойства (магнитные, радиационные).
Технологические свойства — пригодность материала для изготовления деталей машин, приборов. Оценивается способностью к обработке резанием, сварке, литью, выдерживать термическую обработку.
Экономические или стоимостные определяют экономичность использования в зависимости от цены материала.
3.2 Механические свойства металлов
Основными механическими свойствами являются прочность, упругость, вязкость, твердость. Зная механические свойства, можно обоснованно выбрать соответствующий материал, обеспечивающий надежность и долговечность конструкций при их минимальной массе.
Механические свойства определяют поведение материала при деформации и разрушении от действия внешних нагрузок.
В зависимости от условий нагружения механические свойства могут определяться при:
- статическом нагружении - нагрузка на образец возрастает медленно и плавно.
При статических нагружениях проводят испытания на растяжение и сжатие, твердость, изгиб и кручение, обычно их проводят на образцах стандартных размеров в лабораторных условиях;
- динамическом нагружении - нагрузка возрастает с большой скоростью, имеет ударный характер. Динамические испытания проводят для определения ударной вязкости;
- повторно-переменном или циклическим нагружении - нагрузка в процессе испытания многократно изменяется по величине или по величине и направлению. В испытаниях с переменной нагрузкой определяется предел выносливости материала;
- термические испытания - определение порога хладноломкости металлов при низких температурах и испытания на ползучесть при повышенных температурах.
Для получения сопоставимых результатов образцы и методика проведения механических испытаний регламентированы ГОСТами.
При статическом испытании на растяжение получают характеристики прочности и пластичности. Прочность - способность материала сопротивляться деформациям и разрушению. Испытания проводятся на специальных машинах, которые записывают диаграмму растяжения, выражающую зависимость удлинения образца Δℓ (мм) от действующей нагрузки Р (кгс ), т.е Δℓ = f(P).
Но для получения данных по механическим свойствам перестраивают: зависимость относительного удлинения Δℓ(мм) от напряжения σ (кгс/мм2) или в СИ выражается в МПа.
|
|
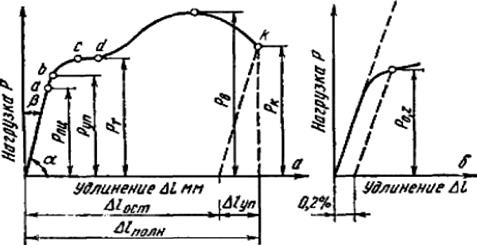
Рисунок 3.1 - Диаграммы растяжения
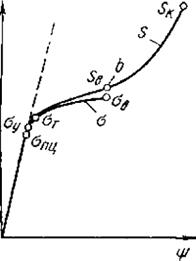
Процессы, которые происходят в материале образца при увеличении нагрузки, показаны на рисунке 3.1, показаны диаграммы растяжения: а – абсолютная; б - относительная; в - схема определения условного предела текучести.
Участок оа на диаграмме соответствует упругой деформации материала, когда соблюдается закон Гука. Напряжение, соответствующее упругой предельной деформации в точке а, называется пределом пропорциональности.
Предел
пропорциональности (![]() ) - максимальное напряжение, до которого сохраняется
линейная зависимость между деформацией и напряжением.
) - максимальное напряжение, до которого сохраняется
линейная зависимость между деформацией и напряжением.
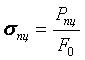 ,
(3.1)
,
(3.1)
где
![]() -нагрузка;
-нагрузка;
![]() - площадь поперечного сечения (мм2) образца.
- площадь поперечного сечения (мм2) образца.
При напряжениях выше предела пропорциональности происходит равномерная пластическая деформация (удлинение или сужение сечения).
Каждому напряжению соответствует остаточное удлинение, которое получаем проведением из соответствующей точки диаграммы растяжения линии параллельной оа.
Так как практически невозможно
установить точку перехода в неупругое состояние, то устанавливают условный
предел упругости, максимальное напряжение, до которого образец получает только упругую деформацию. Считают
напряжение, при котором остаточная
деформация очень мала(![]() ):
):
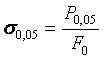 . (3.2)
. (3.2)
Предел текучести
характеризует
сопротивление материала небольшим пластическим деформациям.
В зависимости от
природы материала используют физический или условный предел текучести.
Физический предел
текучести (![]() ) - это напряжение, при котором происходит
увеличение деформации
при постоянной нагрузке (наличие горизонтальной площадки
на диаграмме
растяжения). Используется для очень пластичных материалов.
Но основная часть
металлов и сплавов не имеет площадки текучести.
) - это напряжение, при котором происходит
увеличение деформации
при постоянной нагрузке (наличие горизонтальной площадки
на диаграмме
растяжения). Используется для очень пластичных материалов.
Но основная часть
металлов и сплавов не имеет площадки текучести.
Условный предел текучести (![]() ) - это напряжение
вызывающее остаточную деформацию δ = 0,2 %.
) - это напряжение
вызывающее остаточную деформацию δ = 0,2 %.
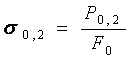 .
(3.3)
.
(3.3)
Физический или условный предел текучести являются важными расчетными характеристиками материала. Действующие в детали напряжения должны быть ниже предела текучести.
Равномерная по всему объему пластичная деформация продолжается до значения предела прочности. В точке в наиболее слабом месте, начинает образовываться шейка - сильное местное утомление образца.
Предел прочности (![]() ) -
напряжение, соответствующее
максимальной нагрузке,
которую выдерживает образец до разрушения (временное
сопротивление разрыву):
) -
напряжение, соответствующее
максимальной нагрузке,
которую выдерживает образец до разрушения (временное
сопротивление разрыву):
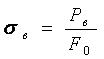 .
(3.4)
.
(3.4)
Образование шейки характерно для пластичных материалов, которые имеют диаграмму растяжения с максимумом. Предел прочности характеризует прочность как сопротивление значительной равномерной пластичной деформации. За точкой в, вследствие развития шейки, нагрузка падает и в точке К происходит разрушение.
Истинное сопротивление разрушению - это максимальное напряжение, которое выдерживает материал в момент, предшествующий разрушению образца (см. рисунок 3.2). Истинное сопротивление разрушению значительно больше предела прочности, так как оно определяется относительно конечной площади поперечного сечения образца
Sк = Pк / Fк . (3.5)
Напряжения, определенные по отношению приложенной нагрузки к начальной площади образца, называют условными напряжениями, а определенные по отношению к действительной площади – истинными напряжениями.
σ,S
 Fк
-
конечная площадь
поперечного сечения образца.
Истинные напряжения
S определяют как
отношение нагрузки к площади поперечного сечения в данный момент времени
S =
P/F.
Fк
-
конечная площадь
поперечного сечения образца.
Истинные напряжения
S определяют как
отношение нагрузки к площади поперечного сечения в данный момент времени
S =
P/F.
При испытании на растяжение определяются и характеристики пластичности .
Пластичность–способность материала к пластической деформации, то есть способность получать остаточное изменение формы и размеров без нарушения сплошности. Это свойство используют при обработке металлов давлением.
Рисунок 3.2 - Истинная диаграмма растяжения
Характеристиками пластичности материала являются:
-
относительное удлинение d =![]() % , (3.6)
% , (3.6)
где l0 и lк - начальная и конечная длина образца;
Δ lост - абсолютное удлинение образца, определяется измерением образца после разрыва;
- относительное сужение
y =
![]() % , (3.7)
% , (3.7)
где![]() - начальная площадь поперечного сечения;
- начальная площадь поперечного сечения;
![]() - площадь поперечного сечения в шейке после разрыва.
- площадь поперечного сечения в шейке после разрыва.
Относительное сужение более точно характеризует пластичность и служит технологической характеристикой. Пластичные материалы более надежны в работе, так как для них меньше вероятность опасного хрупкого разрушения.
3.2 Определение твердости металлов
Одним из важнейших механических свойств металлов является твердость. Твердость - это сопротивление материала проникновению в его поверхность стандартного тела (индентора), не деформирующегося при испытании. Широкое распространение данного метода объясняется тем, что для него не требуются специальные образцы.
Это неразрушающий метод контроля, основной метод оценки качества термической обработки изделия. О твердости судят либо по глубине проникновения индентора (метод Роквелла), либо по величине отпечатка от вдавливания (методы Бринелля, Виккерса, микротвердости).
Во всех случаях происходит пластическая деформация материала. Чем больше сопротивление материала пластической деформации, тем выше твердость. Наибольшее распространение получили методы Бринелля, Роквелла, Виккерса и микротвердости. Схемы испытаний представлены на рисунке 3.3 (а - по Бринеллю, б - по Роквеллу, в - по Виккерсу).

Рисунок 3.3 - Схемы определения твердости
Испытание на твердость по Бринеллю производится вдавливанием в образец стального шарика определенного диаметра под действием заданной нагрузки в течение определенного времени. Схема испытания на твердость по Бринеллю дана на рисунке 3.3,а. В результате вдавливания шарика на поверхности образца получается отпечаток (лунка). Отношение нагрузки Р к поверхности полученного отпечатка (шарового сегмента) дает число твердости по Бринеллю, обозначается HB.
Поверхность шарового сегмента определяется
F=πDn ,
где D – диаметр вдавливаемого шарика (мм);
n - глубина отпечатка, мм.
Величину n можно выразить через диаметр шарика D и отпечатка d, получим
n =
![]() мм.
(3.8)
мм.
(3.8)
Тогда число твердости по Бринеллю можно определить по формуле
НВ =
![]() кгс/мм2
.
(3.9)
кгс/мм2
.
(3.9)
Испытание проводят на твердомере Бринелля (типа ТШ). В качестве индентора используется стальной закаленный шарик диаметром D=2,5; 5; 10 мм, в зависимости от толщины изделия.
Метод Роквелла. Испытания на твердость по Роквеллу производятся вдавливанием в образец алмазного конуса с углом 120° или стального шарика диаметром 1,588 мм. Нагружение осуществляется в два этапа. Сначала прикладывается предварительная нагрузка Ро (10 кгс) для плотного соприкосновения наконечника с образцом. Затем прикладывается основная нагрузка Р1, в течение некоторого времени действует общая рабочая нагрузка Р. После снятия основной нагрузки определяют значение твердости по глубине остаточного вдавливания наконечника h под нагрузкой Ро (см. рисунок 3.3,б).
Величина твердости представляет собой глубину отпечатка, получаемую от вдавливания индентора при определенной нагрузке – 60, 100 или 150 кгс. Твердость по Роквеллу – число отвлеченное и выражается в условных единицах. Число твердости по Роквеллу обозначается НRА – при испытании алмазным конусом под нагрузкой 60 кгс (отсчет по шкале А); НRВ – при испытании стальных шариков под нагрузкой 100 кгс (отсчет по шкале В); НRС – при испытании алмазным конусом под нагрузкой 150 кгс (отсчет по шкале С).
Определение твердости на приборе Роквелла имеет ряд преимуществ по сравнению с определением твердости на приборах типа ТШ, т.к. испытания проводят быстро, величина твердости читается по шкале без каких-либо измерений и пересчетов, получающиеся отпечатки очень малы и не портят детали, диапазон измерений практически не ограничен.
В методе Виккерса твердость определяется по величине отпечатка (см. рисунок 3.3,в). В качестве индентора используется алмазная четырехгранная пирамида.с углом при вершине 136°. Твердость рассчитывается по формуле
![]() . (3.10)
. (3.10)
Нагрузка Р составляет 5...100 кгс. Диагональ отпечатка d измеряется при помощи микроскопа, установленного на приборе. Преимущество данного способа в том, что можно измерять твердость любых материалов, тонкие изделия, поверхностные слои, а также высокая точность и чувствительность метода.
Способ микротвердости предназначен для определения твердости отдельных структурных составляющих и фаз сплава, очень тонких поверхностных слоев (сотые доли миллиметра). Аналогичен способу Виккерса. Индентор - пирамида меньших размеров, нагрузки при вдавливании Р составляют 5.. .500 гс.
Стандартные методы испытаний для определения механических свойств металлов более подробно описаны в соответствующих ГОСТах.
4 Лекция. Основы теории сплавов
Содержание лекции: основные фазы в сплавах. Структурные составляющие сплавов. Правило фаз. Основные виды диаграмм состояния двухкомпонентных сплавов. Методы их построения. Определение состава и количества фаз по диаграмме состояния. Для самостоятельного изучения: Понятие о диаграммах состояния трехкомпонентных сплавов. Связь между свойствами сплавов и типом диаграммы состояния.
4.1 Основные понятия в теории сплавов
Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Возможны другие способы приготовления сплавов: спекания, электролиз, возгонка. Сплав, приготовленный преимущественно из металлических элементов и обладающий металлическими свойствами, называется металлическим сплавом. Сплавы обладают более разнообразным комплексом свойств, которые изменяются в зависимости от состава и метода обработки.
В металловедении системами являются металлы и металлические сплавы. Чистый металл является простой однокомпонентной системой, сплав - сложной системой, состоящей из двух и более компонентов.
Компоненты - вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур.
Фаза - однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются.
Вариантность (С) (число степеней свободы) - это число внутренних и внешних факторов (температура, давление, концентрация), которые можно изменять без изменения количества фаз в системе. Если вариантность С=1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз. Если вариантность С=0 (нонвариантная система), то внешние факторы изменять нельзя без изменения числа фаз в системе.
Существует математическая связь между числом компонентов (k), числом фаз (f) и вариантностью системы (С). Это правило фаз или закон Гиббса
С = k − f + 2.
Если принять (для металлов), что все превращения происходят при постоянном давлении, то число переменных уменьшится
С = k − f + 1,
где С - число степеней свободы;
k - число компонентов;
f - число фаз и «1» учитывает возможность изменения температуры.
4.2 Особенности строения, кристаллизации и свойств сплавов: механических смесей, твердых растворов, химических соединений
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии (см. рисунок 4.1,а) растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевании возможно различное взаимодействие компонентов. На рисунке 4.1 приведены строение и структура элементарных ячеек различных биметаллических сплавов с компонентами А и В:
1- атомы металла А; 2- атомы металла В;
3 - твердый раствор внедрения; 4-твердый раствор замещения.
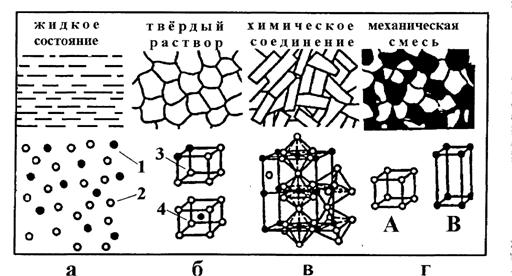 |
В зависимости от характера взаимодействия компонентов различают сплавы: механические смеси, химические соединения, твердые растворы.
Рисунок 4.1 - Строение и структура сплавов с компонентами А и В
Сплавы механические смеси образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Образуются между элементами, значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше, чем между разнородными. Сплав состоит из кристаллов входящих в него компонентов (см. рисунок 4.1,г). В сплавах сохраняются кристаллические решетки компонентов.
Сплавы химические соединения (см. рисунок 4.1,в) образуются между элементами, значительно различающимися по строению и свойствам, и сила взаимодействия между разнородными атомами больше, чем между однородными. Особенности этих сплавов:
1) постоянство состава, то есть сплав образуется при определенном соотношении компонентов, химическое соединение обозначается АпВт;
2) образуется специфическая, отличающаяся от решеток элементов, составляющих химическое соединение, кристаллическая решетка с правильным упорядоченным расположением атомов (см. рисунок 4.2,в);
3) ярко выраженные индивидуальные свойства;
4) постоянство температуры кристаллизации, как у чистых компонентов.
Сплавы твердые растворы - это твердые фазы, в которых соотношения между компонентами могут изменяться. Характерной особенностью твердых растворов является наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя. Твердый раствор состоит из однородных зерен.
4.3 Классификация сплавов твердых растворов
По степеням растворимости компонентов различают твердые растворы:
- с неограниченной растворимостью компонентов;
- с ограниченной растворимостью компонентов.
При неограниченной растворимости компонентов кристаллическая решетка компонента растворителя по мере увеличения концентрации растворенного компонента плавно переходит в кристаллическую решетку растворенного компонента.
Для образования растворов с неограниченной растворимостью необходимы:
1) изоморфность (однотипность) кристаллических решеток компонентов;
2) близость атомных радиусов компонентов, которые не должны отличаться более чем на 8.- 15 %;
3) близость физико-химических свойств подобных по строение валентных оболочек атомов.
При ограниченной растворимости компонентов возможна концентрация растворенного вещества до определенного предела. При дальнейшем увеличении концентрации однородный твердый раствор распадается с образованием двухфазной смеси. По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы: замещения, внедрения, вычитания.
В растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента (см. рисунок 4.2,б). Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
Твердые растворы внедрения образуются внедрением атомов растворенного компонента в поры кристаллической решетки растворителя (см. рисунок 4.2,в). Образование таких растворов, возможно, если атомы растворенного элемента имеют малые размеры.
Твердые растворы вычитания или растворы с дефектной решеткой образуются на базе химических соединений, при этом возможна не только замена одних атомов в узлах кристаллической решетки другими, но и образование пустых, не занятых атомами, узлов в решетке (см. рисунок 4.2, г).
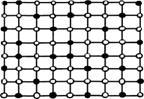
Рисунок 4.2 б-Структура твердого раствора замещения компонента В в кристаллической решетке компонента А

Рисунок 4.2 в- Структура твердого раствора внедрения компонента В в кристаллической решетке компонента А

Рисунок 4.2г- Структура твердого раствора вычитания в кристаллической решетке компонента А

Рисунок 4.2 а -Кристалли ческая структура чистого компонента А
4.4 Диаграмма состояния
Кристаллизация сплавов подчиняется тем же закономерностям, что и кристаллизация чистых металлов. Необходимым условием является стремление системы в состояние с минимумом свободной энергии.
Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. Для построения диаграмм состояния двойных сплавов применяют координатные оси, изображенные на рисунке 4.3.
Ось абсцисс представляет собой ось концентраций и изображается в виде отрезка, длину которого принимают за 100%. Концы этого отрезка соответствуют чистым компонентам, т.е. 100% А и 100% В, если сплавы составляют компоненты А и В. Любая точка, помещенная на отрезке, делит его на части, количественно определяющие химический состав сплава. Обычно на ось концентраций наносят количество одного из компонентов, так как количество другого легко определяется по разности от 100%. Ось ординат представляет собой ось температур.
Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа. В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки.
Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации - точками солидус.
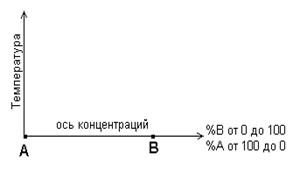
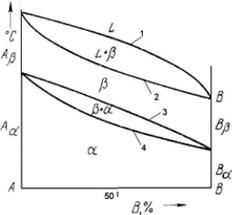
Рисунок 4.3 Рисунок 4.4
На рисунке 4.4 приведена диаграммы состояния, где шкала концентраций показывает содержание компонента В, основными линиями являются линии ликвидус (1) и солидус (2), а также линии, соответствующие фазовым превращениям в твердом состоянии (3, 4).
По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно свойства сплава, виды обработки, которые можно применять для сплава.
5 Лекция (продолжение темы 4).
Диаграммы состояния двухкомпонентных сплавов
Вид диаграммы состояния определяется характером взаимодействий, которые возникает между компонентами в твердом и жидком состояниях. Предполагается, что в жидком состоянии существует неограниченная растворимость, т.е. однородная фаза (обозначается L) существует при любом соотношении компонентов. Рассмотрим следующие виды диаграмм состояния:
- диаграмма состояния сплавов с отсутствием растворимости компонентов в твердом состоянии (механические смеси);
- диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью);
- диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии;
- диаграмма состояния сплавов, компоненты которых образуют химические соединения.
5.1 Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода)
Исходные условия: оба компонента в жидком состоянии неограниченно растворимы, а в твердом состоянии нерастворимы и не образуют химических соединений. Компоненты: вещества А и В (k =2). Фазы: жидкость L, кристаллы А и кристаллы В (максимальное-количество фаз в системе f = 3).
Общий вид диаграммы состояния показан на рисунке 5.1.
Линия АСВ является линией ликвидус (начало
кристаллизации), линия DCE - линией 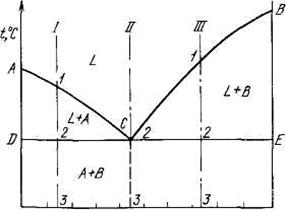 солидус (конец кристаллизации). На линии АС начинают (при охлаждении)
выделяться кристаллы А, а на линии СВ - кристаллы В. На линии DCE из жидкости
концентрации С одновременно выделяются кристаллы А и В. Если взять какой-нибудь
сплав, например, сплав I, то кривая охлаждения для него будет иметь вид,
солидус (конец кристаллизации). На линии АС начинают (при охлаждении)
выделяться кристаллы А, а на линии СВ - кристаллы В. На линии DCE из жидкости
концентрации С одновременно выделяются кристаллы А и В. Если взять какой-нибудь
сплав, например, сплав I, то кривая охлаждения для него будет иметь вид,
|
0 20 40 60 80 100 В.% |
показанный на рисунке 5.2,а.
Рисунок 5.1 - Диаграмма состояния для сплавов I − III
На этой кривой участок 0—1 соответствует охлаждению жидкого сплава, участок 1—2 — выделению кристаллов А,
участок 2—2' — совместному выделению кристаллов А и В и
участок 2'—3 — охлаждению твердого тела.
На рисунке 5.2 схематически показано строение сплава в разные моменты кристаллизации. Из жидкости (см. рисунок 5.2,а) выделяются кристаллы А, затем оставшаяся жидкость кристаллизуется с одновременным выделением кристаллов А и В (механическая смесь кристаллов А+В). Правый крайний рисунок показывает структуру уже закристаллизовавшегося металла, в котором находятся кристаллы А и механическая смесь кристаллов А+В. Механическая смесь двух (или более) видов кристаллов, одновременно кристаллизовавшихся из жидкости, называется эвтектикой, эвтектика (А+В).
Кривая охлаждения сплава эвтектической концентрации показана на рисунке 5.2,б.
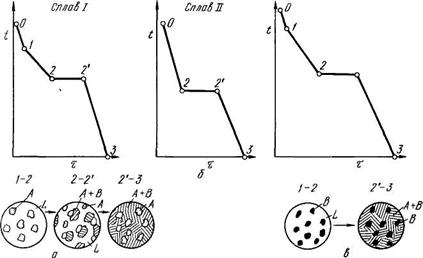
Рисунок 5.2 - Кривые охлаждения доэвтектического (I), эвтектического (II) и заэвтектического (III) сплавов
На кривой охлаждения отрезок 0—2 соответствует охлаждению жидкого сплава, отрезок 2—2'- кристаллизации эвтектики, 2'—3 – охлаждению закристаллизовавшегося сплава.
На диаграмме состояния (см. рисунок 5.1) показаны области существования различных фаз. Ниже эвтектической горизонтали DCE находятся две фазы — кристаллы А и В. Левее эвтектической концентрации из жидкости выделяются вначале кристаллы А, а затем эвтектика. Поэтому структурное состояние доэвтектического сплава можно обозначить через
А + эвтектика (А+В) и заэвтектического – В + эвтектика (А+В), хотя и в том и в другом случае в сплаве две фазы. А и В.
5.2 Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии (II рода)
Исходные условия: оба компонента неограниченно растворимы в жидком и твердом состояниях и не образуют химических соединений.
Компоненты: А, В. Фазы: L, α.
Если два компонента неограниченно растворяются в жидком и твердом состояниях, то возможно существование только двух фаз - жидкого раствора L и твердого раствора α. Следовательно, трех фаз быть не может, кристаллизация при постоянной температуре не наблюдается, и горизонтальной линии на диаграмме нет. Диаграмма, изображенная на рисунке 5.3а, состоит из трех областей: жидкость, жидкость + твердый раствор α и твердый раствор α. Линия АmВ является линией ликвидус, линия АnВ - линией солидус. Процесс кристаллизации изображается кривой охлаждения сплава (см. рисунок 5.3,б).
Точка 1 соответствует началу кристаллизации, точка 2-концу. Между точками 1 и 2 (т. е. между линиями ликвидус и солидус) сплав находится в двухфазном состоянии. При двух компонентах и двух фазах система моновариантна (с = k –f + 1 = 2 — 2+ 1 = 1), т. е. если изменяется температура, то изменяется и концентрация компонентов в фазах; каждой температуре соответствуют строго определенные составы фаз.
Пользуясь диаграммой состояния, можно для любого сплава при любой температуре определить не только число фаз, но и их состав и количественное соотношение. Для этого используется правило отрезков. Состав жидкой фазы изменяется по линии ликвидуса, а состав твердой фазы - по линии солидуса. Концентрация и количество фаз у сплава, лежащего между линиями солидус и ликвидус, определяются правилом отрезков.
Cплав К в точке а состоит из жидкой и твердой фаз. Состав жидкой фазы определится проекцией точки b, лежащей на линии ликвидус. Состав твердой фазы определится проекцией точки с, лежащей на линии солидус.
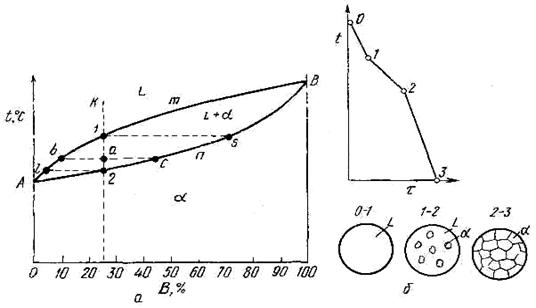
Рисунок 5.3 - Диаграмма состояния с неограниченной растворимостью в твердом состоянии (а) и кривая охлаждения (б)
Количество всего сплава (Qbc) определяется отрезком bс.
Отрезок, прилегающий к линии ликвидус аb, определяет количество твердой фазы.
Отрезок, прилегающий к линии солидус (или к оси компонента) ас, определяет количество жидкой фазы.
Количество жидкой и твердой фаз определяется из следующих соотношений:
количество
твердой фазы ![]() ,
,
количество
жидкой фазы ![]() .
.
Во всем интервале кристаллизации (от точки 1 до точки 2) из жидкого сплава, имеющего исходную концентрацию К, выделяются кристаллы, более богатые компонентом В. Состав первых кристаллов определится проекцией s.
Закончиться кристаллизация сплава К должна в точке 2, когда последняя капля жидкости, имеющая состав ℓ, затвердеет. Отрезок, показывающий количество твердой фазы, равнялся нулю в точке 1, когда только началась кристаллизация, и количеству всего сплава в точке 2, когда кристаллизация закончилась. Состав жидкости изменяется по кривой 1 - ℓ, а состав кристаллов — по кривой s - 2, и в момент окончания кристаллизации состав кристаллов такой же, как и состав исходной жидкости.
5.3 Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (Ш рода)
Исходные условия: оба компонента неограниченно растворимы в жидком состоянии, ограниченно в твердом и не образуют химических соединений.
Компоненты: А, В. Фазы: L, α, β.
В сплавах такого рода возможно существование: жидкой фазы, твердого раствора компонента В в А, который называтся α -раствором,
и твердого раствора компонента А в В, который обозначен через β. В этих сплавах возможно нонвариантное равновесие при одновременном сосуществовании трех фаз: L, α, β. В зависимости от того, какая реакция протекает в условиях существования трех фаз, могут быть два вида диаграмм: диаграмма с эвтектикой и диаграмма с перитектикой.
5.3.1 Диаграмма с эвтектикой.
 В этой системе не
образуются фазы, представляющие собой чистые компоненты. жидкости
могут выделяться
только твердые растворы α или β. Следовательно, около вертикалей А и В (см. рисунок 5.4), соответствующих чистым компонентам, находятся области существования твердых растворов α
или β.
Предельная растворимость компонента В в А
определяется линией DF, а предельная
В этой системе не
образуются фазы, представляющие собой чистые компоненты. жидкости
могут выделяться
только твердые растворы α или β. Следовательно, около вертикалей А и В (см. рисунок 5.4), соответствующих чистым компонентам, находятся области существования твердых растворов α
или β.
Предельная растворимость компонента В в А
определяется линией DF, а предельная
растворимость А в В — линией CG.
0 20 40 60 80 100В%
Рисунок 5.4 - Диаграмма состояния с эвтектикой
Сплавы, находящиеся между этими двумя линиями, находятся за пределами растворимости и являются двухфазными, состоящими из α + β. Окончание кристаллизации происходит по эвтектической реакции
L → α + β.
Линия АЕВ является на этой диаграмме линией ликвидус, линия ADCB – линией солидус. Зная правило фаз и правило отрезков, можно проследить за процессом кристаллизации любого сплава.
Кристаллизация сплава I. Выше точки 1 сплав находится в жидком состоянии. В точке 1 начинается процесс кристаллизации. Выделяются кристаллы твердого раствора α, концентрация которого изменяется по кривой а-2, а состав жидкости изменяется по кривой 1-b.
В точке 2 кристаллизация закончится, и полученные кристаллы твердого раствора должны иметь (для равновесной кристаллизации) концентрацию исходной жидкости. Эти кристаллы не изменяются до точки 3, лежащей на линии предельной растворимости.
Ниже этой точки твердый раствор α является пересыщенным и выделяет избыточные кристаллы. Такими кристаллами являются кристаллы β-твердого раствора, что определяют, применяя правило отрезков для сплава, лежащего внутри двухфазной области α + β (т. е. для сплава ниже линии DF).
Состав твердого раствора α изменяется по кривой 3-F, вследствие выделения кристаллов β концентрации G. Количество кристаллов β при охлаждении увеличивается. Количество кристаллов β, выделившихся из сплава I, характеризуется отрезком от вертикали I до линии 3-F. Кривые охлаждения и схемы структур этого сплава при различных температурах показаны на рисунке 5.5 (а- сплава, образующего при кристаллизации твердый раствор с последующим выделением вторичной фазы; б- доэвтектического сплава).
Сплав I Сплав II
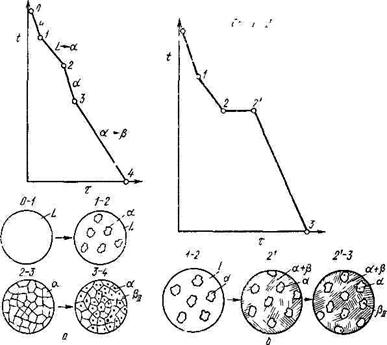
Рисунок 5.5 - Кривые охлаждения и схемы структур
Кристаллы, выделившиеся из твердого раствора,
называются вторичными кристаллами и часто обозначаются символом β![]() в
отличие от первичных (β
в
отличие от первичных (β![]() )
)
β-кристаллов, выделяющихся из жидкости. Процесс выделения вторичных кристаллов из твердой фазы носит название вторичной кристаллизации в отличие от процесса первичной кристаллизации, когда кристаллы (первичные) образуются в жидкой фазе.
Сплав, концентрация которого лежит левее точки F, не будет иметь вторичных выделений β -кристаллов. Так как линия CG в отличие от линии FD изображена на рисунке 5.4 вертикальной, т. е. растворимость компонента А в В не зависит от температуры, то вторичных выделений α -кристаллов нет, но они были бы, если бы линия CG была наклонена вправо, т. е. растворимость уменьшалась бы с понижением температуры. Точка D для твердого раствора α показывает максимальную растворимость компонента В в компоненте А при наиболее благоприятных условиях.
Кристаллизация сплава II. При кристаллизации этого сплава, в отличие от предыдущего, при достижении горизонтальной линии DEC наступает нонвариантная реакция. В равновесии находятся три фазы: жидкость состава Е, α-кристаллы состава точки D и |β-кристаллы состава точки С.
По достижении температуры, соответствующей горизонтали DEC, наступает эвтектическая реакция – из жидкости выделяются кристаллы обоих твердых растворов:
L → α + β.
Реакция эта нонвариантна, так как при двух компонентах в реакции участвуют три фазы (с = к – f + 1 = 2 – 3+1 = 0).
Все три фазы, участвующие в реакции, имеют определенные составы (проекции точек Е, D и С) и температура их превращения постоянна.
В результате кристаллизации сплава II, кроме первичных (выделившихся при охлаждении от точки 1 до точки 2) кристаллов α, образуется еще эвтектика (α + β).
При дальнейшем охлаждении вследствие изменения
растворимости α-кристаллы выделяют вторичные кристаллы β![]() и
при нормальной температуре α-кристаллы (как первичные, так и входящие в
эвтектику) будут иметь состав, отвечающий точке F. Кривая охлаждения сплава II
и структуры этого сплава показаны на рисунке 5.5, б.
и
при нормальной температуре α-кристаллы (как первичные, так и входящие в
эвтектику) будут иметь состав, отвечающий точке F. Кривая охлаждения сплава II
и структуры этого сплава показаны на рисунке 5.5, б.
Несмотря на многообразие структурных составляющих, окончательно охлажденный сплав содержит только две фазы α и β, независимо от того, в какой структурной форме они находятся.
5.3.2 Диаграмма с перитектикой.
При эвтектическом превращении жидкость кристаллизуется с образованием двух твердых фаз. Возможен и другой тип нонвариантного превращения (трехфазного равновесия), когда жидкость реагирует с выпавшими ранее кристаллами и образует новый вид кристаллов
L + β → α.
Реакция подобного типа называется перитектической.
Диаграмма с перитектическим превращением показана на рисунке 5.6. На диаграмме показаны три однофазные области: жидкость L и ограниченные твердые растворы α и β.
Линия ACВ является линией ликвидус, линия APDB – линией солидус.
Кристаллизация сплава I. Кристаллизация начинается в точке 1 (см. рисунок 5.6), когда из жидкости выпадают кристаллы β-раствора состава точки b.
Затем по мере снижения температуры жидкость меняет свою концентрацию по линии ликвидус от точки 1 до точки С, а кристаллы β – по линии солидус от точки b до точки D.
По достижении перитектической горизонтали CPD состав жидкости будет отвечать точке С, а состав кристаллов — точке D.
Эти обе фазы реагируют и дают третью фазу α, концентрация которой определяется точкой Р — третьей точкой на горизонтали.
Точки D и Р показывают предельную концентрацию твердых растворов β и α. Количественное соотношение фаз при перитектической реакции,
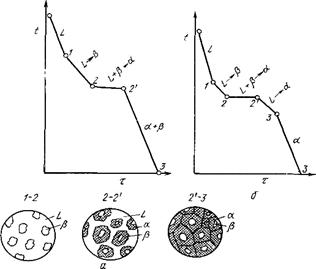
Рисунок 5.6 - Диаграмма состояния с перитектикой
 |
Рисунок 5.7 - Кривые охлаждения сплавов после окончания перитектической реакции, в которых в избытке остаются твердый раствор (а), жидкая фаза (б)
необходимое для образования α -фазы, определяется по правилу отрезков соотношением
количество β / количество L = СР/РD.
В рассматриваемом сплаве количество участвующих в перитектической реакции кристаллов β и жидкости определяется соотношением
количество β / количество L = С2/2D,
т.е. в данном сплаве имеется избыток β-фазы по сравнению с тем количеством, которое необходимо для образования α-кристаллов. Поэтому по окончании реакции в избытке остаются β-кристаллы. Следовательно, в структуре будут продукты перитектической реакции (т. е. α-кристаллы) и оставшиеся избыточные первичные β-кристаллы. Чем ближе точка 2 лежит к точке Р, тем меньше в реакции остается избыточных β-кристаллов.
На рисунке 5.7а показана кривая охлаждения сплава I; отдельные моменты кристаллизации показаны на схемах структур. Для перитектической кристаллизации (средняя схема) характерно то, что новая α -фаза появляется на границе реагирующей друг с другом жидкости и β-кристаллов. Для сплава I перитектической реакцией заканчивается процесс кристаллизации..
Кристаллизация сплава II (см. рисунок 5.7,б). Отличие кристаллизации этого сплава от кристаллизации сплава I состоит в том, что при перитектической температуре имеется избыток жидкой фазы по сравнению с тем количеством, которое необходимо для образования α-кристаллов концентрации Р. Поэтому перитектическое превращение заканчивается исчерпанием β-твердого раствора, и оставшаяся жидкость в интервале между точками 2'–3 кристаллизуется в α-фазу. При этом концентрация жидкости изменяется по кривой С–а, а концентрация образующихся α -кристаллов – по Р– 3 (см. рисунок 5.6).
5.4 Диаграмма состояния для сплавов, образующих химические соединения (IV рода)
Химическое соединение характеризуется определенным соотношением компонентов. Если компоненты А и В образуют химическое соединение АпВт, то, следовательно, на n+m его атомов приходится n атомов А и m атомов В. Определенному атомному соотношению соответствует и определенное соотношение по массе.
Химическое соединение устойчиво, если его можно нагреть без разложения до расплавления, и неустойчиво, если при нагреве оно разлагается. В зависимости от этого могут быть два вида диаграмм. Кроме того, возможно образование нескольких химических соединений между двумя компонентами, а также растворимость на базе химического соединения (это находит отражение в диаграмме состояния).
5.4.1 Диаграмма с устойчивым химическим соединением.
Исходные условия: оба компонента образуют одно устойчивое соединение АпВт, причем и это соединение, и чистые компоненты не образуют в твердом состоянии растворов.
Компонентами системы являются вещества А и В, твердыми фазами — А, АпВт и В. Из четырех возможных в этой системе фаз могут сосуществовать три: L, А, АпВт или L, В, АпВт.
Это химическое соединение устойчиво, поэтому оно может быть нагрето без разложения до своей температуры плавления (точка С). Химическое соединение плавится при постоянной температуре. Химическое соединение можно рассматривать как однокомпонентную систему (один компонент — химическое соединение ), тогда при плавлении
с = k–f+ 1=1–2+1 = 0.
На рисунке 5.8-а показана диаграмма состояния с устойчивым химическим соединением АпВт. Точка С соответствует температуре плавления этого химического соединения. На диаграмме имеются две эвтектические точки Е1 и Е2. Эвтектика Е1 представляет собой смесь кристаллов компонента А и химического соединения, а эвтектика Е2 — кристаллов В и химического соединения. Соответствующими реакциями образования эвтектических смесей являются:
![]() ,
,
![]() .
.
На линиях Е1C и СЕ2 выделяются первичные кристаллы химического соединения. Следовательно, заэвтектические сплавы в отношении эвтектики Е1 и доэвтектические сплавы в отношении эвтектики Е2 в твердом состоянии состоят из первичных кристаллов АпВт и эвтектики Е1 или Е2.
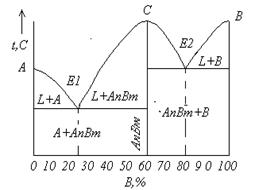
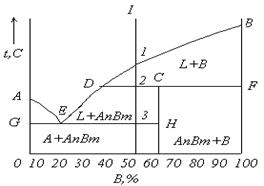
Рисунок 5.8 - Диаграмма состояния с устойчивым (а) и неустойчивым (б) химическим соединением
Кристаллизация сплавов по этой диаграмме происходит аналогично кристаллизации сплавов, образующих механическую смесь кристаллов чистых компонентов. Таким образом, диаграмма с химическим соединением представляет собой как бы приставленные одна к другой две простые диаграммы. Можно раз делить такую диаграмму на две части по вертикали, соответствующей химическому соединению, и изучать каждую часть диаграммы отдельно.
5.4.2 Диаграмма с неустойчивым химическим соединением.
В отличие от диаграммы с устойчивым химическим соединением на рисунке 5.8-б приведена диаграмма состояний, где два компонента образуют неустойчивое химическое соединение, которое при нагреве до определенной температуры (t) разлагается на жидкость и один из компонентов, т.е. не расплавляется полностью.
На линии DCF находятся в равновесии три фазы: жидкость концентрации D, кристаллы компонента В и кристаллы химического соединения АпВт.
При нагреве неустойчивое химическое соединение АпВт разлагается на жидкость концентрации D и кристаллы В. При охлаждении, следовательно, произойдет обратная реакция:
![]() .
.
Реакция эта подобна перитектической: жидкость реагирует с выпавшими ранее кристаллами, но образует не новый твердый раствор, как в случае перитектической реакции, а химическое соединение.
Процесс кристаллизации сплава I в равновесных условиях будет протекать следующим образом. В точке 1 начинается кристаллизация, выпадают кристаллы В, и концентрация жидкости изменяется по кривой 1– D.
В точке 2 при постоянной температуре образуется неустойчивое химическое соединение. По окончании реакции в избытке остается жидкость, которая кристаллизуется с выделением соединения АпВт до тех пор, пока концентрация жидкости не достигнет точки Е. Оставшаяся жидкость кристаллизуется в эвтектику, состоящую из кристаллов А и химического соединения. Следовательно, на кривой будем иметь две площадки. верхнюю, соответствующую образованию неустойчивого химического соединения, и нижнюю, соответствующую образованию эвтектики (А + АпВт ).
6 Лекция. Железо и его сплавы
Содержание лекции: диаграмма состояния железоуглеродистых сплавов. Основные фазы в сплавах на основе железа. Углеродистые стали и влияние примесей на свойства сталей. Технологические свойства сталей. Основы легирования стали. Классификация и маркировка сталей. Для самостоятельного изучения: Чугуны. Процессы графитизации. Структура и свойства чугуна. Влияние примесей. Серые, высокопрочные и ковкие чугуны.
6.1 Диаграмма состояния железоуглеродистых сплавов
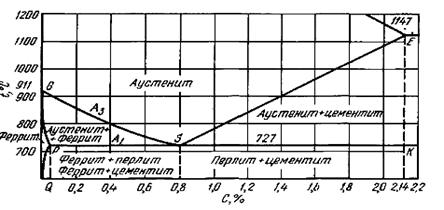
Железоуглеродистые сплавы - стали и чугуны - важнейшие металлические сплавы современной техники. Производство чугуна и стали по объему превосходит производство всех других металлов вместе взятых более чем в десять раз. Диаграмма состояния железо - углерод дает основное представление о строении железоуглеродистых сплавов - сталей и чугунов.
Диаграмма железо - углерод должна распространяться от железа до углерода. Железо образует с углеродом химическое соединение: цементит - Fе3С. Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму - по частям. Так как на практике применяют металлические сплавы с содержанием углерода до 5%, то рассматриваем часть диаграммы состояния от железа до химического соединения цементита, содержащего 6,67% углерода. Диаграмма состояния железо - цементит представлена на рисунке 6.1. Компонентами железоуглеродистых сплавов являются железо, углерод и цементит.
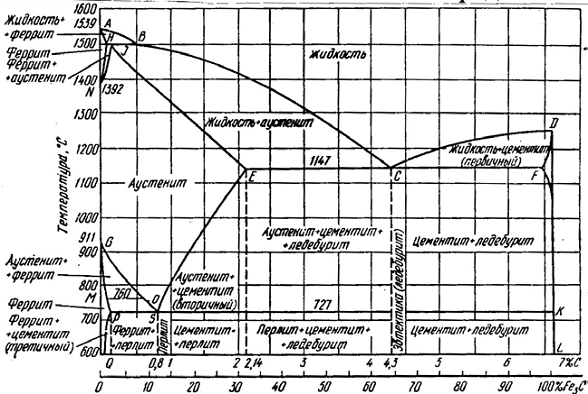
Рисунок 6.1- Диаграмма состояния железо - цементит
6.1.1 Основные фазы в сплавах на основе железа.
В системе железо - углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит.
1 Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
2 Феррит (Ф) Fea (С) - твердый раствор внедрения углерода в α -железо. Феррит имеет переменную предельную растворимость углерода: минимальную -0,006 % при комнатной температуре (точка Q), максимальную - 0,02 % при температуре 727° С (точка Р). Углерод располагается в дефектах решетки.
При температуре выше 1392°С существует высокотемпературный феррит (δ)- (Feδ (С), с предельной растворимостью углерода 0,1 % при температуре 1499°С (точка J). Свойства феррита близки к свойствам железа. Он мягок (твердость =130 НВ, предел прочности σ = 300 МПа) и пластичен (относительное удлинение δ = 30%), магнитен до 768° С.
3 Аустенит (A) Feγ (С) - твердый раствор внедрения углерода в γ-железе. Углерод занимает место в центре гранецентрированной кубической ячейки. Аустенит имеет переменную предельную растворимость углерода: минимальную - 0,8 % при температуре 727°С (точка S), максимальную - 2,14 % при температуре 1147°С (точка Е). Аустенит имеет твердость 200...250 НВ, пластичен (относительное удлинение- δ=40...50%), парамагнитен. При растворении в аустените других элементов могут изменяться свойства и температурные границы существования.
4 Цементит (Fe3C) - химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода. Температура плавления цементита примерно 1250°С. При низких температурах цементит слабо ферромагнитен, теряет магнитные свойства при температуре около 217°С. Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность. Такие свойства являются следствием сложного строения кристаллической решетки.
Цементит - соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов.
В железоуглеродистых сплавах присутствуют фазы: цементит первичный (ЦI) , цементит вторичный (ЦII), цементит третичный (ЦIII). Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении - вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен.
6.1.2 Структура железоуглеродистых сплавов.
Линия ABCD - ликвидус системы. На участке АВ начинается кристаллизация феррита (δ), на участке ВС начинается кристаллизация аустенита, на участке CD - кристаллизация цементита первичного.
Линия AHJECF - линия солидус. На участке АН заканчивается кристаллизация феррита (δ). На линии HJB при постоянной температуре 1499°С идет перитектическое превращение, заключающееся в том, что жидкая фаза реагирует с образовавшимися ранее кристаллами феррита (δ), в результате чего образуется аустенит:
L + Ф(δ)→ A.
На участке JE заканчивается кристаллизация аустенита. На участке ECF при постоянной температуре 1147°С идет эвтектическое превращение, заключающееся в том, что жидкость, содержащая 4,3 % углерода, превращается в эвтектическую смесь аустенита и цементита первичного:
L → эвт (A + ЦI ).
Эвтектика системы железо - цементит называется ледебуритом (Л)
Л = эвт (A + ЦI ),
содержит 4,3 % углерода. При температуре ниже 727°С в состав ледебурита входят цементит первичный и перлит.
По линии HN начинается превращение феррита (δ) в аустенит, обусловленное полиморфным превращением железа. По линии NJ превращение феррита (δ) в аустенит заканчивается. По линии GS превращение - аустенита в феррит, обусловленное полиморфным превращением железа. По линии PG превращение аустенита в феррит заканчивается.
По линии ES начинается выделение цементита вторичного из аустенита, обусловленное снижением растворимости углерода в аустените при понижении температуры. По линии МО при постоянной температуре 768°С имеют место магнитные превращения.
По линии PSK при постоянной температуре 727°С идет эвтектоидное превращение, заключающееся в том, что аустенит, содержащий 0,8 % углерода, превращается в эвтектоидную смесь феррита и цементита вторичного:
А → эвт (Ф + ЦII ).
По механизму данное превращение похоже на эвтектическое, но протекает в твердом состоянии. Эвтектоид системы железо - цементит называется перлитом
П = эвтектоид(Ф + ЦII ),
содержит 0,8 % углерода. Название получил за то, что на полированном и протравленном шлифе наблюдается перламутровый блеск.
Перлит может существовать в зернистой и пластинчатой форме, в зависимости от условий образования.
По линии PQ начинается выделение цементита третичного из феррита, обусловленное снижением растворимости углерода в феррите при понижении температуры.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо - цементит, т.е. критические точки, имеют условные обозначения. Обозначаются буквой А (от французского arret - остановка):
А1 - линия PSK (727°С) - превращение П ↔ А;
А2 - линия МО (768°С, т. Кюри) - магнитные превращения;
A3 - линия GOS ( переменная температура, зависящая от содержания углерода в сплаве) - превращение Ф ↔ А;
А4 - линия NJ (переменная температура, зависящая от содержания углерода в сплаве) – превращение Ф(δ)→ A.
Все сплавы системы железо - цементит по структурному признаку делят на две большие группы: стали и чугуны.
6.2. Углеродистые стали и влияние примесей на свойства сталей
6.2.1 Структура сталей.
Углеродистыми сталями называют сплавы железа с углеродом, содержащие 0,02...2,14% углерода, заканчивающие кристаллизацию образованием аустенита. Они обладают высокой пластичностью, особенно в аустенитном состоянии. Структура сталей формируется в результате перекристаллизации аустенита. Микроструктуры сталей представлены на рисунке 6.2.

а) б) в) г)
Рисунок 6.2 - Микроструктуры сталей
По содержанию углерода и по структуре стали подразделяются на доэвтектоидные (0,02% <С < 0.8%), структура феррит + перлит (Ф+П) (см. рисунок 6.2 а);
эвтектоидные (С = 0,8%), структура перлит (П), перлит может быть пластинчатый или зернистый (см. рисунок 6.2,б и 6.2,в);
заэвтектоидные(0.8% <С <2,14%), структура перлит + цементит вторичный
(П + ЦII ), цементитная сетка располагается вокруг зерен перлита (см. рисунок 6.2,г).
По микроструктуре сплавов можно приблизительно определить количество углерода в составе сплава, учитывая следующее: количество углерода в перлите составляет 0,8 %, в цементите - 6,67 %. Ввиду малой растворимости углерода в феррите, принимается, что в нем углерода нет.
Сплавы железа с углеродом, содержащие углерода более 2,14 % (до 6,67 %), заканчивающие кристаллизацию образованием эвтектики (ледебурита), называют чугунами.
Стали являются наиболее распространенными материалами. Обладают хорошими технологическими свойствами. Изделия получают в результате обработки давлением и резанием. Достоинством является возможность, получать нужный комплекс свойств, изменяя состав и вид обработки. Стали, подразделяют на углеродистые и легированные.
6.2.2 Основы легирования стали.
Свойства углеродистых сталей определяются количеством углерода и содержанием примесей, которые взаимодействуют с железом и углеродом. Влияние углерода на свойства сталей показано на рисунке 6.3. С ростом содержания углерода в структуре стали увеличивается количество цементита, при одновременном снижении доли феррита. Изменение соотношения между составляющими приводит к уменьшению пластичности, а также к повышению прочности и твердости. Прочность повышается до содержания углерода около 1%, а затем она уменьшается, так как образуется грубая сетка цементита вторичного. Углерод оказывает влияние и на технологические свойства. Повышение содержания углерода ухудшает литейные свойства стали (используются стали с содержанием углерода до 0,4 %), обрабатываемость давлением и резанием, свариваемость.
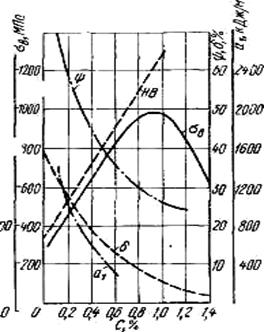
Рисунок 6.3 – Влияние углерода на свойства сталей
Следует учитывать, что стали с низким содержанием углерода также плохо обрабатываются резанием.
В сталях всегда присутствуют примеси, которые делятся на четыре группы.
Постоянные примеси: кремний, марганец, сера, фосфор.
Марганец и кремний вводятся в процессе выплавки стали для раскисления, они являются технологическими примесями. Содержание марганца не превышает 0,5...0,8 %. Марганец повышает прочность, не снижая пластичности, и резко снижает красноломкость стали, вызванную влиянием серы превышает 0,35...0,4 %. Кремний, дегазируя металл, повышает плотность слитка.Кремний растворяется в феррите и повышает прочность стали, особенно повышается предел текучести, но наблюдается некоторое снижение пластичности, что снижает способность стали к вытяжке.
Содержание фосфора в стали 0,025...0,045 %. Фосфор, растворяясь в феррите, искажает кристаллическую решетку и увеличивает предел прочности и предел текучести, но снижает пластичность и вязкость. Повышение содержания фосфора на каждую 0,01 % повышает порог хладоломкости на 20...25°С.
Содержание серы в сталях составляет 0,025...0,06 %. Сера - вредная примесь, попадает в сталь из чугуна. При взаимодействии с железом образует химическое соединение - сульфид серы FeS, которое образует с железом легкоплавкую эвтектику с температурой плавления 988°С. При нагреве эвтектика плавится, нарушаются связи между зернами. При деформации в местах расположения эвтектики возникают надрывы и трещины, заготовка разрушается - явление красноломкости. Красноломкость - повышение хрупкости при высоких температурах. Сера снижает механические свойства, особенно ударную вязкость и пластичность, а также предел выносливости. Она ухудшает свариваемость и коррозионную стойкость.
Скрытые примеси - газы (азот, кислород, водород) - попадают в сталь при выплавке. Азот и кислород находятся в стали в виде хрупких неметаллических включений: окислов (FeO, SiO2, A12O3) нитридов (Fe2N), в виде твердого раствора или в свободном состоянии, располагаясь в дефектах (раковинах, трещинах). Примеси внедрения (азот N, кислород О) повышают порог хладоломкости и снижают сопротивление хрупкому разрушению. Неметаллические включения (окислы, нитриды), являясь концентраторами напряжений, могут значительно понизить предел выносливости и вязкость.
Специальные примеси - специально вводятся в сталь для получения заданных свойств. Примеси называются легирующими элементами, а стали - легированные сталями.
Примеси первых двух групп – неизбежное следствие технологического процесса производства стали, и в указанных концентрациях их нельзя рассматривать как легирующие элементы, а стали, содержащие эти примеси в больших количествах, следует относить к легированным сталям.
6.3 Классификация сталей
Стали классифицируются:
1) по способу получения: конверторная, бессемеровская, мартеновская, электросталь;
2) по химическому составу: углеродистые; легированные;
3) по назначению: конструкционные; инструментальные; специального назначения с особыми свойствами;
4) по степени раскисления: спокойная; полуспокойная; кипящая;
5) по типу структуры: 1) для отожженного состояния (доэвтектоидные; эвтектоидные; заэвтектоидные; ледебуритные; аустенитные; ферритные);
2) для нормализованного состояния (перлитные; мартенситные; аустенитные; ферритные);
по качеству: обыкновенного качества ( < 0.06 % S и < 0.07 % Р); качественные (< 0.04 % S и < 0.035 % Р); высококачественные (< 0.025 % S и <0.025 % Р); особовысококачественные (< 0.015 % S и < 0.02 % Р);
по типу структуры: аустенитные (при введении добавок 1 класса: Ni, Mn, Со); ферритные (при введении добавок 2 класса: Сг, Mo, V, W, Si).
Сталь в соответствии с ГОСТом должна отвечать определенным требованиям и маркируется. В соответствии с ГОСТами предусматривается поставка стали трех групп:
группа А — с гарантируемыми механическими свойствами (сталь не подвергается горячей обработке);
группа Б — с гарантируемым химическим составом (сталь подвергается горячей обработке);
группа В — с гарантируемыми механическими свойствами и химическим составом (для сварных конструкций).
Сталь группы А маркируется буквами Ст и номером 0, 1, 2, 3 и т. д. Чем больше номер, тем выше прочность, но ниже пластичность. Если после марочного обозначения стоит «кп» – значит, сталь кипящая; если стоит «пс» –сталь полуспокойная и если «сп», то сталь спокойная.
Сталь группы Б маркируется М, К, Б, что показывает способ производства (мартеновский, конверторный, бессемеровский). Состав этих сталей общего назначения приводится в справочниках по металлам.
Сталь группы В (изготовляется мартеновским или конвертерным способом) маркируется буквой В и цифрой. Сталь ВСт1 имеет механические свойства, как Ст1, а химический состав — как сталь МСт1кп.
Более подробные сведения можно получить при знакомстве с ГОСТами и другими стандартами на отдельные виды металлургической продукции.
6.4 Классификация чугунов
Чугун отличается от стали: по составу - более высокое содержание углерода и примесей; по технологическим свойствам - более высокие литейные свойства, малая способность к пластической деформации, почти не используется в сварных конструкциях.
В зависимости от состояния углерода в чугуне различают:
1) белый чугун - углерод в связанном состоянии в виде цементита, в изломе имеет белый цвет и металлический блеск;
2) серый чугун - весь углерод или большая часть находится в свободном состоянии в виде пластинчатого графита (см. рисунок 6.4,а,г), а в связанном состоянии находится не более 0,8 % углерода. Из-за большого количества графита его излом имеет серый цвет. Пластинчатая форма графита ухудшает свойства чугуна, поэтому разработаны методы плавки или последующей обработки, при которой изменяется форма графита и улучшаются свойства.
3) высокопрочный чугун, в котором углерод в значительной степени или полностью находится в свободном состоянии в форме шаровидного графита (см. рисунок 6.4,б);
4) ковкий чугун, получающийся в результате отжига отливок из белого чугуна В ковком чугуне весь углерод, или значительная чacть его находится в свободном состоянии в форме хлопьевидного графита (см. рисунок 6.4,в).
Таким образом, чугун (кроме белого) отличается от стали наличием в структуре графитных включений (см. рисунок 6.4), а между собой чугуны различаются формой этих включений: а-пластинчатая, б-шаровидная, в-хлопьевидная, г- вермикулярная (в виде червеобразных прожилок).
Механические свойства чугуна обусловлены его структурой. Механические свойства будут зависеть от количества, размера и характера распределения включений графита. Чем меньше графитных включений, чем они мельче, и чем больше степень изолированности их одно от другого, тем выше прочность чугуна. Чугун с большим количеством прямолинейных крупных графитных выделений, разделяющих его металлическую основу, имеет грубозернистый излом и низкие механические свойства.
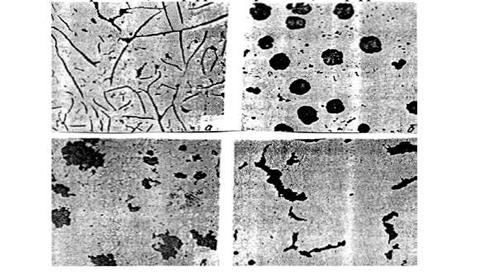
Рисунок 6.4 - Формы графитных включений в чугунах
Пластинки графита уменьшают временное сопротивление разрыву и особенно сильно пластичность чугуна. Относительное удлинение при растяжении серого чугуна независимо от свойств металлической основы практически равно нулю (~0,5 %).
Графитные включения мало влияют на снижение временного сопротивления при сжатии и на твердость, значения которых определяются структурой металлической основы чугуна. Чугун рекомендуется использовать преимущественно для изделий, работающих на сжатие. Пластинки графита менее значительно, чем при растяжении, снижают прочность и при изгибе. Твердости чугуна составляет НВ 143—255.
7 Лекция. Термическая обработка металлов
Содержание лекции: классификация видов термической обработки металлов. Отжиг, закалка, отпуск стали. Основные превращения при термической обработке стали. Получение заданных свойств материалов с помощью различных видов обработки: термической, термомеханической, химико-термической. Для самостоятельного изучения: Поверхностное упрочнение стали. Цементация, азотирование стали. Упрочнение методом пластической деформации (наклепом).
7.1 Виды термической обработки металлов
Цель любого процесса термической обработки состоит в том, чтобы нагревом до определенной температуры и последующим охлаждением вызвать желаемое изменение строения металла.
Основные факторы воздействия при термической обработке — температура и время, поэтому режим любой термической обработки можно представить графиком в координатах t°С (температура) и τ (время) (см. рисунок 7.1). Режим термической обработки характеризуют следующие основные параметры:
температура нагрева tmax, т. е. максимальная температура, до которой был нагрет сплав при термической обработке;
время выдержки сплава при температуре нагрева τв;
скорость нагрева vнагр и скорость охлаждения vохл.
Свойства сплава зависят от его структуры. Основным способом, позволяющим изменять структуру, а, следовательно, и свойства, является термическая обработка.
tmax, екристаллической решетки
Рисунок 7.1 - График (режим) простой (а) и сложной (б) термической обработки металлов и сплавов.
Термическая обработка представляет собой совокупность операций нагрева, выдержки и охлаждения, выполняемых в определенной последовательности при определенных режимах, с целью изменения внутреннего строения сплава и получения нужных свойств.
Различают следующие виды термической обработки:
1) Отжиг 1 рода возможен для любых металлов и сплавов. Его проведение не обусловлено фазовыми превращениями в твердом состоянии. Нагрев, при отжиге первого рода, повышая подвижность атомов, частично или полностью устраняет химическую неоднородность, уменьшает внутренние напряжения. Основное значение имеет температура нагрева и время выдержки. Характерным является медленное охлаждение
Разновидностями отжига первого рода являются:
- диффузионный;
- рекристаллизационный;
- отжиг для снятия напряжения после ковки, сварки, литья.
2) Отжиг II рода - отжиг металлов и сплавов, испытывающих фазовые превращения в твердом состоянии при нагреве и охлаждении. Проводится для сплавов, в которых имеются полиморфные или эвтектоидные превращения, а также переменная растворимость компонентов в твердом состоянии.
Проводят отжиг второго рода с целью получения равновесной структуры и подготовки ее к дальнейшей обработке. В результате отжига измельчается зерно, повышаются пластичность и вязкость, снижаются прочность и твердость, улучшается обрабатываемость резанием.
Характеризуется нагревом до температур выше критических и очень медленным охлаждением, как правило, вместе с печью.
3) Закалка проводится для сплавов, испытывающих фазовые превращения в твердом состоянии при нагреве и охлаждении, с целью повышение твердости и прочности путем образования неравновесных структур (сорбит, троостит, мартенсит).
Характеризуется нагревом до температур выше критических и высокими скоростями охлаждения.
4) Отпуск проводится с целью снятия внутренних напряжений, снижения твер дости и увеличения пластичности и вязкости закаленных сталей.
Характеризуется нагревом до температуры ниже критической. Скорость охлаждения роли не играет. Происходят превращения, уменьшающие степень неравновесности структуры закаленной стали.
Термическую обработку подразделяют на предварительную и окончательную.
Предварительная - применяется для подготовки структуры и свойств материала для последующих технологических операций (для обработки давлением, улучшения обрабатываемости резанием). Окончательная - формирует свойство готового изделия.
Кроме этих основных видов термической обработки, имеются еще два принципиально отличных способа, представляющих сочетание термической обработки с металлургией или механической технологией.
К основным видам термической обработки (отжиг, закалка, отпуск) должны быть добавлены две сложные обработки:
химико-термическая обработка - нагрев сплава в соответствующих химических реагентах для изменения состава и структуры поверхностных слоев;
деформационно-термическая обработка — деформация и последующая термическая обработка.
Способность металлов растворять различные элементы позволяет при повышенных температурах атомам вещества, окружающего поверхность металла, диффундировать внутрь его, создавая поверхностный слой измененного состава. При этой обработке изменяется не только состав, но и структура поверхностных слоев, а иногда сердцевины. Такая обработка называется химико-термической обработкой (ХТО). Диффузионная подвижность неметаллов (С, N, О, Н, В) существенно отличается от подвижности металлов, поэтому химико-термическую обработку подразделяют на диффузионное насыщение неметаллами и металлами.
Обработка, в которой в едином технологическом процессе сочетаются деформация и структурные превращения, получила название деформационно-термическая. В данном случае имеем объединение механической технологии и термической обработки.
Деформационно-термическую обработку разделяют на термомеханическую обработку ТМО (деформация осуществляется до структурного превращения) и механико-термическую обработку МТО (деформация осуществляется после структурного превращения).
7.2 Основные превращения при термической обработке стали
|
|
Основой для изучения термической обработки стали является диаграмма железо – углерод, точнее ее «стальная» часть. Рассматриваются только сплавы с концентрацией до 2 % С и, соответственно, область на диаграмме железо—углерод с концентрацией углерода до 2,14 % С.
Рисунок 7.2 - «Стальной» участок диаграммы Fe - С
Критические точки обозначаются буквой А. Нижняя критическая точка, обозначаемая А1, лежит на линии PSK и соответствует превращению (А ↔ П) аустенит ↔ перлит. Верхняя критическая точка А3 лежит на линии GSE и соответствует началу выпадения или концу растворения феррита в доэвтектоидных сталях или цементита (вторичного) в заэвтектоидных сталях.
Рассматривая структурные превращения в стали, отметим, что основными являются три структуры, а переход их из одной в другую характеризуют основные превращения. Эти структуры:
1) аустенит (А) — твердый раствор углерода в γ-железе Feγ(С);
2) мартенсит (М) — пересыщенный твердый раствор углерода в α-железе Feα(С);
3) перлит (П) — эвтектоидная смесь из одновременно образующихся феррита и карбида Feα + Fe3 С.
Любая разновидность термической обработки состоит из комбинации четырех основных превращений, в основе которых лежат стремления системы к минимуму свободной энергии. На рисунке 7.3 показана зависимость свободной энергии структурных составляющих сталей от температуры: аустенита (FA), мартенсита (FM ), перлита (FП)
I. Превращение перлита в аустенит (П → А) происходит при нагреве выше критической температуры А1; минимальной свободной энергией обладает аустенит Feα + Fe3C → Feγ(С) или П → А.
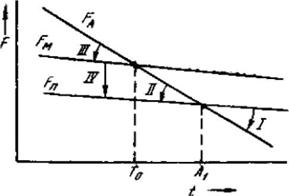
Рисунок 7.3 - Зависимость свободной энергии структурных составляющих сталей от температуры
II. Превращение аустенита в перлит (А → П), происходит при охлаждении ниже А1; минимальной свободной энергией обладает перлит
Feγ(С) → Feα + Fe3C или А → П.
III. Превращение аустенита в мартенсит (А → М), происходит при быстром охлаждении ниже температуры нестабильного равновесия (Т0). При Т0 более устойчивой фазой является перлит, однако работа, необходимая для образования мартенсита из аустенита, меньше, чем для образования перлита, поэтому ниже Т0 образование перлита из аустенита может произойти только в результате превращений аустенита в мартенсит, а затем уже мартенсита в перлит. Таким образом, аустенито-мартенситное превращение является промежуточным в процессе перехода аустенита в перлит
Feγ(С) → Feα(С) или А → М.
IV. Превращение мартенсита в перлит (М → П), происходит при любых температурах, так как свободная энергия мартенсита больше, чем свободная энергия перлита
Feα(С) → Feγ+ Fe3C или М → П.
8 Лекция. Конструкционные материалы из цветных металлов
Содержание лекции: медь и его сплавы. Алюминий его сплавы. Титан, магний и их сплавы. Для самостоятельного изучения: Магний и его сплавы Технология получения технического титана и магния.
8.1 Медь и его сплавы
Медь — металл красновато-розового цвета, имеющий ГЦК-решетку с периодом а = 0,3608 нм, без полиморфных превращений. Медь менее тугоплавка, чем железо (Tпл = 1083 °С), но имеет большую плотность (ρ = 8,9 г/см3). Медь очень технологична: легко прокатывается в тонкие листы и ленты, из нее вытягивают тонкую проволоку, хорошо сваривается и паяется, хорошо полируется. Примеси оказывают сильное влияние на свойства меди. Примеси О2, Н, Bi, Pb ухудшают свариваемость. У меди высокие теплопроводность и электропроводность, у нее хорошая антикоррозионная стойкость (см. рисунок 8.1).
Растворимые в меди элементы Al, Fe, Ni и другие повышают твердость и прочность и используются для легирования сплавов меди. Нерастворимые элементы Pb, Bi образуют легкоплавкие эвтектики по границам зерна и вызывают явления красноломкости, как у сталей. Холодная пластическая деформация упрочняет медь, но снижает электропроводность меди. К недостаткам меди относятся высокая плотность, большая усадка при литье, горячеломкость, сложность обработки резанием и высокая стоимость.

0 1 2 3
Легирующий элемент, % Рисунок 8.2 - Диаграмма состояния Рисунок 8.1 - Влияние легирующих медь–цинк (латунь)
элементов на твердость меди
В промышленности применяется медь техническая и чистая. В зависимости от количества примесей медь имеет следующие обозначения: МОО (99,99 % Си), МО (99,95 % Си), M1 (99,9 Си), М2 (99,7 % Си), МЗ (99,5 % Си). В обозначения безкислородной меди, применяющейся в электротехнике, добавляют букву б (МООб, МОб).
8.1.1 Сплавы меди с цинком (латуни).
Практическое применение имеют медные сплавы с цинком до 45 %, которые называются латунями. Диаграмма состояния представлена на рисунке 8.2. Медь с цинком образуют твердый раствор α с предельной концентрацией 39 % цинка. При большей концентрации образуется электронное соединение Cu—Zn — β-фаза с кристаллической решеткой ОЦК. При 454…468 °С наступает упорядочение β'-фазы. Эти изменения в структуре повышают твердость и хрупкость фазы β'. Если она появляется в сплаве, то изменяются свойства сплава.
Сплавы с большим содержанием цинка отличаются высокой хрупкостью.
Латуни подразделяются на:
- однофазные со структурой α-твердого раствора;
- двухфазные со структурой α + β-фаз.
Однофазные латуни хорошо деформируются в холодном состоянии, что значительно повышает твердость. Маркируют латуни буквой «Л», за которой следует цифра, указывающая содержание цинка. Например, латунь марки Л68 содержит 68 % меди и 32 % цинка. В сложных латунях указывают легирующие элементы: С - свинец, Мn - марганец, Ж – железо.
8.1.2 Бронзы.
Сплав меди с другими элементами кроме цинка, называются бронзой. В состав некоторых марок бронз может входить цинк, но не в качестве основного легирующего элемента.
Обозначают бронзы буквами Бр. Для деформируемых бронз за буквами Бр следуют буквы, указывающие название легирующих элементов, а в конце — цифры, указывающие содержание этих элементов в процентах. Легирующие элементы в бронзах обозначают теми же буквами, что и в латунях. Фосфор обозначается буквой Ф, цинк — Ц, хром — X, бериллий — Б, цирконий — Цр. Например, деформируемая бронза БрОФб,5-0,4 содержит 6,5 % олова, 0,4 % фосфора и 93,1 % меди.
Названия бронз образуются от названий легирующих элементов, входящих в их состав. Наиболее распространенными являются оловянные, алюминиевые, кремнистые и бериллиевые бронзы. Кроме того, бронзы подразделяют на оловянные и безоловянные.
Легирующие элементы в оловянных бронзах улучшают литейные свойства (цинк, фосфор, никель), повышают твердость- и прочность (фосфор, никель), коррозионную стойкость (никель).
8.2 Алюминий его сплавы
Алюминий – металл серебристо-белого цвета. Он не имеет полиморфных превращений, имеет решетку ГЦК с периодом а = 0,4041 нм. Плотность алюминия ρ = 2,7 г/см3, он обладает высокой пластичностью, коррозионной стойкостью.
В зависимости от содержания примесей (Fe, Si, Cu, Zn, Ti) алюминий подразделяют на три класса:
- особо чистый А999 (≤ 0,001 % примесей),
- высокой чистоты А995, А99, А95 (0,005…0,05 % примесей),
- технической чистоты А85, А8 (до 0,1 % примесей).
Алюминий обладает низкими твердостью, прочностью и поэтому его используют только для изготовления малонагруженных конструкций (рам, дверей, трубопроводов), и бытовой продукции. Благодаря высоким тепло- и электропроводным свойствам алюминий широко используют для изготовления теплообменников, холодильников, а в электротехнике — проводов, кабелей, конденсаторов, шин и другой продукции.
Вследствие низкой прочности технический алюминий ограниченно применяется как конструкционный материал. Однако сплавы алюминия имеют боле высокую прочность и широко используются для изготовления нагруженных деталей и конструкций.
8.2.1 Алюминиевые сплавы.
Алюминиевые сплавы подразделяют на деформируемые, литейные и порошковые.
Алюминиевые деформируемые сплавы разделяют на две группы:
- сплавы систем А1-Мп и Al-Mg, не упрочняемые термической обработкой;
- сплавы систем Al-Mg-Si, Al-Cu-Mg, упрочняемые термической обработкой.
Структура сплавов первой группы представляет собой твердый раствор марганца или магния в алюминии. Поскольку содержание этих элементов в сплавах меньше предела их растворимости в твердом растворе при комнатной температуре, то оно остается неизменным при нагреве и охлаждении. Поэтому такие сплавы не упрочняются термической обработкой. Упрочнять их можно пластической деформацией (наклепом) при обработке давлением.
Сплавы этой группы предназначены для изготовления сварных бензобаков, трубопроводов для масла и бензина, заклепок и другой продукции.
Сплавы второй группы упрочняются закалкой и искусственным старением. Упрочняющая термическая обработка сплавов на основе алюминия и меди основана на изменении растворимости соединения CuAl2 в алюминии (см. рисунок 8.3). Видно, что предельная растворимость меди в алюминии при эвтектической температуре равна 5,7 %, а при комнатной температуре – 0,2 %.

 Рисунок 8.4 - Микроструктура
алюминий
- медных сплавов
Рисунок 8.4 - Микроструктура
алюминий
- медных сплавов
Рисунок 8.3 - Диаграмма состояния
алюминий–медь
При быстром охлаждении (закалке) фиксируется состояние пересыщенного твердого раствора. Это неустойчивое состояние приводит к изменениям в структуре за счет выделения вторичной фазы CuAl2. Этот процесс, происходящий при комнатной температуре, называется естественным старением, при повышенных температурах – искусственным старением. Таким образом, весь процесс термической обработки заключается в закалке и старении. Структурные изменения можно увидеть на рисунке 8.4, а - после закалки; б - после старения.
Алюминиевые литейные сплавы. Основные требования, предъявляемые к этим сплавам заключаются в сочетании хороших литейных свойств (высокой жидкотекучести, небольшой усадки, малыми склонностью к образованию горячих трещин и пористостью) с оптимальными прочностью, пластичностью и коррозионной стойкостью. В большей мере таким требованиям отвечают эвтектоидные сплавы на основе систем Al-Si, Al-Cu, Al-Mg.
Сплавы систем Al-Si (АЛ2) и Al-Si-Mg (АЛ4, АЛ9) называются силуминами. Сплавы АЛ2 (Si = 10—13 %) отличаются от других сплавов высокими литейными свойствами и коррозионной стойкостью, но при этом имеют низкую пластичность из-за образования в структуре сплава грубой игольчатой эвтектики с включениями кристаллов кремния.
Алюминиевые спеченные сплавы называют порошковыми или гранулированными. Они обладают повышенными механическими свойствами как при комнатной, так и при повышенных температурах.
Спеченный алюминиевый порошок (САП) получают холодным, а затем горячим прессованием под давлением 700 МПа при температуре 500—600 °С предварительно окисленной алюминиевой пудры. Частички алюминиевой пудры размерами до 1 мкм, покрыты тонким слоем оксида алюминия. Чем меньше частички, тем больше в САП оксида алюминия и тем выше прочность сплава. В зависимости от размера частичек содержание А1203 в САП составлять 6—22 %. В связи с этим сплавы САП разделяют порядковыми номерами: САП-1 (6—9 % А1203), САП-2 (9—13 % А1203 ), САП-3 (13—18 % А1203), САП-4 (18—22 % А1203). Временное сопротивление самого высокопрочного сплава САП-4 составляет σв = 450 МПа при температуре 20 °С и 130 МПа при температуре 500 °С.
8.3 Титан и его сплавы
Титан - металл светло-серого цвета — в зависимости от температуры имеет две аллотропические модификации. Низкотемпературная модификация с ГПУ решеткой (α-титан), существует до температуры 882 °С, а выше этой температуры - высокотемпературная модификация с ОЦК решеткой (β-титан). Плотность титана составляет 4,5 г/см3, температура плавления — 1665 °С.
Важными свойствами титана являются высокая удельная прочность в сочетании с высокой пластичностью и хорошая коррозионная стойкость. Однако титан плохо обрабатывается резанием и имеет низкие антифрикционные свойства.
Постоянными примесями титана являются Fe, Si, С, О, N, Н и др. Технический титан маркируется буквами и цифрами: ВТ1- 00 (95,53 % Ti), ВТ1- 0 (99,48 % Ti), ВТ1-1 (99,44 % Ti). Чем меньше нулей в обозначении титана, тем больше содержится в нем примесей, которые оказывают сильное влияние на механические и другие свойства. Небольшое содержание кислорода, азота и углерода повышает твердость и прочность титана, но при этом снижает пластичность, коррозионную стойкость и ухудшает свариваемость и обрабатываемость давлением.
Технический титан ВТ1-1 с суммарным содержанием
примесей 0,6-0,7 % имеет следующие механические свойства: σ0.2 = 380![]() 500 МПа, σв = 450-600 МПа, δ = 20-25 %, ψ = 48-50 %, НВ
200-210. При меньшем суммарном содержании примесей твердость и прочность
титана снижаются, а пластичность повышается.
500 МПа, σв = 450-600 МПа, δ = 20-25 %, ψ = 48-50 %, НВ
200-210. При меньшем суммарном содержании примесей твердость и прочность
титана снижаются, а пластичность повышается.
8.3.1 Титановые сплавы.
В отличие от технического титана титановые сплавы обладают более высокими прочностью при комнатной температуре, жаропрочностью, жаростойкостью, коррозионной стойкостью, хладостойкостью, что предопределило широкое применение титановых сплавов в промышленности. Например, из сплавов титана изготовляют диски и лопатки турбин и компрессоров авиационных двигателей, гребные винты морских судов, баллоны для сжиженных газов, а также емкости для агрессивных химических сред.
Все элементы, которые с титаном образуют твердые растворы, подразделяются на две группы: А – элементы неограниченно растворимые в титане; Б – ограниченно растворимые (см. рисунок 8.5). Кроме того, элементы, которые повышают температуру полиморфного перехода в I группе, понижают эту температуру во II группе (см. рисунок 8.5).
Структура титановых сплавов представляет собой твердые растворы легирующих элементов в α- и β-модификациях титана. Легирующие элементы подразделяются в зависимости от их влияния на температуру полиморфного превращения титана на две группы (см. рисунок 8.5):
- элементы, расширяющие область существования α-фазы и повышающие температуру превращения (Al, Ga, Ge, La, С, О, N);
- элементы, сужающие α-область и повышающие температуру полиморфного превращения (V, Nb, Та, W, Mo, Cr, Mn, Fe, Со, Si, Ag и др.).
Поскольку легирующие элементы влияют на стабилизацию аллотропической модификации титана, то сплавы титана в зависимости от их стабильной структуры подразделяют на три группы: α-сплавы, (α+β)-сплавы (двухфазные) и β -сплавы.
Титановые сплавы также классифицируют, например по технологии производства (деформируемые, литейные, порошковые) или по механическим свойствам (обычной прочности, высокопрочные, жаропрочные и др.)
Рисунок 8.5 - Диаграммы состояния титановых сплавов
В деформируемых титановых сплавах с α-структурой основным легирующим элементом, влияющим на свойства, является алюминий. При содержании алюминия примерно 5 % существенно повышаются прочность, жаропрочность, жаростойкость и снижается плотность сплава. Деформируемые титановые сплавы упрочняются легированием и пластической деформацией и не упрочняются термической обработкой.
Изделия из титановых сплавов с α- и (α+β)-структурой могут длительное время работать при температурах 500°С (ВТ20) и 550-600°С (ВТ18). Жаропрочность титановых сплавов повышается при легировании Zr, Al, Mo, Si. Деформируемые титановые сплавы с β-структурой не нашли широкого промышленного применения, несмотря на высокую прочность при комнатной температуре. Недостатками этих сплавов являются плохая свариваемость, высокая стоимость из-за необходимости легирования дорогостоящими элементами (V, Mo, Nb, Та).
Литейные титановые сплавы. Эти сплавы имеют хорошие литейные свойства (высокие жидкотекучесть и плотность отливок, малые усадку и склонность к образованию горячих трещин). Однако из-за активного взаимодействия титана с газами и формовочными материалами необходимо производить их плавку и разливку в вакууме или в среде нейтральных газов. По сравнению с деформируемыми сплавами литейные сплавы имеют низкую стоимость, меньшие прочность, пластичность и выносливость
Порошковые титановые сплавы. Современные технологии порошковой металлургии позволяют получать титановые сплавы примерно с теми же механическими и эксплуатационными свойствами, что и у деформируемых сплавов. Однако стоимость и время изготовления изделий из порошковых сплавов существенно ниже (до 50 %), чем из литых или деформируемых сплавов.
9 Лекция. Применение пластических масс и изоляционных материалов для теплоэнергетического оборудования с учетом их эксплуатационных свойств
9.1 Пластмассы
Пластическими массами, или пластмассами, называют материалы, изготовленные на основе полимеров. Они бывают простыми (без добавок) и сложными (с добавками пластификаторов, стабилизаторов, наполнителей).
Наполнители – это органические и неорганические вещества в виде порошков (сажа, древесная мука, графит, TiO2, SiO2 и т.д.), волокон (ткани, стеклоткани и т.д.), листы (шпон, бумага). Количество их до 70 % для повышения механической прочности.
Стабилизаторы – вводятся в количестве нескольких процентов для сохранения структуры полимеров. Кроме этого, они способствуют возникновению поперечных связей в макромолекулах полимеров, предотвращают старение.
Пластификаторы – уменьшают силы межмолекулярного взаимодействия, снижают тем самым хрупкость изделий, улучшают формуемость материала. Количество их до 20 %.
Отвердители (несколько процентов) – способствуют ускоренному затвердеванию пластмасс за счет возникновения связей в микромолекулах в встраивании их в общую сетку.
Специальные добавки, например, красители, смазочные вещества, которые служат для избирательного усиления каких-либо свойств.
Применение пластмасс как конструкционных материалов резко снижает трудоемкость изготовления готовых изделий. Отличительная особенность – малая плотность (1…2 г/см3), у пенопластов – 0,015 г/см3, хорошие электроизоляционные свойства и т.д.
Термопластичные пластмассы (термопласты) нашли широкое применение. Под нагрузкой полимеры ведут себя как вязкоупругие вещества,
а их деформация складывается из трех составляющих: упругой, высокоэластичной и деформации вязкого течения.
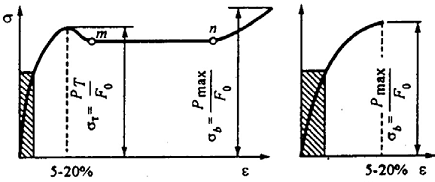
Рисунок 9.1 - Диаграммы растяжения пластмасс
На рисунке 9.1 приведены диаграммы растяжения пластмасс: а - вязкие аморфные и кристаллические термопласты; б-хрупкие термопласты; заштрихованные области – допустимые нагрузки и удлинения. Стеклообразные термопласты при растяжении, как правило, сильно вытягиваются (см. рисунок 9.1 а, б). При разрыве остаточная деформация составляет десятки и сотни процентов. Эта деформация называется вынужденной высокоэластичной, за счет скручивания макромолекул под нагрузкой. Материал начинает течь, появляется «шейка». Сходная картина наблюдается при растяжении кристаллических полимеров (фторопласты). При пластическом течении исходная структура заменяется новой, в которой кристаллы имеют другую форму. Этот процесс называется рекристаллизацией.
Волокниты – пластмассы с волокнистыми наполнителями (асбест). Используют при изготовлении тормозных колодок.
Слоистые полимеры - текстолиты (наполнитель - хлопчатобумажная ткань), гетинаксы (наполнитель - бумага). Содержание наполнителя - до 50 %. Используют в электротехнике, при облицовке помещений, салонов самолетов.
9.2 Общие характеристики неметаллических материалов
Неметаллические коррозионно-стойкие конструкционные материалы достаточно широко распространены в различных отраслях индустрии. Применение таких материалов для изготовления различной аппаратуры позволяет заменить дорогостоящие металлы. Они подразделяются на материалы неорганического и органического происхождения.
Неметаллические конструкционные материалы, используемые в теплоэнергетике и теплотехнике, предназначены для работы в соответствующих устройствах при низких или высоких температурах. Такими материалами являются природные и искусственные абразиво- и коррозионно-стойкие силикатные материалы (естественные горные породы, керамика и фарфор, стекло, ситаллы и каменное литье), огнеупоры, теплоизоляционные материалы, различные органические (пластмассы, полимеры, резины), прокладочные, композиционные (стеклопластики, металлокерамика) и другие материалы. Основные свойства, характерные для неметаллических конструкционных материалов следующие:
- объемная масса (ρ, кг/м3) – масса единицы объема материала (изделия), включая поры;
- пористость материала – степень заполнения его объема порами;
- газопроницаемость – свойство пористых материалов пропускать газ при перепаде давления;
- водопоглощение – способность материала впитывать и удерживать влагу;
- морозостойкость – способность пористого материала в насыщенном водой состоянии выдерживать многократное попеременное замораживание (ниже - 17 °С) и оттаивание (цикл) без видимых признаков разрушения и при незначительном понижении прочности;
- химическая или коррозионная стойкость – способность материала противостоять разрушающему воздействию агрессивных сред (газов, щелочей, кислот или растворов солей, расплавленных шлаков, руды и других минеральных материалов), в которых он предназначен работать;
- прочность – способность материала сопротивляться хрупкому разрушению или упругой деформации под действием различных механических нагрузок — сжатия, изгиба, растяжения, истирания и других при разных условиях эксплуатации;
- термостойкость характеризует способность материала (изделия) не разрушаться от воздействия термических напряжений;
- огнеупорность – способность материала противостоять, не расплавляясь, действию высоких температур. Огнеупорность характеризует предельную температуру службы огнеупора при отсутствии механических нагрузок и физико-химического воздействия среды.
9.3 Композиционные материалы
Композиционными называют сложные материалы, в состав которых входят сильно отличающиеся по свойствам нерастворимые или малорастворимые друг в друге компоненты, разделенные в материале ярко выраженной границей.
Композиционные материалы (КМ) по удельной прочности, жесткости, прочности при высокой температуре, сопротивлению усталостному разрушению и другим свойствам значительно превосходят многие металлические сплавы. Их преимущество заключается в том, что уровень свойств заранее проектируется и реализуется в процессе изготовления, при этом КМ придают форму готовой детали (изделия). Принцип создания КМ заимствован у природы: стволы деревьев, растений, кости человека.
Свойства КМ зависят от свойств компонентов и прочности связи между ними. Основой КМ служат металлы и сплавы, углеродные, керамические материалы - это матрица. Компонент, непрерывный во всем объеме композиционного материала, называется матрицей.
Рисунок 9.2- Схемы полиматричного (а) и полиармированного (б) КМ
Компонент или компоненты прерывистые, разъединенные матрицей, называются арматурой или армирующим компонентом, или, иногда, наполнителем. Наполнители — равномерно распределенные в матрице компоненты — их называют упрочнителями. По прочности, твердости, модулю упругости они должны превосходить свойства матрицы. Свойства КМ зависят от формы, размера, количества и характера распределения наполнителя (схема армирования). Понятие «армирующий» означает «введенный в материал с целью изменения его свойств», но не несет в себе однозначного понятия «упрочняющий».
КМ классифицируются по нескольким основным признакам: а) материалу матрицы и армирующих компонентов; б) структуре: геометрии и расположению компонентов (структурных составляющих);
в) методу получения; г) области применения.
Материал матрицы и армирующих компонентов. Характеристика КМ по материалу матрицы и армирующих компонентов указывает на их физико-химическую природу. В настоящее время по материалу матрицы различают:
1) Металлические КМ или КМ на основе металлов и сплавов. Чаще всего используются алюминий, магний, титан, медь и сплавы на их основе. Также делаются попытки использовать в качестве матрицы высокопрочные стали, тугоплавкие металлы и сплавы.
2) КМ на основе интерметаллидов, когда в качестве матрицы используются интерметаллиды — химические соединения металлов с металлами. Это относительно новый класс КМ, в котором в качестве материала матрицы используются жаропрочные интерметаллиды Ti3Al, TiAl, NiAl, Ni3Al и другие.
3) Керамические КМ. В качестве матрицы этих материалов используются неорганические соединения оксидов, карбидов, нитридов (класс супержаропрочных материалов).
4) КМ на основе неметаллических компонентов. Это прежде всего КМ на основе углерода, которые считаются одними из самых перспективных КМ, особенно в сочетании с углеродными волокнами.
5) КМ с матрицей из полимеров. Эпоксидные, полиэфирные и некоторые другие термоактивные смолы, а также полимерные термопласты являются наиболее широко распространенной группой конструкционных композитов. В качестве армирующих компонентов (наполнителей) полимерных композиционных материалов (ПКМ) обычно применяют твердые наполнители: непрерывные и дискретные волокна различной природы, ткани и нетканые материалы на основе этих волокон. Наибольшее распространение получили пластики, армированные стеклянными, углеродными, органическими, борными и некоторыми другими видами волокон.
9.4 Требования, предъявляемые к металлу в теплоэнергетике
Выбор конструкционных материалов, используемых в теплоэнергетике, и основные требования, предъявляемые к ним, определяются условиями эксплуатации энергооборудования и трубопроводов.
Условия работы металла в теплоэнергетике под воздействием эксплуатационных факторов характеризуются высокими температурой и давлением, агрессивностью рабочей среды. Например, металл поверхностей нагрева котлоагрегатов должен обладать не только высокими прочностью и пластичностью, но и достаточно высоким сопротивлением электрохимической коррозии со стороны пароводяной среды и химической коррозии от продуктов сгорания топлива. В таких условиях металл энергоустановок должен надежно работать длительное время. Обычно расчетный срок службы энергетического оборудования принимают равным 105 ч. Это срок службы обусловлен процессами ползучести при высоких температурах и сохранением характеристик длительной прочности на необходимом уровне. При увеличении скорости ползучести, снижении длительной прочности может возникнуть опасность разрушения металла элементов оборудования.
Исходя из сложных условий, в которых работают современные энергоустановки, к микроструктуре и свойствам металла предъявляют следующие основные требования:
- жаропрочность (сопротивление ползучести);
- жаростойкость (сопротивление окислению в газовой среде при высоких температурах);
- сопротивление усталости (включая термическую усталость);
- коррозионная стойкость (сопротивление разрушению в результате химического или электрохимического воздействия внешней среды);
- эрозионная стойкость (сопротивление износу под воздействием абразивных частиц, потоков воды и пара);
- стабильность структуры и механических свойств при рабочих температурах.
Кроме того, металл оборудования и трубопроводов должен обладать высокими технологическими свойствами (хорошо свариваться, обрабатываться давлением и резанием, не иметь металлургических дефектов и т.п.). Высокие технологические свойства металла, которые закладываются при его выплавке на металлургических заводах, обеспечивают высокое качество оборудования и трубопроводов на стадиях их изготовления на машиностроительных заводах, монтажа на стройплощадках и ремонта в цеховых условиях.
Для обеспечения высокой жаропрочности используют специальное легирование и последующую термическую обработку. При повышенных температурах из пересыщенного твердого раствора с ограниченной растворимостью выделяются упрочняющие частицы, которые затрудняют движение дислокаций. Легирование и термическая обработка определяют структурный класс сталей, уровень механических свойств и предельную рабочую температуру.
Список литературы
1. Гуляев А.Н. Металловедение.- М.: Металлургия, 1986. -647 с.
2. Кузьмин Б.А., Самохоцкий А.И. Металловедение и конструкционные материалы.- М.: Высшая школа, 2000.-304 с.
3. Лахтин Ю.М. Металловедение и термическая обработка металлов.- М.: Металлургия, 1993. - 448 с.
4. Лахтин Ю.М. Основы материаловедения. - М.: Металлургия, 1988. – 319с.
5. Лахтин Ю.М., Леонтьева В.П. Материаловедение. - М.: Машиностроение, 1990.
6.
Геллер
Ю.А., Рахштадт А.Г. Материаловедение.- М.: Металлургия,
1975.-448
с.
7. Материаловедение / Под.ред. Б.Н. Арзамасова.- М.: Машиностроение, 1986.-384 с.
8. Матюнин В.М. Металловедение в теплоэнергетике. – М: Изд.дом МЭИ, 2008. -328с.
9. Мозберг Р.К. Материаловедение. - М.: Высш. шк., 1991.
10. Антикайн М.Т. Металлы и расчет на прочность котлов и трубопроводов, М.: Машиностроение, 1980. -384 с.
11. Новиков И.И. Теория термической обработки металлов. - М.: Металлургия, 1986.
12. Сажин В.Б. Основы материаловедения. - М: ТЕИС, 2005. -156с.
13. Барышев, Г.А. Материаловедение. - Тамбов: Изд-во ТГТУ, 2007.- 140 с.
14. Новые материалы. Под.ред. Ю.С. Карабасова. – М.: МИСИС,2002. -736.
15. Джаманкулова Н.О. Материаловедение. Методические указания к лабораторным работам для студентов всех форм обучения специальности 050717 –Теплоэнергетика. Алматы: АИЭС, 2008г.-37с.
Содержание
1 Лекция. Цели и задачи изучения дисциплины. Введение 3
2 Лекция. Строение и свойства материалов 6
3 Лекция. Конструкционные материалы и их механические свойства 13
4 Лекция. Основы теории сплавов 19
5 Лекция (продолжение темы 4). Диаграммы состояния
двухкомпонентных сплавов 23
6 Лекция. Железо и его сплавы 33
7 Лекция. Термическая обработка металлов 41
8 Лекция. Конструкционные материалы из цветных металлов 45
9 Лекция. Применение пластических масс и изоляционных
материалов для теплоэнергетического оборудования с
учетом их эксплуатационных свойств 52
Список литературы 60