Некоммерческое акционерное общество
АЛМАТИНСКИЙ УНИВЕРСИТЕТ ЭНЕРГЕТИКИ И СВЯЗИ
Кафедра промышленной теплоэнергетики
ХИМИЧЕСКИЙ АНАЛИЗ
Методические указания к выполнению лабораторных работ
(для студентов специальности 5В073100 – «Безопасность жизнедеятельности и защита окружающей среды»)
Алматы 2011
СОСТАВИТЕЛИ: К.О. Кишибаев, Г.А. Колдасова. Химический анализ. Методические указания к выполнению лабораторных работ (для студентов специальности 5В073100 – «Безопасность жизнедеятельности и защита окружающей среды»). – Алматы: АУЭС, 2011 – 45 с.
Методические указания к выполнению лабораторных работ предназначены для бакалавров специальности 5В073100 – «Безопасность жизнедеятельности и защита окружающей среды» и подготовлены в соответствии с образовательным стандартом по курсу «Химический анализ».
Данные методические указания включают описание основных 8 лабораторных работ. Описанию лабораторных работ предшествуют небольшие теоретические введения, а завершают их контрольные вопросы для самопроверки.
Ил. 6, табл. 16, библиогр.- 15 назв.
Рецензент: канд. хим. наук, доц. КазНУ имени аль-Фараби А. И. Ниязбаева
Печатается по плану издания НАО «Алматинского университета энергетики и связи» на 2011 г.
© НАО «Алматинский университет энергетики и связи», 2011г.
Введение
Лабораторный практикум по химическому анализу имеет целью расширение и закрепление знаний, полученных студентами по общей и неорганической химии, приобретение практических навыков работы по качественному и количественному химическому анализу, применение основных теоретических положений аналитической химии при решении конкретных задач химического анализа.
Данное учебное пособие охватывает не только работы по качественному анализу, но и включает ряд работ по количественному анализу аналитической химии.
Перед началом работы в лаборатории аналитической химии студенты должны обязательно изучить «Инструкцию по технике безопасности» и взять на себя обязательства неукоснительно ей следовать, о чем делается запись в «Журнале по технике безопасности».
Все лабораторные эксперименты выполняются полумикрометодом, т.е. капельными количествами реактивов, что позволяет развивать такие, безусловно, полезные качества как наблюдательность и аккуратность.
Составление отчетов по каждой выполненной работе в соответствии с требованиями международной системы ЕСКД (Единая система оформления конструкторской и технологической документации) позволит студентам овладеть навыками оформления инженерных документов в их будущей производственной и научной деятельности.
Для облегчения усвоения материала в каждой работе приводится достаточно подробное теоретическое описание изучаемого вопроса, в конце – перечень контрольных вопросов, которые включает, помимо теоретических вопросов, составление схем качественного анализа в пределах использования основных приемов и методов, а также решение конкретных практических задач по определению качественного и количественного состава анализируемого вещества.
Завершение курса подразумевает выполнение всех лабораторных работ, включая контрольную, сдачу отчетов по ним и получение зачета или допуска к экзамену.
Качественный анализ
Лабораторная работа №1. Аналитические реакции катионов I-III групп по кислотно-основной классификации
1 Теоретическая часть
Качественный анализ катионов включает дробный и систематический анализ.
В дробном анализе обнаружение анализируемых ионов в отдельных порциях исследуемого раствора проводят с использованием специфических или селективных реакций в любой последовательности.
Систематический анализ предусматривает последовательное разделение смеси катионов по аналитическим группам с помощью групповых реагентов и последующее обнаружение отдельных катионов. Деление катионов на аналитические группы основано на различной растворимости соединений катионов с групповыми реагентами.
Таблица 1 – Кислотно-основная классификация катионов
|
Аналитичес- |
Катионы |
Групповой |
Продукты взаимодействия с аналитический сигнал |
|
I |
К+, Na+,
NH |
– |
– |
|
II (хлоридная) |
Ag+,
Pb2+,
Hg |
2 моль/л |
AgCl, PbCl2, Hg2Cl2 – осадки белого цвета |
|
III (сульфатная) |
Ba2+, Ca2+, Sr2+ |
1 моль/л |
BaSO4, CaSO4, SrSO4 – осадки белого цвета |
|
IV (амфолитная) |
Al3+, Sn2+, SnIV,
|
Избыток 2 моль/л раст-вора щелочи
в присутствии |
Гидроксокомплексы:
[Сr(OH)6]3– – изумрудно- |
|
V (гидроксид-ная) |
Mg2+, Mn2+, |
избыток 2 моль/л
раствора |
Mn(OH)2,
Fe(OH)2 – осадки белого цвета, буреющие на
воздухе; MnO2,
Fe(OH)3
– |
|
VI (аммиакатная) |
Cu2+, Cd2+, Ni2+, Co2+, Hg2+ |
избыток |
Аммиакатные комплексы: [Ni(NH3)6]2+-сиреневый
[Co(NH3)6]2+-желтый
|
В зависимости от наблюдаемого аналитического сигнала реакции в растворах делят на осадочные, газовыделительные, цветные, люминесцентные и микрокристаллоскопические.
|
Реакции |
Аналитический сигнал |
|
Осадочные |
Растворение или выделение осадка |
|
Газовыделительные |
Выделение газа |
|
Цветные |
Появление окраски или обесцвечивание окрашенного раствора |
|
Люминесцентные |
Свечение раствора после проведения реакции или гашение люминесценции |
|
Микрокристалло-скопические |
Кристаллы определенной формы, цвета и размера, наблюдаемые под микроскопом |
2 Экспериментальная часть
Качественный анализ катионов I группы
В состав первой аналитической группы входят катионы s-элементов главной подгруппы I группы ПСЭ (Li+, Na+, K+), а также ион аммония NH4+.
Качественные реакции ионов калия
1. Микрокристаллоскопическая реакция осаждения нитрита калия – меди – свинца.
К 3 каплям раствора соли калия на предметном стекле добавляют 1 каплю раствора нитрата (или ацетата) меди (II), 1 каплю раствора нитрата свинца (или стронция) и выпаривают досуха. После охлаждения к осадку добавляют 1 каплю 2 моль/л раствора уксусной кислоты и небольшой кристаллик нитрита натрия – образуются характерные кубические кристаллы нитрита калия – меди – свинца (стронция) черного (зеленого) цвета:
2K+ + Cu2+
+ Pb2+ + 6NO![]() = K2CuPb(NO2)6↓.
= K2CuPb(NO2)6↓.
В аналогичных условиях реакцию осаждения тройной соли нитрита аммония – меди – свинца дают ионы аммония.
2. Реакция с раствором гексанитрокобальтата (III) натрия.
К 3 каплям раствора соли калия (рН = 7) добавляют 3 капли раствора гексанитрокобальтата (III) натрия – образуется желтый осадок:
2K+ + Na+ + [Co(NO2)6]3– = K2Na[Co(NO2)6]↓.
Успешное протекание реакции обеспечивают избыток свежеприготовленного реагента, рН ≈ 4 – 6. В аналогичных условиях реакцию осаждения (NH4)2Na[Co(NO2)6]↓ дают ионы аммония.
Реакция используется для дробного обнаружения ионов калия после их отделения от мешающих ионов действием насыщенного раствора карбоната натрия при нагревании. Фильтрат после отделения осадка подкисляют уксусной кислотой до кислой реакции среды и проводят реакцию обнаружения.
3. Реакция окрашивания пламени (пирохимическая реакция).
Соли и другие соединения калия окрашивают пламя горелки в фиолетовый цвет. Кристаллы соли вносятся в горелку на кончике графитового стержня, наблюдают окрашивание пламени.
Качественные реакции ионов натрия
4. Реакция окрашивания пламени (пирохимическая реакция).
Соли и другие соединения натрия окрашивают пламя горелки в жёлтый цвет. На кончике графитового стержня вносят в пламя горелки кристаллики соли натрия. Пламя окрашивается в ярко-жёлтый цвет.
Качественные реакции ионов аммония
5. Реакция выделения аммиака.
К 3 каплям раствора соли аммония добавляют 5 капель 2 моль/л раствора гидроксида натрия (или калия) и слегка нагревают. Выделяется аммиак, имеющий характерный запах:
NH4+ + OH – = NH3↑ + H2O.
Выделяющиеся пары аммиака окрашивают влажную лакмусовую бумагу в синий цвет, а фенолфталеиновую – в красный. Реакция используется для дробного обнаружения ионов аммония в предварительных испытаниях.
Качественный анализ катионов II группы
Вторая аналитическая группа
катионов представлена
d-элементами I
В и В подгрупп (Ag+,
Hg![]() ) и
p-элементом
IVA подгруппы
ПСЭ (Pb2+).
) и
p-элементом
IVA подгруппы
ПСЭ (Pb2+).
Для катионов серебра и свинца характерно образование различных комплексов, наиболее важные из которых: аммиакатные, хлоридные, тиосульфатные.
Окислительно-восстановительную
активность проявляет
Hg![]() . При действии сильных окислителей ион
Hg
. При действии сильных окислителей ион
Hg![]() окисляется
до Hg2+, а при действии сильных восстановителей
Hg
окисляется
до Hg2+, а при действии сильных восстановителей
Hg![]() восстанавливается до Hg0. Ион
Hg
восстанавливается до Hg0. Ион
Hg![]() существует в виде сложного иона -Hg-Hg-, с условной степенью окисления +1.
Гидроксиды серебра и ртути (I) в обычных
условиях неустойчивы и существуют в виде оксидов, гидроксид свинца (II) амфотерен.
существует в виде сложного иона -Hg-Hg-, с условной степенью окисления +1.
Гидроксиды серебра и ртути (I) в обычных
условиях неустойчивы и существуют в виде оксидов, гидроксид свинца (II) амфотерен.
Ионы Ag+,
Hg![]() и
Pb2+ бесцветные, поэтому цвет их растворов и осадков зависит от
цвета аниона.
и
Pb2+ бесцветные, поэтому цвет их растворов и осадков зависит от
цвета аниона.
Качественные реакции ионов серебра
6. Осаждение раствором хлороводородной кислоты.
К 3 – 4 каплям раствора соли серебра добавляют 1 – 2 капли 2 моль/л раствора HCl:
Ag + + Cl– = AgCl↓.
К полученному осадку после центрифугирования добавляют избыток 2 моль/л раствора NH4OH до полного растворения осадка за счет образования комплексного иона диамминсеребра (I):
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl–.
К полученному раствору добавляют по каплям 2 моль/л раствор HNO3 до выпадения осадка хлорида серебра:
[Ag(NH3)2]+
+ Cl– + 2H+ = AgCl ↓ + 2NH![]() .
.
Аммиакатный комплекс разрушается вследствие связывания молекул аммиака в более прочные ионы аммония. Высвободившиеся катионы серебра связываются с имеющимися в растворе хлорид – ионами в малорастворимое соединение – хлорид серебра.
Хлорид серебра растворим в растворах карбоната аммония, тиосульфата натрия с образованием комплексных соединений.
7. Осаждение растворами едких щелочей.
К 2 – 3 каплям раствора соли серебра добавляют 1 – 2 капли 2 моль/л раствора гидроксида натрия. Выпадает осадок гидроксида серебра, который неустойчив и разлагается до оксида серебра черного цвета:
2Ag+ + 2OH– = 2AgOH↓ = Ag2O↓ + H2O.
8. Осаждение растворами хроматов.
К 2 – 3 каплям раствора соли серебра добавляют 1 – 2 капли раствора хромата калия. Выпадает осадок хромата серебра кирпично-красного цвета:
2Ag+ +
CrO![]() =
Ag2CrO4↓.
=
Ag2CrO4↓.
При выполнении реакции среда должна быть нейтральной (рН = 7), так как в щелочной среде реакция протекает с образованием черного осадка оксида серебра, а в кислой среде осадок не образуется, из-за большой растворимости дихромата серебра.
При добавлении к осадку концентрированного раствора аммиака осадок растворяется с образованием аммиачного комплекса серебра:
Ag2CrO4↓
+ 4NH3 = 2[Ag(NH3)2]+ + CrO![]() .
.
9. Осаждение растворами солей галогеноводородных кислот.
В три пробирки вносят: в первую 2-3 капли раствора NaCl; во вторую 2-3 капли раствора NaBr; в третью 2-3 капли раствора KI. В каждую пробирку добавляют по 3-5 капель раствора нитрата серебра. Напишите уравнения реакций, отметив аналитический сигнал реакций.
К каждому осадку добавляют 5-10 капель концентрированного раствора аммиака. Сделайте вывод о растворимости осадков.
Качественный анализ катионов III группы
Катионы третьей аналитической группы Ca2+, Ba2+, Sr2+ являются катионами s-элементов главной подгруппы II группы ПСЭ.
Групповым реагентом на катионы данной группы является раствор серной кислоты. Однако поляризующей способности катионов третьей группы недостаточно для деформирования оболочек хлорид-, сульфид-, гидроксид-ионов, поэтому данные соединения достаточно хорошо растворяются в воде.
Качественные реакции ионов кальция
10. Осаждение растворами сульфатов и серной кислотой.
К 5 каплям раствора соли кальция прибавляют 2 капли этилового спирта и добавляют по каплям 1 моль/л раствор серной кислоты – выпадает белый осадок сульфата кальция:
Сa2+ +
SO![]() =
CaSO4↓.
=
CaSO4↓.
Полученный осадок центрифугируют и добавляют к нему 10 капель раствора сульфата аммония. Осадок растворяется за счёт образования комплексного иона – дисульфатокальциата:
CaSO4 +
SO![]() = [Ca(SO4)2]2–.
= [Ca(SO4)2]2–.
11. Осаждение растворами гексацианоферрата (II) калия.
К 2 каплям растворам соли кальция добавляют по 2 капли 2 моль/л растворов гидроксида аммония и хлорида аммония, нагревают и прибавляют 4 капли насыщенного раствора калия гексацианоферрата (II). Наблюдают выпадение кристаллического осадка гексацианоферрата (II) кальция – аммония:
Ca2+ + 2NH![]() + [Fe(CN)6]4–
= Ca(NH4)2[Fe(CN)6]↓.
+ [Fe(CN)6]4–
= Ca(NH4)2[Fe(CN)6]↓.
Данная реакция позволяет обнаружить кальций в присутствии стронция.
12. Микрокристаллоскопическая реакция образования кристаллов гипса.
На предметное стекло помещают каплю раствора соли кальция и действуют каплей 1 моль/л раствора серной кислоты, слегка упаривают до появления каёмки по краям капли. Кристаллы дигидрата сульфата кальция в виде крупных призм или пучков отличаются от мелких кристаллов сульфата бария и стронция:
Ca2+ + SO![]() + 2H2O = CaSO4
× 2H2O↓.
+ 2H2O = CaSO4
× 2H2O↓.
13. Реакция осаждения оксалатов.
К 3 каплям соли кальция прибавляют 3 капли раствора оксалата аммония – выпадает осадок оксалата кальция.
Ca2– +
C2O![]() =
CaC2O4↓.
=
CaC2O4↓.
Осадок растворим в минеральных кислотах, но не растворяется в уксусной кислоте в отличие от оксалатов бария и стронция.
3 Контрольные вопросы
1. Напиши уравнения качественных реакции ионов свинца.
2. Напиши уравнения качественных реакции ионов бария.
3. Напиши уравнения качественных реакции ионов стронция.
4. Напиши уравнения качественных реакции ионов
Hg![]() .
.
5. Составьте схему систематического анализа катионов I группы.
6. Составьте схему систематического анализа катионов II группы.
7. Составьте схему систематического анализа катионов III группы.
Результаты проведения качественных реакций регистрируют в лабораторном журнале, оформленном по приведенной ниже схеме:
Тема: Качественные реакции катионов аналитической группы
|
Открываемый ион |
Реактив |
Уравнение |
Условия |
Аналитический сигнал и свойства полученных соединений |
|
|
|
|
|
|
Лабораторная работа №2. Аналитические реакции катионов IV-VI групп
1 Теоретическая часть
IV – аналитическая группа (амфолитная)
В состав четвертой аналитической группы
входят катионы
р-элементов главных подгрупп III;
IV;
V групп (Al3+;
Sn2+;
Sn4+;
As (III);
As (V)) и
d-элементов побочных подгрупп
II и
VI
групп (Zn2+ и
Cr3+) периодической системы.
Мышьяк (III) и мышьяк (V)
обычно открывают в виде арсенит- (AsO![]() ;
AsO
;
AsO![]() ) и арсенат-ионов (AsO
) и арсенат-ионов (AsO![]() ) соответственно, поэтому свойства данных анионов
рассматривают в качественных реакциях анионов.
) соответственно, поэтому свойства данных анионов
рассматривают в качественных реакциях анионов.
Данные катионы объединены в одну группу вследствие амфотерности их гидроксидов, поэтому избыток раствора щелочи является групповым реагентом для данной группы.
В щелочном растворе (рН 7, 8…12)
существуют комплексные ионы состава [Al(H2O)2(OH)4]–;
[Cr(OH)6]3–; [Zn(OH)4]2–;
[Sn(OH)4]2– (упрощенно
AlO![]() ,
CrO
,
CrO![]() ,
ZnO
,
ZnO![]() ,
SnO
,
SnO![]() соответственно),
которые в сильнокислых растворах превращаются в акватированные комплексы
Al3+;
Cr3+ и
Zn2+, а также в хлоридные комплексы [SnCl4]2–.
соответственно),
которые в сильнокислых растворах превращаются в акватированные комплексы
Al3+;
Cr3+ и
Zn2+, а также в хлоридные комплексы [SnCl4]2–.
2 Экспериментальная часть
Качественные реакции ионов алюминия
1. Осаждение раствором гидроксида аммония.
К 2 каплям раствора соли алюминия добавляют 3 капли 2 моль/л раствора гидроксида аммония и нагревают 5 минут на водяной бане. Выпадает белый аморфный осадок гидроксида алюминия:
Al3+ + 3NH3 + 3H2O
= ↓Al(OH)3 + 3NH![]() .
.
Аналогичную реакцию дают едкие щелочи и растворы солей с рН больше 7.
Полученный осадок делят на две части. К части осадка добавляют по каплям раствор соляной кислоты до растворения осадка:
↓Al(OH)3 + 3H+ = Al3+ + 3H2O.
Ко второй части осадка добавляют по каплям раствор гидроксида натрия до растворения осадка:
↓ Al(OH)3 + 3ОН– = [Al(OH)6]3–.
Амфотерный гидроксид алюминия растворяется при рН не менее 4,5 и рН более 10,0.
К полученному раствору алюмината прибавляют кристаллический хлорид аммония и нагревают до кипения – вновь выпадает осадок гидроксида алюминия:
[Al(OH)6]3– + 3NH![]() = ↓Al(OH)3
+ 3NH3 + 3H2O.
= ↓Al(OH)3
+ 3NH3 + 3H2O.
Добавляя хлорид аммония – соль,
гидролизующуюся по катиону (NH![]() + H2O =
NH4OH +
H+), снижают величину рН раствора до 7 – 8, которая
поддерживается постоянной благодаря образованию аммиачной буферной смеси.
+ H2O =
NH4OH +
H+), снижают величину рН раствора до 7 – 8, которая
поддерживается постоянной благодаря образованию аммиачной буферной смеси.
Реакцию используют для отделения и обнаружения в присутствии Zn2+; Cr3+; Mn2+; Fe3+ и других катионов.
2. Реакция с нитратом кобальта (II) (пирохимический способ).
На полоску фильтровальной бумаги помещают последовательно по 1-2 капли солей алюминия и нитрата кобальта (II). После подсушивания и сжигания бумаги образуется пепел синего цвета состава Co(AlO2)2 – «тенарова синь»:
2Al2(SO4)3 + 2Co(NO3)2 = 2Co(AlO2)2 + 4NO2↑ + O2↑ + 6SO3↑.
К мешающим ионам относятся ионы Zn2+, образующие пепел зеленого цвета.
V- аналитическая группа (гидроксидная)
В состав пятой аналитической группы входят катионы р-элементов главной подгруппы пятой группы Bi3+; Sb (III); Sb (V); s-элемента главной подгруппы II группы Mg2+ и d-элементов побочных подгрупп VII и VIII групп (Fe2+; Fe3+; Mn2+) периодической системы.
Из солей катионов V группы растворимыми являются соли сильных кислот, водные растворы которых имеют кислую реакцию среды.
Гидроксиды катионов V группы, кроме гидроксидов сурьмы и железа (III), проявляют основные свойства. В отличие от катионов IV группы гидроксиды большинства катионов V группы не растворяются в избытке щелочи, поэтому раствор щелочи является групповым реагентом на катионы V группы.
Качественные реакции ионов магния
3. Осаждение раствором гидроксида аммония.
К 2-3 каплям раствора соли магния прибавляют 3-4 капли 2 моль/л раствора аммиака – выпадает аморфный осадок гидроксида магния, нерастворимый в избытке реагента, но растворимый в солях аммония:
Mg2+ + 2NH3 + 2Н2О
= ↓Mg(OH)2 + 2NH![]() .
.
Аналогичный аналитический сигнал дает реакция солей магния с растворами щелочей.
4. Микрокристаллоскопическая реакция осаждения фосфата магния-аммония.
Каплю раствора соли магния помещают на предметное стекло и добавляют каплю раствора хлорида аммония. Предметное стекло держат несколько минут каплей вниз над отверстием склянки с концентрированным раствором аммиака. Затем к раствору добавляют кристаллик гидрофосфата натрия и наблюдают под микроскопом кристаллы фосфата магний – аммония в виде шестилучевых звезд:
Mg2+ +
NH4ОН + НРО![]() =
↓MgNH4РО4
+ 2Н2О.
=
↓MgNH4РО4
+ 2Н2О.
Кристаллический осадок двойной соли растворим в уксусной и минеральных кислотах. Реакцию обнаружения проводят при рН 9 в присутствии аммиачного буфера.
Качественные реакции ионов железа (II)
5. Осаждение раствором гидроксида аммония.
К 1-2 каплям раствора соли железа (II) прибавляют 2-3 капли 2 моль/л раствора аммиака – выпадает аморфный осадок гидроксида железа (II):
Fe2+ + 2NH3 + 2Н2О
= ↓Fe(OH)2 + 2NH![]() .
.
Осадок гидроксида железа (II) буреет на воздухе за счет окисления до гидроксида железа (III):
↓4Fe(OH)2 + О2 + 2Н2О = ↓4Fe(OH)3.
6. Реакция с гексацианоферратом (III) калия.
К 1-2 каплям раствора соли железа (II) прибавляют 1-2 капли раствора гексацианоферрата (III) калия – образуется осадок гексацианоферрата (III) железа (II) – «турнбулева синь»:
3Fe2+ + 2[Fe(CN)6]3– = ↓Fe3[Fe(CN)6]2.
Реакция используется для дробного обнаружения железа (II).
7. Реакция с сульфидом аммония.
К 3-4 каплям раствора соли железа (II) прибавляют 2-3 капли раствора сульфида аммония (или сульфида натрия) – выпадает осадок сульфида железа (II) черного цвета:
Fе2+ + S2– = ↓FеS.
Реакцию проводят в нейтральной или аммиачной среде.
VI-аналитическая группа (аммиакатная)
В состав шестой аналитической группы входят d-элементы побочных подгрупп I группы (Cu2+), II группы (Cd2+; Hg2+) и VIII группы (Co2+; Ni2+).
Гидроксиды катионов VI группы нерастворимы в избытке щелочи, но растворимы в избытке раствора NH3 и его концентрированных растворах за счет образования аммиакатов состава [Me(NH3)4]2+ и [Me(NH3)6]2+, что лежит в основе использования 25% раствора аммиака в качестве группового реагента.
Качественные реакции ионов меди (II)
8. Реакция осаждения раствором аммиака.
К 3 каплям раствора соли меди (II) добавляют 1 каплю 2 моль/л раствора аммиака. Выпадает осадок основной соли меди сине-зеленоватого цвета, легко растворимый в избытке аммиака:
CuCl2 + NH3 × H2O = ↓(CuOH)Cl + NH4Cl;
2CuSO4 + 2NH3 × H2O = ↓(CuOH)2SO4 + (NH4)2SO4.
При добавлении к осадку 5-10 капель раствора аммиака осадок растворяется с образованием комплекса ярко-синего цвета:
(CuOH)Cl + 4NH3 × H2O = [Cu(NH3)4]2+ + OH– + Cl– + 4H2O;
(CuOH)2SO4 + 8NH3 × H2O
= 2[Cu(NH3)4]2+ + SO![]() + 8H2O + 2OH–.
+ 8H2O + 2OH–.
При добавлении по каплям 2 моль/л раствора сильной кислоты (HCl, HNO3 или H2SO4) окраска изменяется от ярко-синей до голубой:
[Cu(NH3)4]2+
+ 4H3O+ = [Cu(H2O)4]2+ +
4NH![]() .
.
В кислой среде аммиачный комплекс меди разрушается, и окраска раствора переходит из ярко-синей в голубую окраску аквакомплексов меди.
При дробном анализе по цвету фильтрата, полученного после отделения осадка, образовавшегося при действии на порцию исследуемого раствора концентрированного аммиака, делают вывод о наличии ионов меди в предварительных испытаниях.
9. Реакция с иодидом калия.
К 3 каплям раствора соли меди (II) добавляют 5 капель раствора иодида калия – выпадает осадок иодида меди (I) цвета слоновой кости, одновременно выделившийся иод окрашивает надосадочную жидкость в буро-коричневый цвет:
2Cu2+ + 4I– = 2CuI↓ + I2.
10. Реакция с тиосульфатом натрия.
К 3-4 каплям раствора соли меди добавляют 2-3 капли 1 моль/л раствора серной кислоты и несколько кристалликов тиосульфата натрия. Пробирку осторожно нагревают до кипения. Выпадает буро-коричневый осадок, содержащий Cu2S и S:
2Cu2+ + 2S2O![]() + 2H2O = Cu2S↓
+ S↓ + 4H+ + 2SO
+ 2H2O = Cu2S↓
+ S↓ + 4H+ + 2SO![]() .
.
Осадок Cu2S растворяется в 2 моль/л растворе HNO3. Реакция используется для отделения Cu2+ от других катионов VI группы.
11. Реакция с гексацианоферратом (II) калия.
К 3 каплям раствора соли меди (II) добавляют 1-2 капли гексацианоферрата (II) калия. Выпадает красно-коричневый осадок гексацианоферрата (II) меди, растворимый в растворе аммиака, но нерастворимый в разбавленных кислотах:
2Cu2+ + [Fe(CN)6]4– = Cu2[Fe(CN)6]↓.
Из катионов VI группы к мешающим ионам относятся катионы Co2+; Ni2+.
Реакцию помимо пробирочного метода можно проводить капельным методом на фильтровальной бумаге.
3 Контрольные вопросы
1. Напиши уравнения качественных реакции ионов цинка.
2. Напиши уравнения качественных реакции ионов олова (II).
3. Напиши уравнения качественных реакции ионов хрома (III).
4. Напиши уравнения качественных реакции ионов марганца (II).
5. Напиши уравнения качественных реакции ионов железа (III).
6. Напиши уравнения качественных реакции ионов никеля (II).
7. Напиши уравнения качественных реакции ионов висмута (III).
8. Напиши уравнения качественных реакции ионов кобальта (II).
9. Напиши уравнения качественных реакции ионов кадмия (II).
Результаты проведения качественных реакций регистрируют в лабораторном журнале.
Лабораторная работа №3. Аналитические реакции анионов I-III групп
1 Теоретическая часть
В настоящее время не существует единой общепринятой классификации анионов по группам. При анализе анионов используют компромиссный метод, сочетающий дробный и систематический анализ, последний из которых основан в большинстве случаев на различной растворимости солей бария и серебра с соответствующими анионами или на отношении анионов к действию окислителей и восстановителей. Большее распространение получило первое деление анионов на группы. По растворимости солей бария и серебра анионы делят на три группы.
|
Группа |
Анионы |
Групповой реагент |
|
I |
SO
C2O
PO
CrO |
Раствор BaCl2
в нейтральной или |
|
II |
Cl–, Br–, I– , S2– CN– , NCS– [Fe(CN)6]4–, [Fe(CN)6]3– |
Раствор AgNO3 в присутствии HNO3 |
|
III |
NO |
Отсутствует |
2 Экспериментальная часть
Качественный анализ анионов
Первая аналитическя группа анионов:
SO![]() ,
SO
,
SO![]() ,
S2O
,
S2O![]() ,
C2O
,
C2O![]() ,
CO
,
CO![]() ,
PO
,
PO![]() ,
AsO
,
AsO![]() ,
AsO
,
AsO![]() ,
F–
, CrO
,
F–
, CrO![]() ,
Cr2O
,
Cr2O![]() ,
B4O
,
B4O![]() .
.
Анионы первой группы образуют с солями бария осадки, растворимые в минеральных кислотах (кроме сульфата бария), поэтому реакции проводят в нейтральной или слабощелочной среде.
Анионы первой аналитической группы в водных растворах, за исключением хромата и дихромата, бесцветны.
Качественные реакции сульфат-ионов
1. Реакция с раствором хлорида бария.
К 1-2 каплям раствора, содержащего сульфат-ионы, добавляют 2-3 капли хлороводородной кислоты и 1-2 капли раствора хлорида бария:
SO![]() +
Ва2+ = ↓ВаSO4.
+
Ва2+ = ↓ВаSO4.
Образующийся осадок не растворяется в органических и минеральных кислотах, щелочах, солях. Дробное обнаружение сульфатов проводят в кислой среде, что позволяет устранить мешающее влияние других анионов первой группы. Тиосульфат-ионы, разлагающиеся в кислой среде с образованием элементной серы, мешают обнаружению, поскольку осадок серы может быть принят за сульфат бария.
2. Изоморфное соосаждение перманганата калия с сульфатом бария.
В пробирку помещают по 1 капле растворов сульфат-ионов, уксусной кислоты, перманганата калия и нитрата бария. Образуется осадок розового цвета за счет образования изоморфных кристаллов перманганата калия с сульфатом бария, что повышает специфичность реакции. Осадок отделяют центрифугированием, промывают водой – его окраска не изменяется.
3. Микрокристаллоскопическая реакция образования кристаллов гипса.
На предметное стекло помещают каплю раствора соли кальция и действуют каплей 1 моль/л раствора серной кислоты, слегка упаривают до появления каёмки по краям капли. Кристаллы дигидрата сульфата кальция в виде крупных призм или пучков рассматривают под микроскопом:
Ca2+ + SO![]() + 2H2O = CaSO4
× 2H2O↓.
+ 2H2O = CaSO4
× 2H2O↓.
Вторая аналитическая группа анионов: Cl–, Br–, I–, S2–, CN–, NCS–, [Fe(CN)6]4–, [Fe(CN)6]3–.
Вторая группа объединяет анионы, образующие малорастворимые соединения с раствором нитрата серебра. В отличие от анионов первой группы серебряные соли данной группы (кроме сульфида серебра) нерастворимы в азотной кислоте, поэтому их осаждение проводят в азотнокислой среде. Бариевые соли анионов растворимы в воде. При обработке кислотами только сульфид-ионы разлагаются с образованием летучих продуктов.
Большинство анионов второй группы обладают восстановительными свойствами, наиболее выраженными у сульфид- и иодид-ионов.
Качественные реакции иодид-ионов
4. Реакция осаждения иодида серебра.
К 3-4 каплям раствора иодид-ионов прибавляют 2-3 капли раствора нитрата серебра. Образующийся осадок иодида серебра нерастворим в азотной кислоте, карбонате аммония и в аммиаке, но растворяется в избытке тиосульфата натрия:
I– + Ag+ = ↓AgI;
↓AgI + 2S2O![]() = [Ag(S2O3)2]3–
+ I–.
= [Ag(S2O3)2]3–
+ I–.
5. Реакция окисления до молекулярного иода (экстракционный способ).
К 3-4 каплям раствора иодид-ионов прибавляют 2-3 капли раствора серной кислоты, 0,5 мл хлороформа и 3-4 капли нитрита натрия (хлорида железа (III)). Слой хлороформа окрашивается в розово-фиолетовый цвет:
2I– + 2NO![]() + 4H+ =
I2 + 2NO +
2H2O.
+ 4H+ =
I2 + 2NO +
2H2O.
При добавлении крахмала вместо хлороформа появляется синее окрашивание. Реакция с нитритом специфична и позволяет найти иодиды в присутствии хлорид-, бромид и ацетат-ионов. Реакция окисления хлоридом железа (III) не проводится в присутствии тиоцианат- и ацетат-ионов.
6. Реакция с солями меди (II).
К 3-4 каплям раствора иодид-ионов прибавляют 2-3 капли раствора соли меди (II). Образуется смесь CuI и I2:
4I– + 2Cu2+ = ↓2CuI + I2.
К полученной смеси добавляют раствор
сульфита натрия до
исчезновения окраски иода.
7. Реакция с солями свинца.
К 3-4 каплям раствора соли свинца добавляют 1-2 капли раствора иодида калия. Выпадает аморфный осадок иодида свинца золотисто – желтого цвета:
Pb2+ + 2I– = PbI2↓.
К осадку добавляют 3-4 капли 2 моль/л раствора уксусной кислоты и нагревают до растворения осадка. При охлаждении снова выпадает осадок иодида свинца в виде блестящих золотистых кристаллов.
Третья аналитическя группа анионов:
NO![]() ,
NO
,
NO![]() ,
CH3COO–.
,
CH3COO–.
Третья группа объединяет анионы, не имеющие группового реагента: они не образуют осадков с солями бария и серебра. Летучие продукты с разбавленными минеральными кислотами образуют только нитриты:
2NO![]() + 2Н+ = ↑NO2 + ↑NO + Н2O.
+ 2Н+ = ↑NO2 + ↑NO + Н2O.
В зависимости от условий нитриты проявляют окислительно-восстановительную двойственность. Нитрат ионы при создании соответствующей среды являются окислителями. Все они в водных растворах бесцветны.
Качественные реакции ацетат-ионов
8. Реакция с концентрированной серной кислотой.
К 3-4 каплям раствора ацетат-ионов прибавляют 1-2 капли концентрированной серной кислоты. Содержимое пробирки осторожно нагревают – ощущается запах уксусной кислоты:
CH3COO– + Н+ = CH3COOН.
9. Реакция образования этилацетата.
В пробирку помещают 2-3 кристаллика ацетата натрия, прибавляют по 3-4 капли концентрированной серной кислоты и этилового спирта. Смесь нагревают 1-2 минуты на водяной бане и выливают содержимое пробирки в стакан с холодной водой – образуется этилацетат, имеющий приятный запах:
2CH3COONa + Н2SO4 = 2CH3COOН + Na2SO4,
CH3COOН + C2Н5OH = CH3COOC2Н5 + Н2O.
Катализирует реакцию добавление к реакционной смеси 1-2 капель нитрата серебра.
3 Контрольные вопросы
1. Напиши уравнения качественных реакции сульфит-ионов.
2. Напиши уравнения качественных реакции тиосульфат-ионов.
3. Напиши уравнения качественных реакции карбонат-ионов.
4. Напиши уравнения качественных реакции фосфат-ионов.
5. Напиши уравнения качественных реакции фторид-ионов.
6. Напиши уравнения качественных реакции оксалат-ионов.
7. Напиши уравнения качественных реакции хлорид-ионов.
8. Напиши уравнения качественных реакции сульфид-ионов.
9. Напиши уравнения качественных реакции тиоцианат-ионов.
10. Напиши уравнения качественных реакции нитрат-ионов.
11. Напиши уравнения качественных реакции нитрит-ионов.
Результаты проведения качественных реакций регистрируют в лабораторном журнале.
Количественный анализ
Лабораторная работа №4. Аналитическая посуда и весы. Основные правила работы с ними
1 Теоретическая часть
В практике количественного анализа для измерения объёма жидкости применяют различную измерительную посуду: мерные колбы, пипетки, бюретки, пробирки, мерные цилиндры.
Мерные колбы рассчитаны на объемы 5, 10, 25, 50, 100, 200, 250, 500, 1000, 2000 см3. Они могут быть калиброваны на вливание и выливание, могут иметь обычную или пришлифованную пробку. Колбы, откалиброванные на вливание, имеют одну, на выливание – две кольцевые отметки: одну на объем вливаемого раствора, вторую – на объем выливаемого раствора, равный номиналу колбы. Это объясняется тем, что при выливании часть раствора остается на стенках колбы.
Навеску твердого вещества пересыпают в мерную колбу через сухую чистую воронку, причем высыпать навеску рекомендуется понемногу во избежание застревания частиц вещества в трубке воронки. Не следует начинать обмывание воронки водой прежде, чем вся навеска из неё не высыплется в колбу. Остатки вещества в воронке тщательно без потерь смывают небольшими порциями воды. После этого заполняют колбу до 1/3 или ½ вместимости растворителем и перемешивают до полного растворения.
Заполнение мерных колб, особенно последними порциями раствора или растворителя, проводят осторожно, по каплям, чтобы не добавить излишки растворителя, до совмещения нижнего края мениска раствора с отметкой на колбе (см. рисунок 1а). В случае окрашенных растворов (см. рисунок 1б) совмещают с отметкой верхний край мениска (нижний плохо виден).
 |
а б
Рисунок 1 – Вид совмещенного края мениска с отметкой на колбе для неокрашенных прозрачных растворов (а), для окрашенных растворов (б)
Бюретки применяют для титрования и отмеривания точных объемов раствора. В зависимости от назначения различают объемные, весовые, газовые, поршневые и микробюретки. В простейшем виде она представляет собой трубку с делениями, в нижней части которой имеется кран или резиновая трубка с капилляром, снабженная зажимом Мора. Бюретки выпускают двух классов точности, отклонение в объеме у бюреток первого класса точности равно половине цены деления, у второго класса – цене деления. Перед работой бюретку промывают титрантом и заполняют её выше нулевой отметки, затем сливают титрант по каплям до совмещения края мениска с нулевым делением. Бюретку устанавливают на нуль только после того, как в носике бюретки или капилляре не осталось пузырьков воздуха. Титровать необходимо от нулевой отметки, от других отметок не рекомендуется, так как шкала может быть неравномерной. Заполнение бюретки титрантом производят через воронку или с помощью специальных приспособлений.
Пипетки предназначены для отмеривания точного объёма выливаемой жидкости. В зависимости от формы, наличия градуировки и объема выпускаются в восьми исполнениях. Из градуированных пипеток можно сливать любой произвольный объём в пределах её емкости. Неградуированные рассчитаны на один строго определенный объем жидкости. Допустимые отклонения объема пипеток зависят от класса точности и равны у пипеток первого класса точности половине цены деления, второго класса – цене деления. Пипетки рекомендуется заполнять растворами с помощью специальных резиновых груш. Пипетка при отборе жидкости должна находиться в строго вертикальном положении, при этом уровень жидкости располагают на уровне глаз наблюдателя. Раствор сливают из пипетки, касаясь её кончиком стенки заполняемого сосуда. Иногда замедляют скорость сливания раствора, закрывая часть верхнего отверстия пипетки пальцем. Выдувать остатки раствора из пипетки нельзя.
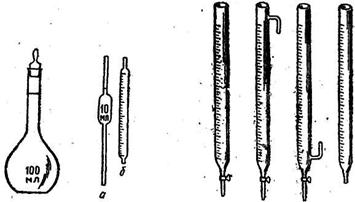 |
Рисунок 2 – Мерная колба; Пипетки; Бюретки
Для не очень точных объёмных измерений применяют цилиндры, мензурки (см. рисунок 3), мерные пробирки.
Цилиндры выпускают с носиком и с пришлифованной пробкой и градуируют на наливание или отливание; допустимые отклонения у первых достигают 1-2% объёма, у вторых – вдвое больше. Мензурки градуируют на отливание, допустимое отклонение у них равно 5% объёма. Мерные пробирки выпускают номинального объёма от 5 до 25 см3, они имеют крайне не высокую точность градуировки. Их используют для отмеривания объёмов растворов вспомогательных веществ, не учитывающихся при вычислении анализа.
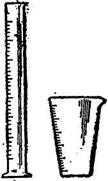 |
Рисунок 3 – Мерные цилиндры и мензурки
Фарфоровая посуда
Кроме стеклянной посуды в лабораторной практике применяется фарфоровая посуда (см. рисунок 4)

1 – чашки; 2 – стаканы; 3 – тигли с крышками; 4 – воронки Бюхнера;
5 – ступки с пестиком; 6 – лодочки; 7 – треугольники.
Рисунок 4 – Фарфоровая посуда
Весы и техника взвешивания
Весы предназначены для измерения массы вещества. В зависимости от требуемой точности в лабораториях пользуются либо техническими или технохимическими, либо аналитическими весами. Технические и технохимические весы позволяют производить взвешивание с погрешностью до ±0,01 г с предельной нагрузкой до десятка килограммов (технические весы) и до 1 кг (технохимические). У аналитических весов различной конструкции предельная нагрузка изменяется от 20 до 200 г и погрешность взвешивания составляет ±0,0001 г.
Технические весы
В лабораторной практике применяют разнообразные технические и технохимические весы. Более совершены последние; они имеют арретирное и балансировочное устройства, повышающие надежность и стабильность показаний весов. К весам прилагается набор гирь, помещенный в футляр, – разновес. Масса гирь-разновесок разная – от 10 мг до 500 г; она обозначена цифрами на каждой гирьке.
Лабораторные технохимические весы Т-200. Перед началом работы весы (см. рисунок 5) устанавливают на ровной поверхности стола по отвесу 6, вращая установочные винты 8, и проверяют правильность работы весов. Для этого поворачивают ручку арретира 9 и наблюдают за колебанием стрелки 5: если она отклоняется вправо и влево на одинаковое число делений, весы работают правильно. Если отклонение в одну сторону немного больше, чем в другую, подвинчивают балансировочные гайки 3 на концах коромысла. Если разница в отклонении вправо и влево значительная, проверяют правильность сборки весов и чистоту их деталей – призм, чашек и т. д.
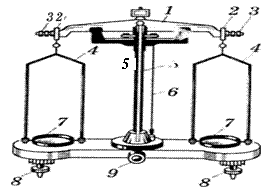 |
1 – коромысло; 2 – серьга; 3 – балансировочные гайки; 4 – стремена;
5 – стрелка; 6 – отвес; 7 – чашки; 8 – установочные винты; 9 – арретир.
Рисунок 5 – Лабораторные технохимические весы Т-200
Взвешиваемый предмет помещают на левую чашку весов, а разновески – на правую. Сначала ставят крупную разновеску, подходящую к массе предмета, затем последовательно заменяют ее или добавляют более мелкие разновески, добиваясь состояния равновесия; при этом разница в колебаниях стрелки вправо и влево не должна быть более одного деления. Подсчитывают массу всех разновесок на чашке, записывают ее и сразу же укладывают гирьки в футляр, еще раз проверяя суммарную массу.
При взвешивании на технических весах следует строго соблюдать общие правила, гарантирующие правильность взвешивания.
1. Все действия с предметом и гирьками можно проводить только при арретированных весах (ручка 9 повернута влево до упора).
2. Нельзя взвешивать предметы, имеющие температуру, отличную от комнатной.
3. Нельзя взвешивать сыпучие вещества непосредственно на чашке весов – следует помещать их в сухой стакан, тигель, бюкс или на часовое стекло.
4. Весы и гирьки необходимо содержать в чистоте и постоянно готовыми к работе.
Аналитические весы
Важными характеристиками аналитических весов являются их чувствительность, а также цена деления шкалы. Чувствительность определяется числом делений шкалы, на которое отклоняется стрелка при нагрузке массой 1 мг, и выражается в делениях шкалы на миллиграмм (дел/мг). С увеличением массы взвешиваемого предмета чувствительность весов уменьшается.
Ценой деления шкалы называют груз, необходимый для смещения стрелки шкалы на одно деление. Цена деления обратно пропорциональна чувствительности весов.
Равновесное положение стрелки ненагруженных весов называют нулевой точкой. При нагруженных весах это положение соответствует точке равновесия. Определение нулевой точки необходимо проводить перед началом каждого взвешивания.
Чтобы получать правильные результаты при взвешивании и не вывести из строя весы, необходимо соблюдать ряд общих правил взвешивания.
1. Перед началом взвешивания проверяют состояние весов и устанавливают нулевую точку так, как это описано в указаниях по технике взвешивания.
2. Взвешиваемый предмет и гирьки помещают на чашки весов, а также снимают их только при закрытом арретире; открывать и закрывать арретир нужно медленно и плавно.
3. Предмет и гирьки помещают в центр чашки. Нельзя взвешивать предмет, имеющий температуру, отличную от температуры весовой комнаты. Разновески берут только пинцетом и ставят не на рабочий стол, а только на весы или в футляр, где они хранятся.
4. Нельзя взвешивать влажные и грязные предметы. Сыпучие вещества нельзя помещать непосредственно на чашку весов или взвешивать на листе бумаги; взвешиваемое вещество должно быть только в бюксе, стаканчике или на часовом стекле. Жидкости, выделяющие пары, а также гигроскопические вещества взвешивают только в закрытом бюксе.
5. Для ускорения взвешивания на аналитических весах рекомендуется предварительное взвешивание на технических весах, с точностью до 0,1 г.
Титриметрический метод анализа
Лабораторная работа №5. Количественное определение вещества методом кислотно-основного титрования
1 Теоретическая часть
Кислотно-основное титрование
Метод основан на реакции между кислотами и основаниями и в общем виде может быть представлен уравнением: H3O+ + ОН– → 2H2O.
|
Метод |
Определяемое вещество |
Рабочий раствор |
Установочное вещество |
|
Ацидиметрия |
Сильные и слабые основания; соли, имеющие щелочную реакцию среды |
HCI; H2SO4 |
Na2B4O7×10H2O; Na2CO3; Реже KIO3; HgO |
|
Алкалиметрия |
Сильные и слабые кислоты; соли, имеющие кислую реакцию среды |
КОН; NaOH |
Н2С2O4×2Н2O; (CH2СООН)2 (кислота янтарная); С6Н5СОOН (кислота бензойная); Реже КHC8H4O4 (калия бифталат); КH(IO3)2 (калия бииодат) |
Возможно, проведение кислотно-основного титрования прямым, обратным и заместительным способом. Прямое титрование в водном растворе возможно в случае определения сильных кислот, щелочей и тех слабых кислот и оснований, константы ионизации которых не слишком малы (К > 10-6), а также для титрования солей слабых кислот или солей слабых оснований с константами ионизации соответствующих слабых протолитов К < 10-8. Метод является фармакопейным методом анализа.
Для определения фактора эквивалентности вещества в кислотно-основном титровании учитывают число атомов водорода, которому эквивалентно определяемое вещество.
Конечную точку титрования определяют визуальным способом с помощью кислотно-основных индикаторов или инструментальными способами, например, потенциометрическим, кондуктометрическим и другими методами.
2 Экспериментальная часть
Реактивы: натрия гидроксид с примесью натрия карбоната (NaOH и Nа2СO3 крист.), кислота хлороводородная (НСl раствор 0,1 н), раствор метилового оранжевого и фенолфталеина (0,1%), кислота борная (Н3ВO3 крист.); натрия гидроксид (NaOH раствор 0,1 н); глицерин, нейтрализованный по фенолфталеину; фенолфталеин (раствор 0,1%).
Посуда и оборудование: установка для титрования; бюретка 25 мл; колба мерная 250 мл; пипетка 10 мл; колбы конические для титрования 250-300 мл; мерный цилиндр; стакан стеклянный мерный, бюкс, воронка, весы аптечные, весы аналитические.
Опыт 1. Определение содержание щелочи и натрия карбоната при совместном присутствии
Твердые щёлочи поглощают из воздуха СO2, превращаясь в соответствующие карбонаты согласно реакции:
2NaOH + CO2 = Na2CO3 + H2O.
Вследствие этого раствор натрия гидроксида всегда содержит примесь Na2СО3.
Определение содержания NaOH и Nа2СO3 при совместном присутствии в растворе основано на титровании смеси кислотой хлороводородной с двумя индикаторами – фенолфталеином и метиловым оранжевым. При помощи фенолфталеина фиксируется тот момент, когда вся щелочь прореагирует по реакции:
NaOH + НСl = NaCl + Н2O,
а натрия карбонат превращается в бикарбонат:
Na2CO3 + HCl = NaHCO3 + NaCl.
После завершения данных реакций происходит обесцвечивание фенолфталеина (ИП 8,2…10): в исследуемом растворе присутствуют NaCl (рН = 7) и NаНСО3 . Бесцветный раствор имеет слабощелочную реакцию за счет гидролиза соли NаНСО3.
![]() .
.
Таким образом, в тот момент, когда нейтрализована вся щелочь до NaCl, а карбонат натрия до NaНСO3, рН раствора будет равна 8,34. При добавлении метилового оранжевого (ИП 3,1…4,4) раствор окрашивается в желтый цвет; при дальнейшем титровании кислотой происходит изменение окраски на розово-оранжевую, что свидетельствует об окончании реакции
NaHCO3 + HCl = NaCl + CO2 + H2O.
По окончании реакции рН раствора можно
рассчитать по формуле: ![]() , т.е. второй точке эквивалентности
соответствует рH
= 4.
, т.е. второй точке эквивалентности
соответствует рH
= 4.
Выполнение работы
В бюкс помещают навеску гранулированного NаОН, содержащего карбонатную примесь, около 1 г, и взвешивают на аналитических весах. Навеску количественно переносят в мерную колбу емкостью 250 мл, растворяют в дистиллированной воде, доводят до метки и перемешивают.
Для трех параллельных определений отбирают пипеткой по 10,00 мл полученного раствора и помещают в колбы для титрования. В каждую колбу вносят 1-2 капли фенолфталеина и титруют стандартным раствором HСl до исчезновения малиновой окраски от одной капли титранта. Фиксируют объем израсходованной кислоты VHCl (ф/ф).
Затем доливают кислоту в бюретку, устанавливают уровень раствора на нулевом делении. К раствору, полученному после титрования с первым индикатором, прибавляют 1-2 капли метилового оранжевого и продолжают титрование до появления оранжево-розовой окраски. Фиксируют объем кислоты, израсходованной на титрование со вторым индикатором VHCl (м/ор). Результаты титрования оформляют в виде таблицы.
|
№ п/п
|
Смесь NaOH и Nа2СO3 |
VHCl , мл |
|||
|
масса капсулы с навеской, г |
масса пустой капсулы, г |
масса навески, г |
ф/ф |
м/ор |
|
|
1 2 3 4 |
|
|
|
V1 V2 V3 Vср |
V1 V2 V3 Vср |
Для расчета берут средние значения из трех параллельных определений.
Примечание: Если расхождение между отдельными определениями объёма титранта превышает 0,2…0,3%, то титрование аликвоты раствора повторяют.
Процентное
содержание NaOH и
Na2CO3 в смеси рассчитывают по формулам:![]()
![]() ;
;
![]() .
.
По результатам определения оформляют протокол.
Опыт 2. Определение содержания кислоты борной
Кислота борная является слабой кислотой (рКа = 9,15), которую невозможно оттитровать в водной среде. С глицерином кислота борная образует комплексное соединение – глицериноборную кислоту, которая проявляет более сильные кислотные свойства (рКа = 7).
Определение основано на алкалиметрическом титровании заместителя, образующегося в результате взаимодействия кислоты борной с глицерином. Используемый в методике глицерин предварительно нейтрализован щелочью. Во избежание затруднений диссоциации глицериноборной кислоты глицерин добавляется частями.
Выполнение работы
Для трёх параллельных определений берут на аналитических весах три навески кислоты борной массой 0,1 г. Каждую навеску количественно переносят в колбу для титрования и растворяют в 10 мл воды, добавляют 20 мл глицерина, предварительно нейтрализованного по фенолфталеину. Раствор перемешивают, добавляют 7 капель фенолфталеина и титруют раствором натрия гидроксида до появления розовой окраски. Затем к титруемому раствору прибавляют еще 5 мл нейтрализованного глицерина, и если розовая окраска при этом исчезает, снова титруют до появления розовой окраски раствора. Добавление глицерина и титрование щелочью продолжают до тех пор, пока от последних 5 мл нейтрализованного глицерина розовая окраска не перестанет исчезать.
Результаты параллельных взвешиваний и титрований оформляют в виде таблицы 3 (стр. 50); рассчитывают среднее значение навески qкислоты и объёма щелочи V. Процентное содержание кислоты борной в препарате рассчитывают по формуле:
![]() ;
;
![]() = 61,83 г/моль.
= 61,83 г/моль.
Результаты анализа оформляют в виде протокола.
3 Контрольные вопросы
1. Приведите примеры прямого, обратного и заместительного кислотно-основного титрования.
2. Каким значением константы ионизации должна обладать кислота или основание для получения удовлетворительных результатов в прямом кислотно-основном титровании? Приведите примеры таких кислот и оснований.
3. Возможно ли прямое кислотно-основное титрование солей в водном растворе: натрия гидрокарбоната, аммония хлорида, натрия ацетата, натрия тетрабората, калия гидрофталата? Приведите возможные уравнения реакций.
4. С какой целью при алкалиметрическом титровании кислоты борной в реакционную смесь добавляется глицерин? Можно ли последний заменить другими веществами?
5. При количественном определении кислоты борной по методике ГФ титрование было закончено без повторного добавления глицерина. Правильно ли выполнено определение? Какая ошибка возможна в этих условиях?
6. С какой целью при алкалиметрическом титровании кислоты борной добавляемый глицерин предварительно нейтрализуют щелочью по фенолфталеину. Какая ошибка возможна, если пренебречь данной рекомендацией?
7. Предложите химизм алкалиметричского определения кислоты борной в присутствии глицерина. Определить молярную массу эквивалента определяемого вещества.
8. Рассчитайте рН в первой и второй точках эквивалентности при ацидиметрическом титровании натрия карбоната. Выберите индикаторы для фиксирования двух точек эквивалентности, кроме предложенных в методике 1.
9. Рассчитайте рН в точке эквивалентности при ацидиметрическом титровании натрия гидрокарбоната. Выберите подходящий индикатор.
10. Неизвестное вещество или их смесь из предложенных в таблице последовательно титруется раствором кислоты хлороводородной с индикаторами фенолфталеин и метиловый оранжевый. Установите соответствие между определяемым веществом и объемом израсходованного титранта, заполнив пустые клетки в таблице:
|
Определяемое вещество |
Объём кислоты хлороводородной |
||
|
с фенолфталеином |
с метиловым оранжевым |
||
|
а) |
NaOH |
V1 |
|
|
б) |
NaHCO3 |
|
V2 |
|
в) |
Na2CO3 |
|
|
|
г) |
NaOH и Na2CO3 |
|
|
|
д) |
NaHCO3 и Na2CO3 |
V3 |
|
11. Неизвестное вещество или их смесь из предложенных в таблице параллельно в двух различных колбах титруется раствором кислоты хлороводородной с индикаторами фенолфталеин и метиловый оранжевый. Установите соответствие между определяемым веществом и объемом израсходованного титранта, заполнив пустые клетки в таблице:
|
Определяемое вещество |
Объём кислоты хлороводородной |
||
|
с фенолфталеином |
с метиловым оранжевым |
||
|
а) |
NaOH |
V1 |
|
|
б) |
NaHCO3 |
|
V2 |
|
в) |
Na2CO3 |
|
|
|
г) |
NaOH и Na2CO3 |
|
|
|
д) |
NaHCO3 и Na2CO3 |
V3 |
|
12. Натрия карбонат определяли ацидиметрически с индикатором фенолфталеин. Предложите формулу для расчета процентного содержания и молярной массы эквивалента карбонат-иона.
13. Соли аммония можно определить обратным кислотно-основным титрованием и формальдегидным методом заместительного кислотно-основного титрования. Предложите химизм реакций, лежащих в основе определения, и формулы для расчета процентного содержания и молярной массы эквивалента иона аммония.
Лабораторная работа №6. Окислительно-восстановительное титрование. Перманганатометрия
1 Теоретическая часть
Перманганатометрическое титрование –
широко используемый фармакопейный метод окислительно-восстановительного
титрования. Калия перманганат является дешевым, легко доступным реагентом.
Титрование перманганатом можно проводить в кислой, нейтральной и щелочной
средах. Наиболее распространена перманганатометрия в кислой среде, в которой
перманганат характеризуется высоким окислительно-восстановительным потенциалом ![]() , что позволяет
определять большое число восстановителей. Кроме того, в кислой среде существует
возможность безындикаторного титрования.
, что позволяет
определять большое число восстановителей. Кроме того, в кислой среде существует
возможность безындикаторного титрования.
В основе перманганатометрических определений лежит полуреакция восстановления перманганата, которая в кислой среде может быть представлена в виде:
MnO![]() + 8H+
+5ē = Mn2+ + 4H2O.
+ 8H+
+5ē = Mn2+ + 4H2O.
В действительности восстановление Mn (VII) в Mn (II) проходит через ряд промежуточных стадий с образованием активного окислителя Mn (III).
В перманганатометрическом титровании прямым методом определяют восстановители с потенциалом менее 1 В (ЭДС 0,4…0,5 В) преимущественно в сернокислой среде. В среде кислоты хлороводородной возможна реакция сопряженного окисления 2Cl– –2ē = Cl2, а азотнокислая среда способствует конкурирующему окислению определяемого восстановителя.
Перманганатометрия – безындикаторный метод титрования, точка эквивалентности фиксируется по появлению розовой окраски от первой избыточной капли окрашенного титранта.
Калия перманганат как сильный окислитель легко восстанавливается органическими восстановителями до MnO2, поэтому твердый перманганат и его растворы содержат примесь диоксида марганца, каталитически ускоряющего разложение KMnO4 согласно реакции:
4KMnO4 + 2H2O = 4MnO2 + 3O2 + 4KOH.
Кроме MnO2, процесс окисления воды ускоряет прямой солнечный свет, нагревание, действие кислот, щелочей, поэтому приготовить титрованный раствор калия перманганата по точной навеске нельзя. Титр его необходимо устанавливать не ранее, чем через 7–10 дней после приготовления раствора. Примесь MnO2, катализирующего разложение перманганата, удаляют фильтрованием. Перед фильтрованием растворы можно прокипятить. Хранить растворы перманганата нужно в склянках темного стекла.
Для стандартизации перманганата в качестве первичных стандартов используют
(NH4)2C2O4·H2O, Na2C2O4, H2C2O4·2H2O, As2O3,
наиболее удобным из которых является не гигроскопичный Na2C2O4, кристаллизующийся без кристаллизационной воды.
Процесс взаимодействия KMnO4 с оксалатом сложен и проходит в несколько стадий с образованием Mn (VI), Mn (IV), Mn (III) и их оксалатных комплексов, поэтому реакция отражает лишь суммарный процесс взаимодействия:
2MnO![]() + 5HC2O
+ 5HC2O![]() + 11H+ = 2Mn2+
+ 10CO2 + 8H2O.
+ 11H+ = 2Mn2+
+ 10CO2 + 8H2O.
Несмотря на большую величину ЭДС реакции, реакция протекает с низкой скоростью, увеличение которой достигается нагреванием до 60…70оС. Сильное нагревание приводит к частичному разложению кислоты щавелевой. Каталитическое влияние на скорость реакции оказывают ионы Mn2+, поэтому по мере их накопления в ходе реакции она ускоряется почти до мгновенного взаимодействия.
Молярная масса эквивалента в перманганатометрии, как и в любом другом методе окислительно-восстановительного титрования, рассчитывается как частное молярной массы окислителя или восстановителя на число переданных одной частицей электронов.
2 Экспериментальная часть
Реактивы: раствор калия перманганата (KMnO4 0,1 н), дигидрат кислоты щавелевой (H2C2O4·2H2O крист.), раствор кислоты щавелевой (Н2C2O4 0,1000 н), раствор кислоты серной (Н2SО4 2 моль/л), гептагидрат железа (II) сульфата (FeSO4 ×7H2O крист.), раствор кислоты фосфорной (H3PO4 6 н), раствор водорода пероксида (Н2О2)
Посуда и оборудование: колбы мерные 100 и 50 мл; установка для титрования; бюретка 25 мл; пипетка 10 мл; колбы конические для титрования 250-300 мл; цилиндры мерные 100 и 50 мл; бюкс; воронка стеклянная; стакан стеклянный мерный; весы аптечные; весы аналитические, водяная баня.
Опыт 1. Стандартизация раствора калия перманганата методом отдельных навесок
Стандартизация раствора KMnO4 основана на титровании точной навески кислоты щавелевой раствором калия перманганата:
2MnO![]() + 5HC2O
+ 5HC2O![]() + 11H+ = 2Mn2+
+ 10CO2 + 8H2O.
+ 11H+ = 2Mn2+
+ 10CO2 + 8H2O.
Выполнение работы
Рассчитывают массу навески дигидрата кислоты щавелевой, на титрование которой будет израсходовано не более 20 мл 0,1 н раствора калия перманганата.
На аналитических весах берут три навески H2C2O4·2H2O; расхождение между вычисленной и взвешенной массой не должно превышать +0,02 г. Каждую навеску растворяют в колбе для титрования в 20–25 мл воды, прибавляют 20 мл 2 моль/л раствора кислоты серной и нагревают на водяной бане до 60–70оС. Устанавливают уровень калия перманганата в бюретке на нуль по верхней границе раствора.
Нагретый раствор кислоты щавелевой титруют калия перманганатом до бледно-розовой окраски, не исчезающей в течение минуты. Первые капли калия перманганата реагируют очень медленно, поэтому титрование вначале надо вести осторожно, прибавляя перманганат по каплям по мере обесцвечивания раствора. Проводят не менее трех параллельных определений. Результаты оформляют в виде таблицы:
|
№ п/п
|
Первичный стандарт H2C2O4·2H2O |
V вторичного стандарта KMnO4, мл |
||
|
масса капсулы с навеской, г |
масса пустой капсулы, г |
масса навески, г |
||
|
1 |
|
|
|
V1 |
|
2 |
|
|
|
V2 |
|
3 |
|
|
|
V3 |
|
|
|
|
|
|
|
|
|
|
qср |
Vср |
Исходя из средней навески H2C2O4·2H2O и среднего объёма KMnO4, затраченного на титрование, рассчитывают N, T и Кп раствора калия перманганата по формулам:
![]() ;
;
![]() ;
;
![]() = 158,3 г/моль;
= 158,3 г/моль;
![]() = 126,06 г/моль.
= 126,06 г/моль.
Результаты анализа оформляют в виде протокола.
Опыт 2. Стандартизация раствора перманганата калия методом пипетирования
Стандартизация раствора KMnO4 основана на титровании аликвоты стандартного раствора кислоты щавелевой раствором калия перманганата.
2MnO![]() + 5HC2O
+ 5HC2O![]() + 11H+ = 2Mn2+
+ 10CO2 + 8H2O.
+ 11H+ = 2Mn2+
+ 10CO2 + 8H2O.
Выполнение работы
В коническую колбу для титрования отмеривают пипеткой 10,0 мл стандартного раствора кислоты щавелевой, прибавляют 10 мл 2 моль/л раствора кислоты серной и нагревают на водяной бане до 60–70оС. Устанавливают уровень калия перманганата в бюретке на нуль по верхней границе раствора.
Нагретый раствор кислоты щавелевой титруют перманганатом до бледно-розовой окраски, не исчезающей в течение минуты. Первые капли калия перманганата реагируют очень медленно, поэтому титрование вначале надо вести осторожно, прибавляя перманганат по каплям по мере обесцвечивания раствора. Определение повторяют не менее трех раз.
Результаты оформляют в виде таблицы:
|
№ п/п |
Объём H2C2O4, мл |
Нормальность H2C2O4, моль/л |
Объём вторичного стандарта KMnO4, мл |
|
1 2 3 |
|
|
V1 V2 V3
Vср |
Исходя из среднего объёма KMnO4, затраченного на титрование, рассчитывают N, T и Кп раствора калия перманганата по формулам:
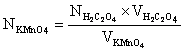 и
и ![]() ;
;
![]() = 158,3 г/моль.
= 158,3 г/моль.
Результаты анализа оформляют в виде протокола.
Опыт 3. Определение содержания железа (II) в гептагидрате железа (II) сульфата
Определение основано на реакции окисления Fe (II) до Fe (III).
MnO![]() + 5Fe2+ + 8H+ = Mn2+
+ 5Fe 3+ + 4H2O.
+ 5Fe2+ + 8H+ = Mn2+
+ 5Fe 3+ + 4H2O.
Для более четкого фиксирования точки эквивалентности, образующиеся в результате титрования ионы Fe3+, имеющие собственную желтую окраску, связывают в бесцветный фосфатный комплекс. За счет связывания Fe3+ уменьшается потенциал редокс-пары определяемого вещества, что приводит к увеличению ЭДС реакции.
Выполнение работы
Рассчитывают навеску FeSO4·7H2O, необходимую для приготовления 50 или 100 мл раствора (по указанию преподавателя). Точную навеску, взвешенную на аналитических весах, переносят в мерную колбу емкостью 50,00 или 100,00 мл. Добавляют в мерную колбу дистиллированной воды до половины объема, 10 мл (в колбу на 100 мл) или 5 мл (в колбу на 50 мл) 2 моль/л раствора кислоты серной, доводят до метки водой и перемешивают.
Отбирают пипеткой в колбу для титрования 10,00 мл полученного раствора, прибавляют 5 мл 6 н H3PO4 и титруют раствором перманганата до появления устойчивого розового окрашивания. Определение повторяют не менее трех раз. Результаты оформляют в виде таблицы 5 (стр. 51).
Расчет процентного содержания железа (II) в гептагидрате проводят по формуле:
![]() ;
;
![]() = 55,84 г/моль,
= 55,84 г/моль, ![]() = 278 г/моль.
= 278 г/моль.
Результаты анализа оформляют в виде протокола.
Опыт 4. Определение содержания водорода пероксида в растворе
Перманганатометрическое определение водорода пероксида основано на реакции:
2MnO![]() + 5H2O2 + 6H+
= 2Mn2+ + 5O2 + 8H2O.
+ 5H2O2 + 6H+
= 2Mn2+ + 5O2 + 8H2O.
При этом пероксид водорода окисляется перманганатом до кислорода:
H2O2 –2ē = O2 + 2H+.
Выполнение работы
Отмеряют пипеткой 10,00 или 5,00 мл исследуемого раствора Н2О2 (по указанию преподавателя) в мерную колбу емкостью 100,00 мл. Доводят дистиллированной водой до метки и перемешивают. Отбирают пипеткой 10,00 мл полученного раствора в колбу для титрования, прибавляют 100 мл воды, 5 мл 2 моль/л раствора H2SO4 и титруют стандартным раствором KMnO4 до розового окрашивания. Определение повторяют не менее трех раз. Результаты оформляют в виде таблицы 4 (стр. 50).
Расчет процентного содержания водорода пероксида в исследуемом растворе в массо-объёмных процентах проводят по формуле:
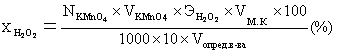 ,
,
![]() = 34,02 г/моль.
= 34,02 г/моль.
Результаты анализа оформляют в виде протокола.
3 Контрольные вопросы
1. Какими химическими процессами, протекающими в растворе, обусловлено изменение нормальности и титра раствора KМnO4? Напишите уравнения соответствующих реакций. Что способствует протеканию этих реакций?
2. Назовите первичные стандартные вещества в перманганатометрии.
3. Укажите и поясните условия (температура, рН, скорость титрования и т.д.), которые необходимо соблюдать при стандартизации раствора KМnO4 по щавелевой кислоте или оксалатам.
4. Почему первые капли титранта при стандартизации KМnO4 по щавелевой кислоте или оксалатам обесцвечиваются медленно, а затем обесцвечивание протекает практически мгновенно?
5. На чем основано фиксирование точки эквивалентности в перманганатометрии? Почему окраска, появляющаяся в точке эквивалентности, исчезает через некоторое время?
6. Какая полуреакция преимущественно лежит в основе перманганатометрических определений? Почему их проводят в сильнокислой среде? Можно ли для создания кислой среды использовать соляную, азотную и уксусную кислоту?
7. Укажите и поясните условия перманганатометрического определения:
а) солей железа (II);
б) водорода пероксида.
8. Как изменится величина скачка в
процессе перманганатометрического титрования ионов
Fe2+ при добавлении в раствор
PO![]() и
F– ионов?
и
F– ионов?
9. Перечислите источники образования MnO2 при хранении и приготовлении титрованных растворов KMnO4. Почему необходимо удалять примесь MnO2 из раствора KMnO4? Каким образом осуществляется эта операция?
10. Приведите химизм перманганатометрического определения:
а) железа в соли Мора;
б) нитритов;
в) кальция в извести;
г) марганца диоксида в пиролюзите;
д) калия дихромата;
е) калия хлората.
Для каждого примера укажите прием титрования, расчетные формулы для определения процентного содержания и молярной массы эквивалентов определяемых веществ.
Лабораторная работа №7. Осадительное титрование. Аргентометрия. Тиоцианатометрия
1 Теоретическая часть
В аргентометрических методах титрантом служит стандартный раствор серебра нитрата, образующий осадки с различными ионами (Cl‑; Br‑; I‑; CN‑; SCN‑ и др.):
Hal‑ + Ag+ = AgHal↓.
Эквивалент в реакциях осаждения – это реальная или условная частица, взаимодействующая с 1 моль однозарядного иона.
Конечная точка титрования может быть установлена различными способами, вошедшими в химическую литературу под именами разработавших их авторов. Существует безындикаторные (метод Гей – Люссака) и индикаторные методы аргентометрии. В качестве индикаторов наиболее часто используются осадительный индикатор K2CrO4 (метод Мора) и адсорбционные индикаторы эозин и флюоресцеин (метод Фаянса).
В любом методе аргентометрии вне зависимости от определяемого иона ‑ галогенида или иона серебра, рекомендуется соблюдать следующий порядок титрования: соли галогенидов титруют раствором AgNO3.
Тиоцианатометрическое титрование (роданометрия) основано на применении осадителя, содержащего SCN‑ ионы:
Ag+ + SCN‑ = AgSCN↓.
Методом тиоцианатометрии определяют ионы серебра, используя стандартные растворы NH4SCN (или KSCN), а также галогенид – ионы с использованием двух стандартных растворов: NH4SCN и AgNO3. Определение галогенид – ионов проводят обратным способом по Фольгарду.
2 Экспериментальная часть
Реактивы: серебра нитрат (раствор AgNO3 0,01 н), натрия хлорид (раствор NaCl 0,0100 н), аммония роданид (раствор NH4SCN 0,0100 н), натрия бромид ( NaBr кр.), раствор новокаина, калия иодид ( KI кр.), ЖАК (раствор NH4Fe(SO4)2 × 12H2O насыщенный), калия хромат (раствор K2CrO4 5%), натрия эозинат (раствор 0,5%), кислота уксусная (раствор СН3СООН 2н и 30%), раствор бромофенолового синего, кислота азотная (раствор HNO3 32%).
Посуда и оборудование: установка для титрования; бюретка 25 мл; колбы для титрования 250 ÷ 300 мл; пипетка 10 мл; мерная колба 100 мл; цилиндры мерные 100 и 50 мл; бюкс; воронка стеклянная; стакан стеклянный мерный; пробирка градуированная мерная; весы аналитические; весы аптечные.
Опыт 1. Стандартизация раствора серебра нитрата по методу Мора методом пипетирования
Стандартизацию проводят с использованием в качестве первичного стандарта раствора натрия хлорида. В точке эквивалентности осадок серебра хлорида приобретает кирпичный цвет за счет осаждения продукта взаимодействия индикатора K2CrO4 c избыточной каплей титранта AgNO3:
NaCl + AgNO3 = AgCl ↓ + NaNO3,
K2CrO4 + 2AgNO3 = Ag2CrO4 ↓ + 2 KNO3.
Выполнение работы
В колбу для титрования помещают 10,00 мл стандартного раствора натрия хлорида (нормальность указана на склянке). Добавляют 2 – 3 капли раствора K2CrO4 и титруют из бюретки раствором AgNO3. Раствор при титровании энергично перемешивают. Титрование заканчивают, когда осадок приобретает слегка красноватый оттенок. Проводят не менее трех параллельных определений. Результаты оформляют в виде таблицы:
|
№ п/п |
VNaCl, мл |
NNaCl, моль/л |
VAgNO3, мл |
|
|
|
|
|
Исходя из среднего объема раствора AgNO3, затраченного на титрование, рассчитывают N, Т и Кп раствора AgNO3.
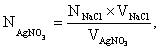
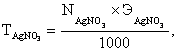
![]() = 169,88 г/моль.
= 169,88 г/моль.
Результаты оформляют в виде протокола.
Опыт 2. Определение содержания натрия бромида методом Фаянса
Определение основано на осаждении бромид-ионов в уксуснокислой среде в присутствии адсорбционного индикатора эозина:
Br‑ + Ag+ = AgBr↓.
После точки эквивалентности в присутствии избыточной капли титранта AgNO3 на поверхности осадка адсорбируются ионы индикатора:
![]() .
.
Выполнение работы
На аналитических весах взвешивают около 0,1 г (точная навеска) натрия бромида, количественно переносят в мерную колбу объемом 100 мл, доводят водой до метки и тщательно перемешивают. В колбу для титрования отбирают пипеткой 10,00 мл полученного раствора, прибавляют 2–3 капли раствора натрия эозината, 5 мл 2 н раствора CH3COOH. Полученную смесь титруют стандартным раствором AgNO3, нормальность которого установлена в работе №1, до перехода розовой окраски в красно-фиолетовую. Проводят не менее трёх параллельных определений. Результаты оформляют в виде таблицы 5 (стр. 51).
Исходя из среднего объема AgNO3, затраченного на титрование, рассчитывают процентное содержание бромида натрия в препарате по формуле:
![]() ;
;
![]() = 102,89 г/моль.
= 102,89 г/моль.
Результаты оформляют в виде протокола.
Опыт 3. Определение содержания калия иодида методом Фольгарда (обратное титрование)
Определение основано на осаждении I‑ – ионов в азотнокислой среде избытком раствора AgNO3, непрореагировавшая часть которого титруется вторым титрантом – аммония тиоцианатом в присутствии комплексообразующего индикатора ЖАК.
I- + Ag+(изб) = AgI↓,
Ag+ + SCN- = AgSCN↓,
Fe(NH4)(SO4)2 + 3NH4SCN = Fe(SCN)3 + (NH4)2SO4.
Выполнение работы
На аналитических весах взвешивают около 0,15 г (точная навеска) калия иодида, количественно переносят в мерную колбу объемом 100 мл, доводят водой до метки и тщательно перемешивают. В колбу для титрования отбирают пипеткой 10,00 мл приготовленного раствора, прибавляют 20,00 мл стандартного раствора серебра нитрата, нормальность которого установлена в работе №1, и 10 мл 32% раствора кислоты азотной. Полученную смесь интенсивно перемешивают, пока осадок AgI не коагулирует и не осядет на дно. Затем добавляют 2 – 3 капли индикатора насыщенного раствора железоаммонийных квасцов. Когда жидкость над раствором станет прозрачной, смесь титруют стандартным раствором аммония роданида при сильном перемешивании до желтовато-розовой окраски. Проводят не менее трёх параллельных определений. Результаты оформляют в виде таблицы 5 (стр. 51).
Исходя из среднего объема аммония роданида, затраченного на титрование, рассчитывают процентное содержание калия иодида в препарате по формуле:
![]() ;
;
![]() = 166,01 г/моль.
= 166,01 г/моль.
Результаты оформляют в виде протокола.
3 Контрольные вопросы
1. Перечислите требования, предъявляемые к реакциям в осадительном титровании.
2. Перечислите стандартные растворы, используемые в аргентометрии.
3. Укажите первичные и вторичные стандартные растворы из числа перечисленных?
4. Назовите способы обнаружения конечной точки титрования в аргентометрии, основанные на образовании окрашенного осадка; комплексного соединения; адсорбционного соединения с осадком.
5. Опишите механизм действия индикатора и условия его применения (pH среды титруемого раствора, необходимая концентрация индикатора и др.) для определения хлоридов по методу Мора.
6. В чём сущность аргентометрического титрования по методу Мора? Для определения каких ионов он применим? Обоснуйте свой выбор.
7. Опишите способ стандартизации титрованных растворов серебра нитрата по методу Мора (установочное вещество, индикатор, pH среды, прием титрования, метод стандартизации).
8. Какой метод аргентометрического титрования целесообразно использовать для определения Br- и Cl- ‑ ионов? Дайте аргументированный ответ.
9. Перечислите распространенные адсорбционные индикаторы и объясните механизм их действия на примере определения бромидов.
10. Сформируйте условия применения адсорбционных индикаторов. Объясните механизм действия данных индикаторов.
11. Почему Cl- – ионы нельзя аргентометрически определять с эозином? С каким индикатором титруют Br- и I- по методу Фаянса?
12. Как связана величина рКа адсорбционного индикатора с интервалом pH, в котором возможно титрование с данным индикатором? Какое значение имеет pH среды при титровании с адсорбционными индикаторами?
13. Почему при титровании с адсорбционными индикаторами эозином и флюоресцеином следует создавать различную рН среды (какую)?
14. Охарактеризуйте метод Фольгарда (титрант, условия титрования, прием титрования, индикатор). Какие ионы могут быть определены с помощью данного метода?
15. Перечислите особенности тиоцианатометрического определения хлоридов. Почему после окончания титрования происходит постепенное исчезновение окраски роданида железа (III)?
16. Объясните механизм действия индикатора ЖАК в прямой тиоцианатометрии. Укажите условия его применения.
17. Какой метод – Мора или Фольгарда, можно предложить для определения Cl- ионов в бария хлориде BaCl2? Дайте аргументированный ответ.
18. Почему недопустимо титрование раствора нитрата серебра галогенидами в методе Мора и Фаянса? Какой порядок титрования используется в данных методах?
19. При определении какого иона (Cl- или Br-) в равных концентрациях погрешность определения по методу Фольгарда будет ниже?
20. Какова роль азотной кислоты в определении галогенидов по методу Фольгарда?
21. Почему при определении иодидов по методу Фольгарда индикатор добавляют после осаждения осадка иодида серебра?
Лабораторная работа № 8. Комплексонометрическое титрование
1 Теоретическая часть
Комплексонометрическое титрование основано на образовании комплексных соединений (комплексонатов) металлоионов с комплексонами – производными аминополикарбоновых кислот. Чаще всего в качестве титранта применяют комплексон III – динатриевую соль этилендиаминтетрауксусной кислоты Na2H2Ү, ЭДТА (торговое название трилон Б), где Ү4- - анион этилендиаминтетрауксусной кислоты ЭДТУ.
 ЭДТА,
обладающий двумя аминогруппами и четырьмя карбоксильными группами, способен к
хелатированию с образованием прочных пятичленных циклов.
ЭДТА,
обладающий двумя аминогруппами и четырьмя карбоксильными группами, способен к
хелатированию с образованием прочных пятичленных циклов.
Независимо от заряда катиона металла стехиометрия реакции между металлоионом и ЭДТА равна 1:1, поэтому наиболее удобным способом выражения концентрации является молярность. Закон эквивалентов, записанный для реакции, лежащей в основе комплексонометрии, принимает форму:
![]() ,
,
где ![]() и
и ![]() – молярные концентрации
раствора трилона Б и раствора определяемого металла.
– молярные концентрации
раствора трилона Б и раствора определяемого металла.
Равновесие реакций комплексообразования зависит от pH раствора, поэтому комплексонометрическое титрование требует создания оптимального значения pH раствора, которое зависит от прочности комплекса и растворимости соответствующего гидроксида металла (см. нижеуказ. табл.).
Минимальное значение рН, обеспечивающее удовлетворительное определение катионов с помощью растворов ЭДТА
|
Катион |
рН |
β |
Уравнение реакции |
|
1 |
2 |
3 |
4 |
|
Sr2+ |
10 |
4,3×108 |
Me2+ + HY3- = MeY2- + H+ |
|
Mg2+ |
10 |
4,9×108 |
|
|
Ca2+ |
8 |
5,0×1010 |
|
|
Mn2+ |
5,8 |
6,2×1013 |
Me+ + H2Y2- = MeY3- + 2H+
Me2+ + H2Y2- = MeY2- + 2H+
Me3+ + H2Y2- = MeY- + 2H+ |
|
Fe2+ |
5,2 |
2,1×1014 |
|
|
Co2+ |
4,6 |
2,0×1016 |
|
|
Al3+ |
4,5 |
1,3×1016 |
|
|
Cd2+ |
4,0 |
2,9×1016 |
|
|
Zn2+ |
3,9 |
3,2×1016 |
|
|
Pb2+ |
3,6 |
1,1×1018 |
|
|
Cu2+ |
3,5 |
6,3×1018 |
|
|
Hg2+ |
2,0 |
6,3×1021 |
Me2+ + H3Y- = MeY2- + 3H+ Me3+ + H3Y- = MeY- + 3H+ |
|
Fe3+ |
1,5 |
1,3×1025 |
Для поддержания заданной величины pH в комплексонометрии используют буферные растворы, которые:
- предотвращают осаждение гидроксидов или основных солей металлов;
- предотвращают смещение равновесия реакции образования комплексонатов влево по мере накопления H+.
Часто используют аммиачный буферный раствор, создающий pH в диапазоне 9 ÷ 10.
Конечную точку титрования устанавливают с помощью металлохромных индикаторов (металлоиндикаторов). Металлоиндикаторы представляют собой органические красители, образующие с ионами титруемого металла интенсивно окрашенные комплексы, цвет которых отличается от окраски свободного индикатора, свойственной ему при данном значении pH.
2 Экспериментальная часть
Реактивы: трилон Б (раствор ЭДТА 0,05 М), аммиачный буферный раствор, индикаторная смесь эриохрома черного Т и хлорида натрия (1:200), магния сульфат (раствор МgSO4 0,0500 М), цинка сульфат (раствор ZnSO4), гексагидрат кальция хлорида (СаСl2×6Н2О крист.).
Посуда и оборудование: установка для титрования; бюретка 25 мл; колба мерная 100 мл; пипетка 10 мл; мерные пробирки 10 мл; колбы конические для титрования 250-300 мл; мерный цилиндр; бюкс; стакан стеклянный мерный; воронка; весы аптечные; весы аналитические.
Опыт 1. Стандартизация раствора трилона Б методом пипетирования
Титрование проводят в среде аммиачного буфера с индикатором – эриохромом черным Т, используя стандартный раствор магния сульфата. Индикатор, существующий при pH = 7÷12 в виде ионов HInd2- синего цвета, после точки эквивалентности образует с избытком MgSO4 комплексы винно-красного цвета менее устойчивые, чем комплексонаты магния:
|
до точки эквивалентности |
H2Y2- + Mg2+ = MgY2- + 2H+ |
βMgY2- = 4,9×108 |
|
после точки эквивалентности |
HInd2- + Mg2+ = MgInd- + H+ синяя форма красный цвет |
βMgInd- = 1,0×107 |
Выполнение работы
10,00 мл раствора трилона Б переносят в колбу для титрования, добавляют 5 мл аммиачного буферного раствора, 0,25 г индикаторной смеси, 50 мл воды и титруют стандартным 0,0500 М раствором магния сульфата до перехода синей окраски в вино-красную.
Проводят не менее трёх параллельных определений. Результаты оформляют в виде таблицы.
|
№ п/п |
Объем раствора трилона Б, мл |
Молярность раствора магния сульфата, моль/л |
Объем раствора магния сульфата, мл |
|
|
|
|
|
Исходя из данных таблицы, рассчитывают молярность, титр и Кп для раствора трилона Б.
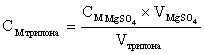 ,
,
Мтрилона Б(Na2H2C10H12O8N2×H2O) = 372,24 г/моль.
Результаты анализа оформляют в виде протокола (стр. 49).
Опыт 2. Определение содержания цинка сульфата в растворе
Определение проводят в среде аммиачного буфера с использованием индикатора эриохрома черного Т стандартным раствором трилона Б. Ионы индикатора HInd2- образуют с ионами Zn2+ комплекс красного цвета:
Zn2+ + HInd2- = ZnInd- + H+
красный
Однако комплекс ZnInd- (β=1012,9) менее прочен, чем комплекс ZnY2- (β=3,2×1016), поэтому в точке эквивалентности происходит разрушение комплекса ZnInd-, сопровождающееся переходом окраски из красной в синюю за счет ионов индикатора HInd2-
ZnInd- + H2Y2- = ZnY2- + HInd2- + H+.
Выполнение работы
Аликвоту (5 или 10 мл) исследуемого раствора цинка сульфата неизвестной концентрации переносят в колбу для титрования, прибавляют 5 мл аммиачного буферного раствора, 0,25 г индикаторной смеси, 50 мл воды и титруют при энергичном перемешивании стандартным раствором трилона Б, молярность которого установлена в ходе стандартизации, до перехода винно-красной окраски в синюю. Проводят три параллельных определения и оформляют результаты в виде таблицы.
|
№ п/п |
V раствора ZnSO4, мл |
Молярность раствора трилона Б, моль/л |
V раствора трилона Б, мл |
|
1 2 3 |
|
|
V1 V2 V3
Vср |
Исходя из данных таблицы, рассчитывают содержание ZnSO4 в растворе в массо-объемных процентах:
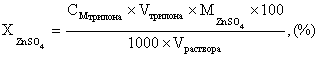 ,
,
где ![]() = 161,45 г/моль,
= 161,45 г/моль,
Vраствора – объем аликвоты исследуемого раствора ZnSO4, мл.
Результаты анализа оформляют в виде протокола.
Опыт 3. Определение содержания кальция хлорида в образце
Определение проводят в среде аммиачного буфера с использованием индикатора эриохрома черного Т стандартным раствором трилона Б. С учетом участия индикатора основные реакции, лежащие в основе определения записываются следующим образом:
Са2+ + HInd2- = СаInd- + H+;
СаInd- + H2Y2- = СаY2- + HInd2- + H+.
Выполнение работы
В бюкс помещают навеску гексагидрата кальция хлорида массой около 0,8 г и взвешивают на аналитических весах. Навеску количественно переносят в мерную колбу емкостью 100 мл, растворяют в дистиллированной воде, доводят до метки и перемешивают.
Для трех параллельных определений отбирают пипеткой по 10,00 мл полученного раствора и помещают в колбы для титрования. В каждую колбу вносят 5 мл аммиачного буферного раствора, 0,25 г индикаторной смеси, 20 мл воды и титруют при энергичном перемешивании стандартным раствором трилона Б, молярность которого установлена в ходе стандартизации, до перехода винно-красной окраски в синюю. Результаты параллельных определений оформляют в виде таблицы.
|
№ п/п |
СаСl2 |
V трилона Б, мл |
||
|
масса бюкса с навеской, г |
масса пустого бюкса, г |
масса навески, г |
||
|
1 2 3 4 |
|
|
|
V1 V2 V3 Vср |
Рассчитывают процентное содержание СаСl2 в образце кристаллогидрата:
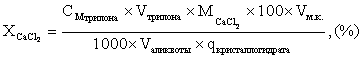 ;
;
Молярная масса СаСl2 × 6Н2О = 219,08 г/моль
Результаты анализа оформляют в виде протокола.
3 Контрольные вопросы
1. В чем заключается ограниченность применения неорганических реагентов в комплексиметрии?
2. Какие органические реактивы называются комплексонами? Перечислите достоинства комплексонов на примере комплексона III.
3. Приведите графическую форму ЭДТА. Какова дентатность ЭДТА? Напишите формулы комплексонатов двух- и трехзарядных металлоионов.
4. Как влияет pH на состав ионизированной формы титранта и индикатора при комплексонометрическом определении катионов с помощью раствора ЭДТА?
5. Приведите примеры определения катионов
а) в среде аммиачного буфера при pH = 9÷11;
б) в кислой среде при pH = 1÷3;
в) в среде ацетатного буфера при pH = 3,5÷6,5.
Напишите уравнения реакций с учетом доминирующей формы ЭДТА и участия индикатора. Предложите подходящий индикатор.
6. Какова роль буферных растворов при комплексонометрическом определении катионов? Какие буферные растворы используются при этом?
7. Почему определение катионов с зарядом +3 и +4 с помощью ЭДТА проводят в кислой среде?
8. Каким образом готовят и стандартизируют рабочие растворы ЭДТА? Перечислите установочные вещества для раствора ЭДТА.
9. Перечислите способы обнаружения конечной точки титрования в комплексонометрии. Приведите примеры индикаторов различных групп.
10. Приведите примеры и объясните механизм действия металлохромных индикаторов в комплексонометрии. С чем связано изменение окраски с красной на синюю (или наоборот) при определении ионов Mg2+, Zn2+, Ca2+ и др. в среде аммиачного буфера с эриохромом черным Т?
11. Что является причиной «блокирования» металлоиндикатора эриохрома черного Т ионами Hg2+, Сu2+, Fe3+? Предложите способ комплексонометрического титрования данных ионов.
12. Охарактеризуйте особенности обратной комплексонометрии (определяемые катионы, требования к комплексонатам определяемого металла и второго титранта, индикаторы) на примере определения катионов Al3+, Cr3+ и др. В каких случаях используют обратное комплексонометрическое титрование?
13. Охарактеризуйте особенности комплексонометрического определения методом замещения на примере катионов Hg2+, Сu2+ и др.
14. Охарактеризуйте особенности
комбинированных методов обратной и заместительной комплексонометрии с
осаждением на примере определения анионов
SO![]() ,
C2O
,
C2O![]() ,
PO
,
PO![]() и
др.
и
др.
Список литературы
1. Булатов М.И. Практическое руководство по физико-химическим методам анализа / М.И. Булатов, И.П. Калинкин. – Л.: Химия, 1986. – 378 с.
2. Васильев В.П. Аналитическая химия: в 2 т. / В.П. Васильев. – М.: Высшая школа, 1989. – Т. 1, 2.
3. Васильев В.П. Сборник вопросов и задач по аналитической химии / В.П. Васильев, Л.А. Калинина и др. – М.: Высшая школа, 1976. – 216 с.
4. Дорохова Е.Н. Аналитическая химия. Физико-химические методы анализа / Е.Н. Дорохова, Г.В. Прохорова. – М.: Высшая школа, 1991. – 256 с.
5. Основы аналитической химии: в 2 кн. / Ю.А. Золотов и др. – М., 1999. – Кн. 1, 2.
6. Задачник по аналитической химии / Н.Ф. Клещев и др. – М.: Химия, 1993. – 221 с.
7. Крешков А.П. Основы аналитической химии: в 3 кн. / А.П. Крешков. – М.: Химия, 1976. – Кн. 1, 2, 3.
8. Лебедева М.И. Лабораторный практикум по физико-химическим методам анализа / М.И. Лебедева, Б.И. Исаева. – Тамбов: Изд-во Тамб. гос. техн. ун-т, 1996. – 105 с.
9. Практикум по аналитической химии / М.И. Лебедева, Б.И. Исаева и др. – Тамбов: Изд-во Тамб. гос. техн. ун-та, 2002. – 79 с.
10. Лурье Н.Н. Справочник по аналитической химии / Н.Н. Лурье. – М.: Химия, 1971. – 453 с.
11. Пилипенко А.Т. Аналитическая химия: в 2 кн. / А.Т. Пилипенко, И.В. Пятницкий. – М.: Химия, 1990. – Кн. 1, 2.
12. Попечителев Е.П. Аналитические исследования в медицине, биологии и экологии / Е.П. Попечителев. – М.: Высшая школа. 2003. – 279 с.
13. Практикум по физико-химическим методам анализа / под ред. О.М. Петрухина. – М.: Химия, 1987. – 245 с.
14. Основы аналитической химии: Учебник для вузов. В 2 кн. / Д. Скуг, Д. Уэст. Перевод с англ. Под ред. Ю.А. Золотова. – М.: Мир, 1979. – 919 с.
15. Справочник по аналитической химии. / Ю.Ю. Лурье. – М.: Химия, 1979. – 480 с.
Содержание
1 Введение 3
Качественный анализ
2 Лабораторная работа №1. Аналитические реакции катионов I-III групп по кислотно-основной классификации 4
3 Лабораторная работа №2. Аналитические реакции катионов IV-VI групп 9
4 Лабораторная работа №3. Аналитические реакции анионов I-III групп 13
Количественный анализ
5 Лабораторная работа №4. Аналитическая посуда и весы. Основные
правила работы с ними 17
6 Лабораторная работа №5. Количественное определение вещества методом
кислотно-основного титрования 22
7 Лабораторная работа №6. Окислительно-восстановительное титрование.
Перманганатометрия 27
8 Лабораторная работа №7. Осадительное титрование. Аргентометрия.
Тиоцианатометрия 32
9 Лабораторная работа №8. Комплексонометрическое титрование 36
10 Список литературы 43
Основной план 2011 г., поз. 13 .