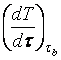Некоммерческое акционерное общество
АЛМАТИНСКИЙ УНИВЕРСИТЕТ ЭНЕРГЕТИКИ И СВЯЗИ
Кафедра физики
СТАТИСТИЧЕСКАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Методические указания
к выполнению лабораторных работ
для студентов всех форм обучения всех специальностей
Алматы 2011
СОСТАВИТЕЛИ: Т.С. Байпакбаев, М. Ш. Карсыбаев, Р.Н. Сыздыкова. Статистическая физика и термодинамика. Методические указания к выполнению лабораторных работ для студентов всех форм обучения всех специальностей. - Алматы: АУЭС, 2011. -32 с.
Методические указания содержат описания восьми лабораторных работ, в которых изложена методика лабораторного эксперимента, описаны экспериментальные установки, указан порядок проведения эксперимента и обработки результатов и контрольные вопросы.
Методические указания предназначены для студентов всех специальностей и всех форм обучения.
Ил. 10, табл. 9, библиогр. - 3 назв.
Рецензент: канд. физ.-мат наук, доц. Л.А. Тонконогая
Печатается по дополнительному плану издания некоммерческого акционерного общества «Алматинский университет энергетики и связи» на 2011г.
© НАО « Алматинский университет энергетики и связи », 2011г.
Введение
Методические указания содержат описания восьми лабораторных работ, которые охватывают основные разделы «Статистической физики и термодинамики»: молекулярно-кинетическую теорию, явления переноса, уравнение состояния идеального газа и термодинамические процессы, первое и второе начала термодинамики, фазовые превращения.
Для осознанного и творческого выполнения работы и обработки результатов эксперимента необходимо:
1) Внимательно прочитать описание лабораторной работы и приведенную литературу.
2) Ознакомиться с приборами и принадлежностями, установленным на стенде и приступить к выполнению лабораторной работы.
3)
Провести наблюдения и отсчеты. Эта часть
работы является наиболее ответственной, и ее
надо проводить очень аккуратно и тщательно,
согласно указаниям, которые даны в каждой работе для измерения и наблюдения данной физической величины. Все
результаты измерений
вносятся
в таблицы записи результатов, приведенные в
конце пункта «Порядок выполнения работы».
4)
Обработать
результаты измерений. Для определения погрешности
измерений
можно использовать статистический метод обработки данных
или
определить приборную погрешность единичного эксперимента.
5) По результатам каждой работы необходимо сформулировать выводы.
1 Лабораторная работа ММФ-10. Определение динамической вязкости жидкости методом Стокса
Цель работы: изучение явления внутренного трения (вязкости) жидкостей.
Задачи:
- ознакомиться с методом Cтокса;
-определить вязкость жидкости (глицерин или касторовое масло) по методу Стокса.
10.1 Методика эксперимента
В данной работе определяется вязкость жидкости методом падающего шарика, так называемым методом Стокса.
При движении тела в вязкой жидкости действует сила сопротивления, обусловленная силами внутреннего трения между слоями жидкости. В этом случае очень тонкий слой жидкости примыкает к поверхности тела и движется с ним как одно целое. Этот слой увлекает в своем движении соседние слои жидкости, которые на некоторый период времени приходят в плавное безвихревое движение (при малых скоростях и размерах тел).
Стокс установил [1], что при небольших скоростях и размерах шариков, сила сопротивления, испытываемая шариком при движении в вязкой жидкости, определяется формулой
![]() , (10.1)
, (10.1)
где
![]() -
динамическая вязкость (или коэффициент внутреннего трения) жидкости;
-
динамическая вязкость (или коэффициент внутреннего трения) жидкости;
![]() - радиус шарика;
- радиус шарика;
![]() - скорость его
движения относительно жидкости.
- скорость его
движения относительно жидкости.
На шарик, падающий вертикально в жидкости (см. рисунок 10.1, а), действуют три силы:
1)
сила тяжести ![]() ,
направленная вниз;
,
направленная вниз;
2)
выталкивающая сила ![]() ,
направленная в верх;
,
направленная в верх;
3)
сила вязкого сопротивления ![]() , направленная в сторону, противоположную
направлению движения шарика, т.е. в верх
, направленная в сторону, противоположную
направлению движения шарика, т.е. в верх
![]() ;
(10.2)
;
(10.2)
![]() ;
(10.3)
;
(10.3)
![]() , (10.4)
, (10.4)
где
![]() и
и ![]() - соответственно массы
шарика и жидкости;
- соответственно массы
шарика и жидкости;
![]() и
и ![]() - их плотности;
- их плотности;
g - ускорение свободного падения.
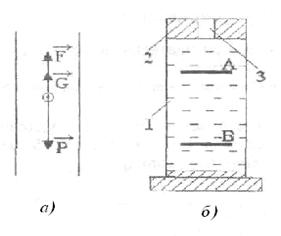
Рисунок 10.1
Первые
две силы по величине постоянны, третья пропорциональна скорости ![]() . Поэтому при
достижении некоторой определенной скорости
. Поэтому при
достижении некоторой определенной скорости ![]() выталкивающая сила и сила сопротивления в
сумме могут уравновесить силу тяжести, вследствие чего шарик начинает двигаться
равномерно. Равнодействующая всех сил при этом станет равной нулю
выталкивающая сила и сила сопротивления в
сумме могут уравновесить силу тяжести, вследствие чего шарик начинает двигаться
равномерно. Равнодействующая всех сил при этом станет равной нулю
![]() . (10.5)
. (10.5)
C учетом (2) - (4) из формулы (5) получим
![]() .
.
Откуда
![]() . (10.6)
. (10.6)
Таким
образом, измерив скорость ![]() равномерного падения шариков в жидкости,
можно определить её динамическую вязкость
равномерного падения шариков в жидкости,
можно определить её динамическую вязкость ![]() по методу Стокса.
по методу Стокса.
10.2 Экспериментальная установка
Установка
(см. рисунок 10.1, б) для определения вязкости по методу Стокса
состоит из стеклянного цилиндрического сосуда 1, наполненного исследуемой
жидкостью и закрытого крышкой 2 с центровочным отверстием 3. На цилиндре
нанесены две горизонтальные риски А и В, расположенные на расстоянии ![]() друг от друга. Верхняя
риска А должна быть на 5 - 8 см ниже уровня жидкости, чтобы установилось
равномерное движение шарика.
друг от друга. Верхняя
риска А должна быть на 5 - 8 см ниже уровня жидкости, чтобы установилось
равномерное движение шарика.
10.3 Порядок выполнения работы
10.3.1 При помощи микрометра тщательно измерить диаметр шарика не менее трех раз и взять среднее значение.
10.3.2 Опустить шарик в жидкость через центровочное отверстие в крышке сосуда.
10.3.3 Измерить время t прохождения шариком расстояния между рисками А и В с помощью секундомера. Опыт провести 3 - 5 раз для разных шариков. Данные измерений занести в таблицу 10.1.
Т а б л и ц а 10.1
|
№ опыта |
|
|
|
м/с |
Па×с |
Па×с |
Па×с |
Па×с |
% |
|
|
|
|
|
|
|
|
|
|
|
10.4 Обработка результатов
10.4.1 Определить скорость равномерного падения шарика по формуле
![]() .
.
10.4.2 Рассчитать
по формуле (10.6) динамическую вязкость ![]() исследуемой жидкости. Результаты
измерений и вычислений занести в таблицу.
исследуемой жидкости. Результаты
измерений и вычислений занести в таблицу.
10.4.3 Оценить
абсолютную и относительную погрешности измерений по методу малых выборок для ![]() .
.
10.4.4 Полученный результат сравнить со справочным значением динамической вязкости и оценить возможные источники погрешностей данного метода.
10.4.5 Проанализировать полученные результаты и сформулировать выводы.
10.5 Контрольные вопросы
10.5.1 В чем состоит сущность метода Стокса?
10.5.2 При каких условиях справедлива формула Стокса?
10.5.3 Каков физический смысл динамической вязкости жидкости?
10.5.4 В каких единицах измеряется динамическая вязкость в системе СИ?
10.5.5 Почему верхняя риска должна находиться на 5 - 8 см ниже уровня жидкости в сосуде?
10.5.6 Каковы возможные источники погрешности метода Стокса?
2 Лабораторная работа ММФ - 11. Определение средней длины свободного пробега и эффективного диаметра молекул воздуха
Цель работы: овладение методом определения средней длины свободного пробега молекул.
Задачи:
- определить среднюю длину свободного пробега молекул воздуха по его вязкости;
- вычислить эффективный диаметр молекул воздуха.
11.1 Методика эксперимента
Процесс столкновения молекул удобно характеризовать величиной эффективного диаметра молекулы. Под ним понимается минимальное расстояние, на которое могут сблизиться центры двух молекул при их столкновении. Расстояние, которое проходит молекула в среднем между двумя последовательными столкновениями, называется средней длиной свободного пробега молекулы.
Молекулярно-кинетическая теория позволила получить формулы, связывающие макроскопические параметры газа (давление, объем, температура) с его микроскопическими параметрами (средние размеры и масса молекул, их средняя скорость, средняя длина свободного пробега и т.д.) [1].
Пользуясь этими формулами, можно на основании измеренных макропараметров газа найти его микроскопические параметры.
В
данной работе определяется средняя длина свободного пробега ![]() молекул воздуха. Из молекулярно-кинетической
теории следует, что вязкость связана со средней длиной свободного пробега
молекулы
молекул воздуха. Из молекулярно-кинетической
теории следует, что вязкость связана со средней длиной свободного пробега
молекулы
![]() ,
(11.1)
,
(11.1)
где ![]() - динамическая вязкость (или коэффициент
внутреннего трения);
- динамическая вязкость (или коэффициент
внутреннего трения);
![]() - плотность газа;
- плотность газа;
![]() - средняя длина
свободного пробега;
- средняя длина
свободного пробега;
![]() - средняя
арифметическая скорость молекул.
- средняя
арифметическая скорость молекул.
Из формулы (11.1) получаем
![]() .
(11.2)
.
(11.2)
Динамическую
вязкость ![]() можно
определить, воспользовавшись известной формулой Пуазейля, выражающей вязкость
через объем
можно
определить, воспользовавшись известной формулой Пуазейля, выражающей вязкость
через объем ![]() газа,
протекающего через сечение трубки за определенное время
газа,
протекающего через сечение трубки за определенное время ![]() при определенной разности
давлений
при определенной разности
давлений ![]() на
ее концах
на
ее концах
![]() ,
(11.3)
,
(11.3)
где
![]() - радиус;
- радиус;
![]() - длина трубки.
- длина трубки.
Плотность идеального газа можно найти из уравнения Клапейрона- Менделеева
![]() ,
(11.4)
,
(11.4)
где
![]() - давление;
- давление;
![]() - абсолютная температура;
- абсолютная температура;
![]() - молярная масса газа;
- молярная масса газа;
![]() - универсальная газовая постоянная.
- универсальная газовая постоянная.
Средняя арифметическая скорость газовых молекул определяется из закона распределения Максвелла
![]() . (11.5)
. (11.5)
Подставляя выражения (11.3), (11.4) и (11.5) в формулу (11.2), получим расчетную формулу для определения средней длины свободного пробега молекул воздуха
 . (11.6)
. (11.6)
Таким
образом, для вычисления средней длины свободного пробега по формуле (11.6)
необходимо знать радиус и длину трубки, через которую протекает воздух,
разность давлений ![]() на
её концах, температуру
на
её концах, температуру
![]() , давление окружающей
среды
, давление окружающей
среды ![]() и
объем
и
объем ![]() газа,
протекающего через трубку за определенное время
газа,
протекающего через трубку за определенное время ![]() .
.
Эффективный
диаметр ![]() молекул
газа связан со средней длиной свободного пробега
молекул
газа связан со средней длиной свободного пробега ![]() соотношением
соотношением
![]() ,
(11.7)
,
(11.7)
где
![]() - число
молекул в единице объема газа.
- число
молекул в единице объема газа.
Из
формулы (11.7) можно найти эффективный диаметр молекул воздуха,
предварительно заменяя в формуле ![]() выражением
выражением
![]() ,
(11.8)
,
(11.8)
где
![]() - число молекул
в единице объема при нормальных условиях (постоянная Лошмидта,
- число молекул
в единице объема при нормальных условиях (постоянная Лошмидта, ![]() ).
).
После замены окончательная формула для эффективного диаметра молекул имеет вид
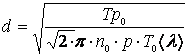 .
(11.9)
.
(11.9)
Здесь
![]() и
и ![]() - давление и температура воздуха при нормальных условиях.
- давление и температура воздуха при нормальных условиях.
11.2 Экспериментальная установка
Установка для выполнения работы (см. рисунок 11.1) состоит из стеклянной трубки 1, имеющей внизу кран 2, а сверху закрытой пробкой, через которую пропущен капилляр 3. Стеклянная трубка на 3/4 заполняется водой. Если открыть кран, вода выливается из трубки отдельными каплями, а над поверхностью воды создается пониженное давление. Таким образом, концы капилляра будут находиться под разным давлением (у верхнего конца давление атмосферное, у нижнего - меньше атмосферного), что обуславливает протекание воздуха через капилляр.
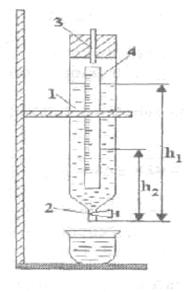
Рисунок 11.1
Так как капилляр очень узок и воздух просачивается через него очень медленно, выравнивания давлений на концах капилляра не произойдет. Для отсчета уровней воды в трубке служит шкала 4, проградуированная в мл.
11.3 Порядок выполнения работы
Предварительно
заполнить стеклянную трубку на 3/4 объема. Приоткрыв кран, добиться того, чтобы
вода из трубки вытекала отдельными каплями. Отметить начальный уровень ![]() воды в трубке (в
момент появления капель), включить секундомер. Измерить конечный уровень воды
воды в трубке (в
момент появления капель), включить секундомер. Измерить конечный уровень воды ![]() и
и
![]() время истечения
10 мл воды.
время истечения
10 мл воды.
Разность давлений на концах капилляра по мере вытекания воды изменяется. Среднее значение этой разности можно определить следующим образом
![]() ,
(11.10)
,
(11.10)
где ![]() - давление над верхним концом капилляра,
равное атмосферному;
- давление над верхним концом капилляра,
равное атмосферному; ![]() - среднее давление у нижнего конца
капилляра.
- среднее давление у нижнего конца
капилляра.
Так
как вода из стеклянной трубки вытекает в атмосферу, то давление ![]() будет
уравновешиваться гидростатическим давлением столба воды в трубке и давлением
будет
уравновешиваться гидростатическим давлением столба воды в трубке и давлением ![]() воздуха над ним. Для
двух разных уровней воды в трубке имеем
воздуха над ним. Для
двух разных уровней воды в трубке имеем
![]() ;
; ![]() ;
(11.11)
;
(11.11)
где
![]() - плотность
воды.
- плотность
воды.
Из формул (11.11) можно найти
![]() .
(11.12)
.
(11.12)
Подставляя (11.12) в (11.10), окончательно получим
![]() .
(11.13)
.
(11.13)
Необходимо также измерить температуру воздуха в лаборатории и атмосферное давление.
Опыт повторить 3-5 раз. Результаты измерений занести в таблицу 11.1.
Т а б л и ц а 11. 1
|
№ опыта |
t, с |
h1, м |
h2, м |
V, м3 |
|
|
|
|
|
d эф, м |
|
|
|
|
|
|
|
|
|
|
|
|
11.4 Обработка результатов
11.4.1
Вычислить среднюю длину ![]() свободного пробега молекул воздуха по
формуле (11.6).
свободного пробега молекул воздуха по
формуле (11.6).
1.4.2
Оценить абсолютную и относительную погрешности измерений по методу малых
выборок для ![]() .
.
11.4.3 Результаты вычислений занести в таблицу.
11.4.4 По формуле (11.9) подсчитать эффективный диаметр молекул воздуха.
11.4.5
Полученные результаты сравнить со справочными значениями ![]() и
d и оценить
возможные источники погрешностей данного метода.
и
d и оценить
возможные источники погрешностей данного метода.
11.4.6 Проанализировать полученные результаты и сформулировать выводы.
11.5 Контрольные вопросы
11.5.1 Что называется средней длиной свободного пробега молекул газа?
11.5.2 Что такое эффективный диаметр молекулы и от чего он зависит?
11.5.3 Как связана вязкость газа со средней длиной свободного пробега молекулы?
11.5.4 В чем состоит сущность данного метода определения средней длины свободного пробега молекул в газе?
11.5.5 При каком условии достигается капельный режим вытекания жидкости из стеклянной трубки?
11.5.6 Чему равен перепад давлений на концах капилляра при капельном режиме вытекания жидкости из трубки?
3 Лабораторная ММФ - 12. Определение показателя адиабаты для воздуха
Цель работы: изучение изопроцессов идеального газа.
Задачи:
- ознакомиться с методом Клемана - Дезорма;
- определить показатель адиабаты для воздуха методом Клемана-Дезорма.
12.1 Методика эксперимента
Определение
показателя адиабаты ![]() в
данной работе производится классическим методом, получившим название метода
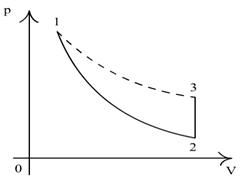
Клемана-Дезорма. Первоначально система (газ) находится в состоянии 1, которое
характеризуется термодинамическими параметрами: температурой
Т1,
давлением р1 и
удельным объемом V1
(объемом единицы массы газа). Совершая адиабатический
процесс расширения, газ переходит в состояние 2 (см.рисунок 12.2) с
параметрами Т2,
р2,V2.
Затем система нагревается при постоянном объеме
V2 до температуры Т3, равной первоначальной
температуре Т1, так что в конечном состоянии параметры равны
Т3,
р3,V3
(Т3=Т1,
V3=
V2). Так как процесс 1-2 является адиабатическим, то
в
данной работе производится классическим методом, получившим название метода
Клемана-Дезорма. Первоначально система (газ) находится в состоянии 1, которое
характеризуется термодинамическими параметрами: температурой
Т1,
давлением р1 и
удельным объемом V1
(объемом единицы массы газа). Совершая адиабатический
процесс расширения, газ переходит в состояние 2 (см.рисунок 12.2) с
параметрами Т2,
р2,V2.
Затем система нагревается при постоянном объеме
V2 до температуры Т3, равной первоначальной
температуре Т1, так что в конечном состоянии параметры равны
Т3,
р3,V3
(Т3=Т1,
V3=
V2). Так как процесс 1-2 является адиабатическим, то
![]() , (12.1)
, (12.1)
где
![]() -
показатель адиабаты для данного газа.
-
показатель адиабаты для данного газа.
В состояниях 1 и 3 газ имеет одну и ту же температуру (процесс изотермический), поэтому, применяя закон Байля -Мариотта, имеем
![]() .
(12.2)
.
(12.2)
Из приведенных соотношений (12.1) и (12.2) нетрудно получить
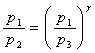 .
(12.3)
.
(12.3)
Отсюда
показатель адиабаты ![]() определяется
определяется
![]() . (12.4)
. (12.4)
Обычно
опыт проводится таким образом, что ![]() равно атмосферному. Тогда давление в
состояниях 1 и 3 можно выразить через
равно атмосферному. Тогда давление в
состояниях 1 и 3 можно выразить через ![]()
![]() ;
; ![]() ,
(12.5)
,
(12.5)
где
![]() и
и ![]() - показания манометра
в делениях его шкалы;
- показания манометра
в делениях его шкалы;
![]() - плотность жидкости в
манометре.
- плотность жидкости в
манометре.
Формулу (12.4) можно представить с учетом (12.5) в следующем виде
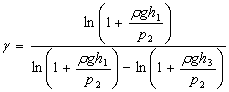 . (12.6)
. (12.6)
Учитывая,
что ![]() и
и ![]() , то
, то ![]() и
и ![]() , и, используя
приближенную формулу
, и, используя
приближенную формулу ![]() при
x<<1, получим формулу для определения показателя адиабаты
при
x<<1, получим формулу для определения показателя адиабаты
![]() .
(12.7)
.
(12.7)
12.2 Экспериментальная установка
Экспериментальная
установка (см. рисунок 12.2) для определения показателя адиабаты методом Клемана
- Дезорма состоит из большого стеклянного баллона 1, соединенного через кран 2
с насосом, с помощью которого накачивают воздух в баллон при этом открытом
кране. Для измерения избыточного давления используется ![]() - образный манометр 3.
Для выпуска воздуха из баллона и соединения его с атмосферой используется еще
один кран 4.
- образный манометр 3.
Для выпуска воздуха из баллона и соединения его с атмосферой используется еще
один кран 4.
12.3 Порядок выполнения работы
12.3.1 При закрытом баллоне (кран 4 закрыт) и открытом кране 2 накачивают воздух в баллон до тех пор, пока разность уровней жидкости в манометре не достигнет 300 - 350 делений (мм).
12.3.2
Закрыв кран 2 и выждав 3-5 минут, пока температура в
баллоне не сравняется с температурой окружающей среды и давление установится
окончательно, произвести отсчет ![]() разности уровней жидкости в манометре.
разности уровней жидкости в манометре.
Отсчет вести по нижнему краю мениска.
 |
12.3.3 Быстро открыть кран 4 на короткое время и закрыть после прекращения шипения выходящего воздуха, что соответствует выравниванию давления внутри баллона с атмосферным.
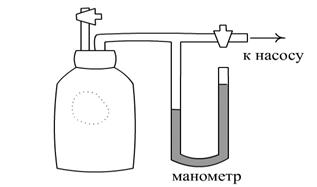
Рисунок 12. 1 Рисунок 12.2
12.3.4 Выждав 3-5 минут, когда воздух в баллоне нагреется до температуры окружающей среды, производят второй отсчет разности уровней жидкости в манометре h3.
12.3.5
Опыт провести 3-5 раз, меняя величину ![]() .
.
12.3.6 Результаты измерений занести в таблицу 12.1.
Т а б л и ц а 12.1
|
№ опыта |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12.4 Обработка результатов
12.4.1 Вычислить по формуле (12.7) показатель адиабаты γ для воздуха.
12.4.2 Оценить абсолютную и относительную погрешности измерений по методу малых выборок для Р=0,95.
12.4.3 Результаты вычислений занести в таблицу 12.1.
12.4.4
Полученный результат сравнить с теоретическим значением ![]() , вычисленным через число
степеней свободы, и оценить возможные источники погрешности данного метода.
, вычисленным через число
степеней свободы, и оценить возможные источники погрешности данного метода.
12.4.5 Проанализировать полученные результаты и сформулировать выводы.
12.5 Контрольные вопросы
12.5.1 Что такое показатель адиабаты?
12.5.2
В чем состоит
сущность метода Клемана - Дезорма, используемого в данной работе для
определения ![]() ?
?
12.5.3 Какой процесс произойдет, если открыть на короткое время кран 4?
12.5.4 Какому уравнению подчиняется адиабатический процесс?
12.5.5 Как изменяются внутренняя энергия и температура газа при адиабатическом процессе?
12.5.6 Какой процесс называется изохорным?
12.5.7 Какому уравнению подчиняется изотермический процесс?
4 Лабраторная работа ММФ-13. Определение отношение изобарной и изохорной теплоемкостей воздуха по скорости звука
Цель работы: овладение методом определения, отношения удельных теплоемкостей воздуха методом стоячих волн.
Задачи:
- изучение явления распространения звука в газах;
- определение скорости звуковых волн;
- определить
отношение ![]() для
воздуха при адиабатическом процессе распространения звуковых волн.
для
воздуха при адиабатическом процессе распространения звуковых волн.
13.1 Методика эксперимента
В данной работе определяется отношение изобарной и изохорной
теплоемкостей ![]() по
методу, основанному на измерении скорости звука в газе.
по
методу, основанному на измерении скорости звука в газе.
В механике выводится следующая формула для скорости распространения звука в газах
![]() ,
(13.1)
,
(13.1)
где
![]() - плотность
газа;
- плотность
газа;
![]() - давление, зависящее
в общем случае не только от
- давление, зависящее
в общем случае не только от ![]() , но и от температуры
, но и от температуры ![]() .
.
Звуковые колебания в газе представляют собой периодические чередования сжатий и разрежений (продольную волну). Как указал Лаплас, колебания плотности и связанные с ним колебания температуры в звуковой волне происходят настолько быстро, а теплопроводность воздуха настолько мала, что для таких процессов теплообмен не играет никакой роли. Разности температур между сгущениями и разрежениями воздуха в звуковой волне не успевают выравниваться, так что распространение звука можно считать адиабатическим процессом.
Рассмотрим, как связаны
между собой параметры, определяющие состояния идеального газа, когда газ
совершает равновесный адиабатический процесс. Так как адиабатический процесс
протекает без теплообмена с окружающей средой
![]() , первое начало термодинамики в этом случае примет вид
, первое начало термодинамики в этом случае примет вид
![]() .
.
Для равновесных
процессов ![]() и
и
![]() , тогда
получим
, тогда
получим
![]() .
.
Из уравнения Клайперона - Менделеева, записанного для одного моля идеального газа
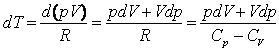 .
.
Исключая
![]() , получим
, получим
![]() .
.
Введем обозначение
![]() ,
(13.2)
,
(13.2)
где ![]() и
и ![]() - соответственно изобарная и изохорная
молярные теплоемкости;
- соответственно изобарная и изохорная
молярные теплоемкости;
![]() -показатель адиабаты.
-показатель адиабаты.
Тогда
![]() .
(13.3)
.
(13.3)
Если в уравнение (13.3) вместо объема ввести плотность
![]() ~
~ ![]() , то оно перейдет в
, то оно перейдет в
![]() ,
(13.4)
,
(13.4)
откуда для адиабатического процесса
![]() .
(13.5)
.
(13.5)
С учетом (13.5) формула для скорости звука в газе, называемая формулой Лапласа, примет вид
![]() .
(13.6)
.
(13.6)
Из
уравнения Клайперона - Менделеева следует ![]() , тогда
, тогда
![]() ,
(13.7)
,
(13.7)
где ![]() - молярная масса газа;
- молярная масса газа;
![]() - его температура.
- его температура.
Из последнего соотношения можно определить отношение
теплоемкостей ![]()
![]() .
(13.8)
.
(13.8)
Скорость звука в газе определяется методом
стоячих волн. Если в некоторой системе сдвиг фаз между падающей и отраженной
волнами составляет ![]() ,
то они при интерференции образуют стоячую волну.
,
то они при интерференции образуют стоячую волну.
В стоячей волне расстояние между соседними узлами или пучностями
![]() . Отсюда
. Отсюда ![]() . С другой стороны
. С другой стороны
![]()
где ![]() - частота звуковых колебаний.
- частота звуковых колебаний.
Сравнивая эти формулы, получим
![]() .
(13.9)
.
(13.9)
Таким образом, измерив расстояние между соседними пучностями или узлами в стоячей волне и зная частоту звуковых колебаний, можно определить скорость звука в газе по формуле (13.9), и затем по формуле (13.8) отношение
 .
.
13.2 Описание экспериментальной установки
Экспериментальная установка (см. рисунок 13.1) для определения скорости звука в воздухе состоит из трубы, на одном конце которой находится источник звукотелефон 3, мембрана которого возбуждается звуковым генератором.
1. Внутри трубы помещается поршень 5, который перемещается при помощи штока. Вблизи телефона располагается приемник–микрофон 4. Электрический сигнал, возникающий в микрофоне под действием звуковых колебаний, подается на вход электронного осциллографа 2.
При установке в трубе стоячей волны (возникновении резонанса) на экране осциллографа будет наблюдаться значительное увеличение амплитуды
колебаний. В данной системе стоячая волна возникает,
если расстояние между источником звуковых волн (телефоном) и поршнем ![]() . Тогда расстояние
. Тогда расстояние
![]() .
(13.10)
.
(13.10)
Настройка на резонанс может быть осуществлена либо перемещением поршня в трубе, либо изменением частоты колебаний генератора.
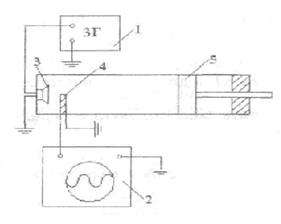
Рисунок 13.1
13.3 Порядок выполнения работы
13.3.1 Включить генератор звуковых частот и электронный
осциллограф. Установить на генераторе необходимую частоту ![]() колебаний;
колебаний;
13.3.2 Установить на экране осциллографа удобный для наблюдения размер изображения, поршень подвинуть возможно ближе к телефону.
13.3.3 Медленно удаляя поршень от телефона, найти расстояние
от микрофона до поршня ![]() , при котором на экране наблюдается
первый максимум амплитуды колебаний. Отодвигая поршень далее, найти
длины
, при котором на экране наблюдается
первый максимум амплитуды колебаний. Отодвигая поршень далее, найти
длины ![]() резонатора
при двух последующих резонансах.
резонатора
при двух последующих резонансах.
13.3.4 Перемещая поршень в обратном направлении, вновь зафиксировать
![]() . Указанный
процесс измерения повторить для 3-5 разных частот.
. Указанный
процесс измерения повторить для 3-5 разных частот.
13.3.5 Результаты измерений занести в таблицу 13.1
Т а б л и ц а 13.1
|
№ Опыта |
Гц |
м |
м |
м |
М |
м/с |
|
< |
|
|
ε, % |
13.4 Обработка результатов измерений
13.4.1
Вычислить по формуле (13.10)
расстояние ![]() и
для каждой частоты найти их средние значения.
и
для каждой частоты найти их средние значения.
13.4.2 Используя формулы (13.9) и (13.8), рассчитать скорость звука и определить отношение теплоемкостей
 .
.
13.4.3 Оценить абсолютную и относительную погрешность измерений по методу малых выборок для Р = 0,95.
13.4.4 Результаты вычислений занести в таблицу 13.1.
13.4.5 Полученный результат сравнить с теоретическим
значением ![]() для
воздуха, вычисленным через число степеней свободы, и оценить возможные
источники погрешностей данного метода.
для
воздуха, вычисленным через число степеней свободы, и оценить возможные
источники погрешностей данного метода.
13.4.6 Проанализировать полученные результаты и сформулировать выводы.
13.5 Контрольные вопросы
13.5.1 Какой процесс называется адиабатическим?
13.5.2 Почему распространение звуковых волн в газе можно считать адиабатическим процессом?
13.5.3 От каких величин зависит скорость звука в газах?
13.5.4 В чем состоит сущность метода, используемого в данной работе?
13.5.5 При каком условии возникает в трубе стоячая волна?
13.5.6 Чему равно расстояние между соседними узлами или пучностями в стоячей волне?
5 Лабораторная работа ММФ-14. Определение изменения энтропии и
кривой нагревания и плавления олова
Цель работы: изучение фазовых переходов первого рода.
Задачи:
- снять зависимость ![]() для олова с помощью термопары;
для олова с помощью термопары;
- построить кривую нагревания и плавления, а также отвердевания и
охлаждения олова;
- определить температуру и удельную теплоту плавления олова;
- вычислить изменение энтропии при плавлении олова.
14.1 Методика эксперимента
Переход твердого вещества в жидкое (плавление) и обратный переход (кристаллизация) относятся к фазовым превращениям первого рода. При этом поглощается или выделяется теплота, называемая теплотой фазового перехода. При фазовом превращении первого рода скачком изменяются плотность, внутренняя энергия, энтропия тела, а сам процесс превращения происходит при строго постоянной температуре при заданном постоянном давлении. Температуру и удельную теплоту плавления можно измерить, если экспериментально определить кривую зависимости температуры вещества от времени при неизменных внешних условиях. Для получения такой зависимости тигель с исследуемым веществом (оловом) помещают в печь и, нагревая его, измеряют через определенные промежутки времени температуру олова в тигле. На рисунке 14.1 приведена характерная кривая плавления при постоянном давлении.
Рисунок 14.1
Участок ab кривой характеризует нагревание вещества до температуры плавления, участок bс –плавления. При постоянной мощности нагревателя печи количество теплоты, передаваемой веществу, зависит от теплопотерь печи в окружающую среду. Теплопотери пропорциональны разности температуры печи и окружающей среды. Поэтому тепловая мощность N, полученная веществом и определенная на участке аb вблизи точки плавления, с большой точностью будет равна тепловой мощности в период плавления
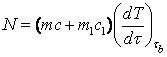 , (14.1)
, (14.1)
где ![]() ,
,
![]() - соответственно массы
олова и тигеля;
- соответственно массы
олова и тигеля;
![]() ,
, ![]() - удельные теплоемкости тигеля и олова;
- удельные теплоемкости тигеля и олова;
![]() - температура олова;
- температура олова;
![]() - время.
- время.
На участке плавления bс
![]() , (14.2)
, (14.2)
где ![]() - время плавления;
- время плавления;
![]() - удельная теплота плавления олова.
- удельная теплота плавления олова.
Из этих соотношений (14.1) и (14.2) можно найти удельную теплоту плавления
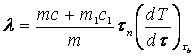 .
(14.3)
.
(14.3)
Если рассматривать процесс нагревания и
плавления вещества как внутренне обратимый квазиравновесный
процесс, то по кривой плавления можно определить
изменение энтропии
![]() системы.
системы.
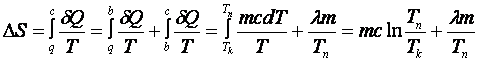 ,
(14.4)
,
(14.4)
где Тк ,Тп - соответственно температуры комнаты и плавления олова.
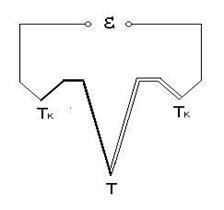
14.2 Описание экспериментальной установки
Схема экспериментальной установки приведена на рисунке 14.2.
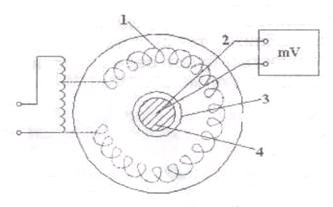
Рисунок 14.2
Экспериментальная установка состоит из электрического нагревателя печи 1, алундового тигеля 3, заполненного исследуемым веществом 4 (оловом). В олово погружается хромель-алюмелевая термопара 2, термо-ЭДС которой измеряется вольтметром. Термопара изготавливается из двух термоэлектродных материалов. При сварке их получается «королек горячего» спая, который располагается в зоне измерения температуры. Термо ЭДС пропорциональна разности температур «горячего» спая и свободных концов термопары, которые должны находиться при одинаковых температурах Тк .
14.3 Порядок выполнения работы
14.3.1 Измерить температуру холодного спая термопары Тк (комнатную температуру) с помощью лабораторного термометра.
14.3.2 С помощью вольтметра измерить термо ЭДС ![]() при начальных
условиях.
при начальных
условиях.
14.3.3 Включить нагреватель печи, одновременно включить секундомер.
14.3.4 Через равные промежутки времени измерять термо ЭДС ![]() термопары.
термопары.
14.3.5 При окончании плавления металла (точка С на кривой) выключить нагреватель и секундомер.
14.3.6
Вновь включить секундомер и через равные промежутки
времени ![]() измерять
термо-ЭДС при процессах охлаждения и отвердевания (кристаллизации)
олова.
измерять
термо-ЭДС при процессах охлаждения и отвердевания (кристаллизации)
олова.
14.3.7 Результаты измерений занести в таблицу 14.1.
Т а б л и ц а 14.1
|
№ Опыта |
c |
Mв |
Тк, K |
Т, K |
Тп, K |
c |
|
N, Вт |
Дж/кг |
Дж/кг |
Дж/К |
14.4 Обработка результатов измерений
14.4.1 Используя градуировочную таблицу хромель - алюмелевой
термопары, построить градуировочную кривую ![]() .
.
14.4.2 Определить температуру олова по градуировочной кривой.
14.4.3 На основании опытных данных построить кривые нагревания и плавления, а также кристаллизации и охлаждения олова.
14.4.4 По формуле (14.1) определить тепловую
мощность ![]() ,
полученную металлом при нагревании. При этом
,
полученную металлом при нагревании. При этом 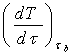 находится по кривой нагревания вблизи
точки плавления (точка в на кривой).
находится по кривой нагревания вблизи
точки плавления (точка в на кривой).
14.4.5 По формуле (14.3) рассчитать удельную теплоту
плавления ![]() олова.
олова.
14.4.6 Определить изменение энтропии ![]() олова в процессе плавления по
формуле (14.4).
олова в процессе плавления по
формуле (14.4).
14.4.7 Результаты вычислений занести в таблицу 14.1.
14.4.8 Сравнить Tn и
![]() со справочными
значениями и оценить возможные источники погрешностей данного метода.
со справочными
значениями и оценить возможные источники погрешностей данного метода.
14.4.9 Проанализировать полученные результаты и сформулировать выводы.
14.5 Контрольные вопросы
14.5.1 Что называется фазовым переходом первого рода?
14.5.2 Что изменяется при фазовом переходе первого рода?
14.5.3 Какие процессы относятся к фазовым переходам первого рода?
14.5.4 Как в данной работе определяются температура и удельная теплота плавления олова?
14.5.5 В чем состоит принцип измерения температуры термопарами?
6 Лабораторная работа ММФ-15. Определение коэффицента вязкости воздуха капиллярным методом
Цель работы: приобретение навыков определения коэффициента вязкости газов капиллярным методом.
Задачи:
- ознакомиться с капиллярным методом определения коэффициента вязкости газов;
- определить коэффициент вязкости воздуха на основе капиллярного метода.
15.1 Методика эксперимента
В данной работе используется капиллярный метод определения коэффициента вязкости газов, основанный на формуле Пуазейля.
Всем реальным жидкостям и газам в большей или меньшей степени присуще внутреннее трение, называемое также вязкостью. Вязкость проявляется в том, что всякое движение, возникшее в жидкости или газе под действием каких-либо внешних факторов, постепенно прекращается при их исчезновении.
Рассмотрим течение вязкой жидкости или газа в круглой трубе. При медленном течении, как показывают измерения, скорость частиц жидкости (газа) изменяется от нуля в непосредственной близости к стенкам трубы до максимума на её оси. Жидкость при этом оказывается как бы разделенной на тонкие цилиндрические слои, которые скользят относительно друг друга, не перемешиваясь. Такое течение жидкости или газа называется ламинарным или слоистым.
Из повседневного опыта следует, что для того, чтобы создать и постоянно поддерживать постоянным течение жидкости (газа) в трубе, необходимо наличие между концами трубы разности давлений. Так как при стационарном течении жидкость движется без ускорения, необходимость сил давления указывает на то, что эти силы уравниваются какими-то силами, тормозящими движение. Этими силами являются силы внутреннего трения (вязкости) на границе со стенкой трубы и на границе между слоями.
Экспериментально
установлено, что модуль силы внутреннего трения,
приложенный к площадке ![]() , лежащей на границе
между слоями, определяется соотношением
, лежащей на границе
между слоями, определяется соотношением
![]() ,
(15.1)
,
(15.1)
|
|
где ![]() - коэффициент
пропорциональности, называемый вязкостью, зависящий от природы и состояния (например,
температуры) жидкости (газа);
- коэффициент
пропорциональности, называемый вязкостью, зависящий от природы и состояния (например,
температуры) жидкости (газа);
![]() - градиент скорости, показывающий изменение скорости на единицу длины в направлении,
перпендикулярном скорости движения слоев.
- градиент скорости, показывающий изменение скорости на единицу длины в направлении,
перпендикулярном скорости движения слоев.
Коэффициент вязкости или просто вязкость зависит от температуры, причем, характер этой зависимости существенно различен для жидкостей и газов. У жидкостей вязкость сильно уменьшается с повышением температуры. У газов, напротив, вязкость с температурой растет. Отличие в характере поведения при изменениях температуры указывает на различие механизма внутреннего трения в жидкостях и газах.
В 1840 г. французский ученый Пуазейль исследовал на опыте
ламинарное течение
жидкостей в очень тонких трубках - капиллярах. Он установил соотношение для
объемного расхода ![]() жидкости,
то есть объема жидкости, протекающего через поперечное сечение капилляра в
единицу
времени
жидкости,
то есть объема жидкости, протекающего через поперечное сечение капилляра в
единицу
времени
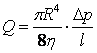 , (15.2)
, (15.2)
которое называется формулой Пуазейля.
Из неё
следует, что расход ![]() очень
сильно зависит от радиуса
очень
сильно зависит от радиуса ![]() капилляра, пропорционален отношению, то есть
перепаду давления на единице
длины трубы, а также обратно пропорционален
капилляра, пропорционален отношению, то есть
перепаду давления на единице
длины трубы, а также обратно пропорционален ![]() вязкости жидкости.
вязкости жидкости.
Формула
Пуазейля используется для определения вязкости жидкостей и газов. Пропуская
жидкость или газ через капилляр известного радиуса
![]() и длиной
и длиной ![]() , измеряют перепад давления
, измеряют перепад давления
![]() и
расход
и
расход ![]() . Затем на основании
полученных опытных данных вычисляют коэффициент вязкости
. Затем на основании
полученных опытных данных вычисляют коэффициент вязкости
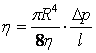 . (15.3)
. (15.3)
В
данной работе формула Пуазейля используется для определения коэффициента вязкости ![]() воздуха.
воздуха.
15.2 Экспериментальная установка
Экспериментальная
установка ФПТ1-1, предназначенная для определения коэффициента вязкости ![]() воздуха, представляет собой
конструкцию из трех основных частей (см.
рисунок
15.1): блока рабочего элемента 1;
приборного блока 2;
стойки 3.
воздуха, представляет собой
конструкцию из трех основных частей (см.
рисунок
15.1): блока рабочего элемента 1;
приборного блока 2;
стойки 3.
На лицевой панели приборного блока 2 находятся органы управления и регулирования установки. Визуально блок разделен на два модуля:
1) модуль питания СЕТЬ с тумблером включения питания и лампой
индикации;
2) модуль ВОЗДУХ с тумблером включения микрокомпрессора, установленного внутри приборного блока, и регулятором расхода воздуха.
На задней панели приборного блока установлены розетка переменного
напряжения ~220 В и сетевые предохранители.
В состав рабочего блока входит рабочий элемент 4, представляющий собой металлический капилляр, закрепленный между отборными камерами. Радиус капилляра - 1 мм, длина - 0,1 м. Через капилляр прокачивается воз-дух от микрокомпрессора, установленного в приборном блоке. Объемный расход воздуха измеряется реометром 5. Перепад давления в капилляре измеряется водным манометром 3, который присоединен к отборным ка- мерам. Стойка 4 представляет собой настольную конструкцию, на которой закреплены вышеперечисленные блоки.
15.3 Порядок выполнения работы
15.3.1 Установить регулятор расхода воздуха на минимум.
15.3.2 Подать на установку питание, включив тумблер на модуле СЕТЬ.
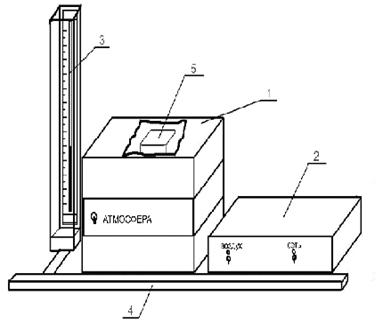
Рисунок 15.1
15.3.3 Плавно вращая регулятор расхода воздуха в модуле ВОЗДУХ, установить
расход ![]() приблизительно
в центре шкалы реометра (примерно
приблизительно
в центре шкалы реометра (примерно ![]() ).
).
15.3.4 Снять показания реометра, то есть расход ![]() воздуха.
воздуха.
15.3.5
Измерить перепад давления ![]() в манометре, соответствующий
данному расходу
в манометре, соответствующий
данному расходу ![]() воздуха.
воздуха.
15.3.6 Опыт провести 5-7 раз, меняя величину расхода Q воздуха.
15.3.7 Результаты измерений занести в таблицу 15.1
Т а б л и ц а 15.1
|
№ опыта |
|
|
|
|
|
e,% |
15.4 Обработка результатов
15.4.1 Вычислить по формуле (15.3)
коэффициент вязкости ![]() воздуха.
воздуха.
15.4.2 Оценить абсолютную и относительную погрешности измерений методом малых выборок P=0,95.
15.4.3 Результаты вычислений записать в таблицу 15.1.
15.4.4 Полученный результат сравнить с
табличным значением вязкости ![]() для воздуха. Оценить возможные источники
погрешностей данного метода.
для воздуха. Оценить возможные источники
погрешностей данного метода.
15.4.5 Проанализировать полученные результаты и сформулировать вывод о точности капиллярного метода определения вязкости воздуха.
7
Лабораторная работа ММФ-16. Определение отношения
![]() теплоемкостей воздуха при
постоянном давлении и объеме методом Клемана и Дезорма
теплоемкостей воздуха при
постоянном давлении и объеме методом Клемана и Дезорма
Цель работы: овладение методом Клемана и Дезорма
и приобретение навыков определения ![]() для газов.
для газов.
Задачи:
- ознакомиться с методом Клемана и Дезорма;
-
определить отношение ![]() для воздуха методом
Клемана и Дезорма.
для воздуха методом
Клемана и Дезорма.
16.1 Методика эксперимента
В данной работе определение отношения Cр/ Cv теплоемкостей воздуха при постоянном давлении и объеме осуществляется классическим методом, предложенным Клеманом и Дезормом.
Для этого используется стеклянный баллон объемом несколько литров,
наполненный газом
при атмосферном давлении (см. рисунок 12.1), при нагнетании
небольшой порции газа
в этот объем, спустя некоторое время, температура ![]() ,
газа в баллоне
сравняется с температурой окружающей среды. При этом
установится давление
,
газа в баллоне
сравняется с температурой окружающей среды. При этом
установится давление ![]() , которое может быть
измерено водяным
манометром.
, которое может быть
измерено водяным
манометром.
Затем при кратковременном сообщении газа в баллоне с
атмосферой, часть его выйдет из него, а давление ![]() в нем сравняется с атмосферным.
При этом газ,
оставшийся в баллоне, адиабатически расширится, совершив
работу против сил давления
окружающего воздуха. Вследствие этого его
температура понизится до некоторого значения
в нем сравняется с атмосферным.
При этом газ,
оставшийся в баллоне, адиабатически расширится, совершив
работу против сил давления
окружающего воздуха. Вследствие этого его
температура понизится до некоторого значения ![]() . Далее в закрытом
баллоне в результате теплообмена газ
начинает медленно нагреваться, пока его температура
. Далее в закрытом
баллоне в результате теплообмена газ
начинает медленно нагреваться, пока его температура ![]() , не сравняется с температурой
окружающего воздуха, давление при этом
повысится до
, не сравняется с температурой
окружающего воздуха, давление при этом
повысится до ![]() .
По
измеренным значениям давления
в
баллоне можно
вычислить отношение теплоемкостей Сp /СV .
.
По
измеренным значениям давления
в
баллоне можно
вычислить отношение теплоемкостей Сp /СV .
Для этого
мысленно выделим внутри баллона произвольную порцию газа, ограниченную замкнутой оболочкой (см.рисунок 12.1).
Проанализируем все
рассмотренные выше процессы, происходящие
с данной порцией (массой) газа. В различных
процессах газ, заключенный в эту оболочку, будет расширяться и сжиматься, совершая работу против сил давления окружающего газа и обмениваясь с ним теплотой. Так
как кинетическая энергия возникающего
макроскопического движения невелика, эти процессы могут рассматриваться
как квазистатические или равновесные, В момент отсчета давления параметры,
характеризующие состояние газа внутри
«оболочки»,
имеют следующие значения. Вначале данная масса газа находится в состоянии 1: (см.
рисунок
12.2), которое характеризуется
термодинамическими параметрами:
температурой ![]() , давлением
, давлением
![]() и
объемом
и
объемом ![]() . Совершая адиабатический процесс
расширения, газ переходит в состояние 2 с параметрами
. Совершая адиабатический процесс
расширения, газ переходит в состояние 2 с параметрами
![]() ,
,
![]() ,
, ![]() . Затем система нагревается
при
постоянном объеме до
температуры
. Затем система нагревается
при
постоянном объеме до
температуры ![]() , равной первоначальной температуре
, равной первоначальной температуре ![]() , так что в конечном состоянии параметры равны
, так что в конечном состоянии параметры равны ![]() ,
,
![]() ,
V3 . (
,
V3 . (![]() =
= ![]()
![]() =
= ![]() ).
).
Далее теория эксперимента расматриваетсяя анологично лабораторной работе ММФ 12 (см. рисунок 12.1 ).
Таким образом, получили формулу для показателя адиабаты
 .
(16.1)
.
(16.1)
Поскольку опыт проводится таким образом, что давление равно
атмосферному, давления в состояниях 1 и 3 можно выразить через
![]() .
.
![]() ,
(16.2)
,
(16.2)
где ![]() и
и ![]() показания
водяного манометра, как избыточное под атмосферным давлением
показания
водяного манометра, как избыточное под атмосферным давлением ![]() . С учетом (16.2) получим:
. С учетом (16.2) получим:
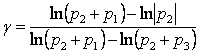 . (16.3)
. (16.3)
Так как избыточные давления ![]() и
и
![]() гораздо
меньше атмосферного
гораздо
меньше атмосферного
![]() ,
то разности логарифмов можно принять пропорциональными разностям
самих давлений и приближенно положить
,
то разности логарифмов можно принять пропорциональными разностям
самих давлений и приближенно положить
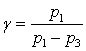 . (16.4)
. (16.4)
Таким
образом, показатель адиабаты ![]() , равный отношению теплоемкостей газа при постоянном
давлении и объеме, можно определить по формуле (16.4) методом Клемана и Дезорма - методом адиабатического расширения
газа.
, равный отношению теплоемкостей газа при постоянном
давлении и объеме, можно определить по формуле (16.4) методом Клемана и Дезорма - методом адиабатического расширения
газа.
16.2 Экспериментальная установка
Экспериментальная установка ФПТ1-6 (см.рисунок 15.1) предназначена для определения отношения Сp /СV, т.е. теплоемкостей воздуха при постоянном давлении и объеме, представляет собой конструкцию, состоящую из четырех основных частей:
блока рабочего элемента 1;
приборного блока 2;
водяного манометра 3;
стойки 4.
На лицевой панели приборного блока 2 находятся органы управления и регулирования установки. Визуально блок разделен на два модуля:
1) модуль питания СЕТЬ с тумблером включения питания микрокомпрессора и лампой индикации;
2) модуль ВОЗДУХ с тумблером включения микрокомпрессора для подачи воздуха в блок рабочего элемента 1 и лампой индикации.
Внутри приборного блока 2 установлен микрокомпрессор. На задней панели этого блока установлены розетка –220 B и сетевые предохранители.
Блок рабочего элемента включает в себя стеклянный баллон 5. Для подключения баллона в пневмоцепь имеются выводные штуцера. На лицевой панели приборного блока 1 установлен пневмотумблер АТМОСФЕРА для сброса воздуха в атмосферу. Водяной манометр 3 предназначен для измерения избыточного давления в баллоне 5. В верхней части манометра расположена ловушка для воды. Стойка 4 представляет собой настольную конструкцию, на которой закреплены вышеперечисленные блоки.
16.3 Проведение эксперимента
16.3.1 Подать на установку питание, включив тумблер в модуле СЕТЬ.
16.3.2 Включить подачу воздуха в стеклянный баллон блока рабочего элемента тумблером ВКЛ в модуле ВОЗДУХ. (НЕ БОЛЕЕ 20 СЕКУНД !)
16.3.3 По манометру проконтролировать рост избыточного давления в рабочем элементе. При достижении разностей уровней воды в манометре (избыточного давления) значения порядка 3000-3500 Па отключить подачу воздуха.
16.3.4 Выждать несколько минут, после
стабилизации давления снять показания манометра ![]() .
.
16.3.5 Переключить пневмотумблер АТМОСФЕРА для сброса воздуха в окружающую среду и оставить в таком положении, пока давление в баллоне рабочего элемента не сравняется с атмосферным. При этом показание манометра будет нулевым.
16.3.6 После стабилизации процесса
(через несколько минут), когда воздух в баллоне нагреется до температуры
окружающей среды (комнатной температуры), произвести второе измерение
избыточного давления ![]() .
.
16.3.7 Опыт провести 5-7 раз, меняя
величину ![]() .
.
16.3.8 Результаты измерений занести в таблицу 1.
Т а б л и ц а 16.1
|
№ опыта |
Па |
Па |
|
|
|
|
|
16.4 Обработка результатов
16.4.1 Вычислить по формуле (16.4) отношение 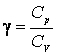 для воздуха.
для воздуха.
16.4.2 Оценить абсолютную и относительные погрешности измерений по методу малых выборок для Р=0,95.
16.4.3 Результаты вычислений занести в таблицу 16.1.
16.4.4 Полученный результат сравнить с теоретическим, вычисленным по классической теории теплоемкости идеального газа . Оценить возможные источники погрешностей данного метода.
16.4.5 Проанализировать полученные результаты и сформулировать выводы о точности метода Клемана и Дезорма.
16.5 Контрольные вопросы
16.5.1 Что такое показатель адиабаты
![]() ?
?
16.5.2 В чем состоит сущность метода Клемана и Дезорма, используемого в данной работе?
16.5.3 Какой процесс произойдет при включении пневмотумблера для сброса воздуха в окружающую среду?
16.5.4 Какому уравнению подчиняется адиабатический процесс?
16.5.5 Объясните, почему при адиабатическом расширении газа внутренняя энергия и температура понижаются?
16.5.6 На каком этапе в данной работе наблюдается изохорное нагревание воздуха в баллоне?
16.5.7 Какому уравнению подчиняется изохорный процесс?
16.5.8 Что такое изотермический процесс и какому уравнению он подчиняется?
16.5.9 Что измеряют с помощью манометра в данной работе?
8 Лабораторная работа ММФ – 17. Изучение фазовыхпереходов первого рода
Цель работы: овладение методом определения удельной теплоты фазового перехода и методом расчета изменения энтропии при фазовых переходах первого рода.
Задачи:
- получить диаграммы нагревания и плавления, охлаждения и кристаллизации образца;
- определить температуру и удельную теплоту плавления материала образца;
- вычислить изменение энтропии при нагревании и плавлении образца.
17.1 Теория и методика эксперимента
Фазовым превращением (или переходом) называется процесс, в результате которого свойства тела меняются скачком. При фазовом превращении первого рода скачком изменяются плотность, внутренняя энергия, энтропия тела. При этом выделяется или поглощается энергия, называемая теплотой фазового перехода. Примерами фазовых превращений могут служить плавление - переход твердого (кристаллического) состояния в жидкое, и обратный переход - затвердевание (кристаллизация). При заданном давлении фазовое превращение первого рода происходит при постоянной температуре.
В данной работе зависимость температуры расплавляемого образца от времени при неизменных внешних условиях. С этой целью тигель с исследуемым веществом помещают в печь и, нагревая его, измеряют через определенные промежутки времени температуру вещества в тигле.
На рисунке 14.1 (лабораторная работа ММФ 14) изображена примерная диаграмма нагревания и плавления кристаллического вещества. Участок ab на этой диаграмме характеризует нагревание образца до температуры плавления; участок bc соответствует плавлению.
Далее теория экспериментарасматривается анологично лабораторной работе ММФ 14 ( см. рисунок 14.1 ).
17.2 Экспериментальная установка
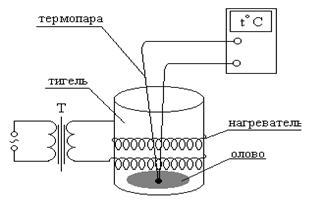
Схема лабораторной установки приведена на рисунке 17.1. Установка состоит из электрического нагревателя (печи), провод которого обвивает цилиндрической формы алундовый тигель, заполненный оловом, а точнее - сплавом олова со свинцом (т.н. припой).

В качестве
термометра, находящегося в непосредственном контакте с исследуемым веществом,
используется термопара вместе с цифровым мультиметром. Термопара изготавливается
из двух разнородных проводников. При их сварке получается «королек горячего»
спая, который приводят в контакт с испытуемым телом. Возникающая термо ЭДС
пропорциональна разности температур Т «горячего» спая и
свободных концов («холодных» спаев) ![]() термопары. Ее измеряют при
помощи милливольтметра (см. рисунок 17.2). В данной установке роль «холодных» спаев
выполняют контакты проводов термопары с клеммами измерительного прибора
(цифрового мультиметра) , который имеет комнатную температуру. Благодаря
наличию в устройстве прибора биметаллической пластины, позволяющей определить
комнатную температуру, и микропроцессора, который пересчитывает величину
термо ЭДС в температуру «горячего» спая термопары, погруженного в олово, с учетом комнатной температуры, на дисплее прибора высвечивается
температура олова в градусах Цельсия.
термопары. Ее измеряют при
помощи милливольтметра (см. рисунок 17.2). В данной установке роль «холодных» спаев
выполняют контакты проводов термопары с клеммами измерительного прибора
(цифрового мультиметра) , который имеет комнатную температуру. Благодаря
наличию в устройстве прибора биметаллической пластины, позволяющей определить
комнатную температуру, и микропроцессора, который пересчитывает величину
термо ЭДС в температуру «горячего» спая термопары, погруженного в олово, с учетом комнатной температуры, на дисплее прибора высвечивается
температура олова в градусах Цельсия.
17.3 Проведение эксперимента
Измерить
с помощью цифрового мультиметра начальную (комнатную) температуру ![]() образца.
образца.
17.3.1 Включить печь и одновременно секундомер. Через равные промежутки времени, сначала через одну минуту, а при достижении 1800 - через каждые полминуты снимать показания термометра.
17.3.2 После того, как олово расплавится, а затем температура расплава достигнет примерно 2200 С, выключить печь и продолжать фиксировать в том же порядке температуру образца, вплоть до кристаллизации и далее до охлаждения образца.
17.3.3 Полученные данные занести в таблицу 17.1.
Т а б л и ц а 17.1
|
|
0 |
1 |
2 |
... |
|
t
,0 |
|
|
|
|
|
T, К |
|
|
|
|
17.4 Обработка результатов
17.4.1
Полученные данные нанести на график, при этом по горизонтальной оси отложить
время ![]() , а по
вертикальной - температуру Т.
, а по
вертикальной - температуру Т.
17.4.2 По графику определить температуру плавления ![]() , время плавления D
, время плавления D![]() и скорость нагрева
и скорость нагрева ![]() вблизи точки плавления. Для
этого выделить прямолинейный возрастающий участок диаграммы вблизи точки
плавления; определить по диаграмме соответствующие этому участку приращения
температуры D
вблизи точки плавления. Для
этого выделить прямолинейный возрастающий участок диаграммы вблизи точки
плавления; определить по диаграмме соответствующие этому участку приращения
температуры D![]() и времени D
и времени D![]() ; вычислить скорость нагревания образца:
; вычислить скорость нагревания образца: ![]() »
»![]() .
.
17.4.3 Вычислить тепловую мощность, подводимую к тиглю с образцом, по формуле (14.1).
17.4.4 Вычислить
удельную теплоту ![]() плавления
олова по формуле (14.3).
плавления
олова по формуле (14.3).
17.4.5 Определить
изменение энтропии D![]() при нагревании и плавлении
олова по формуле (14.4).
при нагревании и плавлении
олова по формуле (14.4).
17.4.6 Результаты вычислений занести в таблицу 17.2.
Т а б л и ц а 17.2
|
|
|
D |
|
|
|
D |
|
|
|
|
|
|
|
|
17.4.7
Сравнить полученные в эксперименте ![]() и
и ![]() олова со справочными
значениями.
олова со справочными
значениями.
17.4.8 Проанализировать возможные источники погрешностей данного метода и сформулировать выводы.
17.5 Контрольные вопросы
17.5.1 Что называется фазовым переходом первого рода?
17.5.2 Что изменяется при фазовом переходе первого рода?
17.5.3 Какие процессы относятся к фазовым переходам первого рода?
17.5.4 Как в данной работе определяются температура и удельная теплота плавления олова?
17.5.5 В чем состоит принцип измерения температуры термопарами?
17.5.6 При каком допущении можно рассчитать изменение энтропии олова в данной работе?
Список литературы
1. Савельев И.В. Курс физики. Т 1. - М.: Наука, 1989.
2. Детлаф А.А., Яворский Б.М. Курс физики. - М.: Высшая школа, 1989.
3. Трофимова Т.И. Курс физики. - М.: Высшая школа, 1998, 2000.
Содержание
Введение
1 Лабораторная работа ММФ-10. Определение вязкости жидкости методом Стокса 4
2 Лабораторная работа ММФ-11. Определение средней длины свободного пробега и эффективного диаметра молекул воздуха 6
3 Лабораторная работа ММФ-12. Определение показателя адиабаты для воздуха 10
4 Лабораторная работа ММФ-13. Определение отношения изобарной и изохорной теплоемкостей воздуха по скорости звука 13
5 Лабораторная работа ММФ-14. Определение изменения энтропии и кривой нагевания и плавления олова 17
6 Лабораторная работа ММФ-15. Определение коэффициента вязкости воздуха капиллярным методом 21
7
Лабораторная работа ММФ-16. Определение отношения ![]() теплоемкостей воздуха при постоянном
давлении и объеме методом Клемана и Дезорма 24
теплоемкостей воздуха при постоянном
давлении и объеме методом Клемана и Дезорма 24
8 Лабораторная работа ММФ-17. Изучение фазовых переходов первого рода 28
Список литературы 31
Св. план 2011г., поз. 55