1.2.6 Дистилляционные и ректификационные установки
Дистилляцией
и ректификацией называются термические процессы разделения смеси жидкостей на
составляющие их части.
Дистилляция
и ректификация представляют собой процесс перегонки, в котором кипящая смесь
выделяет пары, содержащие те же компоненты, что в смеси, но в другой пропорции.
Перегонка применяется в нефтеперерабатывающей, химической, коксохимической,
пищевой и других отраслях.
При
дистилляции перегонка осуществляется с полной конденсации паров. Ректификация
представляет собой процесс перегонки с многократной частичной конденсацией
паров.
Наиболее
просто осуществляется перегонка бинарных смесей: взаимонерастворимых, полностью
или частично растворимых.
К
взаимонерастворимым смесям, например, относится смесь воды и бензола С6Н6.
Для
такой смеси парциальные давления компонентов в газовой фазе равны давлению
насыщенного пара чистого компонента при температуре кипения смеси. Зависимость
температуры кипения смеси можно представить следующим образом (рисунок 1.83)
Полное
давление газовой фазы над бинарной смесью по закону Дальтона равно:
![]() бар. (1.193)
бар. (1.193)
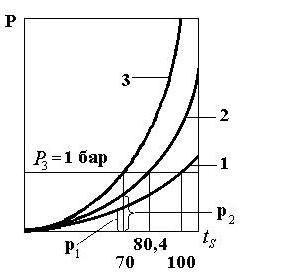
Как видно из графика, температура кипения
смеси (70°С) меньше температуры кипения каждого из компонентов.
1 – бензол, 2 – вода, 3 – смесь
Рисунок 1.83 – Температурные характеристики бинарной
смеси
Соотношение компонентов „а” и „в” в газовой фазе может определяться по закону Авогадро, согласно
которому количество молей п газового
компонента пропорционально его парциальному давлению над жидкостью:
![]() и
и ![]() , (1.194)
, (1.194)
где ![]() - масса и
молекулярный вес i-того компонента („а” или „в”).
- масса и
молекулярный вес i-того компонента („а” или „в”).
Из
совместного решения уравнений 1.194 получаем:
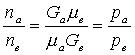 . (1.195)
. (1.195)
Состав
газовой фазы в процентах:
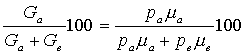 . (1.196)
. (1.196)
Для
рассматриваемой смеси:
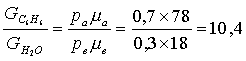 . (1.197)
. (1.197)
Это означает, что независимо от содержания бензола в смеси в газовом объеме на 1 часть водяных паров приходится примерно 10 частей паров бензола.
Температура
кипения смеси остается постоянной, вплоть до полного испарения одного из
компонентов. Содержание компонентов в паровой фазе также остается неизменной
вплоть до полного испарения одного из компонентов в жидкой смеси.
В
смеси со взаиморастворимыми компонентами парциальное давление газов в газовой
смеси подчиняется закону Рауля:
![]() , (1.198)
, (1.198)
где ![]() - давление
насыщения компонента „а” при данной
температуре;
- давление
насыщения компонента „а” при данной
температуре;
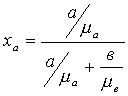 - молекулярная доля
компонента в жидкой смеси;
- молекулярная доля
компонента в жидкой смеси;
а - вес компонента.
Полное давление паров над бинарной жидкостью
равно:
![]() . (1.199)
. (1.199)
Молекулярная
доля компонента „а” в газовой фазе ![]() отличается от доли
компонента в жидкой смеси:
отличается от доли
компонента в жидкой смеси:
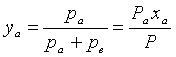 . (1.200)
. (1.200)
Соотношение паров в газовой фазе и в бинарной жидкой смеси:
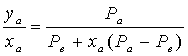 . (1.201)
. (1.201)
Если
компонент „а” является летучим
компонентом смеси (![]() ), то
), то ![]() , то есть содержание летучего компонента в парах больше
содержания его в жидкости.
, то есть содержание летучего компонента в парах больше
содержания его в жидкости.
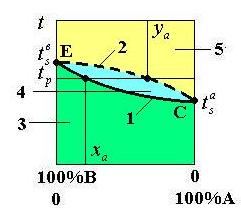
Графически связь температуры кипения, состава жидкости и образующихся паров
при данном давлении представлена на диаграмме кипения и конденсация, которая
называется фазовой диаграммой (рисунок 1.84).
1 – линия кипения жидкой смеси, 2 – линия
сухого насыщенного пара,
3 – область жидкости, 4 – область влажного пара, 5 – область
перегретого пара
Рисунок 1.84 – Фазовая диаграмма жидкой смеси
При
температуре раствора, равной ![]() , содержание компонента „а”
в паре больше, чем в жидкости (
, содержание компонента „а”
в паре больше, чем в жидкости (![]() ). Это означает, что происходит преимущественное испарение
компонента „а”.
). Это означает, что происходит преимущественное испарение
компонента „а”.