АЛМАТИНСКИЙ ИНСТИТУТ ЭНЕРГЕТИКИ И СВЯЗИ
Кафедра промышленной теплоэнергетики
ХИМИЯ
Методические указания к выполнению лабораторных работ
для студентов всех форм обучения специальности
050717- Теплоэнергетика
СОСТАВИТЕЛИ: К.С.Идрисова, А.А.Туманова. Химия. Методические указания к выполнению лабораторных работ для студентов всех форм обучения специальности 050717- Теплоэнергетика
Методические указания к выполнению лабораторных работ по химии предназначены для бакалавров специальности 050717- Теплоэнергетика и подготовлены в соответствии с образовательным стандартом для технических направлений по курсу «Химия».
Введение
Методические указания к выполнению лабораторных работ предназначены для бакалавров специальностей, изучающих химию в объеме трех кредитов. Цель - оказать помощь в подготовке к экзамену, промежуточному и текущему контролю по химии.
Содержание методических указаний соответствует учебной программе курса химии и состоит из 10 лабораторных работ, включающих основные разделы общей химии и электрохимии.
Лабораторные работы являются одной из важнейших составных частей курса химии. Для их выполнения студенту необходимо ознакомиться с лабораторным оборудованием, измерительными приборами, а также с техникой проведения основных лабораторных операций.
Поскольку в химической лаборатории находятся электроприборы, газ, ядовитые и огнеопасные вещества, студенты должны строго соблюдать правила внутреннего распорядка и техники безопасности.
Перед каждым лабораторным занятием студент должен изучить соответствующий раздел учебника, конспекта лекций и описание лабораторной работы.
При оформлении отчета по проделанной работе в лабораторном журнале записывают: дату, номер, название работы и опыта; конспект экспериментальной части; результаты, полученные при ее выполнении, ответы на контрольные вопросы.
Многие опыты выполняются студентами индивидуально: каждый получает задание и оформляет отчет по своим результатам, что развивает у студентов самостоятельность в решении поставленных задач.
1 Лабораторная работа № 1. Классы неорганических соединений
Цель работы: ознакомиться с классами неорганических соединений, способами их получения и химическими свойствами.
1.1 Теоретическое введение
Сложные вещества в неорганической химии разделяются на четыре класса. Это оксиды, основания, кислоты и соли.
Оксиды- сложные вещества, состоящие из двух видов химических элементов, один из которых обязательно кислород. Оксиды подразделяются на солеобразующие и несолеобразующие. К несолеобразующим относятся-N2O, NO, CO, SiO. Все остальные оксиды относятся к солеобразующим и по химическим свойствам делятся на основные, амфотерные и кислотные.
Имеются три основных способа получения оксидов:
а) соединение простого вещества с кислородом
С + О2 =СО2;
б) горение сложных веществ
СН4 + 2О2 = СО2 + 2Н2О;
в) разложение при нагревании кислородных соединений: карбонатов, нитратов, оснований, кислот
2Са(NO3)2 = 2СаО + 4NO2 + О2,
2Fe(OH)3 = Fe2O3 + 3Н2О,
H2CO3 = CO2 +H2O.
Все оксиды неметаллов, кроме несолеобразующих, имеют кислотные свойства: SO2, SO3, CO2, Р2О3, Р2О5.
Оксиды металлов с окислительным числом (о.ч.) +1, +2 обладают, как правило, основными свойствами, например, Na2О, FeO, CaO, NiO, CuO (исключение составляют BeO, ZnO, PbO - амфотерные оксиды); с окислительным числом +3, +4 обладают, как правило, амфотерными свойствами, например, Сг2О3, Al2O3, SnO2, PbO2 (исключение составляют Fe2O3, Ni2O3, Co2O3- основные оксиды); с окислительным числом +5 и более обладают кислотными свойствами, например, MnO3, Mn2O7, CrO3, V2O5 и др.
Амфотерные
оксиды взаимодействуют с кислотами, кислотными
оксидами,
проявляя при этом основные свойства, а с основными оксидами и
основаниями
взаимодействуют, проявляя кислотные свойства. Продукты взаимодействия оксидов с
водой называются гидроксидами. Всем солеобразующим оксидам соответствуют гидроксиды.
Основным оксидам - основания,
амфотерным - амфотерные гидроксиды, кислотным оксидам – кислоты.
Основания - это сложные вещества, состоящие из анионов гидроксогрупп (ОН-) и катионов металлов. Число групп ОН- в основании определяет кислотность основания. Если в составе основания имеется одна группа ОН- - это однокислотное основание, несколько групп ОН- - многокислотное основание. Растворимые в воде основания называются щелочами (LiOH, NaOH, КОН, RbOH, CsOH, Са(ОН)2 и др.).
Все остальные основания нерастворимы в воде.
Амфотерными гидроксидами называются гидраты амфотерных оксидов. Они взаимодействуют как с кислотами, так и с основаниями. Амфотерные гидроксиды обычно нерастворимы в воде
А1(ОН)3 + 3HCI = AlCl3 + 3Н2О
А1(ОН)3 + NaOH = Na[Al(OH)4].
Кислоты - это сложные вещества, состоящие из катионов только
водорода (Н+), способных замещаться только на металл, и анионов кислотного остатка. По составу различают кислородсодержащие (HNO3, H2SO4, Н2СО3 и др.) и бескислородные (HCl, Н2S и др.) кислоты. Основность кислоты определяется числом атомов водорода в кислоте: НС1 - одноосновная кислота, H2SO4 - двухосновная кислота.
Соли - это сложные вещества, состоящие из атома металла и кислотного остатка. В зависимости от кислотности основания и основности кислот при их взаимодействии образуются средние или нормальные соли, не содержащие ионов Н+ и ОН-, основные или гидрооксосоли, содержащие ОН- группы, кислые или гидросоли, содержащие ион Н+. Гидросолью или кислой солью называют продукт неполного замещения атомов водорода в многоосновной кислоте на металл. Гидрооксосолью или основной солью называют продукт неполного замещения гидрооксогрупп в многокислотном основании на кислотный остаток.
Получение солей
1. Взаимодействие основных оксидов с кислотными оксидами
СаО + СО2 = CaCO3.
основной кислотный средняя
оксид оксид соль
2. Взаимодействие оксидов и гидроксидов
CuO + H2SO4 = CuSO4,
основной кислота средняя
оксид соль
Na2O + Zn(OH)2 = Na2ZnO2 + Н2О,
основной амфотерный средняя
оксид гидроксид соль
SO3 + Zn(OH)2 = ZnSO4 + H2O.
кислотный амфотерный средняя
оксид гидроксид соль
3. Взаимодействие гидроксидов
2NaOH + H2SO4 = Na2SO4 + H2O,
основной кислота средняя соль
гидроксид
2NaOH + Zn(OH)2 = Na2ZnO2 + H2O.
основной амфотерный средняя соль
гидроксид гидроксид
4. Получение кислых и основных солей
H3PO4 + NaOH = NaH2PO4 + H2O,
многоосновная основное гидросоль вода
кислота основание
Cu(OH)2 + HCl = CuOHCl + H2O,
многокислотное одноосновная гидроксосоль вода
основание кислота
Zn(OH)2 + HCl = ZnOHCl + H2O,
амфотерный одноосновная гидроксосоль вода
гидроксид кислота
Zn(OH)2 + NaOH = NaHZnO2 + H2O.
амфотерный основный гидросоль вода
гидроксид гидроксид
1.2 Экспериментальная часть
1.2.1 Гидратация основных оксидов (групповой опыт)
В фарфоровую чашку, наполненную на 1/3 негашенной известью (СаО) добавьте воду. Оксид кальция заметно впитывает воду, затем начинается реакция, идущая с сильным разогревом. Напишите уравнение реакции. Полученный гидроксид оставьте для опыта 2.7.
1.2.2 Взаимодействие основного оксида с кислотой
В пробирку к небольшому
количеству оксида меди (II) (один мик-
рошпатель) прибавьте разбавленной соляной
или серной кислоты.
Пробирку нагрейте на спиртовке. Изменение окраски раствора показывает,
что образовалась растворимая в воде соль
меди. Запишите уравнение реакции.
1.2.3 Взаимодействие кислотного оксида с основанием (групповой опыт)
Заполните сухую колбу оксидом углерода (IУ), полученным из аппарата Киппа. Конец газоотводной трубки опустите в сосуд с водой. Газоотводную трубку плотно закройте зажимом, откройте пробку и в колбу засыпьте 2-3 г измельченной щелочи (NaOH или КОН). Закройте колбу плотно пробкой и встряхните. Что происходит? Запишите уравнение реакции. Для доказательства взаимодействия углекислого газа со щелочью конец газоотводной трубки опустите в воду и откройте зажим. Вода энергично засасывается в колбу. Дайте объяснение наблюдаемому эффекту.
1.2.4 Получение нерастворимого основания
Внесите в пробирку по 3-4 капли раствора сульфата меди (II) и раствора щелочи с эквивалентной концентрацией 2 моль/л. Напишите уравнение реакции. Осадок полученного гидроксида меди оставьте для опыта 1.2.6.
1.2.5 Получение амфотерного гидроксида
Налейте в две пробирки по 3-4 капли раствора соли цинка, а в две другие - столько же раствора соли кадмия. В каждую пробирку добавьте по каплям раствора едкой щелочи концентрацией 2 моль/л до появления белых студенистых осадков гидроксидов. Испытайте отношение полученных гидроксидов к кислотам и щелочам. Напишите уравнения всех шести реакций.
1.2.6 Получение средней соли
К осадку гидроксида меди из опыта 2.4 прибавьте 5-6 капель раствора серной кислоты эквивалентной концентрацией 2 моль/л. Напишите уравнение реакции.
1.2.7 Получение кислой соли
Наполните пробирку на 1/3 объема известковой воды из опыта 2.1 и пропускайте в нее диоксид углерода. Отметьте появление осадка карбоната кальция. Продолжайте пропускать диоксид углерода до растворения осадка. Напишите уравнение реакции.
1.2.8 Получение основной соли
В пробирку с 2-3 каплями сульфата меди (II) прибавьте такое же количество раствора соды. Наблюдайте выпадение осадка карбоната гидроксомеди зелено-голубого цвета (СuОН)2СО3. Почему при взаимодействии солей меди с раствором соды не выпадает осадок карбоната меди? Напишите уравнение реакции взаимодействия меди с содой при участии воды.
1.3 Контрольные вопросы
1. Какое основание является наиболее сильным?
2. Какие из указанных газов: Н2S, Н2, Сl2, СО2 - будут поглощаться при пропускании их через раствор едкого натрия? Напишите уравнения соответствующих реакций.
3 . Объясните, почему при пропускании
диоксида углерода через
раствор
хлора или нитрата кальция осадок карбоната не образуется, а при действии диоксида углерода
на известковую воду – выпадает осадок.
4 . К раствору, содержащему соли кальция, бериллия, магния добавили избыток раствора едкого натрия. Напишите уравнения реакций.
5 . Как практически убедиться в амфотерных
свойствах гидроксида
алюминия? Напишите уравнения
соответствующих реакций.
6 . При действии избытка гидроксида
калия и гидроксида аммония
на
раствор сульфата алюминия выпавший вначале осадок сохраняется только в одном
случае. Укажите, в каком именно. Напишите уравнения реакций.
7 . Из каких приведенных кислот: НCl, HNO3, H2CO3, HClO4, H3PO4 – можно получить кислые соли? Напишите уравнения реакций.
8 . Из каких приведенных оснований: NaOH, Ca(OH)2, Al(OH)3, KOH, CsOH – можно получить основные соли? Напишите уравнения реакций.
2 Лабораторная работа №2. Эквивалент и молярная масса эквивалента
Цель работы: ознакомление с понятием эквивалента вещества и методикой расчета, связанной с законом эквивалентов.
2.1 Теоретическое введение
Эквивалент (Э) — это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Так же, как молекула, атом или ион, эквивалент безразмерен. И так же, как в случае молекул, атомов или ионов, состав эквивалента выражают с помощью химических знаков и формул.
Для того чтобы определить состав эквивалента вещества и правильно записать его химическую формулу, надо исходить из конкретной реакции, в которой участвует данное вещество.
Рассмотрим несколько примеров определения формулы эквивалента.
ОН- + Н+ = Н2О. (а)
С одним ионом водорода реагирует один ион гидроксила. Поэтому Э(ОН-) = ОН-.
Са2+ + 2ОН- + 2Н+ + 2Сl- = Са2+ + 2Сl- + 2Н2О. (б)
В
реакции (б) один ион водорода эквивалентен ![]() иона кальция, одному иону
ОН- и одному иону Сl-. Следовательно, Э(Ca2+)=
иона кальция, одному иону
ОН- и одному иону Сl-. Следовательно, Э(Ca2+)=![]() Са2+ ;
Са2+ ;
Э(Сl-) = Сl- ; Э(ОН-) = ОН-.
Запишем уравнение этой реакции в молекулярной форме:
![]() Са(ОН)2 + НС1 =
Са(ОН)2 + НС1 = ![]() CaCl2 +
Н2О.
CaCl2 +
Н2О.
Одному атому водорода
эквивалентна ![]() молекулы Са (ОН)2,
следовательно, Э(Са(ОН)2)=
молекулы Са (ОН)2,
следовательно, Э(Са(ОН)2)= ![]() Са(ОН)2.
Са(ОН)2.
В реакции
А1С13 + 3AgNO3 = A1(NO3)3 + 3AgCl (в)
эквиваленты А1С13 и AgNO3 можно определить косвенным путем, введя вспомогательные реакции
А1Сl3 + 3HNO3 = 3НС1 + AI(NO3)3
+ 3AgNO3 + 3НС1 = 3AgCl + 3HNO3
А1С13 + 3AgNO3 = A1(NO3)3 + 3AgCl.
Одному
атому водорода эквивалентна ![]() молекулы А1С13 и молекула AgNO3,
следовательно, Э(А1С13) =
молекулы А1С13 и молекула AgNO3,
следовательно, Э(А1С13) = ![]() AICI3; Э(AgNO3) = AgNO3.
AICI3; Э(AgNO3) = AgNO3.
Zn2 + +2е- =Zn. (г)
В этой
окислительно-восстановительной реакции с одним ионом цинка взаимодействуют два
электрона. Поэтому эквивалент
Zn2 + Э(Zn2 + )= ![]() Zn2+.
Zn2+.
Fe3+ +е- = Fe2+. (д)
В этой реакции один ион Fe3+ реагирует с одним электроном и, соответственно, Э(Fe3+) = Fe3+ .
Fe3++3e- =Fe°. (e)
В этом случае один ион Fe3+ реагирует с тремя электронами и, следовательно, Э(Fe3 + )= ![]() Fе3+ .
Fе3+ .
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O. (ж)
В данной
окислительно-восстановительной реакции атом марганца в молекуле КМnО4
принимает пять электронов, в результате
чего марганец со степенью окисления +7 превращается в марганец со степенью
окисления +2. Поэтому Э(КМnО4)=
![]() KMnO4.
KMnO4.
В молекуле FeSO4 атом железа отдает один электрон, в результате чего железо со степенью окисления +2 превращается в железо со степенью окисления +3, поэтому Э(FeSO4) = = FeSO4.
Таким образом, зная суммарное уравнение кислотно-основной, ионообменной и окислительно-восстановительной реакции, можно установить химическую формулу эквивалента вещества, участвующего в реакции.
Количество вещества измеряют в молях. Один моль эквивалентов содержит столько эквивалентов, сколько атомов содержится в 0,012 кг углерода-12. Масса моля эквивалентов называется молярной массой эквивалента Мэ.
Например, молярные массы эквивалентов в рассматриваемых ранее реакциях равны:
М![]() = М
= М![]() = 17 г/моль,
= 17 г/моль,
М![]() =
= ![]() = 20,04 г/моль и т. д.
= 20,04 г/моль и т. д.
Следует остановиться на понятии объема моля эквивалентов газа. Как известно, моль любого газа при нормальных условиях занимает объем, равный 22,4 л. Соответственно, для вычисления объема моля эквивалентов газа необходимо знать число молей эквивалентов в одном моле газа. Например, в реакции окисления водорода
![]() Н2 – е- =Н+
Н2 – е- =Н+
эквивалент газообразного водорода — это
половина его молекулы Э(Н2) =![]() Н2.
Н2.
Поэтому один моль эквивалентов водорода занимает при нормальных условиях объем 22,4 л:2 = 11,2 л.
Аналогичным образом можно показать, что объем одного моля эквивалентов кислорода в реакции восстановления
О2 +4е- =2О2-
равен 22,4 л : 4 = 5,6 л.
Поскольку состав эквивалента вещества зависит от реакции, то молярная масса эквивалента одного и того же вещества может быть разной. Например, молярная масса эквивалента FeSO4 в реакции
FeSO4 + 2HCl = FeCl2 + H2SO4
равна 75,925 г/моль, а в реакции
2FeSO4 + Co2(SO4)3 = Fe2(SO4)3 +2CoSO4
равна 151,85 г/моль, так как в первом
случае Э(FeSO4) = ![]() FeSO4,
а во втором - Э(FeSO4) = FeSO4.
FeSO4,
а во втором - Э(FeSO4) = FeSO4.
Раствор, содержащий один моль эквивалентов вещества в литре, называется «эквивалентным» или «нормальным».
Эквивалентная концентрация раствора выражается в кмоль/м3, а практически в моль/л и обозначается «Сэ» или «N».
Закон эквивалентов: вещества реагируют друг с другом в эквивалентных соотношениях, т. е. моль эквивалентов одного вещества реагирует с молем эквивалентов другого вещества. Например, в реакции
![]() Zn + HC1 =
Zn + HC1 =![]() ZnCl2 +
ZnCl2 + ![]() H2
H2
один моль эквивалентов цинка (![]() моль Zn) реагирует с одним молем эквивалентов
кислоты (1 моль НС1) с образованием одного моля эквивалентов хлорида цинка (
моль Zn) реагирует с одним молем эквивалентов
кислоты (1 моль НС1) с образованием одного моля эквивалентов хлорида цинка (![]() моль ZnCl2) и одного моля эквивалентов газообразного водорода (
моль ZnCl2) и одного моля эквивалентов газообразного водорода (![]() моль Н2).
моль Н2).
Закон эквивалентов для реакции
mA +nB = AmBn
протекающей в растворе, можно записать следующим образом:
VANA=VBNB
где VA и VB -объемы реагирующих растворов; NA и NB -их эквивалентные концентрации.
2.2 Экспериментальная часть
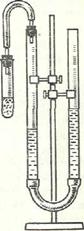
2.2.1 Определение молярной массы эквивалента металла (Mg, Al или Zn) методом вытеснения водорода
Метод основан на измерении объема водорода, который выделяется из кислоты при действии на нее металла.
Применяемый для этой цели прибор состоит из двух бюреток, укрепленных на штативе и соединенных резиновой трубкой. В такой сообщающийся сосуд наливают воду приблизительно до половины бюреток. Одну из бюреток сверху закрывают пробкой с отводной трубкой, к которой присоединяют пробирку, где происходит реакция между кислотой и металлом. Другая бюретка служит приемником для воды, вытесняемой выделяющимся при реакции водородом.
Объем выделившегося водорода определяют по разности уровней воды в любой из бюреток до и после опыта при давлении в закрытой бюретке, равном атмосферному. Давление газа в закрытой бюретке равно атмосферному, если вода в обеих бюретках находится на одном уровне.
Даже при комнатной температуре пар над поверхностью воды обладает заметным давлением. Это следует учитывать при вычислении объема газа, собранного над водой. Поэтому для определения парциального давления водорода необходимо от общего (атмосферного)
|
|
давления, под которым находится водород, вычесть давление насыщенного водяного пара h (см. приложение)
![]() .
.
Для приведения объема выделившегося водорода к нормальным условиям используют уравнение газового состояния
![]()
где V0 — объем водорода при н. у.,мл;
P0 — парциальное давление водорода при н. у., равное 101,3 кПа;
T0 — температура, 273 К;
V — объем водорода при данных условиях, мл;
P — парциальное давление водорода при условиях опыта, равное Pатм —h, кПа;
T— температура опыта, К.
Определив объем водорода при н. у., вычисляют массу одного моля эквивалента металла:
|
Рисунок 1- Прибор для определения молярной массы эквивалента металла 33 |
m г металла вытесняют V0 мл водорода
х ....................................11200..................
Получите навеску металла у лаборанта.
В пробирку налейте соляной кислоты (на одну
четверть пробирки), поддерживая пробирку в наклонном положении, поместите навеску металла (не опуская в кислоту) на стенку у отверстия пробирки и закройте пробирку пробкой с отводной трубкой от бюретки.
Проверьте герметичность прибора. Для этого, не трогая бюретку с пробиркой, переместите другую бюретку вместе с лапкой штатива так, чтобы уровень воды в ней стал на 5 —10 см выше, чем в первой бюретке. Если разница в уровнях не изменяется, прибор исправен («держит»); если уровни в бюретках выравниваются, прибор негерметичен, пропускает воздух, о чем следует заявить лаборанту.
Приведите воду в бюретках к одинаковому уровню и отметьте уровень воды в открытой бюретке (мл). Отсчет производите по нижнему мениску воды с точностью до 0,1 мл.
Примечание. При одинаковых уровнях воды в бюретках они должны быть закреплены так, чтобы бюретка без пробирки стояла несколько выше бюретки с пробиркой.
Стряхните металл в кислоту (смойте его кислотой). Наблюдайте выделение водорода и вытеснение воды из бюретки.
По окончании реакции дайте пробирке охладиться на воздухе, после чего снова приведите воду в бюретках к одинаковому уровню. Запишите новый уровень воды в открытой бюретке. По разности уровней воды до и после реакции рассчитайте объем выделившегося водорода.
По данным опыта определите молярную массу эквивалента металла. Сравнивая ее с теоретическим значением молярной массы эквивалента металла (Mg, Al, Zn), определите, какой металл был взят для реакции.
Запишите в журнал: навеску металла, г; уровень воды в бюретке до и после реакции, мл; температуру, К; атмосферное давление, кПа; давление водяного пара, кПа; давление водорода, кПа.
По полученным данным рассчитайте:
1. Объем выделившегося водорода.
2. Объем водорода при нормальных условиях.
3. Теоретическую молярную массу эквивалента Mg, Al, Zn.
4. Опытную молярную массу эквивалента металла.
5.
Ошибку
опыта: а) абсолютную; б) относительную.
Запишите
уравнение реакции взаимодействия металла с соляной кислотой, зарисуйте прибор и сделайте
вывод.
2.3 Контрольные вопросы
1. Что называют эквивалентом вещества?
2. Как определить
эквивалент кислоты, основания, соли в кислотно-
основных
реакциях?
3. Как определить
эквивалент вещества в окислительно-вос-
становительных реакциях?
4. Что такое моль эквивалентов и молярная масса эквивалентов?
5. Рассчитайте молярные
массы эквивалента следующих веществ
в реакциях обмена: NaOH, H2S, Mg(NO3)2, Ca(OH)2, H2SO4, NH4OH.
Составьте уравнения реакций.
6. К раствору, содержащему 1 г соляной кислоты, прибавили раствор,
содержащий 1 г гидроксида натрия. Будет ли полученный раствор
нейтральным, кислым или щелочным? Ответ подтвердите
расчетом.
3 Лабораторная работа №3. Кинетика химических реакций
Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры.
3.1 Теоретическое введение
Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации реагирующих веществ, температуры, наличия катализатора и др.).
Зависимость скорости реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции
2NO + O2 →2NO2
закон действия масс может быть записан
![]()
где v — скорость химической реакции;
k — константа скорости;
![]() и
и ![]() — концентрации реагирующих веществ.
— концентрации реагирующих веществ.
Реакция в гетерогенной системе [например, С(к) + О2(г) →СО2(г)] осуществляется на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела. Так, для реакции
С(к) + О2(г) →СО2(г)
закон действия масс имеет вид
![]()
где k — константа скорости;
![]() — концентрация кислорода;
— концентрация кислорода;
S — площадь поверхности раздела между фазами.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа
![]()
где ![]() и
и ![]() — скорости реакций при температурах
— скорости реакций при температурах
![]() и
и ![]() ;
;
![]() — температурный коэффициент, показывающий, во сколько раз увеличивается скорость
реакции при повышении температуры на 100С.
— температурный коэффициент, показывающий, во сколько раз увеличивается скорость
реакции при повышении температуры на 100С.
Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания.
Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т. е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
3.2 Экспериментальная часть
3.2.1 Зависимость скорости реакции от концентрации реагирующих веществ
Зависимость скорости реакции от концентрации реагирующих веществ изучают на примере взаимодействия тиосульфата натрия с серной кислотой
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S.
Признаком реакции является помутнение раствора вследствие выделения серы.
Заполните три бюретки: первую — раствором H2SO4 с эквивалентной концентрацией 1 моль/л, вторую — раствором Na2S2O3 с эквивалентной концентрацией 0,05 моль/л, третью — водой. Приведите бюретки в рабочее положение.
Налейте в три пробирки из бюретки по 5 мл H2SO4.
В три конические колбы из бюреток налейте: в первую — 5 мл раствора Na2S2О3 и 10 мл воды; во вторую — 10 мл раствора Na2S2O3 и 5 мл воды; в третью — 15 мл раствора Na2S2O3.
Заметив время, в первую колбу прилейте из пробирки 5 мл отмеренного раствора серной кислоты в быстро перемешайте полученную смесь. Отметьте время помутнения раствора.
Проделайте то же самое с двумя оставшимися колбами. Результаты опыта внесите в таблицу.
Т а б л и ц а 1
|
№ |
Объем, мл |
Общий объем, мл |
Относит.концент- рация |
Темп-ра опыта, 0С |
Время появл-я мути, с |
Относит. скорость реакции |
|||
|
Н2SO4 |
Na2S2O3 |
H2O |
vтеор |
vпрак |
|||||
|
1 |
5 |
5 |
10 |
20 |
1 |
|
|
1 |
1 |
|
2 |
5 |
10 |
5 |
20 |
2 |
|
|
2 |
|
|
3 |
5 |
15 |
- |
20 |
3 |
|
|
3 |
|
На миллиметровой бумаге постройте кривую зависимости vтеор от концентрации Nа2S2О3 (в относительных единицах). Отметьте на графике значения vпрак, полученные при вычислениях.
Напишите уравнение реакции и сделайте вывод о зависимости скорости реакции от концентрации Na2S2O3 при данных условиях.
3.2.2 Зависимость скорости реакции от температуры
Зависимость скорости реакции от температуры изучают на примере реакции
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S.
По правилу Вант-Гоффа (при γ = 1,8)
![]()
получаем, что при повышении температуры на 10° скорость реакции увеличится в 1,8 раза, на 20° - в 3,24 раза, на 30° - в 5,832 раза и т. д.
Приведите бюретки с растворами H2SO4, Na2S2O3 и водой в рабочее положение. В две пробирки из бюретки прилейте по 5 мл H2SO4.
В две конические колбы из бюреток прилейте по 5 мл раствора Na2S2О3 и по 10 мл воды.
Одну колбу и пробирку поместите в стакан с температурой на 10° выше комнатной. Через 5- 7 мин, когда растворы нагреются до нужной температуры, смешайте их и определите время помутнения раствора, как в опыте 3.2.1.
Другую колбу и пробирку поместите в стакан с температурой на 20° выше комнатной. Через 5 - 7 мин смешайте растворы и определите время появления мути.
Результаты опыта запишите в таблицу.
Т а б л и ц а 2
|
№ |
Объем, мл |
Общий объем, мл |
Темп-ра опыта, 0С |
Время появ-я мути, с |
Относит.скорость реакции |
|||
|
Н2SO4 |
Na2S2O3 |
H2O |
vтеор |
vпрак |
||||
|
1 |
5 |
5 |
10 |
20 |
|
|
1 |
1 |
|
2 |
5 |
5 |
10 |
20 |
|
|
1,8 |
|
|
3 |
5 |
5 |
10 |
20 |
|
|
3,24 |
|
На миллиметровой бумаге постройте кривую зависимости vтеор от температуры. На этом же графике отметьте рассчитанные заранее значения vпрак. Рассчитайте значение температурного коэффициента γпрак, исходя из опытных данных.
Сделайте вывод о зависимости скорости реакции от температуры.
3.3 Контрольные вопросы и задачи
1. Что называется скоростью химической реакции? От каких факторов она зависит?
2. Сформулируйте закон действия масс. Запишите математическое
выражение этого закона для реакций:
а) N2O4(г) → 2NO2(г);
б) 2NO(г) + Br2(г) →2NOBr(г);
в) СаО(к) + СО2(г) → СаСО3(к).
3. Как и почему
изменяется скорость химической реакции при
изменении
температуры?
4. Что называют энергией активации?
5. От каких факторов
зависит скорость химической реакции в
гетерогенных
системах?
6. Что называют катализатором
? Какое влияние и почему оказывает
катализатор на скорость химической реакции?
7. Что называют порядком
реакции? Запишите кинетическое
уравнение для реакции первого
порядка.
8. Изобразите графически
зависимость lg С от τ для реакции первого
порядка.
9. Что называют молекулярностью реакции? Приведите примеры.
4 Лабораторная работа №4. Химическое равновесие
Цель работы — изучение влияния различных факторов на химическое равновесие.
4.1 Теоретическое введение
Понятие
«химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором
скорость прямой реакции ![]() равна скорости обратной реакции
равна скорости обратной реакции ![]() . Равенство
. Равенство ![]() является кинетическим
условием химического равновесия.
является кинетическим
условием химического равновесия.
Химическое равновесие характеризуется постоянством величины энергии Гиббса системы GT. Равенство ΔGT =0 является термодинамическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия. Для обратимой реакции
Н2 (г) + J2 (г) = 2НJ (г)
константа равновесия имеет вид
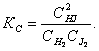
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе.
Константа
равновесия связана со стандартной энергией Гиббса данной реакции (![]() ) следующим соотношением
) следующим соотношением
![]()
где R — универсальная газовая постоянная [8,31 Дж/(моль К)];
Т- абсолютная температура, К;
Кс - константа равновесия.
Химическое равновесие остается неизменным до тех пор, пока остаются постоянными параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции, то равновесие смещается вправо.
В общем случае направление смещения равновесия определяется принципом Ле- Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
4.2 Экспериментальная часть
4.2.1 Влияние концентрации веществ на химическое равновесие (полумикрометод).
В данном опыте изучают обратимую реакцию взаимодействия трихлорида железа с роданидом аммония. Трироданид железа Fe(SCN)3 придает раствору красную окраску. По изменению интенсивности окраски можно судить об изменении концентрации Fe(SCN)3, т. е. о смещении равновесия в ту или иную сторону.
В четыре микропробирки внесите по 5—10 капель разбавленных растворов трихлорида железа FeCl3 и роданида аммония NH4SCN. Легким встряхиванием пробирок размешайте растворы. Поставьте все пробирки в штатив.
В одну из пробирок микрошпателем добавьте несколько кристаллов трихлорида железа, в другую — роданида аммония, в третью — хлорида аммония, четвертую пробирку оставьте для сравнения.
Растворы размешайте энергичным встряхиванием или стеклянной палочкой.
При оформлении отчета: отметьте изменение интенсивности окраски в каждом случае; запишите уравнение реакции между FeCl3 и NH4SCN и выражение константы равновесия данной реакции.
В каком направлении смещается равновесие и как изменяется концентрация каждого компонента в случае добавления: а) трихлорида железа; б) роданида аммония; в) хлорида аммония?
4.3 Контрольные вопросы и задачи
1. Какое
состояние обратимой реакции называется химическим
равновесием?
2. Напишите
уравнение константы равновесия для каждого из
следующих
обратимых процессов:
а) 2NO2(г)= 2NO(г) + О2(г);
б) 3Н2(г) + N2(г) = 2NH3 (г);
в) Н2(г) + СuО(к)= Н2О(г) + Сu(к).
Как сместится равновесие в каждом из указанных случаев при увеличении давления?
3. В каком направлении сместится равновесие при повышении
температуры в следующих обратимых
реакциях (тепловой эффект
реакции рассчитайте по табличным данным):
а) 2SO2(г) + O:(г) = 2SO3(г);
б) Н2(г) + Вr2(г) = 2НВr(г);
в) N2(г) + О2(г) = 2NO(г).
4. Вычислите константу равновесия реакции, используя табличные данные
SO3(г) + Н2О(ж)= H2SO4(ж).
5 Лабораторная работа №5. Гидролиз солей
Цель работы: изучение некоторых свойств водных растворов солей, связанных с реакцией гидролиза.
5.1 Теоретическое введение
Гидролизом называют обменные химические реакции, протекающие с участием воды. Если в обменную реакцию с водой вступает соль, то взаимодействие называют гидролизом соли.
Признаком гидролиза соли является изменение нейтральной реакции среды водного раствора. Например, при растворении в воде хлорида аммония NH4C1 образуется избыток ионов Н+ и раствор подкисляется (рН < 7).
NH4C1 + Н2О = NH4OH + HC1 или
NH4+ + Н2О = NH4OH + Н+.
Если же растворить в воде ацетат натрия СН3СООNа, раствор подщелачивается (рН > 7) вследствие образования из
CH3COONa + Н2О = СН3СООН + NaOH или
СН3СОО- + Н2О = СН3СООН + ОН-.
Следовательно, водные растворы солей могут иметь кислую или щелочную реакцию среды потому, что они вступают в химическое взаимодействие с водой. Однако не все соли вступают в реакцию гидролиза. Если растворить в воде хлорид калия КС1, нейтральная реакция среды (рН 7), характерная для чистой воды, не изменится, т. е. в растворе сохранится равенство Сн+ == Сон-
КС1 + Н2О = КОН + НС1 или
Н2О =Н+ + ОН-.
Можно утверждать, что соли, образованные сильным основанием и сильной кислотой (KCl, LiNO3, NaCl и т. п.), в реакцию гидролиза не вступают.
С водой взаимодействуют: а) соли, образованные слабыми основаниями и сильными кислотами (NH4C1, СuCl2, NH4NO3 и т. п.); б) соли, образованные слабыми кислотами и сильными основаниями (Na2S, KCN, Na2CO3 и т. п.); в) соли, образованные слабыми основаниями и слабыми кислотами (NH4CH3COO и т. п.).
Из рассмотренных примеров следует, что в реакцию с водой вступают катионы слабых оснований и анионы слабых кислот. Если эти ионы многозарядны (Fe3+, Сu2+, СОз2-, SiO32- и т. п.), их взаимодействие с водой обычно идет до образования основного или кислого иона (первая ступень гидролиза), например
Fe3+ +H2O = FeOH2+ + Н+,
CO32- +H2O = HCO3- + OH-.
О глубине протекания процесса гидролиза соли при заданных условиях можно судить по степени гидролиза β, являющейся отношением концентраций гидролизованных ионов (С) к их исходной концентрации в растворе (Со)
β=С/С0.
Реакция гидролиза соли обратима. В прямом направлении (→) она протекает в сторону образования молекул (основных ионов) слабых оснований или молекул (кислых ионов) слабых кислот, а в обратном (←) — в сторону образования молекул воды. Реакцию образования молекул Н2О из ионов Н+ и ОН- называют реакцией нейтрализации. Следовательно, реакция гидролиза соли обратна реакции нейтрализации.
К реакции гидролиза соли применимы все положения и законы учения о химическом равновесии. Константа равновесия реакции гидролиза называется константой гидролиза соли Кг. Ее величина характеризует соотношение между равновесными концентрациями (активностями) всех компонентов системы. Связь между константой гидролиза соли (Кг) и степенью гидролиза (β) в растворе заданной концентрации (Со) выражается законом Оствальда
![]()
Равновесие процесса гидролиза, отвечающее равенству скоростей реакций гидролиза и нейтрализации, подвижно и может быть смещено вправо или влево в соответствии с принципом Ле- Шателье. Так, например, при повышении температуры равновесие гидролиза смещается вправо, так как прямая реакция эндотермическая (ΔН>0), а обратная (нейтрализация) — экзотермическая (ΔН<0). При постоянной температуре Т равновесие гидролиза можно сместить вправо, уменьшая концентрацию раствора (разбавляя раствор); это следует из закона Оствальда: при Кг = const чем меньше Со, тем больше β.
Прежде чем приступить к выполнению опытов, необходимо ознакомиться с методикой расчета: а) константы гидролиза солей; б) степени гидролиза; в) рН раствора гидролизующейся соли; г) концентрации раствора гидролизующейся соли по известному рН.
5.2 Экспериментальная часть
5.2.1 Гидролиз соли, образованной сильным основанием и слабой кислотой
Приготовьте 100 мл раствора карбоната, гидрокарбоната, ацетата или нитрита натрия заданной молярной концентрации (задание получите у преподавателя). Рассчитайте навеску, взвесьте соль на лабораторных весах с точностью до 0,01 г и приготовьте раствор соли в мерной колбе.
Измерьте рН приготовленного раствора с помощью рН-метра. Составьте уравнение реакции гидролиза соли (первая ступень) и вычислите рН приготовленного раствора.
Закончите оформление результатов опыта сравнением измеренного и вычисленного значений рН.
5.2.2 Гидролиз соли, образованной слабым основанием и сильной кислотой
Получите у лаборанта навеску хлорида железа (III) FeCl3 и приготовьте в мерной колбе раствор соли.
Вычислите молярную концентрацию приготовленного раствора (C0 теор).
Измерьте рН раствора, используя рН-метр.
Запишите уравнение реакции гидролиза (первая ступень) и вычислите молярную концентрацию соли в растворе на основании найденного значения водородного показателя среды рН (С0 изм).
Результаты расчетов и измерений сведите в таблицу.
Т а б л и ц а 3
|
Навеска, г |
Объем раствора, мл |
С0 теор, моль/л |
рН |
С0 изм, моль/л |
|
|
|
|
|
|
5.2.3. Смещение равновесия реакции гидролиза соли при разбавлении раствора
Убедитесь в том, что концентрированный раствор нитрата свинца прозрачен.
В коническую колбу налейте 50 мл водопроводной воды и добавьте 1—2 капли концентрированного раствора Pb(NO3)2.
Наблюдайте образование осадка.
При оформлении результатов опыта:
1. Назовите гидролизующийся ион, составьте уравнение реакции гидролиза и объясните, почему концентрированный раствор Pb(NO3)2 прозрачен.
2. Объясните, почему при
разбавлении в колбе появился осадок. Составьте уравнение реакции образования
осадка.
Имеет ли
отношение эта реакция к процессу гидролиза рассматриваемой соли?
3. Сделайте вывод о влиянии разбавления растворов гидролизующихся солей на гидролитическое равновесие.
5.2.4 Смещение равновесия реакции гидролиза при изменении температуры
В пробирку внесите 5 - 6 мл раствора ацетата натрия NaCH3COO и 1-2 капли индикатора (фенолфталеина). Содержимое пробирки разделите на 2 части, одну из них оставьте для сравнения, другую — нагрейте до кипения.
Сравните окраску индикатора в обеих пробирках. Дайте пробирке охладиться и снова сравните окраску индикатора в обеих пробирках. Опишите и поясните свои наблюдения.
Составьте уравнение реакции гидролиза соли, назвав предварительно гидролизующийся ион. Сделайте вывод о среде раствора и о влиянии температуры на гидролитическое равновесие.
5.3 Контрольные вопросы и задачи
1. Имеются растворы солей КCl, NaCl, CuCl2 и АlС13. В каких
растворах концентрация иона Н+ равна концентрации иона ОН-?
Ответ поясните.
2.
Можно ли, пользуясь фенолфталеином, отличить водный раствор
Na2Si2О3
от водного раствора Na2SO4. Ответ
поясните.
3. Можно
ли с помощью рН-метра отличить водный раствор КСl
от водного раствора NH4Cl? Ответ поясните.
4. Справедливо
ли утверждение о том, что водные растворы
NaCl и КС1 имеют одинаковое значение
водородного показателя
среды? Ответ поясните.
5. Используя
справочные данные, рассчитайте константу гидролиза
соли CH3COONa. Ответ. 0,57-10-9.
6. Используя
справочные данные, рассчитайте степень гидролиза
соли CH3COONa в растворе
концентрацией 0,01 моль/л. Ответ. 2,39∙10-4
(2,39∙10-2 %).
7. На примерах гидролиза
солей Na3PO4 и FeCl3 объясните
ступенчатое протекание процесса
гидролиза при нагревании или
разбавлении растворов. Составьте уравнения реакций.
8. Вычислите рН раствора Na2CO3 концентрацией 0,001 моль/л (при расчете учитывайте только первую ступень гидролиза). Ответ. 10,56.
9. Вычислите рН раствора СuС12 концентрацией 0,1 моль/л (при расчете учитывайте только первую ступень гидролиза). Ответ. 4,26.
10. рН водного раствора NH4CI равен 5. Составьте уравнение
реакции гидролиза и рассчитайте исходную
концентрацию раствора.
Ответ. 0,179 моль/л.
6 Лабораторная работа №6 Окислительно- восстанови-тельные реакции (ОВР)
Цель работы: ознакомление с окислительно-восстановительными свойствами металлов, неметаллов и их соединений; освоение методики составления уравнений окислительно-восстановительных процессов.
6.1 Теоретическое введение
Реакции, протекание которых связано со смещением или полным переходом электронов от одних атомов или ионов к другим, называют окислительно-восстановительными. Число электронов, смещенных от атома (иона) данного элемента или к атому (иону) данного элемента в соединении, называют степенью окисления. Степень окисления может быть положительной (электроны смещены от атома или иона) и отрицательной (электроны смещены к атому или иону).
Процесс отдачи электронов, т. е. повышения степени окисления элемента, называют окислением, а вещества, отдающие электроны,—восстановителями. К типичным восстановителям относятся простые вещества, атомы которых характеризуются невысокой электроотрицательностью (металлы, водород, углерод), некоторые анионы (Сl-, S2-, SO32- и др.), катионы, у которых степень окисления может возрастать (Fe3 + , Sn2 + и др.), некоторые соединения углерода (углероводороды, оксид углерода), азота (азотоводороды), бора (бороводороды) и др.
Процесс присоединения электронов, т. е. понижение степени окисления, называют восстановлением, а вещества, принимающие электроны, называют окислителями. К типичным окислителям относятся простые вещества, атомы которых характеризуются высокой электроотрицательностью (элементы VI и VII групп главных подгрупп), катионы с высокой степенью (Pb+4, Cr+6, Ce+4), анионы, в которых электроположительный элемент имеет высокую степень окисления (N+5O3-, Сг2+6 О72- ,Mn+7O4- и др.), высшие оксиды, а также пероксиды.
Окислительно-восстановительные реакции — это одновременно протекающие процессы окисления и восстановления. Реакции, в которых окислители и восстановители представляют собой разные вещества, называют межмолекулярными. Если окислителями и восстановителями служат атомы или ионы одной и той же молекулы, то такие реакции называют внутримолекулярными.
Направление окислительно-восстановительных реакций определяется вторым законом термодинамики. Если процесс протекает при изобарно-изотермических условиях, то прямая реакция возможна при условии, что энергия Гиббса ее ниже нуля: ΔG < 0.
Окислительно-восстановительную способность вещества определяет окислительно-восстановительный потенциал реакции (редокс-потенциал). Окислительная способность веществ тем выше, чем больше положительное значение окислительно-восстановительного потенциала реакции.
6.2 Экспериментальная часть
6.2.1. Влияние рН среды на окислительно-восстановительные реакции
В три пробирки налейте по 3 мл раствора перманганата калия. В первую пробирку прилейте 2 мл 1 М раствора Н2SO4, во вторую — 2 мл Н2О, в третью -2мл 2 М раствора КОН.
В каждую пробирку добавьте по 3 мл раствора сульфита натрия.
Запишите наблюдения, составьте уравнения окислительно-восстановительных реакций и объясните результаты опыта. Учтите, что фиолетовая окраска характерна для ионов MnO4-, слабо-розовая — для ионов Мn2+, зеленая — для ионов MnO42-, бурый цвет имеют осадки МnO2 и Mn(OH)4.
6.2.2 Окислительные свойства бихромата калия
Растворите 2-3 кристаллика бихромата калия в таком количестве дистиллированной воды, чтобы получился раствор соломенно-желтого цвета. Подкислите раствор несколькими каплями серной кислоты и бросьте в него кристаллик сульфата закиси железа. В какой цвет окрашивается раствор?
Напишите уравнение реакции. Укажите восстановитель и окислитель.
6.2.3 Окислительно-восстановительная двойственность перекиси водорода
I Окислительные свойства перекиси водорода
К 2-3 каплям 0,5 н раствора иодида калия, подкисленного равным объемом серной кислоты, прилейте раствор перекиси водорода. Прибавьте 1-2 капли крахмала, убедитесь в присутствии свободного иода. Напишите уравнение реакции. Укажите окислитель и восстановитель.
2 Восстановительные свойства перекиси водорода
Налейте в пробирку около I мл насыщенного раствора перманганата калия, подкислите раствором серной кислоты и прибавьте 1 -2 мл перекиси водорода. Тлеющей лучинкой испытайте выделяющийся газ. Какой это газ ? Напишите уравнение реакции. Укажите окислитель и восстановитель.
6.3 Контрольные вопросы и задачи
1. Определите степень
окисления серы в соединениях: H2S,
Na2S2O3, H2SO3 и H2SO4.
2. Приведите примеры межмолекулярных и внутримолекулярных
окислительно-восстановительных реакций.
3. Определите, возможно
ли протекание реакции в прямом
направлении при температуре
298 К:
СuО + Н2 = Cu + Н2О (ж)
4. Какими способами можно определить направление окислительно-восстановительных реакций?
7 Лабораторная работа № 7. Ряд напряжений металлов и работа гальванических элементов
Цель работы: овладение методикой измерения ЭДС и напряжения гальванических элементов.
7.1 Теоретическое введение
Основное химическое свойство металлов - это способность их атомов сравнительно легко отдавать валентные электроны и превращаться в положительно заряженные ионы. Эта способность у различных металлов в соответствии с особенностями строения их электронных оболочек и кристаллической решетки проявляется по-разному. При погружении металла в воду часть его ионов переходит в раствор, вследствие чего на границе раздела фаз возникает скачок потенциала, называемый обычно потенциалом металла (φ). Непосредственно измерить скачок потенциала на границе раздела фаз не удается, поэтому пользуются относительными значениями потенциалов, измеренными по отношению к стандартному водородному электроду, потенциал которого условно принят за ноль (φН2/2Н+= 0).
Потенциалы металлов, являющихся восстановителями по отношению к стандартному водородному берутся со знаком минус, с окислителями - со знаком плюс. Расположенные в порядке возрастания стандартных электродных потенциалов (т.е. определенных в стандартных условиях) металлы образуют так называемый ряд напряжений металлов, в который помещен и водород, образующий подобно металлам положительные ионы.
Металлы, стоящие в ряду напряжений до водорода, способны вытеснять его из разбавленных растворов кислот. Чем левее в ряду напряжений находится металл, то есть чем меньше его потенциал, тем легче он окислится, и тем труднее восстанавливаются его ионы. Чем правее он находится (т.е. чем больше его потенциал), тем труднее он окисляется и тем легче восстанавливаются его ионы.
Каждый металл, расположенный в ряду напряжений левее (т.е. ближе к началу), вытесняет из растворов солей все последующие за ним (стоящие правее) металлы. При этом первый окисляется и переходит в раствор в виде ионов, а второй восстанавливается и выделяется из раствора в виде металла.
Система, состоящая из металла, погруженного в раствор собственной соли называется металлическим электродом. Так как потенциалы различных электродов отличаются друг от друга, то составив из них замкнутую электрическую цепь можно получить систему, позволяющую преобразовывать химическую энергию в электрическую вследствие протекания в ней окислительно-восстановительных процессов.
Система, в которой энергия окислительно-восстановительной химической реакции преобразуется в электрический ток называется гальваническим элементом. Электрод, на котором происходит окисление называется анодом, восстановление - катодом.
Анодом
всегда является более активный металл, расположенный в
ряду напряжений левее (потенциал смещен в сторону отрицательных
значений).
Рассмотрим в качестве примера гальванический элемент, составленный из никеля, погруженного в молярный раствор сульфата никеля (φ° = -0,25 В), и серебра, погруженного в молярный раствор азотнокислого серебра (φ° = + 0,80 В). Контакт между растворами осуществляется с помощью электрического ключа (стеклянной трубки, заполненной раствором электролита), обеспечивающего ионную электропроводность, но препятствующего смешению растворов.
Соединив электроды во внешней цепи металлическим проводником через гальванометр, можно обнаружить наличие электрического тока и определить его направление.
При работе данного гальванического элемента на электродах происходят следующие преобразования:
анод: Ni°-2e = Ni2+ (окисление);
катод: Ag+ + е = Ag° (восстановление).
Анод при этом заряжается отрицательно, катод - положительно. Электродвижущую силу гальванического элемента можно найти по формуле
Е= φк – φА
или в данном случае Е = + 0,80 - (-0,25) = 1,05 В.
7.2 Экспериментальная часть
7.2.1 Вытеснение водорода из кислоты металлами
В пять пробирок налейте по 3-4 мл раствора соляной кислоты и поместите в них порознь по кусочку магния, алюминия, цинка, железа и меди.
Какие из металлов вытесняют водород из кислоты? Напишите молекулярные, ионные и электронные уравнения реакций.
7.2.2 Вытеснение одних металлов другими
1. Налейте в пробирку 3-4 мл раствора медного купороса, опустите кусочек очищенной от ржавчины железной проволоки. Что происходит? Повторите опыт, заменив железную проволоку цинковой пластиной. Напишите молекулярное, ионное и электронное уравнения реакций.
2. Налейте в пробирку 3-4 мл раствора уксуснокислого свинца и опустите кусочек цинка. Что происходит? Напишите молекулярное, ионное и электронное уравнения реакций.
3. На часовое стекло налейте несколько капель раствора азотнокислого серебра и погрузите в него хорошо очищенную медную проволочку. Что наблюдается? Напишите молекулярное, ионное и электронное уравнения реакций. .
7.2.3 Медно-цинковый гальванический элемент
Медную пластинку опустите в молярный раствор медного купороса, а цинковую пластинку - в молярный раствор цинкового купороса.
Соедините оба раствора изогнутой стеклянной трубочкой, заполненной раствором хлористого калия и примесью агар-агара и клея (чтобы раствор не выливался).
К обоим металлическим пластинкам прикрепите медные проволочки и свободные концы их опустите в стаканчик с раствором сернокислого натрия, к которому прибавлено несколько капель раствора фенолфталеина.
Наблюдается окрашивание в малиновый цвет раствора около проволоки, прикрепленной к цинковой пластине.
Какие окислительно-восстановительные процессы происходят на аноде и на катоде?
Напишите ионное уравнение реакции, протекающей при работе построенного гальванического элемента. Вычислите э.д.с. этого элемента.
7.3 Контрольные вопросы и задачи
1. Что называется стандартным электродным потенциалом ?
2. Почему из раствора солей цинк вытесняет свинец, а не наоборот ?
3. Из каких растворов железо будет вытеснять металлы: Al2(SO4)3, Ag2SO4, SnSO4.
4 . Влияет ли на потенциал металла
концентрация его ионов в
растворе?
5 . Какие металлы - Fe, Al, Zn, Cu, Cr, Ca, Hg- будут выделять водород из раствора разбавленной серной кислоты?
6 . Составьте схемы двух гальванических элементов, в одном из которых железо является катодом, а в другом - анодом. Напишите уравнения реакций, протекающих при работе этих элементов.
7
. Вычислите э.д.с., напишите уравнения электродных реакций и
укажите направление движения электронов в гальваническом элементе (-) Fe/Fe2+//Ag+/Ag (+) при условии, что ![]() .
.
8. Вычислите э.д.с. элемента
(-) Cd/Cd2+//Cu2+/Cu (+), если концентрации ![]() .
.
9. Пользуясь данными ряда напряжения, объясните из каких металлов надо составить гальванический элемент, чтобы он имел наибольшую э.д.с.
10. Как составить гальванический элемент, в котором протекает следующая окислительно-восстановительная реакция
Zn + 2Fe3+ -> Zn2+ + 2Fe2+.
8 Лабораторная работа №8. Электролиз
Цель работы: ознакомление с процессами, протекающими на растворимых и нерастворимых электродах при электролизе водных растворов электролитов.
8.1 Теоретическое введение
Под электролизом понимают химические процессы на электродах, протекающие при прохождении постоянного тока через раствор или расплав электролита. Эти процессы сопровождаются превращением электрической энергии в химическую.
Сущность электролиза заключается в том, что под действием электрического тока на аноде происходит процесс окисления, а на катоде - процесс восстановления. При электролизе водных растворов солей щелочных и щелочно-земельных металлов на катоде разряжаются ионы водорода, а катионы металла остаются в растворе. Если подвергнуть электролизу раствор соли металла, находящегося в ряду напряжений между алюминием и водородом, например, цинка, никеля, то на катоде выделяется не водород, а соответствующий металл, что объясняется перенапряжением выделения водорода на этих металлах.
Если анод сделан из инертного материала, например, из графита, то при электролизе на аноде разряжаются анионы электролита и при этом только те, которые не содержат в своем составе кислорода, например,Cl-, Br-, S2- (кроме F). Если же анионы содержат кислород, например, SO42-, РО43-, NO3- и др., то они остаются в растворе, а разряжаются ионы ОН- (из воды) с выделением свободного кислорода:
4ОН- - 4е = 2H2O + O2.
При электролизе водного раствора соли металла, находящегося в ряду напряжений до алюминия, и кислородосодержащей кислоты, например, К2SO4 ионы соли не разряжаются. Процесс в этом случае сводится к электролизу воды: на катоде выделяется водород, на аноде - кислород.
Схема электролиза водного раствора K2SO4
K2SO4= 2К+ + SO42-,
H2O= H+ + OH-
![]()
![]()
![]()
![]() катод
анод
катод
анод
2Н++ 2е- = Н2 4ОН- - 4е- = 2Н2О + О2
Вследствие уменьшения концентрации ионов водорода в катодном пространстве среда становится щелочной, а в анодном - вследствие уменьшения концентрации гидроксид-ионов - кислой.
Схема электролиза водного раствора NiSO4:
NiSO4= Ni2+ + SO42-,
H2O= H+ + OH-
![]()
![]()
![]()
![]() катод анод
катод анод
Ni2+ + 2е- =Ni0 4ОН- - 4е- = 2Н2О + О2
В анодном пространстве среда становится кислой, в катодном -кислотность не меняется, так как не меняется соотношение концентраций ионов водорода и гидроксид-ионов.
8.2 Экспериментальная часть
8.2.1 Электролиз раствора йодистого калия
В U - образную трубку налейте приблизительно до половины раствор йодистого калия, к которому прибавлено несколько капель крахмального клейстера и 2-3 капли раствора фенолфталеина. Вставьте в оба колена трубки угольные электроды и включите постоянный электрический ток. Наблюдается окрашивание раствора у катода и у анода. Дайте объяснение. Составьте схему электролиза водного раствора.
8.2.2. Электролиз раствора сернокислого натрия
В U - образную трубку для электролиза налейте раствор сернокислого натрия, к которому добавлен раствор лакмуса (индикаторная бумага). Вставьте электроды и включите постоянный электрический ток. Наблюдается изменение (через 1-2 мин) окраски раствора у электродов. Составьте схему электролиза водного раствора сернокислого натрия.
8.2.3. Электролиз раствора сернокислой меди
В U - образную трубку налейте раствор сернокислой меди. Пользуясь угольными электродами, пропускайте ток в течение 4-5 минут. Что выделяется на электродах? Дайте объяснение. Составьте схему электролиза раствора.
8.2.4. Электролиз с растворимым анодом
Присоединив электрод с отложившейся в предыдущем опыте медью к положительному полюсу источника тока, другой электрод подключите к отрицательному полюсу, пропускайте электрический ток.. Наблюдается растворение меди с анода. Дайте объяснение. Составьте схему электролиза водного раствора сернокислой меди при медном аноде.
8.2.5. Электролиз водного раствора хлорида цинка
Электролизер залейте раствором хлорида цинка, опустите в него графитовые электроды, подключите их к источнику тока и проводите электролиз в течение 5 минут. По окончании опыта выньте катод и убедитесь в наличии цинкового покрытия. Появление хлора в анодном пространстве определите по появлению синего окрашивания при добавлении нескольких капель раствора иодида калия и крахмала. Составьте схему электролиза раствора хлористого цинка.
8.3 Контрольные вопросы и задачи
1. Составьте схемы
электролиза водных растворов AgNO3, К2СО3.
Электроды угольные. Определите, какая среда (кислая или щелочная) образуется в анодном и катодном
пространствах.
2. При электролизе каких растворов (CuSO4, Na2S, Al2(SO4)3, Ag2SO4, MnSO4, ZnSO3) в нейтральной среде на катоде будет выделяться водород?
3. При электролизе каких растворов (К3РО4, NaJ, CaCl2, K3S) на аноде будет выделяться кислород?
4. Какие процессы
происходят на аноде и катоде при электролизе
раствора FeCl2, если электроды: а) угольные, б) железные?
5. Сколько меди выделится на катоде, если
через раствор CuSO4
пропускать
электрический ток силой 8 А в течение 6 часов? Что при этом выделится на
инертном аноде и в каком количестве?
9 Лабораторная работа №9. Коррозия металлов
Цель работы: изучение условий возникновения коррозионных микроэлементов, их моделей, а также влияния различных факторов на скорость электрохимической коррозии металлов, ознакомление с наиболее важными методами защиты металлов от коррозии.
9.1 Теоретическое введение
Коррозией называют разрушение металла в результате химического или электрохимического воздействия окружающей среды. Скорость коррозии выражают либо через потерю массы образца в единицу времени на единицу площади поверхности, либо через уменьшение толщины металла в единицу времени.
По характеру разрушения металла различают равномерную и местную коррозию. Равномерная коррозия распределяется по всей поверхности металла, а местная коррозия сосредоточена на отдельных участках.
По механизму коррозионного процесса различают химическую или электрохимическую коррозию. Химическая коррозия характерна для сред, не проводящих электрический ток. В процессе химической коррозии происходит прямое взаимодействие металла с окислителем.
Электрохимическая коррозия возникает в средах, обладающих ионной проводимостью. В этом случае процесс коррозии является анодным растворением металла под влиянием катодного восстановления окислителя. Наиболее распространенными окислителями в коррозионном процессе служат ионы водорода и молекулы кислорода. Коррозия с участием ионов водорода называется коррозией с выделением водорода или коррозией с водородной деполяризацией. В наиболее простом виде электродные процессы могут быть представлены уравнениями
Me0 – ne- →Men+
2Н+ + 2e- →H2
Коррозия с выделением водорода возможна, если потенциал водородного электрода положительнее потенциала металла. Скорость коррозии в этом случае определяется скоростью реакции выделения водорода, зависящей от природы металла и вида поверхности, на которой выделяется водород. Скорость коррозии зависит также от рН и температуры раствора, с которым реагирует металл.
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. В наиболее простом виде электродные процессы могут быть представлены уравнениями
Me0 – ne- →Men+
О2 + 2Н2О +4e- →4OH-
Коррозия с поглощением кислорода возможна, если потенциал кислородного электрода положительнее потенциала металла. Скорость коррозии в этом случае обычно определяется скоростью диффузии кислорода и возрастает яри перемешивании раствора и увеличении концентрации растворенного кислорода.
В некоторых случаях скорость коррозии лимитируется анодными реакциями. Обычно это наблюдается у металлов, способных к пассивации, таких, как алюминий, титан, хром, никель, тантал и др. Пассивностью металла называют состояние повышенной коррозионной устойчивости, вызываемое торможением анодного процесса. Пассивация обычно обусловлена образованием на поверхности металла защитных пленок.
Коррозию можно затормозить пассивацией и изменением потенциала металла, уменьшением концентрации окислителя, изоляцией поверхности металла от окислителя, изменением состава металла. Выбор способа защиты определяется условиями работы металлов и экономической целесообразностью.
Коррозионные свойства, металла можно изменить путем легирования, т. е. введения в состав сплава компонента, который обеспечивает снижение скорости или даже предотвращение коррозии. Обычно в состав сплавов вводят компоненты, вызывающие пассивацию металла, т. е. образование на его поверхности защитных пленок, К числу таких компонентов относятся хром, никель, титан, вольфрам и др.
К эффективному способу снижения скорости коррозии металла относится нанесение на металл защитных покрытий. В качестве защитных используются металлические, оксидные, силикатные, лакокрасочные и другие покрытия. Механизм их действия основан на изоляции металла от окислителя.
Различают катодные и анодные металлические покрытия. Если потенциал металла покрытия отрицательнее потенциала защищаемого металла, то при коррозии происходит растворение металла покрытия, а основной металл не разрушается. Такие покрытия называют анодными, например цинковое покрытие железа. Если потенциал металла покрытия положительнее потенциала основного металла, то в случае нарушения сплошности покрытия (наличия пор, трещин) может корродировать основной металл. Такие покрытия называют катодными, например медное покрытие железа.
Скорость коррозии можно снизить путем торможения анодных или катодных реакций за счет изменения потенциала этих реакций; такой способ защиты металла называют электрохимическим. К электрохимическим методам защиты относят протекторный, катодный и анодный. При подсоединении к защищаемой металлической конструкции протектора, т. е. какого-либо металла, имеющего более отрицательный потенциал, происходит коррозия протектора, а основной металл сохраняется. Катодный метод защиты заключается в подключении защищаемого изделия к отрицательному полюсу внешнего источника тока. В этом случае на защищаемом изделии выделяется водород. При анодном методе защищаемое изделие подключают к положительному полюсу внешнего источника тока, при этом происходит пассивация защищаемого металла.
Коррозию можно замедлить, воздействуя на коррозионную среду: уменьшая концентрацию окислителя или вводя специальные ингибиторы.
9.2 Экспериментальная часть
9.2.1 Электрохимическая неоднородность поверхности стали
Вследствие электрохимической неоднородности стали и наличия окислителя у ее поверхности образуются коррозионные микроэлементы. В процессе их работы осуществляется анодное растворение железа. О растворении железа судят по появлению турнбуленовой сини при взаимодействии Fе2+ с индикатором.
Для проведения опыта зачистите стальную пластинку наждачной бумагой, промойте проточной водой и высушите фильтровальной бумагой. Затем положите на пластинку бумажный фильтр, смоченный ферроксилиндикатором.
Через 2 — 3 мин опишите изменение цвета фильтровальной бумаги, форму и распределение пятен. Объясните наблюдения и, используя значения потенциалов электродных реакций, запишите уравнения этих реакций.
9.2.2 Коррозия железа в контакте с углеродом
Заполните U-образную трубку на ![]() объема 0,5 М раствором хлорида натрия. Зачистите наждачной бумагой и промойте проточной водой стальные и графитовые стержни. В одно колено трубки
поместите стальной стержень и добавьте 3 — 4 капли pacтвора K3[Fe(CN)6],
во второе колено погрузите графитовый стержень и добавьте 3 — 4 капли
фенолфталеина.
объема 0,5 М раствором хлорида натрия. Зачистите наждачной бумагой и промойте проточной водой стальные и графитовые стержни. В одно колено трубки
поместите стальной стержень и добавьте 3 — 4 капли pacтвора K3[Fe(CN)6],
во второе колено погрузите графитовый стержень и добавьте 3 — 4 капли
фенолфталеина.
Замкните внешнюю цепь через милливольтметр и запишите напряжение. Отключите вольтметр, замкните внешнюю цепь медным проводником и наблюдайте за работой элемента, а также изменением окраски раствора в катодном и анодном пространствах.
Запишите уравнения анодного процесса и значение стандартного потенциала электрода. Объясните причину изменения окраски раствора у анода.
Рассчитайте потенциалы возможных катодных процессов с учетом рН среды в начале опыта, принимая давление газов равным атмосферному.
Напишите уравнения процессов, протекающих на катоде, и объясните причину изменения окраски раствора у катода.
Запишите суммарное уравнение коррозионного процесса и схему коррозионного элемента.
9.2.3 Влияние природы контактирующих металлов на скорость коррозии железа
В опыте изучается коррозия стали в паре с различными металлами. В первой части опыта железо находится в паре с никелем или медью, во второй части опыта — в паре со свинцом или кадмием.
В U-образную трубку залейте на 1/2 объема 0,1 М раствор H2SO4. Металлические пластины тщательно зачистите наждачной бумагой и промойте проточной водой. В одно колено трубки поместите стальную пластинку, во второе — никелевую (или медную). С помощью милливольтметра определите напряжение элемента. Повторите опыт с кадмиевой или свинцовой пластинкой.
При оформлении результатов опыта запишите: уравнения анодного и катодного процессов, а также суммарное уравнение реакции. Приведите схему коррозионного элемента.
Рассчитайте потенциал катодной реакции и объясните влияние природы использованных металлов на скорость коррозии и напряжение коррозионного элемента.
9.2.4 Пассивность металла
Поведение пассивного и активного металла в растворе хлорида натрия. Для активации железа стальную пластинку обрабатывают раствором соляной кислоты с молярной концентрацией 0,5 моль/л, для пассивации — дымящей азотной кислотой.
Заполните U-образную стеклянную трубку раствором хлорида натрия с молярной концентрацией 0,5 моль/л. Зачистите наждачной бумагой и промойте проточной водой графитовый и стальной стержни (пластинки). Затем стальной стержень погрузите на 2 — 3 мин в 0,5 М раствор соляной кислоты и промойте проточной водой. В одно колено трубки поместите стальной стержень и добавьте 3 — 4 капли раствора K3[Fe(CN)6], во второе колено погрузите графитовый стержень и добавьте 3 — 4 капли фенолфталеина. Замкните внешнюю цепь через милливольтметр и запишите напряжение. Отключите милливольтметр, замкните внешнюю цепь медным или алюминиевым проводником и наблюдайте за изменением окраски раствора в катодном и анодном пространствах вследствие работы элемента.
Вынув стальной стержень, промойте его проточной водой, погрузите на 2 — 3 мин в дымящую азотную кислоту (плотность 1,5 г/см3) и промойте проточной водой. Обработка в кислоте проводится под тягой! Вылейте раствор из U-образного сосуда и замените его свежим раствором с такими же индикаторами, как и в первой части опыта. Погрузите стальной и графитовый стержни в трубку и повторите наблюдения.
При оформлении результатов опыта:
запишите возможные анодные процессы на стальном стержне в U-образной трубке и причину изменения окраски раствора у анода. Объясните разницу коррозионного поведения стального стержня в сосуде после обработки разбавленной соляной и концентрированной азотной кислотами;
определите потенциалы возможных катодных процессов с учетом рН среды в начале опыта, принимая давление газов равным атмосферному. Запишите уравнения процессов, протекающих на катоде, и причину изменения окраски раствора у катода.
Объясните разное поведение катода в паре с активированным и пассивированным железом.
Запишите суммарное уравнение коррозионного процесса и приведите схему коррозионного элемента. Объясните причину различия напряжения элемента в первой и второй частях опыта.
9.2.5 Активирующее действие ионов хлора
В две пробирки налейте (![]() объема) раствор
сульфата меди, подкисленный серной кислотой. В одну из пробирок добавьте хлорид натрия. Затем в обе пробирки поместите
алюминиевую проволоку. Наблюдайте, в
какой из пробирок интенсивнее выделяется
газ.
объема) раствор
сульфата меди, подкисленный серной кислотой. В одну из пробирок добавьте хлорид натрия. Затем в обе пробирки поместите
алюминиевую проволоку. Наблюдайте, в
какой из пробирок интенсивнее выделяется
газ.
Запишите уравнение анодного, катодного и суммарного процессов, приведите схему коррозионного элемента. Объясните механизм влияния ионов хлора на скорость реакции.
9.2.6 Легирование металла
В качестве легирующих добавок к железу применяют никель и хром, так как никель и хром входят в состав нержавеющей стали.
В две пробирки налейте (![]() объема) воды и
добавьте 2 - 4 мл раствора H2SO4 и 2-4 капли раствора K3[Fe(CN)6]. В одну пробирку поместите зачищенную наждачной бумагой и
промытую проточной водой стальную пластинку, во вторую пробирку —
пластинку из нержавеющей стали (незачищенную). Отметьте изменение цвета
раствора через 5 мин и количество выделяющихся
пузырьков газа в единицу времени.
объема) воды и
добавьте 2 - 4 мл раствора H2SO4 и 2-4 капли раствора K3[Fe(CN)6]. В одну пробирку поместите зачищенную наждачной бумагой и
промытую проточной водой стальную пластинку, во вторую пробирку —
пластинку из нержавеющей стали (незачищенную). Отметьте изменение цвета
раствора через 5 мин и количество выделяющихся
пузырьков газа в единицу времени.
Объясните ваши наблюдения, запишите уравнения анодных и катодных процессов, предварительно рассчитав их потенциалы (рН раствора 1, активность ионов железа 10-3 моль/л). Приведите схему коррозионного процесса. Объясните причину различного поведения пластинок в растворе кислоты.
9.2.7 Анодные и катодные защитные покрытия
В две пробирки налейте (![]() объема) воды и
добавьте по 1-2 мл H2SO4 и по 2-4
капли раствора K3[Fe(CN)6].
В одну пробирку поместите полоску оцинкованного, а в другую — луженого железа.
Через 5 мин отметьте изменение цвета раствора в
пробирках.
объема) воды и
добавьте по 1-2 мл H2SO4 и по 2-4
капли раствора K3[Fe(CN)6].
В одну пробирку поместите полоску оцинкованного, а в другую — луженого железа.
Через 5 мин отметьте изменение цвета раствора в
пробирках.
Объясните ваши наблюдения, запишите уравнения анодных и катодных процессов и приведите схемы работы коррозионных элементов. Укажите, какое из изученных покрытий было анодным и какое — катодным.
Вылейте растворы из пробирок; полоски оцинкованного и луженого железа хорошо промойте под краном проточной водой и проделайте опыт с раствором щелочи. Наблюдения запишите и объясните.
9.3 Контрольные вопросы и задачи
1. Что называется коррозией металлов?
2. Какие виды коррозии вы знаете?
3. В чем отличие электрохимической коррозии от химической?
4. Как можно охарактеризовать скорость электрохимической
коррозии?
5. Чем вызвана электрохимическая неоднородность поверхности металла?
6. Каковы причины возникновения коррозионных микрогаль-
ванических элементов?
7. Каким образом можно определить
возможность протекания
коррозии
с выделением водорода и с поглощением кислорода?
8. Какие факторы влияют на скорость
коррозии с выделением
водорода?
9. Как можно замедлить
скорость коррозии с поглощением
кислорода?
10. Какое явление называется пассивацией металла?
11. Что такое активаторы коррозии?
12. Возможна ли коррозия
с выделением водорода в растворе,
в котором активность Си2+
равна 10-3 моль/л и рН среды равен 3?
13. Возможна ли коррозия
железа с выделением водорода в ра
створе, в котором активность
ионов Fe2+ равна 10-4 моль/л, а рН
среды равен 2?
14. Возможна ли коррозия
меди с поглощением кислорода на
воздухе в растворе, в котором
активность Сu2+ равна 10-4 моль/л,
а среда нейтральна?
15. Возможна ли коррозия
золота с поглощением кислорода на
воздухе в растворе, в котором
активность Аu+ равна 10-4 моль/л, а
среда нейтральна.
16. Как можно снизить скорость коррозии металлов?
17. Какие
защитные покрытия вам известны и какими методами
их
получают?
18. Что такое анодные и катодные защитные покрытия?
19. На
чем основана электрохимическая защита металлов и какие
разновидности
этой защиты вам известны?
20. В чем заключается сущность катодной защиты металлов?
21. Что такое протекторная защита металлов?
22. Как
изменяют коррозионную среду для снижения скорости кор-
розионного
процесса?
23. Какие вещества называют ингибиторами коррозии?
10 Лабораторная работа №10. Определение жесткости воды
Цель работы: проведение анализа воды на жесткость, определение карбонатной и некарбонатной жесткости воды.
10.1 Теоретическое введение
Жесткость — один из технологических показателей, принятых для характеристики состава и качества природных вод.
Жесткой называют воду с повышенным содержанием ионов Са2+ и Mg2+. Сумма концентраций ионов Са2+ и Mg2+ является количественной мерой жесткости воды
![]()
Измеряют жесткость числом миллимолей эквивалентов ионов жесткости (Са2+ и Mg2+) в 1 кг воды (ммоль/кг). В связи с тем, что плотность воды близка к единице, жесткость можно измерять в ммоль/дм3 или ммоль/л.
При расчетах, связанных с жесткостью воды,
следует учитывать, что Э(Са2 +) = ![]() Са2+ и Э(Mg2+) =
Са2+ и Э(Mg2+) =![]() Mg2
+ , a Мэ (Са2+) =
Mg2
+ , a Мэ (Са2+) = ![]() Ми(Са2+) = 20 г/моль
и Mэ(Mg2 +) =
Ми(Са2+) = 20 г/моль
и Mэ(Mg2 +) =![]() Mи(Mg2+) = 12 г/моль где Мэ – молярная
масса эквивалента; Ми – молярная масса иона. Например: 0,2 т - это
масса 0,01 моль или 10 ммоль эквивалентов Са2+.
Mи(Mg2+) = 12 г/моль где Мэ – молярная
масса эквивалента; Ми – молярная масса иона. Например: 0,2 т - это
масса 0,01 моль или 10 ммоль эквивалентов Са2+.
Различают жесткость воды общую Жо, карбонатную Жк и некарбонатную Жнк.
В связи с тем, что в воздухе достаточно велико содержание СО2, в природной воде есть растворенный диоксид углерода. Протекает взаимодействие СО2 с Н2О
СО2 +Н2О = Н2СО3= Н+ + НСО3-
результатом которого является образование гидрокарбонат-иона. Концентрация ионов Са2+ и Mg2+ в воде, эквивалентная содержанию иона НСО3-, определяет карбонатную жесткость воды, а концентрация ионов Са2+ и Mg2 + , эквивалентная всем прочим анионам (SO42-, Cl- и т. д.), некарбонатную. Сумма карбонатной и некарбонатной жесткости составляет общую жесткость воды.
Использование природной воды в технике требует ее предварительной очистки, в том числе умягчения (снижения жесткости до определенной нормы). В настоящее время для умягчения воды широко используется ионный обмен.
При контроле качества воды определяют ее жесткость. Для определения общей жесткости используют метод комплексонометрии. В основе этого метода лежит титрование воды в присутствии аммиачного буферного раствора (рН 10,0) и индикатора раствором комплексона III до перехода розовой окраски в голубую.
При анализе применяют один из индикаторов: кислотный хром синий К или эриохромчерный Т. В присутствии ионов жесткости Са2+ и Mg2+ эти индикаторы окрашиваются в розовый цвет, в отсутствие — в голубой.
Комплексон III — двузамещенная натриевая соль этилен-диаминтетрауксуской кислоты
![]()
![]()
![]() NaOOCCH2
CH2COONa
NaOOCCH2
CH2COONa
N- CH2 – CH2 – N
HOOCCH2 CH2COONa
При титровании жесткой воды раствором комплексона III образуется внутрикомплексное соединение
![]()
![]() OOCCH2
CH2COO 2-
OOCCH2
CH2COO 2-
N – CH2 – CH2 – N
![]()
![]()
![]()
![]()
OOCCH2 Ca CH2COO
т.е. связываются ионы Са2+ и Mg2+. Поэтому в конце титрования индикатор изменяет окраску, раствор становится голубым.
Определение карбонатной жесткости воды Жк сводится к определению концентрации гидрокарбонат-иона HCO3- и, тем самым, эквивалентной этим ионам концентрации ионов жесткости Са2+ и Mg2 + . Анализ проводят методом нейтрализации. В основе этого метода лежит титрование воды в присутствии метилового оранжевого раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую.
Метиловый оранжевый — кислотно-основной индикатор, изменяющий свою окраску от красной при рН < 3,1 до желтой при рН > 4,4. В точке перехода метиловый оранжевый имеет оранжевую окраску.
Анион НСО3- в воде гидролизуется
HCO3- + Н2О = Н2СО3 + ОН-.
Поэтому при условии Жк > 0 вода имеет щелочную реакцию среды и метиловый оранжевый в ней окрашен в желтый цвет. При титровании раствором НС1 такой воды протекает реакция нейтрализации
ОН- +Н+ =Н2О
Ионы Н+ нейтрализуют количество ионов ОН-, эквивалентное концентрации иона НСО3-.
Анализ воды на жесткость предполагает обычно:
а) определение общей жесткости, Жо;
б) определение карбонатной жесткости, Жк;
в) вычисление некарбонатной жесткости, Жнк = Жо — Жк.
10.2 Экспериментальная часть
10.2.1 . Определение общей жесткости воды комплексонометрическим методом
Отберите мерным цилиндром 100 мл воды и перенесите ее в коническую колбу, добавьте к исследуемой воде 5 мл аммиачного буферного раствора и 5 - 7 капель индикатора кислотного хром синего К или несколько кристалликов (на кончике шпателя) эриохромчерного Т.
Приготовленную пробу медленно при постоянном перемешивании оттитруйте раствором комплексона III до перехода розовой окраски индикатора в голубую. Результат титрования запишите.
Повторите титрование еще раз. Если результаты двух титрований совпадут (ΔV≤0,1 мл), рассчитайте общую жесткость воды. В противном случае оттитруйте еще одну пробу воды. Найдите среднее значение объема раствора комплексона III, израсходованное на титрование воды.
Общую жесткость воды рассчитывают по закону эквивалентов [ммоль/л]
![]()
где V1 — объем анализируемой воды, мл;
V2 — объем раствора комплексона III, мл;
N2 — эквивалентная концентрация раствора комплексона III, моль/л;
1000 — коэффициент перевода моль/л в ммоль/л.
Результаты опыта сведите в таблицу.
Т а б л и ц а 4
|
Объем раствора комплексона III V2 |
Эквивалентная концентрация комплексона III N2 |
Объем исследуемой воды V1 |
Общая жесткость воды Жо |
|
|
|
|
|
10.2.2 Определение карбонатной и некарбонатной жесткости воды
Отберите мерным цилиндром 100 мл воды и перенесите ее в коническую колбу. Добавьте к исследуемой воде несколько капель метилового оранжевого, чтобы окраска раствора в колбе по интенсивности была близкой к окраске контрольного раствора с этикеткой «до титрования».
Приготовленную пробу оттитруйте раствором соляной кислоты до перехода желтой окраски индикатора в оранжевую (но не розовую!). Результат титрования запишите.
Повторите титрование еще раз. Если результаты двух титрований совпадут (ΔV≤0,1 мл), рассчитайте карбонатную жесткость воды. В противном случае оттитруйте еще одну пробу воды. Найдите среднее значение объема раствора соляной кислоты, израсходованной на титрование воды.
Расчет карбонатной жесткости воды по закону эквивалентов (ммоль/л):
![]()
где V1 — объем анализируемой воды, мл; V2 — объем раствора HCl, мл; N2 — эквивалентная концентрация раствора HCl, моль/л; 1000 — коэффициент перевода моль/л в ммоль/л.
Некарбонатную жесткость воды Жнк находят по разности
Жнк = Жо — Жк.
Результаты опыта сведите в таблицу.
Т а б л и ц а 5
|
Объем раствора HCl, V2 |
Эквивалентная концентрация раствора HCl, N2 |
Объем исследуемой пробы, V1 |
Жесткость воды |
|
|
карбонатная, Жк |
некарбонатная, Жнк |
|||
|
|
|
|
|
|
10.3 Контрольные вопросы и задачи
1. Какие катионы называют ионами жесткости?
2. Какой технологический
показатель качества воды называют
жесткостью?
3. Почему жесткую воду
нельзя применять для генерации пара
на тепловых
и атомных электростанциях?
4. Какой метод умягчения
воды называют термическим? Какие
химические
реакции протекают при умягчении воды этим методом?
5. Как осуществляют умягчение воды методом осаждения? Какие реагенты используют? Какие реакции протекают?
6. Можно ли умягчить воду с помощью ионного обмена?
7. Какой процесс следует
проводить для умягчения воды: катио-
нирования или анионирования?
Почему? Составьте уравнения реакций,
протекающих при умягчении воды с помощью
ионного обмена.
8. Как определяют общую жесткость воды?
9. Как определяют карбонатную жесткость воды?
10. Как находят некарбонатную жесткость воды?
11. Общая жесткость воды равна 4 ммоль/л. Через ионообменный фильтр пропущено 100 л Н2О. Сколько молей эквивалентов Са2+ и Mg2 + задержано фильтром, если известно, что жесткость снизилась до 0,5 ммоль/л. Ответ. 0,35 моль эквивалентов ионов жесткости.
12. При определении общей жесткости воды на титрование 200 мл Н2О израсходовано 8 мл . раствора комплексона Ш эквивалентной концентрацией 0,1 моль/л. Вычислите общую жесткость. Ответ. 4 ммоль/л.
13. Вычислите карбонатную жесткость, если на титрование 200 мл Н2О израсходовано 8 мл раствора НСl эквивалентной концентрацией 0,05 моль/л. Ответ. 2 ммоль/л.
14. Вычислите общую, карбонатную и некарбонатную жесткость воды, если: а) на титрование 200 мл Н2О израсходовано 7,6 мл комплексона III эквивалентной концентрацией 0,05 моль/л; б) на титрование 100 мл Н2О - 1,5 мл раствора НСl концентрацией 0,1 моль/л. Ответ. 1,9; 1,5; 0,4 ммоль/л.
П р и м е ч а н и е.-. Следует обратить внимание на то, что жесткость измеряется в ммоль/л частиц, состав которых 1/2 Са2+ и 1/2 Mg2+ , т. е. — в ммоль/л эквивалентов ионов жесткости.
Список рекомендуемой литературы
1. Коровин Н.В. Общая химия.- М.: Высшая школа, 2005.
2. Харин А.Н., Катаева Н.А., Харина Л.Г. Курс химии.- М.: Высшая школа,1983.
3. Глинка Н.Л. Общая химия.- Л.: Химия, 1999.
4. Ахметов Н.С. Общая и неорганическая химия. - М.: Высшая школа, 1998.
5. Некрасов Б.В. Основы общей химии.- М.: Химия, 1998.-т.1,2.
6. Угай А. Я. Общая и неорганическая химия. - М.: Высшая школа, 1997.
7. Дробашева Т.И. Общая химия. - Ростов-на-Дону: Феникс, 2004.
8. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии.- М.: Астрель, 2004.
9. Глинка Н.Л. Задачи и упражнения по общей химии.- М.: Интеграл-Пресс, 2004.
10. Задачи и упражнения по общей химии под ред. Коровина Н.В. - М.: Высшая школа, 2004.
11. Лидин Р.А., Молочко В.А., Андреева Л.Л. Задачи по неорганической химии.- М.: Высшая школа, 1990.
Содержание
Введение
1 Лабораторная работа №1. Классы неорганических соединений
2 Лабораторная работа №2. Эквивалент и молярная масса эквивалента
3 Лабораторная работа №3. Кинетика химических реакций
4 Лабораторная работа №4. Химическое равновесие
5 Лабораторная работа №5. Гидролиз солей
6. Лабораторная работа №6. Окислительно-восстановительные реакции
7 Лабораторная работа №7. Ряд напряжений металлов и работа гальванических элементов
8 Лабораторная работа №8. Электролиз
9 Лабораторная работа №9. Коррозия металлов
10 Лабораторная работа №10. Определение жесткости воды
Список рекомендуемой литературы