Коммерциялық емес акционерлік
қоғам
АЛМАТЫ ЭНЕРГЕТИКА және БАЙЛАНЫС УНИВЕРСИТЕТІ
Өнеркәсіптік жылуэнергетика кафедрасы
ХИМИЯ
Дәрістер жинағы
(5В074600 – «Ғарыштық
техника және технологиялар» мамандығының студенттері
үшін)
Алматы 2013
ҚҰРАСТЫРҒАНДАР: Каленова Ж.А., Колдасова Г.А. Химия. 5В074600 – «Ғарыштық техника және технологиялар» мамандығының студенттері үшін дәрістер жинағы. – Алматы: АЭжБУ, 2013 – 39 б.
Химиядан дәрістер жинағы 5В074600 – «Ғарыштық техника және технологиялар» мамандығы бойынша бакалавриатта оқитын 1 курс студенттері үшін «Химия» курсы бойынша дәрістерден тұрады.
Әдеб. көрсеткіші – 9 атау.
Пікір беруші: АЭжБУ доценті Туманов М.Е.
«Алматы энергетика және байланыс университеті» Комерциялық емес акционерлық қоғамы 2013 ж. жоспары бойынша басылады.
© «Алматы энергетика және байланыс университеті» КЕАҚ, 2013 ж.
Кіріспе
Химия – заттар және олардың қасиеттері мен өзгерістері туралы ғылым. Жаратылыстану пәндерінің ішінде химия мен физика өзара тығыз байланысты. Физика пәні денелерді қарастырса, ал химия пәні сол денелерді құрайтын заттарды зерттеуді басты нысана етіп алады.
Химияның міндеті – заттарды қолдану үшін қасиеттерін айқындау, адамдардың сұранысына қажет жаңа химиялық заттар алу, табиғи қорларды орынды пайдаланып, қоршаған ортаны қорғау.
Дәрістер жинағы химия пәнін 2 кредит көлемінде бакалавриат бағыты бойынша оқитын студенттерге арналған. Ұсынылып отырған дәрістер жинағы студенттерге химия пәнін оқуға, емтихан мен аралық бақылауларға дайындалуға көмек етеді.
Дәрістер жинағы химия пәнінен оқулық бағдарламаға сәйкес келеді және 8 дәрістен түрады.
1 дәріс. Химияның негізгі заңдары мен түсініктері
Дәрістің мақсаты: атом-молекулалық ілімнің негізгі қағидаларымен танысу. Атом, молекула, моль, мольдік масса, эквивалент, эквивалент заңымен есеп шығара білу.
Атом молекулалық ілімінің негізі 18-ғасырдың аяғы мен 19-ғасырдың басында жасалды. Ломоносов 1741 жылы шыққан “математикалық химия” деген еңбегінде атом молекулалық ілімінің негізгі қағидаларын былай тұжырымдады:
1) барлық заттар молекулалардан тұрады;
2) молекулалар атомдардан тұрады;
3) бөлшектер, атомдар, молекулалар үнемі қозғалыста болады;
4) жай заттардың атомы бір молекуладан, күрделі заттардың атомы бірнеше молекуладан тұрады.
Молекула – заттың химиялық қасиетін сақтап тұратын ең кіші бөлшегі. Атом – химиялық элементтің ең кіші бөлшегі. Әрбір химиялық элементке белгілі бір атомның жиынтығы сәйкес келеді. Атомдар бір-бірімен бірігіп байланысып молекула түзеді. Қазіргі анықтамасы: атом – оң зарядталған атом ядросынан және теріс зарядталған электрондардан тұратын электронейтрал бөлшек. Протондар мен нейтрондардың ортақ атауы нуклондар. Жалпы алғандағы атом электрлік бейтарап болғандықтан, электрондардың қосынды заряды ядро зарядына тең болуы керек. Элементтің реттік нөмірі атом ядросының зарядына тең және ядродағы протон санына тең және атомдағы электрон санына тең. Ядро массасы (және атом массасы да) протон (Z) саны мен нейтрон (N) санының қосындысымен анықталады. Бұл қосындыны атомның массалық саны (A) деп атайды A=Z+N.
Элемент – белгілі бір атомның түрі. Бірдей атомдардан тұратын заттар жай заттарға жатады: Ғе, О2, Н2.
Бір элементтің бірнеше жай заттар түзуін аллотропиялық құбылыс дейді. Көміртектің аллотроптық түрі: алмас, графит, карбин және фулерен; оттектікі – мелекулалық оттек О2 пен озон О3.
Ядро зарядтары (Z)
бірдей, ал массалық саны (A) әртүрлі болатын
атомдарды изотоптар деп атайды. Сутек элементінің үш изотопы
бар:
протий - ![]() Н, дейтерий -
Н, дейтерий - ![]() Н немесе D, тритий -
Н немесе D, тритий - ![]() Н немесе Т.
Н немесе Т.
Ядро зарядтары (Z)
әртүрлі болатын, ал массалык саны (A)
бірдей атомдарды изобаралар деп атайды. ![]() Ar;
Ar; ![]() K;
K; ![]() Ca.
Ca.
Молекулалары әртүрлі элементтің атомдарынан тұратын заттарды – күрделі заттар дейді: CuO, H2SO4. Күрделі заттарға барлық оксидтер, қышқылдар, негіздер, тұздар және толып жатқан органикалық қосылыстар жатады.
Иондар – зарядталған бөлшектер: оң зарядталғанды катиондар және теріс зарядталғанды аниондар дейді.
Атомның ең маңызды көрсеткіштерінің бірі оның массасы. 1961 жылы халықаралық келісім бойынша массаның атомдық бірлігі ретінде атомдық массасы 12-ге тең көміртек изотопы массасының 1/12 бөлігі қабылданды. Көміртек (С-12) атомы массасының 1/12 бөлігі массасының атомдық бірлігі (м.а.б) деп аталады. 1 массаның атомдық бірлігі (1 м.а.б.) 1,66∙10-27 кг тең.
Ar(O) = 26,60∙10-27 / 1,66∙10-27 = 16;
Ar(H) = 1,67∙10-27 / 1,66∙10-27 = 1.
Салыстырмалы атомдық масса дегеніміз сол элемент атомы массасының көміртек атомы массасыныкі 1/12 бөлігінен немесе массасының атомдық бірлігінен неше есе ауыр екенін көрсететін сан.
Зат мөлшері ν – атом, молекула, иондарының құрылыс бірліктерінің санын көрсететін физикалық шама. Ол ν таңбасымен белгіленеді, өлшем бірлігі – моль. Моль дегеніміз – 0,012 кг 12С изотобындағы құрылыс бірліктеріне тең шама.
Зат мөлшерінің 1 молінің массасы оның молярлық массасы деп аталады М = m/ν; өлшем бірлігі – кг/моль немесе г/моль.
![]() .
.
Зат массасының сақталу заңы (1748 ж. М.В. Ломоносов; 1766 ж. А.Лавуазье ашты.) Реакцияға қатысқан заттардың массасы шыққан зат өнімдерінің массасына тең. Бұл заң ядролық реакцияларда қолданылмайды. 1905 жылы Эйнштейн энергия сақталу заңын ашты:
![]() .
.
Мұндағы Е – энергия;
m – масса;
с – вакуумдағы жарықтың жылдамдығы, ол 2,9979∙108 м/с тең.
Бұл формула бойынша энергия массалардың өзгерісі мен жарық жылдамдығының квадратының көбейтіндісіне тең. Яғни, ядролық реакцияларда массаның өзгерісі алынады: демек, ядролық өзгерістерде масса тұрақты болмайды.
Зат массасының сақталу заңының мәнін былай түсіндіруге болады: реакцияға қатысқан заттардың құрамында қандай атомдар қанша мөлшерде болса, реакция нәтижесінде шыққан заттардың құрамында да сондай атомдар сонша мөлшерде болады. Химиялық реакциялар кезінде атомдар массалары өзгермейтіндіктен реакцияға қатысқан заттардың массасы тұрақты болады. Барлық химиялық реакциялар заттар массасы сақталу заңына бағынады.
Заттар массасы сақталу заңының мысалы ретінде литийдің оттегі арқылы тотығу реакциясының теңдеуін келтірейік:
4Li + O2 = 2Li2O;
6,94∙4 + 15,999∙2 = 6,94∙4 + 15,999∙2;
59,758 = 59,758.
Бұл теңдеуден реакцияға төрт атом литий, екі атом оттегі қатысатынын, ал реакция нәтижесінде түзелген литий оксидінің құрамында да төрт атом литий, екі атом оттегі бар екенін көруге болады. Олай болса реакцияға қатысқан заттар мен шыққан заттардың құрамындағы атомдардың түрлері мен сандары өзгермейтіндіктен реакцияласқан заттардың массасы одан түзілген заттардың массасына тең болады.
1801 жылы француз ғалымы Ж. Пруст құрам тұрақтылық заңын ашты. Алыну әдісіне қарамастан берілген қосылыстардың құрамы тұрақты болады. Аммиакты мынандай әр түрлі әдістермен алуға болады:
N2 + 3H2 = 2NH3;
NH4Cl + NaOH = NH3 + H2O + NaCl;
NH4Cl = NH3 + HCl.
Бұл реакциялар теңдеулерінен аммиак қандай әдістермен алынса да сапалық құрамы жағынан азот пен сутегіден, сандық құрамы жағынан бір атом азоттан және үш атом сутегіден тұратынын көруге болады. Сондықтан оның массасы және құрамындағы элементтердің проценттік мөлшерлері де тұрақты болады.
Құрамын сақтайтын қосылыстар – дальтонидтер, ал құрамын сақтамайтын қосылыстар бертолидтер деп аталды.
Еселік қатынас заңын Д. Дальтон ашты (1803 ж.). Егер екі элемент бір-бірімен бірнеше химиялық қосылыс түзсе, онда бір элемент мөлшерінің екінші элемент мөлшеріне қатынасы бүтін сандарға тең болады. Көміртегі оксидтері СО мен СО2-дегі көміртегінің 12 масса мөлшеріне келетін оттегі массаларының өзара қатынасы 16:32 = 1:2 қатынасындай болатынын аңықтау қиын емес.
Еселік қатынас заңынан молекулалық қосылысқа кіретін элементтің ең кіші бөлшегі атом екеніне көз жеткізуге болады. Мысалы көміртегі (II) оксидінде оттегінің 1 атомы болса, көміртегі (IV) оксидінде оттегінің 2 атомы болады.
Реакцияға қатысқан және оның нәтижесінде түзілген газдардың көлемдерін зерттей келіп француз ғалымы Гей-Люссак (1808 ж.) газдардың көлемдік қатынас заңын ашты. Реакцияға түсетін газдардың көлемдерінің түзілген газ өнімдерінің көлемдеріне қатынасы бүтін санға тең. 1 көлем сутегі мен 1 көлем хлор әрекеттесіп 2 көлем хлорсутек түзеді; екі көлем сутегі мен бір көлем оттегі әрекеттесіп 2 көлем су буын түзеді:
H2 + Cl2 = 2HCl;
2H2 + O2 = 2H2O.
Бойль-Мариот заңы: Тұрақты температурада берілген газ массасындағы газ қысымы мен көлемінің көбейтіндісі тұрақты шама болады:
![]() , егер
, егер ![]() .
.
Гей-Люссак заңы: Тұрақты қысымда берілген газ массасындағы көлем абсолютті температураға тура пропорционал болады:
![]() , егер
, егер ![]()
![]() .
.
Шарль заңы: Тұрақты көлемде берілген газ массасындағы қысым абсолютті температураға тура пропорционал болады:
![]() .
.
Үш параметрдің арасындағы қатынас Менделеев-Клайперон теңдеуімен сипатталады:
![]() .
.
Мұндағы Р – газ қысымы;
V – газ көлемі;
Т – абсолюттік температура;
R – универсалды газ тұрақтысы;
m – газдың мольдік саны;
М – газдың молярлық массасы.
Авогадро заңы: 1811 жылы итальян физигі Авогадро химиялық реакцияларға түскен газдардың көлемдерінің қатынастарын зерттеп мынадай тұжырымдама жасады: Бірдей температура мен қысымда алынған кез келген газдардың бірдей көлеміндегі молекула сандары бірдей болады. Заңнан шығатын салдар:
1) Кез келген газдың 1 молі қалыпты жағдайда бірдей көлем алады. V = 22,4 дм3/моль.
2) Қалыпты жағдайда 1 моль газдың тұрақты көлеміндегі бөлшектердің саны Авогадро тұрақтысымен сипатталады: NA = 6,02·1023 моль-1.
Эквивалент дегеніміз – реакция кезінде орнын баса алатын, қосып алатын, бөліп шығаратын бір сутек ионының немесе тотығу-тотықсыздану реакциясы кезіндегі бір электрон эквивалентіне тең заттың бөлшегі.
Йодты сутекте HI сутегінің 1 молімен қосылып тұрғандықтан йодтың эквиваленті 1 мольге, күкіртті сутекте H2S cутегінің екі молімен қосылып тұрғандықтан күкірттің эквиваленті 1/2 мольге, аммиакта NH3 сутегінің үш молімен қосылып тұрғандықтан азоттың зквиваленті 1/3 мольге, силанда SiH4 сутегінің төрт молімен қосылып тұрғандықтан кремнийдің эквиваленті 1/4 мольге тең болады.
Эквиваленттер заңы: реакцияға түсетін заттардың массасы олардың эквиваленттеріне тура пропорционал болады.
![]() .
.
Егер әрекеттесуші заттар газ түрінде болса, онда эквиваленттер заңы былай өрнектеледі:
![]() .
.
Мұндағы VА мен VВ – әрекеттесуші газдың көлемі.
Химиялық қосылыстың эквиваленті деп оның сутегінің немесе басқа заттың 1 эквивалентімен қалдықсыз әрекеттесетін мөлшерін айтады.
Заттың эквивалентін анықтау үшін химиялық реакция құрып, оның молекулалық массасын әрекеттесуші заттың эквивалент санына бөлу керек.
Алмасу реакциясына қатысатын негіздер мен қышқылдардың эквиваленттік массаларын олардың молярлық массаларын реакция кезінде жоғалтатын гидроксид немесе сутегінің иондарының сандарына бөлу арқылы табады:
NaOH + H2SO4 = NaHSO4 + H2O;
![]()
![]()
NaOH + H2SO4 = Na2SO4 + H2O,
![]()
![]()
2 дәріс. Атом құрылысы. Периодтық заң және периодтық жүйе. Химиялық байланыс. Радиоактивтілік
Дәрістің мақсаты: атомның электрондық құрылысын, химиялық байланыстардың маңызды түрлерін аңықтау, ядролық реакцияларды және өзгерістерді зерттеу.
Э. Резерфорд атом құрылысының моделін ұсынды. Бұл модельді атомның ядролық немесе планеталық моделі деп атады. Өйткені, атом құрылысы Күн жүйесіне ұқсас деп қарастырылды. Бірақ бұл модель атом құрылысының орнықты күйін және олардан шығатын сәулелердің қарқынын классикалық физика ұғымдары аясында түсіндіре алмады. Сондықтан Резерфорд моделі мен классикалық физика арасындағы айтылған қайшылықтарды шешу үшін 1913 ж. Н. Бор өз қағидаларын ұсынды.
Француз ғалымы А. Беккерель 1896 жылы Рентген сәулелерін зерттеумен шұғылданды. Зерттеу барысында кейбір минералдардың сәуле шығаратынын байқаған. Бұл зерттеу нәтижелері радиоактивтілік құбылысының ашылуына себеп болды.
Электронның кеңістіктегі орны оның энергетикалық күйіне байланысты болады. Электронның болу мүмкіндігінің максимал шамасы орбиталь деп аталады. Электронның орнын сақтау үшін бүтін сандар алынады. Ол сандар квант сандары деп аталады.
Бас квант саны n 1, 2, 3...∞ мәндері болады. Ол электронның энергиясын және орбитальдың өлшемін анықтайды. n = 1 болғанда электронның энергетикалық күйі ең төменгі денгейге сәйкес келеді. Электрондық қабат саны артқан сайын энергия да артады. Сондықтан атомдағы орбитальдар белгілі бір энергетикалық деңгейге бөлінеді. Ол энергетикалық деңгейлерді кейде K, L, M, N, O, P, Q – латын алфавитінің әріптерімен белгілейді.
Қосымша квант саны – l, орбитальдың кеңістіктегі пішінін сипаттайды. Сонымен бірге белгілі бір деңгейдегі электронның әртүрлі энергетикалық жағдайын анықтайды. 1, 0, 1, 2...n – 1 мәндері болады. Қосымша квант санының әртүрлі мәндерін ажырату үшін латын әріптерімен белгілеу қабылданған: s (l = 0), р (l = 1), d (l = 2), f (l = 3), g (l = 4). Қосымша квант саны l-дың әртүрлі мәндеріндегі электронның пішіні әртүрлі болады, оларды энергетикалық деңгейшелер деп атайды; n = 1, болғанда l = 0, 1; демек І-деңгейде 2 электрон, ол электрон 1s-ке толтырылады; n = 2, l = 0, 1; яғни ІІ-деңгейде 6 электрон болады, олар 2s 2p-ға толтырылады; n = 3, l = 0, 1, 2; ІІІ-деңгейде 18 электрон болады, олар 3s 3p 3d-ға толтырылады; n = 4, l = 0, 1, 2, 3; IV-деңгейде 18 электрон болады, олар 4s 4p 4d 4f-ке орналасады.
Магнит квант саны ml. Орбитальдардың кеңістікте бағытталуын сипаттайды. Электрон орбитальда қозғалғанда магнит өрісін тудырады. Оның мәндері ml = – l,…0,…+ l.
Кеңістікте бағытталуын анықтау үшін (2l + 1) формуласын қолданады. l = 0; ml = 0; болса, (s-орбиталь) кеңістікте пішіні шар тәрізді болады, l = 1 (р-орбиталь); ml = – 1, 0, 1 кезінде орбитальдың бағытталуы үш түрлі, яғни 3-орбитальға 6-электрон орналаса алады.
Шредингер теңдеуін шешу үшін енгізілген 3 квант саны жеткіліксіз, сондықтан, 4-ші квант саны енгізілді, ол спин квант саны деп аталады, ms әрпімен белгіленеді. Спин дегеніміз –электронның кеңістіктегі қозғалысына байланыссыз, оның өзіндік импульс моментін сипаттайтын шама.
Атомдағы электрондардың энергетикалық деңгейлерге орналасу ретін көрсететін формуланы атомның электрондық конфигурациясы немесе атомның электрондық формуласы деп атайды.
Атомдағы электрондық қабаттардың құрылысын, электрондық конфигурациясын толық түсіну үшін негізгі 4 ұстанымды білу керек:
1) Паули қағидасы.
2) Ең аз энергия ұстанымы.
3) Гунд ережесі.
4) Клечковский ережесі.
1925 жылы Швейцар физигі В. Паули мынадай қағида ұсынды. Атомда бірдей қасиет көрсететін екі электрон болуы мүмкін емес. Электрондық қасиеттері квант сандарымен сипатталатын болғандықтан Паули қағидасы: атомда 4 квант сандары бірдей екі электрон болуы мүмкін емес деп сипатталады. Яғни, бір атомдық орбитальда екі электроннан артық электрон бола алмайды және олардың спиндері қарама-қарсы болуы қажет. Квант санының біреуі n, l, ml, ms спиндері әртүрлі болуы керек. n, l, ml бірдей болғанмен, ms = +1/2; –1/2 болуы мүмкін. Паули қағидасы бойынша: n = 1, l = 0, ml = 1 болса, ms = +1/2; –1/2 болады. Спиндері қарама-қарсы орналасқан екі электрон болуы мүмкін. Орбитальдағы электрондар санын N = 2n2 формуласымен анықтайды.
І-деңг. n = 1, N = 2.
II-деңг. n = 2, N = 8.
III-деңг. n = 3, N = 18.
1Н (1s) атомының электрондық конфигурациясын былай көрсетуге болады: электрондық формуласы – 1s1. Квант ұяшықтарында Паули қағидасы бойынша 2 электрон спиндері бір-біріне ешқашан параллель болмайды.
3Lі 1s2 2s1
Спиндердің орналасуы Гунд ережесімен анықталады: Қосымша квант санының берілген мәнінде электрондар спиндерінің қосындысы ең жоғарғы мән болатындай орналасады. Гунд ережесі бойынша р-электрондар орбитальдарға орналасқанда ең алдымен жеке-жеке ұяшықтарға толтырылады, содан кейін ғана қарсы спинмен алғашқы электронға параллель орналасады. Бұл жағдайда спиндердің қосындысы 3/2 болады.
Ең аз энергия ұстанымы бойынша атомдағы әрбір электрон ең аз энергияға сәйкес орналасуға тырысады. Энергия ең алдымен n квант санымен, содан кейін l квант санымен анықталады. Сондықтан ең алдымен n мен l квант сандарының қосындысының аз мөлшеріне орналасады; Е4s < E3d; 5p < 4f.
1951 жылы В.М. Клечковский мынадай ереже ұсынды: Электрон n төменгі мәніне сәйкес емес, n + l-ң ең төменгі мәніне сәйкес күйі орналасады.
Клечковский ережесі бойынша деңгейшелердің толтырылуы төмендегідей:
1s→2s→3s→3p→4s→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
Әр периодта элемент атомының ядро заряды өскен сайын, оның радиусы кішірейеді.
Үлкен периодтарда d және f-элементтерінің ядро зарядтарының өсуіне байланысты радиустарының кішіреюі өте баяу жүреді. Себебі, бұл электрондар қабат астындағы қабатқа байланысты орналасқандықтан электронның тығыздалуына байланысты болады.
Периодтарда солдан оңға қарай элементтер атомдарының радиустарының кішіреюіне байланысты, олардың металдық қасиеттері азайып, бейметалдық қасиеттері артады.
Топ бойынша атом радиусының өлшемі артады, өйткені период саны өскен сайын электрондық қабат саны да артады. Электрон бергенде атом өлшемі кішірейеді, қосып алғанда өседі. Элементтердің реттік нөмірінің өсуіне байланысты олардың иондарының радиустары да периодты түрде өзгеріп отырады. Металдар электронын оңай береді. Бейметалдар керісінше қосып алуға бейім болады. Атомның электронды қосып алуы мен электронды беріп жіберуі энергия өзгеруі арқылы жүреді.
Атомнан электронды үзу үшін энергия жұмсалады, оны иондану энергиясы деп атайды. Иондану энергиясын иондану потенциалымен анықтайды.
1869 жылы Д. И. Менделеев периодтық заңды және периодтық жүйенің алғашқы нұсқасын ұсынады. Д. И. Менделеевтің периодтық заңының анықтамасы: Химиялық элементтер мен оның қосылыстарының қасиеттері атомдық массаға периодты түрде тәуелді болады.
Химиялық элементтердің қасиеттері бойынша орналастырудың дұрыстығын 1913 жылы ағылшын ғалымы Мозли дәлелдеді. Ол рентген спектрін зерттеу барысында элементтер ядросының зарядын анықтап, ядро заряды реттік нөміріне сәйкес келетінін дәлелдеді.
Радиоактивтілік дегеніміз элемент ядроларының өздігінен сәуле шығарып ыдырауы. Радиоактивтілік жасанды және табиғи болып екіге бөлінеді.
Табиғи радиоактивтілік: α+, β-, γ. α – оң зарядты бөлшек, заряды 2-ге , массасы 4-ке тең, Не ұқсас; β-теріс зарядты бөлшек, заряды – -1; γ-зарядсыз, өтімді бөлшек.
Радиоактивтіліктің ыдырау жылдамдығы жартылай ыдырау периодымен Т½ өлшенеді. Жартылай ыдырау периоды дегеніміз – радиоактивті ядро жартысының ыдырауына кететін уақыт. Мысалы 238U элементінің жартылай ыдырау периоды – Т½ = 4,5·109 жыл т.б.
Ядроның табиғи айналымы 226Ra α – ыдырауға ұшырайды, оны төмендегі өрнек арқылы сипаттайды:
![]()
Торий β- радиоактивті ыдырауға ұшырайды:
![]()
Ядроның жасанды айналымы. Ядроны әртүрлі бөлшектермен атқылау арқылы жасанды айналым жүргізуге болады. Ең алғаш жасанды айналымда Э. Резерфорд азотты α – бөлшекпен атқылау арқылы жасады.
![]() ;
; ![]()
Химиялық байланыс дегеніміз екі немес одан да көп атомның, ионның, молекуланың әр түрлі комбинацияда бірін-бірі ұстап тұру күштерін айтамыз. Мұндағы тарту күші атомның сыртқы қабатындағы электронның конфигурациясына тәуелді.
Химиялық байланыстың мынадай түрлері бар: ковалентті байланыс, иондық байланыс, металдық байланыс, сутектік байланыс; молекула аралық күш.
Ковалентті байланыс дегеніміз атомдар арасындағы электрондардың жұптасуы арқылы болатын байланыс:
.. .. .. ..
H∙ + ∙H → H:H, :Cl∙ + ∙Cl: → :Cl:Cl: – полюссіз;
˙˙ ˙˙ ˙˙ ˙˙
.. ..
Н∙ + ∙Сl: → Н:Сl: – полюсті.
˙˙ ˙˙
Ковалентті байланыстың донорлы-акцепторлы механизмі:
 |
H H +
∙∙ ∙∙
H : N : + H+ → H : N : H
∙∙ ∙∙
H H
Иондық байланыс дегеніміз иондар арасындағы электростатикалық күштің әсерінен болатын байланыс. Иондар электронын бергенде немесе қосып алғанда түзіледі:
Na0 –1ē → Na+;
Cl0 +1ē → Cl- ;
.. ..
Na∙ + ∙Сl: → [Na]+[:Сl:]–.
˙˙ ˙˙
Металдық байланыс дененіміз металдың кристалдық торларындағы металл ионының катоины мен еркін электрондар арасындағы байланыс. Металдық байланыс негізінде металдардың өзіне тән көптеген физикалық және химиялық қасиеттеріне түсініктеме беруге болады.
Химиялық байланыс байланыс энергиясымен, байланыс ұзындығымен және валенттілік бұрыштармен сипатталады.
Химиялық байланыс түзуге жұмсалатын энергия байланыс энергиясы деп аталады. Неғұрлым энергия көп жұмсалса, соғұрлым байланыс берік болады. Байланыс энергиясының өлшем бірлігі – кДж/моль.
Байланыс ұзындығы дегеніміз – энергияның ең кіші мәніндегі атом ядролары арасындағы арақашықтық.
Валенттілік бұрыш дегеніміз – молекуладағы ядролардың арасын қосатын сызықтардың арасындағы бұрыш. Ол атомдардың табиғаты мен байланыстың сипатына тәуелді.
3 дәріс. Химиялық реакциялардың жылдамдығы
Дәрістің мақсаты: химиялық реакциялардың жылдамдығының концентрациядан тәуелділігі, реакциялардың молекулалағын зерттеу, гетерогендік реакциялардың айырмашылығы.
Химиялық кинетика — химияның химиялық процестерінің жылдамдығын және жүру заңдылықтарын қарастыратын бір саласы.
Химиялық реакциялар әрекеттесуші заттардың түріне қарай гомогенді және гетерогенді болып екіге бөлінеді. Гомогенді реакциялардың жылдамдығы әрекеттесуші заттардың табиғатына, қойыртпалығына, температураға, қысымға, катализатордың қатысуына, ал гетерогенді реакциялардың жылдамдығы осы айтылғандардан басқа фазаның жүктелген жеке бөліктерінің күйіне, жылу және масса алмасу жағдайларына және т.б. тәуелді.
Химиялық реакцияның жылдамдығы дегеніміз – әрекеттесуші заттардың біреуінің концентрациясының уақыт бірлігінде өзгеруі.
![]() ,
, ![]() , моль/мин,
, моль/мин,
![]() .
. ![]()
Химиялық реакция барысында реакцияға кіретін заттар концентрациясы азайып, реакция өнімділігінің концентрациясы жоғарылайды.
![]() , моль/мл∙мин.,
, моль/мл∙мин.,
![]() , моль/см2∙мин.
, моль/см2∙мин.
Реакцияның жылдамдығы көптеген факторларға байланысты: әрекеттесуші заттардың концентрациясына, температураға, катализаторға:
1) Концентрацияның әсері.
А + В = АВ.
Әрекеттесуші заттар А, В, өнім – АВ.
Химиялық реакция жылдамдықтарының концентрацияға байланысты артуының мәнін химиялық кинетиканың негізгі заңы (әрекеттесуші массалар заңын 1868 ж. Гульдберг және Вааге ашқан) түсіндіріп береді: тұрақты температурадағы химиялық реакцияның жылдамдығы әрекеттесуші заттардың концентрацияларының көбейтіндісіне тура пропорционал болады.
aA + bВ = сС + dD,
![]() ,
,
![]() .
.
k – жылдамдық константасы, олар әрекеттесуші заттар табиғатына, температураға тәуелді, бірақ концентрациаға тәуелді емес.
Егер [А] = [В] = 1, онда υ = k жылдамдық константасына тең болады.
2) Жылдамдыққа температураның әсері.
Әрекеттесуші массалар заңы кез-келген температураға сәйкес, бірақ тұрақты жылдамдықта температураның әсерінен өседі. Жылдамдыққа температураның әсерін Вант-Гофф ережесі сипаттайды: реакция температурасын әр бір 10ºС көтергенде, реакция жылдамдығы 2 немесе 4 есе артады.
 .
.
γ – температуралық коэффициент;
![]() – t1, t2 температурасындағы
реакция жылдамдықтары.
– t1, t2 температурасындағы
реакция жылдамдықтары.
3) Реакция жылдамдығының катализатор қатысына тәуелділігі.
Химиялық реакция жылдамдығын катализатор өзгертеді, ол тура және кері реакция жылдамдығына бірдей әсер етеді. Катализатордың қатысуының нәтижесінде активті молекулалар саны артады да, жылдамдық жоғарылайды. Катализатор реакция жылдамдығын арттырса, оң катализ деп, ал төмендетсе теріс катализ деп аталады.
Валенттілігі қаныққан молекулалар арасындағы химиялық реакциялар өте қиын жүреді, өйткені молекуладағы атомдар арасындағы байланысты үзу үшін энергия жұмсау керек. Молекулалық реакциялар мономолекулалық, екімолекулалық және үшмолекулалық деп ажыратылады. Ол бір мезгілде өзара әрекеттесуге қатысатын молекулалар санын көрсетеді:
- мономолекулалық реакциясы I2(г) = 2I,
![]() ;
;
- екімолекулалық
реакциясы H2 + I2 = 2HI, ![]() ;
;
- үшмолекулалық реакциясы О2 + 2NO=2NO2,
![]() .
.
Химиялық реакция жылдамдығына температураның әсерін активтендіру теориясының көмегімен жақсы түсіндіруге болады. Бұл теория бойынша, химиялық реакцияға тек белгілі бір энергиясы бар активті молекулалар кіріседі. Активсіз молекулаларды активті күйге айналдыру үшін қосымша энергия жұмсалады. Бұл процесті активтендіру деп атайды. Температура жоғарылағанда активті молекулалар саны лезде өсіп, реакция жылдамдығы артады. Әрекетесетін заттар молекулаларын активтендіру үшін жұмсалатын энергияны активтендіру энергиясы деп атайды. Химиялық реакция жылдамдығы активтендіру энергиясына толық бағынады. Активтендіру энергиясы неғұрлым төмен болса, реакцияның жылдамдығы да жоғары болады.
Егер активтендіру энергиясы жоғары болса, реакция жылдамдығы баяу жүреді.
Реакцияның жылдамдық тұрақтысының активтендіру энергиясы мен температурадан тәуелділігі Аррениус теңдеуімен өрнектеледі:
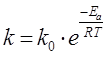 ,
,
мұндағы k0 – пропорционалдылық коэффициенті;
e – натуралдық логарифмдер негізі;
Ea – активтендіру энергиясы.
Химиялық реакциялар қайтымды және қайтымсыз болып екі топқа бөлінеді. Қайтымды реакциялар – реакция өнімдері бір-бірімен әрекеттесіп, бастапқы заттарды қайтадан түзетін реакциялар.
Қайтымсыз реакция – бастапқы заттардың біреуі немесе екеуі де таусылғанша ақырына дейін жүреді.
![]() ↑.
↑.
Қайтымды реакция – кері және тура бағытта жүреді.
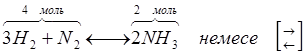 .
.
Егер бірқалыпты үрдісте кері және тура реакция жылдамдықтары бір- біріне тең болса бұл жағдайды тепе-теңдік күй деп атайды.
![]() .
.
Химиялық тепе-теңдік күйдегі әрекеттесуші заттардың концентрациясын тепе-теңдік концентрациялары деп атайды.
Химиялық тепе-теңдікке әртүрлі факторлар әсер етеді. Осы әсер ету жағдайы Ле-Шателье қағидасымен сипатталады:
Тепе-теңдік күйдегі жүйеге сырттан әсер етсе, тепе-теңдік сол әсерді баяулататын жаққа қарай ығысады.
1) Тепе-теңдіктің ығысуына концентрацияның әсері.
Егер әрекеттесуші заттар концентрациясын көтерсек, тепе-теңдік оңға – өнім жағына қарай ығысады. Әрекеттесуші заттар концентрациясын көтерсе, тепе-теңдік оңға өнім жағына қарай жылжиды, ал өнім концентрациясын көтерсе, тепе-теңдік солға, әрекеттесуші заттар жағына қарай жылжиды.
2) Тепе-теңдікке қысымның әсері.
а) Егер қысымды көтерсек, тепе-теңдік моль саны аз жаққа, бұл жүйеде оңға қарай ығысады.
![]() .
.
б) Егер қысымды төмендетсек, тепе-теңдік моль саны көп жаққа ығысады.
Егер көлем өзгермесе қысым тепе-теңдікке әсер етпейді.
![]() .
.
3) Тепе-теңдікке температураның өзгерісінің әсері.
Температура жоғарылағанда қарама-қарсы екі процесс жылдамдығы бірдей өзгереді, бірақ эндотермиялық процесс күшті ұлғаяды, ал температураны төмендетсе, керісінше экзотермиялық процесс ұлғаяды.
Химиялық тепе-теңдік кездегі температураның әсерін білу үшін үрдістің жылу эффектісін (∆H) білу керек. Ол оң болса, температура әсері мәнді болады, ал нөлге жақын болса, температураның өзгеруі тепе-теңдікке әсер етпейді.
Сондықтан, Ле-Шателье қағидасына сәйкес температура жоғарылағанда, тепе-теңдік эндотермиялық реакция бағытына қарай ығысады.
Температура төмендегенде, экзотермиялық реакция бағытына қарай ығысады.
![]() .
.
Температура жоғарылағанда солға ығысады (эндотермиялық реакция жағына).
Температура төмендегенде оңға ығысады (экзотермиялық реакция жағына).
![]() , ∆H<0.
, ∆H<0.
Температураны жоғарылатса – солға, әрекеттесетін заттар жағына, ал қысымды көтерсе – солға, төмендетсе оңға ығысады. Тепе-теңдік жылжымалы.
Ол бір тепе-теңдік күйден, екінші тепе-теңдік күйге ауыса алады, біраз өзгерістен кейін, қайтадан қалпына келеді.
Реакцияның тепе-теңдік константасын kт/т мынадай теңдеу түрінде жазуға болады:
 .
.
Мұндағы [А], [В], [С], [D] – А, В, С, D заттарының тепе-теңдік концентрациялары;
а, b, c, d – А, В, С, D заттарының алдыңдағы сәйкес коэффициенттер.
4 дәріс. Химиялық термодинамиканың негіздері
Дәрістің мақсаты: жүйедегі энергияның бір түрден екінші түрге ауысуын түсіндіретін термодинамиканың заңдарымен танысу. Термодинамикадағы энтальпия, энтропия ұғымдарын, Гиббс энергиясын білу.
Химиялық термодинамика – термодинамиканың заңдарың химиялық процестерге қолданады – сөзі гректің “термос” – жылу және “динамос” – күш, қозғалыс. Химиялық реакциялар кезінде байқалатын энергияның бір түрден басқа түрге айналуын, реакциялардың осы жағдайда өздігінен жүру шегін, сонымен қатар химиялық тепе-теңдіктің болу жағдайларын анықтайтын ғылым.
Термодинамика жүйелерді зерттейді.
Жүйе дегеніміз бір-бірімен әрекеттесу жағдайындағы және өзін қоршаған ортадан ойша бөлектелген бірнеше заттардың жиынтығы.
Жүйенің күйін оның температурасы, қысымы, көлемі, массасы сипаттайды. Бұлардан басқа жүйенің күйін және онда болып жататын өзгерістерді сипаттау үшін оның ішкі энергиясының ΔU, энтальпияның ΔH, энтропияның ΔS, Гиббс энергиясының ΔG қалай өзгеретінін білу керек.
Химиялық реакциялардың жылу эффектісі.
Термодинамиканың бірінші заңы – энергияның әртүрлі формалары бір-біріне тек эквивалентті мөлшерде ауысады. Басқаша сөзбен айтқанда, сыртқы ортамен зат және энергия алмаспайтын жекеленген жүйенің барлық энергия түрлерінің қосындысы әр уақытта тұрақты болады. Жекеленген жүйе жылу сіңіру арқылы бір күйден екінші күйге ауысқанда жұмсалған жылу (Q) мөлшері жүйенің ішкі энергиясын (ΔU) өзгертуге және белгілі бір жұмыс (А) жасауға пайдаланылады
![]() .
.
Келтірілген теңдеу термодинамиканың бірінші заңының математикалық өрнектелуі немесе термодинамикаға қолданылған энергияның сақталу заңының өрнектелуі.
Мұндағы Q – жүйенің сіңірген жылуының мөлшері;
ΔU – жүйенің ішкі энергиясының өзгеруі;
А – жүйенің істеген жұмысының мөлшері.
Жүйенің
ішкі энергиясы – молекулалардың,
атомдардың, иондардың, электрондардың кинетикалық
және потенциялық энергияларының қосындысынан
тұратын толық энергиясы. Жүйенің ішкі
энергиясының (U) абсолюттік мәнін анықтауға
болмайды, сондықтан жүйе бір күйден (U1)
екінші күйге (U2) көшкенде байқалатын ішкі
энергияның өзгеруін ![]() анықтайды.
анықтайды.
Химиялық реакциялар үшін жүйенің жасайтын жұмысы
![]() .
.
мұндағы А – жүйенің жасайтын жұмысы;
ΔV – жүйе бір күйден екінші күйге ауысқандағы өзгерген көлем;
Р – қысым.
Химиялық реакциялар жүру жағдайларына қарай негізінен изобара-изотермиялық және изохора-изотермиялық болып бөлінеді. Изобара-изотермиялық реакциялар тұрақты қысым мен температурада жүреді. Изохора-изотермиялық реакциялар тұрақты көлемде және тұрақты температурада жүреді. Мұндай реакцияларды жабық ыдыстарда (автоклавтарда) жүргізеді.
Термодинамиканың бірінші заңын изохора-изобаралы реакцияларға қолдануды қарастырайық. Заңның математикалық өрнектелуі мынадай:
Qv = ΔU + A = ΔU + РΔV.
Изохора-изотермиялық реакциялар жүргенде жүйенің көлемі өзгермейді
ΔV = 0,
олай болса өзгерген көлемнің қысымға көбейтіндісі де, соған сәйкес істелетін жұмыстың мөлшері де нөлге тең болады. Бұдан шығатын қорытынды изохора-изотермиялық реакциялар жүрген кезде жұмсалатын жылудың мөлшері жүйенің ішкі энергиясын өзгертуге ғана жұмсалады.
Qv = U2 – U1 = ΔU.
Егер жүретін химиялық реакциялардың қысымы тұрақты болса, бөлінетін немесе сіңірілетін жылудың мөлшері жүйенің ішкі энергиясын өзгертуге және сыртқы қысымға қарсы жұмыс жасауға жұмсалады.
Qp = ΔU + A = (U2 – U1) + Р(V2 – V1),
Qp = H2 – H1 = ΔH, ΔH = ΔU + РΔV,
ΔH – жүйенің энтальпиясы деп аталады. Химиялық реакцияларға қатысатын және түзілетін заттармен бірге реакцияның жылу эффектісі көрсетілген теңдеулерді термохимиялық теңдеулер дейді. Термохимиялық теңдеулерді жазғанда термодинамика бойынша бөлінген жылу теңдеудің оң жағына минус (–) белгісімен, ал сіңірілген жылу плюс (+) белгісімен көрсетіледі. Реакциялардың жылу эффектілерін сан жағынан зерттейтін ғылымның бірі термохимия деп аталады.
Термохимияның негізгі заңын 1840 жылы орыс ғалымы Г.И. Гесс ашты, ол Гесс заңы деп аталады және былай айтылады:
Реакцияның жылуы (энтальпиясы) – реакцияның қандай жолмен жүруіне байланысты емес, тек реакцияларға қатысатын бастапқы заттардың және реакция нәтижесінде түзілетін заттардың түріне және күйіне ғана байланысты.
Көміртегі (IV) оксидін екі түрлі реакциялардың жәрдемімен алуға болады.
I әдіс: C(граф) + O2(газ) = CO2( газ), ΔH1;
II әдіс: C(граф) + 1/2O2(газ) = CO(газ), ΔH2;
CO(газ) + 1/2O2(газ) = CO2(газ), ΔH3.
Г.И. Гесс заңынан бірнеше салдар шығады. Олардың аса маңыздылары мыналар:
Тура реакцияның жылу эффектісі кері таңбамен алынған кері реакцияның жылу эффектісіне тең.
A→B +∆H1; B→A –∆H2,
мұнда Гесс заңынан шығатын салдар бойынша ∆H1 = –∆H2 тең болады.
Реакцияның жылу энтальпиясы оның нәтижесінде түзілген заттардың түзілу жылуларының (энтальпияларының) қосындысынан реакцияға қатысқан заттардың түзілу жылуларының қосындысынан алып тастағанға тең. Реакция теңдеуіндегі заттардың алдындағы коэффициенттері олардың сәйкес түзілу жылуларына көбейткіш болады.
![]() ,
,
2Mg(қ) + CO2(г) = 2MgO(қ) + C(графит).
Гесс заңы бойынша бұл реакцияның жылу эффектісін былай табады:
![]() .
.
Жылу эффектісін өлшеу үшін калориметрді пайдаланады. Оларда реакцияларды белгілі мөлшерімен жүргізеді және температураның өзгерісі бойынша бөлінген (немесе сіңірілген) жылу мөлшерін өлшейді.
Заттардың
жану энтальпиясы ![]() – деп
стандартты жағдайда, тиісті жоғары оксидтерді түзе
жүретін заттың бір молінің оттекпен тотығу
реакциясындағы өзгеруін айтады.
– деп
стандартты жағдайда, тиісті жоғары оксидтерді түзе
жүретін заттың бір молінің оттекпен тотығу
реакциясындағы өзгеруін айтады.
Гесс заңының екінші салдары: химиялық реакцияның жылу эффектісі бастапқы заттардың жану жылулықтарының қосындысынан реакция өнімдерінің жану жылулығының қосындысын шегергенге тең
![]() .
.
Энтропия. Екі газдың молекулалары бір-бірімен өздігінен араласып, біраздан кейін ыдыстың барлық көлеміне біркелкі тарайды. Араласу кезінде жүйенің қысымы, температурасы, энергиясы өзгермейді, газдар да бір-бірімен әрекеттесе қоймайды, бірақ газдардың араласу процесі өздігінен жүрді. Бастапқы күйде ыдыстың әр бөлімінде әр газдың молекулалары өзара белгілі бір ретпен орналасқан еді, ал екі газдың молекулалары араласқаннан кейін жүйеде ретсіздік байқалады.
Энергиясы өзгермей өздігінен жүретін процестер жүйеде реттілік азайып күшейетін бағытта жүреді. Жүйедегі ретсіздіктің сандық мәнін энтропия анықтайды, оны S әрпімен белгілейді. Егер жүйе бір күйден (1) екінші күйге (2) ауысатын болса, онда оның энтропиясының өзгеруін былай табады:
![]() .
.
Энтропияның сандық мәні Дж/(моль∙К). Заттардың әртүрлі агрегаттық күйлерін олардың осы жағдайдағы қасиеттері деп қатал тиісті энтропияларының сандық мәні арқылы көрсетуге болады. Заттың қатты күйден сұйық күйге, сұйық күйден газ күйіне ауысқанда энтропияларының өсетінін байқауға болады.
![]() .
.
G – изобара-изотермиялық потенциал немесе Гиббстің еркін энергиясы
![]() .
.
Тұрақты қысымда және тұрақты температурада изобара-изотермиялық реакциялардың өздігінен жүруіне энтальпиялық және энтропиялық факторлардың әсері изобара-изотермиялық потенциалдың өзгеруін анықтайды. Химиялық реакцияның изобара-изотермиялық потенциалдың өзгеруі энтальпиялық және энтропиялық факторлардың айырмасына тең.
![]() –
изобара-изотермиялық жағдайда.
–
изобара-изотермиялық жағдайда.
Бұл функцияның өзгеру белгісі, сол заттар арасындағы реакцияның өздігінен жүру мүмкіндігін анықтайды:
- егер ΔG ˂ 0 – онда реакция тура бағытта мүмкін;
- егер ΔG ˃ 0 – онда реакция мүмкін емес;
- егер ΔG = 0 – онда реакция тура және кері бағытта мүмкін, және реакция кайтымды.
![]() .
.
Химиялық реакциялардың бағытына температураның әсері
|
ΔH |
ΔS |
ΔG |
Реакция бағыты |
Мысалы |
|
ΔH ˂ 0 |
ΔS ˃ 0 |
ΔG ˂ 0 |
Кез келген температу-раларда тура реакция өздігінен жүретін бола алады |
Сграф + 1/2О2 = СО |
|
ΔH ˃ 0 |
ΔS ˂ 0 |
ΔG ˃ 0 |
Кез келген температу-раларда тура реакция өздігінен жүре алмайды |
СО = Сграф + 1/2О2 |
|
ΔH ˂ 0 |
ΔS ˂ 0 |
ΔG ˂ 0 ΔG ˃ 0 |
Тура реакция төменгі температураларда өзді-гінен жүре алады және кері реакция – жоғары температурада |
СаО + СО2 = СаСО3 |
|
ΔH ˃ 0 |
ΔS ˃ 0 |
ΔG ˃ 0 ΔG ˂ 0 |
Тура реакция жоғары температура кезінде, ал кері реакция – төменгі температура кезінде өз-дігінен жүре алады |
СН4 + 2Н2О(г) = СО2 + 4Н2 |
Гельмгольц энергиясы
Изохоралы-изобаралы процестердің тепе-теңдік кезіндегі жүйенің жасайтын жұмысы тең
![]() ,
,
![]() .
.
F – реакцияның жүру бағытын және жүру шегін сипаттайды.
5 дәріс. Ерітінділер
Дәрістің мақсаты: ерітінділердің концентрацияларын, титрін, массалық үлесін есептеу, электролиттердің диссоциациялануын және гиздролиз процесінің қандай жағдайларда жүретінін білу.
Ерітінді деп екі немесе бірнеше компоненттен тұратын гомогенді жүйелерді айтады. Компоненттердің агрегаттық күйі бойынша ерітінділерді үш топқа бөлуге болады: газдың-газдағы ерітіндісі, сұйық ерітінділер, қатты ерітінділер. Газ ерітінділеріне ауа, ал қатты ерітінділерге түрлі металдардың қортпалары жатады. Ал сұйық ерітінділер газдардың сұйықтағы ерітінділері, қатты заттардың сұйықтағы ерітінділері, сұйықтың сұйықтағы ерітінділері болып бөлінеді.
Ерітінділер еріген заттан және еріткіштерден тұрады. Заттардың белгілі бір еріткіштегі ерігіштігі шектеулі болады. Сондықтан белгілі бір температурада берілген еріткіште ери алатын зат еріткіш деп аталады. Ерітінділерді ерігіштігіне байланысты жіктейді.
Қаныққан – берілген температурада зат одан әрі ерімейтін ерітінді, яғни ерітінді еритін затпен тепе-теңдікте болады. Қанықпаған – берілген температурада ондағы еритін заттың мөлшері оның қаныққан ерітіндідегісінен аз ерітінді, аса қаныққан ерітінді – бірдей жағдайда қаныққан ерітіндіде еріген затпен салыстырғанда, еріген заты артық болатын ерітінді. Ерігіштік – температура мен қысымға тәуелді. Сонымен бірге ерітінділер сұйық және концентрлі ерітінділер деп те жіктеледі.
Ерітінділердің маңызды сипаттамаларының біріне концентрация жатады. Концентрация – ерітіндінің немесе еріткіштің белгілі мөлшеріндегі еріген заттың мөлшері.
Массалық үлес (пайыздық үлес) – еритін зат шамасының ерітіндінің жалпы шамасына пайыздық қатынасы, пайыздық үлес әр 100 г ерітіндіде еріген заттың (грамм) мөлшерін көрсетеді.
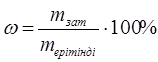 .
.
Молярлық концетрация CМ – 1 л ерітіндідегі еріген заттың мөлшері
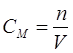 ,
,
мұндағы М – еріген заттың молярлық салмағы, г/моль;
V – ерітінді көлемі, л;
mзат – еріген заттың шамасы, г.
Еріген зат шамасының ерітінді көлеміне қатынасы моль/л белгіленеді.
Мольдік үлес N – еріген зат санының немесе еріткіштің ерітіндідегі барлық зат санының мөлшеріне қатынасы. Еріткіш және бір еріген заттан тұратын жүйеде, соңғының мольдік үлесі тең
![]() .
.
Мұнда n1, n2 – еріткіштің және еріген заттың моль санына сәйкес.
Моляльдық концентрация 1000 г еріткіште еріген заттың моль саны көрсетіледі
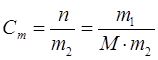 ,
,
мұндағы n – еріген заттың моль саны;
m1 – еріген заттың массасы;
m2 – еріткіштін массасы;
M – еріген заттың молярлық массасы.
Эквиваленттік немесе нормальдық концентрация – Сн еріген заттың грамм эквивалент шамасы
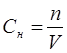 .
.
Титр – еріген зат массасының ерітінді көлеміне қатынасын көрсетеді. Өлшем бірлігі: г/мл:
 ,
,  .
.
Ерітінділердің еруі еритін заттардың табиғатына, ерітіндінің концентрациясына, температурасына байланысты.
Ерітіндінің қайнау температурасының жоғарлауы мен қату температурасының төмендеуі еріген заттың концентрациясына тура пропорционалды тәуелділікте болады.
![]() ,
,
![]() .
.
Мұнда Сm – моляльдық концентрация;
DТқату = Tеріткіштің қату температурасы – Терітіндінің қату температурасы;
DТқайнау = Tерітіндінің қайнау температурасы – Теріткіштің қайнау температурасы;
Е және K – эбулиоскопиялық және криоскопиялық тұрақты шама, табиғи еріткішке қатысты.
Жартылай өткізгіш қалқа арқылы еріткіштің бір жақты диффузия құбылысы осмос деп аталады. Еріткіштің молекулаларына жартылай өткізгіш қалқа арқылы өтуіне кедергі болатын жазықтықтың бірлігіне әсер ететін күш осмостық қысым деп аталады. Осмостық қысым Р еріген заттың және ерітінді температурасының концентрациясына тікелей қатынасы бар
![]() ,
,
мұнда CM – молярлық концентрация;
Т – абсолюттік температура.
Ерітіндіде иондарға – катиондар мен аниондарға бөлініп ыдырайтын заттарды электролит деп атайды. Осы заттардың ерітіндісі электр тогын өткізеді. Қышқылдар, негіздер және тұздар электролиттер болып табылады. Электролиттер молекулаларының катион мен аниондарға бөлініп ыдырау үрдісін электролиттік диссоциация деп атайды:
CH3COOH ↔ H+
+ CH3COO![]() ,
,
Сонда
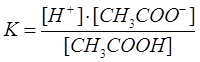 ,
,
K – диссоциациялану константасы.
Ыдырамаған молекулалардың концентрациясы мен иондар концентрациясының ара қатынасына байланысты барлық электролиттер күшті, орташа және әлсіздерге бөлінеді. Егер заттардың молекулалары ерітіндіде толық бөлініп ыдыраса, онда оларды күшті электролиттер деп атайды (HCl, HBr, HI, HClO4, H2SO4, HNO3, LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2, НMnO4).
Егер заттардың молекулалары ерітіндіде толық бөлініп ыдырамаса, онда орташа немесе әлсіз электролиттер деп атайды(CH3COOH, C2H5COOH, H2CO3, H2S, Cu(OH)2, Al(OH)3, NH4OH, су, HNO2, H2SO3, H2O2, H2SiO3, HF, HCN). Орташа және әлсіз электролиттердің ерітіндісінде иондармен қатар ионды емес молекулалар бар. Электролиттің сандық сипаттамасы иондарға бөлініп ыдырауға мүмкіндік туғызатын электролиттік ыдырау дәрежесі (α) болып табылады. Бұл электролиттің жалпы санынан (N) қаншасы иондарға ыдырайтынын көрсетеді. Осы ерітіндіде иондарға бөлініп ыдырайтын молекула саны (n) мен ерітіндідегі электролит молекулаларының жалпы санының (N) арасындағы өзара қатынас электролиттік бөлініп ыдырау дәрежесіне тең.
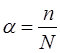 .
.
Диссоциациялану дәрежесі неғұрлым көп болса, электролит соғұрлым күштірек болады және мұндай ерітінді соғұрлым үлкен электр өткізгіштікке ие болады. Сондықтан диссоциациялану дәрежесін электр өткізгіштікті өлшеп табуға болады.
Диссоциациялану константасы мен дәрежесі келесі қатынаспен байланысқан (Освальдтың сұйылту заңы):
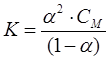 ,
,
мұнда СМ – электролиттің молекулалық концентрациясы.
Ыдыраудың шамасы диссоциация константасы мен дәрежесінің ара қатынасы Оствальдтың сұйылту заңына байланысты
![]() ,
,
одан
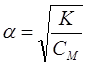 .
.
Ерітіндіні сұйылту ыдырау дәрежесінің өсетінін көрсетеді.
Концентрацияға тәуелді болатын электролит ерітінділер қасиеттері (қату температурасының төмендеуі, қайнау температурасының жоғарылауы, осмостық қысым) Вант-Гофф заңына бағыттайды, себебі диссоциация кезінде ерітіндінің концентрациясы артады. Берілген ерітіндінің сандық қасиеттерін сипаттау үшін Вант-Гофф теңдеуіне көбейткіш i – изотондық коэффициент енгізген. Электролиттер үшін
![]() ,
,
![]() ,
,
![]() .
.
Изотондық коэффициенті DТқату, DТқайнау, Росм эксперимент өлшемдерін есептеу арқылы анықталған өлшемдермен салыстыра отырып табады.
Ерітіндідегі иондар жағдайын бағалау үшін активті – тиімділік ұғымы, иондар концентрациясының химиялық реакцияға сәйкестігі. Активті ион оның концентрациясына және коэффициент активтігінің көбейтіндісіне тең коэффициент активтілігі f:
![]() .
.
Коэффициент активтілігі әртүрлі иондарға әртүрлі. Концентрацияның өзгеруіне байланысты былай өзгереді. Мысалы: егер f<1, иондар арасындағы әрекеттесу оларды біріктіруге әкеледі. Егер f»1, онда иондар арасындағы әрекеттесулері әлсіз болып келеді .
Сұйытылған ерітінділер табиғатына активтілік коэффициенті аз әсер етеді. Жуықтап алғанда, коэффициент активтілігі ионның зарядымен қатар ерітіндінің иондық күшіне тәуелді I, жартылай барлық ерітіндінің концентрациясының квадратына тең:
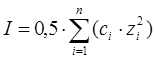 ,
,
мұндағы z – ионның заряды.
Дебай-Хюккель теориясына сәйкес, электролиттің активтілік коэффициенті ерітіндінің иондық күшімен келесі қатынаспен байланысқан:
![]() .
.
Сутектік көрсеткіш. Таза су аз мөлшерінде өзін құрайтын иондарға диссоциацияланады:
H2O
→ H+ + OH![]() ,
,
 .
.
K – судың диссоциация тұрақтысы; оның 22°С-дағы мәні тең:
K = 1,8∙10-16.
Судың өте аз мөлшері ғана иондарға ыдырайтындықтан теңдеудегі судың концентрациясын тұрақты шама деп есептеуге болады, ол 1 л. Массасын судың молярлық массасына бөлгенге тең:
[H2O] = 1000/18 = 55,56 моль.
Енді жоғарыдағы теңдеуді былай жазуға болады:
[H+][OH![]() ] = K∙[H2O]
= Kс.
] = K∙[H2O]
= Kс.
Kс – судың иондық көбейтіндісі деп аталатын тұрақты шама. Судың иондық көбейтіндісінің сандық мәнін табамыз:
Kс = [H+][OH![]() ] = 1,8∙10-16
∙55,56 = 1∙10-14.
] = 1,8∙10-16
∙55,56 = 1∙10-14.
Таза
суда сутегі ионының концентрациясы гидроксид ионының
концентрациясына тең, өйткені судың бір мелекуласында бір Н+
бір ОН![]() түзіледі,
яғни бұл иондардың әрқайсысының 22°С-дағы
концентрациясы өзара тең болады:
түзіледі,
яғни бұл иондардың әрқайсысының 22°С-дағы
концентрациясы өзара тең болады:
![]() .
.
Ерітіндінің қышқылдығын немесе сілтілігін анықтау үшін сутегі иондарының конценрациясын қолданады. Бұл жағдайда бейтарап орта үшін [H+] = 10-7, сілтілік ортада [H+] > 10-7, қышқылдық ортада [H+] < 10-7.
Сутектік көрсеткіш деп сутек иондары концентрациясының теріс таңбамен алынған ондық логарифмін айтады:
![]() .
.
Гидролиз дегеніміз – тұз иондары мен су иондары әрекеттескенде әлсіз электролит түзілуі нәтижесінде ерітіндідегі сутегі және гидроксид иондары өзгеруі арқылы жүретін реакцияны айтады.
Гидролизге келесі тұздар ұшырайды: әлсіз қышқыл және күшті негіз; әлсіз негіз және күшті қышқыл; әлсіз қышқыл және әлсіз негіз.
Күшті негіз және күшті қышқыл гидролизденбейді, нәтижесінде бейтараптану процесі жүреді. Әлсіз қышқыл және күшті негіз арасындағы гидролиз (натрий ацетаты):
CH3COONa + H2O = CH3COOH + NaOH,
CH3COO![]() + H2O
= CH3COOH + OH
+ H2O
= CH3COOH + OH![]() .
.
Бұл жағдайда анион тұзы гидролизге ұшырайды, нәтижесінде ОН- ион түзіледі. Реакция ортасы – сілтілік.
Әлсіз негіз және күшті қышқыл арасындағы гидролиз:
NH4NO3 + H2O = NH4OH + HNO3,
NH![]() + H2O = NH4OH + H+.
+ H2O = NH4OH + H+.
Бұл жағдайда тұздың катионы Н+ түзіледі . Реакция ортасы – қышқылдық.
Әлсіз негіз және әлсіз қышқыл арасындағы гидролиз:
CH3COONH4 + H2O = CH3COOH + NH4OH,
CH3COO![]() + NH
+ NH![]() + H2O = CH3COOH + NH4OH.
+ H2O = CH3COOH + NH4OH.
Гидролиз бұл жағдайда катионды және анионды бірден екі әлсіз электролит түзіледі.
6 дәріс. Тотығу-тотықсыздану реакциялары
Дәрістің мақсаты: тотығу-тотықсыздану реакцияларының түрлерін, процестерін, шығару әдістерін үйрену, тотықтырғыш пен тотықсыздандырғыштың қасиеттерін білу.
Көптеген химиялық реакциялар жүру кезінде оларға қатысатын заттардың құрамындағы элементтердің тотығу дәрежелері өзгермейді. Бұларға электролит ерітінділеріндегі иондар арасында жүретін алмасу реакциялары, сондай-ақ күрделілігі жоғары заттардың күрделілігі кемірек заттардың күрделілігі кемірек заттарға ыдырау реакциялары, күрделі заттардың одан да күрделірек заттар түзу кезінде жүретін косылу реакциялары жатады.
Химиялық реакция кезінде әрекеттесуші заттар құрамындағы атомдар тотығу дәрежесін өзгерте жүретін реакциялар тотығу –тотықсыздану реакциялары деп аталады.
Тотығу дәрежесі деп қосылыстағы атомның немесе ионның шартты зарядын айтады.
Жай және күрделі заттардағы элементтердің тотығу дәрежелері нейтрал, оң теріс болуы мүмкін. Кез келген жай заттың молекуласы бір атомнан немесе бірдей атомдардан тұратындықтан олардың құрамындағы элементтердің тотығу дәрежесі нөлге тең болады. Барлық жай заттардың тотығу дәрежелері нөлге тең.
Күрделі заттардың құрамындағы элементтердің электртерістігі бірдей болмайды, сондықтан олардың арасындағы қос электрон электртерістігі аз элементтерден электртерістігі көп элементке ауысады. Осының салдарынан электроннан айрылып қалған элемент оң тотығу дәрежесін, ал электрон қосып алған элемент теріс тотығу дәрежесін көрсетеді. Элемент неше электроннан айырылып қалса оның тотығу дәрежесінің сандық мәні сонша оң болады, ал элемент неше электрон қосып алса оның тотығу дәрежесінің сандық мәні сонша теріс болады.
Элементтің қосылыстағы тотығу дәрежесін анықтау үшін мынадай жағдайларды есепке алу керек:
Сутегінің бейметалдармен қосылыстарындағы тотығу дәрежесі +1, металдармен қосылысында (гидридтерде) - 1 тең.
Қосылыстағы сілтілік металдардың тотығу дәрежелері +1, сілтілік жер металдарының тотығу дәрежелері +2, алюминийдікі +3, тең болады.
Оттегінің көпшілік қосылыстардағы тотығу дәрежесі -2, пероксидтерде -1 тең.
Қосылыстардағы фтордың тотығу дәрежесі әруақытта -1 тең.
Химиялық қосылысты құрайтын элеметтердің тотығу дәрежелерінің қосындысы нөлге тең.
Тотығу дәрежесінің өзгеруі әрекеттесуші атомдар арасында электрондар алмасу жүретінін көрсетеді.
0¯ -1 0 -1
Cl2+2KJ = J2 + 2KCl
Cl2 +2ē = 2Cl![]() – электронды
қосып алу, тотықсыздану процесі,
– электронды
қосып алу, тотықсыздану процесі,
2I![]() –2ē = I2 – электронды
беру, тотығу
процесі.
–2ē = I2 – электронды
беру, тотығу
процесі.
Әрекеттесуші заттардың атомы, молекуласы не ионы электрон беру процесін тотығу дейді. Тотығу кезінде тотығу дәрежесі артады.
Әрекеттесуші атомдар, молекулалар не иондар электрон қосып алу процесін тотықсыздану дейді. Тотықсыздану кезінде тотығу дәрежесі кемиді.
Химиялық реакция кезінде электрондарын беретін атомдар, иондар не молекулалар тотықсыздандырғыш, ал электрондар қосып алатын атомдар, иондар не молекулалар тотықтырғыштар болып саналады.
Егер қосылыс құрамындағы элемент тотығу дәрежесінің мәні теріс болса, онда ол қосылыс химиялық реакция кезінде тек тотықсыздандырғыш болады.
Егер қосылыс құрамындағы элемент тотығу дәрежесінің мәні, сол элемент көрсете алатын ең жоғарғы оң сан болса, онда ол қосылыс химиялық реакция кезінде тек тотықтырғыш болады. Себебі, олардың атомдары электрон қабылдауға ғана жарайды.
Тотығудың ең төменгі дәрежесіндегі элементтер тек қана тотыға алады. Себебі, олардың атомдары электрон беруге ғана ыңғайлы.
Егер қосылыс құрамындағы элемент аралық тотығу дәрежесін көрсетсе, онда ол қосылыс химиялық реакция кезінде тотықтырғыш та, тотықсыздандырғыш та бола алады.
Тотығу тотықсыздану реакциялары молекула аралық, бір молекула ішіндегі және диспропорциялану тотығу-тотықсыздану реакциялары болып бөлінеді.
Молекулааралық тотығу-тотықсыздану реакциялары әр түрлі молекулалардағы элементтердің тотығу дәрежелері өзгеру арқылы жүреді:
+4 -1 +2 0
MnO2 + HCl → MnCl2 + Cl2+H2O
1/ Mn4+ +2ē → Mn2+ тотықтырғыш, тотықсыздану процесі,
2/ Cl-1 ̶ ē → Cl0 тотықсыздандырғыш, тотығу процесі
MnO2 +4HCl = MnCl2 + Cl2+2H2O
Молекула ішіндегі тотығу-тотықсыздану реакцияларына бір молекула ішіндегі әр түрлі элементтердің тотығу дәрежелері өзгеру арқылы жүреді:
-3 +3 0
NH4NO2 → N2 + H2O
2N-3 ̶ 6ē → N20 тотықсыздандырғыш, тотығу процесі,
2N+3 +6 ē → N20 тотықтырғыш, тотықсыздану процесі
NH4NO2 = N2 +2H2O
Диспропорциялану тотығу-тотықсыздану реакциялары бір элементтің тотығу дәрежелері әрі жоғарылау әрі төмендеу арқылы жүреді:
5+ 7+ 1-
KClO3 → KClO4 + KCl
6/ Cl5+ ̶ 2ē → Cl7+ тотықсыздандырғыш, тотығу процесі,
2/ Cl5++ 6ē → Cl1+ тотықтырғыш, тотықсыздану процесі,
4KClO3 =3KClO4 + KCl
Тотығу-тотықсыздану реакциялары табиғатта аса кең тараған. Әлемде жүріп жатқан маңызды процестерінің бәрі осы тотығу-тотықсызданумен байланысты. Тотығу тотықсыздану реакциясын пайдаланып химия өнеркәсібінде, техникада маңызды заттар - таза металдар, аммиак, сілті, қышқылдар алады.
Ең маңызды тотықтырғыштар:
1) Ең маңызды элементар тотықтырғыштар бейметалдар (F2, Cl2, Br2, I2, O2), тотықтырғыш роліндегі галогендер тотығу дәрежесі –1-ге, оттегінікі –2-ге ие болады.
2) Құрамында оттегі болатын қышқылдар мен тұздар арасындағы біршама маңызды тотықтырғыштар KМnO4, K2CrO4, K2Cr2O7, концентрацияланған күкірт қышқылы, азот қышқылы және нитраттар, галогендердің оттекті қышқылдары.
Ең маңызды тотықсыздандырғыштар:
1) Элементар заттар арасындағы тотықсыздандырғыштар (белсенді) металдар (сілтілік, сілтілік- жер, цинк, алюминий, темір және т.б.), сондай-ақ, кейбір бейметалдар (сутегі, көміртегі, фосфор, кремний) жатады. Мұнымен қатар металдар қышқылдық ортада оң мәнді зарядталған иондарға дейін, сілтілік ортада гидроксидтерге дейін тотығады. Көміртегі CO және CO2-ге дейін тотығады.
2) Оттексіз қышқылдарда (HCl, HBr, HI, H2S) және олардың тұздарында болып әдеттегі элементар заттарға дейін тотықсызданатын қасиеттері Cl-дан F-ға дейін күшейеді.
3) Тотығудың ең төменгі дәрежесіндегі металдар (Sn2+, Fe2+, Cu+2 иондары және т.б.) тотыға отырып, өздерінің дәрежесін көтереді.
4) Органикалық заттар – альдегидтер, спирттер, глюкоза т.б.
Иондық-электрондық әдіс бойынша реакция теңдеуін құру. Қышқылдық ортаны көрсетіп реакция теңдеуінің схемасын жазамыз:
MnO4-+SO3-2 + H+→Mn+2+SO4 -2 +H2O.
Тотықсыздандырғыш сульфит – ионның жеке тотығу теңдеуін тотықтырғыш перманганат ионның тотықсыздану теңдеулерін құрамыз.
Тотықсыздандырғыш SO3-2 екі элентронын беріп тотығады:
SO3-2 ̶ 2ē → SO4-2.
SO3-2 ионы SO4-2 ионына айналғанда жетпейтін оттегі ионын судан қосып алатын ескеріп теңдеуді былай жазамыз:
SO3-2 + H2О ̶ 2ē →SO4-2 +2H+.
Тотықтырғыш перманганат – ион 5 электрон қосып алып тотығады, ал босап шығатын оттегінің төрт ионын байланыстыру үшін сутегінің сегіз ионы реакцияға қатысады:
MnO4-+5ē + 8H+→Mn+2+4H2O.
Тотықсыздандырғыштың берген электрондарының жалпы саны тотықтырғыштың қосып алған электрондарының жалпы санына тең екенін еске алып әр теңдеуді тиісті коэффициенттерге көбейтіп жазамыз:
5/ SO3-2 + H2О ̶ 2ē →SO4-2 +2H+;
2/ MnO4-+ 8H++5ē →Mn+2+4H2O.
Әрбір иондық теңдеуді көрсетілген коэффициенттерге көбейтіп теңдеулердің сол жағын сол жағына, оң жағын оң жағына мүшелеп қосып олардың жиынтық иондық теңдеуін жазамыз:
5SO3-2+2MnO4-+5H2O +16H+= 5SO4-2+2Mn+2 +8H2O+10H+.
Ұксас мүшелерді қысқартып бұл реакцияның иондық-эдектрондық теңдеуінің ақырғы түрін жазамыз:
5SO3-2+2MnO4-+6H+= 5SO4-2+2Mn+2 +3H2O.
Дүрыс құрылған иондық-электрондық теңдеудің сол және оң жақтағы элементтердің саны мен зарядтарының жиынтығы өзара тең болуы керек. Бұл теңдеудің екі жағында да 6 оң зарядтан болуы, оның дұрыс құрылғанын көрсетеді.
7 дәріс. Электрохимиялық процестер
Дәрістің мақсаты: гальваникалық элементерінде ЭҚҚ есептеу, электролиттің ерітіндісі мен балқымасының электролизі кезіндегі электродтарда жүретін процестерді үйрену, Фарадей заңдарымен танысу.
Кернеулер қатары металдардың химиялық қасиеттерін сипаттайды: металл неғұрлым сол жаққа қарай тұрса, соғұрлым ол химиялық активті, оңайырақ тотығады және өз иондарынан қиынырақ қалпына келеді; бұл қатардағы әр металл одан кейінгі тұрған металдардың барлығын тұзды ерітіндіден ығыстырады; сутегінен солға қарай орналасқан металлдардың барлығы оны ерітілген қышқылдардан ығыстырады; берілген екі металл бір-бірінен неғұрлым алыс орналасса, соғұрлым олардан құрылған гальваникалық элементтің ЭҚК-і көп болады.
Электродтық потенциалдардың түзілуі. Кез келген металдың кристалл торы түйінінде оң зарядты металл ионы орналасады. Металл иондары беттік қабаттан бөлініп гидраттанған күйде ерітіндіге тарайды.
Металл иондары әсерінен ерітінді оң зарядталады да, металл пластина артық электрондар болғандықтан теріс зарядталады. Бірақ, металл катиондары онша алыстамай, теріс зарядты металл пластинасына тартылып, сол пластина айналасына орналасады. Соның нәтижесінде ертіндіде екі қабат - қос электрлік қабат пайда болады.
Металл мен ерітінді арасында біршама потенциал айырмасы түзіледі. Металл иондарының ерітіндіге бөлінуі қайтымды процесс. Тепе-теңдік орнаған кездегі металл мен оны қоршаған ерітінді арасында пайда болған потенциалдар айырмасын электродтық потенциал дейді.
Әрбір электродтық потенциал металдың табиғатына, ерітіндідегі иондар концентрациясына және температураға тәуелді болады. Егер электродтық потенциал стандартты жағдайда өлшенетін болса - T=298 K және Р=105 Па, және металл пластина иондарының активтігі бірге тең өз тұзы ерітіндісіне батырылған болса, оның электрондтық потенциалы берілген температурада тұрақты шама болады. Осындай потенциалды стандартты электродтық потенциал дейді.
Металдардың стандартты электродтық қатары олардың химиялық қасиетін көрсетеді. Металдың стандартты электродтық потенциалының алгебралық мәні неғұрлым кіші болса, оның соғұрлым тотықсыздандырғыш қасиеті жоғары, тотықтырғыш қасиеті төмен болады.
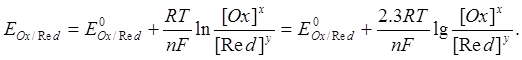 |
Металдың электродтық потенциалының температураға және концентрацияға байланыстылығы мына теңдеуден (Нерст теңдеуі) көрінеді:
R - 8,315 Дж/(К×моль) – газ тұрақтысы;
F - 96500 Кл – Фарадей саны;
Т- абсолюттік температура;
n – металл ионының заряды;
[Ox] және [Red] – сәйкес тотыққан және тотықсызданған формаларының концентрациялары, моль/л.
 |
Бұл теңдеуге 25°С (298 К) үшін тұрақтылардың мәндерін койғаннан кейін оның түрі мынадай болады:
Гальваникалық элемент. Химиялық процестер кезінде электр тогы түзілетін болса, ондай процестерді электрохимиялық процестер дейді. Электрохимиялық процестерге гальвани элементтерінде, электролиз, металдар коррозиясы кезінде жүретін тотықсыздану реакциялары жатады.
Егер тотықтырғыш кеңістіктерін бөліп, электрондарды металл өткізгіш бойымен жүргізетін болсақ, мұнда гальвани элементін аламыз. Яғни, гальвани элементі тотығу-тотықсыздану кезінде кезінде түзілетін химиялық энергияны электр тогы энергиясына айналдырады.
Мысал ретінде Даниэль-Якоби элементінің жұмыс принципін қарастырайық: екі құтыны алып, оларға мырыш және мыс тұздары ерітіндісін құяды, оларға өздерінің металл пластинасын батырады. Екі құтыны ерітінді толтырылған түтікше арқылы жалғастырады.
Мырыш және мыс пластинкаларын металл өткізгішпен қосқан кезде жүйеде электр тогы пайда болады:
Zn0 –2ē ® Zn2+.
Мырыштан бөлінген электрондар металл өткізгіш бойымен мыс арқылы CuSO4 -беріліп, мыс тотықсызданады:
Cu2+ +2ē ® Cu0.
Осы кезде түтікше
арқылы SO![]() ионы
мырыш тұзы ерітіндісі жаққа өтеді.
ионы
мырыш тұзы ерітіндісі жаққа өтеді.
Tеңдеуден бұл қарапайым тотығу-тотықсыздану реакциясы екені көрініп тұр. Бірақ электрон металл өткізгіш арқылы ауысқандықтан бұл процесс кезінде химиялық энергия электр тогғына айналып тұр.
Электроды металл өткізгішке беріп тұрған мырыш электроды - теріс, ал мыс электроды - оң деп аталады. Тотығу процесі жүретін электрод анод, ал тотықсыздану процесі жүретін электрод катод деп аталады. Келтірілген мысалда, мырышта тотығу процесі жүреді - ол анод (А), ал мыста тотықсыздану процесі жүреді - ол катод (К). Мұндай таңбалау галвани элементтерінде ғана қолданылады. Электролиз процесі жүргенде электродтар керісінше аталады. Теріс электрод –катод, оң электрод -анод болады.
Гальваникалық элементті электрохимиялық сызба-нұсқа түрінде жазады:
(–) Zn | Zn2+ || Cu2+ | Cu (+).
Mұнда бір сызық электрод пен ерітінді арасындағы шекті, ал екі сызық ерітінділер арасындағы шекті көрсетеді. Екі жағына жақша ішіне электродтар зарядын қояды. Анодты солға, катодты оңға жазады.
Отындық элемент.
Отындық элемент. Онда отынның (көмірдің, кокстың, жанар газдардың және т.б.) немесе оларда қайта өңдеу өнімдерінің (сутектің, көмір оксидінің және т.б.) оттекте жану реакциясы жүреді. Бөлінетін энергия бірден тікелей тұрақты тоққа айналады. Отындық элементтердің тиімді жұмысы үшін катализаторларды (мысалы металл пластинасы немесе қоспасы, Co және Al немесе Fe, Mn және Ag) электродқа жұқа қабатпен қаптайды. Отындық элементтердің пайдалану коэффициенті өте жоғары (80%-дан жоғары), үздіксіз жұмысы және т.б. оларды келешекте кеңінен қолдануға жол ашады.
Сонымен стандартты электродтық потенциал деп, электродтың үрдісіне қатысатын заттардың концентрациясы бірге тең болғандағы электродтың потенциалын айтамыз. Электродтың атауы – онымен жүзеге асатын реакцияның түрімен аталады: тотығу үрдісі өтетін электрод – анод деп, ал тотықсыздану үрдісі өтетін электрод катод деп аталады.
Гальваникалық элементтің жұмыс істеуіне қажетті шарт – электродтардағы потенциалдар айырымы, ол гальваникалық элементтің электр қозғаушы күші (ЭҚК) деп аталады. Әрбір жұмыс істейтін электр қозғалту күші – оң таңбалы болады. Кез-келген бейметалдық элементтің электр қозғалту күші электродтың потенциалдардың айырымынан есептеп алуға болады. Ол үшін үлкен оң мәннен кішісін алып тастау керек.
Гиббс энергиясы электродтық потенциалмен мына теңдеумен байланысқан:
![]() .
.
Гальваникалық элементтің ЭҚК-н біле отырып, гальваникалық элементте жүретін реакциядағы Гиббс энергиясын есептеуге болады.
Тоқтың химиялық көздері болып гальваникалық элементтер, аккумуляторлар және т.б. элементтер жатады. Аккумулятор – бірнеше рет қолдануға келетін қайтымды гальваникалық элементтерді айтады. Олар жиналған химиялық энергияны электр энергиясына айналдыра алады (разрядтаған кезде) және электр энергиясын химиялық энергияға айналдырады. Аккумулятордың энергиясын қолданғаннан соң, оны тағы тоқ өткізу арқылы қалпына келтіруге болады. Химиялық энергияны тотығу – тотықсыздану негізінде электр тоғына айналдыру қазіргі ғылым алдында тұрған ең негізгі мәселелелердің бірі болып табылады. Оларды отындық элементтер деп атайды. Тотықтырғыш зат ретінде кәдімгі отын-көмір, кокс, табиғи және қолдан жасалған табиғи газ қолдануда. Тотықтырғыш ретінде оттегі мен ауаны пайдаланады. Энергетикалық тұрғыдан сутегі ыңғайлы.
Электролит балқымасында немесе ерітіндісінде әр аттас иондар хаосты қозғалыста болады. Егер осындай балқымаға немесе ерітіндіге электродтар батырып оларды тұрақты ток көзіне қосса катиондар катодқа, ал иондар – анодқа қарай жылжи бастайды. Электролит балқымасы немесе ерітіндісі арқылы электр тогі өткен кезде электродтарда жүретін тотығу-тотықсыздану процесін электролиз дейді. Электролиз кезінде электр энергиясы химиялық реакция энергиясына, атап айтқанда тотығу және тотықсыздану энергиясына айналады. Электролиз кезінде катод – тотықсыздандырғыш, ол катиондарға электрондар береді. Ал анод – тотықтырғыш, өйткені ол атомдардан электрондарды алады. Электролиз кезіндегі электродтық үрдістерге және оның жүруіне электролизденетін заттың құрамы, еріткіш, электрод материалы және электролиз жағдайы әсер етеді. Электролиттердің балқымаларының электролизі. CuCl2 – балқыған кезде молекулалар иондарға ыдырайды және олар сәйкес электродтарға қарай қозғалады: анодқа және катодқа. CuCl2 → Cu2+ + 2ClЭлектролит арқылы өткен электр тоғы мен электролиз кезінде бөлініп шыққан заттың арасында байланыс бар, бұл Фарадейдің екі заңымен түсіндіріледі.
Фарадейдің І заңы – электролиз кезінде электродта бөлініп шыққан заттың массасы, электролит ерітіндісі арқылы өткен электр тоғына тура пропорционал:
![]() немесе
немесе ![]() .
.
m – электродта бөлінген заттың массасы, г;
E – электрохимиялық эквивалент, ол электролит арқылы бір кулон тоқ өткенде түзілетін заттың массасы, г;
Q – ток күші (I) мен уақыттың (t) көбейтіндісіне тең электр мөлшері.
Фарадейдің ІІ заңы – электролиз кезіндегі бірдей электр тоғы әртүрлі заттардың бірдей эквиваленттік массасын бөліп шығарады:
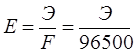 .
.
Мұндағы Э – заттың химиялық эквиваленті.
Фарадейдің екі заңын біріктіріп мынадай теңдеумен көрсетуге болады:
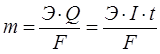 .
.
Тұздарының балқымаларын электролиздеу арқылы сілтілік, сілтілік – жер металдардың өндіреді, ал ерітінділерін электролиздеу арқылы мыс, мырыш, никель кобальт, марганец т.б. металдар алынады. Еритін анодтарды қолданып тұздарын электролиздеу арқылы мысты, никельді рафинайдтайды (тазартады). Электролизді металдарды және пластмассаларды әр түрлі металдармен қаптау үшін қолданады. Химия өнеркәсәбіңде электрлиз арқылы судан сутегі, оттегі хлор жіне әр түрлі тотықтырғыштар алуға қолданады.
8 дәріс . Коррозия және металдарды одан қорғау
Дәрістің мақсаты:
- коррозияның механизмін білу, металдарды қорғауда әртүрлі әдістерді қолданып білу.
Қоршаған ортаның әсерінен металдар мен балқымалардың өзінен-өзі бұзылу (тотығу) процесін коррозия (жемірілу) деп атайды (латынша «korrodo» – кеміру, мүжу). Жалпы металдардың коррозиясы экономикаға аса үлкен зиян келтіреді, жыл сайын әлемдегі күллі металдардың 20% жемірілуге ұшырайды екен.
Жүру механизмі бойынша коррозия келесі түрлерге бөлінеді: химиялық (газды және бейэлектролит ерітінділерінде), электрохимиялық (газды, электролит ерітінділерінде және жер қыртысында), биологиялық.
Химиялық коррозия деп металдардың қоршаған ортамен әрекеттесуі нәтижесінде бұзылуын айтады. Бұл кезде металдың бетінде тотығу процесі жүріп, оксидтің қабыршағы түзіледі.
Газдардағы коррозия әдетте жоғары t0-ларда өтеді, ол кезде металдың бетінде ылғалдың конденсациялануы мүмкін емес. Коррозияның бұл түріне пештердің арматуралары, газ турбиналарының қалақтары, іштен жанатын двигательдер (қозғауыштар) ұшырайды.
Көбінесе металдар газды
коррозияға ауадағы оттегінің арқасында
ұшырайды: nMe + ![]() O2
→ MenOm.
O2
→ MenOm.
Химиялық термодинамиканың заңдарына сәйкес, бұл реакция ∆G<0 болғанда өздігінен жүреді. Кестелердегі металдардың көбісінің ∆G0<0 -– бұл фактор реакция оттегінің атмосфералық қысымында өздігінен жүретіндігін айтады.
Жәй заттар үшін Гиббстің түзілу энергиясы нольге тең, ал металдардың тотығуының Гиббс энергиясы тең оксидтің түзілуінің Гиббс энергиясына

мұндағы ∆G0 –
Гиббстің стандартты энергиясы (кестеден алынады); ![]() – оттегінің парциальді
қысымы.
– оттегінің парциальді
қысымы.
Жоғарыда айтылғаннан келесі тұжырым жасауға болады: коррозия жүрмейді ∆G>0 болса. Бірақ бұл шарт оттегінің ең төменгі қысымдарында орындалады, ал практикада бұл мүмкін емес. Нәтижесінде, металдардың көбісі оттегінің атмосферасында химиялық коррозияға ұшырайды.
Химиялық коррозияның жылдамдығы өнімдерінің сипаттамасымен анықталады. Тотығу кезінде металдың бетінде оксид қабыршағы түзіледі (қатты). Коррозия ары қарай жүруі үшін, метал иондары немесе оттегі осы қабыршақ арқылы өту керек (диффузиялану немесе екеуі бірдей). Әдетте Ме-оксид бөлу бетінен металдан қабыршақтың сыртқы бетіне қарай метал иондары диффузияланады, ал оксид-газ бөлу бетінен қабыршақтың ішіне қарай оттегінің атомы жүреді де (ол атом қабыршақта ионданады: О +2ē → О-2) металл иондарымен кездесіп, оксид түзеді.
Түзілетін қабыршақ сыңғыш және аз созымды болатындықтан қабыршақ өскен сайын созылса немесе қысылса, онда жарық пайда болуы мүмкін. Бұл метал мен коррозия өнімдерінің көлемдерінің (Vокс) қатынасына байланысты
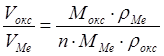 ,
,
мұндағы ρ – тығыздық;
Мокс – оксидтің молекулалық массасы;
n – оксид молекуласындағы Ме-ң атомдар саны.
а) Егер 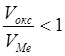 болса – қабыршақ
тұтас емес және металды коррозиядан қорғамайды
(сілтілік, сілтілік жер металдар, V, W, Mo).
болса – қабыршақ
тұтас емес және металды коррозиядан қорғамайды
(сілтілік, сілтілік жер металдар, V, W, Mo).
Мұндай металдардың қабыршақтарының өсу жылдамдығы уақытта тұрақты болады. Қабыршақ қалыңдығы мына теңдеумен есептеледі
![]() – сызықты тәуелділік
тотығу уақытына тәуелді;
– сызықты тәуелділік
тотығу уақытына тәуелді;
б) егер  параболалық тәуелділік
― қабыршақ тұтас, сондықтан иондардың
диффузиясы қиналады да қабыршақ
қалыңдығының өсуі баяулайды (Fe, Co, Ni, Mn, Ti
металдары үшін). Онда
параболалық тәуелділік
― қабыршақ тұтас, сондықтан иондардың
диффузиясы қиналады да қабыршақ
қалыңдығының өсуі баяулайды (Fe, Co, Ni, Mn, Ti
металдары үшін). Онда ![]() ,
,
мұндағы k – тұрақты;
D – ионның диффузиялану коэффициенті;
![]() –
оттегінің газдағы концентрациясы;
–
оттегінің газдағы концентрациясы;
в) кейбір металдар үшін (Zn, Al, Cr) қабыршақтың уақытта өсуі логарифмдік тәуелділікте болады
![]() .
.
Температураның өсуі кейде қабыршақтың өсуіне мүмкіндік туғызады.
Қабыршақтар жіктеледі:
а) жұқа ≤ 40 нм (1 нм = 10-9 м) - көзге көрінбейді;
б) орташа 40-50 нм - бояуынан көруге болады;
в) қалың > 50 нм - кәдімгідей қалыңдығы бар.
Ең жоғары қорғау қасиеттері тегіс бетінде пайда болатын тұтас, жұқа және иілімді қабыршақта болады.
Электрохимиялық коррозия деп қоршаған орта әсерінен гальваникалық жұптың пайда болуы нәтижесінде металдың бұзылуын айтады.
Егер бұйымның беттік қабаты бұзылуға түгелдей кез болса, онда мұндайды бүтіндей (жалпы) жемірілу дейді; егер беттік, қабаттық жекеленген бөліктері бұзылуға душар болса, оны төңіректік (жергілікті) жемірілу дейді.
Төңіректік жемірілуде металдың бүлінуі өте тез өтеді.
Электрохимиялық коррозияда келесі процестер жүреді: анодтық – металдың анодтық күйіне дейін тотығуы (металдың еруі) және катодтық – тотықтырғыштың тотықсыздануы.
Анод Ме0 –nē → Men+ тотығу;
Катод Ox +nē → Red тотықсыздану,
яғни электрохимиялық коррозия процесінің механизмі гальваникалық элементтің жұмысына сәйкес келеді, тек мұнда сыртқы тізбек болмайды, сондықтан электрондар коррозияға ұшыраған металдан шықпай, соның ішінде қозғалып жүреді.
Электрохимиялық коррозия активтіліктері әртүрлі металдар арасында жүреді. Активтілеу Ме тотығып, ерітіндіге ауысады, ал активтілігі азырақ металдың бетінде ерітіндідегі сутегі иондары тотықсызданады. Сонда активтілігі азырақ Ме коррозияға ұшырамайды.
Мысал ретінде тұз қышқылына салынған мырыш пен мыстан тұратын құйманы қарастырсақ:
Анод Zn0 ![]() Zn2+
тотығу (яғни мырыштың коррозиялануы).
Zn2+
тотығу (яғни мырыштың коррозиялануы).
Катод 2H+ ![]() H
H![]() ↑
тотықсыздану (Cu коррозияға
ұшырамайды, оның беттінде сутегі
газы бөлініп, коррозиядан қорғайды).
↑
тотықсыздану (Cu коррозияға
ұшырамайды, оның беттінде сутегі
газы бөлініп, коррозиядан қорғайды).
Тотықтырғыш
ретінде электрохимиялық коррозияда келесі молекулалар мен иондар болады:
О2, Cl2, SO2, CO2, NO2,
NaCl, H+, Fe3+, NO![]() –
иондары.
–
иондары.
Сутегінің қатысуымен өтетін коррозияны сутегінің бөлінуімен жүретін коррозия (сутектік деполяризация) деп атайды:
- қышқылдық ортада 2Н+ +2ē → Н2↑ (рН<7);
- негіздік немесе бейтарап ортада 2Н2О +2ē → Н2 + 2ОН- (рН≥7).
![]()
Оттегінің қатысуындағы коррозия оттегі сіңірумен өтетін коррозия деп аталады (оттектік поляризация):
- қышқылдық
ортада О2 + 4Н+ ![]() 2Н2О (рН<7);
2Н2О (рН<7);
- негіздік немесе бейтарап
ортада О2 + 2Н2О ![]() 4ОН-
(рН≥7).
4ОН-
(рН≥7).
Электрохимиялық процестердің өздігінен жүруін немесе жүрмеуін бағалау үшін Пурбэ диаграммасы қолданылады.
![]()
![]()
![]()
РO2=РH2=1 атм оттекті және сутекті
электродтардың ортаның қышқылдығына тәуелділігі
Егер ∆Gкоррозия < 0 болса, онда коррозия процесі өздігінен жүреді.
Егер: а) ![]()
![]() коррозия
мүмкін емес.
коррозия
мүмкін емес.
б) ![]()
![]() коррозия оттегінің
сіңірілуімен өтуі мүмкін, ал сутегінінің
бөлінуімен мүмкін емес.
коррозия оттегінің
сіңірілуімен өтуі мүмкін, ал сутегінінің
бөлінуімен мүмкін емес.
в) ![]()
![]() коррозия оттегінің
сіңірілуімен де, сутегінің бөлінуімен де мүмкін (сілтілік
және сілтілік жер металдар, Al, Zn, Fe).
коррозия оттегінің
сіңірілуімен де, сутегінің бөлінуімен де мүмкін (сілтілік
және сілтілік жер металдар, Al, Zn, Fe).
Электрохимиялық коррозия процесінің негізгі сипаттамасы - бірлік уақытында металдың шығынымен көрсетілетін коррозия жылдамдығы.
Электрохимиялық коррозия бірнеше сатыда өтеді, ал оның жылдамдығы ең баяу өтетін сатының жылдамдығына тәуелді болады. Оны Фарадей заңы бойынша ток күші немесе ток тығыздығы арқылы өрнектеуге болады
iшекті = ![]() ,
,
мұндағы iшекті ― токтың шекті тығыздығы;
![]() –
оттегінің диффузиялану коэффициенті;
–
оттегінің диффузиялану коэффициенті;
![]() –
оттегінің ерітіндідегі концентрациясы;
–
оттегінің ерітіндідегі концентрациясы;
σ – диффузиялық қабаттың қалыңдығы.
Коррозияны азайту үшін оттегінің тотықсыздануы өтетін жүйеде оның концентрациясын азайту керек немесе металды оттегіден изолирлеу керек.
Сутегінің бөлінуі өтетін жүйеде коррозияны процестің температурасын төмендетіп және Н+ - иондарының концентрациясын азайтып, немесе металды қоспалардан тазартып, немесе металдың бетін изоляциялап, баяулатуға болады.
Өзінің негізгі жолынан тармақталатын токтар қаңғыма токтар деп аталады. Қаңғыма токтарының қайнары болып тұрақты токта істейтін әртүрлі жүйелер мен құрылғылар бола алады. Электр поездары, трамвай жолдары, тұрақты токтың жерге қосылуы, электрпісіру қондырғылар, электролиздік ванналар және т.б.
Рельс бойымен ток генератор станциясына қайтып оралу керек, бірақ оның бір бөлігі ылғал жерге кетіп, электрондар сол жердің молекулалық оттегімен немесе қышқыл жердің Н+ - иондарымен байланысып, ал жердің астындағы өтетін құбырлардан ылғал жерге темір иондары өтеді:
Fe ![]() Fe2+ анод;
Fe2+ анод;
2Н+
![]() Н
Н![]() катод;
катод;
яғни құбырдың коррозиясы жүреді.
Коррозиядан қорғаудың келесі әдістері бар:
а) легирлеу – құйманың құрамына металдың пассивациясын қоздыру үшін компоненттерді енгізеді (Cr, Ni, W және т.б.). Нәтижесінде құйманы коррозиядан қорғайтын реакция өнімдері түзіледі;
б) протекторлық қорғау – металды электрохимиялық жолмен қорғау. Ол үшін арнаулы анод қолданылады – ол коррозиядан қорғалатын металға қарағанда потенциялы төмендеу металдан жасалады. Сонда протектор қорғалатын металмен байланыстырғанда, анодтың ролін орындайды, ал қорғалатын метал – катод болады (бу қазандықтарын, жер астындағы құбырларды және т.б. қорғау);
в) изоляциялау – металл бұйымдарын сырлау, бояу, қорғайтын қабатпен, сонымен қатар сыртын басқа металмен қаптау. Металдық қаптау потенциалы терістілеу металдан жасалса – анодтық қаптау деп аталады, ал потенциалы жоғарырақ металдан жасалса – катодтық қаптау деп аталады;
г) тежегіштерді (ингибиторларды) қолдану. Олар металл бетіне адсорбцияланып, оның потенциалын оңды етеді де осы арқылы жемірілу процесін баяулатады (мысалы, бу генераторларында тотты кетіру үшін).
Әдебиеттер тізімі
1. Коровин Н.В., Масленникова Г.Н., Мингулина Э.И., Филиппов Э.Л. Общая химия. – М.: Высшая школа, 2005.
2. Бірімжанов Б.А. Жалпы химия. – А.: Мектеп, 2001. 3. Глинка Н.Л. Общая химия. – Л.: Химия, 2002.
3. Некрасов Б.В. Основы общей химии. – М.: Химия, 2004(т.1,2)
4. Богатиков А.Н., Красицкий В.А., Лапко К.Н. Сборник задач, вопросов и упражнений по общей и неорганической химии. – Минск: Электронная книга БГУ, 2002.
5. Задачи и упражнения по общей химии. Под. ред. Коровина Н.В. – М.: Высшая школа, 2004.
6. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 2008.
7. Лебедева М.И., Анкудимова И.А. Сборник задач и упражнений по химии с решением типовых и усложненных задач. – М.: Машиностроение, 2002.
8. Пірәлиев С.Б., Бутин Б.Н., Байназарова Г.М. Жайлау С.Ж. Жалпы химия. – Алматы, 2003. – т.1-2.
9. Идрисова К.С., Туманова А.А. Химия. Дәрістер жинағы. – Алматы, АЭжБИ, 2006. -60 б.
Мазмұны
|
Кіріспе 1 дәріс. Химияның негізгі заңдары мен түсініктері 2 дәріс. Атом құрылысы. Периодтық заң және периодтық жүйе. Химиялық байланыс. Радиоактивтілік 3 дәріс. Химиялық реакциялардың жылдамдығы 4 дәріс. Химиялық термодинамиканың негіздері 5 дәріс. Ерітінділер 6 дәріс. Тотығу-тотықсыздану реакциялары 7 дәріс. Электрохимиялық процестер 8 дәріс. Коррозия және металдарды одан қорғау Әдебиеттер тізімі |
3 4
8 12 16 20 25 28 33 39
|
2013 ж. жиынтық жоспары, реті 262 .
Каленова Жан Абдразаховна
Колдасова Гульзира Айнадиновна
ХИМИЯ
Дәрістер жинағы
(5В074600 – «Ғарыштық
техника және технологиялар» мамандығының
студенттері үшін)
Редактор
Қасымжанова
Б.С.
Стандарттау бойынша маман Молдабекова Н. Қ.
____.____.____. басуға
қол қойылды
Пішімі 60×84
1/16
Таралымы 50 дана.
№ ____ типографиялық қағаз
Көлемі 2.5 оқу-
бас. ә.
Тапсырыс
____. Бағасы 250 тг.
«Алматы
энергетика және байланыс университеті»
коммерциялық емес акционерлік
қоғамының
көшірмелі-көбейткіш бюросы
050013
Алматы, Байтұрсынұлы көшесі, 126