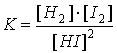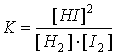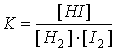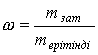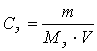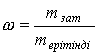АЛМАТЫ ЭНЕРГЕТИКА және БАЙЛАНЫС ИНСТИТУТЫ
Өнеркәсіптік
жылуэнергетика
кафедрасы
ХИМИЯДАН
ТЕСТ ТАПСЫРМАЛАРЫ
(050717 – Жылуэнергетика
мамандығының студенттеріне арналған)
![]()
Алматы 2005
 ҚҰРАСТЫРУШЫЛАР:
А.А.Тұманова, К.С.Идрисова . Химиядан тест тапсырмалары (050717 – Жылуэнергетика
мамандығының студенттеріне арналған)– Алматы: АЭжБИ, 2005. – 32
б.
ҚҰРАСТЫРУШЫЛАР:
А.А.Тұманова, К.С.Идрисова . Химиядан тест тапсырмалары (050717 – Жылуэнергетика
мамандығының студенттеріне арналған)– Алматы: АЭжБИ, 2005. – 32
б.
Жинақта
жылуэнергетика мамандығының 1 курс студенттеріне арналған
химиядан тест тапсырмалары ұсынылады.
Библ.
4 атау
Пікірші: хим.ғыл.канд., ҚазҰТУ доц. Г.Ж.Елигбаева
Алматы энергетика және
байланыс институтының 2005 ж.
жоспары
бойынша басылды.
Алматы энергетика және
байланыс институты, 2005ж
Кіріспе
Ұсынылып отырған химия пәнінен тест сұрақтары
I курс студенттеріне арналған.
Мақсаты – студенттерге
химиядан аралық және
ағымды бақылауға, сонымен қатар емтиханға
дайындалуға көмек көрсету.
Бейорганикалық және жалпы химияның негізгі
тақырыптарының 11 бөлімінен тұратын тест
тапсырмаларының мазмұны химия курсының оқу
бағдарламасына сәйкес келеді.
Тестер оқу материалын системалауға және біршама
оңай есептерді шығарғанда негізгі түсініктер мен
заңдарды қолданып білуді ұйғарады.
Осы тест тапсырмалары бойынша студент оқу бағдарламасының
материалы бойынша өзінің химиядан білім деңгейін тексере
алады.
1 Атом құрылысы. Химияның негізгі
заңдары
1. Авогадро тұрақтысының сандық мәні тең:
1)
6,02·1023 моль
2) 6,02·1023 моль-1
3) 6,02·1023 молекула
4) 22,4 л/моль
2. 6,02·1023
молекула
заттың қандай мөлшеріне тең:
1) 1 моліне 2) 2 моліне 3) 0,5 моліне 4) 4 моліне
3. 34 г
күкіртті сутегіндегі зат мөлшері:
1) 2 моль
2) 1 моль
3) 0,5 моль
4) 0,1 моль
4. Бас
кванттық саны n=2, электрондық қабатындағы
электрондардың максимальді саны:
1) 2 2)
4 3)
6 4)
8
5. 3,01·1023
газ
молекуласының тұрақты жағдайдағы көлемі:
1) 22,4 л 2) 11,2 л 3) 44,8 л 4)
1,12 л
6. Салыстырмалы молекулалық
массаның өлшем бірлігі:
1) г/моль 2) г/мл 3) г 4) өлшемсіз
шама
7. Сутегімен салыстырғандағы газ тығыздығы:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
8. Газдың молярлық
көлемінің өлшем бірлігі:
1) моль/л
2) г/моль
3) л/моль
4) л
9. 36 г
судағы зат мөлшері:
1) 1 моль
2) 0,5 моль
3) 2 моль
4) 0,2 моль
10. Заттың
молярлы массасының өлшем бірлігі:
1) г
2) моль/л
3) г/моль
4) өлшемсіз шама
11. Ауамен
салыстырғандағы газ тығыздығы:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
12. Атомдарда
5d-деңгейшеден кейін
толтырылатын деңгейше:
1) 6 s 2)
4 f 3)
6 p 4)
5 f
13. Атомдық
орбиталь - ол:
1) Кеңістіктегі
электрон орналасатын
ықтималдығы мол аймақ
2) Электронның
жүру траекториясы
3) Төрт
кванттық сандардың жиынтығы
4) Кеңістіктегі атом орналасатын ықтималдығы мол
аймақ
14. Менделеев-Клапейрон
теңдеуі:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
15. Бас кванттық саны n=4, электрондық қабатындағы
электрондардың максимальді саны:
1) 6 2) 8
3)
18 4) 32
16. Атомдарда
5f-деңгейшеден кейін келесі
деңгейше толтырылады:
1) 6 d 2) 7 p
3) 6 s 4) 6 p
17. Орбитальдіқ
кванттық сан көрсетеді:
1) Орбитальдардың кеңістіктегі
бағытталуын
2) Атомдық орбитальдардың түрін
3) Электронның өзіндік қозғалысын
4) Электрондық орбитальдардың энергиясын
және мөлшерін
18. Бас
кванттық саны n=3 электрондық қабатындағы электрондардың
максимальді саны
1) 6 2)
18 3) 8 4) 32
19. Атомдар
тұрады:
1) протондардан және нейтрондардан
2) молекулалардан
3) атомдық ядролардан және электрондардан
4) нуклондардан
20. d-элементтердің барлығы жатады:
1) бейметалдарға
2) металдарға
3) жартылай өткізгіштерге
4) изоляторларға
2 Химиялық эквивалент
1. Қышқылдық-негіздік
реакциядағы заттың бөлігі эквивалентті:
1) бір сутек молекуласына
2) бір электронға
3) бір сутек ионына
4) реакцияға қатысатын сутек иондарының
санына
2. Мыс
хлориді эквивалентінің молярлы массасы:
1) 135 г/моль
2) 67,5 моль/л
3) 67,5 г/моль
4) 135 моль/л
3. Зат эквивалентінің молярлы
массасының өлшем бірлігі:
1) г
2) моль/л
3) г/моль
4) өлшемсіз шама
4. Натрий
гидроксиді эквивалентінің молярлы массасы:
1) 40 г/моль
2) 20 г/моль
3) 40 моль/л
4) 20 г/мл
5. Натрий
хлоридінің негіздігі тең:
1) 1 2) 2 3)
3 4) 4
6. Хром
(ІІІ) гидроксидінің негіздігі тең:
1) 2 2) 3 3) 4 4) 6
7. Эквиваленттік
факторларының мәндері бірдей қосылыстардың
қатарына жатады:
1) NaOH, HCl, K2CO3
2) H2SO4, Ca(OH)2,
NaBr
3) CrCl3, Al(OH)3,
H3PO4
4) Al2(SO4)3,
Cr(OH)3, CaI2
8. Күкірт қышқылының негіздігі тең:
1) 1 2) 2 3) 3 4) 4
9. Эквиваленттік факторларының
мәндері бірдей қосылыстардың қатарына жатады:
1) Ca(OH)2, Na2CO3, H2SO3
2) Ca(OH)2, H2SO4,
KCl
3) HNO3, NaOH, CaCl2
4) KI, NaCl, H3PO4
10. Тұз қышқылының негіздігі тең:
1) 1 2) 2 3) 3 4) 4
11. Мыс сульфатының негіздігі тең:
1) 1 2) 2 3) 3 4) 4
12. Тотығу-тотықсыздану реакциясындағы заттың бөлігі эквивалентті:
1) бір сутек ионына
2) реакцияға қатысатын сутек иондарының санына
3)
реакцияға қатысатын
электрондардың санына
4) бір электронға
13. Темір
(ІІІ) нитратының негіздігі тең:
1) 1 2) 2 3) 3 4) 4
14. Эквиваленттік
факторларының мәндері бірдей қосылыстардың
қатарына жатады:
1) Ca(CH3COO)2,
BaCl2, HNO3
2) CH3COOH, NaOH,
Mg(NO3)2
3) CH3COONa, LiOH, HI
4) Al(OH)3, Ca3(PO4)2,
K2CO3
15. Эквиваленттік факторларының мәндері бірдей қосылыстардың қатарына жатады:
1) Ba(OH)2, SrSO4,
NaBr
2) CaBr2, K2C2O4,
LiOH
3) Li2CO3, Cr(OH)2,
HNO3
4) Fe2S3, Al2(SO4)3,
Ca3(PO)2
3 Бейорганикалық қосылыстардың негізгі кластары
1. Қышқылдық оксидті таңдаңыз:
1) натрий оксиді
2) магний оксиді
3) көміртегі (IV) оксиді
4) хром оксиді
2. Негіздік оксидті
таңдаңыз:
1) натрий оксиді
2) азот оксиді
3) мырыш оксиді
4) күкірт оксиді
3. Қышқылды
таңдаңыз:
1) HNO3
2) BaCl2
3) Cr2(SO4)3
4) Zn(OH)2
4. Амфотерлі
оксидті таңдаңыз:
1) хром оксиді
2) мырыш оксиді
3) темір оксиді
4) көміртегі оксиді
5. Тұзды
таңдаңыз:
1) CH3COOH
2) NaOH
3) CH3COONa
4) CuO
6. Формуласы қате
жазылған тұзды таңдаңыз:
1) FeCl3
2) CuCl2
3) NaCl
4) FeCl
7. Қышқылдық
тұзды таңдаңыз:
1) Cu(OH)SO4
2) CaCl2
3) Na2HPO4
4) Na2B4O7
8. Тұз түзетін оксидті
таңдаңыз:
1) марганец оксиді
2) азот оксиді
3) көміртегі оксиді
4) азоттың (IV) оксиді
9. Қате аталған тұзды
таңдаңыз:
1) Натрийдің ортофосфиты
2) Мыс хлориді
3) Темір(ІІ) сульфаты
4) Алюминий нитраты
10. Тұз түзбейтін
оксидтерді таңдаңыз:
1) магний оксиді
2) калий оксиді
3) азот(ІІ) оксиді
4) алюминий оксиді
11. Орта тұздың
формуласын табыңыз:
1) KHSO4
2) Mg(OH)Cl
3) MgSO4
4) Na[Al(OH)4]
12. Мыс хлоридінің негіздік
тұзы аталады:
1) гидрохлорид
2) гидрохлорит
3) гидроксохлорид
4) гидроксохлорит
4 Комплексті қосылыстар
1. Комплекстүзуші-ионның
айналасындағы координацияланатын лигандтар саны былай аталады:
1) комплексті
ионның заряды
2) дентаттылық
3) координациялық
сан
4) лигандтың
заряды
2. Комплексті қосылыстарда
химиялық байланыс түзілгенде, электрон жұбының доноры
болып келеді:
1) сыртқы
сфераның катионы
2) сыртқы
сфераның анионы
3) лиганд
4) комплекстүзуші-ион
3. Комплекстүзуші-ион
мен лигандтың арасындағы байланыс саны аталады:
1) комплексті
ионның заряды
2) дентаттылық
3) координациялық
сан
4) лигандтың
заряды
4. Полидентатты
лигандтарға жатады:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
5. Na3[Co(NO2)6] қосылысындағы
комплексті анионның заряды тең:
1) +3 2) -3 3) +6 4) -6
6. Комплексті қосылыстарда химиялық байланыс түзілгенде, электрон жұбының акцепторы болып келеді:
1) сыртқы сфераның катионы
2) сыртқы сфераның анионы
3) лиганд
4) комплекстүзуші-ион
7. Лиганд пен комплекстүзуші-ионның арасындағы байланыс:
1) иондық байланыс
2) сутектік байланыс
3) донорлы-акцепторлық байланыс
4) ковалентті полюстық байланыс
8.
Орталық комплекстүзуші-ион лигандпен құрайды:
1)
сыртқы сфераны
2) ішкі сфераны
3) комплексті қосылысты
4) нейтралды молекуланы
9. [Pt(NH3)4SO4](OH)2 комплексті
қосылысындағы комплекстүзуші-ионның тотығу
дәрежесі мынаған тең:
1) +2 2)
+3 3) +4 4) -4
10. Бидентатты
лигандтарға жатады:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
11. Диссоциацияланғанда иондық байланысы
үзілетін комплексті қосылысты таңдаңыз:
1) Na[Al(OH)4]
2) [Co(NH3)4I2]
3) [Fe(CO)5]
4) [Co(H2O)2(NH3)4]
12. Диссоциацияланғанда иондық байланысы үзілетін
комплексті қосылысты таңдаңыз:
1) [Co(NH3)4I2]
2) [Cu(NH3)4]SO4
3) [Cr(NH3)3(CNS)3]
4) [Ni(CO)4]
5 Химиялық кинетика және катализ
1. Реакция жылдамдығының
теңдеуі ![]() сипаттайды:
сипаттайды:
1) нольдік ретті реакцияны
2) бірінші ретті реакцияны
3) екінші ретті реакцияны
4) үшінші ретті реакцияны
2. 2H2S + 3O2
= 2SO2 + 2H2O реакциясының тепе-теңдік
тұрақтысының теңдеуі:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
3. Егер температуралық
коэффициент γ = 3 тең болса, температураны 300С-ге дейін
жоғарлатқанда химиялық реакцияның жылдамдығы
қалай өзгереді?
1) 9 есе артады
2) 9 есе кемиді
3) 27 есе артады
4) өзгермейді
4. Химиялық
реакцияның жылдамдығы деп белгілі уақыт аралығында
ненің концентрациясының өзгеруін айтады?
1) бастапқы заттың
2) катализатордың
3) ферменттің
4) ингибитордың
5. Нольдік
ретті реакцияның жылдамдығы:
1) тұрақты температурада өседі
2) тұрақты температурада төмендейді
3) реагенттің концентрациясына тәуелді
4) реагенттің концентрациясына тәуелді емес
6. 2NO + O2 = 2NO2 реакциясына сәйкес келетін әсер етуші
массалар заңының формуласы:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
7. Егер температуралық коэффициент γ = 4 тең болса, температураны 200С-ге дейін жоғарлатқанда химиялық
реакцияның жылдамдығы қалай өзгереді?
1)
8 есе артады
2) 16 есе кемиді
3) 16 есе артады
4) өзгермейді
8. Қысымның өзгеруі тепе-теңдікке әсер
етпейтін жүйені таңдаңыз:
1) 2SO2 +
O2 = 2SO3
2) C + 2H2 = CH4
3) H2 + I2 = 2HI
4) CO + H2O = CO2 +
H2
9. H2(г) + I2(г) = 2HI(г) реакциясының тепе-теңдік тұрақтысының теңдеуі:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
10. Келтірілген реакциялардың
қайсысында қысымның өзгеруі тепе-теңдікке
әсер етпейді?
1) 2SO2 + O2 =
2SO3
2) COCl2 = CO + Cl2
3) 2NO + Cl2 = 2NOCl
4) H2 + F2 = 2HF
6 Химиялық процестердің энергетикасы. Химиялық термодинамика
1. Оқшауланған
жүйе сыртқы ортамен:
1) энергиямен алмасады, затпен алмаспайды
2) затпен де, энергиямен де алмаспайды
3) затпен алмасады, энергиямен алмаспайды
4) затпен де, энергиямен де алмасады
2. Эндотермиялық
реакцияда:
1)
ΔH<0
2)
ΔH>0
3)
ΔH=0
4)
ΔU>0
3. Келтірілген заттардың
қайсысында түзілу жылуы нольге тең емес:
1) Cl2
2) Br2 3) N2 4) CO
4. Жабық жүйе
сыртқы ортамен:
1) энергиямен алмасады, затпен алмаспайды
2) затпен де, энергиямен де алмаспайды
3) затпен алмасады, энергиямен алмаспайды
4) затпен де, энергиямен де алмасады
5. Интенсивті
параметрлерге жатады:
1) V, S, U, H, G
2) V, T, H, τ, U
3) T, P, C, τ, ρ
4) P, S, C, V, G
6. Термодинамикалық теңдеулердегі стехиометриялық коэффициенттер көрсетеді:
1) зат мөлшерлерінің қатынасын
2) реакцияға қатысатын және түзілетін заттардың нақты мөлшерін
3) заттардың массаларын
4) заттардың жұмсалу және түзілу жылдамдықтарын
7. Ашық жүйе сыртқы ортамен:
1) энергиямен алмасады, затпен алмаспайды
2)
затпен де, энергиямен де
алмаспайды
3) затпен алмасады, энергиямен алмаспайды
4) затпен де, энергиямен де алмасады
8. Жәй
заттардың стандартты түзілу энтальпиялары мынаған тең:
1) 1 кДж
2) 298 Дж
3) нольге
4) 273 кДж
9. Термодинамикалық
реакцияларда стандартты жағдай деп мынаны айтады:
1) қысым 1 атм және температура 00С
2) қысым 101325 Па және температура 298 К
3) қысым 100 Па және температура 100 К
4) қысым 100 кПа
10. Экстенсивті
параметрлерге жатады:
1) V, S,
U, H, G
2) V, T, H, τ, U
3) T, P, C, τ, ρ
4) P, S, C, V, G
11. Экзотермиялық реакцияда:
1) ΔH<0
2) ΔH>0
3) ΔH=0
4) ΔU>0
12. Гиббстің бос энергиясының өлшем бірлігі:
1)
кДж/моль
2) кДж
3) Дж/моль·К
4) Дж/К
13. Тұрақты қысымда химиялық
реакцияның жылу эффектісі - ол:
1) бөлінген немесе сіңірілген жылу
мөлшері
2) химиялық реакцияның нәтижесіндегі
энтальпияның өзгеруі
3) химиялық реакцияның нәтижесіндегі
ішкі энергияның өзгеруі
4) химиялық реакциясындағы жасалған
жұмыс
14. Энтропияның өлшем бірлігі:
1) кДж/моль
2) кДж
3) Дж/моль·К
4) Дж/К
15. Термодинамикалық
жүйедегі ретсіздік дәрежесін келесі физикалық шама сипаттайды:
1) S 2) H 3) G 4) V
7 Ерітінділердің концентрацияларын көрсетудің жолдары
1. Ерітіндінің молярлы
концентрациясының өлшем бірлігі:
1) г/мл
2) моль/л
3) г
4) л/моль
2. Ерітіндінің
массалық үлесі - ол:
1) еріген заттың массасының ерітіндінің
массасына қатынасы
2) еріген заттың массасының еріткіштің
массасына қатынасы
3) еріген заттың массасының ерітіндінің
1 мл-не қатынасы
4) еріген заттың массасының еріткіштің
1 мл-не қатынасы
3. Ерітіндінің
молярлы эквиваленттік концентрациясының өлшем бірлігі:
1) г/мл 2) г 3)
г/моль 4) моль/л
4. Ерітіндінің
молярлы концентрациясы:
1) зат мөлшерінің 1 л ерітіндіге
қатынасы
2) 1 мл ерітіндіде еріген заттың грамдық
массасы
3) 1 л ерітіндіде еріген зат мөлшері
4) зат массасының еріткіш массасына қатынасы
5. Ерітінділердің
молярлы эквивалентті концентрациясын есептейтін формула:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
6. Ерітіндінің
массалық үлесінің өлшем бірлігі:
1) г 2) мл 3) % 4)
моль/л
7. Молярлы эквиваленттік
концентрация - ол:
1) зат мөлшерінің 1 л ерітіндіге қатынасы
2) 1 мл ерітіндіде еріген заттың грамдық
қатынасы
3) 1 л ерітіндіде еріген зат мөлшері
4) 1 л ерітіндіде еріген зат эквивалентінің
мөлшері
8. Ерітіндінің титрінің
өлшем бірлігі:
1) моль/л
2) г/мл
3) л/моль
4) г
9. Ерітіндінің
молярлы концентрациясын есептейтін формула:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
10. Ерітіндінің массалық үлесін есептейтін
формула:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
8 Электролиттер ерітінділері. Тұздардың гидролизі
1. Нейтралды ортада сутекті
иондардың концентрациясы ![]() және рН мынаған
тең:
және рН мынаған
тең:
1) 10-14, 14
2) 10-4, 4
3) 10-7, 7
4) 10-8, 8
2. Гидроксильді көрсеткіш рОН
деп келесі шаманы айтады:
|
1) |
- |
|
2) |
- |
|
3) |
|
|
4) |
- |
3. ОН-
-иондарының концентрациясы 10-4 моль/л
ерітіндінің реакция ортасы (рН)
мынаған тең:
1) 4 2) 10 3)
– 4 4) 7
4. Кw тұрақтысының
аталуы:
1) жылдамдық тұрақтысы
2) диссоциация тұрақтысы
3) гидролиздену тұрақтысы
4) судың иондық көбейтіндісі
5. Егер ![]() реакцияның ортасы болады:
реакцияның ортасы болады:
1) сілтілік
2) әлсіз сілтілік
3) қышқылдық
4) нейтралды
6. Егер ![]() реакцияның
ортасы болады:
реакцияның
ортасы болады:
1) сілтілік
2) қышқылдық
3) нейтралды
4) әлсіз қышқылдық
7. 298 К
сутегі иондарының таза судағы концентрациясы мынаған
тең:
1) 10-14 2) 10-7 3) 107 4) 1014
8. 298 К
гидроксил-иондарының таза судағы концентрациясы мынаған
тең:
1) 10-14 2) 10-7 3) 107 4) 1014
9. Оствальдтің
сұйылту заңы әлсіз электролиттер үшін келесі формула
бойынша есептеледі:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
10. Сутекті көрсеткіш рН деп келесі өлшемді айтады:
|
1) |
- |
|
2) |
- |
|
3) |
|
|
4) |
- |
11. Судың
рН мынаған тең:
1) 10-14 2) 14 3) 7 4)
2
12. Судың
рОН мынаған тең:
1) 10-14 2) 14 3) 7 4)
2
13. Диссоциациялану
процесін сипаттайтын сандық мөлшер:
1) диссоциация дәрежесі
2) дисперстік дәрежесі
3) гидролиздену дәрежесі
4) бөліп алу дәрежесі
14. Ерітіндінің
иондық күшін келесі формула бойынша есептеуге болады:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
15. Н+
- иондарының концентрациясы 1·10-8 моль/л ерітіндінің реакция ортасы
(рН) мынаған тең:
1) - 8
2) 8
3) 6
4) -6
16. Мыс хлоридін гидролизге ұшыратқанда реакцияның
ортасы:
1) негіздік
2) қышқылдық
3) нейтрал
4) әлсіз негіздік
17. Гидролиз процесі кері:
1) диссоциациялану процесіне
2) нейтрализациялау процесіне
3) электролиз процесіне
4) коррозия процесіне
18. Ерітіндінің температурасын жоғарлатқанда
тұздың гидролиздену дәрежесі:
1) үлкейеді
2) азаяды
3) үлкейеді де, азаяды да
4) өзгермейді
19. Натрий карбонатын гидролиздегенде бірінші сатысында түзіледі:
1) натрий гидрокарбонаты
2) көмір қышқылы
3) натрий гидроксокарбонаты
4) гидролизге ұшырамайды
20. Гидролизге ұшырайтын тұзды таңдаңыз:
1) KCl 2) Na2SO4 3) Al2S3 4) CsNO3
9 Тотығу-тотықсыздану реакциялары
1. Күкірттің максимальді
тотығу дәрежесі:
1) +2
2) +3
3) +4
4) +6
2. Марганецтің тотығу
дәрежелерінің қатары:
1) +1, +3, +5
2) +2, +3, +6
3) +2, +4, +7
4) +3, +4, +5
3. CaO, MgO, BaO қосылыстарындағы
металдардың валенттілігі:
1) 2
2) 1
3) 4
4) 3
4. Асқын тотық
қосылыстарындағы оттегінің тотығу дәрежесі:
1) +2
2) -2
3) +1
4) -1
5. Ортофосфор
қышқылындағы қышқылдық
қалдықтың заряды:
1) 2+
2) 3-
3) 3+
4) 2-
6. BaS, K2S, Al2S3
қосылыстарындағы
бейметалдың валенттілігі:
1) 3 2) 4 3) 1 4)2
.
7. Атомның тотығу
дәрежесі мен валенттілігінің арасындағы байланыс:
1) тотығу дәрежесі валенттіліктен
әрқашан төмен
2) тотығу дәрежесі валенттіліктен жоғары
болуы мүмкін
3) тотығу дәрежесі валенттілікке тең
4) айырмашылығы жоқ
8. Темірдің тотығу дәрежелері:
1) +3, +4
2) +1, -1
3) +2, +3
4) +1, +3
9. Азот (-3) тотығу
дәрежесін көрсететін қосылысты таңдаңыз:
1) NO2
2) N2O
3) NH3
4) N2O4
10. Тұзды гидридтердегі
сутегінің тотығу дәрежесі:
1) +1 2) 0 3) -1 4)
+2
11. Хлордың тотығу
дәрежесі ең жоғары молекуланы таңдаңыз:
1) KClO
2) HClO4
3) KClO3
4) NaClO2
12. Хлордың тотығу
дәрежесі ең төмен молекуланы таңдаңыз:
1) KClO
2) NaCl
3) KClO3
4) NaClO2
10 Электрохимиялық процестер. Металдардың коррозиясы
1. Оттегі электродының потенциалын есептейтін Нернст
теңдеуі:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
2. Якоби-Даниэль элементінің жалпы электродтық реакциясы келесі теңдеумен сипатталады:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
3. Концентрациялық элемент деп
келесі электродтардан құрастырылған жүйесін айтады:
1) металл және сутегі электродтары
2) өздерінің тұздарына батырылған
екі бірдей электрод
3) мыс және мырыш электродтары
4) кадмий және мырыш электродтары
4. Тотығу-тотықсыздану
электродының потенциалын есептейтін Нернст теңдеуінің
түрі:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
5. Сутегі
электродының потенциалын есептейтін Нернст теңдеуі:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
6. Металл
электродының потенциалын есептейтін Нернст теңдеуі:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
7. Электролиз заңдарын
тұжырымдаған:
1) Э.
Резерфорд
2) Д.
И. Менделеев
3) М.
Фарадей
4) Аристотель
8. Кальций
хлоридінің сулы ерітіндісін электролиздегенде анодта бөлінеді:
1) сутегі
2) оттегі
3) хлор
4) кальций
9. Ерітінді немесе балқыма
электролиттері арқылы тұрақты электр тоғын жібергенде
электродтарда өтетін тотығу-тотықсыздану реакциялары аталады:
1) гидролиз
2) этерификация
3) электролиз
4) диссоциация
10. Ерімейтін анодта калий
нитратының сулы ерітіндісін электролиздегенде келесі заттар
түзіледі:
1) катодта - калий, анодта - оттегі
2) катодта - сутегі, анодта - оттегі
3) катодта - калий, анодта - азот
4) катодта - сутегі, анодта - азот (IV) оксиді
11. Сулы
ерітіндісін және балқымасын электролиздегенде бірдей зат
түзеді:
1) мыс (ІІ) хлориді
2) калий бромиді
3) натрий гидроксиді
4) ондай зат болмайды
12. Электролиз
процесі жүргізілетін ыдыс аталады:
1) конвертор
2) диализатор
3) электролизер
4) электрофорез
13. Ерімейтін
анодта мыс сульфатының сулы ерітіндісін электролиздегенде келесі заттар
түзіледі:
1) катодта - мыс, анодта - оттегі
2) катодта - сутегі, анодта - оттегі
3) катодта - мыс, анодта - күкірт
4) катодта - сутегі, анодта – күкірт
14. Фарадей
заңдарын сипаттайтын формула:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
15. Натрий хлоридінің сулы ерітіндісін электролиздегенде катодтағы ортаның қышқылдығы:
1) бейтарап
2) қышқылдық
3) сілтілік
4) әлсіз қышқылдық
16. Коррозия процесінде металдардың тотыққандағы Гиббс энергиясы келесі теңдеумен есептеледі:
|
1) |
|
|
2) |
|
|
3) |
|
|
4) |
|
17. Мырышталған темір ауадағы оттекпен коррозияға ұшырағанда катодта жүретін процесс:
1) темірдің тотықсыздануы
2) темірдің тотығуы
3) мырыштың тотықсыздануы
4) оттектің тотықсыздануы
18. Натрий
хлориді сулы ерітіндісін электролиздегенде келесі өнімдер түзіледі:
1) натрий
және сутегі;
2) сутегі және
хлор;
3) оттегі және сутегі;
4) натрий және оттегі.
19. Металдан жасалған конструкция коррозияға тез
ұшырайды, егер электролиттің құрамында:
1) жоғары температурада қышқылдық ортада
тотықтырғыш болса;
2) орташа (біркелкі) температурада қышқылдық ортада
тотықсыздандырғыш болса;
3) төменгі температурада қышқылдық ортада
тотықтырғыш болса;
4) төменгі температурада қышқылдық ортада
тотықсыздандырғыш болса.
20. Темірді
коррозиядан қорғағанда катодтық қаптама жасау
үшін қолданылатын металды таңдаңыз:
1)
мырыш; 2) сынап; 3) магний; 4) литий.
11 Металдар, құймалар, олардың қасиеттері
1. Металдардың құймасын араластырғанда түзілетін металдардың өзара химиялық қосылысы аталады:
1) қатты ерітінділер
2) интерметаллидтер
3) құймалар
4) аралас қосылыстар
2. Болат - ол келесі заттардың құймасы:
1) Fe мен Ni
2) Fe мен Cd
3) Fe мен C
4) Fe мен Cu
3. Кара металдарға
жатады:
1) Cu
2) Pb
3) Zn
4) Fe
4. Металдар қатарына жатады:
1) Sc, Hg, Tb, Re
2) Sn, B,
Ti, Rn
3) Sm, Hf, Te, Rh
4) As, Mo, In, Au
5. Қосымша топшада орналасқан металдар қатары:
1) B, Al, Ga, In, Tl
2) Li, Na, K, Pb, Cs, Fr
3) Mn, Tc, Re, Rh
4) Be, Mg, Ca, Sr, Ba, Ra
6. Құйма деп келесі жүйені айтады:
1) бейметалдардың балқытылған қоспасының қатаюын
2) металдардың балқытылған қоспасының қатаюын
3) электролит ерітінділерінің қоспасын
4) бейэлектролит ерітінділерінің қоспасын
7. Табиғатта
таза күйінде кездесетін металл:
1) күміс
2) кадмий
3) натрий
4) магний
8. Сілтілік
металдар сумен әрекеттескенде түзіледі:
1) гидридтер мен оттегі
2) сілтілер мен сутегі
3) пероксидтер мен сутегі
4) оксидтер мен озон
9. Авиациялық
техникада өзінің жеңілдік және жоғары
қаттылық қасиеттеріне қарай кеңінен
қолданылатын құйма:
1) шойын
2) латунь
3) дюралюмин
4) болат
10. Ең
жоғарғы температурада еритін металдарға жатады:
1) мырыш
2) темір
3) қорғасын
4) вольфрам
11. Хромды
алюминотермиялық әдіспен алғанда келесі заттар
қолданылады:
1) Cr, Al
2) Cr2O3,
Al2O3
3) Cr, Al2O3
4) Cr2O3,
Al
12 . Ауыспалы металдарға жатады:
1) ауыспалы валенттілік көрсететін элементтер
2) бөлме температурасында сұйық күйінде кездесетін жәй заттар
3)
d- және f-электрондары бар валентті
элементтер
4) бірнеше оксид түзетін элементтер.
Әдебиеттер тізімі
1. Бірімжанов Б.А. Жалпы химия. – А.: Мектеп, 2001.
2. Коровин Н.В., Масленникова Г.Н., Мингулина Э.И.,
Филиппов Э.Л. Курс общей химии. - М.: Высшая
школа, 2000.
3. Харин А.Н., Катаева Н.А., Харина
Л.Г. Курс химии. - М.: Высшая школа,1983.
4. Глинка Н.Л. Общая химия. - Л.:
Химия, 1999.
Мазмұны
Кіріспе
........................................................................................................ 3
1 Атом құрылысы,
химияның негізгі заңдары………………..................... 4
2 Химиялық эквивалент
................................................................................ 7
3. Бейорганикалық қосылыстардың негізгі кластары ……….................... 9
4. Комплексті қосылыстар……………………………………...................... 11
5 Химиялық кинетика
және катализ
……………………….......................
13
6 Химиялық процестердің энергетикасы. Химиялық
термодинамика ...... 16
7 Ерітінділердің концентрацияларын көрсету
жолдары..............................
18
8 Электролиттер ерітінділері. Тұздардың гидролизі
................................... 20
9 Тотығу-тотықсыздану
реакциялары
………………………....................
24
10 Электрхимиялық процестер. Металдардың коррозиясы.……………… 26
10 Металдар, қорытпалар, олардың қасиеттері ……………...................... 30
Әдебиеттер тізімі
........................................................................................ 33
2005 ж. жиынтық жоспары, реті 13
Айтбала Айтеновна
Тұманова
Қарлыгаш Садыровна
Идрисова
ХИМИЯДАН ТЕСТ ТАПСЫРМАЛАРЫ
(050717 – Жылуэнергетика
мамандығы студенттеріне арналған)
Редакторы Ж. А. Байбураева
Басуға қол қойылды__________ Пішімі 60х84 1/16
Тиражы 50 дана. №1 типография
қағазы
Көлемі 2,1 оқу-басп.т. Тапсырыс______.
Бағасы 68 теңге
Алматы энергетика және байланыс институтының
көшірмелі-көбейткіш бюросы
![]()
480013 Алматы, Байтұрсынов
к., 126