АЛМАТИНСКИЙ ИНСТИТУТ ЭНЕРГЕТИКИ И СВЯЗИ
Кафедра промышленной теплоэнергетики
ХИМИЯ
Программа, методические указания и контрольные задания для студентов
специальностей 050718 –
Электроэнергетика, 050719 – Радиотехника, электроника и телекоммуникации
заочной формы обучения
Алматы 2005
СОСТАВИТЕЛИ: Идрисова К.С., Туманова А.А. Химия. Программа, методические указания и контрольные задания для студентов специальностей 050718 – Электроэнергетика, 050719 – Радиотехника, электроника и телекоммуникации заочной формы обучения. – Алматы: АИЭС, 2005. – 35 с.
Методические указания предназначены для студентов специальностей 050718 – Электроэнергетика и 050719 – Радиотехника, электроника и телекоммуникации факультета заочного обучения и содержат рабочую программу курса «Химия», задания к контрольным работам, рекомендации по их выполнению, перечень рекомендуемой литературы.
Табл. 2, библиогр. – 11 назв.
Рецензент: канд. хим. наук, доцент кафедры физической химии и электрохимии КазНУ им. аль-Фараби А.С. Тусупбекова.
Печатается по плану издания Алматинского института энергетики и связи на 2005 г.
![]() ©
Алматинский институт энергетики и связи, 2005 г.
©
Алматинский институт энергетики и связи, 2005 г.
Введение
Изучение химии играет важную роль в технике, развитие
которой немыслимо без понимания процессов превращения вещества. Глубокое понимание
законов химии и их применение позволяют как совершенствовать существующие, так
и создавать новые процессы, машины, установки и приборы.
Химические реакции широко используются во многих
производственных процессах (получение электроэнергии, топлива, металлов,
различных материалов, продуктов питания и т.п.). В настоящее время, например,
электрическую и механическую энергии получают в основном преобразованием
химической энергии природного топлива. В процессе этого преобразования
происходят сложные химические реакции: горения, взаимодействия воды и ее
примесей с металлами и т.п. Без понимания этих процессов невозможно обеспечить
эффективную работу электростанций и двигателей внутреннего сгорания.
Использование химических реакций в ряде производственных
процессов позволяет резко повышать производительность труда и качество
продукции, получать новые материалы.
Изучение механизмов химических реакций позволяет избежать
нежелательных процессов (например, коррозия металлов, старение полимеров и
т.д.), выбрать рациональные методы
охраны окружающей среды, создавать новые безвредные процессы.
В результате изучения дисциплины «Химия» обучающиеся должны:
а)
знать:
1) основные стехиометрические законы химии;
2) строение атома;
3) периодический закон и периодическую систему Д. И.
Менделеева и их связь с теорией строения атомов и молекул;
4) основные виды и характеристики химической связи, причину
связи между структурой таблицы и распределением электронов внутри атома;
5) теорию кинетики химических реакций;
6) законы химической термодинамики;
7) учение о растворах;
8) окислительно-восстановительные реакции;
9) теорию электродных потенциалов и электролиз;
10) коррозию металлов и методы защиты от нее.
б)
уметь:
1) проводить расчеты на основе стехиометрических законов
химии;
2) описывать положение элементов в периодической системе, их
электронные и электронно-графические формулы, конфигурацию по типу орбитали;
3) формулировать 1 и 2 законы термодинамики, рассчитывать
теплоту реакции;
4) вычислять скорость и температурный коэффициент химических
реакций, пользоваться принципом Ле-Шателье для определения направления смещения
химического равновесия;
5) рассчитывать концентрации и рН растворов, переходить от
одного способа выражения концентрации к другому;
6) писать реакции гидролиза солей и
окислительно-восстановительные реакции;
7) пользоваться рядом напряжений металлов для расчета ЭДС
гальванических элементов и электродных потенциалов, для описания электродных
реакций процесса электролиза и коррозии.
По
курсу предусмотрено выполнение контрольной работы.
Форма
контроля овладения дисциплиной – тестирование, контрольная работа, экзамен.
1 Рабочая программа курса «Химия»
Целью
преподавания дисциплины является формирование у студентов знаний,
умений и навыков в области общей и неорганической химии, являющихся составной
частью профессиональной подготовки инженеров в области энергетики,
радиотехники, электроники и связи.
Задачи
изучения дисциплины:
-
создание у студентов теоретической базы
по химии;
-
приобретение умения применять полученные знания на практике при решении задач
энергетики, радиотехники, электроники и
связи (протекание ионных реакций,
защита оборудования от коррозии, химические источники энергии, создание
конструкционных и электротехнических материалов, охрана окружающей среды и
т.д.).
1.1
Объем курса
Объем
курса химии в часах для бакалавриата
электроэнергетического факультета (БЭ)
и бакалавриата факультета радиотехники, электроники и связи (БРЭ)
представлен в таблице 1.
Таблица 1 – Объем
курса химии в часах
|
Отделение |
Всего
часов |
Объем
лекций, ч. |
Объем
лаборат. занятий,
ч. |
Объем
практич. занятий,
ч. |
Объем
дист.обу- чения.,
ч. |
Объем
СРС,
ч. |
|
Бакалавриат электроэнергетичес-кого факультета
|
45 |
4 |
4 4 |
4 |
5 |
28 |
|
Бакалавриат факультета радиотехники, электроники
и связи |
45 |
4 |
4 |
4 |
5 |
28 |
1.2
Содержание разделов программы
1.2.1 Химия как предмет
естествознания. Основные понятия и законы химии. Классы неорганических
соединений. Основные понятия химии: атом, молекула, атомная и молекулярная
массы, простое и сложное вещество, химический эквивалент; основные
стехиометрические законы: закон постоянства состава, закон эквивалентов, закон
кратных отношений, закон объемных отношений.
1.2.2 Периодический закон и
периодическая система элементов Д.И.Менделеева. Строение атома. Структура периодической системы,
построенной на основе периодического закона, строение атома и ядра, волновая
теория строения атома, двойственная природа электрона, волновая функция и
понятие об электронном облаке и квантово-механической модели атома; квантовые
числа как характеристики состояния электрона в атоме (s, p, d, f – электроны), формы
электронных облаков. Принцип Паули, правила Хунда, Клечковского, принцип
минимума энергии, емкость электронных уровней и подуровней, деление элементов
на s-, p-, d-, f - элементы и их
расположение в периодической системе (период, группа: главная и побочная).
1.2.3 Химическая связь.
Основные типы химической связи. Порядок, длина и энергия связи, валентный
угол, насыщаемость, направленность
связи. Основные положения теории валентных связей, молекулярных орбиталей. Гибридизация атомных орбиталей и
пространственное строение молекул, понятие о степени окисления.
1.2.4 Химическая кинетика.
Скорость химической реакции и факторы влияющие на нее. Константа скорости.
Порядок и молекулярность реакции. Химическое равновесие. Катализаторы. Закон действующих масс, правило
Вант-Гоффа, уравнение Аррениуса;
понятие об энергии активации, обратимых и необратимых реакциях,
химическом равновесии, константе равновесия; принцип Ле-Шателье; гомогенный и
гетерогенный катализ.
1.2.5 Энергетика химических
процессов. Химическая термодинамика. Первое и второе начала термодинамики,
понятия энтальпии, энтропии, свободной энергии Гиббса; закон Гесса и следствия
из него.
1.2.6 Растворы. Общая характеристика
растворов. Классификация растворов. Способы выражения концентрации растворов.
Понятия степени и константы
электролитической диссоциации, ионная сила растворов, электролитическая
диссоциация воды, закон разведения
Оствальда, водородный показатель среды (рН растворов сильных и слабых
электролитов); ионные реакции в растворах, гидролиз солей, степень и константа
гидролиза.
1.2.7
Окислительно-восстановительные реакции.
Основные понятия: степень
окисления, окислитель, восстановитель. Типы окислительно-восстановительных
реакций. Типичные окислители и восстановители. Степень окисления элементов,
уравнивание окислительно-восстановительных реакций методом электронного баланса
и ионно-электронным методом.
1.2.8 Электрохимические
процессы. Определение, классификация электрохимических процессов. Понятие об
электродных потенциалах. Гальванические элементы. ЭДС и ее измерение.
Электролиз. Законы Фарадея. Стандартный водородный электрод и водородная шкала
потенциалов, уравнение Нернста для расчета потенциалов металлических, газовых и
окислительно-восстановительных
электродов. Теория электролиза, законы Фарадея, выход по току, реакции электролиза с нерастворимым и
растворимым анодами.
1.2.9 Коррозия и защита
металлов. Основные виды коррозии: химическая и электрохимическая коррозии, коррозия
под действием блуждающих токов. Методы защиты от коррозии: легирование,
электрохимическая защита, защитные покрытия и ингибиторы коррозии.
1.3
Темы и содержание практических занятий
1.3.1
Основные понятия и законы химии.
Примеры решения задач на расчет
эквивалента, молярной массы и молярной массы эквивалента вещества,
стехиометрические расчеты по уравнениям реакций.
1.3.2
Периодическая система элементов Д. И. Менделеева. Строение атома.
Определение квантовых чисел элементов,
написание электронной и графической формул элементов, определение их
валентностей в основном и возбужденном состояниях.
1.3.3
Кинетика химических реакций. Химическое равновесие.
Расчет скорости и константы равновесия химической реакции, влияние различных
факторов на скорость химической реакции. Определение энергии активации реакции.
1.3.4
Растворы и их свойства. Способы выражения концентрации растворов.
Вычисление степени и константы
диссоциации растворов неэлектролитов, ионной силы, активности и коэффициента
активности растворов электролитов
и расчет рН растворов.
1.3.5
Электрохимические процессы.
Расчет электродного потенциала, ЭДС
гальванического элемента, расчеты по формуле Фарадея, написание электродных
процессов, протекающих в гальваническом элементе, при электролизе и коррозии
металлов.
1.4
Темы лабораторных работ
1.4.1
Основные классы неорганических соединений. Получение
солей, оксидов, оснований и кислот.
1.4.2
Окислительно-восстановительные реакции. Экспериментальное определение
окислительных и восстановительных свойств элементов.
1.4.3
Гальванический элемент. Электродвижущая сила. Экспериментальное определение электродвижущей силы гальванического
элемента.
1.4.4
Коррозия металлов. Методы защиты от нее.
Определение коррозионных свойств различных металлов.
1.5
Методические указания к изучению разделов программы
При
изучении разделов программы особое внимание следует обратить на
- определение эквивалента простого и сложного вещества и молярной массы
эквивалента вещества (л.3, гл.1.1-1.5);
- связь между электронным строением атома и химическими свойствами элемента (л.3, гл.2.1-2.6);
- определение степени окисления и валентности элементов в соединениях
(л.2, гл.7.1-7.4);
- следствия из закона Гесса, определение возможности самопроизвольного
протекания реакций (л.1, гл.5; л.2,гл.1; л.8, гл.5);
- расчеты рН растворов сильных и слабых электролитов; на расчеты, связанные с переходами от одной концентрации раствора к другой (л.1, гл.8.1-8.5);
- классификацию веществ: только окислители, только восстановители, а
также окислители- восстановители (
л.2, гл.7.1-7.2; л.8, гл.9.1-9.2);
- составление схемы гальванического элемента и расчет ЭДС; на написание
катодных и анодных процессов при электролизе (л.1, гл.9.2-9.8; л.2,
гл.8.1-8.9);
- катодное и анодное покрытие металлов; на написание электродных процессов при электрохимической коррозии
(л.1, гл. 10.1-10.4; л.2, гл.8.10-8.11).
1.6
Рекомендуемая литература
1. Коровин Н.В.,
Масленникова Г.Н., Мингулина Э.И., Филиппов Э.Л. Курс общей химии. – М.: Высшая
школа, 2004.
2. Харин А.Н.,
Катаева Н.А., Харина Л.Г. Курс химии. – М.: Высшая школа, 1983.
3. Глинка Н.Л.
Общая химия. – Л.: Химия, 2002.
4. Некрасов
Б.В. Основы общей химии. – М.: Химия, 1998. – т.1,2.
5. Угай Я.
Общая химия. – М.: Химия, 1994.
6. Дробашева
Т.И. Общая химия. – Ростов-на-Дону: Феникс, 2004.
7. Даулетов
Б.Д., Ильясов Е.Г. Химия. Методические
указания к выполнению лабораторных работ (для студентов специальностей тепло-,
электроэнергетика, радиотехника и связь). – Алматы: АИЭС, 2002. – 40 с.
8. Гольбрайх
З.Е., Маслов Е.И. Сборник задач и упражнений по химии. – М.: Астрель, 2004.
9. Глинка Н.Л.
Задачи и упражнения по общей химии. – М.: Интеграл-Пресс, 2004.
10. Туманова
А.А., Идрисова К.С. Тестовые задания по курсу «Химия» для бакалавриата
«Электроэнергетика» и «Радиотехника и телекоммуникации». – Алматы: АИЭС, 2005.
11. Краткий
справочник физико-химических величин. / Под ред. А. А. Равделя и А. М.
Пономаревой. – С. – П.: «Иван Федоров», 2003.
2 Методические рекомендации по выполнению контрольной работы
Каждый студент выполняет вариант контрольных
заданий, обозначенный двумя последними цифрами номера студенческого билета. Например, номер студенческого билета 050175, две последние
цифры 75, им соответствует вариант контрольного задания 75.
Вариант контрольной работы содержит 11 заданий. Номера задач
выбираются по ключу, приведенному в таблице 2.
Ответы на вопросы заданий, не требующих вычислений, должны
быть исчерпывающими, логичными, достаточно краткими.
При
решении задач необходимо переписать условие задачи, дать его краткую запись,
записать формулы основных закономерностей в общем виде, обосновать их
применение. Решение задачи поясняется и делается соответствующий вывод.
В
конце работы приводится список использованной литературы с указанием года
издания.
Контрольные работы, не соответствующие своему
варианту, не рассматриваются.
При
затруднениях можно обратиться за консультацией на кафедру.
Контрольная
работа должна быть сдана на кафедру промышленной теплоэнергетики за месяц до
даты сдачи экзамена.
Таблица 2 – Таблица вариантов контрольных заданий
|
Номер вар-та |
Номера
задач, относящихся к данному заданию |
|
01 |
3.1.1 3.2.11 3.3.2 3.4.12 3.5.3 3.6.13 3.7.4 3.8.14 3.9.5 3.10.15 3.11.6 |
|
02 |
3.1.2 3.2.12 3.3.3 3.4.13 3.5.4 3.6.14 3.7.5 3.8.15 3.9.6 3.10.16 3.11.7 |
|
03 |
3.1.3 3.2.13 3.3.4 3.4.14 3.5.5 3.6.15 3.7.6 3.8.16 3.9.7 3.10.17 3.11.8 |
|
04 |
3.1.4 3.2.14 3.3.5 3.4.15 3.5.6 3.6.16 3.7.7 3.8.17 3.9.8 3.10.18 3.11.9 |
|
05 |
3.1.5 3.2.15 3.3.6 3.4.16 3.5.7 3.6.17 3.7.8 3.8.18 3.9.9 3.10.19 3.11.10 |
|
06 |
3.1.6 3.2.16 3.3.7 3.4.17 3.5.8 3.6.18 3.7.9 3.8.19 3.9.10 3.10.20 3.11.11 |
|
07 |
3.1.7 3.2.17 3.3.8 3.4.18 3.5.9 3.6.19 3.7.10 3.8.20 3.9.11 3.10.1 3.11.12 |
|
08 |
3.1.8 3.2.18 3.3.9 3.4.19 3.5.10 3.6.20 3.7.11 3.8.1 3.9.12 3.10.2 3.11.13 |
|
09 |
3.1.9 3.2.19 3.3.10 3.4.20 3.5.11 3.6.1 3.7.12 3.8.2 3.9.13 3.10.3 3.11.14 |
|
10 |
3.1.10 3.2.20 3.3.11 3.4.1 3.5.12 3.6.2 3.7.13 3.8.3 3.9.14 3.10.4 3.11.15 |
|
11 |
3.1.11 3.2.1 3.3.12 3.4.2 3.5.13 3.6.3 3.7.14 3.8.4 3.9.15 3.10.5 3.11.16 |
|
12 |
3.1.12 3.2.2 3.3.13 3.4.3 3.5.14 3.6.4 3.7.15 3.8.5 3.9.16 3.10.6 3.11.17 |
|
13 |
3.1.13 3.2.3 3.3.14 3.4.4 3.5.15 3.6.5 3.7.16 3.8.6 3.9.17 3.10.7 3.11.18 |
|
14 |
3.1.14 3.2.4 3.3.15 3.4.5 3.5.16 3.6.6 3.7.17 3.8.7 3.9.18 3.10.8 3.11.19 |
|
15 |
3.1.15 3.2.5 3.3.16 3.4.6 3.5.17 3.6.7 3.7.18 3.8.8 3.9.19 3.10.9 3.11.20 |
|
16 |
3.1.16 3.2.6 3.3.17 3.4.7 3.5.18 3.6.8 3.7.19 3.8.9 3.9.20 3.10.10 3.11.1 |
|
17 |
3.1.17 3.2.7 3.3.18 3.4.8 3.5.19 3.6.9 3.7.20 3.8.10 3.9.1 3.10.11 3.11.2 |
|
18 |
3.1.18 3.2.8 3.3.19 3.4.9 3.5.20 3.6.10 3.7.1 3.8.11 3.9.2 3.10.12 3.11.3 |
|
19 |
3.1.19 3.2.9 3.3.20 3.4.10 3.5.1 3.6.11 3.7.2 3.8.12 3.9.3 3.10.13 3.11.4 |
|
20 |
3.1.20 3.2.10 3.3.1 3.4.11 3.5.2 3.6.12 3.7.3 3.8.13 3.9.4 3.10.14 3.11.5 |
|
21 |
3.1.20 3.2.11 3.3.1 3.4.12 3.5.2 3.6.13 3.7.3 3.8.14 3.9.4 3.10.15 3.11.5 |
|
22 |
3.1.19 3.2.12 3.3.20 3.4.13 3.5.1 3.6.14 3.7.2 3.8.15 3.9.3 3.10.16 3.11.4 |
|
23 |
3.1.18 3.2.13 3.3.19 3.4.14 3.5.20 3.6.15 3.7.1 3.8.16 3.9.2 3.10.17 3.11.3 |
|
24 |
3.1.17 3.2.14 3.3.18 3.4.15 3.5.19 3.6.16 3.7.20 3.8.17 3.9.1 3.10.18 3.11.2 |
|
25 |
3.1.16 3.2.15 3.3.17 3.4.16 3.5.18 3.6.17 3.7.19 3.8.18 3.9.20 3.10.19 3.11.1 |
|
26 |
3.1.15 3.2.16 3.3.16 3.4.17 3.5.17 3.6.18 3.7.18 3.8.19 3.9.19 3.10.20 3.11.20 |
|
27 |
3.1.14 3.2.17 3.3.15 3.4.18 3.5.16 3.6.19 3.7.17 3.8.20 3.9.18 3.10.1 3.11.19 |
|
28 |
3.1.13 3.2.18 3.3.14 3.4.19 3.5.15 3.6.20 3.7.16 3.8.1 3.9.17 3.10.2 3.11.18 |
|
29 |
3.1.12 3.2.19 3.3.13 3.4.20 3.5.14 3.6.1 3.7.15 3.8.2 3.9.16 3.10.3 3.11.17 |
|
30 |
3.1.11 3.2.20 3.3.12 3.4.1 3.5.13 3.6.2 3.7.14 3.8.3 3.9.15 3.10.4 3.11.16 |
|
31 |
3.1.10 3.2.1 3.3.11 3.4.2 3.5.12 3.6.3 3.7.13 3.8.4 3.9.14 3.10.5 3.11.15 |
|
32 |
3.1.9 3.2.2 3.3.10 3.4.3 3.5.11 3.6.4 3.7.12 3.8.5 3.9.13 3.10.6 3.11.14 |
|
33 |
3.1.8 3.2.3 3.3.9 3.4.4 3.5.10 3.6.5 3.7.11 3.8.6 3.9.12 3.10.7 3.11.13 |
|
34 |
3.1.7 3.2.4 3.3.8 3.4.5 3.5.9 3.6.6 3.7.10 3.8.7 3.9.11 3.10.8 3.11.12 |
|
35 |
3.1.6 3.2.5 3.3.7 3.4.6 3.5.8 3.6.7 3.7.9 3.8.8 3.9.10 3.10.9 3.11.11 |
|
36 |
3.1.5 3.2.6 3.3.6 3.4.7 3.5.7 3.6.8 3.7.8 3.8.9 3.9.9 3.10.10 3.11.10 |
|
37 |
3.1.4 3.2.7 3.3.5 3.4.8 3.5.6 3.6.9 3.7.7 3.8.10 3.9.8 3.10.11 3.11.9 |
|
38 |
3.1.3 3.2.8 3.3.4 3.4.9 3.5.5 3.6.10 3.7.6 3.8.11 3.9.7 3.10.12 3.11.8 |
|
39 |
3.1.2 3.2.9 3.3.3 3.4.10 3.5.4 3.6.11 3.7.5 3.8.12 3.9.6 3.10.13 3.11.7 |
|
40 |
3.1.1 3.2.10 3.3.2 3.4.11 3.5.3 3.6.12 3.7.4 3.8.13 3.9.5 3.10.14 3.11.6 |
|
41 |
3.1.2 3.2.10 3.3.1 3.4.11 3.5.2 3.6.12 3.7.3 3.8.13 3.9.4 3.10.14 3.11.5 |
|
42 |
3.1.3 3.2.9 3.3.2 3.4.10 3.5.3 3.6.11 3.7.4 3.8.12 3.9.5 3.10.13 3.11.6 |
|
43 |
3.1.4 3.2.8 3.3.3 3.4.9 3.5.4 3.6.10 3.7.5 3.8.11 3.9.6 3.10.12 3.11.7 |
|
44 |
3.1.5 3.2.7 3.3.4 3.4.8 3.5.5 3.6.9 3.7.6 3.8.10 3.9.7 3.10.11 3.11.8 |
|
45 |
3.1.6 3.2.6 3.3.5 3.4.7 3.5.6 3.6.8 3.7.7 3.8.9 3.9.8 3.10.10 3.11.9 |
|
46 |
3.1.7 3.2.5 3.3.6 3.4.6 3.5.7 3.6.7 3.7.8 3.8.8 3.9.9 3.10.9 3.11.10 |
|
47 |
3.1.8 3.2.4 3.3.7 3.4.5 3.5.8 3.6.6 3.7.9 3.8.7 3.9.10 3.10.8 3.11.11 |
|
48 |
3.1.9 3.2.3 3.3.8 3.4.4 3.5.9 3.6.5 3.7.10 3.8.6 3.9.11 3.10.7 3.11.12 |
|
49 |
3.1.10 3.2.2 3.3.9 3.4.3 3.5.10 3.6.4 3.7.11 3.8.5 3.9.12 3.10.6 3.11.13 |
|
50 |
3.1.11 3.2.1 3.3.10 3.4.2 3.5.11 3.6.3 3.7.12 3.8.4 3.9.13 3.10.5 3.11.14 |
|
51 |
3.1.12 3.2.20 3.3.11 3.4.1 3.5.12 3.6.2 3.7.13 3.8.3 3.9.14 3.10.4 3.11.15 |
|
52 |
3.1.13 3.2.19 3.3.12 3.4.20 3.5.13 3.6.1 3.7.14 3.8.2 3.9.15 3.10.3 3.11.16 |
|
53 |
3.1.14 3.2.18 3.3.13 3.4.19 3.5.14 3.6.20 3.7.15 3.8.1 3.9.16 3.10.2 3.11.17 |
|
54 |
3.1.15 3.2.17 3.3.14 3.4.18 3.5.15 3.6.19 3.7.16 3.8.20 3.9.17 3.10.1 3.11.18 |
|
55 |
3.1.16 3.2.16 3.3.15 3.4.17 3.5.16 3.6.18 3.7.17 3.8.19 3.9.18 3.10.20 3.11.19 |
|
56 |
3.1.17 3.2.15 3.3.16 3.4.16 3.5.17 3.6.17 3.7.18 3.8.18 3.9.19 3.10.19 3.11.20 |
|
57 |
3.1.18 3.2.14 3.3.17 3.4.15 3.5.18 3.6.16 3.7.19 3.8.17 3.9.20 3.10.18 3.11.1 |
|
58 |
3.1.19 3.2.13 3.3.18 3.4.14 3.5.19 3.6.15 3.7.20 3.8.16 3.9.1 3.10.17 3.11.2 |
|
59 |
3.1.20 3.2.12 3.3.19 3.4.13 3.5.20 3.6.14 3.7.1 3.8.15 3.9.2 3.10.16 3.11.3 |
|
60 |
3.1.1 3.2.11 3.3.20 3.4.12 3.5.1 3.6.13 3.7.2 3.8.14 3.9.3 3.10.15 3.11.4 |
|
61 |
3.1.1 3.2.1 3.3.1 3.4.1 3.5.1 3.6.1 3.7.1 3.8.1 3.9.1 3.10.1 3.11.1 |
|
62 |
3.1.2 3.2.2 3.3.2 3.4.2 3.5.2 3.6.2 3.7.2 3.8.2 3.9.2 3.10.2 3.11.2 |
|
63 |
3.1.3 3.2.3 3.3.3 3.4.3 3.5.3 3.6.3 3.7.3 3.8.3 3.9.3 3.10.3 3.11.3 |
|
64 |
3.1.4 3.2.4 3.3.4 3.4.4 3.5.4 3.6.4 3.7.4 3.8.4 3.9.4 3.10.4 3.11.4 |
|
65 |
3.1.5 3.2.5 3.3.5 3.4.5 3.5.5 3.6.5 3.7.5 3.8.5 3.9.5 3.10.5 3.11.5 |
|
66 |
3.1.6 3.2.6 3.3.6 3.4.6 3.5.6 3.6.6 3.7.6 3.8.6 3.9.6 3.10.6 3.11.6 |
|
67 |
3.1.7 3.2.7 3.3.7 3.4.7 3.5.7 3.6.7 3.7.7 3.8.7 3.9.7 3.10.7 3.11.7 |
|
68 |
3.1.8 3.2.8 3.3.8 3.4.8 3.5.8 3.6.8 3.7.8 3.8.8 3.9.8 3.10.8 3.11.8 |
|
69 |
3.1.9 3.2.9 3.3.9 3.4.9 3.5.9 3.6.9 3.7.9 3.8.9 3.9.9 3.10.9 3.11.9 |
|
70 |
3.1.10 3.2.10 3.3.10 3.4.10 3.5.10 3.6.10 3.7.10 3.8.10 3.9.10 3.10.10 3.11.10 |
|
71 |
3.1.11 3.2.11 3.3.11 3.4.11 3.5.11 3.6.11 3.7.11 3.8.11 3.9.11 3.10.11 3.11.11 |
|
72 |
3.1.12 3.2.12 3.3.12 3.4.12 3.5.12 3.6.12 3.7.12 3.8.12 3.9.12 3.10.12 3.11.12 |
|
73 |
3.1.13 3.2.13 3.3.13 3.4.13 3.5.13 3.6.13 3.7.13 3.8.13 3.9.13 3.10.13 3.11.13 |
|
74 |
3.1.14 3.2.14 3.3.14 3.4.14 3.5.14 3.6.14 3.7.14 3.8.14 3.9.14 3.10.14 3.11.14 |
|
75 |
3.1.15 3.2.15 3.3.15 3.4.15 3.5.15 3.6.15 3.7.15 3.8.15 3.9.15 3.10.15 3.11.15 |
|
76 |
3.1.16 3.2.16 3.3.16 3.4.16 3.5.16 3.6.16 3.7.16 3.8.16 3.9.16 3.10.16 3.11.16 |
|
77 |
3.1.17 3.2.17 3.3.17 3.4.17 3.5.17 3.6.17 3.7.17 3.8.17 3.9.17 3.10.17 3.11.17 |
|
78 |
3.1.18 3.2.18 3.3.18 3.4.18 3.5.18 3.6.18 3.7.18 3.8.18 3.9.18 3.10.18 3.11.18 |
|
79 |
3.1.19 3.2.19 3.3.19 3.4.19 3.5.19 3.6.19 3.7.19 3.8.19 3.9.19 3.10.19 3.11.19 |
|
80 |
3.1.20 3.2.20 3.3.20 3.4.20 3.5.20 3.6.20 3.7.20 3.8.20 3.9.20 3.10.20 3.11.20 |
|
81 |
3.1.11 3.2.2 3.3.3 3.4.19 3.5.10 3.6.11 3.7.1 3.8.15 3.9.9 3.10.4 3.11.4 |
|
82 |
3.1.12 3.2.3 3.3.2 3.4.18 3.5.9 3.6.12 3.7.11 3.8.14 3.9.10 3.10.4 3.11.5 |
|
83 |
3.1.13 3.2.4 3.3.1 3.4.17 3.5.8 3.6.13 3.7.2 3.8.13 3.9.11 3.10.20 3.11.6 |
|
84 |
3.1.14 3.2.5 3.3.20 3.4.16 3.5.7 3.6.14 3.7.12 3.8.12 3.9.13 3.10.1 3.11.7 |
|
85 |
3.1.15 3.2.6 3.3.19 3.4.15 3.5.6 3.6.15 3.7.3 3.8.11 3.9.12 3.10.3 3.11.8 |
|
86 |
3.1.16 3.2.7 3.3.18 3.4.14 3.5.15 3.6.16 3.7.13 3.8.1 3.9.19 3.10.6 3.11.9 |
|
87 |
3.1.17 3.2.8 3.3.17 3.4.13 3.5.14 3.6.17 3.7.4 3.8.2 3.9.20 3.10.5 3.11.10 |
|
88 |
3.1.18 3.2.10 3.3.16 3.4.12 3.5.13 3.6.18 3.7.14 3.8.3 3.9.1 3.10.10 3.11.11 |
|
89 |
3.1.19 3.2.10 3.3.15 3.4.11 3.5.12 3.6.19 3.7.5 3.8.4 3.9.2 3.10.7 3.11.1 |
|
90 |
3.1.20 3.2.19 3.3.14 3.4.10 3.5.11 3.6.20 3.7.15 3.8.5 3.9.3 3.10.8 3.11.2 |
|
91 |
3.1.10 3.2.18 3.3.4 3.4.9 3.5.1 3.6.10 3.7.6 3.8.16 3.9.4 3.10.14 3.11.3 |
|
92 |
3.1.9 3.2.17 3.3.5 3.4.20 3.5.2 3.6.9 3.7.16 3.8.17 3.9.5 3.10.18 3.11.12 |
|
93 |
3.1.8 3.2.16 3.3.6 3.4.1 3.5.3 3.6.8 3.7.7 3.8.18 3.9.17 3.10.9 3.11.13 |
|
94 |
3.1.7 3.2.15 3.3.7 3.4.2 3.5.4 3.6.7 3.7.17 3.8.19 3.9.16 3.10.11 3.11.14 |
|
95 |
3.1.6 3.2.14 3.3.8 3.4.3 3.5.5 3.6.6 3.7.8 3.8.20 3.9.15 3.10.19 3.11.18 |
|
96 |
3.1.5 3.2.13 3.3.9 3.4.4 3.5.16 3.6.1 3.7.18 3.8.10 3.9.14 3.10.17 3.11.19 |
|
97 |
3.1.4 3.2.12 3.3.10 3.4.5 3.5.17 3.6.2 3.7.9 3.8.6 3.9.8 3.10.16 3.11.20 |
|
98 |
3.1.3 3.2.11 3.3.11 3.4.6 3.5.18 3.6.3 3.7.19 3.8.7 3.9.6 3.10.15 3.11.17 |
|
99 |
3.1.2 3.2.1 3.3.12 3.4.7 3.5.19 3.6.4 3.7.20 3.8.8 3.9.7 3.10.13 3.11.15 |
|
100 |
3.1.1 3.2.20 3.3.13 3.4.8 3.5.20 3.6.5 3.7.10 3.8.9 3.9.18 3.10.12 3.11.16 |
3 Контрольное задание
3.1 Основные понятия и законы
химии
Пример
1. При сгорании металла образуется 9,43 г его оксида. Молярная масса
эквивалента оксида металла равна 17 г/моль. Какая масса металла вступила в
реакцию?
Решение. Учитывая, что Мэ
(оксида металла) = Мэ (кислорода) + Мэ (металла), можно
найти молярную массу эквивалента металла:
Мэ (металла) = Мэ
(оксида металла) – Мэ (кислорода) = 17 – 8 = 9 г/моль.
По закону эквивалентов найдем
количество металла, вступившего в реакцию:
m (оксида металла) / Мэ (оксида металла) = m (металла) / Мэ (металла);
m (металла) = 9,43 · 9 / 17 = 4,99 г.
Ответ: 4,99 г.
Пример
2. Какова масса 200 л хлора при 0°С и 101,3 кПа?
Решение. Масса 22,4 л Сl2 составляет 70,91 г
Масса 200 л Сl2 составляет x г
х = 200 · 70,91 / 22,4 = 633,2 г.
Ответ: 633,2 г.
Задачи
3.1.1 Приведите примеры
химических соединений с молярной массой, равной молярной массе эквивалента.
3.1.2 Сколько моль эквивалентов
содержится в 100 г карбоната кальция?
3.1.3 Определите массу трех молей
эквивалентов хлорида натрия.
3.1.4 Какой объем занимают 0,2
моль эквивалентов водорода (н. у.)?
3.1.5 Определите объем 2 моль
эквивалентов кислорода (н. у.).
3.1.6 При сгорании 1,5 г металла
получилось 2,1 г оксида. Рассчитайте молярную массу эквивалента этого металла.
3.1.7 Сколько граммов гидроксида
натрия вступило в реакцию, если в результате получилось 2 моль эквивалентов
металла?
3.1.8 Сколько моль эквивалентов
металла вступило в реакцию с кислотой, если при этом выделилось 5,6 л водорода
при нормальных условиях?
3.1.9 Молярная масса эквивалента
металла равна 56,2 г/моль. Вычислите массовую долю металла в его оксиде.
3.1.10 Металл массой 1 г
соединяется с 8,89 г брома и 1,78 г серы. Определите молярную массу эквивалента
металла.
3.1.11 Рассчитайте молярную массу
эквивалента кислоты, если на нейтрализацию 9 г ее израсходовано 8 г гидроксида
натрия.
3.1.12 Определите молярную массу
эквивалента воды при реакции ее с металлическим натрием и с оксидом натрия.
3.1.13 Вычислите массу 1 л
следующих газов при 0°С и 101,3 кПа: а) водорода; б) кислорода; в) оксида
углерода (IV); г) оксида углерода (II).
3.1.14 Какой объем в миллилитрах
займут при нормальных условиях: а) 0,85 г аммиака; б) 1,4 г этилена С2Н4;
в) 128 г иодида водорода.
3.1.15 Какой объем в литрах
займут при нормальных условиях: а) 3,5 г азота; б) 640 г кислорода; в) 110 г
оксида углерода (IV); г) 70 г оксида углерода (II).
3.1.16 Сколько граммов AgCl можно получить из 34 г AgNO3?
3.1.17 К раствору, содержащему
12,6 г HNO3, добавили
раствор, содержащий 7,2 г NaOH. Какое вещество
и сколько останется в избытке?
3.1.18 Сколько Mn3O4 можно получить из 10 кг MnО2? Сколько кислорода выделится при этом (в молях и в
литрах)?
3.1.19 В какой массе азота
содержится 1024 молекул?
3.1.20 В каком объеме хлора (0°С,
101,3 кПа) содержится 1020 молекул?
3.2 Строение атома. Периодическая
система элементов Д.И.Менделеева
Пример
1. Каково максимальное число ориентаций f- орбиталей в пространстве?
Решение: Так как при
ℓ = 3 (f- подуровень) имеется семь
значений квантового числа ml = –3, –2, –1,
0, +1, +2, +3, характеризующих ориентацию электронных облаков в пространстве,
то число ориентаций f- орбиталей равно семи.
Пример
2. Напишите электронную конфигурацию атома олова (Sn, элемент №50).
Решение. Элемент №50
расположен в IVА–подгруппе V периода. Следовательно: а) внешние электроны расположены
на пятом энергетическом уровне (n = 5), б) номер
группы IV и индекс главной подгруппы А указывают
на расположение четырех электронов (в том числе формирующего) именно на внешнем
(пятом уровне). Каждый уровень начинается двумя s- элементами, затем следуют р- элементы (при n ≥ 2). Таким образом, электронная формула атома олова
– 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d105p2.
Задачи
3.2.1 Сколько
электронов может находиться на 2р- и 3р- подуровнях?
3.2.2 Период заканчивается, когда
заполняются все s- и р- орбитали одного уровня.
Какое максимальное суммарное число электронов могут содержать s- и р- орбитали одного уровня?
3.2.3 В какой последовательности
заполняются подуровни, для которых сумма (![]() ) равна последовательно 1, 2 и 3?
) равна последовательно 1, 2 и 3?
3.2.4 В какой последовательности
заполняются подуровни, для которых сумма (![]() ) последовательно
равна 6, 7 и 8?
) последовательно
равна 6, 7 и 8?
3.2.5 В каком порядке заполняются
электронные подуровни атомов элементов в соответствии с таблицей Д. И.
Менделеева? Сопоставьте этот порядок с порядком заполнения электронных
подуровней, выведенным по правилу Клечковского. Какие существенные различия
следует отметить?
3.2.6 Изобразите электронные
облака атомов следующих элементов: а) лития; б) бериллия; в) бора; г) углерода;
д) азота; е) кислорода; ж) хрома; з) марганца.
3.2.7 Почему в VII группе периодической системы элементов объединены атомы
элементов неметаллов ― галогенов (А – подгруппа) и атомы элементов с
характерными металлическими свойствами (В – подгруппа)?
3.2.8 Что понимают под процессом
ионизации данного атома? Затрачивается
или поглощается энергия при образовании положительных ионов? Приведите примеры.
3.2.9 У атомов элементов IIВ – подгруппы (Cu, Ag, Au) наблюдается
явление «провала» электрона. Запишите общую сокращенную электронную формулу
атомов этих элементов без «провала» и с «провалом» электрона. Чем обусловлен
этот эффект?
3.2.10 Увеличиваются или
уменьшаются значения энергии сродства к электрону у атомов элементов VIIА – подгруппы от фтора к астату?
3.2.11 Напишите электронные
формулы атомов элементов второго и третьего периодов периодической системы.
Какие из них являются s-, а какие – р- элементами?
3.2.12 Напишите электронные
формулы атомов элементов четвертого периода ― калия, скандия, марганца,
цинка, мышьяка и криптона.
3.2.13 Напишите электронные
формулы атомов элементов пятого периода с порядковыми номерами 37, 43, 48, 52
и 54. К каким группам периодической системы относятся эти элементы? Как
отражается принадлежность к группе в электронной формуле?
3.2.14 Почему марганец проявляет металлические свойства, а хлор – неметаллические? Ответ мотивируйте строением атомов этих элементов. Напишите формулы оксидов и гидроксидов хлора и марганца.
3.2.15 Назовите элементы, имеющие
по одному электрону на подуровне: а) 3d;
б) 4d; в) 5d. Напишите электронные формулы
атомов этих элементов и укажите их положение в периодической системе ―
период, группа и подгруппа.
3.2.16 Назовите элементы 4, 5 и
6-го периодов, у которых заканчивается заполнение d- орбиталей (3d10,
4d10 и 5d10). Напишите электронные формулы атомов этих элементов и
укажите, к какому периоду, группе и подгруппе периодической системы они
относятся.
3.2.17 Сколько свободных d- орбиталей имеется в атомах титана и ванадия? Напишите
для них электронно-графическую формулу d- подуровня.
3.2.18 Назовите элементы 4-го
периода, атомы которых содержат наибольшее число непарных d- электронов. Напишите электронно-графическую формулу их d- подуровня.
3.2.19 Сколько свободных p- орбиталей содержится в атомах элементов-халькогенов?
3.2.20 Назовите элемент, атомы
которого на энергетическом уровне с n = 5 имеют девять
электронов. Перечислите аналоги электронной структуры этого элемента.
3.3 Химическая связь и строение
молекул
Пример
1. Определите возможные валентности атома кобальта.
Решение. Отсутствие
неспаренных электронов у атома кобальта на внешнем 4-м энергетическом уровне
определяет его валентность в основном состоянии, равную нулю, несмотря на то,
что на предвнешнем 3d- подуровне имеются неспаренные
электроны. Последние не могут образовывать электронные пары с электронами
других атомов, так как закрыты электронами внешней оболочки:
![]() 3d
4s 4p
3d
4s 4p
Co
В возбужденном состоянии
происходит распаривание 4s- пары
электронов и валентность может быть 2, 3, 4, 5.
![]() 3d 4s 4p
3d 4s 4p
Co*
Пример 2. Определите
вид гибридизации электронных облаков и пространственную структуру молекулы SiCl4.
Решение. В возбужденном состоянии
структура внешнего энергетического уровня атома кремния следующая: 3s1 3p3
![]() 3s 3p
3s 3p
![]()
![]()
![]()
![]()
В образовании химических связей в атоме
кремния участвуют электроны третьего внешнего энергетического уровня: один
электрон в s- и три электрона в р- состоянии. При образовании
молекулы SiCl4 возникают четыре гибридных электронных облака (sp3 – гибридизация),
расположенных в пространстве тетраэдрически.
Задачи
3.3.1 Покажите, какие орбитали и
как участвуют в образовании химических связей в молекулах: а) LiН; б) NH3; в) Н2О;
г) HF; д) РС13.
3.3.2 Сколько связей по обменному
механизму могут образовывать атомы: а) лития; б) бериллия; в) бора; г)
углерода; д) азота; е) фтора; ж) кремния; з) фосфора; и) хлора?
3.3.3 По каким механизмам могут
образовывать химические связи атомы следующих элементов: а) кислорода; б)
фтора; в) калия; г) кальция; д) алюминия; е) кремния; ж) фосфора?
3.3.4 Определите все валентные
состояния атомов марганца и вольфрама.
3.3.5 Как влияет размер атомов на
длину и энергию образующейся между ними связи?
3.3.6 Почему использование
гибридных орбиталей предпочтительнее, чем обычных (негибридизированных)
орбиталей при образовании химических связей?
3.3.7 Молекула хлорида бора BCl3 имеет плоскую структуру, а
хлорида азота NCl ― пирамидальную. Чем
объясняется такое различие?
3.3.8 В молекулах CH4, NH3, Н2О валентные орбитали атомов С, N и О находятся в состоянии sp3 – гибридизации, однако углы между ними не равны: в СН4 109,3°,
в NH3 107,3° и в Н2О
105°. Как это объяснить?
3.3.9 Каково взаимное
расположение электронных облаков при sp2 – гибридизации?
Приведите примеры соединений с таким типом гибридизации. Какова
пространственная структура молекул этих веществ?
3.3.10 К каким атомам смещены
связывающие электронные облака в следующих молекулах: а) НС1; б) NaH; в) ВеО; г) C1F; д) MgS; ж) ВВг3;
з) СО2; и) А1С13?
3.3.11
Рассчитайте эффективные заряды на атомах следующих молекул: a) BrCl; б) BrF; в) C1F; г) НС1; д) НВг; е) НI; ж) LiBr; з) LiF; и) NaCl.
3.3.12 Как и какие свойства
молекул и сложных ионов изменяются при удалении электрона: а) со связывающей
МО; б) с разрыхляющей МО?
3.3.13 Как изменяются кратность и
энергия связей в ряду молекул: а) В2, С2, N2; б) N2, O2, F2; в ряду молекулярных
ионов: в) В![]() , С
, С![]() , N
, N![]() ; г) N
; г) N![]() , О
, О![]() , F
, F![]() ?
?
3.3.14 Сравните кратность и
энергию связей в ряду частиц: О2, О![]() , О
, О![]() .
.
3.3.15 Составьте энергетическую
диаграмму МО частиц NO+, NO и NO– и сравните их
кратность и энергию связей.
3.3.16 Сравните кратность,
энергию связей и магнитные свойства частиц СО+, СО и СО–.
3.3.17 Составьте энергетическую
диаграмму АО и МО молекулы LiH. Какие орбитали
в ней являются связывающими, а какие – несвязывающими?
3.3.18 При каких условиях
образуются δ- и π-связи?
3.3.19 Какая связь называется
водородной? Между молекулами каких веществ она образуется?
3.3.20 Какой тип связи
формируется в галогенидах щелочных металлов?
3.4 Химическая кинетика
Пример 1. Вычислите во сколько раз
увеличится скорость реакции, протекающей в газовой фазе, при повышении
температуры от 40° до 80°С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости
химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа
по формуле
![]() =
= ![]() ·
· ![]() ;
;
![]() =
= ![]() ·2(80-
40)/10 =
·2(80-
40)/10 = ![]() ·24
= 16·
·24
= 16·![]() .
.
Следовательно, скорость реакции ![]() ,
протекающей при 80°С, увеличилась по сравнению
со скоростью реакции
,
протекающей при 80°С, увеличилась по сравнению
со скоростью реакции ![]() ,
протекающей при 40°С, в 16 раз.
,
протекающей при 40°С, в 16 раз.
Пример 2. Как сместится равновесие в
системе N2 + 3H2 ![]() 2NH3, если увеличить давление?
2NH3, если увеличить давление?
Решение. В соответствии с принципом
Ле-Шателье увеличение внешнего давления вызовет такие изменения, которые
приведут к уменьшению давления в системе. Так как из 4 моль газа (из четырех
объемов) образуется 2 моль (два объема аммиака), то равновесие сместится
вправо.
Задачи
3.4.1 Во сколько раз следует увеличить
концентрацию водорода в системе N2 + 3H2 ![]() 2NH3, чтобы скорость реакции
возросла в 100 раз?
2NH3, чтобы скорость реакции
возросла в 100 раз?
3.4.2 Во сколько раз увеличится константа
скорости химической реакции при повышении температуры на 40°С, если γ = 3,2?
3.4.3 Вычислите γ реакции, если
константа скорости ее при 120°С составляет
5,88·10–4, а при 170°С равна 6,7·10–2.
3.4.4 При повышении температуры на 50°С скорость реакции возросла в 1200 раз. Вычислите
γ.
3.4.5 Что называется скоростью химической
реакции? В каких единицах она измеряется? Почему при повышении концентрации
реагирующих веществ скорость реакции увеличивается? Почему увеличивается
скорость реакции при повышении температуры?
3.4.6 Рассчитайте энергию активации реакции,
если при увеличении температуры от 500 до 1000 К константа скорости реакции
возросла в 100 раз.
3.4.7 При синтезе аммиака при некоторых
условиях в равновесии находятся 0,1 моль/л N2, 0,2 моль/л Н2 и
0,8 моль/л NH3. Вычислите константу равновесия и рассчитайте
исходные концентрации азота и водорода.
3.4.8 Исходная смесь состоит из 0,30 моль/л Н2
и 0,20 моль/л N2. Равновесие наступит, когда прореагирует 0,24
моль/л Н2. Вычислите константу равновесия, если уравнение химической
реакции N2(г) + 3H2(г) ![]() 2NH3(г).
2NH3(г).
3.4.9 В каком направлении сместится
равновесие системы N2 + 3H2 ![]() 2NH3; ∆Н° = –92 кДж/моль при понижении температуры? Как
объяснить, что на практике синтез аммиака ведут при повышенной температуре (не
ниже 400–500°С)?
2NH3; ∆Н° = –92 кДж/моль при понижении температуры? Как
объяснить, что на практике синтез аммиака ведут при повышенной температуре (не
ниже 400–500°С)?
3.4.10 В каком направлении сместится
равновесие системы 3Fe + 4H2O ![]() Fe3O4 + 4H2, если: а) увеличить
концентрацию водорода; б) уменьшить концентрацию паров воды?
Fe3O4 + 4H2, если: а) увеличить
концентрацию водорода; б) уменьшить концентрацию паров воды?
3.4.11 Во сколько раз увеличится скорость
реакции C + O2 = CO2 при увеличении концентрации
кислорода в три раза?
3.4.12 Что такое молекулярность и порядок
химических реакций? Приведите примеры реакций первого и второго порядка.
3.4.13 Выведите уравнение константы
химического равновесия для реакции MgO(к) + CO2(г) ![]() MgCO3(к), ∆Н < 0. Какими
способами можно сместить химическое равновесие этой реакции влево?
MgCO3(к), ∆Н < 0. Какими
способами можно сместить химическое равновесие этой реакции влево?
3.4.14 Реакция между оксидом азота и хлором
протекает по уравнению 2NO + Cl2 ![]() 2NOCl. Как изменится скорость
реакции при увеличении: а) концентрации оксида азота в два раза; б)
концентрации хлора в два раза; в) концентрации обоих веществ в два раза?
2NOCl. Как изменится скорость
реакции при увеличении: а) концентрации оксида азота в два раза; б)
концентрации хлора в два раза; в) концентрации обоих веществ в два раза?
3.4.15 Скорость реакции ацетона с йодом СН3СОСН3
+ I2
![]() СН3СОСН2I + HI прямо
пропорциональна концентрации ацетона и не зависит от концентрации йода. За
какое время прореагирует 80% ацетона, если при этой же температуре концентрация
его уменьшается вдвое за 30 мин?
СН3СОСН2I + HI прямо
пропорциональна концентрации ацетона и не зависит от концентрации йода. За
какое время прореагирует 80% ацетона, если при этой же температуре концентрация
его уменьшается вдвое за 30 мин?
3.4.16 В реакции первого порядка концентрация
исходного вещества составляла 1,345 моль/л
через 5 мин после начала реакции и 1,209 моль/л через 10 мин после ее начала. Определите
константу скорости и начальную концентрацию исходного вещества.
3.4.17 Установлено, что разложение оксида
азота (IV) 2NO2(г) ![]() 2NO(г) +O2(г) является реакцией
второго порядка. Определите константу скорости, если в начальный момент времени
в реакторе находился только оксид азота (IV) с концентрацией 2 моль/л,
а через 15 мин концентрация кислорода составляла 0,5 моль/л.
2NO(г) +O2(г) является реакцией
второго порядка. Определите константу скорости, если в начальный момент времени
в реакторе находился только оксид азота (IV) с концентрацией 2 моль/л,
а через 15 мин концентрация кислорода составляла 0,5 моль/л.
3.4.18 В каком направлении произойдет
смещение равновесия при повышении температуры систем:
а) COCl2 ![]() CO + Cl2; ∆H = 113 кДж;
CO + Cl2; ∆H = 113 кДж;
б) 2СО ![]() СО2 + С; ∆Н = -171 кДж;
СО2 + С; ∆Н = -171 кДж;
в) 2SO3 ![]() 2SO2 + O2; ∆Н = 192 кДж.
2SO2 + O2; ∆Н = 192 кДж.
3.4.19 На сколько градусов следует повысить
температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз
(γ = 2,5)?
3.4.20 Рассчитайте, во сколько раз изменится
константа скорости реакции при увеличении температуры от 500 до 1000 К, если
энергия активации равна 95,5 кДж/моль.
3.5 Химическая термодинамика
Пример
1. Рассчитайте тепловой эффект реакции окисления моля оксида мышьяка
(III) озоном.
Решение. По имеющимся в
справочниках теплотам образования веществ можно рассчитать тепловой эффект для
любого написанного уравнения реакции, а если тепловой эффект реакции известен,
то можно рассчитать теплоту образования одного из веществ реакции.
Напишем уравнение реакции: As2O3(т) + 2/3O3(г) = As2O5(т)
На основании следствия из закона Гесса можно записать:
∆H![]() = ∆H
= ∆H![]() – (∆H
– (∆H![]() + 2/3 ∆H
+ 2/3 ∆H![]() ).
).
Подставив в это выражение
значения стандартных энтальпий образования веществ с учетом их агрегатных
состояний (табл.данные), получим:
∆H![]() = -925 – (-666 + 2/3 · 143) = -354 кДж/моль.
= -925 – (-666 + 2/3 · 143) = -354 кДж/моль.
Пример
2. Рассчитайте стандартную энергию Гиббса химической реакции при 298
К и установите возможность ее самопроизвольного протекания в прямом направлении
CuSO4(к) + 2NH4OH(ж) = Cu(OH)2(к) + (NH4)2SO4(к).
Величины стандартных энергий
Гиббса образования веществ даны в таблице.
Решение. Энергия Гиббса
∆G – термодинамическая функция состояния
системы. Изменение энергии Гиббса химической реакции можно рассчитать на
основании следствия из закона Гесса:
∆G![]() = ∆G
= ∆G![]() + ∆G
+ ∆G![]() – ∆G
– ∆G![]() – 2∆G
– 2∆G![]() = -359,4 – 900,3 –
= -359,4 – 900,3 –
- (-661,9) – 2 · (-254,2) = -89,4
кДж < 0.
Так как ∆G![]() < 0, процесс протекает самопроизвольно в прямом
направлении.
< 0, процесс протекает самопроизвольно в прямом
направлении.
Задачи
3.5.1 Вычислите ∆Н° реакций:
а) 2Mg + СО2
= 2MgO + С;
б) В2О3 + 3Mg = 3MgO + 2В;
в) SiO2
+ 2Mg = 2MgO + Si;
г) ZnO + С = CO + Zn;
д) MnO2
+ 2C = 2CO + Mn.
3.5.2 Вычислите ∆Н° реакций:
а) 3Fe3O4
+ 8A1 = 4A12O3 + 9Fe;
б) 4СО + 2SO2 = 4CO2 + S2(г);
в) 4FeS2
+ 11O2 = 2Fe2O3
+ 8SO2;
г) 2C12 +
2H2O(г) = 4HC1 + O2;
д) 2NH3 + 1,5O2 = N2 + ЗН2О(ж).
3.5.3 Вычислите изменение
энтропии в реакциях:
а) Н2О(ж) + О3 = Н2О2(ж)
+ О2;
б) СН4 + ЗСO2 = 4СО + 2Н2O(г);
в) С + Н2О (г) = СО + Н2;
г) Вr2(г) =
2Вr(г).
3.5.4 Вычислите ∆G° образования СН4,
С2Н4 и NH3, исходя из
значений ∆Н![]() и изменения энтропии ∆S°. Полученные величины сравните с табличными данными.
и изменения энтропии ∆S°. Полученные величины сравните с табличными данными.
3.5.5 Вычислите ∆G° следующих
реакций и определите, в каком направлении они будут протекать, если все
вещества взяты при стандартных условиях:
а) 2N2O
+ О2 = 4NO;
б) N2O
+ NO = NO2 + N2;
в) N2O + NО2 =
3NO;
г) 4HCl + O2 = 2Cl2 + 2H2O(г);
д) H2 + Se(г) = H2Se(г).
3.5.6 Какие из перечисленных
оксидов можно восстановить водородом: а) Li2О; б) СuО; в) МnО; г) РbО?
3.5.7 Теплоты растворения SrCl2 и SrCl2 · 10H2O составляют соответственно (-47,7) и 31,0 кДж/моль. Вычислите
изменение энтальпии реакции
SrCl2 + 10Н2О
= SrCl2 · 10Н2О.
3.5.8 Теплота растворения CuSO4 составляет 66,1 кДж/моль, а
теплота перевода CuSО4 в CuSO4 · 5Н2О равна -78,8
кДж/моль. Вычислите теплоту растворения CuSO4 · 5Н2О.
3.5.9 Теплота сгорания метана
∆Н![]() = -890 кДж/моль. Вычислите теплотворную
способность метана (в кДж/м3) и теплоту его образования.
= -890 кДж/моль. Вычислите теплотворную
способность метана (в кДж/м3) и теплоту его образования.
3.5.10 Сколько теплоты выделится
при сжигании 38 г сероуглерода?
3.5.11 Вычислите теплоту перехода
графита в алмаз, если при образовании моля СО2 из графита выделяется
393,5 кДж/моль, а из алмаза -395,4 кДж/моль.
3.5.12 Исходя из теплот реакций окисления As2O3 кислородом и озоном
As2O3 + О2 = As2O5; ∆Н° = -271 кДж/моль,
As2O3 + 2/з О3 = As2O5;
∆Н° = -365 кДж/моль,
вычислите теплоту образования озона из молекулярного
кислорода.
3.5.13 Исходя из теплоты
образования воды (ж) и теплового эффекта реакции Н2O2
= Н2О(ж) + 1/2O2; ∆Н° = -98,3 кДж/моль, вычислите теплоту
образования Н2О2.
3.5.14 Энергии
диссоциации Н2 и С12 соответственно составляют 436 и 243
кДж/моль. Вычислите атомарную теплоту образования НС1 и энергию связи НС1.
3.5.15 Вычислите теплоту
образования С3Н8, если известно, что при сгорании 11 г
его выделилось 552 кДж.
3.5.16 Исходя из теплот
диссоциации Н2 и О2, равных соответственно 436 и 495
кДж/моль, вычислите атомарную теплоту образования воды (г) и среднюю энергию
связи Н — О.
3.5.17 Вычислите теплоту сгорания
этилена С2Н4, если известно, что теплота его образования
52,3 кДж/моль. Каков тепловой эффект сгорания 10 л С2Н4
(27°С и 98,64 кПа)?
3.5.18 Вычислите теплоту
образования карбида кальция СаС2, исходя из теплового эффекта
реакции СаО + ЗС = СаС2 + СО; ∆Н° = 460 кДж/моль.
3.5.19 При сгорании одного литра
ацетилена (0°С и 101,3 кПа) выделяется 58,2 кДж. Вычислите ∆Н![]() ацетилена.
ацетилена.
3.5.20 Теплоты сгорания этана С2Н6
и этилена С2Н4 соответственно составляют (-1560) и -1411
кДж/моль. Вычислите ∆Н° реакции
гидрирования этилена С2Н4 + Н2 = С2Н6.
3.6 Растворы
![]()
Пример
1. 500 мл раствора содержат 196 г серной кислоты. Рассчитайте
молярную и эквивалентную концентрации, а также титр раствора.
Решение. 1) Молярная
концентрация раствора рассчитывается по формуле ![]() .
.
Молярная масса серной кислоты ![]() = 98 г/моль.
= 98 г/моль.
Тогда ![]() 4 моль/л.
4 моль/л.
2) Эквивалентная концентрация раствора рассчитывается по формуле
![]() .
.
Молярная масса
эквивалента серной кислоты ![]() =
=![]() = 49 г/моль.
= 49 г/моль.
![]() =
= ![]() = 8 моль/л.
= 8 моль/л.
3) Титр раствора рассчитывается
по формуле Т = ![]() =
= ![]() = 0,392 г/мл.
= 0,392 г/мл.
Ответ: ![]() 4 моль/л,
4 моль/л, ![]() 8 моль/л, Т = 0,392
г/мл.
8 моль/л, Т = 0,392
г/мл.
Пример
2. Вычислите рН раствора NaOH с молярной
концентрацией ![]() = 0,05 моль/л.
= 0,05 моль/л.
Решение. Для расчета рН
растворов оснований применяется формула
![]() , где
, где ![]() ,
, ![]() .
.
Для нахождения коэффициента активности нужно вычислить ионную силу
раствора NaOH. Так как при диссоциации из 0,05
моль/л NaOH
получается 0,05 моль/л ионов Na+ и 0,05 моль/л
ионов ОН–,
![]() .
.
Из таблицы берется значение
коэффициента активности ![]() при
при ![]() для однозарядных
ионов:
для однозарядных
ионов: ![]() = 0,85.
= 0,85.
Отсюда ![]() .
.
Тогда ![]()
Ответ: ![]()
Задачи
3.6.1 Сколько граммов вещества
следует взять для приготовления: а) 2 л
раствора карбоната калия с Сэ = 0,06 моль/л; б) 0,8л раствора нитрата серебра с Сэ
= 0,025 моль/л; с) 150 мл раствора
бромида бария с Сэ = 0,4 моль/л; д) 300 мл раствора сульфита калия с
См = 2 моль/л; е) 3 л раствора хлорида железа (III) с См = 5 моль/л?
3.6.2 Сколько граммов
растворенного вещества содержит 1л следующих растворов: а) серной кислоты с Сэ
= 0,2 моль/л; б) сульфата магния с Сэ = 0,5 моль/л; с) хлорида
алюминия с Сэ = 0,015 моль/л; д) сульфата алюминия с Сэ =
1,5 моль/л; е) сульфида цинка с Сэ = 0,33 моль/л?
3.6.3 Сколько миллилитров
40%-ного раствора Н3РО4 (ρ = 1,25 г/мл) требуется
для приготовления: а) 400 мл раствора Н3РО4 с См
= 0,25 моль/л; б) 3 л раствора Н3РО4 с См=
0,15 моль/л?
3.6.4 Вычислите молярную и
нормальную концентрации следующих растворов, насыщенных при 20°С: а)
17,2%-ного раствора NH4C1 (ρ = 1,075 г/мл); б) 16,9%-ного раствора Ва(ОН)2
∙ 8Н2О (ρ = 1,04 г/мл); с) 61,4%-ного раствора MgSO4 ∙ 7Н2О (ρ
= 1,31 г/мл); д) 5,67%-ного раствора KA1(SO4)2 (ρ = 1,053 г/мл); е)
2,6%-ного раствора Na2B4О7 (ρ = 1,02г/мл).
3.6.5 Вычислите массовую долю
растворенного вещества в следующих растворах: а) H2SO4 с Сэ
= 10 моль/л (ρ = 1,29 г/мл); б) НС1 с Сэ = 5,75
моль/л (ρ = 1,13 г/мл); с) HNO3 с См
= 3,65 моль/л (ρ = 1,16 г/мл); д) CsОН с См = 5,75 моль/л (ρ = 1,35г/мл);
е) NH3 с См = 12,3 моль/л
(ρ = 0,90 г/мл).
3.6.6 Сколько граммов ВаС12
∙ 2Н2О требуется для взаимодействия с 750 мл раствора H2SO4 с
Сэ = 1,12 моль/л?
3.6.7 Сколько граммов раствора,
содержащего 8% алюмокалиевых квасцов КА1(SO4)2 ∙ 12Н2О, необходимо для
реакции с 800 мл раствора ВаС12 с Сэ = 0,8 моль/л?
3.6.8 Сколько литров раствора Н3РО4
с Сэ = 0,04 моль/л способно прореагировать с 250 г 4%-ного раствора NaOH с образованием дигидроортофосфата натрия?
3.6.9 Вычислите эквивалентную,
молярную и моляльную концентрации, а также титр 42%-ного раствора H3PO4, плотность
которого равна 1,22 г/мл. Сколько граммов кислоты содержится в 4 л этого
раствора?
3.6.10 Рассчитайте рН: а) 0,6%
раствора гидроксида калия; б) 0,16% раствора гидроксида цезия.
3.6.11 Рассчитайте активность
ионов водорода в растворе, рН которого равен 4,2.
3.6.12 Рассчитайте степень
диссоциации в 0,0005 молярном растворе гидроксида аммония.
3.6.13 Рассчитайте ионную силу
раствора, содержащего в 1 л 0,02 моль нитрата бария и 0,02 моль хлорида натрия.
3.6.14 При какой молярной
концентрации H2SO3 недиссоциированными остаются: а)
50% молекул кислоты; б) 75% молекул кислоты?
3.6.15 Как изменится степень
диссоциации муравьиной кислоты, если ее 0,1 молярный раствор разбавить в 100
раз?
3.6.16 Степень диссоциации
раствора уксусной кислоты с Сэ = 0,1 моль/л равна 1,34%, а с Сэ
= 0,01 моль/л -4,25 %. В 1 л какого раствора содержится больше ионов водорода?
3.6.17 Константа диссоциации
синильной кислоты равна 7∙10–10. Вычислить степень диссоциации
кислоты, концентрацию ионов водорода и рН раствора кислоты с См =
0,05 моль/л.
3.6.18 Рассчитайте молярную
концентрацию раствора серной кислоты, если известно значение рОН: а) 11,62; б)
11,96; с) 11,87; д) 12,16; е) 12,07.
3.6.19 Определите рН следующих растворов щелочи МеОН: а) 0,0074
моль/л; б) 0,0029 моль/л; с) 0,0018 моль/л; д) 0,0055 моль/л; е) 0,0041 моль/л.
3.6.20 Вычислите ионную силу и
активность ионов в 1% растворе сульфата натрия.
3.7
Гидролиз солей
Пример
1. Опишите в молекулярно-ионной форме процесс гидролиза сульфида
натрия.
Решение. Гидролиз
сульфида натрия идет по 2 ступеням.
1 ступень: Na2S + H2O = NaHS + NaOH (молекулярная
форма),
2Na+ + S2– + H2O = Na+ + HS–
+ Na+ + OH– (ионная
форма),
S2– + H2O = HS– + OH–
(сокращенная ионная форма), рН > 7.
2 ступень: NaHS + H2O = Н2S + NaOH (молекулярная
форма),
Na+ + HS– + H2O = Н2S + Na+ + OH–
(ионная форма),
HS– + H2O = Н2S + OH–
(сокращенная ионная форма), рН > 7.
Пример
2. Рассчитайте константу и степень гидролиза раствора хлорида
аммония с См = 0,02 моль/л.
Решение. Запишем реакцию
гидролиза в молекулярной форме:
NH4Cl + H2O = NH4OH + HCl.
Из справочника найдем значение константы
диссоциации образующегося слабого
электролита: Кд(NH4OH) = 1,8·10–5.
Тогда константа гидролиза ![]() .
.
Степень гидролиза ![]()

![]() .
.
Ответ: ![]()
![]()
Задачи
3.7.1 Напишите уравнения
ступенчатого гидролиза раствора сульфата аммония. Рассчитайте константу и
степень гидролиза раствора, если его молярная концентрация равна 0,035 моль/л.
3.7.2 Рассчитайте степень
гидролиза и рН раствора сульфита натрия с молярной концентрацией: а) 0,001
моль/л; б) 0,025 моль/л; с) 0,1 моль/л; д) 0,5 моль/л; е) 1,0 моль/л.
3.7.3 Напишите уравнения
гидролиза в молекулярно-ионной форме, а также рассчитайте степень гидролиза и
рН раствора сульфата алюминия с См
= 10–3 моль/л.
3.7.4 Напишите уравнения
гидролиза солей NaNO2, K2CO3, FeSO4, ZnCl2 по всем возможным
ступеням. Укажите реакцию среды растворов этих солей.
3.7.5 Оцените степень гидролиза
соли K2SiO3 по 1-й ступени, если ее молярная концентрация составляет:
а) 0,1 моль/л; б) 0,001 моль/л. Сделайте вывод по полученным значениям.
3.7.6 Рассчитайте значения
константы и степени гидролиза 0,05
молярных растворов следующих солей: а) фторид аммония; б) ацетат свинца; с)
нитрат цинка. Напишите уравнения гидролиза. Укажите реакцию среды.
3.7.7 При смешивании растворов FeCl3 и Na2SO3 каждая из взятых
солей гидролизуется необратимо до конца. Выразите процесс гидролиза уравнениями
в молекулярно-ионной форме.
3.7.8 При смешивании
растворов A12(SO4)3 и К2CO3 каждая из взятых солей
гидролизуется необратимо до конца. Выразите процесс гидролиза уравнениями в
молекулярно-ионной форме.
3.7.9 Во сколько раз степень
гидролиза сульфида калия больше степени гидролиза сульфита калия в растворах
одинаковой концентрации?
3.7.10 Вычислите константу
гидролиза раствора гипохлорита калия. Укажите реакцию среды.
3.7.11 Напишите уравнения
гидролиза солей сульфата хрома и сульфита калия. Укажите реакцию среды.
3.7.12 Какие из солей Na2SO3, NaCl, Cd(NO3)2, K2CO3 при растворении в воде вызывают основную
реакцию среды?
3.7.13 Выразите процесс
совместного гидролиза уравнениями в молекулярно-ионной форме:
AlCl3 + (NH4)2S + H2O =
3.7.14 Выразите процесс
совместного гидролиза уравнениями в молекулярно-ионной форме:
Cr2(SO4)3 + (NH4)2S + H2O =
3.7.15 Выразите
процесс совместного гидролиза уравнениями в молекулярно-ионной форме:
Na2SiO3 + NH4Cl + H2O =
3.7.16 Вычислите рН и степень гидролиза в
0,03 молярном растворе нитрата цинка.
3.7.17 Вычислите рН и степень гидролиза в
0,01 молярном растворе нитрата ртути (II).
3.7.18 Составьте уравнения гидролиза солей CH3COOK, K3PO4, Na2SiO3 в молекулярно-ионной форме.
Укажите реакцию среды.
3.7.19 Оцените
степень гидролиза соли Cr2(SO4)3 по 1-й ступени, если ее молярная концентрация составляет:
а) 0,2 моль/л; б) 0,002 моль/л. Сделайте вывод по полученным значениям.
3.7.20 Напишите уравнения
ступенчатого гидролиза раствора хлорида железа. Рассчитайте константу и степень
гидролиза раствора, если его молярная концентрация равна 0,006 моль/л.
3.8 Окислительно-восстановительные реакции
Пример. Исходя из степени окисления фосфора в соединениях Н3РО4,
Н3РО3, РН3, определите, какое из них является
только окислителем, только восстановителем и какое может проявлять как
окислительные, так и восстановительные свойства.
Решение. Степень окисления фосфора в Н3РО4 максимальна и
равна (+5). Поэтому фосфорная кислота может быть только окислителем.
Степень окисления фосфора в фосфине РН3
минимальна и равна (-3). Это соединение может быть только восстановителем. В Н3РО3
фосфор проявляет промежуточную степень окисления, равную (+3), поэтому может
выполнять роль как окислителя, так и восстановителя.
Задачи
3.8.1 Закончите уравнения
реакций. Подберите коэффициенты методом электронного баланса:
а) Na2S2O3 + Br2 + NaOH →
б) Mn(NO3)2 + NaBiO3
+ HNO3 →
3.8.2 Закончите уравнения
реакций. Подберите коэффициенты методом электронного баланса:
а) S +
KClO3 + H2O →
б) HCl
+ KMnO4 →
3.8.3 Закончите уравнения
реакций. Подберите коэффициенты методом электронного баланса:
а) KBr
+ KMnO4 + H2SO4 →
б) NaI
+ NaIO3 + H2SO4 →
3.8.4 Закончите уравнения
реакций. Подберите коэффициенты методом электронного баланса и напишите
уравнения в сокращенной ионной форме:
a) K2S + KMnO4 + H2SO4
→
б) Zn +
K2Cr2O7 + H2SO4 →
3.8.5 Закончите уравнения
реакций. Подберите коэффициенты методом электронного баланса и напишите
уравнения в сокращенной ионной форме:
a)
SnSO4 + KMnO4 + H2SO4 →
б) NaI + KMnO4 + KOH →
3.8.6 Закончите уравнения
реакций. Подберите коэффициенты методом электронного баланса и напишите уравнения
в сокращенной ионной форме:
а) Cl2 + KOH →
б) Na2SO3
+ KIO3 + H2SO4 →
3.8.7 Закончите уравнения
реакций. Подберите коэффициенты в схемах реакций диспропорционирования методом электронного баланса:
а) K2MnO4
+ CO2 →
б) KClO3 →
3.8.8 Закончите уравнения
реакций. Подберите коэффициенты в схемах реакций диспропорционирования методом электронного баланса:
a)
Cr2O3 + Br2 + NaOH →
б) KClO
→
3.8.9 Закончите уравнения
реакций. Подберите коэффициенты в схемах реакций диспропорционирования методом электронного баланса:
а) S +
KOH →
б) NH3 + KMnO4 + KOH →
3.8.10 Закончите уравнения
реакций. Подберите коэффициенты, укажите восстановитель и окислитель.
Изобразите уравнения в ионной и сокращенной ионной формах:
а) Cl2 + Br2 + KOH →
б) Na2SO3 →
3.8.11 Закончите уравнения
реакций. Подберите коэффициенты, укажите восстановитель и окислитель.
Изобразите уравнения в ионной и сокращенной ионной формах:
а) Ti2(SO4)3 + KClO3 + H2O
→
б)
Fe(NO3)2 + MnO2 + HNO3 →
3.8.12 Закончите уравнения
реакций. Подберите коэффициенты, укажите восстановитель и окислитель.
Изобразите уравнения в ионной и сокращенной ионной формах:
a) KCNS + K2Cr2O7 + H2SO4 →
б) H2O2 + HIO3 →
3.8.13 Закончите уравнения
реакций. Используя метод электронного баланса, подберите коэффициенты, укажите,
в каких реакциях пероксид водорода играет роль окислителя, в каких —
восстановителя:
а) H2O2 + HI →
б) CuFeS2 + HNO3 →
3.8.14 Закончите уравнения
реакций. Используя метод электронного баланса, подберите коэффициенты, укажите,
в каких реакциях пероксид водорода играет роль окислителя, в каких —
восстановителя:
а) H2O2
+ KMnO4 + HNO3 →
б) FeSO4
+ K2Cr2O7 + H2SO4
→
3.8.15 Закончите уравнения
реакций. Составьте уравнения в сокращенной ионной форме, используя метод
полуреакций:
а) KI + KBrO3 + HCl →
б) H2O2 + CrCl3 + KOH →
3.8.16 Закончите уравнения
реакций. Составьте уравнения в сокращенной ионной форме, используя метод
полуреакций:
a)
Cr + O2 + H2SO4 →
б) Ca(ClO)2
+ Na2S + H2O →
3.8.17 Закончите уравнения
реакций. Методом полуреакций подберите коэффициенты.Напишите уравнения в
сокращенной ионной и молекулярной формах:
а) KI + KNO2 + H2SO4
→
б) Na2C2O4 + KBrO3 + H2O →
3.8.18 Закончите уравнения
реакций. Методом полуреакций подберите коэффициенты, напишите уравнения в
сокращенной ионной и молекулярной формах:
a)
KMnO4 + KNO2 + H2O →
б) AgNO3 + PH3
+ H2O →
3.8.19 Закончите уравнения
реакций. Методом полуреакций подберите коэффициенты, напишите уравнения в
сокращенной ионной и молекулярной формах:
а) K2Cr2O7
+ HCl(конц.) →
б) As2O3
+ Zn + H2SO4 → As-3 + …
3.8.20 Закончите уравнения
реакций. Методом полуреакций подберите коэффициенты, напишите уравнения в
сокращенной ионной и молекулярной формах:
а) (NH4)2SO4
+ HNO3(конц.) →
б) Hg2Cl2 + KClO4 + HCl →
3.9 Электродные потенциалы.
Электродвижущая сила гальванического элемента
Пример 1. Рассчитайте ЭДС гальванического элемента, состоящего из медного и
никелевого электродов, опущенных в растворы своих солей с концентрациями 0,01 и
0,1 моль/л соответственно. Составьте схему гальванического элемента, напишите
уравнения электродных процессов.
Решение. Находим значения стандартных электродных потенциалов из таблицы:
![]()
![]()
Рассчитаем потенциалы
электродов по уравнению Нернста:
![]()
![]()
ЭДС гальванического
элемента:
![]()
Т.к. ![]() , на медном электроде будет идти процесс восстановления, на никелевом – окисления.
, на медном электроде будет идти процесс восстановления, на никелевом – окисления.
Катод: Cu2+ ![]() Cu – восстановление
Cu – восстановление
Анод: Ni ![]() Ni2+ – окисление
Ni2+ – окисление
Схема гальванического
элемента: А Ni/Ni2+//Cu2+/Cu К
Ответ: Е = 0,0015 В.
Пример 2. Рассчитайте значение окислительно-восстановительного потенциала
электрода для системы NO![]() → NO
→ NO![]() ,
если стандартный электродный потенциал
,
если стандартный электродный потенциал ![]() , активности окисленной и восстановленной форм 0,25 и 0,025
соответственно, рН = 5.
, активности окисленной и восстановленной форм 0,25 и 0,025
соответственно, рН = 5.
Решение. Определим количество электронов, участвующих в
окислительно-восстановительной реакции:
NO![]() + 2Н+
+ 2Н+ ![]() NO
NO![]() + Н2О.
+ Н2О.
Рассчитаем
окислительно-восстановительный потенциал по уравнению Нернста
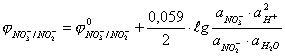 .
.
Активность воды принимается
постоянной и входит в значение ![]() , а
, а ![]()
После преобразований
уравнение примет вид

![]()
Ответ: ![]() = 0,6645 В.
= 0,6645 В.
Задачи
3.9.1 Потенциал
окислительно-восстановительного электрода
в системе FeCl3/FeCl2 равен 0,888 В, стандартный окислительно-восстановительный![]()
![]() =
0,77 В. Рассчитать процентное
соотношение концентраций окисленной и восстановленной форм при 25°С.
=
0,77 В. Рассчитать процентное
соотношение концентраций окисленной и восстановленной форм при 25°С.
3.9.2 Элемент состоит из
двух водородных электродов. Один электрод опущен в раствор с pH= 4.
Рассчитать pH и ![]() раствора у второго
электрода, если при 18°С э. д. с.
элемента составляет 0,243 В.
раствора у второго
электрода, если при 18°С э. д. с.
элемента составляет 0,243 В.
3.9.3 Элемент состоит из
двух водородных электродов. Один электрод опущен в раствор с pH 3, а
другой находится в растворе с pH 1. Рассчитать э.д.с. при
25°С.
3.9.4 Сколько электронов
участвует в окислительно-восстановительной
реакции, если ![]() = 0,169 В,
= 0,169 В, ![]() = 0,110 В и в системе окисленной формы в 10 раз
больше, чем восстановленной?
= 0,110 В и в системе окисленной формы в 10 раз
больше, чем восстановленной?
3.9.5 Вычислить стандартный
окислительно-восстановительный потенциал системы, если ![]() = –0,15 В и в системе 20% окисленной формы и 80%
восстановленной. В окислительно-восстановительной реакции принимает участие
один электрон.
= –0,15 В и в системе 20% окисленной формы и 80%
восстановленной. В окислительно-восстановительной реакции принимает участие
один электрон.
3.9.6 Рассчитайте значение
равновесного потенциала водородного электрода при р![]() = 3·10–5, рН = 3 и Т = 298 К.
= 3·10–5, рН = 3 и Т = 298 К.
3.9.7 Рассчитайте ЭДС
гальванического элемента Cd / Cd2+ // Cu2+ / Сu при 298 К и активности ионов Cd2+ и Cu2 + 0,5 и 0,05 моль/л соответственно.
3.9.8 Рассчитайте
равновесный потенциал электрода, на котором протекает реакция: PbO2 + 4H+ +2ē = Pb2+ + 2H2O, если
активность ионов Pb2+ равна 0,03 моль/л, рН = 8, Т = 298 К.
3.9.9 Рассчитайте ЭДС
серебряно-цинкового элемента при 298 К, токообразующей реакцией в котором
является AgO + Zn = Ag + ZnO. Объясните, почему
полученное значение не совпадает с напряжением этого элемента, равным 1,6 В.
3.9.10 Рассчитайте потенциал
электрода, на котором при Т = 298 К установилось равновесие: Cl2 +2ē = 2 Cl– при р![]() = 7 и
= 7 и ![]() = 10–4 моль/л.
= 10–4 моль/л.
3.9.11 Вычислите ЭДС,
составьте схему концентрационного элемента, состоящего из кобальтовых
электродов, опущенных в растворы хлорида кобальта с активностями 0,032 и 0,055
моль/л соответственно. Напишите уравнения электродных процессов.
3.9.12 Вычислите ЭДС
гальванического элемента, образованного свинцовым электродом в сочетании со
стандартным водородным электродом, если С![]() = 0,063 моль/л. Определите знак заряда свинцового электрода и напишите
уравнения электродных процессов. Как изменится ЭДС, если активность ионов
свинца уменьшить в 10 раз?
= 0,063 моль/л. Определите знак заряда свинцового электрода и напишите
уравнения электродных процессов. Как изменится ЭДС, если активность ионов
свинца уменьшить в 10 раз?
3.9.13 Составьте схему и
уравнения электродных реакций гальванического элемента, состоящего из цинкового
и водородного электродов, опущенных в растворы сульфата цинка и соляной кислоты
с концентрациями 0,042 и 0,012 моль/л соответственно. Рассчитайте ЭДС элемента
при 298 К и р![]() = 1.
= 1.
3.9.14 Составьте уравнение
для расчета окислительно-восстановительного потенциала системы PO![]()
![]() PO
PO![]() ,
если активности окисленной и восстановленной форм равны 1 и 0,1 моль/л
соответственно, рН = 3.
,
если активности окисленной и восстановленной форм равны 1 и 0,1 моль/л
соответственно, рН = 3.
3.9.15 Составьте уравнение
для расчета окислительно-восстановительного потенциала системы HNO2 ![]() NO, если активности окисленной
и восстановленной форм равны 1 и 0,01 моль/л соответственно, рН = 5.
NO, если активности окисленной
и восстановленной форм равны 1 и 0,01 моль/л соответственно, рН = 5.
3.9.16 Составьте уравнение
для расчета окислительно-восстановительного потенциала системы Cr2O![]()
![]() 2Cr3+, если активности окисленной
и восстановленной форм равны 0,035 и 0,05 моль/л соответственно, рН = 5.
2Cr3+, если активности окисленной
и восстановленной форм равны 0,035 и 0,05 моль/л соответственно, рН = 5.
3.9.17 С помощью
термодинамического расчета определите, за счет какой из реакций можно
реализовать гальванический медно-цинковый элемент с большей ЭДС. Расчет
проводите для 298 К при стандартных состояниях всех веществ:
Zn + CuO = ZnO + Cu
Zn + Cu(OH)2 = ZnO + Cu + H2O
3.9.18 По величине ЭДС
элемента Cd/CdCl2//HCl/Cl2, Pt при 298 К, равной 1,821 В,
определите активность иона Cd2+ в растворе, если активность
иона Cl– равна 1 моль/л, а ![]() = 1.
= 1.
3.9.19 Составьте схемы двух
гальванических элементов, в одном из которых кобальт является анодом, а в
другом - катодом. Напишите уравнения электродных реакций. Вычислите ЭДС
элемента при стандартных состояниях веществ.
3.9.20 Как устроен
стандартный кислородный электрод? От каких факторов зависит его потенциал?
Рассчитайте значение потенциала кислородного электрода при стандартном давлении
кислорода, рН = 4 и рН = 8.
3.10 Электролиз
Пример 1. Какие реакции будут протекать на инертных электродах при электролизе
водного раствора сульфата меди (II)?
Решение. CuSO4 = Cu2+ + SO![]() ,
,
H2O = H+ + OH–.
К отрицательно заряженному
катоду направятся катионы Сu2+ и H+, а к положительно
заряженному – анионы SO![]() и OH–. Так как потенциал меди
электроположительнее, на катоде будет идти процесс восстановления меди. На
аноде окисляются более электроположительные анионы ОН–:
и OH–. Так как потенциал меди
электроположительнее, на катоде будет идти процесс восстановления меди. На
аноде окисляются более электроположительные анионы ОН–:
Катод: Сu2+, H+ Анод: SO![]() , OH–
, OH–
Сu2+ ![]() Cu 4ОН–
Cu 4ОН– ![]() О2 + 2Н2О.
О2 + 2Н2О.
Пример 2. Сколько времени должен длиться электролиз раствора Pb(NO3)2 при силе тока
5,5 А, чтобы на катоде выделилось 3,2795 г Pb?
Решение. По закону Фарадея ![]()
![]() , F =
96500 Кл/моль.
, F =
96500 Кл/моль.
![]()
Ответ: 9 мин 15 сек.
Задачи
3.10.1 Напишите уравнения
реакций электролиза водных растворов иодида калия и сульфата натрия с инертными
электродами.
3.10.2 Какие продукты
образуются при электролизе
водных растворов следующих солей
с инертными электродами: а) АgNO3; б) ZnSO4; в) AuCl3?
3.10.3 Составьте уравнения
реакций электролиза водных растворов
следующих веществ: а) AlCl3; б) K3PO4; в) Pt(NO3)2. Электролиз
ведется с инертными электродами.
3.10.4 При электролизе
расплава хлорида калия на катоде получили
калий массой 7,8 г. Определите объем хлора, который выделился на
аноде. Объем рассчитайте при нормальных
условиях.
3.10.5 При электролизе
водного раствора нитрата серебра с инертными
электродами на аноде выделился кислород массой 12 г. Какая масса
серебра образовалась при этом?
3.10.6 Какова
продолжительность электролиза 250 мл 6%-ного раствора HgCl2 (ρ = 1,05)? Сила тока 5,8 А.
3.10.7 Через электролизер,
содержащий 10 л 7,4%-ного раствора КОН (ρ = 1,6), пропускали ток в течение
2 суток, после чего оказалось, что массовая
доля КОН в растворе составляет 8%. Какова была сила тока?
3.10.8 2,5 А тока выделили в
течение 15 мин 0,72 г меди из раствора CuSO4. Вычислите коэффициент
полезного действия тока.
3.10.9 При электролизе в
течение 30 мин раствора NaCl на аноде выделилось 2,8 л
хлора при 0°С и 101,3 кПа. Какой объем раствора CuSO4 с эквивалентной
концентрацией Сэ = 0,75 моль/л можно подвергнуть химическому
превращению при пропускании тока того же значения в течение 45 мин?
3.10.10 При
электролитическом осаждении всего железа из 200 мл раствора FeSO4 на аноде выделилось 2712 мл
кислорода. Газ был измерен при –3°С и 103,4 кПа. Вычислите молярную
концентрацию раствора FeSO4.
3.10.11 При полном электролизе 1
кг раствора сульфата железа (II) на катоде выделилось 56 г железа. Сколько граммов фосфора может вступить в
реакцию с веществом, выделившимся на аноде, и каков будет состав соли, если
полученный продукт реакции растворить в 87,24 мл 28% раствора гидроксида
натрия?
3.10.12 Напишите уравнения
электродных реакций при электролизе водного раствора Na2SO4 в электролизере с Pt –
электродами.
3.10.13 При электролизе
водного раствора AgCl с рутениевым анодом в течение 2 часов было
потрачено 0,3 А электричества.
Рассчитать массу
выделившегося на катоде вещества. Написать уравнения электродных процессов.
3.10.14 Вычислить объемы
газа (при н.у.), выделяющегося при электролизе водного раствора KNO3 с Pt – анодом, если через
раствор в течение 3 ч. был пропущен ток силой 4,5 А. Написать уравнения
электродных процессов.
3.10.15 Что такое
концентрационная поляризация и от каких факторов она зависит? Какое влияние
оказывает поляризация на процессы электролиза?
3.10.16 Составьте уравнения
реакций, происходящих на электродах при электролизе раствора и расплава
сульфата кадмия.
3.10.17 Через раствор
сульфата металла (II) пропустили 400 Кл электричества. При этом на
катоде выделилось 0,196 г металла. Выход металла по току на катоде 80%.
Определите металл и составьте уравнения реакций, протекающих на электродах: а)
для графитовых электродов; б) для металлических электродов.
3.10.18 При электролизе
раствора сульфата меди на аноде выделилось 560 мл кислорода, измеренного при
н.у. Сколько граммов меди выделилось на катоде?
3.10.19 Напишите уравнения
реакций, протекающих на электродах при электролизе водного раствора сульфата
кадмия: а) с графитовым анодом; б) с кадмиевым анодом. Если через раствор
пропускать ток силой 134 А в течение
2 ч, то как изменится количество кадмия в растворе в
обоих случаях, если выход по току кадмия на катоде равен 80%, а на аноде –
100%?
3.10.20 При электролизе
раствора бромида меди (II) (нерастворимые электроды)
на одном из электродов выделилось 0,635 г меди. Сколько граммов брома выделилось
на другом электроде, если выход по току брома 90%? Составьте уравнения реакций,
протекающих на электродах.
3.11 Коррозия металлов
Пример. Составьте уравнения электродных процессов (катодного и анодного),
происходящих при атмосферной коррозии: а) оцинкованного железа; б) луженного железа.
Решение. Коррозии подвержен металл, имеющий более электроотрицательный
потенциал.
Сравним значения стандартных
электродных потенциалов (табличные данные):
а) ![]() <
< ![]() .
.
Корродировать будет цинк (на
аноде), а железо будет защищено от коррозии атмосферным кислородом (на катоде):
Анод: Zn ![]() Zn2+ – окисление
Zn2+ – окисление
Катод: О2 + 2Н2О ![]() 4ОН– – восстановление
4ОН– – восстановление
б) ![]() >
> ![]() .
.
Анод: Fe ![]() Fe2+ – окисление
Fe2+ – окисление
Катод: О2 + 2Н2О ![]() 4ОН– – восстановление
4ОН– – восстановление
Корродирует (растворяется)
железо, олово защищено от коррозии.
Задачи
3.11.1 Изделие из железа с
алюминиевым покрытием поместили в раствор хлорида алюминия с молярной
концентрацией См = 0,05 моль/л. Будет ли протекать коррозия этого
изделия при комнатной температуре? Будет ли изменяться ЭДС и как, если
концентрация раствора возрастет до 0,08 моль/л?
3.11.2 Какой металл будет
разрушаться при коррозии, протекающей на поврежденной поверхности железа: а)
никелированного; б) луженого; с) оцинкованного? Рассмотрите подробно механизм
коррозии во всех этих случаях.
3.11.3 Как происходит атмосферная
коррозия луженого железа и луженой меди при нарушении покрытия? Составьте
электронные уравнения анодного и катодного процессов.
3.11.4 Какие процессы происходят
при ржавлении железа? Рассмотрите электрохимический механизм коррозии железа.
3.11.5 Механизм защиты металлов от коррозии. Приведите пример защиты магния от коррозии в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
3.11.6 Если на стальной предмет
нанести каплю воды, то коррозии подвергнется средняя, а не внешняя часть
смоченного металла. После высыхания капли в ее центре появляется пятно
ржавчины. Чем это можно объяснить? Какой участок металла, находящегося под
каплей воды, является анодным и какой катодным?
3.11.7 Если гвоздь вбить во влажное
дерево, то ржавчиной покроется та его часть, которая находится внутри дерева.
Чем это можно объяснить? Анодом или катодом является эта часть гвоздя?
Составьте электронные уравнения соответствующих процессов.
3.11.8 Почему включение инородных
металлов влияет на скорость коррозии и как? Приведите пример.
3.11.9 Составьте электронные
уравнения анодного и катодного процессов, происходящих при коррозии технического
железа во влажном воздухе и в сильнокислой среде. Почему химически чистое
железо является более стойким к коррозии, чем техническое железо?
3.11.10 Что такое катодное и
анодное покрытия металла? Приведите примеры металлов, которые могут служить для
анодного и катодного покрытия железа. Составьте электронные уравнения анодного
и катодного процессов, происходящих при коррозии железа, покрытого медью, во
влажном воздухе и в сильнокислой среде.
3.11.11 Кобальтовое изделие
покрыли оловом. Какое это покрытие – анодное или катодное? Почему? Составьте
электронные уравнения анодного и катодного процессов коррозии этого изделия
при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты
коррозии образуются в первом и во втором случаях?
3.11.12 Железное изделие покрыли
свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте
электронные уравнения анодного и катодного процессов коррозии этого изделия
при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты
коррозии образуются в первом и во втором случаях?
3.11.13 Две железные пластинки,
частично покрытые одна оловом, другая кадмием, находятся во влажном воздухе.
Какая из этих пластинок подвергнется коррозии раньше и почему? Составьте
электронные уравнения анодного и катодного процессов. Каков состав продуктов
коррозии железа?
3.11.14 В обычных условиях во
влажном воздухе оцинкованное железо при нарушении покрытия не ржавеет, тогда
как при температуре выше 70° оно покрывается ржавчиной. Чем это можно
объяснить? Составьте электронные уравнения анодного и катодного процессов
коррозии оцинкованного железа в первом и во втором случаях.
3.11.15 Определите
термодинамическую возможность газовой коррозии изделия из кадмия до оксида
кадмия под действием кислорода с относительным давлением ![]() и температуре 650 К.
Определите парциальное давление кислорода, при котором прекращается газовая
коррозия при указанной температуре.
и температуре 650 К.
Определите парциальное давление кислорода, при котором прекращается газовая
коррозия при указанной температуре.
3.11.16 Опишите механизм
химической коррозии в газах.
3.11.17 В раствор соляной кислоты
поместили цинковую пластину, частично покрытую медью. В каком случае процесс
коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные
уравнения соответствующих процессов.
3.11.18 Магний и
его сплавы применяются в качестве протекторов для защиты от коррозии.
Перечислите металлы, которые можно защитить от коррозии с помощью магниевых
протекторов.
3.11.19 Кадмий корродирует в
морской воде (рН = 8) при контакте с воздухом. Напишите уравнения реакций
анодного и катодного процессов.
3.11.20 Какие из металлов (Mn, Pd, Fe)
могут быть окислены кислородом в водном растворе при стандартных состояниях
всех веществ, рН = 5 и 298 К?
4 Теоретические вопросы
4.1 Основные понятия химии:
атом, молекула, атомная и молекулярная массы, простое и сложное вещество,
химический эквивалент. Моль.
4.2 Основные законы химии.
4.3 Основные классы неорганических
веществ: кислоты, соли, основания, оксиды.
4.4 Периодический закон и
периодическая система элементов Д.И.Менделеева, ее структура.
4.5 Основные этапы развития
представлений о строении атома и ядра.
Квантово-механическая модель атома.
4.6 Квантовые числа. Понятие
об электронном облаке.
4.7 Порядок заполнения
орбиталей электронами. Емкость энергетических уровней и подуровней. Принцип минимума энергии. Принцип Паули.
Правило Хунда. Правило Клечковского.
4.8 Строение электронных
оболочек атомов и связь периодической системы со строением атомов.
4.9 Энергия ионизации,
энергия сродства к электрону, электроотрицательность. Ионизационный потенциал.
4.10 Природа химической
связи. Теория валентности. Понятие о степени окисления.
4.11 Виды химической связи:
ковалентная, ионная, металлическая, водородная.
4.12 π и
σ-связи. Длина связи, энергия связи.
4.13 Донорно-акцепторный
механизм образования ковалентной связи.
4.14
Окислительно-восстановительные реакции. Основные виды
окислительно-восстановительных реакций. Типичные окислители и восстановители.
Электронный и ионно-электронный баланс.
4.15 Растворы, определение,
классификация. Понятие о концентрации растворов, способы ее выражения.
4.16 Сильные и слабые
электролиты. Теория электролитической диссоциации. Степень и константа
электролитической диссоциации. Закон разведения Оствальда.
4.17 Вода. Ионное
произведение воды. Водородный показатель среды.
4.18 Активность, коэффициент
активности. Ионная сила растворов. Связь между коэффициентом активности и ионной
силой раствора.
4.19 Гидролиз солей. Степень
и константа гидролиза.
4.20 I и II
законы термодинамики. Энтальпия, энтропия, свободная энергия Гиббса. Закон
Гесса и следствие из него. Понятие о стандартном состоянии и стандартных
теплотах образования. Вычисление тепловых эффектов химических реакций.
4.21 Критерий направления
процесса. Влияние энтальпийного и энтропийного факторов на направление
процесса. Константа химического равновесия. Связь константы химического
равновесия с величиной изменения свободной энергии Гиббса.
4.22 Скорость химической
реакции. Влияние температуры на скорость химической реакции. Правило
Вант-Гоффа. Уравнение Аррениуса. Порядок и молекулярность реакций. Энергия
активации, ее физический смысл.
4.23 Влияние концентрации
реагентов на скорость химической реакции. Закон действующих масс. Константа
скорости химической реакции и ее физический смысл.
4.24 Катализ. Понятие о
гомогенном и гетерогенном катализе. Влияние катализа на скорость прямой и
обратной реакции.
4.25 Обратимость химических
реакций. Влияние концентрации, давления и температуры на химическое равновесие.
Принцип Ле-Шателье. Константа химического равновесия.
4.26 Определение и
классификация электрохимических процессов. Понятие об электродном потенциале.
Стандартный электродный потенциал. Уравнение Нернста для расчета потенциала
металлического электрода.
4.27 Гальванический элемент.
ЭДС гальванического элемента. Концентрационный элемент.
4.28 Газовые электроды.
Расчет потенциалов водородного и кислородного электродов.
4.29
Окислительно-восстановительный (Redox) потенциал.
4.30 Кинетика электродных
процессов. Концентрационная и электрохимическая поляризация.
4.31 Электролиз. Законы
Фарадея. Электролиз с растворимым и нерастворимым анодом (в расплаве и в
растворе). Выход по току. Практическое применение.
4.32 Коррозия. Основные виды
коррозии: химическая, электрохимическая, коррозия под действием блуждающих
токов. Методы защиты от коррозии. Ингибиторы коррозии.
4.33 Термодинамика и
кинетика коррозии.
4.34 Физико-химические свойства
металлов. Основные методы получения металлов.
4.35 Металлические сплавы,
твердые растворы и интерметаллические соединения.
Содержание
Введение ...…………………………………………...……………………. |
3 |
|
1
Рабочая программа курса ……………………………………………… |
4 |
|
2
Методические рекомендации по выполнению контрольной работы … |
8 |
|
3
Контрольное задание .…………………………………………………… |
11 |
|
33 |
Содержание
……………………..…………………..…………………….. 35
Св.план 2005 г., поз. 100 .
Карлыгаш Садыровна Идрисова
Айтбала Айтеновна Туманова
ХИМИЯ
Программа, методические указания и контрольные задания для студентов специальностей 050718 – Электроэнергетика, 050719 – Радиотехника, электроника и телекоммуникации заочной формы обучения
Редактор Ж.М. Сыздыкова
Подписано к печати . . . Формат 60×84 1/16
Тираж 150 экз. Бумага типографская № 1
Объем 2,3 уч.- изд. л. Заказ _ . Цена 90 тг.
Копировально-множительное бюро
Алматинского института энергетики и связи
![]() 050013,
Алматы, ул. Байтурсынова, 126
050013,
Алматы, ул. Байтурсынова, 126