Некоммерческое акционерное общество
АЛМАТИНСКИЙ УНИВЕРСИТЕТ ЭНЕРГЕТИКИ И СВЯЗИ
Кафедра промышленной теплоэнергетики
ХИМИЯ
Методические указания к выполнению лабораторных работ
(для студентов специальности 5В073100 – «Безопасность жизнедеятельности и защита окружающей среды»)
Алматы 2011
СОСТАВИТЕЛИ: К.О. Кишибаев, Г.А. Колдасова. Химия. Методические указания к выполнению лабораторных работ (для студентов специальности 5В073100 – «Безопасность жизнедеятельности и защита окружающей среды»). – Алматы: АУЭС, 2011 – 50 с.
Методические указания к выполнению лабораторных работ предназначены для бакалавров специальности 5В073100 – «Безопасность жизнедеятельности и защита окружающей среды» и подготовлены в соответствии с образовательным стандартом по курсу «Химия».
Данные методические указания включают описание основных 10 лабораторных работ. Описанию лабораторных работ предшествуют небольшие теоретические введения, а завершают их контрольные вопросы для самопроверки.
Ил. 3, табл. 7, библиогр.- 10 назв.
Рецензент: канд. хим. наук, доц. КазНУ имени аль-Фараби А. И. Ниязбаева
Печатается по плану издания НАО «Алматинского университета энергетики и связи» на 2011 г.
© НАО «Алматинский университет энергетики и связи», 2011г.
Введение
Химия – фундаментальная наука о свойствах и превращениях веществ, из которых состоит материальный мир. Химия изучает состав, строение, реакционную способность и стабильность, способы и пути превращения одних веществ в другие.
Изучение химии включает в себя лекции, самостоятельную работу студентов с учебником, выполнение лабораторных работ. Все виды занятий взаимосвязаны. Лабораторные работы способствуют развитию знаний и умений студента только тогда, когда они выполняются не механически, а после необходимой теоретической подготовки. Студент должен знать последовательность выполнения опыта, почему и как протекает химическая реакция, какие параметры процесса превращения он определяет экспериментально.
Лабораторный практикум по общей и неорганической химии имеет целью ознакомить вчерашних школьников с основными методами проведения лабораторных работ, где студенты-первокурсники своими руками должны выполнить достаточно простые химические эксперименты.
Перед началом работы в лаборатории общей и неорганической химии студенты должны обязательно изучить «Инструкцию по технике безопасности» и взять на себя обязательства неукоснительно ей следовать, о чем делается запись в «Журнале по технике безопасности».
Все лабораторные эксперименты выполняются полумикрометодом, т.е. капельными количествами реактивов, что позволяет развивать такие, безусловно, полезные качества, как наблюдательность и аккуратность.
Для облегчения усвоения материала в каждой работе приводится достаточно подробное теоретическое описание изучаемого вопроса, в конце – перечень контрольных вопросов, которые, как правило, задает преподаватель при приеме отчета по данной лабораторной работе.
Лабораторная работа №1. Основные классы неорганических соединений
Цель работы – получение и ознакомление со свойствами оксидов, кислот, оснований, амфотерных гидроксидов и солей.
1 Теоретическое введение
Неорганические соединения классифицируются как по составу, так и по свойствам (функциональным признакам). По составу они подразделяются на двухэлементные (бинарные) и многоэлементные соединения.
По функциональным признакам неорганические соединения подразделяются на классы в зависимости от характерных функций, выполняемых ими в химических реакциях. Выделяют следующие основные классы: оксиды, кислоты, основания (как частный случай гидроксидов, т. е. соединений, включающих группу ОН) и соли.
Оксиды – сложные вещества, состоящие из атомов кислорода и
другого элемента. В оксидах кислород проявляет степень окисления –2. Общая
формула оксидов: ![]() .
.
Оксиды делятся на солеобразующие и несолеобразующие. Последних довольно мало (СО, NО, N2О). Они не образуют солей ни с кислотами, ни со щелочами. Солеобразующие оксиды делятся на основные (их гидраты – основания), кислотные (их гидраты – кислоты), амфотерные (их гидраты проявляют свойства как кислот, так и оснований).
По современной номенклатуре названия этого класса строятся следующим образом: к слову «оксид» добавляется название элемента с указанием его степени окисления, если она не постоянная. Например, МgО – оксид магния; СО – оксид углерода (II); CО2 – оксид углерода (IV).
К основным оксидам относятся оксиды щелочных и щелочноземельных металлов, а также многие оксиды других металлов со степенью окисления +1, +2. Они взаимодействуют с водой с образованием оснований:
CaO + H2O = Ca(OH)2.
Основные оксиды взаимодействуют с кислотными оксидами и кислотами, образуя соли:
CaO + CO2 = CaCO3,
CaO + 2HCl = CaCl2 + H2O.
Кислотные оксиды образуют неметаллы (Cl2О, CО2, SО2, N2О5 и др.), а также металлы со степенью окисления +5, +6, +7 (V2О5, CrО3, Mn2О7).
Многие кислотные оксиды непосредственно взаимодействуют с водой, образуя кислоты:
CO2 + H2O = H2CO3,
SO3 + H2O = H2SO4.
Со щелочами кислотные оксиды образуют соль и воду:
N2O5 + 2NaOH = 2NaNO3 + H2O.
Амфотерные оксиды образуют металлы, имеющие степень окисления +2, +3, иногда +4. К амфотерным оксидам относятся, например, ВеО, ZnO, Al2O3, Cr2O3, SnO, PbO, MnO2 и др. Они характеризуются реакциями солеобразования и с кислотами, и с основаниями, так как в зависимости от условий проявляют как основные, так и кислотные свойства. Например:
Cr2O3 + 6HCl = 2CrCl3 + 3H2O,
Cr2O3 + 2NaOH = 2NaCrO2 + H2O.
Оксиды можно получить следующими способами:
непосредственно взаимодействием простого вещества с кислородом:
2Mg + O2 = 2MgO, 4P + 5O2 = 2P2O5
разложением сложных веществ:
Cu(OH)2
![]() CuO +
H2O,
CuO +
H2O,
CaCO3 ![]() CaO +
CO2,
CaO +
CO2,
2Zn(NO3)2
![]() 2ZnO + 4NO2 + O2.
2ZnO + 4NO2 + O2.
Кислоты – вещества, при электролитической диссоциации которых катионами могут быть только положительно заряженные ионы водорода Н+ (точнее, ионы гидроксония [Н3О]+):
HCl → H+ + Cl-.
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации молекулы кислоты: НCl – одноосновная кислота, H2SO4 – двухосновная, H3PO4 – трехосновная.
Кислоты можно разделить на бескислородные (HCl, HBr, HCN, H2S) и кислородсодержащие (HNO3, H2SO4, H3PO4).
Названия кислородсодержащих кислот, в которых степень окисления кислотообразующего элемента (центрального атома) равна номеру группы в периодической системе элементов Д. И. Менделеева (высшая степень окисления), образуется от названия элемента с добавлением суффикса -н (-ов или -ев) и окончания -ая. Например: HNO3 – азот-н-ая кислота, H2SiO3 – кремни-ев-ая кислота. При меньшей степени окисления центрального атома названия кислот образуются с суффиксом -ист. Например, HNO2 – азот-ист-ая кислота, H2SO3 – серн-ист-ая кислота. В зависимости от содержания молекул воды некоторые кислоты могут находиться в мета- или ортоформе. Приставка мета- означает минимальное содержание молекул воды, орто- – на одну или несколько молекул больше. Например, HPO3 – метафосфорная кислота, H3PO4 (HPO3 + H2O) – ортофосфорная кислота.
В названиях бескислородных кислот к наименованию элемента добавляют слово «водородная». Например, HCl – хлороводородная, H2S – сероводородная.
В соответствии с электролитической диссоциацией общие свойства кислот обусловлены ионами водорода H+. В растворах кислот индикаторы меняют свою окраску: лакмус становится красным, метиловый оранжевый – розовым.
Кислоты реагируют с основаниями и основными оксидами:
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O,
2HNO3 + CaO = Ca(NO3)2 + H2O.
При взаимодействии кислот с солями могут образовываться новые соль
и кислота. Реакции этого типа идут при условии образования малорастворимых, летучих или малодиссоциирующих (слабых электролитов) продуктов реакции:
2HCl + CaCO3 = CaCl2 + H2CO3,
H2SO4 + BaCl2 = BaSO4↓ + 2HCl.
Кислоты получают гидратацией кислотных оксидов:
P2O5 + 3H2O = 2H3PO4
обменной реакцией соли с кислотой:
Ca3(PO4)2 + 3H2SO4 = 3CaSO4↓ + 2H3PO4.
Основания – вещества, при электролитической диссоциации которых в качестве анионов образуются гидроксид-ионы OH-:
NaOH → Na+ + OH-.
Кислотность основания определяется числом ионов OH-, образующихся при диссоциации молекулы гидроксида. NаОН – однокислотное основание, Са(ОН)2 – двухкислотное основание, Fe(ОН)3 – трехкислотное основание.
По растворимости в воде различают:
а) основания, растворимые в воде, – щелочи, например, LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2 и др.;
б) основания, нерастворимые в воде, например, Cu(OH)2, Fe(OH)3, Cr(OH)3 и др.
Названия оснований образуются из слова «гидроксид» и названия соответствующего металла с указанием его степени окисления, если она переменная. Например, Ca(OH)2 – гидроксид кальция, Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид железа (III).
Водные растворы щелочей изменяют окраску индикаторов. В их присутствии фиолетовый лакмус синеет, бесцветный фенолфталеин становится малиновым.
Щелочи реагируют с кислотными оксидами и кислотами:
Ba(OH)2 + CO2 = BaCO3 + H2O,
2NaOH + H2SO4 = Na2SO4 + 2H2O.
При действии щелочей на растворы солей получаются новая соль и новое основание, причем одно из полученных веществ должно выпадать в осадок:
2KOH + CuSO4 = Cu(OH)2↓ + K2SO4,
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH.
С точки зрения электролитической диссоциации общие свойства щелочей обусловлены гидроксид-ионами OH-.
Нерастворимые в воде основания, так же, как и щелочи, взаимодействуют с кислотами:
Fe(OH)3↓ + 3HCl = FeCl3 + 3H2O
и разлагаются при нагревании:
2Fe(OH)3↓
![]() Fe2O3 + 3H2O.
Fe2O3 + 3H2O.
Получить щелочи можно растворением в воде соответствующих металлов и их оксидов:
2Na + 2H2O = 2NaOH + H2,
CaO + H2O = Ca(OH)2.
Общий способ получения нерастворимых в воде оснований – действие щелочей на растворимые соли металлов, основания которых нерастворимы:
2NaOH + FeSO4 = Fe(OH)2↓ + Na2SO4.
Основания являются частным случаем группы соединений с общим названием «гидроксиды». Гидроксиды – вещества, содержащие группу OH-, получаются соединением оксидов с водой. В зависимости от того, какой ион (H+ или OH-) образуется при электролитической диссоциации, гидроксиды бывают трех видов: основные (основания), кислотные (кислородсодержащие кислоты) и амфотерные (амфолиты).
Амфолиты – это гидроксиды, которые проявляют как основные, так и кислотные свойства. К ним относятся, например, Cr(OH)3, Zn(OH)2, Be(OH)2, Al(OH)3 и др.
Амфотерные гидроксиды способны реагировать как с кислотами, так и со щелочами. С кислотами они реагируют как основания, а со щелочами – как кислоты. Чтобы установить амфотерность гидроксида, следует провести две реакции взаимодействия его с кислотой и со щелочью. Если обе реакции имеют место, то гидроксид амфотерен. Например, гидроксид алюминия Al(OH)3 при взаимодействии со щелочью ведет себя как кислота H3AlO3 (ортоалюминиевая) или HAlO2 (метаалюминиевая):
Al(OH)3 + 3HCl = AlCl3 + 3H2O,
Al(OH)3 + 3NaOH = Na3AlO3 + 3H2O.
Соли – вещества, при диссоциации которых образуются катионы
металлов (или аммония NH![]() ) и
анионы кислотных остатков.
) и
анионы кислотных остатков.
Соли можно рассматривать как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или гидроксильных групп в молекуле основания кислотными остатками. В зависимости от этого соли делятся на средние, кислые и основные.
Средние соли – продукты полного замещения,
они состоят только из катионов металлов или
NH![]() и анионов кислотных остатков.
и анионов кислотных остатков.
Чтобы правильно написать формулу
какой-либо соли, следует учитывать величины зарядов катиона и аниона. Число
каждого иона должно быть таким, чтобы алгебраическая сумма зарядов была равна
нулю, т. е. соединение было электронейтральным. Например, сульфат хрома (III)
состоит из ионов Cr3+ и
SO![]() имеет состав Cr2(SO4)3,
а ортофосфат кальция, состоящий из ионов Ca2+ и
PO
имеет состав Cr2(SO4)3,
а ортофосфат кальция, состоящий из ионов Ca2+ и
PO![]() – Са3(РО4)2.
– Са3(РО4)2.
Названия солей составляют из названия аниона кислоты в именительном падеже и названия катиона в родительном падеже (хлорид натрия, карбонат кальция и т. п.). Если степень окисления катиона металла переменная, ее указывают римскими цифрами в скобках (сульфат железа (II) – FeSО4, сульфат железа (III) – Fe2(SО4)3).
Кислые соли (гидросоли) – продукты
неполного замещения ионов водорода многоосновных кислот катионами металлов. Их
образуют только многоосновные кислоты. Признак кислой соли – наличие в ее
составе незамещенных H+. Для верного
написания формул кислых солей следует рассчитать заряд аниона с учетом незамещенных
ионов H+ (НСО![]() ,
НРО
,
НРО![]() ,
H2РО
,
H2РО![]() ).
Число ионов подбирается так, чтобы соединение было электронейтральным.
Например, формула кислой соли из ионов Cr3+ и НРО
).
Число ионов подбирается так, чтобы соединение было электронейтральным.
Например, формула кислой соли из ионов Cr3+ и НРО![]() имеет состав Cr2(НРО4)3.
имеет состав Cr2(НРО4)3.
Названия кислых солей образуются добавлением к названию аниона (кислотного остатка) приставки гидро- или дигидро-, если не замещены два иона Н+, что возможно только для трехосновных кислот: Cа(НСО3)2 – гидро-карбонат кальция, Al2(НРО4)3 – гидроортофосфат алюминия, Al(Н2РО4)3 – дигидроортофосфат алюминия.
Основные соли (гидроксосоли) по составу
являются продуктами неполного замещения гидроксогрупп основания на кислотные
остатки. Их образуют только многокислотные основания. Признак гидроксосоли –
наличие в составе незамещенных ОН-. Для верного написания формул
основных солей следует рассчитать заряд катиона с учетом незамещенных групп ОН-
(СаОН+, AlOH2+, Al(OH)![]() ). Далее число ионов, как для средних и кислых солей,
подбирается так, чтобы соединение было электронейтральным. Например, формула
гидроксосоли из ионов Al(OH)
). Далее число ионов, как для средних и кислых солей,
подбирается так, чтобы соединение было электронейтральным. Например, формула
гидроксосоли из ионов Al(OH)![]() и SО
и SО![]() : (Al(OH)2)2SО4.
: (Al(OH)2)2SО4.
Названия основных солей образуются добавлением к названию катиона металла приставки гидроксо- или дигидроксо-, если незамещены две гидроксогруппы, что возможно только для трехкислотных оснований: (CuOH)2СО3 – карбонат гидроксомеди; AlOHSО4 – сульфат гидроксоалюминия, (Al(OH)2)2SО4 – сульфат дигидроксоалюминия.
Средние соли получают следующими способами:
1) металл + неметалл:
2Na + Cl2 = 2NaCl;
2) металл + кислота:
Мg + 2НCl = MgCl2 + H2;
3) металл + cоль:
Zn + CuSО4 = Cu + ZnSО4;
4) основной оксид + кислотный оксид:
СаО + СО2 = СаСО3;
5) основание + кислота:
Zn(ОН)2 + 2НNО3 = Zn(NО3)2 + 2Н2О;
6) соль + соль:
Pb(NO3)2 + Na2SO4 = PbSO4↓ + 2NaNO3;
7) основной оксид + кислота:
CuО + Н2SО4 = CuSО4 + Н2О;
8) кислотный оксид + основание:
Р2О5 + 6NaОН = 2Na3РО4 + 3Н2О;
9) щелочь + соль:
Ва(ОН)2 + К2СО3 = ВаСО3↓ + 2КОН;
10) кислота + соль:
Н2SО4 + ВаCl2 = ВаSО4↓ + 2НCl.
Кислые соли могут быть получены в кислой среде:
1) основание + кислота (избыток):
NaОН + Н3РО4 = NaН2РО4 + Н2О,
2NaОН + Н3РО4 = Na2НРО4 + Н2О;
2) средняя соль + кислота (избыток):
Na3РО4 + 2Н3РО4 = 3NaН2РО4,
2Na3РО4 + Н3РО4 = 3Na2НРО4.
Основные соли могут быть получены в щелочной среде:
1) кислота + основание (избыток):
Al(OH)3 + 2НCl = AlOHCl2 + 2Н2О,
Al(OH)3 + НCl = Al(OH)2Cl + Н2О;
2) средняя соль + щелочь:
AlCl3 + NaОН = AlOHCl2 + NaCl,
AlCl3 + 2NaОН = Al(OH)2Cl + 2NaCl.
Превращение кислых и основных солей в средние происходит следующими способами:
1) кислая соль + щелочь:
NaНSО3 + NaОН = Na2SО3 + Н2О,
Са(Н2РО4)2 + 2Са(ОН)2 = Са3(РО4)2 + 4Н2О;
2) основная соль + кислота:
(CuОН)2SО4 + Н2SО4 = 2CuSО4 + 2Н2О.
2 Экспериментальная часть
Опыт 1. Получение и исследование свойств оксида и гидроксида меди
Оксид меди (II) получается путем термического разложения карбоната гидросида меди (II). Для этого нужно собрать прибор, изображенный на рисунке 1. В пробирку 2 на 1/3 её объема насыпать порошок карбоната гидроксида меди (II), закрыть пробирку пробкой с газоотводной трубкой 3. Газоотводную трубку опустить в стакан с известковой водой 4. Нагреть пробирку 2 на пламени горелки 1.
Нагревание проводить постепенно, в направлении от верха пробирки к её дну, до тех пор, пока весь карбонат гидроксида меди (II) не превратится в черный порошок. Наблюдать конденсацию паров воды на холодных частях пробирки и пробулькивание газа через раствор известковой воды в стакане 4.
Написать уравнение реакции разложения карбоната гидроксида меди (II) и взаимодействия СО2 с известковой водой. Полученный в пробирке оксид меди (II) после охлаждения исследовать на химическую природу. Для этого в три пробирки поместить по микрошпателю порошка CuO и добавить по 10 капель: в первую пробирку дистиллированную воду, во вторую – раствор
 H2SO4, в
третью – раствор NaOH. Что наблюдается? Каждую пробирку нагреть до кипения
на газовой горелке или спиртовке. Что изменилось? Написать уравнения реакций.
Сделать вывод относительно химического характера оксида меди (II).
H2SO4, в
третью – раствор NaOH. Что наблюдается? Каждую пробирку нагреть до кипения
на газовой горелке или спиртовке. Что изменилось? Написать уравнения реакций.
Сделать вывод относительно химического характера оксида меди (II).
Гидроксид меди (II) получите следующим образом: в пробирку поместить 5 – 6 капель раствора сульфата меди (II) и добавить 5 – 6 капель щёлочи. Отметить цвет выпавшего осадка гидроксида меди (II).
Далее исследовать химическую природу Cu(OH)2. Для этого получить осадок гидроксида меди в трех пробирках. В одну пробирку добавить раствор H2SO4 (5 – 6 капель), в другую – столько же NaOH, а третью пробирку нагревать до тех пор, пока Cu(OH)2 не превратится в черный осадок. Что наблюдается в первых двух пробирках? Почему почернел осадок Cu(OH)2? Написать уравнения соответствующих реакций. Сделать вывод относительно химической природы гидроксида меди (II).
Опыт 2. Получение и свойства оксида и гидроксида алюминия
В пробирку поместить 20 капель 0,5 М раствора Al2(SO4)3 и добавить столько же 1 н. раствора NH4OH. Что наблюдается?
Содержимое разделить на три пробирки. В одну из пробирок при взбалтывании прибавить по каплям 10%-й раствор соляной кислоты до полного растворения осадка, во вторую прилить 10%-й раствор гидроксида натрия, тоже до полного растворения осадка. Написать уравнения реакций и сделать вывод о характере гидроксида алюминия.
Третью пробирку нагреть на пламени горелки до полного разложения гидроксида алюминия. Синтезированный таким образом оксид алюминия исследовать на взаимодействие с кислотой и щелочью. Для этого полученный Al2O3 разделить на три части и поместить в три пробирки. В первую добавить 5 – 8 капель 10%-го раствора HCl, по вторую – столько же 10%-го раствора гидроксида натрия (NaOH), в третью – дистиллированную воду. Что наблюдается? Пробирки нагреть. Что изменилось? Написать уравнения соответствующих реакций и сделать вывод о характере оксида алюминия.
Опыт 3. Изучение свойств оксида углерода (IV) и оксида кремния (IV)
Для изучения характера свойств диоксида углерода налить в пробирку 10 – 15 капель дистиллированной воды и прибавить 1 – 2 капли лакмуса. Затем пропустить из аппарата Киппа в воду оксид углерода (IV) до изменения окраски раствора. Почему окраска изменилась? Каков характер свойств CO2? Написать уравнение реакции.
Поместить в две пробирки по микрошпателю оксида кремния (IV). В одну пробирку добавить 5 – 7 капель концентрированной щелочи, а в другую – столько же концентрированной соляной кислоты. Обе пробирки нагреть. В какой пробирке диоксид кремния растворяется? Написать уравнение реакции. Сделать вывод.
Опыт 4. Получение основной соли и перевод её в среднюю соль
Налить в пробирку 6 капель 1 н. раствора хлорида кобальта (II) и прилить к нему 4 капли 1 н. раствора NaOH. Содержимое пробирки встряхнуть. Написать уравнение реакции и назвать полученное соединение. Далее к полученной основной соли кобальта (II) добавить 2 – 3 капли 2 н. раствора соляной кислоты. Что наблюдается? Написать уравнение реакции. С помощью каких химических реакций основные соли можно перевести в нормальные?
Опыт 5. Получение кислой соли и перевод её в среднюю соль
Налить в пробирку 10 – 15 капель насыщенного раствора гидроксида кальция (известковой воды) и пропустить в данный раствор из аппарата Киппа несколько пузырьков оксида углерода (IV). Наблюдать образование нерастворимой в воде средней (нормальной) соли – карбоната кальция. Написать уравнение реакции. Продолжить пропускать в раствор известковой воды оксид углерода (IV) из аппарата Киппа до полного растворения образовавшегося вначале карбоната кальция. Написать уравнение реакции получения кислой соли. Назвать соль.
Полученный раствор разделить на две пробирки. В одну пробирку добавить 2 капли насыщенного раствора гидроксида кальция. Отметить, что наблюдается. Раствор во второй пробирке нагреть до кипения. Наблюдать образование осадка нерастворимой соли. Написать уравнения реакций. Сделать соответствующий вывод.
Какие еще способы вы могли бы предложить для получения кислых солей и, наоборот, для перевода кислых солей в нормальные?
Опыт 6. Способы получения солей
Получить различные соли следующими способами.
1. Взаимодействие металла с кислотой. В пробирку налить 5 капель 6 н. серной кислоты и опустить алюминиевую стружку (можно микрошпатель алюминиевого порошка). Для ускорения реакции пробирку нагреть. Какой газ выделяется? Написать уравнение реакции. Назвать полученную соль.
2. Взаимодействие гидроксида с кислотным оксидом. Налить в пробирку 10 капель насыщенного раствора гидроксида кальция. Продуть в раствор через согнутую трубку воздух изо рта. Наблюдать образование белого осадка, а при дальнейшем продувании растворение его. Написать уравнения реакций образования и растворения осадка.
3. Взаимодействие соли с металлом. Поместить в пробирку 10 капель 2 н. раствора сульфата меди (II) и поместить в раствор алюминиевую стружку. Через некоторое время раствор обесцветится. Почему? Слить раствор и достать алюминий. Какого он цвета? Написать уравнение реакции и назвать полученную соль.
4. Взаимодействие соли с неметаллом. Поместить в пробирку 10 капель 2 н. раствора иодида калия и 10 капель хлорной воды. Как изменится окраска раствора? Написать уравнение реакции.
5. Взаимодействие соли с кислотой. Налить в пробирку 5 капель 2 н. раствора нитрата свинца (II) и 5 капель 2 н. раствора соляной кислоты. Что наблюдается? Написать уравнение реакции. Назвать соль.
6. Взаимодействие двух солей. Налить в пробирку 5 капель 2 н. раствора нитрата свинца (II) и 5 капель 2 н. раствора иодида калия. Наблюдать образование осадка. Написать уравнение реакции.
Добавить 10 – 15 капель дистиллированной воды. Нагреть до растворения осадка и охладить. Наблюдать образование золотых кристаллов. Назвать полученное соединение.
Опыт 7. Получение двойных солей
Налить пробирку по 10 капель насыщенных раствора сульфата аммония и сульфата железа (II). Наблюдать выпадение осадка двойной соли (NH4)2Fe(SO4)2·6H2O. Если осадок не появляется, то добиться этого потиранием стеклянной палочкой внутренней стенки пробирки. Написать уравнение реакции и назвать соль.
3 Контрольные вопросы
1. На какие основные классы подразделяются неорганические соединения?
2. Что называется оксидом? Назовите типы оксидов и дайте характеристику каждого из них, способы их получения.
3. Что называется кислотой? Что такое основность кислоты? Укажите свойства кислот и способы их получения.
4. Что называется основанием? Что такое кислотность основания? Укажите свойства оснований и способы их получения.
5. Какие соединения называют гидроксидами? Назовите типы гидроксидов.
6. Какие металлы образуют амфотерные гидроксиды? Укажите свойства амфотерных гидроксидов.
7. Что называется солью? Охарактеризуйте средние, кислые (гидро-) соли и основные (гидроксо-) соли.
8. Укажите способы получения средних солей.
9. Укажите способы получения гидро- и гидроксосолей, взаимные переходы различных типов солей.
Лабораторная работа №2. Определение эквивалентных масс простых и сложных веществ
Цель работы – знакомство с некоторыми экспериментальными методами определения эквивалентных масс металла, сложного вещества. Использование полученных экспериментальных данных для вычисления эквивалентных масс простых и сложных веществ.
1 Теоретическое введение
Эквивалент, как и моль, относится к основным понятиям химии.
Эквивалентом
называют реальную или условную частицу вещества, которая может замещать,
присоединять, высвобождать один ион водорода в кислотно-основных или
ионообменных реакциях или один электрон в окислительно-восстановительных
процессах. Количество эквивалентное вещества обозначают ![]() .
.
Масса одного моля эквивалентов называется молярной
массой эквивалента (эквивалентной массой), обозначается ![]() и измеряется в граммах на моль:
и измеряется в граммах на моль:
![]() .
.
В общем случае эквивалентная масса (![]() ) определяется отношением молярной
массой (М) к фактору эквивалентности (
) определяется отношением молярной
массой (М) к фактору эквивалентности (![]() ):
):
![]() .
.
Для газообразных веществ существует также и молярный
объём эквивалента (эквивалентный объём) ![]() , который
определяется как отношение молярного объёма газа
, который
определяется как отношение молярного объёма газа ![]() к фактору
эквивалентности вещества:
к фактору
эквивалентности вещества:
![]() .
.
Физический смысл эквивалентного объёма в том, что он показывает объём, занимаемый одним молем эквивалентов газообразного вещества.
Фактор эквивалентности веществ зависит от характера реакции, в которой данное вещество принимает участие.
Например, углерод с кислородом может образовывать два оксида:
1. 2С + О2 = 2СО;
2. С + О2 = СО2.
В первом случае ![]() углерода будет
равен двум и эквивалентная масса составит
углерода будет
равен двум и эквивалентная масса составит ![]() г/моль, а во втором
случае
г/моль, а во втором
случае ![]() и эквивалентная масса углерода
будет иметь значение
и эквивалентная масса углерода
будет иметь значение ![]() г/моль. Фактор эквивалентности
кислорода в каждом из приведённых примеров составит
г/моль. Фактор эквивалентности
кислорода в каждом из приведённых примеров составит ![]() и
и ![]() г/моль.
г/моль.
Фактор эквивалентности сложных соединений определяется следующим образом:
а) фактор эквивалентности кислоты
определяется её основностью, т.е. числом атомов водорода в молекуле кислоты.
Например: ![]() ,
а
,
а ![]() г/моль;
г/моль;
б) фактор эквивалентности основания
определяется валентностью металла ![]() , образующего основание, или числом
гидроксогрупп
, образующего основание, или числом
гидроксогрупп ![]() .
Например:
.
Например: ![]() и
и
![]() г/моль;
г/моль;
в) фактор эквивалентности соли
определяется произведением валентности металла ![]() на число его атомов в молекуле
на число его атомов в молекуле ![]() :
:
![]() .
.
Например: ![]() и
и ![]() г/моль.
г/моль.
Эквивалентную массу оксида
![]() можно определить по
сумме эквивалентных масс элемента (
можно определить по
сумме эквивалентных масс элемента (![]() ) и кислорода (
) и кислорода (![]() ):
):
![]() .
.
Например, эквивалентная масса СО2 будет равна сумме эквивалентных масс углерода и кислорода:
![]() г/моль.
г/моль.
Закон эквивалентов: вещества в химических реакциях взаимодействуют друг с другом и образуются в результате реакции в эквивалентных количествах. Математически закон эквивалентов выражается следующим образом:
![]() ,
,
где ![]() и
и
![]() - массы
реагирующих веществ, г;
- массы
реагирующих веществ, г;
![]() и
и
![]() -
эквивалентные массы реагирующих веществ, г/моль.
-
эквивалентные массы реагирующих веществ, г/моль.
Учитывая, что отношение массы вещества к
его эквивалентной массе (![]() ) есть число эквивалентов (
) есть число эквивалентов (![]() ), можно представить
закон эквивалентов следующим образом: количества эквивалентов всех реагирующих
веществ и продуктов реакции равны между собой. Например, для реакции
), можно представить
закон эквивалентов следующим образом: количества эквивалентов всех реагирующих
веществ и продуктов реакции равны между собой. Например, для реакции
NaOH + HCl =NaCl + H2O
можно записать: ![]() .
.
Если в реакциях участвуют газы, их эквиваленты можно выражать при помощи эквивалентных объемов. В этом случае закон эквивалентов может быть записан так:
 ,
,
где ![]() и
и ![]() - объемы реальных газов, взятых при
нормальных условиях, л;
- объемы реальных газов, взятых при
нормальных условиях, л;
![]() и
и ![]() - эквивалентные объемы этих газов,
л/моль.
- эквивалентные объемы этих газов,
л/моль.
Нормальные условия (н.у.):
![]() = 760 мм рт. ст. = 101,3 кПа = 1 атм,
= 760 мм рт. ст. = 101,3 кПа = 1 атм, ![]() = 273 К.
= 273 К.
Если одно из реагирующих веществ находится в твердом состоянии, а второе в газообразном, то закон эквивалентов можно выразить формулой:
![]() ,
,
где ![]() -
масса твердого вещества,
-
масса твердого вещества, ![]() - его эквивалентная масса;
- его эквивалентная масса;
![]() -
объём газа при нормальных условиях,
-
объём газа при нормальных условиях, ![]() - его эквивалентный объём.
- его эквивалентный объём.
2 Экспериментальная часть
Опыт 1. Определение эквивалентной массы металла
Собрать установку, показанную на рисунке 2. На штативе 3 укрепить две бюретки 2 и 5, соединенные между собой резиновой трубкой 1.
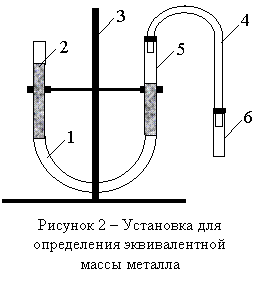 Бюретки
заполнить наполовину водой. К бюретке 5 подсоединить через резиновую трубку 4
реакционную пробирку 6. Проверить герметичность прибора. Для этого приподнять
вверх бюретку 2. Вода в обеих бюретках должна держаться на полученных уровнях.
Бюретки
заполнить наполовину водой. К бюретке 5 подсоединить через резиновую трубку 4
реакционную пробирку 6. Проверить герметичность прибора. Для этого приподнять
вверх бюретку 2. Вода в обеих бюретках должна держаться на полученных уровнях.
Получить у лаборанта навеску металла. Массу металла занести в таблицу 1. Отмерить в вытяжном шкафу 4 – 5 мл 18%-й HCl при помощи цилиндра и перенести кислоту в реакционную пробирку 6.
Приподнять бюретку 2 и установить уровень воды в бюретке 5 на нулевой отметке. Открыть реакционную пробирку 6, опустить в нее полученный металл и быстро закрыть пробирку 6 пробкой. Попав в кислоту, металл начинает с ней реагировать. Выделившийся водород по резиновой трубке 4 попадает в бюретку 5 и вытесняет воду. Уровень воды в бюретке 5 понижается. По объему вытесненной воды судят об объеме выделившегося водорода.
Таблица 1
|
Параметры |
Обозначение |
Единица измерения |
Результат |
|
Масса металла |
|
г |
|
|
Объем выделившегося водорода |
|
мл |
|
|
Температура |
|
°С |
|
|
Атмосферное давление |
|
мм рт. ст. |
|
|
Давление насыщенного водяного пара при температуре опыта |
|
мм рт. ст. |
|
После прекращения реакции подождать 5 –
10 минут, чтобы газ внутри бюретки приобрел комнатную температуру, добавиться
совпадения уровней воды в обеих бюретках, перемещая бюретку 2. Этим создается
давление внутри бюретки 5, равное атмосферному давлению. По положению нижнего
мениска воды в бюретке 5 определить объём выделившегося водорода. Результат
занести в таблицу 1. Записать также в таблицу комнатную температуру,
атмосферное давление и давление насыщенного пара (![]() ).
).
Обработка экспериментальных данных
1. Привести объём водорода к значению объема при нормальных условиях. По объединенному газовому закону
![]() .
.
В данном уравнении вместо ![]() брать парциальное давление водорода
брать парциальное давление водорода ![]() ,
,
![]() .
.
2. По закону эквивалентов определить экспериментальное значение эквивалентной массы металла
![]() .
.
Здесь 11200 мл – эквивалентный объём водорода при н. у.
3. Зная, что для эксперимента был взят двухвалентный металл, рассчитать атомную массу:
![]() .
.
По таблице Д. И. Менделеева определить исследуемый металл.
4. Взять из таблицы точное значение атомной массы металла ![]() (самое близкое к
экспериментальному значению). Рассчитать относительную погрешность опыта
(самое близкое к
экспериментальному значению). Рассчитать относительную погрешность опыта ![]() , %:
, %:
![]() .
.
5. Написать уравнение реакции и сделать соответствующий вывод об определяемом металле и о причинах, вызвавших погрешность опыта.
Опыт 2. Определение эквивалентной массы карбоната кальция
В этом опыте эквивалентная масса сложного вещества – карбоната кальция определяется по известной эквивалентной массе оксида углерода (IV) СО2.
В данном опыте используется прибор, который применяли в опыте 1 (см. рисунок 2), но вода в нем должна быть заменена насыщенным раствором хлорида натрия. Такая замена необходима потому, что растворимость оксида СО2 в растворе хлорида натрия значительно меньше, чем в воде.
Получить у лаборанта навеску мрамора (карбоната кальция). Навеска должна составлять 0,3 – 0,4 г. Аналогично, как в первом опыте, налить в реакционную пробирку 4 мл 16%-й соляной кислоты и, соблюдая ту же методику, провести реакцию взаимодействия карбоната кальция с соляной кислотой. Определить объём выделившегося углекислого газа. Результаты записать в таблицу 2.
Таблица 2
|
Параметры |
Обозначение |
Единица измерения |
Результат |
|
Масса мрамора |
|
г |
|
|
Объём выделившегося газа |
|
мл |
|
|
Температура |
|
°С |
|
|
Атмосферное давление |
|
мм рт. ст. |
|
Обработка экспериментальных данных
1. Вычислить массу газа по уравнению Клапейрона – Менделеева
![]() .
.
2. По закону эквивалентов 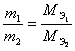 вычислить эквивалентную массу карбоната
кальция
вычислить эквивалентную массу карбоната
кальция ![]() ,
зная, что эквивалентная масса СО2 в реакции нейтрализации,
протекающей с образованием средней соли, равна его молекулярной массе, деленной
на два:
,
зная, что эквивалентная масса СО2 в реакции нейтрализации,
протекающей с образованием средней соли, равна его молекулярной массе, деленной
на два:
![]() .
.
3. Рассчитать теоретическое значение эквивалентной массы соли
CaCO3 (![]() ) и определить относительную погрешность
опыта
) и определить относительную погрешность
опыта ![]() , %:
, %:
![]() .
.
5. Написать уравнение реакции и сделать соответствующий вывод.
3 Контрольные вопросы
1. Что называют эквивалентом вещества? Как определяется эквивалентное число и фактор эквивалентности?
2. Определите эквивалентное число и фактор эквивалентности для веществ:
а) Fe2O3; б) HClO4; в) NaHS; г) MgOHCl; д) Ca(OH)2.
3. Как связаны молярная масса вещества и молярная масса эквивалента? Рассчитайте молярную массу эквивалента веществ, приведенных в вопросе 2.
4. Как рассчитывается молярная масса эквивалента окислителя и восстановителя в окислительно-восстановительной реакции?
5. Рассчитайте молярную массу эквивалента перманганата калия KMnO4, рассматривая данное соединение как:
а) соль; б) окислитель, превращающийся в MnO(OH)2; в) окислитель, превращающийся в MnSO4.
6. Какой объем занимает при нормальных условиях 1 моль эквивалента газообразного вещества: а) кислорода; б) хлора; в) углекислого газа?
7. Используя закон эквивалентов, рассчитайте объем оксида углерода (II), который потребуется для восстановления железа из 1 кг оксида железа (III) при нормальных условиях.
Лабораторная работа №3. Окислительно-восстановительные реакции
Цель работы – изучение окислительно-восстановительных свойств веществ, приобретение опыта составления окислительно-восстановительных реакций.
1 Теоретическое введение
1. Основные понятия окислительно-восстановительных реакций
Реакция, в результате которых происходит изменение степеней окисления у элементов, участвующих в них, называют окислительно-восстановительными.
Степенью окисления называются относительный заряд атома элемента, измеряемый количеством частично или полностью отданных или принятых электронов.
Атомы, принимающие электроны и понижающие свою степень окисления, называются окислителями. Атомы, отдающие электроны и повышающие свою степень окисления, называются восстановителями. Процесс принятия электронов называется восстановлением, а процесс отдачи электронов – окислением. Важнейшие окислители и восстановители приведены в таблице 3.
Например: Fe + CuSO4 = FeSO4 + Cu.
Cu2+ –2ē = Cu0 – восстановление, CuSO4 – окислитель,
Fe0 +2ē = Fe2+ – окисление, Fe – восстановитель.
2. Классификация окислительно-восстановительных реакций
Классификация окислительно-восстановительных реакций основывается на том, где расположены атомы окислителя и восстановителя, то есть в состав каких молекул они входят. Все окислительно-восстановительные реакции подразделяются на три основных класса:
1) Реакции межмолекулярного окисления-восстановления.
К реакциям данного типа относятся такие реакции, в которых атомы окислителя и восстановителя входят в состав молекул равных веществ. Например:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2↑.
восст. окисл.
Таблица 3 – Важнейшие окислители и восстановители
|
Окислители |
Восстанавлива-ются до … |
Восстановители |
Окисляются до … |
|
1 Неметаллы VI, VII групп. Их атомы принимают электро-ны и понижают степень окисления |
|
1 Металлы и некото-рые неметаллы (Н2, С). Они отдают элек-троны и повышают степень окисления. Zn, Al, Cr и др. могут окисляться в щелочной среде |
|
|
2 Ионы металлов с высшей степенью окисления: Fe3+, Cu2+, Pb4+, Sn4+, Co3+, Ni3+ |
|
2 Ионы металлов с низшей степенью окисления: Fe2+, Cu1+, Pb2+, Sn2+, Co2+, Ni2+ |
|
|
3 Растворы кислот: HNO3 конц. HNO3 разб. HNO3 оч. разб. H2SO4 конц. HClO, HClO2, HClO3, HClO4 HIO3, HIO4 HBrO, HBrO3 |
H2 NO2 NO NH3 SO2
I2
или
|
3 Соединения немет-аллов, содержащие атомы с низшим значением степени окисления элемента: NH3, PH3, H2S, HCl, HBr, HI |
нейтральных атомов (S, I2 и т.д.) или соед-инений, где атом имеет высшую степень окисления: H2SO4, H3PO4 и т.д. |
|
4 Соединения, содер-жащие атомы с высшим значением степени окисления: K2CrO4 в щелочной среде K2Cr2O7 в кис. среде KMnO4 в кис. среде KMnO4 в нейтраль-ной среде KMnO4 в щелочной среде |
MnO2
|
4 H2O2 |
|
|
5 Н2О2 |
(H2O) |
5 Кислотные оксиды и соответствующие им кислоты, соли со средним значением степени окисления: SO2, H2SO3, HNO2, KCrO2 |
соединений с высшим знач-ением степени окисления: SO3, H2SO4, HNO3, K2CrO4 (в кисл. среде K2Cr2O7) |
|
6 Кислородные кис-лоты со средним значением степени окисления: H2SO3 HNO2 |
S NO |
2) Реакция внутримолекулярного окисления-восстановления.
К реакциям данного типа относятся такие реакции, в которых атомы окислителя и восстановителя входят в состав одной молекулы. Например:
NH4NO3 = N2O + 2H2O.
восст. окисл.
3) Реакции самоокисления-самовосстановления (диспропорционирования).
К реакциям данного типа относятся такие реакции, в которых окислителем и восстановителем является один и тот же атом. Например:
4KCl+5O3 = 3KCl+7O4 + KCl-1.
Здесь часть хлора – окислитель, а часть – восстановитель.
3. Метод ионно-электронного баланса (метод полуреакций)
Для уравнивания коэффициентов в
окислительно-восстановительных реакциях, а также для предсказания их возможных
продуктов используется метод ионно-электронного баланса. При составлении
уравнений с помощью данного метода считается, что реакция протекает в виде двух
«полуреакций» – окисления и восстановления, причём атомы окислителя или
восстановителя рассматриваются в составе тех ионов, в виде которых они
присутствуют в растворе после диссоциации вещества. Например, ![]() в растворе диссоциирует на ионы
в растворе диссоциирует на ионы ![]() и
и
![]() , поэтому марганец (VII) в полуреакции мы будем записывать не в
виде
, поэтому марганец (VII) в полуреакции мы будем записывать не в
виде ![]() , а в
виде
, а в
виде ![]() . Также
необходимо учитывать среду, в которой протекает реакция: кислая, нейтральная
или щелочная.
. Также
необходимо учитывать среду, в которой протекает реакция: кислая, нейтральная
или щелочная.
Рассмотрим пример. Дописать следующее уравнение реакции и уравнять в нём коэффициенты: KMnO4 + Na2SO3 + H2SO4 → …
1) Сначала необходимо определить, какое
из веществ – окислитель, а какое – восстановитель, помня о том, что атомы
элемента, находящиеся в высшей (максимальной) степени окисления, могут быть
только окислителями, а низшей – только восстановителями. Если элемент находится
в промежуточной степени окисления, то для предсказания его
окислительно-восстановительных свойств необходимо посмотреть на присутствие
других элементов, способных повлиять на поведение этого элемента в данной
реакции. Итак, ион ![]() будет
проявлять окислительные свойства, а ион
будет
проявлять окислительные свойства, а ион ![]() - восстановительные.
- восстановительные.
2) Затем надо определить, какая среда в этой реакции. Поскольку у нас присутствует в уравнении серная кислота, то и среда будет кислая.
3) Теперь начинаем уравнивать полуреакцию восстановления. Сначала уравниваем реакцию по веществу, а затем по зарядам:
![]() + 8Н+ +5ē =
+ 8Н+ +5ē = ![]() + 4Н2О,
+ 4Н2О,
![]() + Н2О –2ē =
+ Н2О –2ē = ![]() + 2Н+.
+ 2Н+.
4) Записав два уравнения вместе, перед каждым ставим стехиометрический коэффициент, равный количеству электронов в другом уравнении, и суммируем каждую часть полуреакции, получая полное уравнение реакции в ионном виде:
|
2 5 |
|
|
|
2 |
Анализируем полученное уравнение, и если в обеих частях уравнения присутствуют молекулы одного и того же вещества, то сокращаем их количество, чтобы в каждой части уравнения остались молекулы, не повторяющиеся в другой части. В итоге получаем:
2![]() + 6Н+ + 5
+ 6Н+ + 5![]() = 2
= 2![]() + 3Н2О + 5
+ 3Н2О + 5![]() .
.
5) На последнем шаге составления
окислительно-восстановительной реакции общее ионное уравнение приводим к
молекулярному виду, добавляя к каждому иону противоион (т. е. ион, имеющий
противоположный заряд). Если в продуктах получается ион, который по сравнению с
исходным меняет знак, то противоионы для него берутся из молекул вещества,
создавшего среду. Например, в нашем случае ионы
![]() переходят в ионы
переходят в ионы ![]() , и противоионами для
них будут сульфат-ионы. В итоге наше уравнение примет вид:
, и противоионами для
них будут сульфат-ионы. В итоге наше уравнение примет вид:
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O.
Замечания: при уравнивании полуреакций по веществу в кислой среде можно использовать только Н2О и Н+, в щелочной – только Н2О и ОН-; в нейтральной среде можно использовать молекулы воды и ионы, которые получаются в полуреакции восстановления.
2 Экспериментальная часть
Опыт 1. Окислительные свойства иода
В пробирку поместить 5 капель раствора сульфида натрия и по каплям прибавлять иодную воду. Наблюдать обесцвечивание раствора. Составить уравнение реакции, учитывая, что сульфид-ион переходит в сульфат-ион.
Опыт 2. Окисление двухвалентного олова до четырёхвалентного
К 3 каплям хлорида железа (III) прилить 1 каплю раствора роданида аммония. О наличии каких ионов в растворе говорит появившееся окрашивание?
К полученной смеси приливать по каплям раствор хлорида олова (II). Почему раствор обесцвечивается? Составить уравнение окислительно-восстановительной реакции (роданид аммония в уравнение не включать).
Опыт 3. Окислительные свойства азотной кислоты
К 4 каплям раствора иодида калия прилить 4 капли 2 н. раствора азотной кислоты. Что наблюдается? Составьте уравнение реакции. Как можно доказать, что появившаяся окраска обусловлена выделившимся иодом?
Опыт 4. Окислительные свойства концентрированной азотной кислоты
В пробирку поместить маленький кусочек меди и 4 капли концентрированной азотной кислоты (ОСТОРОЖНО! Опыт проводить в вытяжном шкафу!). Отметить, что наблюдается. Составить уравнение окислительно-восстановительной реакции.
Опыт 5. Восстановление перманганата калия в кислой среде
К 4 каплям раствора перманганата калия прилить 4 капли раствора сульфата железа (II) и подкислить 2 каплями серной кислоты. Что наблюдается? Составить уравнение реакции. Для открытия образовавшихся ионов железа (III) прилить 1 каплю раствора роданида аммония.
Опыт 6. Восстановление перманганата калия в нейтральной среде
В пробирку налить по 4 капли растворов перманганата калия и пероксида водорода. Что наблюдается? Составьте уравнение реакции.
Опыт 7. Восстановление перманганата калия в щелочной среде
К 4 каплям раствора перманганата калия прилить
3 – 4 капли концентрированного раствора щёлочи и 6 капель раствора сульфита
натрия. Наблюдать появление зелёной окраски, характерной для иона
![]() . Составить уравнение реакции.
. Составить уравнение реакции.
Опыт 8. Окисление хромит-иона в хромат-ион
К 4 каплям раствора сульфата хрома (III) прилить 1 каплю раствора гидроксида калия. Наблюдать образование осадка. Составить уравнение реакции.
Растворить полученный осадок в избытке гидроксида калия. Составить уравнение реакции получения метахромита калия KCrO2. Какова окраска полученного раствора? К полученному раствору прилить 6 капель пероксида водорода. Что наблюдается? Составить уравнение реакции.
Опыт 9. Восстановление дихромат-иона до трёхвалентного хрома
3 капли раствора дихромата калия подкислить 3 каплями серной кислоты, встряхнуть и добавить 5 капель раствора сульфида натрия. Еще раз встряхнуть пробирку. Что изменяется? Составить уравнение реакции.
Опыт 10. Восстановительные свойства алюминия
В пробирку поместить кусочек алюминиевой стружки и 5 капель концентрированного раствора щёлочи. Слегка нагреть пробирку. Что наблюдается? Написать уравнение реакции.
3 Контрольные вопросы
1. Какие реакции относятся к окислительно-восстановительным?
2. Что такое степень окисления элемента?
3. Дать определение процессу диспропорционирования.
4. Как относятся понятия «степень окисления» и «валентность» элемента?
5. В чем состоит сущность процессов окисления и восстановления?
6. Какие элементы периодической системы обладают наиболее сильной окислительной и восстановительной способностью?
7. Почему большинство металлов проявляют только восстановительные свойства, а типичные неметаллы – окислительные?
8. Определите степень окисления в соединениях:
азота – HNO3, RNO2, NH3, NO2, N2O, N2;
серы – H2S, S, SO2, H2SO4, KHSO3.
Все соединения назовите.
Лабораторная работа №4. Комплексные соединение
Цель работы – ознакомление со свойствами комплексных соединений, способами их получения и устойчивостью в растворах.
1 Теоретическое введение
В природе существует целый ряд соединений, называемых комплексными, или координационными. Чёткого определения этого класса веществ не существует. Номенклатурная комиссия ИЮПАК рекомендует следующее: комплексными (или координационными) соединениями являются вещества, содержащие атом, к которому присоединяются другие атомы или группы в количестве, превышающем то, которое соответствует классической или стехиометрической валентности этого атома.
В состав любого комплексного соединения (или кратко - комплекса) обязательно входят центральный атом и лиганды. Центральный атом (или комплексообразователь) – это атом, к которому присоединяются другие атомы или атомные группы. Лиганды – это атомы или группы, присоединяющиеся к центральному атому.
Например, при добавлении к раствору сульфата меди (II), имеющего голубой цвет, избытка аммиака сначала выпадает осадок гидроксида меди (II), а затем он растворяется с образованием комплексного соединения, имеющего васильковый цвет. Это отражается следующими уравнениями реакций:
CuSO4 + 2NH3 + 2H2O = Cu(OH)2↓ + (NH4)2SO4,
голубой р-р синий осадок
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2.
васильковый р-р
Здесь в соединении [Cu(NH3)4](OH)2 ион Cu2+ является центральным атомом, а молекулы NH3 – лигандами.
Атомы, через которые лиганды присоединяются к комплексообразователю, называются координирующими (или соединительными) атомами. Так, в [Cu(NH3)4](OH)2 соединительными будут атомы азота N-3.
Количество связывающих атомов, непосредственно
соединённых с комплексообразователем, называется координационным числом.
В нашем примере координационное число меди равно четырём (![]() ).
).
Число координирующих атомов в лиганде обуславливает его дентатность. Иными словами, дентатность – это количество связей, которые может образовывать лиганд. В комплексе [Cu(NH3)4](OH)2 дентатность аммиака равна единице, т. е. данный лиганд монодентатен.
Комплексные соединения образуются за счёт донорно-акцепторных связей между комплексообразователем и лигандами. Центральный атом и лиганды образуют внутреннюю сферу комплекса, остальные же атомы входят во внешнюю сферу. В нашем примере [Cu(NH3)4]2+ - внутренняя сфера, а два иона ОН- - внешняя сфера комплекса.
Координационные соединения классифицируют по заряду их внутренней сферы:
а) катионные комплексы. В этих соединениях комплексная часть вещества имеет положительный заряд. Например: [Cu(NH3)4]2+(ОН)2;
б) анионные комплексы. В соединениях данного типа комплексная часть молекулы имеет отрицательный заряд. Например: K4[Fe(CN)6]4-;
в) катионно-анионные комплексы. Это соединения, состоящие из двух внутренних сфер, каждая из которых имеет противоположный заряд. Например: [Cu(NH3)4]2[Fe(CN)6];
г) нейтральные комплексы. К ним относятся комплексные соединения, состоящие только из внутренней сферы. Например: [Ni(CO)8].
В растворах комплексные ионы способны ступенчато диссоциировать. Например, диссоциация комплекса [Cu(NH3)4]2+ проходит по следующим ступеням:
[Cu(NH3)4]2+ ↔ [Cu(NH3)3]2+ + NH3,
[Cu(NH3)3]2+ ↔ [Cu(NH3)2]2+ + NH3,
[Cu(NH3)2]2+ ↔ [Cu(NH3)]2+ + NH3,
[Cu(NH3)]2+ ↔ Cu2+ + NH3.
Поскольку данный процесс является равновесным, то для можно записать выражение константы равновесия, которая для случая диссоциации комплексов называется константой нестойкости. Например, выражение константы нестойкости для случая полного распада аммиаката меди будет выглядеть следующим образом:
![]() ,
,
где ![]() ,
,
![]() и
и ![]() – равновесные
концентрации ионов меди (II), аммиака
и ионов тетрааминомеди (II), моль/л.
Чем меньше значение константы нестойкости, тем более устойчиво комплексное
соединение.
– равновесные
концентрации ионов меди (II), аммиака
и ионов тетрааминомеди (II), моль/л.
Чем меньше значение константы нестойкости, тем более устойчиво комплексное
соединение.
В растворах комплексных веществ при протекании химических реакций проявляются свойства не только отдельных ионов, атомов или молекул, входящих в состав этого комплекса, но и всего координационного соединения в целом.
Наиболее частыми комплексообразователями являются d-элементы.
2 Экспериментальная часть
Опыт 1. Получение комплексных соединений с комплексными анионами
Налить по 2 капли в каждую из 5 пробирок 1 н. раствора хлорида кобальта (II):
а) в первую пробирку добавить концентрированного раствора ацетата натрия до получения ярко выраженной розовой окраски, обусловленной ионом [Co(CH3COO)6]4-;
б) во вторую – концентрированного раствора нитрита натрия до появления желто-оранжевой окраски, обусловленной ионом [Co(NO2)6]4-;
в) в третью – концентрированную HCl до появления синего цвета, обусловленного ионом [CoCl4]2-;
г) в четвертую – концентрированного раствора роданида калия до появления фиолетового цвета, обусловленного ионом [Co(SCN)4]2-;
д) в пятую – концентрированного раствора тиосульфата натрия до появления синей окраски, обусловленной ионом [Co(S2O3)3]4-.
Во всех пяти пробирках образуются комплексные соединения с комплексными анионами, в которых комплексообразователем является ион Со2+. Написать уравнения реакций получения комплексов, отметить их окраску и назвать комплексные соединения.
Написать уравнения диссоциации комплексов и выражения констант нестойкости комплексов. Дать полную характеристику каждого комплекса.
Опыт 2. Получение комплексных соединений с комплексными катионами
Взять пять пробирок и поместить по 2 капли:
а) в первую – 1 н. раствора хлорида кобальта (II);
б) во вторую – концентрированного раствора сульфата хрома (III);
в) в третью – 1 н. раствора сульфата меди (II);
г) в четвертую – концентрированного раствора сульфата никеля (II);
д) в пятую – концентрированного раствора сульфата цинка (II).
Затем прилить в каждую пробирку по каплям (до 10 капель) концентрированного раствора аммиака до приобретения раствором цвета, соответствующего комплексному катиону. Получатся следующие окраски:
а) в первой пробирке – коричневая (красно-бурая), обусловленная ионом [Cо(NH3)6]2+;
б) во второй – бледно-лиловая, обусловленная ионом [Cr(NH3)6]3+;
в) в третьей – синяя, обусловленная ионом [Cu(NH3)4]2+;
г) в четвертой – сине-фиолетовая, обусловленная ионом [Ni(NH3)6]3+;
д) в пятой пробирке сначала образуется белый осадок Zn(OH)2, затем он растворится с образованием бесцветного комплекса [Zn(NH3)4]2+.
Написать уравнения реакций получения комплексов. Назвать каждое комплексное соединение. Написать уравнения диссоциации комплексов и выражение константы нестойкости комплексов. Дать полную характеристику каждого комплексного соединения.
Опыт 3. Получение комплексных соединений с комплексным катионом и комплексным анионом
Налить в пробирку 5 капель 1 н. раствора гексацианоферрата (II) калия и 2 капли концентрированного раствора сульфата никеля (II). Образуется бледно-зеленый осадок. В данном случае протекает реакция замещения внешнего иона в комплексном соединении
K4[Fe(CN)6] + 2NiSO4 = Ni2[Fe(CN)6]↓ + 2K2SO4.
Далее к полученному соединению добавить по каплям концентрированный раствор аммиака до полного растворения осадка и образования бледно-лиловых кристаллов комплексной соли [Ni(NH3)6]2[Fe(CN)6] (кристаллы лучше заметны, если дать пробирке немного постоять).
Написать уравнения реакций, отметить изменение окраски, назвать все комплексные соединения. Написать уравнения диссоциации и выражения констант нестойкости. Дать полную характеристику комплексов.
Опыт 4. Исследование прочности и комплексов
1. Разрушение комплексов в результате осаждения комплексообразователя. Взять три пробирки. В первую налить 5 капель 0,5 М раствора сульфата железа (II) и добавить 1 каплю 1 н. раствора сульфида натрия. Выпадает черный осадок сульфида железа (II). Этот контрольный опыт показывает, что наличие в растворе иона Fe2+ приводит к образованию с ионом S2- черного осадка сульфида железа.
Во вторую пробирку также налить 5 капель 0,5 М раствора сульфата железа (II) и добавить 3 капли концентрированного раствора ацетата натрия. В результате реакции образуется комплекс Na4[Fe(CH3COO)6] коричневого цвета.
В третью пробирку налить 5 капель 1 н. раствора K4[Fe(CN)6]. Затем во вторую и третью пробирки добавить по 1 капле 1 н. раствора сульфида натрия.
Что наблюдается? В какой пробирке выпадает осадок FeS? Почему? Сравнить устойчивость комплексов K4[Fe(CN)6] и Na4[Fe(CH3COO)6].
2. Разрушение комплекса в результате образования нового комплекса. Сначала получить комплекс Na4[Со(CH3COO)6]. Для этого в 2порбирки налить по 2 капли 1 н. раствора хлорида кобальта (II) и по 10 капель концентрированного раствора ацетата натрия до появления ярко-розового цвета, обусловленного ионом [Со(CH3COO)4]2-.
Далее одну пробирку оставить для сравнения цвета, а во вторую добавить 10 капель концентрированного раствора роданида калия до появления фиолетового цвета, обусловленного ионом [Co(SCN)4]2-.
Написать уравнения реакций и объяснить, чем обусловлено разрушение данного комплексного иона и образование другого.
Опыт 5. Свойства комплексных соединений
1. Реакции обмена комплексообразователя. В пробирку поместить 2 капли 1 н. раствора хлорида кобальта (II) и добавить 5 – 10 капель концентрированной HCl до появления сине-фиолетового окрашивания, обусловленного образованием комплексного иона [CoCl4]2-. Затем в пробирку внести 2 капли концентрированного раствора сульфата цинка до появления розовой окраски. В результате этой реакции происходит обмен комплексообразователя Со2+ на Zn2+. Розовая окраска обусловлена выделением в свободном виде иона Со2+.
Написать уравнения протекающих реакций и назвать полученные комплексы. Объяснить, почему происходит обмен комплексообразователя.
В другую пробирку налить 2 капли концентрированного раствора сульфата цинка и добавить несколько капель (3 – 7) концентрированного раствора аммиака до образования комплексного иона [Zn(NH3)4]2+. Раствор этого комплекса бесцветный. Затем в эту пробирку внести 2 – 3 капли 1 н. раствора сульфата меди (II) до появления синего цвета, обусловленного образованием нового комплексного катиона [Cu(NH3)4]2+.
Написать уравнения протекающих реакций и назвать все комплексы. Объяснить, чем обусловлена замена комплексообразователя. Написать выражение констант нестойкости комплексов и привести их табличные значения.
2. Участие комплексных соединений в окислительно-восстановительных реакциях. Внести в пробирку 5 капель 0,5 н. раствора иодида калия, 5 капель концентрированной HCl и 3 капли толуола. Содержимое пробирки встряхнуть и убедиться, что верхний слой (слой толуола) остается бесцветным. Затем внести в пробирку 2 – 3 капли насыщенного раствора красной кровяной соли (гексацианоферрата (III) калия), встряхнуть и наблюдать за изменением окраски верхнего толуольного слоя жидкости. В результате реакции иод окисляется до свободного состояния (при этом I2 переходит в слой толуола и окрашивает его), а комплексообразователь Fe3+ восстанавливается до Fe2+.
Написать уравнение окислительно-восстановительной реакции, учитывая, что толуол в ней участия не принимает, а соляная кислота создает среду. Назвать все комплексы. Привести их константы нестойкости.
3 Контрольные вопросы
1. Дать определение понятию «комплексные соединения».
2. Как построена молекула комплексного соединения?
3. Что такое комплексообразователь, лиганды, координационное число?
4. Что такое центральный ион, внутренняя и внешняя сферы комплексного соединения?
5. Как протекает процесс диссоциации комплексных солей? Привести пример.
6. Дать определение константы нестойкости комплексного иона. Привести пример.
7. Написать уравнение реакции Zn(OH)2 с аммиаком. Координационное число равно 4.
8. Написать уравнение диссоциации на ионы соли K2[PtCl4] и суммарное уравнение вторичной диссоциации иона [PtCl4]2-.
Лабораторная работа №5. Энергетика химических процессов
Цель работы – определить тепловые эффекты и направление химических процессов.
1 Теоретическое введение
Возможность осуществления химического взаимодействия между веществами оценивается по их энергетическому состоянию. Расчёт энергии веществ и процессов производится на основании уравнений первого и второго законов термодинамики. Количественно величина энергии зависит от параметров состояния химической системы и типа процесса: изобарный, изохорный, изотермический и др.
Химическая термодинамика позволяет предвидеть возможность реализации химических процессов, оценить количественно реакционную способность веществ, рассчитать их химическое сродство.
К основным терминам и понятиям термодинамики относятся:
- система – это совокупность веществ, химических и физических факторов, находящихся во взаимодействии между собой и отделенных от окружающей среды реальной или мнимой границей;
- фаза – часть системы, однородная по химическим и физическим свойствам, отграниченная от других её частей поверхностью раздела, при переходе через которую свойства меняются скачкообразно;
- состояние системы – совокупность химических и физических свойств, характеризующая систему в целом;
- теплота (Q) представляет собой как меру хаотического движения частиц данной системы, так и способ передачи энергии от одного тела к другому;
- работа (А) – количественная мера энергии, связанная с перемещением масс, состоящих из большого числа частиц, под действием каких-либо сил;
- внутренняя энергия (U) – сумма потенциальной энергии взаимодействия всех частиц системы между собой и их кинетической энергии;
- энтальпия (Н) – функция состояния с системы, определяющая её теплосодержание. Энтальпия системы складывается из внутренней энергии и работы данной системы:
![]() .
.
В термодинамике существует несколько подходов к классификации систем:
а) по числу фаз:
- система, состоящая из одной фазы, называется гомогенной;
- система, состоящая из нескольких фаз, называется гетерогенной;
б) по типу обмена энергией:
- система, которая обменивается с окружающей средой и теплотой, и веществом, называется открытой;
- система, которая не обменивается с окружающей средой как теплотой, так и веществом, называется изолированной.
Первый закон термодинамики является частным случаем закона сохранения вещества и энергии и формулируется следующим образом: в любой изолированной системе запас энергии остаётся постоянным, а в открытых системах он изменяется, причем разные формы энергии переходят от системы к системе в строго эквивалентных количествах. Первый закон термодинамики регламентирует взаимосвязь между основными тепловыми характеристиками химического процесса:
![]() ,
, ![]() ,
,
где ![]() и
и
![]() – изменение внутренней
энергии и энтальпии системы в ходе какого-либо процесса, соответственно;
– изменение внутренней
энергии и энтальпии системы в ходе какого-либо процесса, соответственно;
![]() – теплота процесса (реакции);
– теплота процесса (реакции);
![]() и
и ![]() – работа против внешних сил при изохорном
и изобарном процессе, соответственно.
– работа против внешних сил при изохорном
и изобарном процессе, соответственно.
При
изобарных условиях изменение энтальпии в ходе химической реакции (![]() ) является величиной
противоположной тепловому эффекту. Химическое уравнение с указанием теплового
эффекта (или энтальпии) процесса и агрегатного состояния веществ называется термохимическим
уравнением. В термохимических уравнениях допускаются дробные коэффициенты.
) является величиной
противоположной тепловому эффекту. Химическое уравнение с указанием теплового
эффекта (или энтальпии) процесса и агрегатного состояния веществ называется термохимическим
уравнением. В термохимических уравнениях допускаются дробные коэффициенты.
Частным случаем первого закона термодинамики для термохимических расчётов (т. е. определения тепловых эффектов) является закон Гесса, который формулируется следующим образом теплота любого процесса зависит от от начального и конечного состояния системы и не зависит от пути его протекания. В химии практическое значение имеет следствие из этого закона, которое выражается следующей формулой:
![]() ,
,
где
![]() и
и ![]() – стехиометрические коэффициенты
i-го и
j-го веществ, соответственно;
– стехиометрические коэффициенты
i-го и
j-го веществ, соответственно;
![]() - стандартная энтальпия образования
вещества.
- стандартная энтальпия образования
вещества.
Второй закон термодинамики позволяет определить
возможность самопроизвольного протекания процесса. Он имеет статистический
характер, т.е. справедлив лишь для систем, состоящих из очень большого числа
частиц. Функцией состояния системы, характеризующей кинетическую
упорядоченность частиц и направление передачи теплоты в системе, является энтропия:
![]() .
.
Для термохимических расчётов применяется следующая
формулировка второго закона термодинамики: в изолированных системах
самопроизвольно идут только такие процессы, которые сопровождаются возрастанием
энтропии, т. е. ![]() .
.
Изменение энтропии в ходе химической реакции можно рассчитать согласно следствию из закона Гесса, пользуясь стандартными значениями энтропии веществ.
Энтальпия и энтропия, характеризующие
две противоположные тенденции процессов – стремление к объединению, порядку и
стремление к разъединению, беспорядку, взятые по отдельности, не могут быть
критериями самопроизвольного течения химических реакций. Для
изобарно-изотермических процессов их объединяет функция, называемая
изобарно-изотермическим потенциалом, или свободной энергией Гиббса (![]() ), равная:
), равная:
![]() .
.
Энергия Гиббса служит критерием самопроизвольного протекания химической реакции:
-
если ![]() , то возможно самопроизвольное протекание
данной реакции при определенных условиях;
, то возможно самопроизвольное протекание
данной реакции при определенных условиях;
- если ![]() , то в данных условиях протекание реакции
принципиально невозможно;
, то в данных условиях протекание реакции
принципиально невозможно;
- если ![]() , то данная реакция является абсолютно
равновесной, т.е. равновесие в реакции наступает в момент
, то данная реакция является абсолютно
равновесной, т.е. равновесие в реакции наступает в момент ![]() .
.
2 Экспериментальная часть
Опыт 1. Определение теплового эффекта (энтальпии) реакции нейтрализации кислоты щёлочью
В стеклянный стакан налить 25 мл 1 М раствора соляной кислоты. Опустить в раствор термометр и измерить температуру раствора (точность измерения зависит от шкалы термометра). В другой стакан налить 25 мл 1 М раствора щёлочи и также измерить его температуру. После выравнивания температур провести реакцию нейтрализации, для чего к раствору кислоты осторожно прилить раствор щёлочи и, плавно помешивая смесь термометром, зафиксировать максимальное изменение температуры смеси.
Обработка экспериментальных данных
1. Составить краткое ионное уравнение реакции нейтрализации и рассчитать теоретическое значение энтальпии для этого процесса по следствию из закона Гесса.
2. Определить количество теплоты, выделившееся в реакции нейтрализации, по уравнению:
![]() ,
,
где ![]() и
и ![]() - массы растворов кислоты и щёлочи, соответственно
(плотности растворов принять равными 1 г/мл), г;
- массы растворов кислоты и щёлочи, соответственно
(плотности растворов принять равными 1 г/мл), г;
![]() - максимальное изменение температуры
смеси, °С;
- максимальное изменение температуры
смеси, °С;
![]() - удельная теплоёмкость смеси принимается
равной теплоёмкости воды,
- удельная теплоёмкость смеси принимается
равной теплоёмкости воды, ![]() Дж/(г·К).
Дж/(г·К).
3. Рассчитать экспериментальную энтальпию (кДж/моль) реакции по формуле:
![]() ,
,
где ![]() - количество теплоты,
выделившееся в ходе реакции нейтрализации, Дж;
- количество теплоты,
выделившееся в ходе реакции нейтрализации, Дж;
![]() - объём раствора кислоты, л;
- объём раствора кислоты, л;
![]() - молярная концентрация раствора, моль/л.
- молярная концентрация раствора, моль/л.
4. определить относительную ошибку опыта.
Опыт 2. Определение теплового эффекта растворения соли в воде
Налить в стакан 100 мл дистиллированной воды и измерить её температуру. Взять навеску соли массой примерно 1,5 г. Высыпать навеску соли в стакан с водой и, осторожно перемешивая термометром до полного растворения навески, зафиксировать максимальное изменение температуры раствора.
Обработка экспериментальных данных
1. Рассчитать тепловой эффект растворения соли в воде по уравнению:
![]() ,
,
где ![]() и
и ![]() - соответственно масса воды и
соли, г;
- соответственно масса воды и
соли, г;
![]() - максимальное изменение температуры при
растворении, °С;
- максимальное изменение температуры при
растворении, °С;
![]() - удельная теплоёмкость воды,
- удельная теплоёмкость воды, ![]() Дж/(г·К);
Дж/(г·К);
![]() - молярная масса соли, г/моль.
- молярная масса соли, г/моль.
2. Рассчитать относительную ошибку опыта, учитывая, что
теоретическое значение энтальпии растворения нитрата калия в воде при 25°С
составляет ![]() кДж/моль.
кДж/моль.
3. Оценить изменение энтропии при растворении соли и сделать соответствующие выводы.
3 Контрольные вопросы
1. Дайте определения понятиям: термодинамическая система, термодинамические параметры, термодинамический процесс, функция состояния системы.
2. Сформулируйте первый закон термодинамики, приведите его математическое выражение.
3. Сформулируйте второй закон термодинамики.
4. Как изменяется внутренняя энергия системы в процессе теплообмена с окружающей средой и совершения работы?
5. Что представляет собой тепловой эффект реакции, проведённой при постоянном объёме? При постоянном давлении?
6. Какие условия состояния системы называют стандартными?
7. Сформулируйте закон Гесса и следствие из него.
8. В чём состоит смысл понятия «энтропия»? Как изменяется энтропия в изолированной системе при химических и фазовых превращениях?
9. Какими одновременно действующими факторами определяется направленность химического процесса? Какую тенденцию выражает энтальпийный фактор? Энтропийный фактор?
Лабораторная работа №6. Кинетика химических реакций
Цель работы – изучить влияние различных факторов (концентрации и температуры) на скорость химической реакции.
1 Теоретическое введение
Химическая кинетика – это учение о скоростях реакций, процессе взаимодействия веществ и его зависимости от времени и различных факторов. Химическая термодинамика, как известно, позволяет рассчитывать тепловые эффекты реакций, химическое сродство, предсказывать возможность протекания данной реакции, определять состояние её равновесия. Химическая кинетика, в свою очередь, позволяет предсказать скорость реакции, механизм процесса взаимодействия веществ, стадии химического превращения и, следовательно, управлять химическим процессом в лабораторных и производственных условиях.
Основным понятием в химической кинетике
является понятие скорости реакции. Скорость химической реакции (![]() ) – это изменение
количества вещества за единицу времени в единице объёма. Так, для реакции
) – это изменение
количества вещества за единицу времени в единице объёма. Так, для реакции
![]() .
.
Скорость расходования исходных веществ (иными словами, скорость по исходным веществам) определяется как
![]() ,
, ![]() ,
,
где ![]() и
и
![]() - изменение
количеств реагирующих веществ А и В соответственно;
- изменение
количеств реагирующих веществ А и В соответственно;
![]() - время протекания реакции;
- время протекания реакции;
![]() - объём реакционного пространства.
- объём реакционного пространства.
Скорость обратной реакции будет определяться следующим образом:
![]() ,
, ![]() .
.
Поскольку скорость химической реакции –
величина всегда положительная, и с учётом того, что изменение отношения
количества вещества к объёму системы (![]() ) есть изменение концентрации вещества (
) есть изменение концентрации вещества (![]() ), основное уравнение
кинетики примет вид:
), основное уравнение
кинетики примет вид:
![]() .
.
Скорость реакции, найденная по данному уравнению, называется средней скоростью реакции, так как здесь используется большой промежуток времени. Скорость реакции, вычисленная как дифференциал концентрации по времени, называется истинной скоростью химической реакции:
![]() .
.
Как видно из предыдущих уравнений, скорость химической реакции зависит от текущей концентрации реагирующих веществ. Аналитически эта зависимость выражается основным законом кинетики (законом действия масс):
![]() ,
,
где ![]() -
константа скорости химической реакции;
-
константа скорости химической реакции;
![]() и
и ![]() - концентрации веществ А и В
соответственно, в текущий момент времени;
- концентрации веществ А и В
соответственно, в текущий момент времени;
![]() и
и ![]() - частные порядки реакции по веществу А
и В соответственно.
- частные порядки реакции по веществу А
и В соответственно.
Частные порядки по веществам показывают, сколько молекул данного вещества принимает участие в элементарном акте взаимодействия. Под элементарным актом реакции понимают одну из её стадий, которая обуславливает скорость всей реакции и приводит к образованию продуктов взаимодействия. Для простоты расчётов можно принимать частные порядки, равные стехиометрическим коэффициентам.
Сумма частных порядков реакции по всем веществам называется общим порядком реакции (n):
![]() .
.
Константа скорости реакции есть величина постоянная при данной температуре. Её физический смысл заключается в том, что она показывает скорость реакции при единичных концентрациях всех веществ. Значение константы скорости зависит от природы реагирующих веществ, температуры, присутствия катализаторов.
Для гетерогенных реакций, когда взаимодействие веществ происходит на поверхности какой-либо фазы, решающее влияние на скорость оказывает площадь контакта этих веществ. Следует отметить, что концентрация конденсированной (твёрдой) фазы в уравнение закона действия масс никогда не записывается. Например, для реакции
Zn + 2HCl = ZnCl2 + H2
кинетическое уравнение по закону действия масс будет выглядеть
следующим образом: ![]() .
.
Скорость химической реакции также зависит и от температуры. Для качественной оценки влияния температуры на скорость взаимодействия веществ можно использовать две зависимости: правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа формулируется следующим образом: при изменении температуры реакции на каждые 10 градусов скорость реакции изменяется в 2 – 4 раза. Математически это выражается следующим уравнением:
![]() ,
,
где ![]() и
и
![]() - скорости
при температурах Т2 и Т1 соответственно;
- скорости
при температурах Т2 и Т1 соответственно;
![]() - температурный коэффициент скорости,
который для большинства реакций принимает значения от 2 до 4.
- температурный коэффициент скорости,
который для большинства реакций принимает значения от 2 до 4.
Для более точных расчётов кинетических параметров реакций в зависимости от температуры используют уравнение Аррениуса:
![]() ,
,
где ![]() -
предэкспоненциальный множитель (кинетический фактор Аррениуса);
-
предэкспоненциальный множитель (кинетический фактор Аррениуса);
![]() - энергия активации реакции;
- энергия активации реакции;
![]() - универсальная газовая постоянная,
- универсальная газовая постоянная, ![]() Дж/(моль·К);
Дж/(моль·К);
![]() - термодинамическая температура.
- термодинамическая температура.
Энергия активации (![]() ) является одной из важнейших
характеристик реакции и показывает количество энергии, которым должны обладать
молекулы, вступающие в элементарный акт взаимодействия. Если реагирующие
молекулы обладают запасом энергии меньшим, чем энергия активации, то они не
смогут вступить во взаимодействие.
) является одной из важнейших
характеристик реакции и показывает количество энергии, которым должны обладать
молекулы, вступающие в элементарный акт взаимодействия. Если реагирующие
молекулы обладают запасом энергии меньшим, чем энергия активации, то они не
смогут вступить во взаимодействие.
Энергия активации любого процесса складывается из энергозатрат на разрыв химических связей в реагирующих молекулах, энергии образования новых химических связей, теплоты сопутствующих процессов (сублимация, возгонка, испарение, конденсация и др.) и некоторых других факторов.
Энергия активации зависит только от природы реагирующих веществ и присутствия катализаторов. Если энергия активации мала, то константа скорости будет высокой, а значит, высокой окажется и скорость реакции. Вещества, которые понижают энергию активации реакции, увеличивая тем самым её скорость, но сами в ней не участвуют, называются катализаторами.
Вещества, которые увеличивают энергию активации реакции, уменьшая тем самым её скорость, но сами в ней не участвуют, называются ингибиторами.
Катализаторы по их агрегатному состоянию принято подразделять на гомогенные и гетерогенные. Если катализатор находится в той же фазе, что и реагирующие вещества, то он будет являться гомогенным. Если катализатор находится в другой фазе по сравнению с реагирующими веществами, то он будет являться гетерогенным.
2 Экспериментальная часть
Опыт 1. Влияние концентрации реагирующих веществ на скорость химической реакции
Взять 3 сухие микропробирки. Внести в первую 4, во вторую – 8, в третью – 12 капель 1 н. раствора тиосульфата натрия. Для получения равных объёмов во всех пробирках добавить в первую 8, во вторую – 4 капли дистиллированной воды. Таким образом, в пробирках получаются разные концентрации тиосульфата натрия. Условно обозначим их: с – первая пробирка, 2с – вторая пробирка, 3с – третья пробирка.
Добавить в первую пробирку одну каплю 2 н. раствора серной кислоты и начать отсчет времени от момента добавления кислоты до появления в растворе опалесценции, вызванной помутнением раствора в связи с выделением серы:
Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2 + H2O.
Аналогичные опыты проделать со второй и третьей пробирками. Данные опыта занести в таблицу 4.
Таблица 4
|
Номер опыта |
Число капель р-ра Na2S2O3 |
Число капель Н2О |
Число капель H2SO4 |
Общий объём р-ра (число капель) |
Относи-тельная конц-я Na2S2O3 |
Время течения реакции
|
Условная скорость реакции
|
|
1 |
4 |
8 |
1 |
13 |
с |
… |
… |
|
2 |
8 |
4 |
1 |
13 |
2с |
… |
… |
|
3 |
12 |
– |
1 |
13 |
3с |
… |
… |
Рассчитать условные скорости реакции во
всех трёх случаях. Начертить график зависимости скорости реакции от
концентрации реагирующих веществ ![]() . Сделать выводы.
. Сделать выводы.
Опыт 2. Влияние температуры на скорость реакции
Подготовить растворы для проведения опыта, для чего в четыре микропробирки поместить по 4 капли 2 н. раствора Na2S2O3 и по 8 капель дистиллированной воды. Пробирки со смесью поставить в штатив.
Наполнить на 2/3 объёма дистиллированной водой комнатной температуры стакан на 50 мл и поместить туда первую пробирку с раствором и термометр. Через несколько минут, когда температура воды и раствора в пробирке выровняются, записать показания термометра. Добавить в пробирку одну каплю 2 н. серной кислоты. Записать время от начала реакции до момента появления опалесценции раствора.
Поместить в стакан вторую пробирку с тиосульфатом натрия и нагреть воду до температуры на 10°С выше той, при которой находилась первая пробирка. Затем добавить в раствор каплю 2 н. серной кислоты и отметить время протекания реакции.
Аналогично поступить с третьей и четвёртой пробирками, каждый раз повышая температуру воды ещё на 10°С.
Полученные результаты занести в таблицу 5.
Результаты опытов представить в виде
графика, построенного в координатах ![]() . Сделать выводы о зависимости скорости от
температуры.
. Сделать выводы о зависимости скорости от
температуры.
По результатам опыта определить условную энергию активации данной реакции графическим способом, для чего необходимо составить вспомогательную таблицу (см. таблицу 6).
Таблица 5
|
Номер опыта |
Температура
|
Время реакции
|
Относительная скорость реакции
|
Во сколько раз изме-няется скорость реак-ции при повышении температуры на каж-дые 10°С |
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
Таблица 6
|
Номер опыта |
Температура |
1/Т |
Относительная скорость реакции
|
|
|
|
|
|
||||
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
Используя полученные данные, построить
график зависимости ![]() .
График должен представлять собой прямую линию, если точки разбросаны на
координатном поле, то их необходимо усреднить для получения линейной
зависимости.
.
График должен представлять собой прямую линию, если точки разбросаны на
координатном поле, то их необходимо усреднить для получения линейной
зависимости.
Условная энергия активации реакции ![]() определяется по
следующей формуле:
определяется по
следующей формуле:
![]() ,
,
где ![]() -
универсальная газовая постоянная;
-
универсальная газовая постоянная;
![]() - тангенс угла наклона графика к оси
абсцисс; определяется как отношение
- тангенс угла наклона графика к оси
абсцисс; определяется как отношение ![]() .
.
3 Контрольные вопросы
1. Что такое скорость химической реакции? От каких факторов она зависит?
2. Чем отличаются средняя и истинная скорость реакции?
3. В соответствии с законом действующих масс составьте выражение для скорости реакции:
а) протекающей в гомогенной системе 2NO + O2 → 2NO2;
б) протекающей в гетерогенной системе FeO(к) + CO(г) → Fe(к) + CO2(г).
4. Что такое константа скорости реакции? От каких факторов зависит её величина?
5. Зависит ли температурный коэффициент скорости реакции от значения энергии активации? Ответ обосновать.
6. Объясните правило Вант-Гоффа.
7. Что такое энергия активации? В каких единицах она выражается?
8. Напишите уравнение Аррениуса. Какую зависимость оно устанавливает?
9. Почему катализатор увеличивает скорость реакции?
Лабораторная работа №7. Химическое равновесие
Цель работы – исследование влияния изменения концентрации реагирующих веществ и температуры на химическое равновесие.
1 Теоретическое введение
При взаимодействии веществ в замкнутом объёме наряду с химической реакцией между исходными соединениями (прямая реакция) по мере образования продуктов начинается химическое взаимодействие между нами (обратная реакция), в результате которой снова образуются исходные компоненты:
![]() ,
,
где ![]() и
и
![]() - исходные
вещества;
- исходные
вещества;
![]() и
и ![]() - продукты реакции;
- продукты реакции;
![]() ,
, ![]() ,
, ![]() ,
, ![]() - стехиометрические коэффициенты;
- стехиометрические коэффициенты;
![]() - обозначает прямую реакцию;
- обозначает прямую реакцию;
![]() - обозначает обратную реакцию.
- обозначает обратную реакцию.
Через определённое время, которое зависят от условий химической реакции, скорость прямой реакции (количество молекул продуктов реакции, образующихся в единицу времени) уменьшается, а скорость обратной реакции (количество молекул этих продуктов, прореагировавших в единицу времени с образованием исходных веществ) увеличивается.
После уравнивания скоростей реакций наступает состояние химического равновесия, обозначаемого по схеме реакции. Число молекул веществ, составляющих химическую систему, перестает изменяться при постоянных внешних условиях. Реакции, одновременно протекающие в двух направлениях, называются обратимыми реакциями.
Химическая термодинамика позволяет предсказать концентрации реагентов в равновесной смеси, предвидеть и рассчитать максимальный выход продукта реакции, а также степень превращения исходных веществ в продукты.
Связь между равновесными концентрациями (или
парциальными давлениями) веществ, участвующих в реакции, выражается законом
действия масс, открытым в 1867 году Гульдбергом и Вааге. Для вышеприведенной
реакции при ![]()
![]() ,
,
где ![]() -
константа равновесия.
-
константа равновесия.
Если ![]() - реакция смещена в сторону образования
продуктов реакции. Если
- реакция смещена в сторону образования
продуктов реакции. Если ![]() - количество веществ эквивалентно. Если
- количество веществ эквивалентно. Если ![]() - реакция смещена в
сторону образования исходных веществ. Численные значения константы равновесия
зависят от того, в каких величинах используются в уравнении взаимодействующие
вещества. Это могут быть концентрации, парциальные давления, активности
компонентов и т. д.
- реакция смещена в
сторону образования исходных веществ. Численные значения константы равновесия
зависят от того, в каких величинах используются в уравнении взаимодействующие
вещества. Это могут быть концентрации, парциальные давления, активности
компонентов и т. д.
Константа равновесия реакции связана со стандартным изменением энергии Гиббса реакции следующим уравнением:
![]() ,
,
где ![]() -
энергия Гиббса реакции при постоянной температуре
-
энергия Гиббса реакции при постоянной температуре ![]() , кДж/моль;
, кДж/моль;
![]() - универсальная газовая постоянная;
- универсальная газовая постоянная;
![]() - термодинамическая температура, К;
- термодинамическая температура, К;
![]() - значение константы равновесия при
постоянной температуре
- значение константы равновесия при
постоянной температуре ![]() .
.
Переход из одного равновесного состояния в другое называется смешением химического равновесия. Для качественного определения направления сдвига равновесия реакции используется принцип Ле Шателье – Брауна: если на систему, находящуюся в состоянии равновесия, оказывают внешнее воздействие, то в системе происходит такое смещение равновесия, которое ослабляет это воздействие. Например, при увеличении температуры системы равновесие процесса будет смещаться в сторону эндотермической реакции (идущей с поглощением теплоты), а при понижении – в сторону экзотермической (идущей с выделением теплоты). Если в реакции участвуют газы, например, N2 + 3H2 ↔ 2NH3, то увеличение общего давления в системе смещает равновесие в сторону прямой реакции образования аммиака, так как при этом происходит уменьшение числа молекул (4 моля газа в левой части уравнения и 2 моля газа – в правой).
2 Экспериментальная часть
Опыт 1. Влияние изменения концентрации реагирующих веществ на смещение химического равновесия
Приготовить четыре пробирки. В одну из них налить приблизительно одну треть пробирки раствора хлорида железа (III) и добавить равный объем раствора роданида калия. Раствор перемешать. Получить равномерно окрашенный в красноватый цвет исходный раствор роданида железа (III). Разлить полученный раствор приблизительно поровну по всем четырем пробиркам, одну пробирку сохранить в качестве контрольной для сравнения. В растворе идет обратимая реакция
FeCl3 + 3KSCN ↔ Fe(SCN)3 + 3KCl.
Роданид железа (III) придает раствору красную окраску, по изменению интенсивности которой можно судить об изменении концентрации роданида железа (III), т. е. о смещении равновесия вправо или влево.
Во вторую пробирку добавить микрошпателем кристаллик FeCl3, в третью – кристаллик KSCN, в четвертую – несколько кристалликов KCl. Отметить изменение интенсивности окраски в каждом случае, сравнивая с раствором в контрольной пробирке. Заполнить таблицу 7.
Таблица 7
|
Номер пробирки |
Добавленное вещество |
Изменение интенсивности окраски (ослабление, усиление) |
Направление смещения равновесия |
|
1 |
Контроль |
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
Написать выражение константы равновесия данного обратимого процесса. Объяснить смещение равновесия при изменении концентрации реагирующих веществ, применив принцип Ле Шателье – Брауна.
Опыт 2. Влияние изменения температуры на смещение химического равновесия
Налить приблизительно половину пробирки раствора крахмала, добавить 2 капли раствора иода. Наблюдать появление синей окраски. После перемешивания отлить половину раствора в другую пробирку. Нагревать одну из них в пламени горелки, не доводя до кипения. Наблюдать изменение окраски раствора. Затем охладить эту же пробирку проточной водой из-под крана. Наблюдать появление синей окраски снова.
При взаимодействии крахмала с иодом образуется сложное соединение синего цвета (иод - крахмал). Эта реакция экзотермическая, ее можно представить следующей схемой:
Иод + Крахмал ↔ Иод – Крахмал –![]() .
.
Объяснить изменение окраски и смещение равновесия при нагревании и охлаждении, исходя из принципа Ле Шателье – Брауна.
3 Контрольные вопросы
1. Какие реакции называются обратимыми?
2. Что такое химическое равновесие?
3. Что представляет собой математическое выражение для константы химического равновесия?
4. От каких факторов зависит константа химического равновесия?
5. По какому признаку классифицируют реакции на эндо- и экзотермические?
6. Что называется сдвигом химического равновесия?
7. Сформулируйте принцип Ле-Шателье.
8. Напишите выражение константы равновесия гетерогенной системы СаО(к) + 3С(к) ↔ СаС2(к) + СО(г).
Лабораторная работа №8. Гидролиз солей
Цель работы – изучение различных типов реакций гидролиза солей, факторов, влияющие на гидролиз солей.
1 Теоретическое введение
При растворении многих солей в воде образующиеся при диссоциации ионы способны вступать во взаимодействие с молекулами воды. При этом происходит смещение равновесия при диссоциации воды, связывание ионов Н+ или ОН-, в результате чего изменяется рН раствора.
В общем случае процесс обмена ионами между водой и растворёнными в ней солями называется гидролизом.
Соли очень слабых кислот и очень слабых оснований подвергаются полному гидролизу и в растворах существовать не могут. Соли, образованные сильными основаниями и сильными кислотами, не содержат ионов, способных связать ионы водорода и гидроксила, поэтому они практически гидролизу не подвергаются.
Если один из ионов воды участвует в образовании слабого электролита, то другой ион накапливается в растворе и чаще всего обусловливает изменение рН среды.
Существует несколько видов гидролиза солей.
1. Гидролиз солей, образованных сильным основанием и слабой кислотой (например: CH3COONa, K2SO3, Na2CO3, Na2S).
Гидролиз этих солей обусловлен связыванием ионов водорода в слабый электролит. Так, гидролиз ацетата натрия может быть представлен уравнениями:
CH3COONa + H2O ↔ CH3COOH + NaOH,
CH3COO- + Na+ + H2O ↔ CH3COOH + Na+ + OH-,
CH3COO- + H2O ↔ CH3COOH + OH- (pH > 7).
Соли, образованные слабой многоосновной кислотой, гидролизуются ступенчато. Гидролиз протекает в значительно большей мере по первой ступени. Это приводит к образованию кислых солей.
Na2S + H2O ↔ NaHS + NaOH,
2Na+ + S2- + H2O ↔ Na+ + HS- + Na+ + OH-,
S2- + H2O ↔ HS- + OH- (pH > 7).
Растворы солей, образованных сильным основанием и слабой кислотой, имеют щелочную реакцию среды.
2. Гидролиз солей, образованных слабым основанием и сильной кислотой (например: NH4Cl, CuSO4, Zn(NO3)2, AlCl3).
Гидролиз этих солей обусловлен связыванием гидроксид-ионов в слабый электролит. Так, гидролиз хлорида аммония может быть представлен уравнениями:
NH4Cl + H2O ↔ NH4OH + HCl,
NH![]() + Cl- + H2O ↔ NH4OH
+ H+ + Cl-,
+ Cl- + H2O ↔ NH4OH
+ H+ + Cl-,
NH![]() + H2O ↔ NH4OH + H+ (pH
< 7).
+ H2O ↔ NH4OH + H+ (pH
< 7).
Соли, образованные слабым многокислотным основанием, гидролизуются ступенчато. Процесс гидролиза протекает в большей мере по первой ступени, что приводит к образованию основных солей:
Zn(NO3)2 + H2O ↔ Zn(OH)NO3 + HNO3,
Zn2+ + 2NO![]() + H2O ↔ Zn(OH)+ + NO
+ H2O ↔ Zn(OH)+ + NO![]() + H+ + NO
+ H+ + NO![]() ,
,
Zn2+ + H2O ↔ Zn(OH)+ + H+ (pH < 7).
Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию среды.
3. Гидролиз солей, образованных слабым основанием и слабой кислотой.
Соли этого типа гидролизуются наиболее сильно, так как их ионы одновременно связывают ионы водорода и гидроксид-ионы воды. Например, гидролиз ацетата аммония может быть выражен уравнением:
CH3COONН4 + H2O ↔ CH3COOH + NН4OH.
Соли, образованные слабыми многокислотными основаниями и слабыми многоосновными кислотами, гидролизуются необратимо:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑,
поэтому не могут быть получены водные растворы таких солей, как Al(CO3)3, Cr2S3, Fe2S3 и др.
В зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания растворы солей этого типа могут иметь слабокислую или слабощелочную среду реакции, т. е. рН ≈ 7.
4. Соли, образованные сильным основанием и сильной кислотой (например: NaCl, K2SO4, KNO3 и др.), гидролизу не подвергаются, так как при их растворении взаимодействия ионов этих солей с водой не происходит. Поэтому в растворах этих солей рН = 7, т. е. реакция среды остаётся нейтральной.
Количественно гидролиз характеризуется степенью и
константой гидролиза. Степень гидролиза (![]() ) – это
отношение числа молекул, подвергшихся гидролизу (
) – это
отношение числа молекул, подвергшихся гидролизу (![]() ), к общему
числу растворенных молекул (
), к общему
числу растворенных молекул (![]() ):
):
![]() .
.
Выражение константы гидролиза для солей, гидролизующихся по аниону (KF, NaClO, Na2SO3, K3PO4, KCN и др.), имеет следующий вид:
![]() .
.
Имеется аналогичное выражение для солей, гидролизующихся по катиону (NH4Cl, CuSO4, AlCl3 и др.):
![]() ,
,
а также для солей, гидролизующихся по аниону и катиону (CH3COONH4, NH4F, Fe2S3 и др.):
![]() .
.
Чем больше константа гидролиза, тем сильнее соль гидролизуется. Константа и степень гидролиза связаны между собой следующим соотношением:
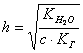 ,
,
где ![]() -
концентрация раствора соли, моль/л;
-
концентрация раствора соли, моль/л;
![]() - ионное произведение воды (при
температуре 25°С,
- ионное произведение воды (при
температуре 25°С, ![]() );
);
![]() - константа гидролиза;
- константа гидролиза;
![]() ,
, ![]() - константы диссоциации слабой кислоты и
слабого основания соответственно.
- константы диссоциации слабой кислоты и
слабого основания соответственно.
Степень гидролиза тем больше:
- чем больше ![]() , т. е. чем больше температура, так как
, т. е. чем больше температура, так как ![]() возрастает с
температурой;
возрастает с
температурой;
- чем меньше ![]() (
(![]() ), т. е. чем слабее кислота (основание),
которая образуется в результате гидролиза соли;
), т. е. чем слабее кислота (основание),
которая образуется в результате гидролиза соли;
- чем меньше концентрация соли, т. е. чем больше разбавлен раствор (для соли типа CH3COONH4 степень гидролиза не зависит от разбавления).
Таким образом, чтобы усилить гидролиз соли, надо разбавить раствор и нагреть его. Согласно закону действующих масс при введении в раствор одного из продуктов гидролиза равновесие сместится влево (гидролиз соли уменьшается). Наоборот, если удалять продукты гидролиза, то равновесие сместится вправо (гидролиз соли усиливается).
2 Экспериментальная часть
Опыт 1. Изучение различных видов гидролиза
В 4 пробирки налить по 10 капель: в первую – дистиллированной воды, во вторую – раствора карбоната натрия, в третью – раствора хлорида цинка, в четвёртую – раствора нитрата натрия. В каждую добавить по 1 капле лакмуса.
Сравнить окраску индикатора в воде и растворах солей. Какие из испытуемых растворов подверглись гидролизу? Написать уравнения реакций. Объяснить, чем обусловлена реакция среды в каждом случае.
Опыт 2. Сравнение гидролиза кислых и средних солей
В одну пробирку поместить 3 – 4 капли карбоната натрия, в другую – такое же количество раствора гидрокарбоната натрия. В обе пробирки добавить по одной капле фенолфталеина. Обратить внимание на различие окраски. Отсутствие окраски в растворе гидрокарбоната натрия говорит о незначительной степени гидролиза этой соли. Малиновое окрашивание раствора карбоната натрия указывает на гидролиз этой соли по первой ступени.
Составить молекулярные и молекулярно-ионные уравнения гидролиза карбоната натрия с образованием кислой соли. Сделать вывод о возможности образования кислых солей при гидролизе.
Опыт 3. Получение и гидролиз соли слабого основания и слабой кислоты
В пробирку внести 5 – 7 капель раствора сульфата алюминия и такое же количество раствора карбоната натрия. Отметить образование осадка гидроксида алюминия и выделение оксида углерода (IV). Составить молекулярные и молекулярно-ионные уравнения всех протекающих в опыте процессов.
Проверить, входит ли карбонат алюминия в состав осадка. Для этого подействовать концентрированным раствором соляной кислоты. Что наблюдается? Сделать вывод.
Опыт 4. Зависимость степени гидролиза от температуры
В пробирку внести 1 микрошпатель ацетата натрия, 5 – 7 капель дистиллированной воды и две капли фенолфталеина. Пробирку с раствором нагреть на спиртовке. Отметить изменение окраски раствора. Охладить раствор и отметить его обесцвечивание.
Составить уравнение гидролиза ацетата натрия при нагревании. Сделать вывод об обратимости процесса гидролиза.
Опыт 5. Образование основных солей при гидролизе
В пробирку внести 5 – 7 капель раствора сульфата меди (II) и приливать по каплям раствор карбоната натрия до образования светло-зеленого осадка основной соли меди (II). Отметить выделение оксида углерода (IV).
Составить молекулярные и молекулярно-ионные уравнения всех протекающих в опыте процессов.
3 Контрольные вопросы
1. Какие реакции называются реакциями гидролиза?
2. Какие соли подвергаются гидролизу и почему?
3. Почему не все соли гидролизуются?
4. В чем состоит полный гидролиз солей? Приведите примеры.
5. Какой величиной рН характеризуются растворы солей, подвергающихся гидролизу?
6. Как влияют температура и разбавление на гидролиз?
7. Почему не происходит гидролиз солей типа NaCl и K2SO4?
8. В каких случаях при гидролизе образуются: а) кислые соли; б) основные соли? Приведите по одному примеру на каждый случай с написанием уравнений гидролиза.
Лабораторная работа №9. Гальванические элементы
Цель работы – изучение физико-химических основ работы гальванического элемента.
1 Теоретическое введение
Электрохимические процессы – это гетерогенные окислительно-восстановительные процессы, сопровождающиеся возникновением электрического тока или протекающие под воздействием электрического тока на границе раздела: электрод – раствор или расплав электролита. Электрохимические реакции протекают в химических источниках электрической энергии: гальванических элементах, аккумуляторах, топливных элементах, при электрохимической коррозии металлов и сплавов, в процессах электролиза и др.
При погружении металла в раствор электролита, содержащий ионы этого металла, на границе раздела «металл - раствор» устанавливается подвижное равновесие:
![]()
или, с учетом гидратации ионов:
![]() .
.
Этому равновесию соответствует определенный скачок потенциала, называемый равновесным электродным потенциалом. Электродный потенциал можно вычислить по уравнению Нернста:
![]() ,
,
где ![]() -
стандартный электродный потенциал, В;
-
стандартный электродный потенциал, В;
![]() - количество электронов в электродной
реакции;
- количество электронов в электродной
реакции;
![]() - активная концентрация ионов металла,
моль/л.
- активная концентрация ионов металла,
моль/л.
Активная концентрация иона может быть рассчитана по формуле
![]() ,
,
где ![]() -
молярная концентрация электролита, моль/л;
-
молярная концентрация электролита, моль/л;
![]() - коэффициент активности иона.
- коэффициент активности иона.
Стандартные потенциалы металлических электродов определяют по отношению к стандартному водородному электроду, потенциал которого условно принят равным нулю. Если концентрация ионов отличается от стандартных условий, потенциал водородного электролита может быть вычислен по уравнению Нернста. Для растворов слабых электролитов
![]() .
.
Если известен рН раствора, то потенциал водородного электрода может быть рассчитан по формуле
![]() .
.
Из двух любых электродов, имеющих различные потенциалы, можно составить гальваническую цепь или собрать гальванический элемент. Конструктивно гальванический элемент можно представить как систему, состоящую из двух электродов, погруженных в раствор электролитов. Для замыкания внутренней электрической цепи растворы соединяют электрическим мостиком. Внешняя цепь замыкается металлическим проводником. Измерительные приборы включаются во внешнюю цепь.
Разность потенциалов катода и анода при силе тока во внешней цепи близкой к нулю составляет электродвижущую силу (ЭДС) элемента
![]() .
.
Вычислив по уравнению Нернста потенциалы катода и анода, можно рассчитать теоретическое значение ЭДС элемента.
При работе гальванического элемента на аноде протекают реакции окисления, на катоде – восстановления.
2 Экспериментальная часть
Опыт 1. Определение ЭДС цинк-медного гальванического элемента
Приготовить 0,005 М раствор ZnSO4 путем разбавления 0,05 М раствора этой соли и, соответственно, раствор 0,1 М CuSO4 разбавлением 0,5 М раствора. Растворы готовить следующим образом. Отмерить пипеткой или мерным цилиндром расчетное количество раствора сульфата цинка, перенести в мерную колбу на 50 мл, довести дистиллированной водой до метки и перемешать. Аналогично приготовить и раствор сульфата меди. Растворы солей цинка и меди налить отдельно и стаканчики на 50 мл.
Собрать гальванический элемент, как показано на рисунке 3. Для этого погрузите цинковую пластину в раствор сульфата цинка, а медную – в раствор сульфата меди. Для замыкания внутренней цепи элемента солевой мостик в виде изогнутой трубки с гелем, содержащим хлорид калия, опустить в раствор солей. Электроды с помощью проводов подключить к высокоомному входу потенциометра. Измерить разность потенциалов электродов, которая должна соответствовать практическому значению ЭДС элемента.
 Рассчитать
теоретическое значение ЭДС данного элемента по уравнению Нернста, учитывая, что
коэффициент активности ионов цинка в 0,005 М растворе сульфата цинка
Рассчитать
теоретическое значение ЭДС данного элемента по уравнению Нернста, учитывая, что
коэффициент активности ионов цинка в 0,005 М растворе сульфата цинка
![]() ,
а коэффициент активности ионов меди в 0,1 М растворе сульфата меди
,
а коэффициент активности ионов меди в 0,1 М растворе сульфата меди ![]() . Рассчитать
относительную ошибку опыта. Написать схему гальванического элемента и уравнения
электродных реакций.
. Рассчитать
относительную ошибку опыта. Написать схему гальванического элемента и уравнения
электродных реакций.
Опыт 2. Определение ЭДС концентрационного гальванического элемента
Приготовить 0,01 М раствора сульфата меди (II)
из 0,05 М раствора. Для этого расчётное количество 0,05 М раствора сульфата меди (II) отмерить пипеткой или мерным цилиндром, перенести в
мерную колбу на 50 мл и довести до метки дистиллированной водой. В качестве
второго раствора взять приготовленный в предыдущем опыте 0,1 М раствор сульфата меди (II). Оба раствора налить в стаканчики на 50 мл и собрать
гальванический элемент, используя в качестве электродов две медные пластины.
Измерить практическое значение ЭДС элемента. Рассчитать потенциал медного
электрода в растворе с меньшей концентрацией, учитывая, что коэффициент
активности ионов для 0,01 М раствора сульфата меди (II)
![]() . Потенциал медного электрода в 0,1 М растворе сульфата меди взять из первого опыта. Сопоставить величины двух медных электродов.
Определить анод и катод. Рассчитать теоретическое значение ЭДС. Вычислить
относительную ошибку опыта. Написать схему гальванической цепи. Составить
уравнения реакций. Сделать вывод о том, до каких пор возможна работа
гальванического элемента.
. Потенциал медного электрода в 0,1 М растворе сульфата меди взять из первого опыта. Сопоставить величины двух медных электродов.
Определить анод и катод. Рассчитать теоретическое значение ЭДС. Вычислить
относительную ошибку опыта. Написать схему гальванической цепи. Составить
уравнения реакций. Сделать вывод о том, до каких пор возможна работа
гальванического элемента.
3 Контрольные вопросы
1. Что называется гальваническим элементом?
2. Что называется электродным потенциалом металла и неметалла?
3. Изобразите схему водородного электрода. С какой целью он применяется?
4. Что называется стандартным электродным потенциалом?
5. Что такое электродвижущая сила элемента?
6. Как вычислить электродный потенциал?
7. Составьте схемы гальванических элементов для определения стандартных электродных потенциалов электродов Al / Al3+ и Cu / Cu2+ в паре со стандартным водородным электродом. Укажите стрелками направление движения электронов во внешней цепи.
8. Химически чистый цинк почти не реагирует с соляной кислотой. При добавлении к кислоте нитрата свинца (II) происходит энергичное выделение водорода. Объясните это явление.
Лабораторная работа №10. Электролиз
Цель работы – изучение химических процессов электролиза водных растворах электролитов.
1 Теоретическое введение
Электролизом называются окислительно-восстановительные процессы, протекающие на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
Электролиз осуществляют с помощью источников постоянного тока в устройствах, называемых электролизерами. Электрод, соединённый с отрицательным полюсом источника тока, называют катодом, а электрод, подключённый к положительному полюсу, анодом. На аноде протекают реакции окисления, на катоде – восстановления.
Процессы электролиза могут проходить с растворимым или нерастворимым анодом. Металл, из которого сделан анод, непосредственно участвует в реакции окисления, т. е. отдаёт электроны и в виде ионов переходит в раствор или расплав электролита. Типичным случаем электролиза с растворимым анодом является электролиз водного раствора соли, содержащей ион металла, из которого изготовлен анод. Например, электролиз раствора NiCl2 с никелевым анодом:
NiCl2 = Ni2+ + 2Cl-,
реакция на катоде: Ni2+ +2ē = Ni,
реакция на аноде: Ni –2ē = Ni2+.
Нерастворимые аноды сами не принимают непосредственное участие в окислительном процессе, а являются только переносчиками электронов. В качестве нерастворимых анодов могут быть использованы графит, инертные металлы, такие как платина, иридий и др. На нерастворимых анодах идёт реакция окисления какого-либо восстановителя, находящегося в растворе.
Отрицательные ионы окисляются на аноде в определённой
последовательности. По активности к окислению аниона могут быть расположены в
ряд: S![]() ,
I
,
I![]() ,
Br
,
Br![]() ,
Cl
,
Cl![]() ,
OH
,
OH![]() , (H2O),
SO
, (H2O),
SO![]() ,
NO
,
NO![]() ,
SO
,
SO![]() ,
NO
,
NO![]() .
.
При характеристике катодных реакций следует иметь в виду, что последовательность восстановления ионов металлов зависит от положения металла в ряду напряжений и от концентрации их в растворе. Если в растворе одновременно находятся ионы двух или нескольких металлов, то в первую очередь восстанавливаются ионы того металла, который имеет более положительный потенциал. Если потенциалы двух металлов близки, то наблюдается совместные выделение двух металлов, т. е. образуется сплав. В водных растворах на катоде совместно с такими металлами, как цинк, хром, марганец и др. может восстанавливаться также водород. В растворах, содержащих ионы щелочных и щелочноземельных металлов (стандартный потенциал которых отрицательнее, чем – 1,5 В), на катоде при электролизе выделяется только водород.
Примеры электролиза с нерастворимым анодом.
1. Электролиз раствора хлорида калия
KCl = K+ + Cl-.
Под действием электрического поля ионы калия будут
двигаться к катоду, но восстанавливаться не будут, так как потенциал калия
очень отрицателен (![]() В). В этом случае на катоде будет
восстанавливаться водород из воды. На аноде будут окисляться ионы хлора:
В). В этом случае на катоде будет
восстанавливаться водород из воды. На аноде будут окисляться ионы хлора:
на катоде: 2Н2О +2ē = Н2 + 2ОН-,
на аноде: 2Cl- –2ē = Cl2.
2. Электролиз раствора серной кислоты
H2SO4 = 2H+ +
SO![]() .
.
Из положительных ионов в растворе
содержатся только ионы водорода. Они и будут восстанавливаться на катоде. Ионы
SO![]() окисляться на аноде не будут, так как сера в кислотном остатке находится в
высшей степени окисления. В водном растворе в этом случае на аноде идёт
окисление воды:
окисляться на аноде не будут, так как сера в кислотном остатке находится в
высшей степени окисления. В водном растворе в этом случае на аноде идёт
окисление воды:
на катоде: 4Н+ +4ē = 2Н2,
на аноде: 2Н2О –4ē = О2 + 4Н+.
Суммарная реакция электролиза: 2Н2О = 2Н2 + О2.
Таким образом, при электролизе раствора серной кислоты на электродах идёт разложение воды.
Количество окисленного или восстановленного на электродах вещества может быть рассчитано согласно закону Фарадея:
![]() ,
,
где ![]() -
масса вещества, г;
-
масса вещества, г;
![]() - эквивалентная масса, г/моль;
- эквивалентная масса, г/моль;
![]() - сила тока, А;
- сила тока, А;
![]() - время, с;
- время, с;
![]() - число Фарадея,
- число Фарадея, ![]() Кл/моль.
Кл/моль.
Если при электролизе на электродах выделяются вещества в газообразном состоянии, то объём можно подсчитать по формуле
![]() ,
,
где ![]() -
объём газа, л;
-
объём газа, л; ![]() -
эквивалентный объём газа, л/моль.
-
эквивалентный объём газа, л/моль.
2 Экспериментальная часть
Опыт 1. Электролиз раствора хлорида натрия
Закрепить электролизер, которым служит U-образная стеклянная трубка, на штативе. Налить в неё на 2/3 объёма раствор хлорида натрия. Вставить в оба отверстия трубки электроды и включить постоянный ток напряжением 4 – 6 В. Электролиз вести 3 – 5 мин.
После этого добавить в раствор к катоду несколько капель фенолфталеина, а в раствор к аноду несколько капель раствора иодида калия. Наблюдать окрашивание раствора у катода и у анода. Какие процессы проходят на катоде и на аноде? Написать уравнения реакций, происходящих на катоде и на аноде. Как изменился характер среды в растворе у катоде?
Опыт 2. Электролиз раствора сульфата натрия
В электролизер налить раствор сульфата натрия. В раствор к катоду и к аноду прилить несколько капель нейтрального лакмуса. Включить ток и через 3 – 5 мин наблюдать изменение окраски электролита в прикатодном и в прианодном пространстве.
Написать уравнения реакций, происходящих на катоде и на аноде. Как изменился характер среды в прикатодном и прианодном пространстве раствора?
Опыт 3. Электролиз раствора сульфата меди (II)
В электролизер налить раствор сульфата меди (II). Пропустить ток в течение 5 – 10 мин до появления заметного слоя розовой меди на катоде. Составить уравнение электродных реакций.
Опыт 4. Электролиз раствора сульфата меди (II) c использованием растворимого анода
Использовать электролизер с раствором и электродами после третьего опыта. Переключить полюса электродов на клеммах источника тока. После этого электрод, который был катодом, теперь будет являться анодом, а электрод, бывший анодом, будет катодом. Таким образом, электрод, покрытый в предыдущем опыте медью, будет выполнять в данном опыте роль растворимого анода. Электролиз проводить до полного растворения меди на аноде.
Что происходит на катоде? Написать уравнения реакций.
3 Контрольные вопросы
1. Что называется электролизом?
2. Нарисуйте схему лабораторного варианта электролизера (электролитической ячейки).
3. Что называется катодом и анодом?
4. Какие процессы происходят на катоде и аноде?
5. Какой из металлов: медь, никель, кобальт, цинк – может быть использован в качестве материала для анода в гальваническом элементе?
6. Написать уравнение реакций катодного и анодного процессов, протекающих при электролизе с графитовыми электродами водных растворов: хлорида никеля (II), нитрата кальция, гидроксида натрия, сульфата железа (II), серной кислоты, нитрата серебра.
7. Какие продукты будут выделяться на катоде и аноде на первой стадии электролиза водных растворов на угольных электродах, если в электролизере находится смесь следующих солей: CuSO4 и KCl; NiSO4 и NaCl; FeCl3 и Na2SO4; SnCl2 и KI?
8. Написать уравнения реакций, протекающих на электродах при электролизе раствора: сульфата никеля с никелевыми электродами; нитрата серебра с серебряными электродами; хлорида меди с медными электродами.
Список литературы
1. Коровин Н.В., Масленникова Г.Н., Мингулина Э.И., Филиппов Э.Л. Общая химия. – М.: Высшая школа, 2005.
2. Харин А.Н., Катаева Н.А., Харина Л.Г. Курс химии. – М.: Высшая школа, 1983.
3. Глинка Н.Л. Общая химия. – Л.: Химия, 1999.
4. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. – М.: АСТ-Астрель, 2004.
5. Богатиков А.Н., Красицкий В.А., Лапко К.Н. Сборник задач, вопросов и упражнений по общей и неорганической химии. – Минск: Электронная книга БГУ, 2002.
6. Задачи и упражнения по общей химии. Под. ред. Коровина Н.В. – М.: Высшая школа, 2004.
7. Ольшевский М.В., Гурылёв В.В., Диденко С.В. и др. Лабораторный практикум по химии. – Владимир: Владим. ГУ, 2004.
8. Колотова Г.К., Полякова С.Н., Димиденок Ж.А. Лабораторный практикум по общей и неорганической химии. – Благовещенск: Изд-во ДальГАУ, 2005. – 191с.
9. Коровин Н.В., Мингулина Э.И., Рыжова Н.Г. Лабораторные работы по химии. – М.: Высшая школа, 2007. – 256 с.
10. Ахметов Н.С., Азизова М.К., Бадыгина Л.И. Лабораторные и семинарские занятия по общей и неорганической химии. – М.: Высшая школа, 2003. – 367 с.
Содержание
1 Введение 3
2 Лабораторная работа №1. Основные классы неорганических соединений 4
3 Лабораторная работа №2. Определение эквивалентных масс простых и сложных веществ 13
4 Лабораторная работа №3. Окислительно-восстановительные реакции 18
5 Лабораторная работа №4. Комплексные соединение 23
6 Лабораторная работа №5. Энергетика химических процессов 28
7 Лабораторная работа №6. Кинетика химических реакций 32
8 Лабораторная работа №7. Химическое равновесие 37
9 Лабораторная работа №8. Гидролиз солей 40
10 Лабораторная работа №9. Гальванические элементы 43
11 Лабораторная работа №10. Электролиз 46
12 Список литературы 50
Основной план 2011 г., поз. 11 .