Некоммерческое акционерное общество
АЛМАТИНСКИЙ УНИВЕРСИТЕТ ЭНЕРГЕТИКИ И СВЯЗИ
Кафедра промышленной теплоэнергетики
ХИМИЯ
Конспект лекций
для студентов специальностей
5В071800 – Электроэнергетика,
5В081200 – Энергообеспечение сельского хозяйства
Алматы 2014
СОСТАВИТЕЛЬ: Султанбаева Б.М., Каленова Ж.А. Химия. Конспект лекций для студентов специальностей 5В071800 - Электроэнергетика, 5В081200 -Энергообеспечение сельского хозяйства. -Алматы: АУЭС, 2014.- 37с.
Конспект лекций по химии предназначен для бакалавров специальностей 5В071800 - Электроэнергетика, 5В081200 – Энергообеспечение сельского хозяйства и подготовлен в соответствии с образовательным стандартом для технических направлений по курсу «Химия».
Ил. 7, библиогр. - 9 назв.
Рецензент: канд.техн.наук М.В. Башкиров
Печатается по плану издания некоммерческого акционерного общества «Алматинский университет энергетики и связи» 2014 г.
© НАО «Алматинский университет энергетики и связи», 2014 г.
Введение
Химия относится к числу естественных наук, изучающих окружающий нас мир со всем богатством его различных форм и многообразием происходящих в нем явлений. Глубокое понимание законов химии и их применение позволяет как совершенствовать существующие, так и создавать новые процессы, машины, установки и приборы.
Для развития новой техники, космонавтики, ядерной энергетики, автоматики, микроэлектроники нужен целый арсенал разнообразных веществ, которых нет в природе: полимеры и полупроводники, сверхчистые и сверхтвердые, сверхпроводящие, жаростойкие и другие вещества. Современная химия решает эти задачи и создает новые методы обработки и получения новых материалов.
Настоящий конспект лекций предназначен для бакалавров, изучающих химию в объеме двух кредитов. Содержание конспекта лекций соответствует учебной программе курса химии и состоит из 8 блоков, включающих основные разделы неорганической и общей химии: основные понятия и законы химии, строение атома и периодическая система Д.И.Менделеева, химическая связь и строение молекул, химическая кинетика и химическое равновесие, химическая термодинамика, растворы, окислительно-восстановительные реакции и электрохимические процессы, химия металлов, коррозия и защита металлов от коррозии.
Целью данной методической разработки является создание у студентов расширенной теоретической базы в области неорганической и общей химии и обучение их умению применять полученные знания на практике. В конспект лекций внесены основные понятия и законы, формулы и уравнения реакций. Для закрепления лекционного материала рекомендуется решать практические задания и расчетные задачи по химии.
Данный конспект лекций поможет бакалавру при самостоятельном изучении курса «Химия».
1 Лекция №1. Основные понятия и законы химии
Содержание лекции: основные понятия химии, основные законы химии.
Цель лекции: изучить важнейшие понятия и основные законы химии, ознакомить с различными способами их применения в расчетах.
1.1 Основные химические понятия
Химический элемент – это совокупность атомов с одним и тем же зарядом ядра, равным порядковому номеру элемента в периодической системе.
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Каждому химическому элементу соответствует определенный вид атомов.
Молекула – наименьшая частица индивидуального вещества, способная к самостоятельному существованию, обладающая его основными химическими свойствами и состоящая из одинаковых или различных атомов.
Если молекула состоит из одного вида атомов, то вещество называется простым или элементарным (H2, O2 и т.д.). Молекула вещества, состоящая из разных атомов, образует сложное вещество (CO, H2O и т.д.).
Атомная единица массы (а.е.м.) – 1/12 часть массы атома изотопа углерода с массовым числом 12 (основного изотопа природного углерода).
а.е.м. = 1/12 · m(12C) = 1,66057 · 10-24 г. (1.1)
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12С.
Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12С. Mr равна сумме относительных атомных масс всех элементов с учетом индексов.
Количество вещества – это число структурных элементов (атомов, молекул, ионов и др.) в системе. Единица измерения – моль.
 .
(1.2)
.
(1.2)
Моль – это количество вещества системы, которое содержит столько определенных структурных элементов (молекул, атомов, ионов, электронов и т.д.), сколько атомов содержится в 0,012 кг изотопа углерода 12С.
Молярная масса – масса одного моль вещества, численно равная Mr, но выраженная в г/моль, кг/моль.
1.2 Основные законы химии
Закон сохранения массы (М.В. Ломоносов, 1748 г.; А. Лавуазье, 1789 г.):
масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон постоянства состава (Ж. Пруст, 1808 г.): всякое чистое вещество, независимо от способа его получения, имеет постоянный количественный и качественный состав.
Этот закон справедлив только для жидких и газообразных соединений с постоянной молекулярной структурой (например, SO2, SO3, NH3, N2H4, CH4, C6H6), называемых дальтонидами. Для соединений с ионной и атомной кристаллической решеткой этот закон неприменим. Такие соединения называются бертоллидами, их состав зависит от условий получения.
Закон кратных отношений (Д. Дальтон, 1803 г.): если 2 элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
N2O, N2O3, NO2 (N2O4), N2O5.
Число атомов кислорода в молекулах этих соединений, приходящиеся на два атома азота, относятся между собой как 1 : 3 : 4 : 5.
Закон эквивалентов (Рихтер, 1792 - 1800 г.). Эквивалент – это реальная или условная частица вещества, которая эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону – в данной окислительно-восстановительной реакции.
Для нахождения эквивалента вещества используют понятие фактор эквивалентности – число, показывающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону – в данной окислительно-восстановительной реакции:
fэкв = ![]() . (1.3)
. (1.3)
Основность вещества (z) равна:
1) для кислот – числу атомов водорода H+ в кислоте:
fэкв (HNO3) = 1;
fэкв (H3PO4) = ![]() ;
;
2) для оснований – числу гидроксильных групп OH-:
fэкв (NaOH) = 1; fэкв (Ca(OH)2)
= ![]() ;
;
3) для солей и оксидов-произведению числа ионов металла на его заряд:
fэкв (Na3PO4)
= ![]() .
.
Молярная масса эквивалента вещества равна:
Mэкв = fэкв · М. (1.4)
Используя определение молярной массы эквивалента, можно сформулировать закон эквивалентов. Массы реагирующих веществ относятся между собой как молярные массы их эквивалентов.
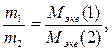 (1.5)
(1.5)
где m1 и m2 - массы реагирующих веществ;
Мэкв(1) и Мэкв(2) - молярные массы их эквивалентов.
Молярную массу эквивалента простого вещества (элемента) рассчитывают по формуле:
Мэкв(Э) = М / В, (1.6)
где М - молярная масса элемента;
В - валентность элемента.
Молярная масса эквивалента сложного вещества (кислоты, основания, соли) рассчитывается по формуле:
Мэкв = М / В · n, (1.7)
где B - валентность функциональной группы (H+, OH-, Men+);
n - число вступивших в реакцию функциональных групп.
Эквивалентный объем, Vэкв – объем, занимаемый одним моль эквивалента вещества при данных условиях.
Как известно, моль любого газа при нормальных условиях (T = 273 K, P = 101,3 кПа) занимает объем, равный 22,4 л, этот объем называется молярным объемом Vм. Исходя из этой величины, можно рассчитать объем одного моль эквивалента газа (Vэкв, [л/моль]) при нормальных условиях:
Vэкв = fэкв · Vм. (1.8)
Закон объемных отношений (Гей-Люссак, 1808 г.): объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа
2H2 + O2 = 2H2O.
2 объема 1 объем 2 объема водяного пара
Закон Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же количество молекул.
Из закона Авогадро следуют 3 вывода:
1) 1 моль любого вещества содержит одинаковое число молекул, равное постоянной Авогадро NA = 6,02 ∙ 1023;
2) при нормальных условиях (T = 273 K, P = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л, называемый молярным объемом Vм;
3) массы различных газов, занимающих одинаковые объемы, относятся между собой как их молярные массы:
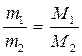 при
при
![]() (1.9)
(1.9)
Отношение ![]() называется относительной
плотностью первого газа по второму и обозначается D.
Она равна отношению молярной массы одного газа к молярной массе другого:
называется относительной
плотностью первого газа по второму и обозначается D.
Она равна отношению молярной массы одного газа к молярной массе другого:
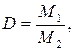
![]() , (1.10)
, (1.10)
где M1, M2 – соответственно молярные массы 1-го и 2-го газа.
2 Лекция №2. Строение атома. Периодический закон и периодическая система элементов Д.И. Менделеева
Содержание лекции: развитие представлений об атоме и его строении, квантово-механическая теория строения атома, периодический закон и периодическая система элементов Д.И. Менделеева, изменение важнейших свойств элементов периодической системы с позиций строения атома.
Цель лекции: изучить основные этапы развития представлений о строении атома; дать представление об атомной орбитали, квантовых числах; ознакомить с основными принципами распределения электронов в атоме; изучить структуру периодической системы, характер изменения некоторых свойств атомов элементов и их соединений.
2.1 Основные представления о строении атома и ядра
В 1904 году Д. Томсон предложил модель строения атома, согласно которой атом можно представить в виде положительно заряженной сферы одинаковой плотности по всему объему диаметром порядка 0,1 нм.
В 1910 г. Резерфорд предложил ядерную планетарную модель атома, состоящего из тяжелого ядра, вокруг которого двигаются по орбитам электроны, подобно планетам солнечной системы. Однако, как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
Датский учёный Н. Бор (1913 г.), используя модель Резерфорда и теорию Планка, предложил первую квантовую модель строения атома водорода, согласно которой электроны двигаются вокруг ядра не по любым, а лишь по разрешённым орбитам, на которых электрон обладает определёнными энергиями. При переходе электрона с одной орбиты на другую атом поглощает или испускает энергию в виде квантов. Теория Бора позволила рассчитать энергию электронов, значения квантов энергии, испускаемых при переходе электрона с одного уровня на другой. Но теория Бора не смогла объяснить поведение электрона в магнитном поле, оказалась непригодной для многоэлектронных атомов.
2.2 Волновая теория строения атома
В 1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон, как и другие микрочастицы, характеризуется корпускулярно – волновой двойственностью. Де Бройль предложил уравнение, связывающее длину волны λ электрона с массой m и скоростью υ:
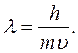 (2.1)
(2.1)
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределённости, согласно которому положение и импульс движения микрочастицы принципиально невозможно определить в любой момент времени с абсолютной точностью.
Э. Шредингер (Австрия) в 1926 г. вывел математическое описание поведения электрона в атоме. Сущность его заключается в том, что движение электронов в атоме описывается волновым уравнением, а определение местоположения электрона производится по вероятностным принципам.
Быстро движущийся электрон, обладающий свойствами волны, может находиться в любой части пространства, окружающего ядро, и совокупность различных его положений рассматривается как электронное облако с определённой плотностью отрицательного заряда.
Атомная орбиталь (АО) или электронное облако – это пространство вокруг ядра, в котором вероятность пребывания электрона составляет не менее 90%. АО могут различаться размерами, формой, ориентацией в пространстве. Электронное облако – это квантово – механическая модель движения электрона в атоме.
2.3 Квантовые числа
Главное
квантовое число n определяет
энергию электрона на энергетическом уровне и размер атомной орбитали. Оно может
принимать целочисленные значения от 1 до ![]() (практически от 1 до 7 соответственно
номеру периода, в котором находится элемент). Чем больше n,
тем больше энергия электрона и размер атомной орбитали (электронного облака).
(практически от 1 до 7 соответственно
номеру периода, в котором находится элемент). Чем больше n,
тем больше энергия электрона и размер атомной орбитали (электронного облака).
Состояние электрона, характеризующееся определённым значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме. Энергетические уровни обозначают прописными буквами:
- значение n : 1 2 3 4 5 6 7;
- обозначение: K L M N O P Q.
Орбитальное квантовое число l характеризует форму атомной орбитали (электронного облака) и энергию электрона на энергетическом подуровне. Состояния электрона, характеризующиеся различными значениями орбитального квантового числа l принято называть энергетическими подуровнями электрона в атоме (подоболочками ).
Как и n, l квантуется, т.е. изменяется только целочисленно, принимая значения от 0 до (n - 1), где n – главное квантовое число, всего n значений.
Энергетические подуровни обозначают буквами:
- значение l : 0 1 2 3 4 5;
- обозначение подуровня: s p d f g h.
Число подуровней равно номеру уровня.
Электроны с орбитальным квантовым числом 0 называются s - электронами. Орбитали имеют сферическую форму (см. рисунок 2.1, а).
Электроны с орбитальным квантовым числом 1 называются p – электронами. Орбитали имеют «гантелевидную» форму (см. рисунок 2.1, б).
Электроны с l = 2 называют d – электронами. Орбитали имеют форму сложной «четырехлепестковой» фигуры (см. рисунок 2.1, в).

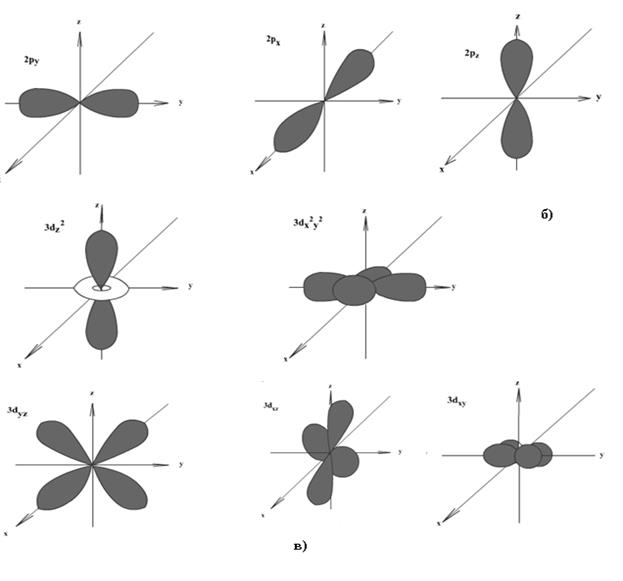
Рисунок 2.1 - Формы электронных облаков: a – s-АО; б - p-АО; в - d-АО
Электроны с l = 3 получили название f – электронов. Форма их орбиталей ещё сложнее, чем форма d – орбиталей.
В одном и том же энергетическом уровне энергия подуровней возрастает в ряду Es < Ep < Ed < Ef .
Магнитное квантовое число ml характеризует пространственную ориентацию атомной орбитали и связано с числом l, квантуется и принимает целочисленные значения, от – l до + l, включая ноль. Число значений ml равно 2l + 1. Это число орбиталей с данным значением l, т.е. число энергетических состояний, в которых могут находиться электроны данного подуровня.
Определим число состояний (орбиталей) электронов в соответствующем подуровне:
|
Подуровень |
Орбитальное квантовое число, l |
Магнитное квантовое число, ml |
Число орбиталей с данным l, 2l + 1 |
|
s p d f |
0 1 2 3 |
0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0 ,+1, +2,+3 |
1 3 5 7 |
Общее число состояний (орбиталей) на уровне равно n2. На рисунке 2.1 показаны формы и ориентация в пространстве 1s -, 2p -, 3d - орбиталей.
На основе представлений о квантовых числах можно уточнить определение атомной орбитали (АО): совокупность положений электрона в атоме, характеризуемых определёнными значениями квантовых чисел n, l и ml. Условно АО обозначают в виде клеточки – □. Соответственно, для s – подуровня одна АО – □, для p – подуровня три АО – □□□, для d– подуровня пять АО – □□□□□, для f – подуровня семь АО – □□□□□□□.
Спиновое квантовое число ms характеризует собственный момент количества движения электрона, обусловленный его движением вокруг своей
оси;
ms = ![]() . Знаки
«+» и «-» соответствуют различным направлениям вращения электрона: по
направлению или против часовой стрелки.
. Знаки
«+» и «-» соответствуют различным направлениям вращения электрона: по
направлению или против часовой стрелки.
2.4 Распределение электронов в атомах
Последовательность заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах определяется различными принципами.
Принцип наименьшей энергии: максимуму устойчивости системы соответствует минимум её энергии.
Следовательно, в соответствии с данным принципом электроны будут вначале располагаться на атомных орбиталях, имеющих минимальную энергию, в этом случае связь электронов с ядром наиболее прочная, и атомная система находится в состоянии максимальной устойчивости.
Порядок возрастания энергии атомных орбиталей в сложных атомах описывается правилом Клечковского: при увеличении заряда ядра атома заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях суммы (n + l) – в порядке возрастания n.
Соответственно правилу подуровни выстраиваются в следующий ряд:
![]()
Исключение составляют d - и f - элементы с полностью и наполовину заполненными подуровнями, у которых наблюдается так называемый провал электронов, например: Cu, Ag, Cr, Mo, Nb, Ru, Rh, Pt, Au.
Принцип запрета Паули: в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел.
Правило Гунда: устойчивому (невозбужденному) состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение их суммарного спинового числа максимально (| Σ ms |).
2.5 s-, p-, d-, f – элементы
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства:
s – элементы: заполняется электронами s – подуровень внешнего уровня. Валентными являются электроны внешнего уровня, способные участвовать в образовании химических связей в молекулах, ионах и т.д.
p – элементы: заполняется электронами p – подуровень внешнего уровня. Валентными являются s - и p - электроны внешнего уровня.
d – элементы: заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона (y 46Pd - ноль). К ним относятся элементы вставных декад больших периодов, расположенных между s - и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи).
f – элементы: заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы - семейство лантаноидов) и 7 - м (5f - элементы – семейство актиноидов) периодах периодической системы.
2.6 Периодический закон Д.И. Менделеева. Структура периодической системы. Периодичность изменения свойств элементов
Важнейшим событием химии в XIX веке было открытие периодического закона, сделанное в 1869 г. гениальным русским ученым Д. И. Менделеевым, современная формулировка которого: свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда атомных ядер.
Период представляет собой последовательный ряд элементов, в атомах которых происходит заполнение одинакового числа энергетических уровней. Номер периода указывает на число электронных слоев в атомах элементов.
Элементы периодической системы подразделяются на восемь групп. Группы элементов – это совокупность элементов с одинаковым количеством валентных электронов в атоме. Номер группы равен числу валентных электронов. Положение в группах s - и p - элементов определяется общим числом электронов внешнего слоя. Положение в группах d - элементов обусловливается общим числом s – электронов внешнего и d – электронов предвнешнего уровня.
|
p - элементы составляют так называемую главную подгруппу, или подгруппу А, d - элементы – побочную, или подгруппу В. f – элементы вынесены в отдельные строки, в соответствии с особенностями их конфигурации.
Атомный радиус элементов периодически изменяется в зависимости от
величины заряда ядра. В периоде атомные радиусы с ростом порядкового
номера уменьшаются (от щелочного металла к инертному газу). Объяснить это можно
тем, что с увеличением заряда ядра увеличивается с13-13-18ила кулоновского
притяжения электронов к ядру, которая превалирует над силами взаимного
отталкивания электронов. Наибольшее уменьшение радиусов наблюдается у элементов
малых периодов. В больших периодах у d - и ![]() f - элементов
наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома.
Это уменьшение называется соответственно d
- и f - сжатием.
В пределах каждой подгруппы элементов радиусы, как правило,
увеличиваются при увеличении номера периода (или z), так как
возрастает число энергетических уровней.
f - элементов
наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома.
Это уменьшение называется соответственно d
- и f - сжатием.
В пределах каждой подгруппы элементов радиусы, как правило,
увеличиваются при увеличении номера периода (или z), так как
возрастает число энергетических уровней.
Энергия ионизации - энергия, необходимая для отрыва электрона от невозбужденного атома, I, [кДж/моль, либо в эВ/атом (1 эВ = 1,6 ∙ 10-19 Дж)]. В результате ионизации атомы превращаются в положительно заряженные ионы: Э – ē = Э+.
Энергия ионизации и восстановительные свойства элементов в периоде возрастают слева направо. Наименьшие значения I имеют щелочные элементы, наибольшими значениями I характеризуются благородные газы, что обусловлено возрастанием заряда ядра и уменьшением размеров атомов. В главных подгруппах с увеличением порядкового номера энергия ионизации уменьшается, что обусловлено увеличением размеров атомов по мере увеличения числа электронных слоев.
Энергия сродства к электрону (сродство к электрону) - энергетический эффект присоединения электрона к нейтральному атому, E , [кДж/моль или эВ/атом]. Принимая электроны, атом превращается в отрицательно заряженный ион по схеме: Э + ē = Э- .
В периодах слева направо E и окислительные свойства элементов возрастают (исключение для N и P). В группах сверху вниз E, как правило, уменьшается.
Электроотрицательность. Согласно определению Малликена электроотрицательность атома может быть выражена: ЭО = 1/2 (I + E).
По периоду слева направо металлические и восстановительные свойства элемента уменьшаются, а неметаллические возрастают, так как увеличиваются энергия ионизации и электроотрицательность атома. По группе А сверху вниз металличность и восстановительные свойства элемента резко увеличиваются, а неметалличность уменьшается, так как резко возрастает атомный радиус.
3 Лекция №3. Химическая связь. Строение молекул
Содержание лекции: характеристики химической связи, теория метода валентных связей, гибридизация атомных орбиталей, понятие о методе молекулярных орбиталей, ионная связь, водородная связь, металлическая связь, химическая связь в твердых телах.
Цель лекции: определить причины образования и количественные характеристики химической связи; ознакомить с основными положениями метода валентных связей и метода молекулярных орбиталей, изучить механизм образования и свойства всех типов связи; дать представление о гибридизации атомных орбиталей.
3.1 Определение и характеристики химической связи
Химическая связь – это сложные протонно-электронные взаимодействия атомов, которые приводят к образованию молекул простых или сложных веществ или кристаллов.
Энергия связи, Есв – это количество энергии, которое нужно затратить на ее разрыв или количество энергии, выделяемое при образовании молекулы из атомов. Есв определяет прочность химической связи. Единица измерения энергии связи – кДж/моль (эВ/моль). Энергия химической связи изменяется в интервале 40 ÷ 400 кДж/моль.
Длина связи, dсв, [нм] – это расстояние между ядрами двух химически связанных атомов, когда силы притяжения между ними уравновешивают силы отталкивания, и система характеризуется минимальной энергией. dсв определяется экспериментально.
Валентный угол – угол между прямыми, соединяющими центры ядер атомов в молекуле. Валентными углами определяется пространственное строение молекул. Величины валентных углов зависят от природы атомов и характера связи.
В зависимости от характера распределений электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую.
3.2 Механизм образования ковалентной связи
Обменный механизм образования ковалентной связи заключается в том, что каждый из соединяющихся атомов предоставляет на образование общей электронной пары по одному неспаренному электрону. Электроны взаимодействующих атомов должны при этом иметь противоположные спины.
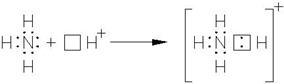
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что одна частица – донор – предоставляет на образование связи электронную пару, а вторая – акцептор – свободную орбиталь. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого.
Рассмотрим механизм образования иона аммония NH![]() .
В молекуле аммиака NH3 азот
имеет неподеленную пару электронов:
.
В молекуле аммиака NH3 азот
имеет неподеленную пару электронов:

У иона водорода свободна 1s - орбиталь, что можно обозначить как Н+. При сближении молекулы аммиака с ионом водорода двухэлектронное облако атома азота становится общим для азота и водорода, то есть превращается в молекулярное электронное облако. Возникает четвертая ковалентная связь. Заряд иона водорода при этом делокализуется между всеми атомами. Процесс образования иона аммония можно представить схемой:
3.3 Свойства ковалентной связи
Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной и характеризуется свойствами: полярность, насыщаемость, направленность.
Полярность ковалентной связи. Ковалентная связь, в которой обобществленная электронная плотность симметрична по отношению к ядрам взаимодействующих атомов, называется неполярной ковалентной связью. Такая связь реализуется в молекулах простых веществ, состоящих из одинаковых атомов (H-H, O=O, CI=CI, N≡N и т. д.). Она также может проявляться между разными атомами, обладающими одинаковой относительной электроотрицательностью.
Ковалентная связь с несимметричным распределением обобществленной электронной плотности называется полярной ковалентной связью (например, в молекулах Н2О и NH3 , в кристаллах SiC).
Насыщаемость ковалентной связи характеризует способность атомов участвовать в образовании определенного ограниченного числа ковалентных связей и определяет стехиометрический состав молекул.
Направленность ковалентной связи заключается в том, что максимальное перекрывание валентных электронных облаков взаимодействующих атомов возможно при определенной их взаимной ориентации. В зависимости от направления перекрывания атомных орбиталей различают σ - , π - и δ - связи.
σ - связью называется связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов. Сигма-связь может возникать при перекрывании s - орбиталей (см. рисунок 3.1, а), s -, p - орбиталей (см. рисунок 3.1, б), p - орбиталей (см. рисунок 3.1, в), d - орбиталей (см. рисунок 3.1, г), а также d -, s - орбиталей и f - орбиталей с друг другом и другими орбиталями. σ - связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.
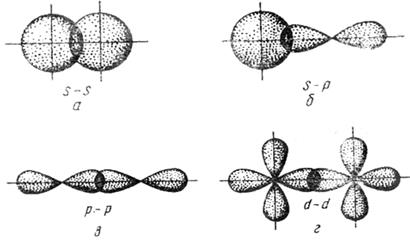
Рисунок 3.1 - Перекрывание атомных орбиталей при образовании
σ – связей
π - связью называется связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания). Пи-связь может образовываться при перекрывании p - p - орбиталей (см. рисунок 3.2, a), p - d - орбиталей (см. рисунок 3.2, б), d - d - орбиталей (см. рисунок 3.2, в), а также f - p - , f - d - и f - f - орбиталей.
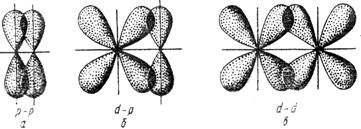
Рисунок 3.2 - Перекрывание
атомных орбиталей при образовании ![]() связей
связей
δ - связью называется связь, образованная перекрыванием d - орбиталей всеми четырьмя «лепестками» (см. рисунок 3.3).
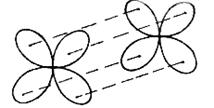
Рисунок 3.3 - Направления перекрывания атомных d - орбиталей при образовании δ – связей
3.4 Гибридизация атомных орбиталей
Для объяснения пространственного строения молекул используется теория гибридизации атомных орбиталей Л. Полинга, основные положения которой приводятся ниже:
1) Если у атома, вступающего в химическую связь, имеются разные АО, то в процессе образования химической связи происходит гибридизация – выравнивание по форме и энергии АО с образованием новых, гибридных АО.
2) В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание.
3) Характер гибридизации валентных орбиталей центрального атома определяет пространственную конфигурацию молекул.
Если в химическую связь вступает атом, у которого на внешней оболочке имеется s - и p - электроны, то происходит sp - гибридизация АО (см. рисунок 3.4). Две sp - гибридные орбитали расположены симметрично под углом 180˚.
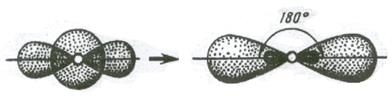
(s+p) орбитали, две sp – орбитали.
Рисунок 3.4 - Схема sp – гибридизации
Если у атома на внешней оболочке имеется один s - и два p - электрона, то происходит sp2 - гибридизация АО этого атома (см. рисунок 3.5). Три sp2 -гибридные орбитали расположены под углом 120˚.

(s+p+p) – орбитали, три sp2 – орбитали.
Рисунок 3.5 - Схема sp2 – гибридизации
У атома, имеющего на внешней оболочке один s - и три p - электрона, происходит sp3 - гибридизация (см. рисунок 3.6). Четыре sp3 - гибридные орбитали симметрично ориентированы в пространстве под углом 109˚28′.
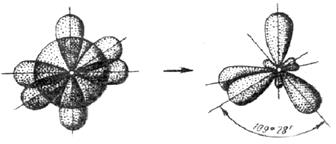
(s+p+p+p)орбитали, четыре sp3 – орбитали.
Рисунок 3.6 - Схема sp3 – гибридизации
3.5 Водородная связь
Водородная связь возникает между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом с большой электроотрицательностью, например атомом фтора, кислорода или азота другой молекулы. Возникновение водородной связи объясняют донорно-акцепторным взаимодействием: акцептором является ион водорода одной молекулы, донором - электроотрицательный атом другой молекулы, предоставляющий иону водорода неподеленную пару электронов.
В молекуле HF электронная пара смещена к атому фтора. Между положительно поляризованным атомом водорода одной молекулы HF и отрицательно атомом фтора другой молекулы HF возникает водородная связь:
![]()
![]()
![]()
![]() +
+ ![]()
![]() H F
.
H F
.
Энергия водородной связи составляет 8 – 40 кДж/моль. Водородная связь в 15-20 раз слабее ионной и ковалентной связи, тем не менее она приводит к ассоциации молекул – объединению их в агрегаты (HF)n , (H2O)n , (NH3)n , особенно при невысоких температурах. Ассоциация сильно влияет на свойства вещества: повышаются точки кипения, плавления, уменьшается способность к электролитической диссоциации.
Водородные связи могут возникать не только между различными молекулами (межмолекулярная), но и внутри одной и той же молекулы (внутримолекулярная – белки, нуклеиновые кислоты).
3.6 Ионная связь
Связь, которая осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов, называется ионной. К типичным соединениям с ионной связью относятся галогениды щелочных металлов, например, CsF, CsCI, NaCI.
Ионная связь характеризуется:
- ненаправленностью: электрическое поле иона имеет сферический характер и равноценно во всех направлениях;
- ненасыщаемостью: при взаимодействии ионов не происходит полной взаимной компенсации их силовых полей, и ионы сохраняют способность электростатически взаимодействовать с другими ионами.
Соединения с ионной связью представляют собой кристаллические вещества. Весь кристалл можно рассматривать как единую гигантскую молекулу, состоящую из очень большого числа ионов.
Теория ионной связи разработана в 1916 г. немецким ученым В. Косселем. Согласно этой теории, устойчивой конфигурацией является оболочка инертного газа s2p6. При этом атомы металлов отдают свои валентные электроны, приобретая оболочку предыдущего инертного газа и положительный заряд. Атомы неметаллов принимают электроны, приобретая оболочку последующего инертного газа и отрицательный заряд.
3.7 Металлическая связь
Металлическая связь – это сильно нелокализованная химическая связь, возникающая в том случае, когда атомы имеют мало валентных электронов по сравнению с количеством свободных валентных орбиталей, а валентные электроны из-за малой энергии ионизации слабо удерживаются ядром. Металлическая связь характерна для металлов, находящихся в твердом и жидком состоянии.
Металлическая связь имеет некоторое сходство с ковалентной. Однако, при ковалентной связи обобщены валентные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны; в последнем случае возможно взаимное смещение ионов и электронов без нарушения связи. Это говорит об отсутствии направленности металлической связи.
4 Лекция №4. Химическая кинетика. Химическое равновесие
Содержание лекции: скорость химической реакции и факторы, влияющие на нее; химическое равновесие, принцип Ле-Шателье.
Цель лекции: изучить и теоретически обосновать влияние различных факторов на скорость химической реакции; определить причины установления и смещения химического равновесия.
4.1 Скорость химической реакции и факторы, влияющие на нее
Химическая кинетика изучает скорость химической реакции и механизм ее протекания.
Гомогенные реакции – это реакции, при которых реагирующие вещества не разделены граничной поверхностью, т.е. находятся в одном фазовом состоянии; процесс осуществляется по всему объему системы. Скорость гомогенной химической реакции определяется изменением концентрации одного из веществ реакции в единицу времени, υгом, [моль/л ∙с].
υгом = 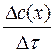 ,
(4.1)
,
(4.1)
где Δс(х) - изменение концентрации вещества (х), Δс = с2 – с1; Δτ - изменение времени, Δτ = τ2 – τ1.
Гетерогенные реакции – это реакции, при которых реагирующие вещества разделены граничной поверхностью, т.е. вещества находятся в разных фазовых состояниях; процесс осуществляется на поверхности раздела фаз между реагентами. Скорость гетерогенной реакции определяется изменением количества вещества реакции, произошедшего в единицу времени на поверхности раздела фаз, υгет, [моль/м2 · с].
υгет
=  , (4.2)
, (4.2)
где S - площадь поверхности раздела фаз между реагентами.
Для элементарных реакций справедлив закон действующих масс, открытый Гульдбергом и Вааге в 1864-1867 г: при постоянной температуре скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называют кинетическим уравнением реакции. Для элементарной реакции, записанной в общем виде:
mA + nB → pC + gD,
кинетическое уравнение имеет вид:
υ = k ∙ cm(A) ∙ cn(B), (4.3)
где c(A), c(B) – молярные концентрации реагирующих веществ;
m, n – стехиометрические коэффициенты реагирующих веществ;
k – коэффициент пропорциональности, константа скорости.
Физический смысл k: k = υ, если c(A) = c(B) = 1 моль/л.
Константа скорости реакции k зависит от природы реагирующих веществ, температуры среды, присутствия катализатора, а также площади поверхности раздела фаз (если реакция гетерогенная), но не зависит от концентрации реагентов.
Закон действующих масс не учитывает реагирующие вещества, находящиеся в твердом состоянии, а также жидкости, взятые в избытке.
Показатель степени (m и n) при концентрации в приведенном уравнении называют порядком реакции по данному веществу. Порядок реакции – величина формальная, может быть положительной и отрицательной; целым, дробным или нулевым числом.
Молекулярность реакции – это число молекул, принимающих участие в элементарном акте химического превращения.
Зависимость скорости реакции от температуры определяется правилом Вант–Гоффа: при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2 - 4 раза.
Математически эта зависимость выражается соотношением:
![]() , (4.4)
, (4.4)
где ![]() -
скорости реакции соответственно при начальной (T1)
и конечной (T2) температурах (T2 > T1);
-
скорости реакции соответственно при начальной (T1)
и конечной (T2) температурах (T2 > T1);
γ - температурный коэффициент скорости реакции: γ = ![]() = 2 ÷ 4.
= 2 ÷ 4.
Физический смысл температурного коэффициента: γ показывает во сколько раз увеличится скорость реакции с повышением температуры на 10 градусов.
Функциональная зависимость константы скорости химической реакции от температуры была установлена шведским ученым Аррениусом (1889 г.):
k = A
∙ ![]() , (4.5)
, (4.5)
где A – предэкспоненциальный множитель;
Ea – энергия активации;
![]() –
доля молекул, обладающих избыточной энергией Ea по
сравнению со средней энергией молекулы.
–
доля молекул, обладающих избыточной энергией Ea по
сравнению со средней энергией молекулы.
Прологарифмировав, получим
In k = In A – Ea / RT. (4.6)
Энергия активации, Ea, [кДж/моль] – некоторое избыточное количество внутренней энергии (по сравнению со средней), которым должна обладать молекула, чтобы прореагировать в данной химической реакции. Ea необходима для преодоления сил отталкивания между сближающимися молекулами, ослабления и нарушения связей в молекулах реагирующих веществ. Чем больше значение Ea, тем меньше скорость реакции и наоборот.
Катализаторы – это вещества, которые изменяют скорость реакции, а сами к концу процесса остаются неизменными как по составу, так и по массе. Явление ускорения химических реакции благодаря присутствию катализаторов носит название катализа, а замедления – ингибирования.
Существует два вида катализа – гомогенный и гетерогенный: при гомогенном катализе исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой); при гетерогенном – газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора.
Действие катализатора, как теперь установлено, связано с понижением энергии активации химического процесса: катализатор участвует в одной из промежуточных элементарных стадий полного процесса, вступая в реакцию с одним из реагентов этой реакции, образуя с ним активированный комплекс, обладающий меньшим значением Ea.
4.2 Химическое равновесие
Реакции, которые протекают только в одном направлении и идут до конца, называются необратимыми.
Реакции, идущие одновременно в двух противоположных направлениях (прямом и обратном) называются обратимыми.
В состояние химического равновесия может придти только обратимая система. В ходе обратимой реакции устанавливается подвижное химическое равновесие, при котором скорости прямого и обратного процессов равны:
υпр = υобр . (4.7)
Связь между равновесными концентрациями реагентов и продуктов реакции выражает закон действующих масс для равновесной системы: отношение произведения равновесных концентраций продуктов к произведению равновесных концентраций реагентов, возведенных в степени стехиометрических коэффициентов, является постоянной величиной при неизменной температуре. Эта постоянная величина называется константой равновесия К.
Для гипотетической обратимой гомогенной реакции:
mA + nB ↔ pC + gD
закон действующих масс математически описывается выражением:
![]() К =
К = 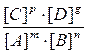 или
К =
или
К =![]() , (4.8)
, (4.8)
где [A], [B], [C], [D] - равновесные молярные концентрации соответствующих веществ, [моль/л];
m, n, p, g - стехиометрические коэффициенты в уравнении реакции;
k1, k2 - константы скоростей прямой и обратной реакций.
В выражение константы равновесия К не включают концентрации веществ, находящихся в твердой фазе, а также концентрации жидкостей, взятых в избытке. Константа химического равновесия зависит от природы реагирующих веществ и температуры среды, но не зависит от концентрации веществ и присутствия катализатора. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
Переход из одного равновесного состояния в другое называется смещением химического равновесия.
Направление, в котором смещается равновесие, определяется принципом Ле - Шателье: если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменение T, P, C), то равновесие смещается в направлении, ослабляющим данное воздействие.
Влияние изменения концентрации веществ на смещение химического равновесия определяется законом действующих масс (4.8). Из него следует, что увеличение концентрации реагентов или уменьшение концентрации продуктов смещает равновесие вправо и, наоборот, уменьшение концентрации реагентов или увеличение концентрации продуктов смещает равновесие влево.
Влияние изменения температуры на смещение химического равновесия определяется тепловым эффектом реакции ΔН. Повышение температуры смещает химическое равновесие в направлении эндотермической реакции и, наоборот, понижение температуры смещает равновесие в направлении экзотермического процесса.
Влияние давления на смещение химического равновесия рассматривается в тех случаях, если один из участников равновесной системы является газообразным веществом и объем газовой смеси неодинаков в обеих частях обратимой реакции. Повышение давления смещает равновесие в сторону той реакции, в ходе которой уменьшается объем газов и, наоборот, уменьшение давления приводит к смещению равновесия в том направлении, в ходе которого увеличивается объем газов.
5 Лекция №5. Химическая термодинамика. Энергетика химических процессов
Содержание лекции: основные понятия химической термодинамики; I закон термодинамики, энтальпия; термохимия, закон Гесса; П закон термодинамики, энтропия; свободная энергия Гиббса.
Цель лекции: изучить законы химической термодинамики, а также направление и пределы самопроизвольного протекания химических реакций; ознакомить с расчетами энергетических эффектов химических реакций; научить определять возможность и направление протекания реакций.
5.1 Основные понятия химической термодинамики
Химическая термодинамика – часть термодинамики, изучающая основные закономерности превращений химической энергии в другие виды энергий: электрическую, тепловую, механическую и т.д.
Термодинамическая система - это любой объект природы, состоящий из достаточно большого числа молекул (структурных единиц) и отделенный от других объектов природы реальной или воображаемой границей раздела.
Объекты, не входящие в систему, называются средой.
Химическая система – частный случай термодинамической системы. Она может быть однофазной (гомогенной) или многофазной (гетерогенной).
Фаза – часть термодинамической системы, однородная по составу и свойствам; отделенная от других частей системы поверхностью раздела.
Системы делятся на:
- изолированные – между системой и окружающей средой отсутствует обмен массой и энергией (Вселенная, лед в идеальном термосе);
- закрытые – между системой и окружающей средой отсутствует массообмен, но возможен энергообмен (планета Земля;остывающий камень);
- открытые – между системой и окружающей средой возможен обмен массой и энергией (человек).
Переход системы из одного состояния в другое называется процессом.
Состояние системы характеризуется термодинамическими параметрами: температура (T), давление (p), объем (V), внутренняя энергия (U), энтальпия (H), энтропия (S) и т.д.
Функцией состояния называется параметрическое изменение, которое зависит от начального и конечного состояний системы и не зависит от пути процесса. К важнейшим функциям состояния относятся: внутренняя энергия, U; энтальпия, H; энтропия, S; свободная энергия Гиббса (изобарно-изотермический потенциал), G.
Внутренняя энергия – полный запас энергии системы, обусловленный кинетической и потенциальной энергиями частиц, обозначается U,[кДж, кДж/моль]
Абсолютное значение внутренней энергии измерить невозможно, но можно измерить ее изменение (ΔU = U2 – U1) при переходе из одного состояния в другое. Известны две формы передачи энергии от одной системы к другой: упорядоченную форму передачи энергии называют работой (A), а неупорядоченную – теплотой (Q).
Работа А, [кДж] является мерой энергии, переданной от одного тела к другому за счет перемещения масс под действием каких-либо сил.
Теплота Q, [кДж] – мера энергии, переданная от одного тела к другому за счет разницы температур этих тел. В химической термодинамике считают положительными теплоту, подводимую к системе, и работу, которую система совершает против внешних сил. Внутреннюю энергию системы можно изменить:
- совершив какую-либо работу над системой;
- сообщив системе какое-то количество теплоты.
Внутренняя энергия является функцией состояния системы: ее изменение не зависит от пути и способа перехода системы из одного состояния в другое и определяется начальным и конечным состоянием, т.е.
ΔU = U2 – U1. (5.1)
Теплота (Q) и работа (A) функциями состояния системы не являются.
5.2 Первый закон термодинамики. Энтальпия
Взаимосвязь между внутренней энергией, теплотой и работой устанавливает первый закон (начало) термодинамики: энергия не создается и не уничтожается, а лишь превращается из одного вида в другой в строго эквивалентных количествах (Джоуль, 1842). Его математическое выражение:
Q = ΔU + A. (5.2)
Это означает, что теплота Q, подведенная к системе, расходуется на изменение ее внутренней энергии ΔU и на совершение системой работы A над внешней средой. Работа, совершаемая системой (над системой), складывается из полезной работы A1 и работы расширения pΔV: A = A1 + pΔV. Используя уравнение (5.2), можно рассчитать ΔU.
Существует множество процессов, в которых полезная работа равна 0. Тогда работа расширения системы является единственным видом работы:
A = pΔV. (5.3)
Математическое выражение 1-го закона термодинамики запишется:
Qp = ΔU + pΔV, (5.4)
где Qp – теплота, подведенная к системе при постоянном давлении.
Учитывая, что ΔU = U2 – U1 и ΔV = V2 – V1, преобразуем уравнение (5.4):
Qp = U2 – U1 + pV2 - pV1 = (U2 + pV2) – (U1 + pV1). (5.5)
Сумма (U + pV) – энтальпия системы, обозначается H, [кДж/моль], определяется как теплосодержание системы, которое включает в себя внутреннюю энерию и работу:
Н = U + pV. (5.6)
Подставив (5.6) в (5.5), получим:
Qp = Н2 – Н1 = ΔН, (5.7)
то есть теплота, подведенная к системе при постоянном давлении (р = const) расходуется на изменение энтальпии системы.
Поскольку ΔН определяется разностью (Н2 – Н1) и не зависит от пути и способа проведения процесса, то энтальпия является функцией состояния системы.
5.3 Тепловой эффект химической реакции. Термохимия. Закон Гесса
Тепловым эффектом химической реакции ΔН называется теплота, выделяемая или поглощаемая в результате превращения исходных веществ в количествах, соответствующих уравнению химической реакции.
Независимость ΔН от пути процесса при р = const и T = const (A = pΔV) впервые была установлена в 1836 г. русским ученым Г.И. Гессом: тепловой эффект химической реакции ΔН не зависит от пути ее протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции.
Закон составляет теоретическую основу термохимии - раздела химической термодинамики, в котором вычисляются тепловые эффекты различных физико-химических процессов.
Следует помнить, что все термохимические расчеты проводятся при стандартных условиях: T = 298 K (250C), p = 101, 3 кПа (1 атм).
В термохимии уравнение химической реакции записывается с указанием теплового эффекта реакции (энтальпии) и агрегатного состояния веществ. Эти уравнения называют термохимическими уравнениями:
N2(г) + 3Н2(г) = 2NH3(г),
ΔН![]() = -
94,4 кДж/моль.
= -
94,4 кДж/моль.
Теплота разложения химического соединения – это количество теплоты, которое поглощается или выделяется при разложении 1 моль сложного вещества на простые в стандартных условиях.
Теплота образования соединения – это количество теплоты, выделяемое или поглощаемое при образовании 1 моль сложного вещества из простых веществ при стандартных условиях.
Теплотой сгорания называют тепловой эффект реакции окисления одного моля данного соединения кислородом с образованием высших оксидов соответствующих элементов или соединения этих оксидов.
Тепловой
эффект, измеренный в стандартных условиях, называется стандартной энтальпией
и обозначается ΔН![]() или ΔН0; его
значения являются справочными величинами. ΔН0 простых веществ,
устойчивых в стандартных условиях, принимаются равными нулю.
или ΔН0; его
значения являются справочными величинами. ΔН0 простых веществ,
устойчивых в стандартных условиях, принимаются равными нулю.
В термохимических расчетах широко используются три следствия из закона Гесса.
Первое следствие: тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком: ΔНпр = - ΔНобр.
Второе следствие: ΔН реакции равен разности между суммой энтальпий сгорания исходных веществ и суммой энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов веществ:
ΔНр = Σ (ν ∙ ΔНсг )исх.вещ-в - Σ (ν ∙ ΔНсг )прод., (5.8)
где ν - стехиометрический коэффициент в уравнении реакции;
ΔНсг - энтальпия сгорания вещества.
Третье следствие: ΔН реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом стехиометрических коэффициентов веществ, участвующих в процессе:
ΔНр = Σ (ν ∙ ΔНобр )прод. - Σ (ν ∙ ΔНобр )исх.вещ-в, (5.9)
где ΔНобр - энтальпия образования вещества.
5.4 Второй закон термодинамики. Понятие энтропии
I закон термодинамики не затрагивает вопроса о направлении перемещения энергии. Большинство процессов представляют одновременно два явления: передачу энергии и изменение упорядоченности частиц относительно друг друга. Передача энергии характеризуется изменением энтальпии ΔН. Для характеристики упорядоченности частиц была введена величина, называемая энтропией, S.
Возможность и направление самопроизвольно протекающих (необратимых) процессов устанавливается вторым законом термодинамики: в изолированной системе самопроизвольно протекают только те процессы, которые сопровождаются возрастанием энтропии:
ΔS ≥ Q/ T, (5.10)
где S, [Дж / моль ∙ К] - энтропия, количественная мера беспорядка, функция состояния системы;
Q - количество теплоты, поглощенное системой;
T - абсолютная температура.
Если система переходит от более упорядоченного состояния к менее упорядоченному – энтропия возрастает ΔS > 0.
Увеличение энтропии характерно для многих реакций разложения, а также для фазовых переходов: твердое тело→ жидкость; жидкость→ газ.
Уменьшение энтропии происходит в ходе многих реакций соединения, а также при фазовых переходах: газ→ жидкость; жидкость→ твердое тело.
Энтропию веществ принято относить к стандартным условиям. Значение S![]() можно найти в справочных таблицах. Изменение энтропии, как функции состояния,
может быть рассчитано по уравнению:
можно найти в справочных таблицах. Изменение энтропии, как функции состояния,
может быть рассчитано по уравнению:
ΔS0 = Σ
(ν ∙ ΔS![]() )прод. - Σ (ν ∙ ΔS
)прод. - Σ (ν ∙ ΔS![]() )исх.вещ-в. (5.11)
)исх.вещ-в. (5.11)
5.5 Свободная энергия Гиббса
Связь между энтальпией и энтропией системы устанавливает термодинамическая функция состояния, которая называется свободной энергией Гиббса G, [кДж/моль]. Физический смысл G: свободная энергия системы, которая может быть превращена в работу. G характеризует направление и предел самопроизвольного протекания процессов в изобарно-изотермических условиях ( p = const, Т = const).
Разность между энтальпийным и энтропийным факторами отражает уравнение Гиббса:
ΔG = ΔH – TΔS, (5.12)
которое позволяет судить о возможности самопроизвольного протекания химического процесса в данном направлении. Самопроизвольно могут протекать процессы при ΔG < 0. Если ΔG > 0, то самопроизвольное протекание процесса невозможно (протекает обратная реакция). Если ΔG = 0, то система находится в состоянии химического равновесия.
Если вещество находится в стандартных условиях, то энергия Гиббса образования
называется стандартной энергией Гиббса образования вещества (ΔG![]() ). Величины ΔG
). Величины ΔG![]() приводятся в справочных таблицах. ΔG
приводятся в справочных таблицах. ΔG![]() простых веществ(Cl2, H2, O2, Mg, графит и т.д.) равна нулю.
простых веществ(Cl2, H2, O2, Mg, графит и т.д.) равна нулю.
Изменение энергии Гиббса химической реакции ΔG, как функции состояния, может быть рассчитано по уравнению:
ΔG0 = Σ
(ν ∙ ΔG![]() )прод. - Σ (ν ∙ ΔG
)прод. - Σ (ν ∙ ΔG![]() )исх.вещ-в. (5.13)
)исх.вещ-в. (5.13)
6 Лекция №6. Растворы
Содержание лекции: характеристика и классификация растворов; растворы электролитов, константа и степень электролитической диссоциации; закон разбавления Оствальда; активность и ионная сила раствора; ионное произведение воды, водородный показатель.
Цель лекции: изучить классификацию растворов, растворимость веществ, научить расчетам определенных величин растворов слабых и сильных электролитов.
6.1 Характеристика и классификация растворов. Растворимость
Растворы – гомогенные (однородные) системы, состоящие из двух или нескольких компонентов и продуктов их взаимодействия.
Растворитель – вещество, которое при растворении не меняет своего агрегатного состояния и его концентрация выше, чем концентрация других компонентов.
Растворенное вещество – вещество, находящееся в растворе в меньшем количестве.
Растворы классифицируют:
- по размерам частиц (взвеси, коллоидные, истинные растворы);
- по агрегатному состоянию на газообразные (воздух), жидкие (кислота, щелочь, соль, сахар в воде), твердые (сплав металлов)).
Жидкие растворы делятся на водные и неводные; растворы электролитов и неэлектролитов.
Растворение следует рассматривать как совокупность физических и химических явлений, выделяя при этом три основных процесса:
1) Разрушение химических и межмолекулярных связей в растворяющихся газах, жидкостях или твердых телах, требующее затраты энергии. Энтальпия системы при этом растет: ΔH1 > 0.
2) Химическое взаимодействие растворителя с растворяющимся
веществом, вызванное образованием новых соединений — сольватов
(или гидратов) - и сопровождающееся выделением энергии. Энтальпия системы при
этом уменьшается: ΔH2 < 0.
3) Самопроизвольное
перемешивание раствора или равномерное
распределение сольватов (гидратов) в
растворителе, связанное с
диффузией и требующее затраты
энергии; энтальпия системы: ΔH1 > 0.
Раствор, в котором устанавливается равновесие между растворением и образованием (осаждением, кристаллизацией, выделением) вещества, называется насыщенным, а концентрация такого раствора — растворимостью, cp.
6.2 Растворы электролитов
Электролитами называются вещества, диссоциирующие на ионы в воде или других полярных растворителях. Растворы и расплавы электролитов проводят электрический ток.
Полный или частичный распад растворенного вещества на сольватированные ионы под действием полярных молекул растворителя называется электролитической диссоциацией (ЭД).
Сильные электролиты – это вещества, которые при растворении в полярном растворителе практически полностью диссоциируют на ионы.
Слабые электролиты – это вещества, диссоциирующие в растворе неполностью, частично.
Для количественной оценки полноты
диссоциации используют понятие степени электролитической диссоциации ![]() , которая
представляет собой отношение числа распавшихся на ионы молекул (n)
к общему числу растворенных молекул (N):
, которая
представляет собой отношение числа распавшихся на ионы молекул (n)
к общему числу растворенных молекул (N):
α = ![]() или α
=
или α
= ![]() , (6.1)
, (6.1)
где cд- молярная концентрация продиссоциированных молекул, [моль/л];
c0 - молярная концентрация общих (исходных) молекул, [моль/л].
В растворе слабого электролита из-за его частичной электролитической диссоциации (ЭД) устанавливается химическое равновесие между образовавшимися ионами и оставшимися непродиссоциированными частицами (молекулами или сложными ионами). Константу равновесия такого процесса называют константой электролитической диссоциации,Кд, которая равна отношению произведения равновесных концентраций ионов к концентрации непродиссоциированных молекул:
Кд = 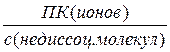 . (6.2)
. (6.2)
Кд зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации электролита. Чем больше Кд, тем сильнее электролит. Значения Кд слабых электролитов приводятся в справочнике.
Между Кд и степенью диссоциации α существует следующая связь:
Кд = 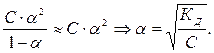 (6.3)
(6.3)
Закон разведения Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора.
Для оценки состояния ионов в растворах сильных электролитов пользуются величиной, называемой активностью, а - это эффективная (кажущаяся) концентрация иона.
a = f ∙ c, (6.4)
где c - молярная концентрация раствора, [моль/л];
f - коэффициент активности, зависящий от природы вещества, растворителя, концентрации раствора, температуры и ионной силы раствора.
Чем сильнее притяжение между ионами, тем меньше f.
Ионная сила раствора, μ – характеристика раствора, учитывающая концентрации всех ионов в растворе:
μ = 1/2 Σ ci · z![]() . (6.5)
. (6.5)
Установлено, что в 1 л воды при 250С распадается на ионы 10-7 моль молекул воды. Диссоциация слабого электролита протекает по уравнению:
Н2О= Н+ + ОН-.
Из одной молекулы Н2О получается по одному иону Н+ и ОН-, тогда концентрация ионов в чистой воде [H+] = [OH-] = 10-7 моль/л. Так как
Кдис (Н2О) = [H+] · [OH-]![]() [H2O],
[H2O],
Кдис ∙ [H2O] = [H+] ∙ [OH-] = 10-7 ∙ 10-7= 10-14 · Кдис ∙ [H2O]= Кw – ионное произведение воды, постоянная величина, представляющая собой произведение концентраций ионов водорода и гидроксид-ионов в чистой воде или любом водном растворе при 250С
Кw= [H+] ∙ [OH-] = 10-14. (6.6)
а) [H+] = [OH-] = 10-7 моль/л – раствор нейтральный;
б) [H+] > [OH-] – раствор кислый;
в) [H+] < [OH-] – раствор щелочной.
Для характеристики среды удобнее пользоваться величиной водородного показателя среды pH. рН - это десятичный логарифм концентрации водородных ионов, взятый с обратным знаком: рН= - lg [H+].
pH + pOH=14. (6.7)
7 Лекция №7. Окислительно-восстановительные реакции (ОВР). Электрохимические процессы
Содержание лекции: типичные окислители и восстановители, типы окислительно-восстановительных реакций; электродный потенциал, уравнение Нернста, гальванический элемент; электролиз растворов и расплавов, законы электролиза.
Цель лекции: научить составлять уравнения ОВР; разобрать сущность процессов, в гальваническом элементе; объяснить характер электролиза в зависимости от природы электролита и электродов, рассмотреть количественные соотношения при электролизе.
7.1 Окислительно-восстановительные реакции
Окислительно - восстановительными называются реакции, сопровождающиеся переходом электронов от одних частиц к другим, то есть изменением степеней окисления атомов элементов, входящих в состав реагирующих молекул.
В периодах периодической системы Д. И. Менделеева с повышением порядкового номера элемента восстановительная способность электронов и их соединений уменьшается, а окислительная способность повышается. В группах (сверху вниз) с повышением порядкового номера и увеличением радиуса атома элемента восстановительная способность элемента и его соединения увеличивается, а окислительная способность понижается.
Типичными окислителями являются:
1) кислород и галогены (O![]() , F
, F![]() , CI
, CI![]() , Br
, Br![]() , I
, I![]() );
);
2) положительно заряженные ионы металлов в высшей степени окисления (Fe+3CI3, Sn+4CI4);
3) сложные ионы и молекулы, содержащие атом металла в высшей степени окисления
(KMn+7O4, K2Cr![]() 0
0![]() , KCI+5O3, HN+5O3, H2S+6O4).
, KCI+5O3, HN+5O3, H2S+6O4).
Типичными восстановителями являются:
1) металлы и некоторые неметаллы (Zn0, Mn0, C0, H![]() );
);
2) отрицательно заряженные ионы неметаллов (HCI-, H2S-2, HBr-, CaH![]() );
);
3) положительно заряженные ионы металлов в низшей степени окисления (Fe+2CI2, Sn+2CI2).
Различают следующие типы окислительно-восстановительных реакций:
1) Межмолекулярные реакции – реакции, протекающие с изменением степени окислителя атома элемента в разных молекулах, т.е. окислитель и восстановитель находятся в разных молекулах:
2H2S-2 + H2S+4O3 → 3S0 + 3H2O.
2) Внутримолекулярные реакции – реакции, протекающие с изменением степени окисления разных атомов в одной и той же молекуле:
2NaN+5O![]()
![]() 2NaN+3O2 + O
2NaN+3O2 + O![]() .
.
3) Реакции диспропорционирования (дисмутации) – реакции, протекающие с одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента:
3K2Mn+6O4 + 2H2O → 2KMn+7O4 + Mn+4O2 + 4KOH.
4) Реакции конпропорционирования (усреднения) - внутримолекулярные окислительно-восстановительные реакции, в ходе которых происходит выравнивание степеней окисления атомов одного и того же элемента:
N-3H4N+3O2 → N![]() + 2H2O.
+ 2H2O.
7.2 Классификация электрохимических процессов
Электрохимия – это раздел химии, изучающий процессы взаимного превращения химической и электрической форм энергии. Такие процессы, называемые электрохимическими.
Металл, находящийся в контакте с электролитом, называется электродом. На границе металл-раствор возникает двойной электрический слой (заряженная поверхность металла и прилегающий к ней противоположно заряженный слой раствора) и, соответственно, ему – скачок потенциала. Разность потенциалов, возникающая между металлом и раствором, называется электродным потенциалом.
Абсолютную величину скачка потенциала нельзя измерить экспериментально, так как
мы имеем дело с разными фазами: твердая и жидкая. Для этого измеряют разность
потенциалов между исследуемым электродом и другим электродом, который взят в
качестве электрода сравнения. Таким электродом сравнения является стандартный
водородный электрод, абсолютное значение потенциала которого условно
принимается равным нулю при любой температуре: E![]() = ± 0, 00 B.
= ± 0, 00 B.
Электродный потенциал,
измеренный при стандартных условиях: T=298K,
P=101,3 кПа, с(Меn+)=1моль/л,
является стандартным электродным потенциалом металла и
обозначается Е![]() = …В.
= …В.
Определив стандартные электродные потенциалы металлов относительно
водородного электрода, можно расположить их по активности в ряд напряжений
металлов, предложенный Н.Н. Бекетовым: K Ca Na Mg AI Mn Zn Fe Ni Sn Pb H2
Cu Hg Ag Au. Значения Е![]() определены для большинства электрохимических
систем и являются табличными данными.
определены для большинства электрохимических
систем и являются табличными данными.
Ряд стандартных электродных потенциалов используется для определения последовательности разряда ионов при электролизе, а также для описания общих свойств металлов.
Зависимость электродного потенциала металла от концентрации иона в растворе выражается уравнением Нернста:
E Me![]() /
Me = E
/
Me = E![]() +
+
![]() ,
(7.1)
,
(7.1)
где E Me![]() / Me – реальный электродный потенциал металла в растворе;
/ Me – реальный электродный потенциал металла в растворе;
E![]() – стандартный электродный потенциал металла;
– стандартный электродный потенциал металла;
R – универсальная газовая постоянная (8,314 Дж/град · моль);
T – температура по шкале Кельвина;
F – постоянная Фарадея (96500 Кл/моль);
n – число электронов, участвующих в ОВпроцессе,
a Me![]() –
концентрация ионов металла в растворе электролита, [моль/л].
–
концентрация ионов металла в растворе электролита, [моль/л].
Подставляя значения R, F, T = 298K, множитель 2,3 перехода от натурального логарифма к десятичному логарифму, перепишем уравнение Нернста в сокращенном виде:
E Me![]() /
Me = Е
/
Me = Е![]() +
+ ![]() .
(7.2)
.
(7.2)
Система, состоящая из двух электродов, помещенных в раствор электролита, в которой энергия окислительно - восстановительной реакции преобразуется в электрический ток, называется гальваническим элементом.
В гальваническом элементе можно осуществить ту окислительно-восстановительную реакцию, которая протекает самопроизвольно, поэтому ΔG < 0, где ΔG – свободная энергия Гиббса.
Чем больше разность потенциалов двух электродов гальванического элемента, тем больше его электродвижущая сила (ЭДС):
ЭДС (Г.Э.) = Екатода – Еанода > 0, (7.3)
где Eкатода, Еанода – электродный потенциал катода и анода.
Так как гальванический элемент – это источник электрического тока, то для него вводится понятие работы электрического тока:
А = n(ē) · F · ЭДС(Г.Э) = n(ē) · F · Е, (7.4)
где Е - разность потенциалов (ЭДС) гальванического элемента;
F - постоянная Фарадея;
n(ē) - число электронов, участвующих в ОВР.
Электролиз - это окислительно-восстановительный процесс, возникающий на электродах при прохождении электрического тока через раствор или расплав электролита. При электролизе окислительно-восстановительная реакция не протекает самопроизвольно, поэтому ΔG > 0; ЭДС < 0.
Электрод, на котором протекает процесс окисления, называют всегда анодом. Анод при электролизе соединен с положительным полюсом источника постоянного тока. Аноды бывают растворимые (активные) и нерастворимые (инертные). Нерастворимые аноды изготовляют из платины, палладия, графита. Растворимые аноды – из меди, железа, никеля, цинка и других металлов, в процессе электролиза окисляются.
Электрод, на котором протекает процесс восстановления, называют катодом. Катод при электролизе соединен с отрицательным полюсом источника постоянного тока.
При электролизе в расплавах солей на катоде происходит восстановление катионов активных и малоактивных металлов, а на аноде – окисление анионов бескислородных и кислородсодержащих кислот, причем, при окислении анионов кислородсодержащих кислот получается смесь различных продуктов. Если электролит является водным раствором, то на катоде и аноде могут разряжаться не только ионы электролита, но и молекулы воды.
Cхема процесса электролиза расплава КВr такова:
![]()
![]() KBr
KBr ![]() K+ + Br-
K+ + Br-
(-) K: K+ ![]() K 2
K 2
(+) A: 2Br- ![]() Br2 1
Br2 1
![]()
2K+ + 2Br- ![]() 2K + Br2
2K + Br2
![]()
![]() 2KBr
2KBr ![]() 2K + Br2
2K + Br2
Последовательность
восстановления катионов определяется
значениями электродных потенциалов Е![]() .
.
1) Катионы металлов, у которых стандартный электродный потенциал больше, чем у водорода (от Cu2+ до Au3+), при электролизе практически полностью восстанавливаются на катоде.
2) Катионы металлов с малой величиной стандартного электродного потенциала (от Li+ до AI3+ включительно) не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды, а в кислой среде – ионы водорода.
3) Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от Mn2+ до H2). В зависимости от условий проведения электролиза ( pH раствора, плотности тока, потенциала разложения и др.) возможно преимущественное восстановление молекул воды (в кислотных растворах – ионов водорода) или катионов металла, в противном случае, протекает одновременное восстановление на катоде и молекул воды, и катионов металла.
Последовательность окисления анионов зависит как от присутствия молекул воды, так и от вещества, из которого сделан анод:
1) На аноде легче будут окисляться те частицы, для которых ![]() меньше
(более отрицательное).
меньше
(более отрицательное).
2) В первую очередь окисляются простые анионы в порядке возрастания величины их стандартных потенциалов, не превышающих 1,5 B (S2-, I- , Br- , CI-).
3) Если же раствор содержит анионы кислородcодержащих кислот или фторид - ионы, то на аноде вместо них окисляются молекулы воды с выделением кислорода.
Количественные соотношения при электролизе основываются на двух законах Фарадея.
I закон электролиза: масса вещества, выделившегося на электроде, прямо пропорциональна количеству электричества, пропущенного через раствор или расплав электролита:
m = KЭ · Q, (7.5)
где m - масса продукта электролиза, [г];
Q - количество прошедшего через раствор электричества, [Кл].
Так как количество электричества, прошедшего через раствор, равно произведению силы тока I в амперах на время τ в секундах, то
m = KЭ · I · τ, (7.6)
где КЭ - электрохимический эквивалент, который показывает какая масса вещества выделится на электроде, если через электролит пропустить 1 Кл электричества.
II закон электролиза: eсли через разные электролиты пропускать одно и то же количество электричества, то массы веществ, выделяющихся на электродах двух различных электролитов, прямо пропорциональны молярным массам их эквивалентов.
Экспериментально установлено, что для выделения молярной массы эквивалента вещества (МЭ) требуется пропустить 96500 Кл электричества. Это число называется постоянной Фарадея и обозначается буквой F.
КЭ = МЭ / 96500. (7.7)
Подставим выражение КЭ в формулу (7.6) закона Фарадея
m = MЭ · I · τ / 96500. (7.8)
8 Лекция №8. Общие свойства металлов. Сплавы. Коррозия металлов
Содержание лекции: общие свойства металлов; электронное строение металлов, изоляторов и полупроводников; способы получения металлов; коррозия металлов и сплавов, защита их от коррозии.
Цель лекции: изучить физико-химические свойства металлов, методы их получения; объяснить механизм процесса коррозии и методы защиты металлов и сплавов от коррозии.
8.1 Физические и химические свойства металлов
В металлической решетке ионы связаны друг с другом нелокализованными подвижными электронами. Этим объясняется высокая электрическая проводимость и теплопроводность металлов. Максимальную электрическую проводимость имеют серебро, медь, золото и алюминий. Ионы металлов в кристалле могут скользить относительно друг друга. Этим объясняется ковкость (способность к расплющиванию) и пластичность (способность вытягиваться в проволоку и ленту). К легким (ρ < 5 г/см3) относятся s-металлы и алюминий, скандий и титан, минимальную плотность имеет литий (ρ = 0,53 г/см3), к тяжелым относятся, в основном, f - металлы 5 - 7 периодов. К легкоплавким относятся в основном s -, р – металлы, а также d - металлы П группы. К тугоплавким принадлежат, в основном, d - металлы IV - VIII групп.
Будучи восстановителями, металлы могут взаимодействовать с окислителями. Все металлы окисляются фтором и могут окисляться хлором. Большинство металлов (кроме платины и золота) могут окисляться бромом и кислородом в кислой среде. Большой склонностью к пассивации обладают бериллий, алюминий, d - металлы IV - VIII групп. Многие металлы катализируют различные химические и электрохимические реакции. Так как металлы и их катионы имеют вакантные молекулярные орбитали, то большинство из них являются комплексообразователями.
Металлы получают из руд. Предварительно руда обрабатывается для увеличения концентрации металла путем отделения пустой породы и разделения остатка на различные фракции. Последующие операции заключаются в получении соединения металла, из которого удобно выделить металл тем или иным способом.
8.2 Электронное строение металлов, изоляторов и полупроводников
Объяснение электропроводности металлов, полупроводников и диэлектриков дается на основе зонной теории кристаллов. Согласно методу молекулярных орбиталей при образовании кристаллов в химические связи вступает огромное число частиц N и соответственно образуется множество МО, разность между энергетическими уровнями МО чрезвычайно мала. В результате образуются энергетические зоны, состоящие из огромного числа подуровней. Зона, полностью заполненная электронами, называется валентной. Зона, свободная от электронов и находящаяся выше валентной зоны, называется зоной проводимости. Если валентные зоны и зоны проводимости не перекрываются друг с другом, то между ними существует запрещенная зона с шириной ΔE, которая определяет свойства кристаллов.
У металлов валентные зоны и зоны проводимости перекрываются, поэтому электроны при очень незначительных возбуждениях легко переходят с одной МО на следующую МО, что и обеспечивает электрическую проводимость и теплопроводность. Удельная электропроводность металлов σ колеблется от 104 до 106 ом-1 · см-1.
У диэлектриков (изоляторов) валентные зоны и зоны проводимости разделены запрещенной зоной, ширина которой превышает 4 эВ. Для возбуждения электронов, то есть для перехода из валентной зоны в зону проводимости, требуется значительная энергия, при подведении которой кристалл либо расплавляется, либо разрушается. По этой причине диэлектрики имеют очень малую удельную электропроводность (от 10-10 до 10-22 ом-1 · см-1) и обладают изолирующими свойствами.
Полупроводниками называется большая группа веществ с удельной электропроводностью (от 10-10 до 104 ом-1 · см-1). Полупроводниковые свойства проявляют кристаллические вещества при ширине запрещенной зоны ниже 4 эВ. При поглощении энергии электроны валентной зоны возбуждаются и переходят в зону проводимости. В результате в зоне проводимости появляются подвижные электроны, а в валентной зоне – вакансии или положительно заряженные дырки, что обеспечивает собственную проводимость полупроводников (кремний, германий).
8.3 Коррозия металлов и сплавов, защита их от коррозии
Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды. Коррозионные разрушения имеют различные виды: равномерное, пятнами, точечное, питтинг, межкристаллитное, растрескивающее, селективное. Наиболее опасными являются питтинг и межкристаллитные разрушения.
Химическая коррозия - коррозия, обусловленная взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Образующиеся на металле оксидные пленки часто препятствуют дальнейшему окислению.
Разрушение металла с возникновением в системе электрического тока при соприкосновении с электролитом называется электрохимической коррозией. При электрохимической коррозии разрушение металла происходит в результате работы огромного числа коррозионных микроэлементов. При этом на корродирующем металле протекает анодная реакция:
(-) А: Me0 ![]() Men+.
Men+.
На катодных участках идет процесс восстановления окислителя. Наиболее распространенными окислителями являются
1) молекулы кислорода воздуха:
(+) K: O2 + 2H2O ![]() 4OH-
;
4OH-
;
2) ионы водорода Н+ электролита:
(+) K: 2H+ ![]() H2↑.
H2↑.
Продуктом коррозии является соль металла соответствующей кислоты (в кислой среде) или гидроксид металла (в нейтральной среде).
Скорость коррозии тем больше, чем дальше отстоят в ряду напряжений металлы, из которых образовалась гальваническая пара. Скорость коррозии возрастает с ростом температуры и с увеличением концентрации окислителя.
Широко применяются методы защиты металлических конструкций от коррозии. Наиболее дешевым и распространенным методом являются лакокрасочные покрытия. Для защиты от коррозии используют металлические покрытия. К анодным покрытиям относятся покрытия из металлов с более отрицательным электродным потенциалом (оцинкованное железо). К катодным относятся покрытия из менее активных металлов (луженое железо, никелевое покрытие железа). Широко используют жаростойкое легирование, т.е. введение в состав сплава компонентов, повышающих жаростойкость. Например, для повышения коррозионной стойкости стали в нее вводят легирующие элементы - хром, никель, титан, вольфрам. Для защиты от коррозии в коррозионную среду вводят небольшое количество добавок, или замедлителей коррозии (ингибиторов). Их тормозящее действие сводится к образованию оксидных пленок или пленок труднорастворимых соединений.
В агрессивных средах (морская вода, почва) применяют электрохимический метод защиты. В промышленности часто применяют так называемую протекторную защиту. К стальной конструкции корпуса судна (трубопровода) присоединяют пластины цинка или цинка с алюминием. При этом образуется макрогальванический элемент, где роль анода выполняет цинк, а защищаемая конструкция становится катодом, коррозия конструкции вследствие сдвига потенциала уменьшается или вообще прекращается. В других методах, называемых катодной защитой, аналогичный результат достигается присоединением защищаемого металла к отрицательному полюсу внешнего источника. Сравнительно легкопассивирующие металлы такие, как титан, никель, нержавеющая сталь, можно защитить от коррозии, присоединяя их к положительному полюсу генератора (так называемая анодная защита).
Список литературы
1. Пралиев С.Ж., Бутин Б.М., Байназарова Г.М., Жайлау С.Ж. Общая химия. - Алматы, 2003 - т. 1, 2.
2. Коржуков Н.Г. Общая и неорганическая химия. - М.: МИСИС. Инфра - М, 2004.
3. Дробашева Т.И. Общая химия. - Ростов - на - Дону: Феникс, 2004.
4. Коровин Н.В. Общая химия. - М.: Высшая школа, 2005.
5. Саенко О.Е. Химия. - Ростов - на - Дону: Феникс, 2009.
6. Глинка Н.Л. Общая химия. - М.: Юрайт, 2011.
7. Султанбаева Б.М. Химия. Учебное пособие. - Алматы: АУЭС, 2011.
8. Алексашин Ю.В. Общая химия. – М.: «Дашков и К», 2012.
9. Общая химия / под ред. Г.П.Жмурко и др. - М.: Академия, 2012.
|
Содержание |
|
|
1 Введение |
3 |
|
2 Лекция №1. Основные понятия и законы химии |
4 |
|
3 Лекция №2. Строение атома. Периодический закон и периодическая система элементов Д.И.Менделеева |
7 |
|
4 Лекция №3. Химическая связь. Строение молекул |
13 |
|
5 Лекция№4. Химическая кинетика. Химическое равновесие |
18 |
|
6 Лекция №5. Химическая термодинамика. Энергетика химических процессов |
22 |
|
7 Лекция №6. Растворы |
26 |
|
8 Лекция №7. Окислительно-восстановительные реакции (ОВР). Электрохимические процессы |
29 |
|
9 Лекция №8. Общие свойства металлов. Сплавы. Коррозия металлов |
33 |
|
Список литературы |
37 |
Сводный план 2014 г., поз.315
Султанбаева Болдых
Мирсадыковна
Каленова Жан Абдразаковна
ХИМИЯ
Конспект лекций
для студентов специальностей
5В071800 – Электроэнергетика,
5В081200 – Энергообеспечение сельского хозяйства
Редактор Н.М. Голева
Специалист по стандартизации Н.К. Молдабекова
Подписано в печать __________
Формат 60×84 1/16
Тираж 150 экз.
Бумага типографская № ____
Объем 2,4 уч.- изд. л.
Заказ ____ Цена 1200 тг.
Копировально-множительное бюро
некоммерческого акционерного общества
«Алматинский университет энергетики и связи»
050013, Алматы, Байтурсынова, 126