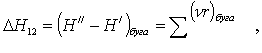ҚАЗАҚСТАН
РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ
МИНИСТРЛІГІ
Алматы энергетика және
байланыс институты
Темірбаев Д.Ж.
ЖЫЛУТӘСІЛДЕМЕЛІК
ФИЗИКАЛЫҚ ХИМИЯНЫҢ
НЕГІЗДЕРІ
Оқу құралы
Алматы 2006
Жылутәсілдемелік физикалық
химияның негіздері: Оқу құралы.-
Темірбаев Д.Ж. Алматы: АЭжБИ, 2006.- 85 б.
Оқу
құралында ЖЫЛУТӘСІЛДЕМЕЛІК
ФИЗИКАЛЫҚ ХИМИЯның қазіргі
жылу мен мањыз жєне қозғалыс мөлшерлерінің табиѓи
таралуы мен жану және жарылу ќ±былыстарына, өзара байланысты
ќарќынына, негізгі мєселелері мен оњтайлы жєне мекен қорғаулы іс
тєсілдемелігіне, инженерлік есептеу єдістеріне ерекше кµњіл бµлініп, жаттыѓу
мен зерттеу (жеке) сабаќтарының әдістемелік н±сќаулары жасалып, мысалдары
қаралған. Бұлар бір - бірімен мазмұнды өзара
байланыстырылып, наќты жағдайлары ќарастырылып, пєнніњ әдістемелік
және іс жүзінде пайдалы мәселелері бейімделген. Студенттер
есептердің д±рыс шыѓару жолдарын игеріп, єдістеріне жаттығу
үшін күрделі есептер мен с±раќтар талданып, баќылаулыќ шыѓарулары
мен жауаптары келтірілген.
Оқу құралы ЖЫЛУТӘСІЛДЕМЕЛІК өндірістің
әртүрлі мамандық студенттері мен магистранттарына
арналған.
Кесте 1, без. 13,
библиогр. - 19 атау.
ПІКІРШІЛЕР: техн.
ғыл. докторы, профессор Қалтаев Айдархан (Аль-Фараби атындағы
Қазақ Ұлттық университеті);
техн. ғыл. канд. АЭжБИ-дің
профессоры Есенбек Нұрекен.
Қазақстан Республикасы
Білім және Ғылым министрлігі 2006 жылғы баспа жоспары бойынша
басылды.
Т![]()
ISBN
9965-708-63-0
ã Алматы энергетика
және байланыс институты,
2006 ж.
Алғы сөз
Физикалық химия – заттардың
құрылысы мен химиялық жылуқоз-ғалым,
химиялық кинетика және электрлік химия мен коллоидтық
(желімдік) химия секілді көптеген химиялық салалардың
құбылыстарының теориялық негіздерін зерттейтін физикамен байланысты химиялық
ілім.
Физикалық химияны
ұлы ғалым М.В.Ломоносов бірінші рет құрастырып
студенттерге оқыған екен. Ол: ²Физикалық химия – химиялық тектесулерді физиканың
тәжірибесі мен негіздері арқылы түсіндіретін ғылым.²- депті. Бұл анықтама қазіргі кезеңде сәл
ғана келесідей толтырылған:
²Физикалық химия – заттардың әртүрлі
жағдайлардағы құрылысы мен химиялық
өзгерістерінің негізгі жалпы заңдарының ғылымы.²
Физикалық
химияның ғылыми негізінде жататын кинетикалық пен
квантты-химиялық әдістері органикалықсыз бен
органикалық және талдаулық (аналитикалық) химияларда
жеткілікті беріледі. Ал, оның жылуқозғалымдық
үшінші әдісіне (әртүрлі жылутәсілдемелік арнайы
пәндердің негіздерінде және жылутәсілдік пен
жылуқайраттық өндірістерінде пайдаланатындықтан) біз
осы пәнге көбірек көңіл бөлеміз. Дегенмен,
бұл әдістің сипаттаушы берне, химиялық мүмкіндік
(потенциал) пен жұмыстық қабілеттілігі (эксергия -
түрленулік), жылуқозғалымдық шаққылық
теңдеулері және тектікүйлі (фазалық)
өзгерістерінің тәсілдік жылуқозғалымда берілетіні
ескеріледі.
Химиялық
өзгерістер тәсілді жылуқозғалымның негізгі
үш заңының әсерлерімен өтеді. Оның бірінші
заңының химиялық құбылыстарында пайдалануынан термохимия
саласы пайда болды. Жылуқозғалымның үшінші
заңы мен термохимияның арқасында химиялық
тектесулердің жылулық әсерлерін (тепловые
эффекты реакций) анықтау мүмкін болды.
Жылуқозғалымның екінші заңы арқылы
химиялық құбылыстардың теңдесуінің
зерттелуі мен әртүрлі шарттарға тәуелді сырттай
қалыптасқан күйіне жеткізілуі мүмкін болды.
Мұның маңыздылығын келесі мысалдан көруге болады.
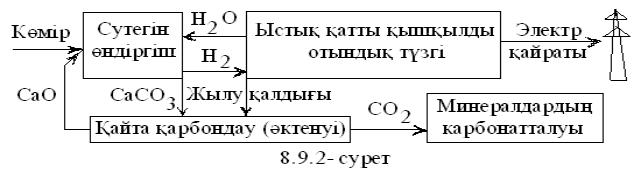
Көміртегі оттегіде жанғанда ыстықтықтың
мәніне байланысты жану өнімдеріндегі көміртегі тотығы
СО (2С+О2=2СО) мен көмірқыщқыл газы СО2-нің (С+О2=СО2)
қатынасы әртүрлі болады. Жану құтысында отын
толық жағылғанда СО нөлге жуық, ал
газөндіргіштерде, керісінше, СО (80 пайыздай) жоғары (СО2
20 пайыздай ғана) болады. Бұл жағдайларға
сәйкесті жану ыстықтықтары 800 0С-ден жоғары
және 550 0С-дей болуға тиісті. Осы секілді
химиялық шарттарды іске асыру үшін химиялық теңдесуді
зерттеп білу қажет.
Химиялық теңдесуді игере, әсіресе
көмірдің мүмкіншілігін үнемиеттік және
мекенқорғаулық өте жоғары физикалы химиялық
тікелей не газдандырып электрлікке өзгертуге болады. Осы химиялық
теңдесудің негізінде еліміздің сол секілді кең
байтақ мұнай өндірісінің де жылулық
тәсілдемесін жоғары дәрежеге көтеру өте тиімді.
Мысалы, мұнайды толық бөлшектеп, қалдықсыз
өндіріп, ықшамды түзгілерін нейтронды белсендіріп,
терең зерттеп, ванадий, германий, молибден секілді
құраушыларын анықтап не, әсіресе сланецтердің,
сұйық және газды көмірлі сутектерінен (углеводороды)
жұпар иісті құнды өнімдерінің көзі тиофен
мен оның туындыларын шығарып, мұнайды бағаласа;
күкіртінен қышқылын, коксынан электртегі (электрод) секілді
пайдалы өнім шығарса, төгіліп жатқан шикі заттарымыз
дүниенің байлығы болар еді. Мұнайы жоқ, Германия
секілді елдер бізден мұнайды шикі зат түрінде сатып алып,
мұнайды өңдеуші завод салып, оның құнды
бөлшектерін бұл қылып, байып, өркениетті елдердің
қатарында болу да. Ал ғылымсыз, ілімсіз, білімсіз оларға
ілесе алмай, болашаққа үміт артуға бола ма?
Сондықтан, келешекте жылутәсілдік арнайы
пәндерді, олардың физикалы химиялық негіздерін біле, жақсы
игеріп, болашақ жылутәсілдемелік өндірістің майталман
шебері болу – оған үлкен үлес қосу болар еді.
Бұл оқу құралында физикалы
химиялық, әсіресе жылулық әсердің көзі бола
алатын, құбылыстары мен олардың есептеу әдістері [1-6]
жылутәсілдемелік мәселелерімен [7-11]
ұштастырылып және жылуқозғалымдық [12-14] негізделіп, жылуқайраттықтың
үнемиеттік пен мекен қорғаулық көрнекті
мысалдарымен [15-19] қамтылып келтірілген.
1- бөлім. Жылу мен жұмыстың химиялық өзгерістері
1 Термохимия. Жылулық әсер
1.1 Химиялық жылуқозғалымның
негізгі ұғымдары
Термохимия [грекше thermos – тёплый – жылы +
латынша chimia – химия -заттардың тектесулік ілімі] - химиялық
құбылыстардың жылу әсерлерін ғылыми зерттейтін физикалық химияның
жылуқозғалымдық саласы.
Барлық заттардың затшалары
(молекулалары) өзінше қалыптасқан химиялық
түзгілерден құралған атомдардың жүйесі
болады. Әрбір заттың затшалық құрылысы
қандай күрделі болғанымен, берілген күйде
қасиеттері бірдей болады. Тек сыртқы себепті (жылулық,
сәулеленулік, электрлік, затшалардың соғылуы секілді)
әсерлер арқылы затшалардың құрылысы
өзгерсе, бұл дене жоғалып, басқа бір дене не бірнеше
денелер пайда болады. Олардың физикалы химиялық қасиеттері
басқа болады. Осы секілді бір денелердің басқа денелерге
өзгеру құбылысын химиялық тектесулер
дейміз. Бұған қатынасты басты және соңғы
денелерді химиялық тектесулердің құраушылары
(компоненті) дейміз.
Егер бір тектікүйдегі денелер тектессе, біртекті
(гомогенді) тектесу дейміз. Ал, әртүрлі
тектікүйдегі (газ бен қатты дене, не сұйық пен
қатты дене) денелер тектессе, әртекті (гетерогенді) тектесу
дейміз.
Тектесу теңдеулері заттың химиялық
құраушыларының тектесулік
(стехиометриялық) арақатынасын және
табиғаттын көрсетеді. Мысалы,
2СО + О2 = 2СО2 (1.1.1)
теңдеуі көміртегі тотығының екі киломолі мен
оттегінің бір киломолі тектескендегі көмірқышқылы
газдың екі киломолі пайда болатынын көрсетеді.
Стехиометрия [грекше stoicheion-основание-негізі,
элемент-түзгі+…метрия-өлшем = тектесулік] - заттардың
бір-бірімен тектесуінің ара қатынасты өлшемі.
Химиялық тектесу
теңдеулері келесідей жалпы түрінде жазылып, талдануы мүмкін
аА + вВ + ... = сС + dD + ... . (1.1.2)
Мұндағы
үлкен әріптер – химиялық түзгілерді, ал кіші
әріптері олардың балама еселеуіштерін белгілейді.
Химиялық
тектесудің әрбір кезеңіндегі басты құраушылары
мен өнімдері біртекті қоспаны құрады.
Мұны тұйықталған жылуқозғалымдық
жүйе ретінде қарауымызға болады. Осы жүйенің
көлеміне келтірілген СА , СВ , СС ,
... қоспаның құраушыларының киломоль
сандарын шоғырлары (концентрации) дейміз.
Тектесуші жүйенің
күйі үш мекендіктермен - көрсеткіштермен сипатталады.
Бұлардың ішіндегі қосымша көрсеткіш – шоғыр
- өзгермелі, ал қалған екеуі – V мен Т = тұрақты (тұрақты көлемді - ыстықтықты (изохорно - изотермическая)) не р мен Т = тұрақты (тұрақты қысымды -
ыстықтықты (изобарно -
изотермическая)) жүйелер болады.
Химиялық тектесулерде
жылу шығып не сіңіріліп (экзо - не эндотермиялық) отырылады.
Сондықтан тектесулі жүйенің ыстықтығы
өзгеріп тұрады. Тектесу ыстықтығын тұрақты
деп (мүлтіксіз - идеально) талдаған қолайлы.
Мұның мүмкінді екенін келесі мысалдан көруге болады.
Тұйық ыдыста (бомбада) жағылған отынның жану
жылулығы суға беріліп анықталады. Мұнда жану
өнімдері жану ыстықтығынан суытылып, отынның
бұрынғы ыстықтығына келтірілетіндігінен, химиялық
тектесу бұрынғы бір ыстықтықта өткендей,
қорытынды өзгермейді.
Химиялық
тектесулерде физикалық ішкі қайратқа затшалардың
өзара ішкі байланысының және ішкі атомдық
оптикалық деңгейлерінің сәулеленулік қайраттары
қосылып, химиялық ішкі қайратты
анықтайды.
Осы секілді химиялық тектесулерде механикалық
кеңею жұмысына сипаттаушы берненің кемуіне тең ең
үлкен жұмысы (не химиялық тектесудің пайдалы
(гальваникалық электр ағынының не отындық
түзгінің (топливный элементтің)) жұмысы LП
деп аталатын) қосылады. Мұнымен салыстыра, химиялық
тектесулердегі киломоль сандарының өзгерісімен жүйе
көлемінің өзгеруінен пайда болатын механикалық
кеңею L0 жұмысын ең кіші
жұмысы дейміз.
1.2 Химиялық тектесулердің
жылулық әсерлері
Жылулық әсері (тепловой эффект) - тектесу жүйесінің тек қана
көлемі өзгергендегі механикалық жұмыстың жылу мөлшері.
Химиялық жылуқозғалымда: тектесуде бөлінетін
(шығатын) жылуды (экзотермическая реакция) - оң санды, ал - сіңірілетін жылуды
(эндотермическая реакция) - теріс
санды деп атайды.
Жұмыстың
таңбалары, тәсілдік
жылуқозғалымдағыдай - оң санды деп жүйенің
қоршаған ортаға істейтін жұмысын, ал, керісінше,
қоршаған ортаның жүйеге беретін жұмысын - теріс
санды деп алады.
Егер тектесусіз тәсілді
жылуқозғалымдық жүйеде
E2 – E1
= Q – L (E = U + Ew + Eh) (1.2.1)
дейтін болсақ, химиялық тектесулерге және сол секілді
қайраттың өзгеруімен өтетін
құбылыстарға тәсілді жылуқозғалымның
бірінші заңын (1.1- баптың соңында айтқанымызды ескере)
келесідей жазамыз
U1 – U2 = Q + L0 + LП , (1.2.2)
яғни химиялық тектесулі жүйенің ішкі
қайратының төмендеуінен Q жылуы шығады
және көлемінің өзгеруінен L0
механикалық жұмысы мен тектесудің пайдалы LП
жұмысы пайда болады. Бұл құбылыстар бүкіл жүйенің
көлеміне қатынасты болатындықтан (1.2.2) үлкен
әріптермен жазылды.
Тектесудегі
маңыздың түрленуі қайтымсыз болатындықтан
теңдесулі жылуқозғалымдық күйге дейін
(жылуқозғалымның екінші заңына сәйкесті)
механикалықсыз жұмыстар жылуға толық өзгеріп, LП
= 0 болады. Бұл қорытынды, теңдесулі
күйде еркін (F=U-TS) қайраттың кемуі нөл болатынынан (dLTV=dLEHY=-dF=0) не осы теңдесулі күйде Т=тұрақты
болып, механикалықсыз жұмыстың нөл болатынынан да
белгілі [1, 2, 12, 13]. Сонымен, химиялық тектесудің жылуқозғалымдық
теңдесулі күйіндегі механикалықсыз жұмысы жоқ
ыстықтығы тұрақты өтетін химиялық
тектесудің ең үлкен Qеңү
жылулығын химиялық тектесудің жылулық әсері
дейміз. Бұл жағдайда (1.2.2) келесідей жазылады
U1 – U2 = Qеңү + L0 .
(1.2.3)
Жылуы шығатын
тектесулердің жылулық әсері оң мәнді, жылуы
сіңірілетін тектесулердің жылулық әсері (тәсілді
жылуқозғалымда ((1.2.1)-ге) кері) теріс мәнді болады.
Ыстықтығы мен
көлемі тұрақты тектесу жүйенің кеңею
жұмысы dL0 = pdV = 0 болатындықтан оның жылулық әсері
(1.2.3) бойынша ішкі қайратының кемуіне тең болады
QTVеңү = U1 – U2 . (1.2.4)
Ыстықтығы мен
қысымы тұрақты тектесу жүйенің кеңею
жұмысы L0 = p(V2 – V1) болатындықтан оның жылулық әсері (1.2.3) бойынша
қажырының (H = U + pV - энтальпия) кемуіне тең болады
QpTеңү
= QTVеңү - p(V2 – V1) = U1
– U2 - p(V2 – V1) = H1 – H2 .
(1.2.5)
Химиялық
тектесулердің басындағы және соңындағы
құраушыларын мүлтіксіз газдар деп қаралуы мүмкін
болғанда келесі күй теңдеулерін алуға болады
p1V1 = n1RmT; p2V2 = n2RmT. (1.2.6)
Сонда р мен Т = тұрақтыдағы кеңею жұмысы
L0
= p(V2 – V1) = (n2 - n1)RmT = DnRmT (1.2.7)
болатындықтан оның тектесудегі жылулық әсері
(1.2.5) бойынша
QpTеңү
= QTVеңү - DnRmT = U1 – U2 -
DnRmT . (1.2.8)
Мұнда ((1.1.1)-дегі
тектесудің басында n1=3 киломоль, ал
соңында n2=2 киломоль болып, көлемі
өзгергендегідей, жұмысы нөл болмағандықтан) n2
- n1 = Dn ¹ 0-де QpTеңү ¹ QTVеңү болады, яғни n2 - n1
= Dn ³ 0 не Dn £ 0 болғанда ((1.10) бойынша) сәйкесті QpTеңү
£ QTVеңү не QpTеңү
³ QTVеңү
болады, өйткені V мен Т = тұрақтыдағы тектесудегі QTVеңү = U1 –
U2 (1.2.4) шарт бойынша (V мен Т = тұрақты) күй
көрсеткіштеріне тәуелсіз (мүлтіксіз газдың
физикалық жылулық құрамының (ішкі
қайратының) тек ыстықтыққа
тәуелділігіндей), ал ішкі қайраттың химиялық
жылулығы (Т = тұрақтыда) атомдардың
сәулеленулік байланыстарына тәуелді.
1.3 Гесс заңы және
оның пайдалануы
V, Т = тұрақты мен р, Т = тұрақты
құбылыстардағы химиялық тектесулердің
жылулық әсерлері (1.2.4) мен (1.2.5)-лер бойынша сәйкесті
ішкі қайрат пен қажырдың
кемулеріне тең. Бұлар физикалық күй бернелері.
Сондықтан жылулық әсерлер тектесулік жүйенің тек
басты және соңғы күйлерімен анықталады. Бұл
қорытындыны 1840 жылы Г.И.Гесс тәжірибелі тауып бейнелегендіктен Гесс
заңы деп аталған.
Түзгілердің қосылып күрделі затқа
айналуындағы жылулық әсерін - құрылу
жылулығы деп, керісінше, күрделі заттың
түзгілерге бөлінуіндегі жылулық әсерін - ыдырау жылулығы деп атаймыз.
Гесс заңының келесі ілесулері (следствия) іс жүзінде қолданылуы (әсіресе толық
зерттелмеген химиялық тектесулердің жылулық әсерлерін
анықтауға) қолайлы:
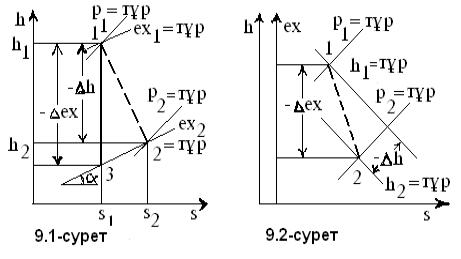
1 - ілесу. Құрылудың
жылулық әсері (1.1-сурет) ыдыраудың теріс таңбалы
жылулық әсеріне тең ![]() ;
;
2 - ілесу. Екі түрлі басты
(1.2-суреттегі 1 мен 2) күйлерден бір күйге жеткен
тектесулердің жылулық әсерлерінің айырымы бірінші басты
күйден екінші басты күйге өткен тектесудің
жылулық әсеріне тең ![]() ;
;
3 - ілесу. Бір күйден (1.3-сурет) екі күйге жеткен тектесулердің
жылулық әсерлерінің айырымы ақырлы
күйлерінің арасындағы тектесудің жылулық
әсеріне тең ![]() .
.
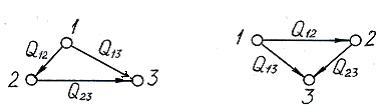
1.1-сурет 1.2-сурет 1.3-сурет
Гесс заңы әсіресе
күрделі не тәжірибелі бақылауы мүмкін болмайтын
химиялық тектесулердің жылулық әсерлерін, олардың
басқадай қолдан келетін тектесулерінің жылулық әсерлері
арқылы анықтауға пайдалы. Мысалы, көміртегінің
толық жану тектесуін
С +
О2 = СО2 + Q
(1.3.1)
бірінен соң бірі өтетін көміртегінің толық
жанбауындағы
С + 0,5О2 = СО + Q¢
(1.3.2)
және көміртегі тотығының қосымша
жағылуының тектесуі
СО + 0,5О2 = СО2 + Q² (1.3.3)
арқылы жүргізуге болады.
Мұндағы тектесулердің (1.3.1) мен
(1.3.3)-теріндегі жылулық әсерлер тәжірибелі оңай
анықталады, ал (1.3.3) тектесу іс жүзінде таза асырылмайды.
Бірақ, оның жылулық әсерін Гесс заңының
2(3)- ілесуі арқылы (1.2(1.3)- суреттегі Q13 = Q; Q12 = Q¢; Q23 = Q²)
Q¢ = Q - Q² (1.3.4)
деп анықтауға болады.
Химиялық тектесулердің белгісіз жылулық
әсерін Гесс заңы бойынша тектесулердің химиялық
теңдеулерін қосып не алып анықтауға болады. Бұл
мысалдағы (1.3.1)-ден (1.3.3)-ті алсақ
С + О2 - СО -
0,5О2 = СО2 + Q
- СО2 - Q²,
(1.3.5)
С + 0,5О2 = СО + Q - Q² (1.3.6)
шығады. Мұны (1.3.2)-мен салыстырсақ, (1.3.4)
шығады.
1- жаттығу. Жылулық
әсерлер. Гесс заңы
1.1-есеп (15.1[4]). Этил спиртінің С2Н5ОН
жану жылулығы Q = 1,415×106 кДж/кмоль. Көмір
қышқылы (углекислота) мен судың құрылу
жылулықтары сәйкесті 402000 және 285000 кДж/кмольдарға
тең. Спирттің құрылу х жылулығын
анықтаңыздар.
Шешімі. Этил спиртінің тікелей
жағылуының химиялық теңестігі келесі
![]() .
(1.3.7)
.
(1.3.7)
Егер сол спиртті көмір мен су тектеріне ыдыратып (Qы
= - Qқ = - х)
![]() (1.3.7)
(1.3.7)
әрқайсысын
жеке жақсақ, көмір қышқылы мен судың
құрылу тектесулерінің
2С + 2О2 Û 2СО2 + 2×0,402×106, (1.3.8)
3Н2 + 3О2/2 Û 3Н2О + 3×0,285×106 (1.3.9)
қорытындысы
(қосындысы) келесі болады
![]() . (1.3.10)
. (1.3.10)
Екінші жолғы (спирттың ыдырауы мен оның
өнімдерінің тектесулеріндегі) жылулық әсер ![]() (Гесс
заңының 2 - ілесуі бойынша) бірінші жолдағыдай (спирттің
тікелей жағылғандығындай) болуға тиіс
(Гесс
заңының 2 - ілесуі бойынша) бірінші жолдағыдай (спирттің
тікелей жағылғандығындай) болуға тиіс
![]() (1.3.11)
(1.3.11)
Сондықтан ![]() .
.
1.2-есеп (15.3[4]). Көмір қышқылы мен судың пайда
болғандағы метанның СН4 жану тектесуіндегі
жылулығы 887500 кДж/кмоль. Көмір қышқылы мен
судың құрылу жылулықтары сәйкесті 402000 мен
285000 кДж/кмоль.
Метанның құрылу х жылулығын
анықтаңыздар.
Шешімі. Метанның екі түрде (1)
тікелей және 2) түзгілеріне бөлшектеп)
жағылғандағы химиялық теңестіктері ((1.3.14) пен
(1.3.15)-тің қосындысы (1.3.16))
1) ![]() (1.3.12)
(1.3.12)
2)![]() (1.3.13)
(1.3.13)
С + О2 Û СО2 + 0,402×106, (1.3.14)
2Н2
+ О2 Û 2Н2О + 2×0,285×106, (1.3.15)
![]() (1.3.16)
(1.3.16)
Екінші жолғы жылулық әсер 972000 - х (Гесс
заңы бойынша жану әдісіне тәуелсіз) бастапқыдай
болуға тиістілігінен
![]() (1.3.17)
(1.3.17)
Сондықтан ![]() .
.
1.3-есеп
(15.5[4]). Этиленнің С2Н4 түзгілерінен
құрылу жылулығы 11300 кДж/кмоль және көмір
қышқылы мен судың құрылу жылулықтары
сәйкесті 402000 мен 285000 кДж/кмоль. Этиленнің жану
тектесуіндегі Q жылулығын анықтаңыздар.
Шешімі. 1)
Этиленнің тікелей жануындағы теңестігі
![]() (1.3.18)
(1.3.18)
Мұндағы Q - жылулық әсер.
2) Этиленнің
бөлшектерінен құралып
![]() (1.3.19)
(1.3.19)
түзгілері
жанғандағы теңестіктері (және (1.3.20) мен
(1.3.21)-дің қосындысы (1.3.22))
![]() (1.3.20)
(1.3.20)
![]() (1.3.21)
(1.3.21)
![]() (1.3.22)
(1.3.22)
Екінші жолғы жылулық әсер тікелей
жанғандағыдай болуға тиістілігінен
![]() (1.3.23)
(1.3.23)
1.4-есеп. Көміртегі С – ның СО - көміртегі тотығына дейін
тектескендегі: С + О2/2 Û СО р мен t = 25 C0 = тұрақтылардағы
жылулық әсері ![]() кДж/ кмоль. Бұл тектесудің
кДж/ кмоль. Бұл тектесудің ![]() тұрақтыларындағы
тұрақтыларындағы ![]() жылулық әсерін анықтаңыздар.
жылулық әсерін анықтаңыздар.
Шешімі. Газдардың (СО, О2)
көлемдерінен көміртегінің көлемі салыстырмалы өте
аз болатындықтан мольдердің сандарының өзгерісі ![]() болғандықтан:
болғандықтан: ![]() (1.3.23)
(1.3.23)
1.5-есеп (15.8[4]). Көміртегі
тотығының ![]() де жанғандағы жылулық әсері
де жанғандағы жылулық әсері ![]() Сол
ыстықтықтағы
Сол
ыстықтықтағы ![]() ны анықтаңыздар.
ны анықтаңыздар.
Шешімі. ![]() мен
мен ![]() лардың арақатынасы
лардың арақатынасы
![]() (1.3.24)
(1.3.24)
Мұндағы СО-ның жанғандағы моль
сандарының өзгерісін оның тектесу ![]() кейіптемесінен анықтаймыз
кейіптемесінен анықтаймыз
![]() (1.3.25)
(1.3.25)
Сондықтан
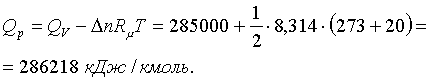 (1.3.26)
(1.3.26)
1.4 Кирхгоф заңы
Жылулық QV мен Qр әсерлері
(1.2.4) мен (1.2.5) бойынша физикалық күй көрсеткіштері: U
мен Н -тарға тәуелді. Мүлтіксіз газдарға QV
мен Qр тек ыстықтыққа тәуелділігінен
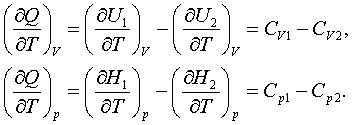 (1.4.1)
(1.4.1)
Бұларды жалпы түрде келесідей жазып
 (1.4.2)
(1.4.2)
жылулық әсердің ыстықтық туындысы
химиялық тектесудің басты және соңғы
құраушыларының ақиқаттық
жылусыйымдылықтарының айырымына тең екенін көреміз.
Жылулық
әсердің ыстықтыққа тәуелділігін Кирхгоф
заңы дейміз. Кирхгоф заңының кейіптемесін (1.4.2)-ді
аумаққылап табамыз
dQ = C1dT – C2dT; Q = Q0 + 0òT(C1 – C2)dT. (1.4.3)
Химиялық жылуқозғалымда
ақиқаттық мольдік жылусыйымдылықтарды (әдетті)
пайдаланады. Оларды тектесулердің басты және соңғы
құраушыларына келесідей бейнелеуге болады
mс = а + вТ +сТ2 + ... ,
(1.4.4)
mс¢ = а¢ + в¢¢Т +с¢Т2 + ... . (1.4.5)
Бұларды ескере, (1.4.3) Кирхгоф заңын
келесідей жазамыз
Q = Q0 + aТ + bТ2 + gТ3 + ... . (1.4.6)
Мұндағы Q0 – басты (Т
= 0 К –дегі) жылулық әсер, ал әр
дәрежедегі ыстықтықтардың еселеуіштері келесідей
анықталады
a = åna - ån¢a¢, b = (ånв - ån¢в¢)/2, g = (ånс - ån¢с¢)/3, ... . (1.4.7)
Сонымен, Гесс пен Кирхгоф
заңдарының физикалы химиялық және
жылутәсілдемелік маңыздылықтары белгісіз күрделі
тектесулердің жылулық әсерлерін анықтауға
және олардың ыстықтық тәуелділіктерін бейнелеуге
беретін мүмкіндіктері. Жылулық әсер, әдістемелік,
ыстықтық тұрақтыда қарапайым анықталып, оның
ыстықтық тәуелділігі қосымша Кирхгоф заңымен
табылады.
Әртүрлі тектесулердің жылулық
әсерлері халықаралық ұйымдастыру жүйесінің
(ҚҰЖ - ISO) тәртібі бойынша Т0 = 298 К мен р0 = 0,102325 МПа-ға
анықталып, арнайы әдебиет жүзінде (мысалы, [2]-де) келтіріледі.
Мұндай жылулық әсерлердің мәндері - қалыпты
(стандартные) мәндер деп аталады.
Кирхгоф Густав Роберт (1824-1887) – аса көрнекті
неміс физигі, 24 жасында диссертация қорғап, Берлин мен Гейдельберг
университеттерінің профессоры болған. Ол Р. Бунзенмен спектральді
талдауды ашқан, сәулеленулік жылуқозғалымның
негізін жасаған. ²Кирхгоф заңы² қайраттың кванттарын ашуға себеп болған.
2- жаттығу.
Жылулық әсерлердің ыстықтыққа
тәуелділігі
2.1-есеп (18.7[4]). Су буының
пайда болуының жылулық ![]() әсерін
ыстықтыққа тәуелді анықтаңыздар,
егер оның
әсерін
ыстықтыққа тәуелді анықтаңыздар,
егер оның ![]() дегі тәжірибелік мәні
дегі тәжірибелік мәні ![]() болса. Есепте келесі ақиқаттық
жылусыйымдылықтар ескеріледі (кДж/(кмольК))
болса. Есепте келесі ақиқаттық
жылусыйымдылықтар ескеріледі (кДж/(кмольК))
![]() (1.4.8)
(1.4.8)
![]() (1.4.9)
(1.4.9)
![]() (1.4.10)
(1.4.10)
Шешімі.Су буының пайда болуының
тектесу
![]() (1.4.11)
(1.4.11)
теңдеуінің
![]() жылулық әсерін ыстықтыққа
тәуелді анықтау үшін Кирхгофтің (1.4.2) кейіптемесін
келесідей пайдаланамыз
жылулық әсерін ыстықтыққа
тәуелді анықтау үшін Кирхгофтің (1.4.2) кейіптемесін
келесідей пайдаланамыз
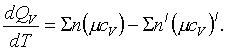 (1.4.12)
(1.4.12)
Мұндағы текттесудің басты заттарының және
соңғы өнімдерінің (1.4.8) – (1.4.11) - лерге
сәйкесті жылусыйымдылықтарының қосындылары
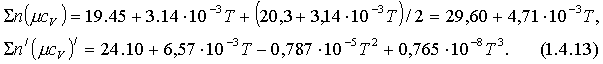 Сондықтан, (1.4.13)-ті (1.4.8)-ге қойсақ
Сондықтан, (1.4.13)-ті (1.4.8)-ге қойсақ
![]() (1.4.14)
(1.4.14)
Мұның аумаққысы ![]() (1.4.15)
(1.4.15)
Мұндағы аумаққылаудың ![]() дегі тектесудің жылулық
дегі тектесудің жылулық ![]() әсерін сол
әсерін сол ![]() дегі тәжірибелік мәні
дегі тәжірибелік мәні ![]() ді ескере табылған аумаққыдан келесідей
анықтаймыз
ді ескере табылған аумаққыдан келесідей
анықтаймыз
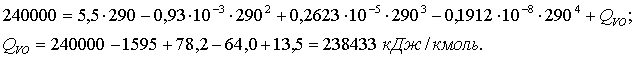
Сонымен, су буының пайда болуының жылулық ![]() әсерінің
ыстықтыққа тәуелді ізделінген кейіптемеміз келесі
болады
әсерінің
ыстықтыққа тәуелді ізделінген кейіптемеміз келесі
болады
![]() .
.
2.2-есеп (15.19[4]). Көміртегі
тотығы СО мен Н2О су буының ![]() дегі пайда болуларының жылулықтары:
дегі пайда болуларының жылулықтары: ![]() бен
бен ![]()
![]() (1.4.16)
(1.4.16)
тектесуінің ![]() жылулық
әсерін ыстықтыққа тәуелді және
жылулық
әсерін ыстықтыққа тәуелді және ![]() де анықтаңыздар. Келесі ақиқатты жылусыйымдылықтар (кДж/(кмоль)) ескерілсін:
де анықтаңыздар. Келесі ақиқатты жылусыйымдылықтар (кДж/(кмоль)) ескерілсін:
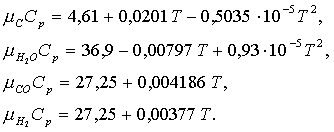 (1.4.17)
(1.4.17)
Шешімі. Кирхгофтің (1.4.6)
кейіптемесін келесідей пайдаланамыз
![]() (1.4.18)
(1.4.18)
Мұның ![]() еселеуіштерін
(1.4.16) мен (1.4.17) арқылы келесідей анықтаймыз
еселеуіштерін
(1.4.16) мен (1.4.17) арқылы келесідей анықтаймыз

![]() .
.
Бұларды (1.4.10)-те ескеріп, Кирхгоф кейіптемесінің
мұндағы есептік түрін табамыз
![]() (1.4.19)
(1.4.19)
Берілген тектесудің ![]() дегі жылулық әсерін анықтау үшін СО
мен Н2О-лардың пайда болу тектесулерінің химиялық
кейіптемелерін жазып
дегі жылулық әсерін анықтау үшін СО
мен Н2О-лардың пайда болу тектесулерінің химиялық
кейіптемелерін жазып
![]() (1.4.20)
(1.4.20)
![]() (1.4.21)
(1.4.21)
(1.4.20)-дан
(1.4.21)-ді алсақ, (1.4.16) өзінің
![]()
жылулық әсерімен шығады.
Мұны (1.4.19)-те ескере, ![]() ді анықтаймыз
ді анықтаймыз
![]() Сонымен, Qp0-дің
мәнін (1.4.19)-те ескере, берілген (1.4.16) тектесудің
жылулық әсерінің кейіптемесін ыстықтыққа
тәуелді келесідей табамыз:
Сонымен, Qp0-дің
мәнін (1.4.19)-те ескере, берілген (1.4.16) тектесудің
жылулық әсерінің кейіптемесін ыстықтыққа
тәуелді келесідей табамыз:
![]() (1.4.21)
(1.4.21)
Мұның ![]() дегі мәні
дегі мәні
![]()
1.5 Еркін және байланған
қайраттар. Тұрақты ыстықтықты жұмыс
Заттың көптеген затшаларының санды
мөлшері - маңыз (масса) болады. Олардың
мүмкіндік және қозғалымдық қайраттарын,
мысалы су (СЭС) мен бу шығырларындағыдай, пайдалы механикалық
жұмысқа (мүлтіксіз - 100 пайыз- ды) өзгертуге болады.
Сол затшалардың ішкі қайраттарының кинетикалық
бөлімі маңыздың ыстықтығын анықтайды.
Заттың ішкі қайраты да пайдалы жұмысқа өзгерілуі
мүмкін.
Затшалардың қайраттарын пайдалы
жұмысқа өзгертудің бір (жылулық)
әдісінде екі дененің (көлемнің) арасында ыстықтық
айырымының болуы қаралады. Жұмыс жасаушы затты жұмыс
дене дейміз. Ол айналу құбылысын жасап, әрбір
айналымын бір күйден бастап отыруы мүмкін. Ыстықтық
айырымына негізделген бұл әдіс, ең алдымен, жылу
күшті құрылғыларды (теплосиловые машины)
пайдаланады. Ыстықтық айырымын анықтаушы отынның бітуімен
жылу күшті құрылғылар (ЖЭС-лар) тоқтайды.
Екінші әдісте ыстықтықтың айырымысыз-ақ (тұрақты
ыстықтықты) жұмыс жасалады. Бұл әдіс
жұмыс дененің қалдықты
өзгерістерімен байланысты. Жұмыс дененің өзгерісі
тоқталуымен тұрақты ыстықтықты істейтін
құрылғы (мысалы, құйынды жылуөндіргіштер)
тоқтайды.
Жылуқайраттық бізге аса белгілі [15,16] саланың
негізінде бірінші әдіс пайдаланады. Сондықтан мұнда екінші
әдісті қысқаша қараймыз.
Тұрақты ыстықтықта істейтін
(мысалы, сығылған ауалы) қозғалтқыш
қоршаған ортадан алған жылуын мүлтіксіз (идеально)
шекті жағдайда (Qқайт, қайтымды)
толық (100%) жұмысқа өзгертеді (ПЖЕ = 1).
Жылудың мұндағы жұмысқа өзгеруі
сығылған ауаның сиретілуінде өтеді. Енді
сығылған ауаның сиретілуі сығылған ауаның
энтропиясын өсіреді десек
DS = Qқайт/Tтолық (не Qқайт = TтолықDS).
(1.5.1)
Энтропияның осы өсуімен жұмыс
дененің (ыстықтық тұрақтыдағы жұмыс
жасалғандағы) қалдықты және қатерлі
ілесулерінің өзгерістерін байланысты. Осы өзгерістердің
әсерін сығылған ауаның сиретілуімен байланыстырмай
қарайық.
Жылуқозғалымның бірінші бастамасы
Q = L + DU
(1.5.2)
жүйеге келтірілген Q жылудың сыртқа
берілген L жұмысқа және ішкі DU қайраттың өсуіне қалай
таратылатынын көрсетпейді. Бұл жылуқозғалымның
екінші бастамасымен анықталады. Мұны келесідей жазып
Q = Qқайт = TтолықDS,
(1.5.3)
(1.5.2)-ге қойсақ,
L = TтолықDS - DU
(1.5.4)
болады. Мұны ыстықтық
тұрақты құбылысқа келесідей жаза аламыз
LТ = - D(U - TтолықS).
(1.5.5)
Мұндағы
жақшаның ішіндегі: U мен S – күй
бернелері; Т – күй көрсеткіші. Сондықтан
U – TS = F
(1.5.6)
- күй бернесі. Мұны еркін қайрат деп
атайды. Еркін қайрат ішкі
қайраттан келесіге кем
U – F = TS. (1.5.7)
Бұл-қоршаған (ортаға кеткен,
яғни) ортамен байланған қайрат (связанная
энергия - анергия) деп аталатын ішкі қайраттың пайдалы жұмыс
жасай алмайтын (қайраттың түрленбейтін) бөлшегі.
Сонымен
айтқанымызды және (1.5.6)-ды (1.5.5)-те ескерсек,
LТ = - D F (1.5.8)
- қайтымды Т =
тұрақты құбылыстағы пайдалы жұмыстың
ең үлкен мәні - еркін қайраттың (ішкі
қайраттың (мұнда) жұмыстық үлесі) кемуіне
тең екенін көреміз.
Қаралып
отырылған мысалымыздағы (баллондағы) сығылған
ауаның Т = тұрақтыдағы сиретілуінің ең үлкен
жұмысын (ішкі қайраты өзгермейтіндіктен (DUТ = 0)) (1.5.4) мен (1.5.8)
арқылы келесідей табамыз
LТ = TтолықDS = - D F. (1.5.9)
Мұндағы
DST = mRln(p1/p2); (1.5.10)
m мен
R – ауаның маңызы (кг) мен газ тұрақтысы,
Дж/(кг×К);
p1
мен p2 – ауаның басты және
соңғы қысымдары, МПа.
2 Химиялық кинетиканың
басты ұғымдары
Химиялық кинетика - химиялық
құбылыстардың уақытқа тәуелді
заңдылықтарының ілімі. Осы бапта келесі тарауда қаралатын химиялық тектесудің
ұғымдарына қажетті химиялық тектесудің
жылдамдығы мен жылдамдық
тұрақтысының (константа скорости) және маңыздық
әрекет заңының (закон действующих масс) түсініктерін
өтіп, 5- тарауда химиялық тектесудің тектік пен теңдесу
заңдылықтарына сүйене химиялық кинетикаға жататын
химиялық тектесудің жылдамдығының
ыстықтыққа тәуелділігін қараймыз.
2.1 Химиялық тектесудің
жылдамдығы мен жылдамдық тұрақтысы
және
маңыздық әрекет заңы
Теңдеуі (1.1.2)
аА + вВ + ... = сС + dD + ... (2.1.1)
химиялық
тектесудің қарқыны бір құраушысының
шоғырының уақытқа тәуелді өзгерісімен
сипатталады, мысалы
wA = - dCA/dt.
(2.1.2)
Егер химиялық (2.1.1) тектесудің басты
құраушыларының тектесулік қатынастарының
(стехиометрические соотношения; мольдерінің) саны үштен асса,
мұндай тектесу міндетті түрде күрделі болып, бірнеше
түзгілі (сатылы) өтеді. Әрбір құраушының
химиялық тектесу (2.1.2) жылдамдығы уақыт бойы өзгеріп
тұрады. Сондықтан жеткілікті Dt
аралығындағы сол құраушының DСА
өзгерісін осы Dt-ға
қатынасын алып, тектесудің орта жылдамдығын келесідей
сипаттауға болады
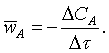 (2.1.3)
(2.1.3)
Уақыт бойымен (dt, Dt > 0) басты А құраушының шоғыры азаятынынан (dСА,
DСА < 0) жылдамдықтың осы екі (2.1.2) мен (2.1.3) түрлері
теріс мәнді болады. Егер тектесудің жылдамдығын оның
өнімдерінің құраушыларының өзгерістерімен
сипаттасақ, мысалы
wD = dCD/dt не ![]() (2.1.4)
(2.1.4)
деп,
жылдамдықтар дұрыс мәнді болар еді. Дегенмен, химиялық
тектесулердің жылдамдықтарының жоғарғылардай
((2.1.2) - (2.1.4)) анықталулары
қолайсыз, өйткені олар өзара сәйкес (А
затының а киломолі шыққанына С
затының с киломолі пайда болуы) болғанымен,
әртүрлі
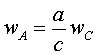 .
(2.1.5)
.
(2.1.5)
Сондықтан химиялық
тектесулердің жылдамдық ілімінің негізіне маңыздық
әрекетінің заңы алынады. Маңыздық
әрекет заңы бойынша: әрбір кезеңдегі А + В = С + D тектесудің жылдамдығы
тектесуші заттардың шоғырларының көбейтіндісіне
сәйкес
w = - dC/dt = kСАСВ. (2.1.6)
Мұндағы сәйкестік
еселеуіші k – жылдамдықтың тұрақтысы деп
аталады.
Маңыздық әрекет
заңын келесідей түсіндіруге болады. Тектесудің әрбір
түзгісіне затшалардың соқтығысуы қажетті. Ал
тектесудің жылдамдығы осындай соқтығысулардың
жиілігіне сәйкес, яғни тектесуші затшалардың санына
сәйкес. Тектесуші затшалардың әрқайсысы бірнеше
мольдерден болса, (2.1.1) секілді күрделі химиялық тектесулерде
әрбір А,В,... құраушылардың
шоғырлары (2.1.6) секілді химиялық жылдамдыққа а,в,...
ретпен еніп, келесідей анықталады
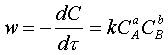 ¼ . (2.1.7)
¼ . (2.1.7)
Тектесуші заттардың газ күйіндегі химиялық
тектесудің жылдамдықтары осылай анықталады. Егер тектесуге
қатты дене не сұйық заттар қатынасса, олардың
көлемдері газ күйлерінің көлемдерінен салыстырмалы
өте аз болатындықтан, тектесудің жылдамдығына
әсер етпейді. Сондықтан қатты денелер мен сұйық
заттардың шоғырлары маңыздық (дұрысы:
көлемдік) әрекет заңында ескерілмейді. Мысалы,
көміртегінің жануындағы
С + О2
= СО2 (2.1.8)
тектесудің
жылдамдығы оттегінің шоғырымен ғана анықталады
w = kСО2.
(2.1.9)
Салыстыру үшін сутегінің
жануын алсақ
2Н2 +
О2 = 2Н2 О, (2.1.10)
оның
тектесу жылдамдығы тектесуші газдардың шоғырларымен
анықталады
w = kС2Н2СО2
. (2.1.11)
3 Химиялық теңдесу. Пайдалы жұмыс. Химиялық
мүмкіндік
3.1 Химиялық тектесулердің қайтымдылығы мен
теңдесуі
және
теңдесу тұрақтылары
Химиялық тектесулер әдетте
соңғы өнімдеріне дейін өтетінінен олар бір
бағытты (тура) болып сезіледі. Дегенмен, тура тектесулермен қатар
соңғы өнімдерінен басты құраушылары пайда болып,
кері тектесулер де жүріп жатады.
Егер кері тектесудің w2 жылдамдығы
тура тектесудің w1 жылдамдығынан өте
аз (w2 << w1)
болса, химиялық (2.1.1) тектесу
аА + вВ + ...® сС + dD
+ ... . (3.1.1)
қайтымсыз болады.
Егер берілген сыртқы шарттарда кері тектесудің w2
жылдамдығы тура тектесудің w1 жылдамдығымен
шамалас (w2 @ w1)
болса, химиялық (2.1.1) тектесу
аА + вВ + ...Û сС + dD + ... . (3.1.2)
қайтымды болады.
Маңыздық
әрекет заңы (2.1.7) бойынша тектесудің қорытынды w
жылдамдығын келесідей жаза аламыз
![]() .
(3.1.3)
.
(3.1.3)
Химиялық тектесудің
қорытынды жылдамдығы w = 0 болғанда
химиялық жүйенің затшалар санының өзгерілуі
тоқталып, сыртқы шарттары өзгермесе, тұрақты
болады. Дегенмен, қарама - қарсы бағытты химиялық
тектесулер біргелкі (w2 @ w1)
жылдамдықтармен жүріп жатады.
Химиялық тектесудің
мұндай қозғалымдық теңелу күйі химиялық
теңдесу (химическое равновесие) деп аталады.
Химиялық теңдесудің шарты тура және
кері қайтымды тектесулердің жылдамдықтарының
теңділігімен анықталады
![]() . (3.1.4)
. (3.1.4)
Мұндағы С – тектесудің құраушыларының
теңдесулік шоғырлары.
Теңдескен жылдамдықтардың
тұрақтыларының қатынасын
 (3.1.5)
(3.1.5)
- теңдесу
тұрақтысы деп атайды.
Химиялық теңдескен
жүйенің V көлеміндегі i таңбалы
газ құраушысының киломольінің сандары ni
болса, оның шоғыры
Сi = ni/V, киломоль/м3
(3.1.6)
болады.
Бұл газдың күй
теңдеуін шоғырлығы арқылы келесідей жаза аламыз
piV
= niRmT; pini/Ci
= niRmT; pi = CiRmT. (3.1.7)
Егер мұнан i газының
шоғырын анықтап
Ci = pi/(RmT),
(3.1.8)
(3.1.5)-те
ескерсек,
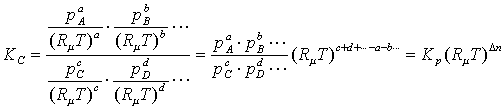 (3.1.9)
(3.1.9)
болады.
Мұндағы
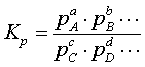 (3.1.10)
(3.1.10)
- тектесу
құраушыларының шоғырлары арқылы анықталатын
(3.1.5) теңдесу тұрақтысы секілді сол құраушыларының
үлестік қысымдары арқылы анықталатын теңдесу
тұрақтысы;
Dn = c + d + ¼ - a – b - ¼ - тектесуді құраушылардың киломольдарының сан
өзгерісі.
Теңдесу тұрақтылары
арқылы химиялық тектесулердің дәрежесін (толығын)
және теңдесулік құрамын анықтауға болады.
Күрделі химиялық
тектесулердің түзгілік тектесулері қатар өтеді.
Химиялық тектесудің жүйесі теңдескенде әрбір
тектесулері де теңдеседі. Сондықтан бір тектесуінің теңдесу
тұрақтысы арқылы барлық тектесу жүйенің теңдесулік құрамын
анықтауға болады. Бұған қоса, сол себептен
әр тектесудің теңдесу
тұрақтылары өзара байланысты және осы себептен бір
тектесудің белгілі теңдесу тұрақтысы арқылы
басқа (тікелей зерттелмейтін) тектесулердің теңдесу
тұрақтыларын анықтауға болады.
Мысалы, келесі тектесудің теңдесу Kp тұрақтысын
анықтау қажет болсын
2СО + 2Н2
Û СН4 + СО2. (3.1.11)
Егер қосындысы мұны беретін келесі екі тектесулердің
2СО Û С + СО2; С + 2Н2
Û СН4
(3.1.12)
теңдесу
тұрақтылары
Кр¢ = рСО2/рСО2 мен Кр² = рН22/рСН4 (3.1.13)
белгілі болса,
Кр¢× Кр² = (рСО2× рН22)/( рСН4× рСО2) = Кр (3.1.14)
(3.1.11)-ге
сәйкес болады.
3.2 Ыдырау мен ыдыраудың дәрежесі және мұның
теңдесу
тұрақтысымен
байланысы
Сыртқы күй көрсеткіштері (р,Т) өзгергендіктен пайда
болған химиялық күрделі заттың қарапайым
бөлшектерге бөліну тектесуін ыдырау (диссоциация)
дейміз. Ыдырау басталысымен басты зат пен оның өнімдері арасында
химиялық теңдесу болғанша жалғасады. Басты заттың
және оның өнімдерінің теңдескен
қоспасының қысымы мен ыстықтығына тәуелді
ыдырау тектесуінің тереңдігін
ыдырау дәрежесі (степень диссоциации) дейміз. Ыдырау
дәрежесі басты заттың теңдесу күйіне дейінгі ыдырауының
(a) үлесімен анықталады. Ыдырау құбылысының жалпы
теңдеуі келесідей жазылады
аА Û вВ + сС + ... . (3.2.1)
Ыдырау құбылысының теңдесу
тұрақтысы
 (3.2.2)
(3.2.2)
азайса
(ұлғайса), ыдырау тереңдеп (тайыздап), ыдырау дәрежесі a ұлғаяды (азаяды), яғни (3.2.1)-дегі
ыдырауда Kp мен
a тәуелділігі
(Kp = f (a)) кері сәйкесті.
Химиялық тектесудің теңдесу тұрақтысы
қысым мен ыстықтыққа тәуелді. Оның Кр(Т)
тәуелділігін 5- тарауда көреміз. Ал, Кр
(мен Кс)-лардың қысымға
тәуелсіздігінен (3.1.10)-дағы рі = rip (ri = ni/n; (3.1.9)-да сі-ді)
деп, табылған Кn теңдесу
тұрақтысының жүйенің р қысымына
тәуелділігін келесідей қараймыз
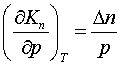 . (3.2.3)
. (3.2.3)
Бұл кейіптемені ыдырау тектесуінде қолдансақ, оның
киломоль сандарының өзгерісіне байланысты келесі үш
жағдайды көреміз
егер Dn > 0 болса, dp > 0 де: dКn > 0, da < 0,
(3.2.4)
егер Dn < 0 болса, dp > 0 де: dКn < 0, da > 0, (3.2.5)
егер Dn = 0 болса, dp = 0 де: dКn = 0, da = 0, (3.2.6)
яғни dКn
мен da 1- мен 2- жағдайларда (3.2.4) бен (3.2.5)-дай
қысымға тәуелді, ал 3- жағдайда (3.2.6)
қысымға тәуелсіз.
Әрбір тектесудің
теңдесуіне сәйкесті dKp мен da-нің өз байланысы болады. Мысал ретінде
көмірқышқылының (көміртегі қостотығы)
ыдырауын қарайық
2СО2
Û 2СО + О2. (3.2.7)
Бұл Dn > 0 жағдайына (3.2.4) жатады. Мұндағы СО2-нің
ыдырау дәрежесі a болсын. Сонда теңдесу кезеңіне СО2-нің
2 киломольінің nСО2 = 2(1 - a ) киломолі
қалады, ал СО-ның nСО = 2a және О2-нің
nО2 = a киломолі пайда болады. Сонда теңдескен қоспада
(жүйеде): nж = nСО2 + nСО + nО2 = 2(1 - a ) + 2a +
a = 2 + a киломоль болады.
Қоспаның құраушыларының үлестік
қысымдары келесілерге теңеледі
pCO2 = nCO2pж/nж = 2(1 - a )pж/(2 + a ); pCO = nCOpж/nж =
= 2apж/(2 + a ); pO2 = nO2pж/nж = apж/(2 + a ). (3.2.8)
Сонда теңдесу тұрақтысы мен ыдырау дәрежесі
келесідей байланысады
Кр = рСО22/( рСО2 × рО2) = [2(1 - a )pж/(2 + a )]2/í[2apж/(2 +
+ a )]2apж/(2 + a )ý = [(1 - a )2(2 + a )]/a3pж. (3.2.9)
Осы әдіспен Dn < 0 мен Dn = 0 тектесу жағдайларындағы теңдесу
тұрақтысы мен ыдырау дәрежесінің байланыс
теңдеулері құрастырылады.
Кейде ыдырау (3.2.1) кейіптемесінің басты заты сол жағында
болмай оң жағында жазылуы мүмкін. Мұндай
жағдайларда теңдесу тұрақтысы (3.2.2) керісінше жазылып
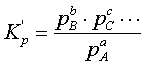 , (3.2.10)
, (3.2.10)
ыдырау
дәрежесімен байланысы тура сәйкесті болады (яғни![]() өссе a де өседі).
өссе a де өседі).
3.3 Химиялық тектесулердің
жылуқозғалымдық теңдесу құбылыстары
мен теңдескен
күйлерінің жалпы шарттары
Жылуқозғалымдық
жүйенің термиялық көрсеткіштері (р,v,Т)
мен еселеуіштерін (a,b,g) және калориялық жылусыйымдылықтары (cp,cv)
мен механикалық емес химиялық ең үлкен пайдалы LП
(1.2.2)-дегі жұмыс
секілді қасиеттерін (яғни калориялық U,H,S бернелерін
термиялық р,v,Т көрсеткіштері арқылы)
айқын бейнелей алатын жылуқозғалымдық бернелерді
сипаттағыш (характеристические функции) дейді.
Жылуқозғалымдық жүйенің бір күйінен
екінші күйіне қайтымды өзгергендегі сипаттағыш
бернелердің кемулері ең үлкен жұмысын беретіндігінен
сипаттағыш бернелер жылуқозғалымдық
мүмкіндіктер деп аталады. Жылуқозғалымдық
жүйедегі заттардың маңыздары өзгерулерімен байланысты
(химиялық, тектікүй секілді) құбылыстардың
сипаттағыш бернелерін химиялық мүмкіндіктер
дейміз. Олар: U – ішкі
қайрат, H = U + pV -
қажыр (энтальпия), F = U - TS – еркін қайрат (Гельмгольц
мүмкіндігі (потенциал), Гельмгольц қайраты), Ф (фи) = H – TS
– еркін қажыр (Гиббс мүмкіндігі, Гиббс қайраты).
Олардың тек әдетте қаралатын мекендіктерде ғана химиялық
мүмкіндіктер болатыны 4.7- бапта көрсетіледі.
Гиббс
Джозайя Виллард (1839-1903) – аса көрнекті американдық физик; 15,
24, 32 жастарында сәйкесті орта білімді, философия докторы, профессор
болған. Гиббстың статистикалық механикасы мен
жылуқозғалымдық ғылыми еңбектері Лапластың
аспандық механикасы мен Максвеллдің
электрқозғалымдық-тай дәрежеде.
Гельмгольц Герман Людвиг Фердинанд (1821-1894) - аса көрнекті неміс
ғалымы, дәрігер, физиология мен физика профессоры, Берлиннің
физикалы тәсілдік институтының директоры болған. Оның
аса жетістігі – химиялық құбылыстардың
жылуқозғалымдық теориясын жасағаны.
Жылуқозғалымның II заңының теңдеуі
dS ³ dQ/T. (3.3.1)
Жылуқозғалымдық жүйенің теңдеспеген
күйінен теңдескен күйіне жылу алмасусыз өтуі
(3.3.1)-дің dS > 0 түрімен бейнеленеді. Жылуқозғалымдық
жүйенің жылуалмасусыз қайтымды (S = тұрақты) теңдескен күйінің
шарты (3.3.1)-ге сәйкес энтропияның ең үлкен
мәнімен анықталатыны белгілі
dS = 0; d2S < 0; S = Sеңү.
(3.3.2)
Химиялық тектесу секілді құбылыстарда бұл шарт
басқадай күй бернелерімен бейнеленуі мүмкін. Химиялық
пайдалы жұмыс жасалмайтын жүйеге, жылуқозғалымның
I және II заңдарын ұштастырып өзгерте, келесідей жаза аламыз
dS ³ dQ/T; TdS ³ dQ = dU + pdV; 0³ dU + pdV- TdS;
dUV,S£ 0; d2UV,S³ 0, (3.3.5)
dS ³ dQ/T; TdS ³ dQ = dH - Vdp; 0³ dH - Vdp - TdS; dHp,S£ 0; d2Hp ,S³ 0. (3.3.6)
Бұларды V,T = тұрақты және p,T = тұрақты жүйелерге шаққылы мен аумаққылы және Гельмгольц
пен Гиббс мүмкіндіктері арқылы келесідей сәйкесті жаза аламыз
0³ dU - TdS; U2 – U1
– T(S2 – S1) £ 0; dF£ 0; F2 – F1£ 0,
(3.3.5)
0³ dH - TdS; H2 – H1
- T(S2 – S1) £ 0; dФ£ 0; Ф2 – Ф1£ 0. (3.3.6)
Мұндағы және төмендегі келесі таңбалар: ²=² - қайтымды және ²<² - қайтымсыз құбылыстарға арналған.
Сондықтан V,T = тұрақты және p,T
= тұрақты жүйелердегі химиялық тектесулер секілді
қайтымды құбылыстардың теңдескен
күйлерінің шарттары сәйкесті еркін қайрат пен еркін
қажыр бернелерінің ең кіші мәндерімен анықталады
dF = 0; d2F
> 0; F = Fеңк, (3.3.7)
dФ = 0; d2Ф> 0; Ф = Феңк. (3.3.8)
Жылуқозғалымның жоғарыда қаралған
әртүрлі теңдесу және теңдескен
жүйелерінің жалпы шарттары 3.1- кестеде келтірілген. Бұлар
да, (3.3.1) секілді, жылуқозғалымның II заңының
теңдеулері.
3.1- кесте Химиялық тектесулерінің
жылуқозғалымдық теңдесу
құбылыстары мен теңдескен күйлерінің жалпы
шарттары
|
Құбылыс шарттары |
Q = 0; dQ = 0 |
V,S=тұрақты (3.3.3) |
p,S=тұрақты (3.3.4) |
V,T=тұрақты (3.3.5), (3.3.7) |
p,T=тұрақты (3.3.7), (3.3.8) |
|
Теңелу құбылысы |
dS > 0 (3.3.1) |
dU < 0 (3.3.3) |
dH < 0 (3.3.4) |
dF < 0 (3.3.5) |
dФ < 0 (3.3.6) |
|
Теңелген күй |
S = Sеңү (3.3.2) |
U = Uеңк (3.3.3) |
H = Hеңк (3.3.4) |
F = Fеңк (3.3.7) |
Ф = Феңк (3.3.8) |
|
Қайтымды теңелген күй |
dS = 0; d2S < 0 (3.3.2) |
dU = 0; d2U > 0 (3.3.3) |
dH = 0; d2H > 0 (3.3.4) |
dF = 0; d2F > 0 (3.3.7) |
dФ = 0; d2Ф > 0 (3.3.8) |
3.4 Жылу әсері мен пайдалы жұмыстың Гиббс пен Гельмгольц
теңдеулері
Жылуқозғалымның I
заңының (1.2.2) химиялық теңдеуінде ішкі
қайраттың
U1 – U2 = Q + L0 + LП (3.4.1)
жылу Q мен механикалық (кеңею) L0
және механикалық емес (химиялық секілді)
пайдалы LП жұмыстары арқылы кемуі бейнеленіп, LП
= 0 дегі QV мен Qр жылулық әсерлері (1.2.4) мен (1.2.5)-те
анықталып еді. Енді осы белгілі QV мен Qр
жылулық әсерлері арқылы пайдалы LП жұмысты бейнелейік. Сипаттағыш
бернелердің теориялық ірге тасын қалаушы Гиббс пен
Гельмгольцтың аттарымен Q мен LП -лердің
байланыс теңдеулері аталған.
Жылулық әсері Q
мен пайдалы жұмыс LП жұмыстың
байланыс теңдеулерін табу үшін Гельмгольц (F = U-TS) пен Гиббс (Ф = H–TS) мүмкіндіктерін
шаққылап жылуқозғалымның I
заңының теңестіктері
TdS = dU + pdV, (3.4.2)
TdS = dH – Vdp (3.4.3)
арқылы
келесідей өзгертейік
dF = dU – TdS – SdT = | dU – TdS
= – pdV (3.4.2) | = – pdV – SdT, (3.4.4)
dФ = dH – TdS – SdT = | dH – TdS
= Vdp
(3.4.3) | = Vdp – SdT. (3.4.5)
Бұлардан Т=тұрақтыдағы
қайтымды (химиялық тектесу, шықтану секілді)
құбылыстардағы механикалықсыз жұмыстардың
ең үлкен мәндері Гельмгольц пен Гиббс
мүмкіндіктерінің кемулеріне тең екенін көреміз
dLП = pdV = -
dFТ; LП = F1 – F2 = U1 – U2 – T(S1 – S2),
(3.4.6)
dLП = - Vdp = - dФТ; LП = Ф1 – Ф2 = H1 – H2 – T(S1 – S2). (3.4.7)
Мұндағы ішкі қайрат пен қажырдың кемулері V,T
= тұрақты мен p,T = тұрақты
механикалықсыз пайдалы жұмыстары жоқ (LП
= 0) жүйелердің жылулық әсерлері
екенін (1.2.4) мен (1.2.5)-тер бойынша ескерсек, (3.4.6) мен (3.4.7)-лерді
келесідей жаза аламыз
LПV = QV – T(S1 – S2), (3.4.8)
LПР = Qр – T(S1 – S2). (3.4.9)
Бұлардың тек Q мен LП –ларының
байланыстарын қалтыру үшін энтропияларынан құтыламыз.
Ол үшін Гельмгольц пен Гиббс мүмкіндіктерінің
толық туындыларын (3.4.4) пен (3.4.5)-термен салыстырамыз
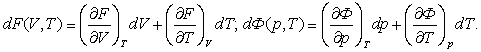 (3.4.10)
(3.4.10)
Сонда келесілерді табамыз
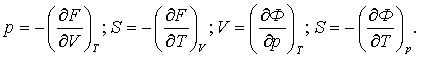 (3.4.11)
(3.4.11)
Мұндағы энтропиялардың мәндерін сәйкесті
(3.4.8) бен (3.4.9)-ға қойсақ, келесілерге ие боламыз
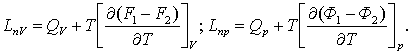 (3.4.12)
(3.4.12)
Егер мұндағы Гельмгольц пен Гиббс
мүмкіндіктерінің кемулері механикалықсыз пайдалы
жұмыстардың ең үлкен мәндеріне тең екенін LПV
= F1 – F2 (3.4.6) мен LПP = Ф1 – Ф2 (3.4.7) бойынша ескерсек, сол механикалықсыз пайдалы
жұмыстардың ең үлкен LП
мәндерін QV мен Qр жылулық
әсерлері арқылы анықтайтын Гельмгольц пен Гиббс
теңдеулерін келесідей табамыз
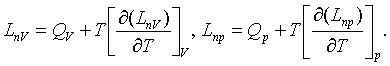 (3.4.13)
(3.4.13)
Ішкі қайрат U мен H
қажырдың F пен Ф-лермен байланыстыратын
Гельмгольц пен Гиббс теңдеулерін F=U-TS пен Ф=H–TS бернелерінен энтропияларды
(3.4.11) арқылы шығарып табамыз
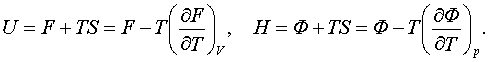 (3.4.14)
(3.4.14)
3.5 Сипаттағыш бернелердің химиялық мүмкіндіктері
Сипаттағыш
бернелердің тектескіштердің өзгермелі маңыздарына
тәуелділігін химиялық мүмкіндіктер (потенциалы) дейміз.
Тек қана Гиббстің
химиялық m
мүмкіндігі жылуқозғалымдық мүмкіндік j болатындықтан (U/m ¹ m, H/m ¹ m, m –
маңыз) [14]
m
= Ф/m = j (3.5.1)
тектескіштерінің
маңыздары өзгермелі (химиялық тектесу, булану, шықтану)
жылуқозғалымдық жүйелердің еркін қажырын
алып, шаққысын ((3.4.5) секілді) жылуқозғалымның
негізгі теңдеуі (3.4.3) арқылы келесідей жазайық
dФ = d(H–TS) + j dn = dH – TdS – SdT+ j dn =
= | dH – TdS = Vdp (3.4.3) | = Vdp –
SdT + j dn .
(3.5.2)
Еркін қажыры күй бернесі болатындықтан оның
шаққысы толық болады
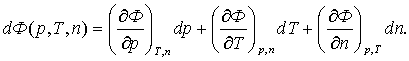 (3.5.3)
(3.5.3)
Соңғы екі теңдеулерді салыстыра, келесілерді табамыз
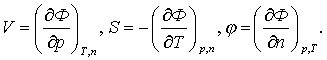 (3.5.4)
(3.5.4)
Егер мұндағы көлемді, (3.5.1)-ді ескере, меншікті
көлемі v = V/m түрінде алсақ (v = (¶j /¶р)Т,n), химиялық
мүмкіндіктің өзгерісін келесідей жаза аламыз
dmT,n = djT,n = vdp. (3.5.5)
Химиялық мүмкіндіктің жалпы түрі (3.5.4)-ке
сәйкесті) келесідей жазылады
 (3.5.6)
(3.5.6)
3.6 Еркін қажырдың тектесу мөлшерімен байланысы
Тектескіштердің кмоль dni сандарының
тектесулік ni қатынастықтарының
үлесін
dni /ni = dx (3.6.1)
- химиялық тектесудің мөлшері (құрамының өзгеру дәрежесі, мера реакции) деп
атайды [2].
Еркін қажырдың (3.5.6)
бойынша алынған өзгерісін химиялық тектесудің
мөлшеріне келтіріп жазайық (оны бұл жерде * таңбасымен
белгілейміз)
dФ*p,T,nj¹I = mI dni / dx = mI dni /( dni /ni ) = mI ni . (3.6.2)
Жүйедегі барлық
тектескіштердің еркін қажырының өзгерістері (3.6.2) бойынша келесідей жазылады
DФ = å mI ni . (3.6.3)
3.7 Мүлтіксіз газ
қоспаларының химиялық мүмкіндігі
Ыстықтығы
тұрақты таза заттың химиялық (3.5.5) мүмкіндігін
мүлтіксіз газдің күй теңдеуі арқылы жазайық
dmT,n = djT,n = Vm dp = | Vm = Rm T/p | = Rm T(dp/p) =Rm Tdlnp (3.7.1)
Мұның тұрақты ыстықтықтағы
аумаққысы
m (р,Т) - m 0(р 0,Т) = DmТ = р0òрRm Tdlnp = Rm Tln(p/p0). (3.7.2)
Мұндағы аумаққының m 0(р0,Т) тұрақтысын әдеттегідей қалыпты p0 = 1 физ. атм қысымында алып, (3.7.2)-ні келесідей жазамыз
m (р,Т) = m 0(р 0=1,Т) +
Rm Tln(p/1). (3.7.3)
Мұндағы р қысымының өлшем
бірлігі p0-дікіндей
әртүрлі болуы мүмкін.
Қоспаның і- құраушысының
химиялық мүмкіндігін (3.7.3)-ке сәйкесті меншікті рі
қысымы арқылы келесідей жазамыз
mі = mі 0 + Rm Tln(pі).
(3.7.4)
3- жаттығу.
Химиялық теңдесу. Теңдесу тұрақтылары. Ыдырау
дәрежесі
3.1-есеп
(15.20[4]). Жалпы түрде жазылған
![]() (3.7.5)
(3.7.5)
біртекті газдың
тектесуінің теңдесу ![]() мен
мен ![]() тұрақтыларын ыдырау дәрежесі
тұрақтыларын ыдырау дәрежесі ![]() мен шығысы
мен шығысы ![]() арқылы
жүйенің қысымы
арқылы
жүйенің қысымы ![]() мен көлемі
мен көлемі ![]() лерге тәуелді
анықтап, соңғыларының теңдесу күйінің
орнына тиетін әсерін айтыңыздар.
лерге тәуелді
анықтап, соңғыларының теңдесу күйінің
орнына тиетін әсерін айтыңыздар.
Шешімі. Теңдесу
күйіне дейінгі Е затының ыдырау үлесі ![]() болсын. Сонда
тектесудің (3.7.5) теңдеуі бойынша жүйенің
теңдескен күйіндегі кмоль сандары келесідей болады
болсын. Сонда
тектесудің (3.7.5) теңдеуі бойынша жүйенің
теңдескен күйіндегі кмоль сандары келесідей болады
![]() (3.7.6)
(3.7.6)
Заттардың (![]() қысымындағы жүйенің
құраушыларының) үлестік қысымдары
қысымындағы жүйенің
құраушыларының) үлестік қысымдары
![]()
Сонда тектесудің (3.7.5) теңдеуіне сәйкесті теңдесу
тұрақтысы келесі болады
 (3.7.7)
(3.7.7)
Мұның талдауға қолайлы (![]() өте аздағы) жуықты мәні
өте аздағы) жуықты мәні
![]() (3.7.8)
(3.7.8)
Тектесудегі (3.7.5) мольдер
санының өзгерісі: ![]()
Сондықтан ((3.2.9) бен (3.7.7)-ге сәйкесті)
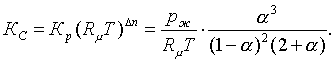 (3.7.9)
(3.7.9)
Мұның (Ж3.1.4)-тегідей жуықты мәні
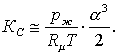 (3.7.10)
(3.7.10)
Берілген ыстықтықта ![]() тұрақты
болатындықтан (3.7.8) бен (3.7.10) бойынша:
тұрақты
болатындықтан (3.7.8) бен (3.7.10) бойынша:![]() мен
мен ![]() өзгерістері
кері сәйкесті. Бұлардың жоғарғы
таңбаларында (яғни жүйенің қысымы өскенде
ыдыраудың дәрежесінің төмендеуінен) (3.7.5)-тің
теңдесуі оңға қарай (ал керісінші жағдайда
солға) жылжиды.
өзгерістері
кері сәйкесті. Бұлардың жоғарғы
таңбаларында (яғни жүйенің қысымы өскенде
ыдыраудың дәрежесінің төмендеуінен) (3.7.5)-тің
теңдесуі оңға қарай (ал керісінші жағдайда
солға) жылжиды.
Енді ![]()
![]() мен
мен ![]() тәуелділіктерінің кейіптемелерін анықтау
үшін, жүйенің теңдесу күйіндегі тектесудің
құраушыларының көлемдік шоғырларын:
тәуелділіктерінің кейіптемелерін анықтау
үшін, жүйенің теңдесу күйіндегі тектесудің
құраушыларының көлемдік шоғырларын: ![]()
![]() (3.1.5) мен
(3.7.9)-да келесідей ескереміз
(3.1.5) мен
(3.7.9)-да келесідей ескереміз
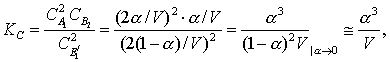 (3.7.11)
(3.7.11)
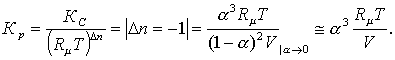 (3.7.12)
(3.7.12)
Берілген ыстықтықта ![]() пен
пен ![]() тұрақты болатындықтан, (3.7.10) мен
(3.7.11) бойынша
тұрақты болатындықтан, (3.7.10) мен
(3.7.11) бойынша ![]() мен
мен ![]() өзгерістері
сәйкесті. Бұлардың жоғарғы (төменгі)
таңбаларында (3.7.5) тектесудің теңдесуі солға
(оңға) қарай жылжиды.
өзгерістері
сәйкесті. Бұлардың жоғарғы (төменгі)
таңбаларында (3.7.5) тектесудің теңдесуі солға
(оңға) қарай жылжиды.
![]() мен
мен ![]() тердің кейіптемелерін табу үшін (3.7.7), (3.7.9),
(3.7.11) мен (3.7.12)-лерде
тердің кейіптемелерін табу үшін (3.7.7), (3.7.9),
(3.7.11) мен (3.7.12)-лерде ![]() деп алу керек
деп алу керек
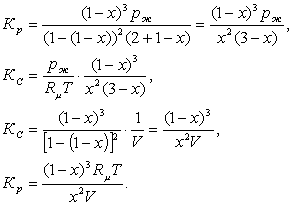 (3.7.13)
(3.7.13)
3.2-есеп (15.22[4]). Ыстықтығы 986 С0 келесі
тектесудің
![]() (3.7.14)
(3.7.14)
теңдесу
тұрақтысы ![]() және
қоспаның басты көлемдік құрамы (%):
және
қоспаның басты көлемдік құрамы (%): ![]()
![]() (барлығы 100%).
Тектесудің теңдескен құрамы мен
бағыты қандай?
(барлығы 100%).
Тектесудің теңдескен құрамы мен
бағыты қандай?
Шешімі. Теңдескен
күйге дейінгі СО мен Н2О-лердің тектескен үлестері
х пайыздан болсын. Сонда қоспаның теңдескен
құрамы келесі болады(%): ![]() (азот тектеспейтін
газ).
(азот тектеспейтін
газ).
Жүйенің
(қоспаның) ![]() қысымындағы құраушыларының
теңдескен күйдегі үлестік қысымдары
қысымындағы құраушыларының
теңдескен күйдегі үлестік қысымдары
![]() Қаралып
отырылған (Ж3.2.1) тектесудің теңдесу тұрақтысы
Қаралып
отырылған (Ж3.2.1) тектесудің теңдесу тұрақтысы
 (3.7.15)
(3.7.15)
Бұл теңдеудің
түбірлерінің: ![]() біріншісі теріс
мәнді болғандықтан шешімге жатпайды. Сондықтан теңдескен
құрам келесі болады
біріншісі теріс
мәнді болғандықтан шешімге жатпайды. Сондықтан теңдескен
құрам келесі болады![]() (барлығы 100%). Тектесуші құраушыларының үлесі
(барлығы 100%). Тектесуші құраушыларының үлесі ![]() оң сан
болғандықтан тектесудің бағыты солдан
оңға қарай болған.
оң сан
болғандықтан тектесудің бағыты солдан
оңға қарай болған.
4 Химиялық тектік
4.1 Химиялық тектік пен тектесудің ыстықтық
тұрақтылығының
теңдеуі
Әртүрлі заттардың өзара тектесулік
қабілеттілігін химиялық тектік (химическое средство)
дейміз. Химиялық тектіктің өлшемі ретінде басында
химиялық тектесудің жылдамдығы қаралған.
Бірақ, ол тек тектесушілердің қасиеттері мен
көрсеткіштеріне тәуелді болмай, жеделдеткішке (катализаторға)
де тәуелді болған. Химиялық тектік жылулық
әсеріне тәуелді деген Бертлоның 1867 жылғы болжамы да
іске аспаған, өйткені жылулық әсері бір тектесулерде
оң мәнді болса, басқа біреулерінде теріс мәнді болуы
мүмкін.
Заттарды өзара әрекеттендіре алатын күштердің
теңелген құбылыста жасай алатын ең үлкен
(механикалықсыз) пайдалы жұмысты Гиббс 1878 жылы бірінші болып
химиялық тектіктің мөлшері ретнде анықтаған.
Дегенмен, нақты тектесулердің ысыраптылығынан пайдалы
жұмыстың өндірілмеуі де мүмкін.
Ақырақ, химиялық тектік тектесудің
жылуқозғалымдық мүмкіндігінің кемуімен
анықталатыны белгілі болған. Сонымен, сипаттағыш бернелерді
есептеп, әртүрлі заттардың химиялық тектігін,
тектесудің мүмкіндігін, сыртқы (ең алдымен
ыстықтыққа) тәуелді оның теңдесулік
құрамын анықтауға болады.
Сипаттағыш бернелердің қолайлығы – олардың
күй бернелігі. Сондықтан олар құбылыстардан
тәуелсіз. Құбылыстар қайтымды не қайтымсыз болсын
химиялық тектік тектесудің екі-ақ күйлеріндегі
сипаттағыш бернелердің мәндерімен анықталады.
Бұл жағдай Гиббстің ұсынысына да қайшы емес,
өйткені қайтымды құбылыстардағы
жылуқозғалымдық мүмкіндіктердің кемулері ең
үлкен пайдалы жұмысты беретіндіктен осы LП
пайдалы жұмыс та химиялық тектіктің қолайлы
өлшемі болады. Мысалы, V,T = тұрақты мен p,T
= тұрақты қайтымды құбылыстарда (сәйкесті)
LП = LVT = F1 – F2 = - DF; LП = LpT = Ф1 – Ф2 = –D Ф. (4.1.1)
Химиялық тектіктің мөлшері – сипаттағыш
бернелердің өзгерістерінің тектесудегі заттардың шекті
шоғырларымен не қысымдарымен байланыстары тектесудің
ыстықтық тұрақтылығының теңдеуі (уравнение
изотермы реакции) деп аталады. Бұл теңдеу тектесудің
химиялық тектігін (мүмкіншілігін) анықтайды және
бағытын көрсетеді.
Тектесудің ыстықтық
тұрақтылығының теңдеуін, басты
көрсеткіштері Рбі мен Сбі
тектескіштерді жеке шығырларда жұмыс істеттіріп, Вант-Гоффтың
²жәшігінде² араластырып, теңелулі рбі мен сбі
көрсеткішті жекелендіріп, басқа шығырларда соңғы Рсі
мен Ссі көрсеткіштердеге дейін
қайта жұмыс істеттіріп, тұрақты ыстықтықты
барлық қайтымды құбылыстардағы жұмыстарды
пайдалы деп, шығаруға болады (шығарудың бұл жолын
оқырмандарға қалтырайық).
Мұнда ыстықтық тұрақтылығының
теңдеуін 3.5-3.7 баптарындағы негізгі ұғымдар
арқылы шығарамыз. Ол үшін еркін қажырды (3.6.3)-тегідей
алып, тектескіштердің химиялық мүмкіндіктерін
жүйенің теңелмеген күйлеріндегі Рі - меншікті
қысымдары арқылы (3.7.4)-тегідей ескеріп, келесідей жазамыз
DФ = å mI ni = åmі 0nі + Rm Tå lnРіnі. (4.1.2)
Мұндағы (T = тұрақтыдағы)
жүйенің теңелген күйіндегі (DФ = 0, рі ) аумаққының
(3.7.2)-ге сәйкесті тұрақтысы
åmі 0nі = - RTå lnріnі = - Rm TlnКр . (4.1.3)
Мұны (4.1.2)-де ескерсек, p,T =
тұрақтыдағы химиялық тектікті келесідей
анықтаймыз
DФ = Rm T(å lnРіnі - lnКр ). (4.1.4)
Химиялық
тектіктің бұл теңдеуін көбейтудің К
таңбасы арқылы келесідей жазуға болады
DФ = - Rm T lnК(рі /Рі)nі. (4.1.5)
Барлық Рі = 1
болғанда, (4.1.5) қалыпты тектіктің (нормальное
сродство) теңдеуі (мәні) болады
DФ0 = - Rm T lnКрі nі = - Rm T lnКр . (4.1.6)
Қаныққан будың меншікті қысымдары (сол
секілді қатты денелердің) рі = Рі болатындығынан
(4.1.4) пен (4.1.5)-терде қысқартылып, ескерілмейді.
Егер қоспаның і- құраушысының
химиялық (3.7.4) мүмкіндігін шоғыры арқылы келесідей
жазсақ
mі = mсі0 + Rm Tlnсі , (4.1.7)
V,T = тұрақтыдағы химиялық
тектіктің мәнін еркін қайрат арқылы
жоғарғыдай ((4.1.4) секілді) табамыз
DF = Rm T(å lnСіnі – lnКс ). (4.1.8)
Мұндағы Сі мен сі
– тектесудің і- құраушыларының
теңелмеген және теңелген күйлеріндегі шоғырлары.
Химиялық тектіктің (4.1.4) және (4.1.8) теңдеулері
химиялық тектесудің ыстықтық
тұрақтылықтарының теңдеулері (уравнения
изотермы реакции) деп аталады. Оларды 1876 жылы Гиббс, ал 1886 жылы Вант-Гофф
шығарған.
Ыстықтық тұрақтылығының
теңдеулерімен (берілген шарттарда) анықталатын химиялық
тектіктің мәндері тектесудің болатынын немесе болмайтынын
және бағытын көрсетеді.
Құбылыс өзінді жүргенде р,Т (не V,T)
= тұрақтыда DФ (не DF) азаяды. Сондықтан тектесу солдан оңға
қарай жүргенде DФ мен DF –тер теріс мәнді болады. Егер берілген шарттарда DФ мен DF –тер оң мәнді болса, яғни å lnРіnі (не å lnСіnі) > lnКр (не lnКс ) болса, тектесу ((4.1.4) және (4.1.8) теңдеулері бойынша) солдан
оңға қарай жүрмейді.
Тектесу солдан оңға қарай (яғни > таңба керісінше <) болу үшін: а) Т = тұрақтыда қоспадағы тектесу
өнімдерінің меншікті қысымдарын (шоғырларын) азайтып,
ал тектескіштердің меншікті қысымдарын (шоғырларын)
ұлғайту керек не б) берілген тектесудің
ыстықтығын (Кр (не Кс)
ұлғайғандай) өзгертіп, Кр (не Кс)
> КРіnі (не КСіnі)-ге жеткізу керек.
Сонымен: а) егер DФ < 0 (LpT > 0) болса, тектесу оңға қарай жүреді
(мұндағы DФ-дің мәні тектескіштердің химиялық
тектігін білдіреді); б) егер DФ > 0 (LpT < 0) болса, тектесу солға қарай жүреді (мұндағы DФ-дің мәні (тектесу теңдеуінің
оң жағындағы) ыдыраушы түзгілердің химиялық
тектігін білдіреді); в) егер DФ= 0 (LpT = 0) болса, тектесу теңелген күйінде болады
(мұндағы DФ-дің мәні тектесудің химиялық
тектігін білдірмейді).
Сипаттаушы бернелердің өзгерістері тектесудің барын не
жоғын білдіргенімен оның жылдамдығын көрсетпейді.
4.2 Химиялық тектіктің жылулық әсерімен байланысы.
Бертло
қағидасы
Химиялық тектік еркін қайрат (DF(4.1.8)) пен еркін қажырдың (DФ (4.1.4)) өзгерістерімен, ал жылулық
әсер QTVеңү=U1–U2
(1.2.4) ішкі қайрат пен QpTеңү=H1–H2
(1.2.5) қажырдың өзгерістерімен
анықталатындығынан келесі сипаттағыш бернелердің: U
мен F-тардың және Н пен Ф-лердің
тұрақты ыстықтықты құбылыстардағы
байланыстарын көрсететін Гельмгольц пен Гиббстің (3.4.14)
теңдеулерін тектесудің басты және соңғы
күйлеріне келесідей жазып [2]
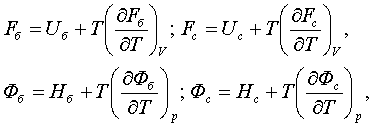 (4.2.1)
(4.2.1)
соңғыларынан бастыларын алып, іздегенімізді табамыз
 (4.2.2)
(4.2.2)
не
 (4.2.3)
(4.2.3)
Химиялық тектіктерді жылулық әсерлермен
байланыстырған теңдеулерді (4.2.3) механикалықсыз
пайдалы (4.1.1) жұмыстар
арқылы келесідей жазамыз
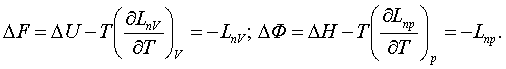 (4.2.4)
(4.2.4)
Немқұрайлы (формально) қарасақ, (4.2.2)
бойынша
Т = 0 не  Т = 0 не
Т = 0 не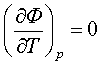 (4.2.5)
(4.2.5)
- химиялық
тектіктер жылулық әсерлерге тең (![]() ) дей салар едік. Бірақ,
бұл (4.2.5) шарттар ыстықтықтың толық нөлімен
байланысты. Сондықтан, бұл күрделі және маңызды
мәселеге жылуқозғалымның үшінші заңын
арнайы қарағанда ораламыз.
) дей салар едік. Бірақ,
бұл (4.2.5) шарттар ыстықтықтың толық нөлімен
байланысты. Сондықтан, бұл күрделі және маңызды
мәселеге жылуқозғалымның үшінші заңын
арнайы қарағанда ораламыз.
Дегенмен, DF < 0 не DФ < 0 шарттарында тектесудің жүретінінен
төменгі ыстықтықтарда ((4.2.3)-тердің оң
жақтарындағы екінші қосындылары салыстырмалы аз
болатындықтан) бұл тектесулердің ішкі қайрат ![]() пен қажырдың
пен қажырдың ![]() кемулеріне (яғни жылу шығарыла, экзотермиялы)
сәйкесті өзінді жүретіні көрінеді. Осы төменгі
ыстықтықтардағы тектесулердің жылу шығарыла жүретінін
бірінші болып айтқандығынан Бертло қағидасы
деп аталады.
кемулеріне (яғни жылу шығарыла, экзотермиялы)
сәйкесті өзінді жүретіні көрінеді. Осы төменгі
ыстықтықтардағы тектесулердің жылу шығарыла жүретінін
бірінші болып айтқандығынан Бертло қағидасы
деп аталады.
4- жаттығу. Химиялық тектік пен ең үлкен жұмыс
Әртүрлі заттардың өзара тектесулік
қабілеттілігін (қасиеттерін, шарттарын) химиялық тектік
(сродство) деп атайды. Тектесулердің (жылуқозғалымдық
қайтымды) ең үлкен жұмысы химиялық
тектіктің мөлшері (мера) болады. Ең үлкен
жұмыстың мәні неғұрлым үлкен (не аз) болса,
солғұрлым жүйе теңдескен күйінен алыс (не
жақын) болады. Теңдескен күйде ең үлкен
жұмыс нөлге тең (![]() ).Тектесу оңға (теңдескен күйіне)
қарай жүргенде ең үлкен жұмыс дұрыс
мәнді (
).Тектесу оңға (теңдескен күйіне)
қарай жүргенде ең үлкен жұмыс дұрыс
мәнді (![]() ) азаяды, ал тектесу солға (теңдескен
күйіне) қарай жылжығанда (ыдырағанда) ол теріс
мәнді (
) азаяды, ал тектесу солға (теңдескен
күйіне) қарай жылжығанда (ыдырағанда) ол теріс
мәнді (![]() ) азаяды.
) азаяды.
Ең үлкен жұмыстың теңдеулері - тектесудің
ыстықтық тұрақтылығы (изотерма реакции)
![]() (4.2.6)
(4.2.6)
![]() (4.2.7)
(4.2.7)
Мұндағы (яғни (4.2.6) мен (4.2.7)-лердегі) ең
үлкен жұмыстың мәндері V не р
= тұрақтыларда Lеңү = LVеңү
не Lеңү = Lpеңү
деп, ал жақшаларының ішіндегі бірінші
қосындыларындағы тектесушілердің меншікті қысымдары Рі
мен шоғырлары Сі шекті (үлкен Рі мен Сі-лі басты және соңғы
теңдеспеген) мәндері арқылы теңдесу
тұрақтылары Кр (кіші рі-лі) мен КС
(кіші сі-лі) секілді анықталады.
4.1-есеп (П1[2],с.384-385). Сутегі Н2 мен йодтың J2
және сутегілі йод HJ газдарының келесі
әртүрлі шоғырлары СН2 = 1) 2; 2)
1,5; 3) 1; СJ2 = 1) 5; 2) 0,25; 3) 2; CHJ
= 1) 10; 2) 5; 3) 10 мен ыстықтығы Т = 717 К және
теңдесу тұрақтысы КС = 50-дегі тектесу
бағыттарын анықтаңыздар
Н2
+ J2 = 2НJ. (4.2.8)
Шешімі. Ол үшін
ең үлкен пайдалы LVеңү жұмысты
(химиялық тектіктікті) Гельмгольцтың (еркін) қайратының
(Ж4.2) кемуімен берілген үш жағдайларға анықтаймыз
1)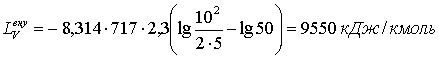 , яғни LVеңү > 0 (DF < 0) тектесу сутегілі НJ йодтың пайда болуына
(теңдесу күйіне оңға) қарай жүреді.
, яғни LVеңү > 0 (DF < 0) тектесу сутегілі НJ йодтың пайда болуына
(теңдесу күйіне оңға) қарай жүреді.
2) , яғни LVеңү < 0 (DF > 0) тектесу сутегілі йодтың ыдырауына (теңдесу
күйіне солға) қарай жүреді
, яғни LVеңү < 0 (DF > 0) тектесу сутегілі йодтың ыдырауына (теңдесу
күйіне солға) қарай жүреді
3) , (4.2.9)
, (4.2.9)
яғни (LVеңү
= - DF = 0) тектесу теңдесу күйінде болады.
4.2-есеп (П2[2],с.385). ![]() тектесудің
қалыпты (стандарттық:
тектесудің
қалыпты (стандарттық: ![]() еркін
қажырын Т = 1273К ыстықтығы мен р = 1 физ. атм қысымдағы СО2-нің ыдырау
еркін
қажырын Т = 1273К ыстықтығы мен р = 1 физ. атм қысымдағы СО2-нің ыдырау ![]() дәрежесінде анықтаңыздар.
дәрежесінде анықтаңыздар.
Шешімі. Теңдесу
күйіндегі моль сандары
![]()
![]() . (4.2.10)
. (4.2.10)
Теңдесу тұрақтысы
 (4.2.11)
(4.2.11)
Қалыпты еркін қажырын (химиялық тектік)
 (4.2.12)
(4.2.12)
5 Химиялық тектік пен теңдесу тұрақтыларының
ыстықтыққа
тәуелділіктері
5.1 Химиялық тектіктің ыстықтыққа
тәуелділігі
Химиялық тектіктің ыстықтыққа
тәуелділігін р = тұрақтыдағы дербес туынды ретінде алып [2]
 (5.1.1)
(5.1.1)
химиялық
тектіктің жылулық әсерімен (4.2.3) байланысын келесі
түрде
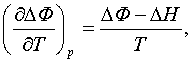 (5.1.2)
(5.1.2)
(5.1.1)-де
ескеріп
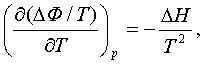 (5.1.3)
(5.1.3)
табылғанның
келесі аумаққысын шығарамыз
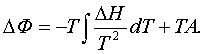 (5.1.4)
(5.1.4)
Мұндағы А –
аумаққының тұрақтысы.
Тектесудің ыстықтық
тұрақтылығының (4.1.4) теңдеуін
DФ = Rm T(å lnРіnі - lnКр ), (5.1.5)
қалыпты
(4.1.6) түрін
DФ0 = - Rm T lnКрі nі = - Rm T lnКр
(5.1.6)
ескере, келесідей
жазып
 (5.1.7)
(5.1.7)
(5.1.3)-ке
қойып, табылғанды аумаққылап, қалыпты
химиялық тектіктің (5.1.4)-ке ұқсас теңдеуін
табамыз
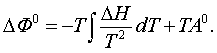 (5.1.8)
(5.1.8)
Мұндағы А0
= А - С; С = Rm lnКРі nі.
Қажырды әдеттегідей (1.4.4) ыстықтыққа
тәуелді жылусыйымдылықтары арқылы алып, (5.1.4) пен
(5.1.8)-ді аумаққылы келесідей жазамыз
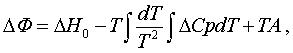 (5.1.9)
(5.1.9)
 (5.1.10)
(5.1.10)
Бұлардағы DН0 – қажыр
аумаққыларының тұрақтысы.
Жылусыйымдылықтардың
жүйелік DСр = ånіСрі мәндерін және әдеттегідей ыстықтыққа
(1.4.4) пен (1.4.5) тәуелділіктерін ескере, (5.1.9) бен (5.1.10)-ды
аумаққылап, химиялық тектіктің
ыстықтыққа тәуелділігін табамыз
DФ = DН0 - aТlnT - bТ2/2 - gТ3/6 + ТА, (5.1.11)
DФ0 = DН0 - aТlnT - bТ2/2 - gТ3/6 + ТА0. (5.1.12)
Ыстықтық толық
нөл болғанда (5.1.9)-(5.1.12)-лерге сәкесті
DФ0 = DФ00 = DН0. (5.1.13)
Заттың Гиббс
қайратының өзгерісін табу үшін (S = - (¶Ф/¶Т)р (3.4.11) бойынша) заттың берілген бір күйіндегі энтропиясын
(заттың толық энтропиясын) білу қажет. Сондықтан
химиялық тектіктің теңдеуіндегі
аумаққысының тұрақтысы (химиялық
тектесуіндегі жүйенің Гиббс қайратының өзгерісі)
химиялық тектесуіндегі жүйенің энтропиясының
өзгерісіне, яғни тектесуші заттардың
(жылуқозғалымның үшінші заңымен
анықталатын) толық энтропияларына (DS = åniSi) тәуелді.
Осы секілді еркін қайраттың
(DF-тің) кемуі арқылы химиялық
тектіктің ыстықтыққа тәуелділігін
(оқырмандардың өздері) де табуға болады.
5.2 Теңдесу тұрақтысының
ыстықтыққа тәуелділігі. Вант-Гофф заңы.
Ле-Шателье – Браун
қағидасы
Қайтымды тектесудің теңдесу күйі
ыстықтыққа тәуелді. Сондықтан теңдесу Кр
мен Кс тұрақтылары да ыстықтыққа
тәуелді болады. Бұл тәуелдіктерді анықтау үшін р,Т
(не V,T) = тұрақтылардағы тектесу
жүйелерінің ыстықтық
тұрақтылықтарының (4.1.4) пен (4.1.8) теңдеулерін
DФ = Rm T(å lnРіnі - lnКр ) , (5.2.1)
DF = Rm T(å lnСіnі – lnКс ), (5.2.2)
жақшаларының
ішіндегі бірінші қосындыларындағы тектесу
құраушыларының басты көрсеткіштері Рбі мен
Сбі және соңғы Рсі мен
Ссі көрсеткіштері берілгендіктен тұрақты
деп алып, Т арқылы шаққылап, табылғандарды Гиббс пен
Гельмгольцтың (3.4.13)-тегі теңдеулеріне қойсақ, Вант-Гофф
заңы шығады (шығарудың бұл жолын
оқырмандарға қалдырайық).
Теңдесу
тұрақтысының ыстықтыққа тәуелділігін
мұнда [2] бойынша (5.1.6)-ны (5.1.7)-ге
қойып
DФ/Т = - Rm lnКр + С, (5.2.3)
табылғанды
(5.1.3)-те ескере, теңдесу тұрақтысы мен жылулық
әсердің шаққылы байланысын келесідей жазамыз
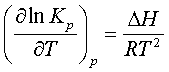 . (5.2.4)
. (5.2.4)
Мүлтіксіз газдарға Кр
қысымға тәуелсіз болатындықтан (5.2.4)-ті
келесі қарапайым туынды түрінде жаза аламыз
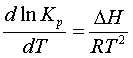 . (5.2.5)
. (5.2.5)
Мұны тектесудің қысым
тұрақтылығының теңдеуі (уравнение изобары
реакции) деп атайды.
Тектесудің көлем тұрақтылығының
теңдеуі (уравнение изохоры реакции) (5.2.5)
секілді (не Кр мен Кс-тардың
байланысы арқылы) шығарылады
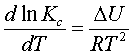 . (5.2.6)
. (5.2.6)
Егер теңдесу
тұрақтылар ы мен жылулық әсерлерді жалпы түрде
сәйкесті К мен Q десек, (5.2.5) пен
(5.2.6)-ларды келесі жалпы түрде жазуға болады
 . (5.2.7)
. (5.2.7)
Мұны көлем мен қысым
тұрақтылықтары (уравнение изохоры-изобары) деп
атайды.
Көрсетілген (5.2.5)-(5.2.7)
теңдеулерді Вант-Гофф
заңы
дейді.
Вант-Гофф
Якоб Гендрик (1852-1911) көрнекті голланд физхимигі, 22; 26 жастарында
ғылым докторы, Амстердам университетінің профессоры, 44-де Берлин
университетінің про- фессоры, көптеген академиялар мен ғылыми
қоғамдардың мүшесі болған. Тарихи химиялық
жылуқозғалымның
негізін қалаушыларының бірі болған.
Вант-Гоффтың заңы химиялық тектесуді талдауға
қолайлы. Егер тектесу жүйесінде жылу шыға (экзотермиялы Q < 0) ыстықтығы dT > 0 ұлғайса (dT < 0, төмендесе), (5.2.7) бойынша dК/dT < 0 (dК/dT > 0) болуға тиіс. Сондықтан dT > 0 (dT < 0)-де dК < 0 (dК > 0) болып, тектесу дәрежесінің төмендеуінен
(ұлғаюынан) солға (оңға) жылжиды, яғни жылу
сіңіріледі (шығарылады). Ал, егер тектесу жылу сіңірілулі
(эндотермиялы Q > 0) болса, тектесудің жүру бағыттары қаралған
жағдайларға қарама - қарсы болып, ыстықтығы
өскенде (төмендегенде) жылу бұл жолы да сіңіріледі
(шығарылады).
Сонымен, теңдесу
тұрақтысы мен тектесу дәрежесінің
ыстықтыққа тәуелділігінен ыстықтық
өскенде тектесудің теңдесу күйі ылғи оның
жылуы сіңірілуі жағына қарай жылжыйды. Мысалы,
тектесудің тура бағыты жылу шығарулы (сіңірілулі)
болса, ыстықтық көтерілгенде теңдесуі солға
(оңға), яғни жылуы сіңірілу жағына жылжып,
негізгі тектесу бағытына қарсы ықпал жасайды.
Бұл жағдай белгілі [15,16,2] Ле-Шателье-Браун қағидасының мысалына
жатады. Осы секілді сыртқы әсерге табиғаттың
қарсылық жасауын француз химигі Л. Ле-Шателье мен неміс физигі
К.Браун 1884-1887 жылдары бақылап, келесі тұжырымға келген: ²Берілген күйдің өзгеруіне табиғаттың
өзі кедергі жасайды² (²Сама природа создает сопротивление всякому изменению данного состояния²).
5.3 Теңдесу
тұрақтысының ыстықтыққа тәуелді
есептелуінің әдістері
Теңдесу
тұрақтысының Т1 ыстықтықтағы К1
мәні белгілі болса, Т2-дегі оның мәнін
Вант-Гоффтың (5.2.7) заңдылығымен келесідей
анықтауға болады.
Егер берілген ыстықтықтардың аралығындағы Q -
жылулық әсерінің мәні тұрақты болса не
оның орта мәні Кирхгофтың (1.4.6) заңдылығымен
анықталса 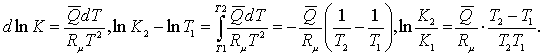 (5.3.1)
(5.3.1)
Егер Т1 мен Т2-дегі
К1 мен К2 теңдесу тұрақтылары белгілі
болса, (5.3.1) арқылы жылулық әсердің орта мәнін
анықтауға болады
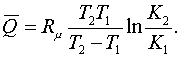 (5.3.2)
(5.3.2)
Бұл есептік кейіптемелердің
негізгі кемшілігі - теңдеу тұрақтысының
ыстықтыққа тәуелділігінің үзіліксіз
ескерілмейтіндігі. Сондықтан Кирхгофтың (1.4.6)
заңдылығын
Q = Q0 + aT + bT2 + gT3 (5.3.3)
Вант-Гоффтың
(5.2.7) заңдылығында ескеріп аумаққыласақ,
теңдесу тұрақтысының ыстықтыққа
тәуелділігі келесідей анықталады
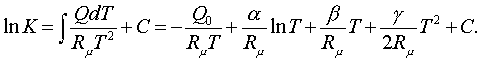 (5.3.4)
(5.3.4)
Мұндағы аумаққының С тұрақтысын
анықтауға болады, егер Q0, a, b, g-лар және
бір (Т = 0 емес) ыстықтықтағы К-ның мәні белгілі
болса. Өйтпегенде теңдесу тұрақтысының ыстықтыққа
тәуелділігі Т = 0 де С0 = lnK0 + Q0/(RmT0) =¥ болып, жылуқозғалымның үшінші заңының
мәліметтерісіз есептелмейді.
Егер тек қана a, b, g-лар белгілі болса, С мен Q0-ді табу үшін К-ның екі
ыстықтықтардағы мәндері белгілі болуға тиіс.
Мұны сызбақты шешуге болады. Ол үшін (5.3.4)-ті
ыстықтықтың кері мәндеріне тура сызықты
тәуелділігіне келесідей келтіріп
D = f(1/T) = Q0×(1/Т) – RC, (5.3.5)
берілген екі (Т1
мен Т2) ыстықтықтардағы сол тура
сызықтың 1/T1 мен 1/T2 –лерге сәйкесті
белгілі К1 мен К2-лердегі D–ның екі (D1 мен
D2) мәндерін (5.3.4) пен (5.3.5)-тен шығатын келесі
кейіптемемен анықтаймыз ![]() (5.3.6)
(5.3.6)
Содан кейін, анықталған (1/T1,D1) мен
(1/T2,D2) мекендіктері
бойынша (5.3.5) тәуелділіктің тура сызығын салып, оның
белгісіз С мен Q0-нің мәндерін келесідей
анықтаймыз:
а) салынған тура сызықтың (1/Т = 0-дегі) D
бағытты тік мекендігімен қиылысқан (D = D0) нүктесінде (яғни (5.3.5) тура
сызықтың 1/Т = 0-нде)
С = - D0/Rm; (5.3.7)
б) салынған тура (5.3.5) сызықтың бұрышы j көлбеуі
бойынша
Q0 = (D2 – D1)/(1/Т2 - 1/Т1) = tgj. (5.3.8)
Бұл әдіс тәжірибелік зерттеулерге өте
қолайлы.
Сонымен, жылулық әсер тектесудің теңдесу
тұрақтыларының мәліметтері мен тектесудегі барлық
заттардың жылусыйымдылықтарының ыстықтыққа
тәуелділіктері арқылы әртүрлі оған жеткілікті
жағдайларда анықталуы мүмкін. Дегенмен, жылулық
әсер мен теңдесу тұрақтысының
ыстықтыққа тәуелді толық есептелулері
жылуқозғалымның үшінші заңының
мәліметтеріне байланысты.
5- жаттығу. Теңдесу
тұрақтыларының ыстықтыққа
тәуелділіктері
Теңдесу тұрақтыларының ыстықтыққа
тәуелділіктері тектесудің көлемдік
пен қысымдық тұрақтылықтарының
(изохора мен изобара) теңдеулерімен келесідей
анықталады
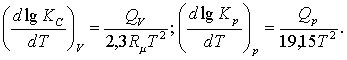 (5.3.9)
(5.3.9)
Бұлардың жалпы түрін аумаққылап,
теңдесу тұрақтысының келесі жалпы түрімен
анықтаймыз
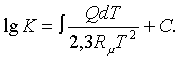 (5.3.10)
(5.3.10)
Мұндағы аумаққылаудың С тұрақтысы
Нернсттің жылулық түйінімен (теоремасымен, яғни
жылуқозғалымның
үшінші заңымен және басқадай жуықты
әдістермен) анықталады.
Көлемдік пен қысымдық
тұрақтылықтарының теңдеулерінен белгілі Т0
ыстықтығындағы теңдесу тұрақтының
мәні арқылы басқа Т ыстықтықтарындағы
теңдесу тұрақтыны, жылулық әсерді жуықты
тұрақты деп (![]() тұрақты деп алуға ыстықтықтардың
аралығы жеткілікті аз болса), келесідей анықтауға болады
тұрақты деп алуға ыстықтықтардың
аралығы жеткілікті аз болса), келесідей анықтауға болады
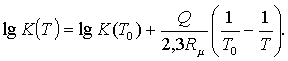 (5.3.11)
(5.3.11)
5.1-есеп (15.24[4]). Сулы газдың
теңдескен құрамын 800 бен 1200К-де анықтаңыздар, егер 1000К-дегі теңдесу тұрақтысы ![]() СО2-нің
СО-дан және
СО2-нің
СО-дан және ![]() -нің пайда болу жылулық
әсерлері: 285000 мен 243000 кДж/кмоль; ыстықтығы 800-1200К
аралығында алынатын сулы газдың жылулық әсері
айтарлықтай өзгермейтін болса. Сулы газ су буы мен көміртегі
қышқылының бірдей көлемдерінен алынады.
-нің пайда болу жылулық
әсерлері: 285000 мен 243000 кДж/кмоль; ыстықтығы 800-1200К
аралығында алынатын сулы газдың жылулық әсері
айтарлықтай өзгермейтін болса. Сулы газ су буы мен көміртегі
қышқылының бірдей көлемдерінен алынады.
Шешімі. Келесі тектесулерді
 (5.3.12)
(5.3.12)
қосып, сулы
газдың тектесуі мен оның жылулық әсерін табамыз
![]() (5.3.13)
(5.3.13)
Берілген ыстықтықтардағы теңдесу
тұрақтыларын (5.3.11)-гідей анықтаймыз
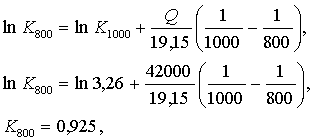 (5.3.14)
(5.3.14)

Теңдесу күйіне дейінгі Н2О мен СО-лардың
тектесу үлестері және Н2 мен СО2-лердің
пайда болу үлестері х болсын. Сонда теңдескен
жүйенің құрамы (кмоль/кмоль) мен теңдесу
тұрақтысы (5.3.13)-ке сәйкес келесідей болады
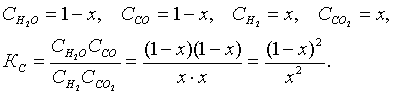 (5.3.15)
(5.3.15)
(5.3.14) 800К-де
![]() (5.3.16)
(5.3.16)
Мұның түбірлерінің: ![]() біріншісі
мүмкін емес, өйткені
біріншісі
мүмкін емес, өйткені ![]() Сондықтан
800К-дегі газдың теңдескен құрамы келесідей болады
Сондықтан
800К-дегі газдың теңдескен құрамы келесідей болады ![]()
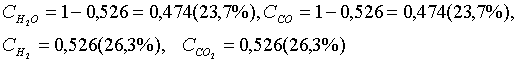 (5.3.17)
(5.3.17)
(барлығы: 2
кмоль/кмоль (100%)).
(5.3.15)
1200К-де:
![]() (5.3.18)
(5.3.18)
Мұның түбірлерінің ![]() екіншісі мүмкін
емес, өйткені
екіншісі мүмкін
емес, өйткені ![]() Сондықтан 1200
К-дегі газдың теңдескен құрамы келесідей болады
Сондықтан 1200
К-дегі газдың теңдескен құрамы келесідей болады![]()
![]()
![]() (барлығы: 2
кмоль/кмоль (100%)).
(барлығы: 2
кмоль/кмоль (100%)).
5.2-есеп
(15.25[4]). Домен пешінде
өтетін келесі тектесудің
![]() (5.3.19)
(5.3.19)
теңдескен күйіндегі құрамын
анықтаңыздар, егер ![]() дегі теңдесу тұрақтысы
дегі теңдесу тұрақтысы ![]() болса.
болса.
Шешімі. Газды
заттарының моль сандарының өзгерісі
![]()
Сондықтан
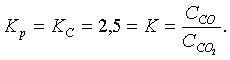 (5.3.20)
(5.3.20)
Теңдесу күйіне дейінгі СО-ның тектесуінің
үлесі х десек, оның қалғанының
үлесі 1 - х және пайда болған СО2-нің
үлесі х болады. Егер теңдескен газ
жүйесінің көлемі V болса, табылатын
шоғырларымыз![]() болады.
Сондықтан
болады.
Сондықтан
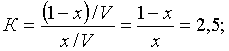
![]() (5.3.21)
(5.3.21)
Тектесудің теңдескен құрамы келесідей болады
 (5.3.22)
(5.3.22)
Барлығы 1 кмоль/кмоль (100%).
5.3-есеп (15.35[4]). Келесі тектесудің
![]() (5.3.23)
(5.3.23)
теңдесу
тұрақтысының
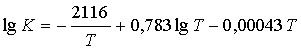 (5.3.24)
(5.3.24)
ыстықтыққа
тәуелділігін ескере, ![]() дегі
дегі ![]() жылулық
әсерін анықтаңыздар.
жылулық
әсерін анықтаңыздар.
Шешімі. Берілген
тектесудің ![]() кмоль
өзгерісіне сәйкесті КР = КС = К мен
кмоль
өзгерісіне сәйкесті КР = КС = К мен ![]() болады.
болады.
Теңдесу
тұрақтысының (5.3.24) туындысының ![]() дегі мәні
дегі мәні
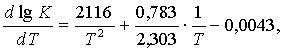 (5.3.25)
(5.3.25)
 . (5.3.26)
. (5.3.26)
Вант-Гоффтің
теңдеуі бойынша
 (5.3.27)
(5.3.27)
Сондықтан
![]() . (5.3.28)
. (5.3.28)
6 Химиялық кинетиканың түзгілері
6.1 Белсендіру қайраттың
айырымының жылулық әсерге теңдігі
Химиялық тектесуге не
ыдырауға затшаларының (молекулаларының) өзара
соқтығысулары және олардың қайраттарының
бұрынғы байланыстарын бұзуға
жеткіліктігі қажетті. Химиялық өзгерістердегі
затшалардың ішкі байланыстарын бұзуға қажетті
қайратын белсендіру қайраты (энергия активации)
дейді. Оны біргелкі жылдамдықты 6,023×1026 затшаларға, яғни киломольге келтіріп, Еа,
кДж/кмоль деп белгілейді.
Әрбір Т
ыстықтығындағы N0 затшалардың белсендіру
қайратты затшаларының Nа саны (газдардың
кинетикалық теориясы бойынша тез жинақтылық
қатардың (быстро сходящийся ряд) бірінші мүшесімен үш
пайыздан жоғары дәлділікпен) белгілі Аррениус заңымен
анықталады
Nа
= N0ехр(-Еа/(RmТ)). (6.1.1)
Егер тектесудің w
жылдамдығының затшалардың N санына және
жылдамдылықтың k тұрақтысына сәйкестіктерін ескерсек,
жылдамдықтың ыстықтыққа тәуелдігі сол
Аррениус заңымен сипатталатынын көреміз
w/w0 = Nа/N0
= k/k0 = ехр(-Еа/(RmТ)). (6.1.2)
Мұндағы экспонента затшалардың тектескендерінің
үлесін және тектесу дәрежесін көрсетеді.
Мұның жартылай логарифмінің ыстықтықтың
кері 1/Т мәніне тура сызықтықты тәуелділігін алатын болсақ
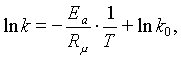 (6.1.3)
(6.1.3)
тура
сызықтықтың j бұрышты көлбеуі
(lnk1 - lnk2)/(1/T2 - 1/T1) = tgj = Ea/Rm (6.1.4)
белсендіру
Ea қайратын, ал 1/Т = 0-дегі lnk = lnk0-ден экспонентаның алдындағы k0 жылдамдық
тұрақтысының мәнін анықтайды.
Арренус заңының (6.1.3)
түрін шаққылы ыстықтыққа тәуелділігін
келесідей жазсақ
 (6.1.5)
(6.1.5)
жылдамдық
тұрақтысының ыстықтық тәуелділігінің
белсендіру Еа қайратына және Вант-Гофф (5.2.7)
заңына, яғни белсендіру қайраттың жылулық
әсерге сәйкес екендерін көреміз. Вант-Гоффтың
заңын келесідей өзгертсек
 (6.1.6)
(6.1.6)
табылғанды,
(6.1.5)-ті ескере, келесідей жаза аламыз
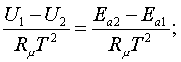 QV
= U1
– U2 = - DU = Ea2
– Ea1. (6.1.7)
QV
= U1
– U2 = - DU = Ea2
– Ea1. (6.1.7)
Сонымен, белсендіру
қайраттың айырымының жылулық әсерге тең
екенін қөреміз. Бұл қорытынды бойынша химиялық
тектесу солдан оңға қарай жүреді, егер жылулық
әсер (яғни ішкі қайраттың кемуі) ен
тектескіштердің белсендіруі (QV + Ea1) > Ea2 – тектесу
өнімдерінің белсендіру қайратынан артық болса, онда
керісінше жағдайларда ыдырау құбылысы болады.
Жылдамдық
тұрақтысының Аррениус заңы бойынша
ыстықтыққа тәуелді сызығының иіліс
(перегиб) нүктесіндегі ыстықтықтың мәнін
(6.1.2)-нің келесі екінші туындысымен анықтаймыз
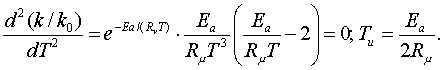 (6.1.8)
(6.1.8)
Бұл өте жоғары
ыстықтыққа іс жүзінде тектесуді жеткізу өте қиын.
Сондықтан нақты тектесулер (6.1.2) тәуелділігінің иіліс
нүктесінің төменгі жағында болады.
6.2 Тектесу
құраушыларының шоғырлары мен жылдамдығының
уақыт
пен қысымға тәуелділігі
Тектескіштердің (басты (б) құраушылардың) сі
шоғырлары арқылы анықталатын тектесу жылдамдығын
(2.1.7) келесідей жазайық
 (6.2.1)
(6.2.1)
Мұндағы k - жылдамдықтың тұрақтысы;
nі – і-тектескіштің тектесулік
(стехиометриялық) қатынасы;
К – көбейту
белгісі;
t - уақыт.
Бірінші дәрежелі тектесудің кинетикалық (6.2.1)
теңдеудің аумаққысы
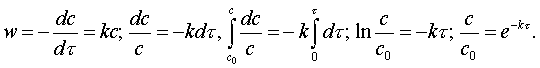 (6.2.2)
(6.2.2)
Мұндағы [k] = с-1.
Екі дәрежелі тектесудің екі тектескіштерінің
шоғырлары (мысалы, 2NO2 = 2NO + O2
ыдырау тектесуіндегідей) бірдей болса
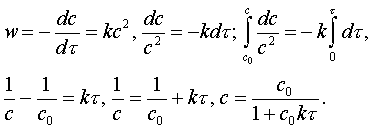 (6.2.3)
(6.2.3)
Мұндағы [k] = кмоль/(м3с).
Үш дәрежелі тектесулер (мысалы: 2NO + O2 = 2NO2;
2СО + О2 = 2СО2) сирек кездеседі. Дегенмен, олардың
шоғырларының шаққылық пен
аумаққылық теңдеулері келесі
 (6.2.4)
(6.2.4)
Бастапқы шоғырлары бірдей (t = 0-дегі с = с0)
тектескіштердің шоғырларының уақыт бойынша
төмендеу қарқыны тектесу дәрежесіне қарама -
қарсы ((6.2.2)-(6.2.4)). Бұл жағдай физикалық та
(табиғи) түсінікті, өйткені тектескіштердің сандары
көбейсе, бір мезгілде соқтығыса қалу
мүмкіншіліктері салыстырмалы азаяды.
Тектесу жылдамдығының қысымға тәуелдігін
көру үшін оның (6.2.1)
анықтамасындағы тектескіштерінің сі
шоғырларын мүлтіксіз газдың күй теңдеуіндегідей
жүйенің р қысымына тәуелдігін келесідей алайық
сі = rip/(RmT). (6.2.5)
Мұндағы ri – і-тектескіштің мольдік үлесі.
Бұл шоғырдың (6.2.5) мәнін бір мен екі және
үш дәрежелі тектесулердің жылдамдықтарының
(6.2.2)-(6.2.4) теңдеулерінде келесідей ескереміз
w1 = kс = krp/(RmT), (6.2.6)
w2 = kс2 = k[rp/(RmT)] 2, (6.2.7)
w3 = kс3 = k[rp/(RmT)] 3. (6.2.8)
Сонымен, тектесу жылдамдығының
қысымға тәуелдігінің қарқыны сол
тектесудің дәрежесіне сәйкес өседі.
6.3 Тізбекті тектесулер
Өткен бапта қаралған (бір
не қос затшалы (молекула) тектесулермен қатар күрделі
өзара әрекетті тектесулер болады. Күрделі тектесулердің
тәжірибелі анықталған жылдамдықтарының
тәуелділіктері (кинетикалық теңдеулері)
қатынастық (стехиометриялық) теңдеулеріне сәйкес
келмейді. Күрделі тектесулердің кинетикалық
теңдеулерінің дәрежелері қатынастық
теңдеулерінің дәрежелерінен төмен болады. Күрделі
тектесулердің ерекшеліктері тізбекті (цепная) тетіктерімен
түсіндіріледі. Тізбекті тектесулердің теориясын академик
Н.Н.Семенов жасаған.
Қайратты өзгелерінен артық
тектесу түзгісін белсенді бөлік (активная частица, радикал)
дейміз. Бір радикал тектесе, жаңа радикалдарды тудырса, тізбекті
тектесу пайда болады. Радикал ыдыстың бетімен соғысып не
басқадай себептермен артықты қайратынан айрылса, тізбекті
тектесу үзіледі.
Радикалдарының шоғырлары
өсетін (өспейтін) тізбекті тектесулер тармақты
(разветвленные) (тармақсыз (неразветвленные) болады.
Тармақсыз тектесудің мысалы ретінде қос
затшалық келесі тектесуді (бимолекулярная реакция) алайық
![]() (6.3.1)
(6.3.1)
Бұл тектесу, қалыпты
жағдайдағы белсендіру қайратының (Еа=167,7 кДж/кмоль) жоғарылығынан, қатынасты (6.3.1)
теңдеуі бойынша жүрмейді. Хлордың молекулаларының
өзара не басқа М молекуламен соқтығысып ыдырауынан
пайда болатын атомдарының шоғырлары келесі теңесумен
анықталады
![]() (6.3.2)
(6.3.2)
Сутегі мен хлорлы жүйеде пайда
болған хлордың атомы сутегімен келесідей тектеседі
![]() (6.3.3)
(6.3.3)
Мұндай тектесудің
белсендіру қайраты (Еа = 21,1кДж/кмоль) (6.3.1)-дікінен бір дәрежедей кем. Сондықтан,
хлор атомдарының шоғыры аз болып, сутегінің молекулаларымен
аз соғылғанының өзінде, (6.3.3) тектесудің
жылдамдығы Аррениустің (6.1.2) дәрежелі заңы бойынша
(6.3.1)-дегі хлор мен сутегінің бимолекулалы тектесуінің
жылдамдығынан әлдеқайда артық болады. Онымен
қатар, хлордың атомды (6.3.3) тектесуінде ![]() -мен бірге сутегінің Н
радикалы пайда болады. Хлордың молекуласы мен осы сутегінің атомды
тектесуінде
-мен бірге сутегінің Н
радикалы пайда болады. Хлордың молекуласы мен осы сутегінің атомды
тектесуінде ![]() -мен бірге (6.3.2)-дегідей
тағы да хлордың радикалы пайда болады
-мен бірге (6.3.2)-дегідей
тағы да хлордың радикалы пайда болады
![]() (6.3.4)
(6.3.4)
Бұл тектесудің жылдамдығы (6.3.3) тектесудің
жылдамдығынан да артық.
Соңғы екі тектесудің қорытындысында, екі ![]() молекулалары пайда болғаннан кейін тектесуді бастаушы
(шақырушы) (6.3.3)-тегі хлордың атомы келесі (6.3.4) тектесумен
қайта пайда болып (қалпына келтіріліп) отырылады.
молекулалары пайда болғаннан кейін тектесуді бастаушы
(шақырушы) (6.3.3)-тегі хлордың атомы келесі (6.3.4) тектесумен
қайта пайда болып (қалпына келтіріліп) отырылады.
Сонымен, тектескіштерден басқа бір М молекуланың
әрекетімен (6.3.2)-те басталған (6.3.1)-дегі тектескіш ![]() молекуласының екі
молекуласының екі ![]() радикалдарына (6.3.2)-де ыдырап,
(6.3.3)-те
радикалдарына (6.3.2)-де ыдырап,
(6.3.3)-те ![]() -ға айнала, пайда болған
сутегінің радикалы Н арқылы (6.3.4)-те
-ға айнала, пайда болған
сутегінің радикалы Н арқылы (6.3.4)-те ![]() молекуланың
молекуланың ![]() мен
мен ![]() радикалына қайта келтіріле,
тізбекті тектесу жүйедегі сутегі мен хлордың молекулалары біткенше
не сутегі мен хлордың атомдары өзара қосылып (Н + Н = Н2;
радикалына қайта келтіріле,
тізбекті тектесу жүйедегі сутегі мен хлордың молекулалары біткенше
не сутегі мен хлордың атомдары өзара қосылып (Н + Н = Н2; ![]() ), не ыдыстың қабырғасына
соқтығысып, тізбекті тектесу үзілгенше, жалғаса бермек.
), не ыдыстың қабырғасына
соқтығысып, тізбекті тектесу үзілгенше, жалғаса бермек.
Қаралып отырған тектсудің жылдамдығы тәжірибелі
![]() (6.3.5)
(6.3.5)
яғни
бұл тектесу сутегі бойынша бірінші дәрежелі, ал хлор бойынша жарты
дәрежелі. Бұл тәуелдік те тектесудің хлор бойынша
жүретінін көрсетеді [2].
Тектесудің тізбекті тетігі
оның қалыпты жолының мүмкіндігін жоққа
шығармайды. Тек, бұл жол - аз мүмкінді, өйткені
белсендіру қайратының
мәні тізбекті түрінен көп жоғары. Басқаша
айтатын болсақ, молекулалярлық тектесу тізбекті тектесуге
қарағанда, өте баяу жүретінінен жалпы қорытындыда
онша сезілмейді.
Тармақты (разветвленные) тізбекті тектесулерде екі не одан көп
радикалдардың (белсенді бөлшектердің) пайда болуына
(6.3.2)-дегідей басты себеп болуы мүмкін. Бұл жолы тектесудің
жылдамдығы тез ұлғаяды. Тармақты тектесудің
мысалы ретінде сутегінің жану тектесуін алуымызға болады
Н2
+ О2/2 = Н2О. (6.3.6)
Келесі басты тектесуден кейін
Н2
+ М = 2Н + М (6.3.7)
ізінше мынадай
тізбекті тектесулер жүреді
Н + О2
= НО + О, (6.3.8)
О + Н2
= ОН + Н, (6.3.9)
ОН + Н2
= Н2О + Н. (6.3.10)
Бұлардың
соңғысын екіге көбейтіп алдыңғы екеуіне
қоссақ
Н + 3Н2
+ О2 = 2Н2О + 3Н, (6.3.11)
тізбекті
тектесуге (6.3.8)-де кіріскен сутегінің бір Н радикалының орынына
ақырлы 2Н2О өнімдерімен қатар сутегінің
үш бірдей (3Н) радикалдарының (6.3.11)-де пайда болғанын
көреміз. Бұл (6.3.6) тектесудің (6.3.7)-(6.3.10) секілді
тармақтылығының белгісі.
Тізбекті тектесудің бастапқы өрбіме кезеңінде
(период индукции) негізгі қайраты радикалдардың пайда болуына
кетіп, (6.3.11) тектесудің жылулық әсері аз болады.
Тектесудің әрі қарай тармақталуы
радикалдардың пайда болатын
сандарына сәйкесті үдеттіріледі. Дегенмен, радикалдардың саны
өсе келе, әрекетсіздік молекуларына айнала, тектесудің
тізбектілігі үзіле, үдеуі бәсеңдейді.
Жалпы айтатын болсақ, тізбекті тектесу көп таралған.
Көмірсутектілердің (углеводороды) көбі тізбекті тектесуліден
өтеді. Тізбекті тектесудің жылдамдығы тектескіштердің шоғырлары мен
ыстықтығына тәуелді. Ыстықтығы
тұрақты жүйеде, тектескіштердің шоғырлары
уақыт бойынша азая келе, тектесудің жылдамдығы нөлге
дейін төмендейді.
Егер тізбекті тектесуші жүйенің ыстықтығы
тұрақты болмаса, бастапқы өрбіме кезеңінде
тектесудің жылдамдығы еркін өзгермейді. Тектесу әрі
қарай, тізбекті дами келе, тектескіштердің шоғырлары
азайғанымен, жылуалмасусыз жүйенің жылулық әсері
өсе, тектесудің жылдамдығы бастапқы өрбіме
мәнінен бірнеше есе асып, тектескішткердің 80-90 пайыздайы
жанғаннан кейін ең үлкен мәніне жетеді.
Тектескіштердің шоғырлары өте азайғаннан кейін,
тектесудің жылдамдығы азайып, уақыт бойымен нөлге
төмендейді.
6.4 Катализ
Тектесудегі маңызы мен химиялық құрамы
өзгермейтін заттардың әрекеттерімен тектесу
жылдамдығының өзгеруін
катализ дейміз.
Тектескіштерден басқа, тектесуде қасиеттері өзгермейтін,
бірақ тектесуді үдеттіретін (не бәсеңдеттіретін) жеделдеткіштің
(катализатордың), керісінше, тежегіштің (ингибитор),
яғни катализдендіргіштердің әрекетімен
химиялық тектесудің жылдамдығының өсуін - оң
(төмендеуін - теріс) катализ дейміз.
Тектесу жылдамдығы катализді өзгерткенде тектескіштері мен
өнімдерінің жылдамдық тұрақтылары бірдей
өзгеретінінен (теңелу күйіндегі олардың қатынасы
болып анықталатын) теңелу тұрақтысы
өзгермейді.
Катализдендіргіштер тектесуші жүйемен
біртекті (әртекті) болғанда катализді тектесуді біртекті
(гомогенді) (әртекті (гетерогенді)) дейді.
Біртекті катализді тектесуді келесідей түсіндіруге болады.
Алдымен А тектескіш пен К катализдендіргіш тектесіп, аралық АК
қосылыс жасайды
А + К Û АК. (6.4.1)
Бұл аралық қосылыс келесі
басты В затпен тектесіп, тектесу С өнімдерін шығара,
катализдендіргішті жаңғыртады
АК + В Û С + D + K. (6.4.2)
Мұндағы аралық
тектесудің белсендіру қайраты катализсіз тектесудің
белсендіру қайратынан аз (не көп) болса, жылдамдығы кері
сәйкесті көп (не аз) болады. Жылдамдық тұрақтысы
белсендіру қайратына Аррениус заңы (6.1.2) бойынша дәрежелі
тәуелді.
Егер тектесу өнімдерінің бірімен
катализденсе, өзіндігінен катализді (автокаталитическая)
деп аталады. Тектесу өзіндігінен оң катализді болса, тектесу
жылдамдығының тез өсуінен тектескіштерінің шоғырлары
тез азайып, тектесудің соңына қарай жылдамдығы да тез
нөлге жуықтайды.
Катализдендіргіш тектескіштерден басқа
текті болғанда, әртекті катализ болады.
Катализдендіргіш әдеттегідей қатты бетті болғанда түйіспелі
(контактный) катализ деп аталады. Оның белсенділігі
(активность) химиялық құрамы мен бетінің
физикалық күйіне тәуелді. Түйіспелі катализде
әдетте әртүрлі жағдайларға сәйкесті
әртүрлі қарқындырушы жылжытқыштар (промоторы)
қоспалы пайдаланады.
Кейбір қоспалар (мышьяк пен фосфор,
ацетилен, оттегі ж.т.б.) катализдік қасиеттерді жоққа
шығаруы мүмкін.
Түйіспелі катализдің тетігі
күрделі. Ол тектескіштердің бетті сіңірілуіне (адсорбция)
және беттегі белсендік орталарына тәуелді. Бұлардың
және әртекті катализдің теориялары дамуда.
6 - жаттығу. Отынның жану
өнімдері мен жылулық қабілеттілігі
Жануға кететін тотықтырғыш пен отын түзгілері
және жану өнімдерінің құрамы мен саны
химиялық тектесулерінің теңдеулерімен анықталады.
Көмірсутегілердің ауада
толық тотығуындағы жану өнімдері
көмірқышқыл (углекислый)
газы СО2 мен су буы Н2О және күкірт
(сернистый) газы SO2-лерден
құралады. Егер отынның құрамында азот болса
және өте белсенді азот атомдары мен оттегі атомдары қосылып
зиянды азот NOx
қышқылдарының пайда болуына арнайы бөгет жасалмаса, жану
құбылыстарындағы азоттардың атомдары өте тез
селқос (инертный) азот затшасына N2-ге айналып, жануға берілген ауаның азотына қосылады.
Егер оттегі отынның толық тектесуіне жетіксіз болса не отын мен
оттегі толық араласпаса, отынның толық жанбауынан жану
өнімдерінде көміртегі қышқылы СО, сутегі Н2,
метан СН4 ж.т.б. жанар газдары пайда болады.
Жанар отынның 1кг-ың толық жануына қажетті
тотықтырғыштың мөлшерін тотықтырғыштың
теориялық қажетті мөлшері деп аталады (М0,
кмоль/кг; G0, кг/кг; V0, м3/м3). Жануға берілетін тотықтырғыштың нақты
мөлшері ![]() теориялық
мөлшерінен әдетте артық болады.
теориялық
мөлшерінен әдетте артық болады.
Тотықтырғыштың
нақты мөлшерінің тектесуге теориялық қажетті
мөлшеріне қатынасын (ауаның) артықтық
еселеуіші (коэффициент избытка (воздуха)) деп аталады
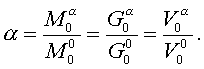 (6.4.3)
(6.4.3)
Толық жану өнімдерінің аталған
құраушыларына пайдаланбаған оттегінің мөлшері
қосылады (m = М0, кмоль/кг; G0, кг/кг; V0, м3/м3)
![]() (6.4.4)
(6.4.4)
Жанардың 1 кг-ның ауада не оттегіде толық
жанғанындағы жылулығын (төменгі о – отын)
отынның жылулық қабілеттілігі ![]() дейді. Егер жану
өнімдеріндегі (түтіндегі) су буы шықтандырылып, оның
текті күй өзгеруінің жылулығы пайдаланса, жылулық
қабілеттілік жоғарғы болады
дейді. Егер жану
өнімдеріндегі (түтіндегі) су буы шықтандырылып, оның
текті күй өзгеруінің жылулығы пайдаланса, жылулық
қабілеттілік жоғарғы болады ![]() , ал егер су буы түтінмен қоршаған
ортаға тасталып, сонда шықталса, тектікүй
өзгеруінің жылулығы далаға кетеді де, отынның
жылулық қабілетілігі төменгі
, ал егер су буы түтінмен қоршаған
ортаға тасталып, сонда шықталса, тектікүй
өзгеруінің жылулығы далаға кетеді де, отынның
жылулық қабілетілігі төменгі ![]() болады.
болады.
Түтіннің су буының тектікүй өзгерісінің
жылулығы әрбір отынның сутегі үлесі H пен
ылғалдылығы W мен келесідей анықталады
![]() (6.4.5)
(6.4.5)
Жылулық қабілеттілік (тәжірибелік мәліметтер
болмағанда) жеткілікті дәлдікпен Д.И.Менделеевтің келесі
кейіптемесімен анықталады
![]() (6.4.6)
(6.4.6)
Мұндағы С, Н, S, O - көмірдің,
сутегінің, күкірттің және оттегінің
отындағы маңыздық үлестері, кг/кг.
Жану ауада не оттегіде болғандағы қоспаның жылу
өнімі
![]() (6.4.7)
(6.4.7)
Егер тотықтырғыш басқадай оттегі бар зат болса
(асақышқыл сутегі-перекись водорода Н2О2,
азот қышқылы ж.т.б. сұйықтық
зымрандардағыдай)
 (6.4.8)
(6.4.8)
Мұндағы ![]() -тотықтырғыштың G0
= 1 кг ыдырауындағы бөлінген не сіңірілген жылулық.
-тотықтырғыштың G0
= 1 кг ыдырауындағы бөлінген не сіңірілген жылулық.
6.1-есеп (IV-1[4]). Ауаның
теориялық қажетті мөлшерінің кейіптемесі
 , кмоль/кг. (6.4.9)
, кмоль/кг. (6.4.9)
Бұл кейіптемені кг/кг және қм3/кг өлшем
бірліктеріне келтіріңіздер.
Отынның күкірті болғанда ауаның шығысы
қаншаға өзгереді?
Шешімі. Ауаның затшалық
(молекулярлық) маңызы m = 28,96 кг/кмоль мен көлемі Vm = 22,4136 қм3/кг болатындықтан
G0а=m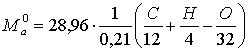 =11,5С + 34,5Н – 4,31О, кг/кг; (6.4.10)
=11,5С + 34,5Н – 4,31О, кг/кг; (6.4.10)
V0а=Vm×М0а=22,4×  =8,89С + 26,6Н –
3,33О, қм3/кг.(6.4.11)
=8,89С + 26,6Н –
3,33О, қм3/кг.(6.4.11)
Отын
күкірті болғанда ауаның келесідей қосымша шығысы
болады:
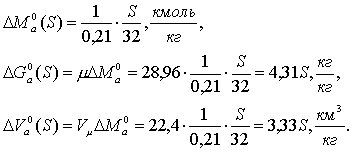 (6.4.12)
(6.4.12)
6.2-есеп
(IV-2[4]). Құрғақ табиғи
отын ауада жанғанда жану өнімдерінің толық
мөлшері келесі кейіптемемен анықталады
![]() (6.4.13)
(6.4.13)
Мұндағы
![]() - жану
өнімдеріндегі (пайдаланбай) қалған ауа мен азоттың
толық мөлшері. Жану өнімдерінің (Ж6.2.1)
кейіптемесін кг/кг және қм3/кг өлшем бірліктеріне
келтіріңіздер.
- жану
өнімдеріндегі (пайдаланбай) қалған ауа мен азоттың
толық мөлшері. Жану өнімдерінің (Ж6.2.1)
кейіптемесін кг/кг және қм3/кг өлшем бірліктеріне
келтіріңіздер.
Жауаптарының бірі: Vгa=1,86С+11,2Н+0,7S+0,8N+22,4(a-0,21)Ма0,
қм3/кг.
6.3-есеп (IV-10[4]).
Диметилгидразиннің (дмг) жылулық қабілеттілігі Qдмг
= 29600 кДж/кг. Оның оттегіде жануындағы тотықтырғыштың
теориялық GO2 шығысын, жану
өнімдерінің маңыздық gi құрамын
және қоспасының жылу өнімін
(теплопроизводительность) Н a = 1,2-де анықтаңыздар.
Шешімі. Диметилгидразиннің
жануының немқұрайлы (формальная) келесі кейіптемесі бойынша
(CH3)2N2H2 +
4O2 = 2CO2 + 4H2O + N2 (6.4.14)
газдары мен
өнімдерінің жалпы шығыстарын және қатынастарын
табамыз (mдмг = 60): GСО2 = 2×44/60 = 1,465; GН2О = 4×18/60 = 1,200; GN2 = 28/60 = 0,465; Gг = GСО2 + GН2О + GN2 = 1,465 + 1,200
+0,465 = 3,13 кг/кг; gСО2 = GСО2/Gг
= 1,465/3,13 = 0,468; gН2О = GН2О/Gг
= 1,200/3,13 = 0,383; gН2 = GН2/Gг
= 0,465/3,13 = 0,149.
Оттегінің жануға қатынасты шығысы
G0О2 = 4mО2/mдмг = 4×32/60 = 2,13 кг/кг.
Қоспаның жылуөнімі (7.5)
Н = Q0/(1 + aG0О2) = 29600/(1 + 1,2×1,3 = 9450 кДж/кг
7 Жылуқозғалымның үшінші заңы
Теңелу
тұрақтысының ыстықтыққа тәуелділігі (5.3.4)
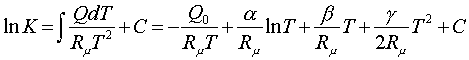 (7.1)
(7.1)
жуықты
есептелуі мен оның аумаққылық С
тұрақтысының берілген
әртүрлі шарттарындағы анықталуының мүмкінді
жолдарын 5.3- бапта көрдік (мұндағы
аумаққыдағы Q-дің мәні Кирхгофтың (1.4.6)
заңы бойынша алынған). Бірақ, бұл
тұрақтының жалпы анықталу жолы мәселелі
қалды.
Химиялық тектіктіктің (5.2.3)-тегі есептелу мәселесі де
жоғарғыдай
DФ/Т = - Rm lnКр + С, (7.2)
өйткені
мұндағы Кр теңелу
тұрақтысының ыстықтыққа тәуелді
есептелуі (7.1)-дегідей осы С тұрақтысының анықталуына
байланысты.
Аумаққылаудың
бұл тұрақтысының
әдеттегідей
шекаралық шарттар
арқылы анықталуының теориялық жолдары
көрінбегендігінен 5.3- бапта осы С-ның тәжірибелік
анықтау жолдары да көрсетілген. Бірақ,
тәжәрибелік жол - өте күрделі және көлемді.
Оңайы, (4.2.5)-тегідей (күдікті болса да) Т = 0-дегі
химиялық тектіктер жылулық әсерлерге тең (![]() ) дей салу. Шынында, Т = 0-де, мысалы,
Кирхгофтың (1.4.6) заңы бойынша Q = DН = DН0
деген физикалық дұрыс мән шығады. Бірақ,
қаралып отырылған теңелу тұрақтысы мен
химиялық тектіктің анықталуы бұл секілді, сырттай да
оңай емес, мысалы, Т = 0-де (7.1)
бойынша К = ¥ болып, тіпті анықталмайды. Оған қоса, толық
ыстықтықтың нөл (ешқандай
қозғалыстың жоқ) болуы да - аса ерекше жағдай.
) дей салу. Шынында, Т = 0-де, мысалы,
Кирхгофтың (1.4.6) заңы бойынша Q = DН = DН0
деген физикалық дұрыс мән шығады. Бірақ,
қаралып отырылған теңелу тұрақтысы мен
химиялық тектіктің анықталуы бұл секілді, сырттай да
оңай емес, мысалы, Т = 0-де (7.1)
бойынша К = ¥ болып, тіпті анықталмайды. Оған қоса, толық
ыстықтықтың нөл (ешқандай
қозғалыстың жоқ) болуы да - аса ерекше жағдай.
Сондықтан, толық ыстықтықтың нөл болуы
мен нөліндегі заттардың күйі мен физикалы химиялық
қасиеттерін білу - теориялық және қолданбалы өте
маңызды. Көптеген, әсіресе органикалық, күрделі
тектесулерді тәжірибелі зерттеу өте қиын.
Катализдендіргіштерді зерттеуден бұрын тектесудің мүмкін
екенін алдын ала білген жөн. Мұны білу үшін теңелу Кр
тұрақтысын (7.1) анықтап, химиялық тектікті (7.2)-мен
бағалау қажет. Ол үшін (7.1) мен (7.2) секілді
кейіптемелердің аумаққылау С тұрақтысының
мәнін анықтаудың теориялық мүмкіндігін табу өте қажет.
Сонымен, теңелу
тұрақтысы мен химиялық тектікті анықтау секілді
жағдайларда жылуқозғалымның бірінші және екінші заңдарының негізіндегі калориялық мәліметтерді білу
жеткіліксіз болғандықтан, 1906 жылы В.Нернст
жылуқозғалымның үшінші заңының
мазмұнын құраған жаңа құптамалар (постулат) енгізген.
Нернст Вальтер
Герман (1864-1941) – көрнекті неміс физигі, физхимигі, көбінде
электрохимия және ерітінділермен айналысқан, жылуқозғалымның тарихында
жылулық
теореманың авторы ретінде аты қалған, 26
жасында Геттинген университетінің приват (обучающий частным образом)
доценті, 41 жасынан Берлин университетінің профессоры, 60-69 жасында
соның физика институтының
директоры, Берлин және бір қатар шет елдердің ғылыми
академияларының мүшесі, 56
жасында (1920 ж) Нобель сыйлығының
иегері болған.
7.1
Нернсттің жылулық теоремасы
Нернсттің жылулық теоремасы (7.1) мен (7.2) - лердің аумаққылық С
тұрақтысының анықтауын мүмкін етеді. Нернсттің
бірінші бақылағаны – ол
толық ыстықтық нөлге шексіз
жуықталғанда (![]() ) шықты күйіндегі
барлық заттардың қалыпты еркін қажырлары (Гиббс
мүмкіндігі) арқылы анықталатын жылулық әсерлерінің
өзара жуықтасатыны. Сондықтан Нернст
) шықты күйіндегі
барлық заттардың қалыпты еркін қажырлары (Гиббс
мүмкіндігі) арқылы анықталатын жылулық әсерлерінің
өзара жуықтасатыны. Сондықтан Нернст ![]() пен
пен ![]() тәуелділіктері Т®0-де тек қана жуықтаспай өзара жанамалы болады деп болжамалайды
тәуелділіктері Т®0-де тек қана жуықтаспай өзара жанамалы болады деп болжамалайды
![]() . (7.1.1)
. (7.1.1)
Бұған қоса, Нернсттің тәжірибелі екінші
бақылағаны - ол қатты және сұйық
заттардың қасиеттері ![]() -де ыстықтыққа
тәуелсіз бола қалатынын
көрсетеді. Сондықтан Нернст
-де ыстықтыққа
тәуелсіз бола қалатынын
көрсетеді. Сондықтан Нернст ![]() пен
пен ![]() тәуелділіктері сызықтарының
тәуелділіктері сызықтарының ![]() -дегі жанамасы Т мекендігіне
қатарлы деп болжамалайды
-дегі жанамасы Т мекендігіне
қатарлы деп болжамалайды
![]() . (7.1.2)
. (7.1.2)
Бұл,
алдында болжамалы ұсынылып, артынан тәжірибелі дәлелденген.
Сондықтан, Нернсттің жылулық теоремасы келесідей
оқылады: ²Қаптаған заттардың қажыры мен еркін
қажырының ыстықтыққа
тәуелділіктерінің толық ыстықтық нөлге
шексіз жуықталғандағы ыстықтық туындылары
нөл болатыны нақты².
Кирхгофтың (1.4.6)
заңының
Q = Q0 + aТ + bТ2 + gТ3 (7.1.3)
туындысын (Q
= DН; Q0 = DН0 = тұрақты екенін ескере) алып
dDH/dT = a + bТ + gТ2, (7.1.4)
Нернсттің
жылулық теоремасы (7.1.2) бойынша (Т = 0 К-нде dDH/dT = 0)
a = 0 (7.1.5)
екенін
қалыпты химиялық тектіктің (5.1.12)
ыстықтыққа тәуелділігінде
DФ0 = DН0 - aТlnT - bТ2/2 - gТ3/6 + ТА0 (7.1.6)
ескеріп,
табылғанның туындысын
dDФ0/dT = - bТ - gТ2/2 + А0, (7.1.7)
(7.1.2)-дегідей,
нөлге теңеп, аумаққылау тұрақтысы нөл
екенін көреміз
А0
= 0. (7.1.8)
Сонымен, Нернсттің
жылулық теоремасына сүйене, шықты және
қатты денелі тектесу жүйелерінің жылулық (7.1.3)
әсері мен қалыпты химиялық (7.1.6) тектігін және
теңелу (5.1.6) тұрақтысын (еселеуіш a = 0 (7.1.5) пен аумаққы (7.1.8)
тұрақтысы А0 = 0-дегі және калориялық
мәліметтердің негізінде) келесідей (сәйкесті) анықтай
аламыз
Q = Q0 + bТ2 + gТ3, (7.1.9)
DФ0 = DН0 - bТ2/2 - gТ3/6, (7.1.10)
lnKp = - DФ0/(RmT) = - DH0/(RmT) + bT/(2Rm) + gT2/(6Rm). (7.1.11)
Көрсетілген қорытындылар DF0-ге де осы секілді
табылады. Бірақ, олар қаралмаған газды жүйеге
таралмайды.
7.2 Жылуқозғалымның үшінші заңы
Нернсттің жылулық теоремасының
маңызы “іздегеніміз-табылды”–дан кең болып,
жылуқозғалымның жаңа - үшінші жалпы
заңына айналды.
Нернсттің жылулық теоремасының (7.1.2) шартынан келесіні
шығарамыз
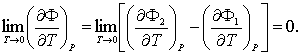 (7.2.1)
(7.2.1)
Мұндағы дербесті туындылар
энтропияның теріс мәні екенін (3.4.11) бойынша ескере

![]() (7.2.2)
(7.2.2)
яғни ![]() -де
-де
![]() тұрақты,
тұрақты, ![]() , (7.2.3)
, (7.2.3)
- деп Макс Планк
Нернсттің заңын келесідей жалпы тұжырымдаған: ²Толық ыстықтықтары нөлге жуықталған
көлемді біртекті барлық денелердің энтропиялары шексіз
төмендейді². Сондықтан мұны Планктің
қағидасы деп атайды.
Сонымен, Т ® 0-дегі (яғни Т = тұрақтыдағы) энтропияның
тұрақтылығы (яғни құбылыстың
жылуалмасусыздығы) Т ® 0-де ыстықтық тұрақты құбылыс - жылуалмасусыз құбылыста да
болатынын көрсетеді. Ал, жылуалмасусыз
құбылыста дене мен зат толық нөлге дейін суи
алмайды. Сондықтан, жылуқозғалымның үшінші
заңын: ²Ыстықтық толық
нөлге жете алмайды². - деген қағидамен (принцип недостижимости абсолютного нуля) жиі бейнелейді. Кейде оны: ²Ғасырлық қозғалтқыштың үшінші
тегі болмайды² (принцип недостижимости вечного двигателя 3-рода), яғни: ²Денені толық нөлге суыта алатын қозғалтқыш
болмайды². – деп, қағидалы
атайды.
Толық нөл мүмкінсіз (яғни ![]() ) болғандықтан жылулық
қозғалтқыштардың қайтымды Карно (қК)
айналымының ПЖЕ-сі ылғи бірден төмен:
) болғандықтан жылулық
қозғалтқыштардың қайтымды Карно (қК)
айналымының ПЖЕ-сі ылғи бірден төмен: ![]() болады.
болады.
Сонымен, жылуқозғалымның бірінші заңы ішкі
қайратты, екіншісі – энтропия мен толық ыстықтықты
анықтаса, үшіншісі - тек қана энтропияның мәнін шектейді.
Химиялық теңдесудің толық энтропия арқылы
есептелуі мен тәжірибелік мәліметтермен келісуі -
жылуқозғалымның үшінші заңының
дәлелі. Қатты не шықталған денелі
жүйелердің барлық тектесулерінде
жылуқозғалымның үшінші заңы тәжірибелік
дәлдіктің деңгейінде
орындалады деуге болады.
Жылуқозғалымның үшінші заңының
негізінде анықталған энтропияның мәндерінің
санақнамалық әдістері арқылы шығарылған-
дарымен келісуі де - жылуқозғалымның үшінші
заңының орындалуының дәлеліне жатады [2].
7.3 Заттардың толық нөл
маңындағы қасиеттері
Гельмгольц (F=U-TS) пен Гиббс (Ф=H–TS) мүмкіндіктерінің толық
туындыларын жылуқозғалымның I
заңының (3.4.2) мен (3.4.3) теңестіктері мен жалпы (3.4.10)
түрлері арқылы жаза салыстырып, 3.4- бапта табылған келесі
көрсеткіштерді
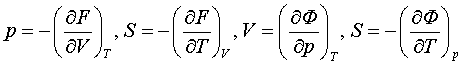 (3.4.11)
(3.4.11)
күй
бернелердің қиылысты туындыларының тең екенін
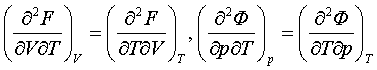 (7.3.1)
(7.3.1)
пайдалана, келесі
Максвелдің III және IV
теңдеулері түрінде жазамыз
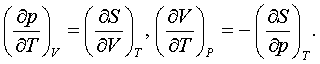 (7.3.2)
(7.3.2)
Мұндағы энтропияның өзгерісі
жылуқозғалымның үшінші заңы (7.2.3) бойынша
толық ыстықтық нөлге жуықталғанда нөл
болатынынан, онымен байланысты тектесу жүйенің қысымы мен
көлемінің (7.3.2) өзгерістері де нөл болатынын
пайдалана, әртүрлі заттардың соңғылармен
байланысты қасиеттерін көруге болады. Оған келесі мысалдарды келтірейік.
10. Жылулық  мен
мен 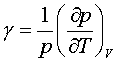 еселеуіштері де
еселеуіштері де ![]() -де шексіз нөлге
жуықтайды. Мұны (7.2.3) пен (7.3.2) арқылы көруге болады.
-де шексіз нөлге
жуықтайды. Мұны (7.2.3) пен (7.3.2) арқылы көруге болады.
20. Жылусыйымдылықтың жалпы теңдеуін
 (7.3.3)
(7.3.3)
жаңағыдай
өзгертсек,
![]() (7.3.4)
(7.3.4)
екенін
көреміз. Ал, физикалық ![]() болатындықтан,
тек
болатындықтан,
тек
![]() мен
мен ![]() (7.3.5)
(7.3.5)
болса ғана,
(7.3.4) орындалады деп қорытынды жасаймыз.
30. Жылуқозғалымның үшінші
заңының ![]() мен
мен ![]() (7.3.5)
қорытындысы бойынша мүлтіксіз газдың pv = RT теңдеуі мен осы Клапейрон теңдеуі
арқылы шығарылатын Майердың
(7.3.5)
қорытындысы бойынша мүлтіксіз газдың pv = RT теңдеуі мен осы Клапейрон теңдеуі
арқылы шығарылатын Майердың ![]() теңдеуі
толық ыстықтық нөлге жуықталғанда
орындалмайды, өйткені әдетті физикалық жағдайларда: cp,
cv, R-лар нөл болмайды. Сондықтан, толық
ыстықтық нөлге жуықталғанда мүлтіксіз
газдың тегі өзгереді (вырождается) деген қорытынды
жасалған [2,13].
теңдеуі
толық ыстықтық нөлге жуықталғанда
орындалмайды, өйткені әдетті физикалық жағдайларда: cp,
cv, R-лар нөл болмайды. Сондықтан, толық
ыстықтық нөлге жуықталғанда мүлтіксіз
газдың тегі өзгереді (вырождается) деген қорытынды
жасалған [2,13].
Мысалы,
сутегінің әдетті ![]() мәні
толық ыстықтық нөлге жуықталғанда:
мәні
толық ыстықтық нөлге жуықталғанда: ![]() -де
-де ![]() болады [2].
болады [2].
7- жаттығу. Жылуқозғалымның
шаққылық теңдеулері
Жылуқозғалымның I
және II бастамаларынан барлық денелердің әртүрлі
көрсеткіштерін байланыстыратын шаққылық
теңдеулері шығарылады. Егер жылулық ![]() көрсеткіштердің тәжірибелік не талдаулық тәуелділіктері
белгілі болса, оларға сәйкесті шаққылық
теңдеулерді аумаққылап, басқадай тәуелділіктері
мен көрсеткіштерді табуға болады. Жылуқозғалымның
негізгі шаққылық теңдеулері [2, 4, 12 - 14]
көрсеткіштердің тәжірибелік не талдаулық тәуелділіктері
белгілі болса, оларға сәйкесті шаққылық
теңдеулерді аумаққылап, басқадай тәуелділіктері
мен көрсеткіштерді табуға болады. Жылуқозғалымның
негізгі шаққылық теңдеулері [2, 4, 12 - 14]
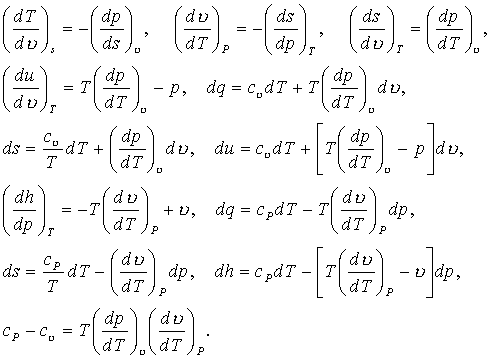 (7.3.6)
(7.3.6)
Сипаттаушы бернелер:
ішкі қайрат u, қажыр h=u+pv, еркін қайрат f=u-Ts, еpкін
қажыр (жылуқозғалымдық мүмкіндік) ф=h-Ts.
Калориялық пен жылулық көрсеткіштердің байланыстары
 (7.3.7)
(7.3.7)
Тепе-теңдік
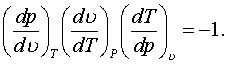 (7.3.8)
(7.3.8)
7.1-есеп (VIII-6[4]). Аумалы
күйдегі жылусыйымдылықтың шексіздігін дәлелдеу.
Шешімі. Көлемі тұрақтыдағы мен аумалы күйдегі
(критическое состояние) жылусыйымдылықтардың байланысын
табайық. Энтропияның Т мен v-ларға тәуелділігіндегі
толық шаққысы
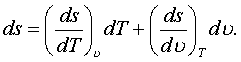 (7.3.9)
(7.3.9)
Мұның аумалы нүктедегі түрі
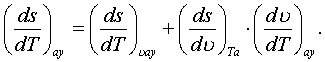 (7.3.10)
(7.3.10)
Мұнда 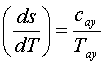 мен
мен  ларды ескерсек
ларды ескерсек
 (7.3.11)
(7.3.11)
Мұнда 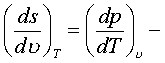 ні ескерсек
ні ескерсек
 (7.3.12)
(7.3.12)
Ал, аумалы
нүктеде  Сондықтан
Сондықтан ![]()
7.2-есеп (VIII-7[4]). 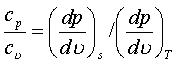 екенін дәлелдеңіздер.
екенін дәлелдеңіздер.
Шешімі. Жылуалмасусыз құбылыстың теңдеуін
шаққылайық:
![]() тұрақты;
тұрақты; ![]() яғни
яғни
 (7.3.13)
(7.3.13)
Енді тұрақты
ыстықтық құбылыстың (изотерманы)
шаққылайық:
![]() тұрақты;
тұрақты; ![]() яғни
яғни
 (7.3.14)
(7.3.14)
Сондықтан ((7.3.13) бен (7.3.14)-тердің қатынасынан)
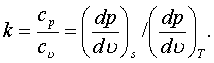 (7.3.15)
(7.3.15)
7.3-есеп (VIII-8[4]). Жылулық
кеңею мен сығылу еселеуіштері
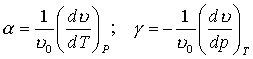 (7.3.16)
(7.3.16)
арқылы
анықталатын ![]() мен
мен ![]() лардың айырымының келесі кейіптемесін дәлелдеңіздер
лардың айырымының келесі кейіптемесін дәлелдеңіздер
![]() . (7.4.17)
. (7.4.17)
Шешімі.
Жылумсыйымдылықтың теңдеуіндегі дербесті ![]() туындыны
туындыны ![]() мен
мен ![]() лармен тепе-теңдік (7.3.8) арқылы ауыстырып,
келесіні табамыз
лармен тепе-теңдік (7.3.8) арқылы ауыстырып,
келесіні табамыз
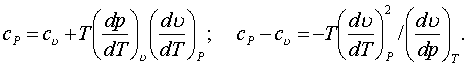 (7.3.18)
(7.3.18)
Мұндағы дербес туындыларды
(7.3.18) бойынша ![]() мен
мен ![]() арқылы жаза,
іздегенімізді ((7.3.17)-ні)табамыз
арқылы жаза,
іздегенімізді ((7.3.17)-ні)табамыз
![]() (7.3.19)
(7.3.19)
7.4-есеп (VIII-13[4]).
Мүлтіксіз газдағы дыбыстың а жылдамдығын
барлық газдарға тән ![]() теңдеуі
арқылы анықтаңыздар.
теңдеуі
арқылы анықтаңыздар.
Шешімі.
Тұрақты энтропиялық құбылысқа ![]() тұрақты. Мұны логарифмдеп,
табылғанның туындысын анықтайық
тұрақты. Мұны логарифмдеп,
табылғанның туындысын анықтайық
![]() тұрақты;
тұрақты;
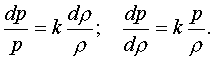 (7.3.20)
(7.3.20)
Мұнда мүлтіксіз газдың күй теңдеуін ескерсек
![]() (7.3.21)
(7.3.21)
екенін табамыз.
Макс Планк
(1858-1947) – аса көрнекті неміс физигі, Гельмгольц пен Кирхгофтың
дәрістерін тыңдап, Клаузиустың еңбектерімен
шұғылданып, 21 жасында жылуқозғалымның екінші
заңы бойынша докторлық диссертация қорғаған;
1880-1885-1889 жылдары Мюнхен, Килде, Берлин университеттерінің доценті,
профессоры болған; 1894 жылы Берлиннің ғылыми
академиясының мүшесі; 1918 жылы Нобель сыйлығының
иегері болған; жылуқозғалымның оқулығын жазған;
қайраттың кванттарын ашып, кванттық физикаға жол
ашқан.
7.4 Толық энтропияның калориялық
мәліметтері арқылы анықталуы
Энтропияның
толық нөлдегі мәні жылуқозғалымның
үшінші заңымен (7.2.3) анықталатындығынан толық
энтропия калориялық мәліметтері арқылы келесідей табылады
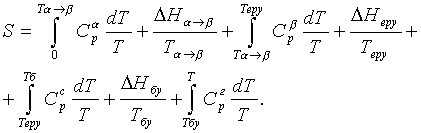 (7.4.1)
(7.4.1)
Мұндағы Тa®b және DНa®b - заттың кристалдық a түрінен басқа b түріне өзгеру ыстықтығы мен жылулық
әсері; Теру, DНеру мен Тбу, DНбу – еру мен буланудың сәйкесті
ыстықтықтары мен жылулық әсерлері; Срa(Т), Срb(Т), Срс(Т), Срг(Т) –
заттың текті күйлеріндегі жылусыйымдылықтарының
ыстықтыққа сәйкесті тәуелділіктері.
2- бөлім. Химиялық және тектікүй өзгерістері
8 Күрделі
тектесулердің физикалық химиясы
8.1 Жану мен
жарылудың ыстықтықтары
Күрделі тектесулерге жану мен жарылу құбылыстары секілді
жарықты (фотохимиялы) және жоғары қайратты (рентген, ![]() - радиациялы)
химиялық сәулеленулік тектесулер жатады.
- радиациялы)
химиялық сәулеленулік тектесулер жатады.
Шырақты және аса мол жылулық әсерлі химиялық
тектесуді жану дейміз. Мұны көміртегі мен сутегі
және күкірттің оттегі не хлормен және тағы
басқалармен тектесулі
қосылғанда көреміз.
Заттың күйі кенет өзгеріп, соғу толқыны пайда
болып, қайраттың сұрапыл көп шығуын жарылыс
дейміз [1]. Өзектік (ядерный) жарылыста затшалық ішкі өзектік сұрапыл үлкен
қайраты өзектік бөлшектерінің
қозғалыстық қайратына өзгереді. Жарылыстар тізбекті
(цепной взрыв) және жылулық болып
бөлінеді.
Тізбекті жарылыс тармақты тізбекті тектесулерде болады.
Ыстықтық пен ыдыстың түріне және газ
қоспалардың құраушыларына байланысты
тұтанудың жоғарғы
және төменгі шектері болады. Мысалы, сутегі мен оттегінің
қалыпты күйіндегі (Т0 = 298 К; р0 = 1физ.атм. = 0,101325 МПа)
қоспасының тұтану шегі (оттегінің көлемдік пайызымен):
төменгісі 6, ал жоғарғысы 95 болады. Осы секілді хлор
- сутегілік ж.т.б. жанулық қоспаларының шекті мәндері
болады. Өзінен жарылудың жоғарғы АВ мен төменгі
ВС шектерін 8.1.1-суреттегідей
көрсетуге болады.
Мұндағы ![]() -да ешбір қысымда өзінен тұтану (жарылу)
болмайды. Ал,
-да ешбір қысымда өзінен тұтану (жарылу)
болмайды. Ал, ![]() өзінен жарылу
өзінен жарылу ![]() аралығында
болып,
аралығында
болып, ![]() мен
мен ![]() -лерде - болмайды (тектесу баяу жүреді). Соңғы - кәдімгі
(тізбексіз) - жылулық жарылыстың жылулық әсері сыртқа
берілетін жылудан
-лерде - болмайды (тектесу баяу жүреді). Соңғы - кәдімгі
(тізбексіз) - жылулық жарылыстың жылулық әсері сыртқа
берілетін жылудан ![]() артық
болғанда, тектесу экзотермиялық болады.
артық
болғанда, тектесу экзотермиялық болады.
Мұны С. Аррениус заңына сәйкесті жылулық
![]() әсерін
ыстықтығы
әсерін
ыстықтығы ![]() орталарға
берілетін: Q2~(T2 – T0);
орталарға
берілетін: Q2~(T2 – T0); ![]() жылулықтармен 8.1.2-суреттегідей салыстыра, көруге болады. Бұлардың
жылулықтармен 8.1.2-суреттегідей салыстыра, көруге болады. Бұлардың
![]() - сі
- сі ![]() тәуелділігіне
тәуелділігіне ![]() В
нүктеде жанама өтетіндіктен:
В
нүктеде жанама өтетіндіктен: ![]() ;
;![]() -тұтану ыстықтығы болады.
Жылуберудің
-тұтану ыстықтығы болады.
Жылуберудің ![]() сызығы
сызығы ![]()
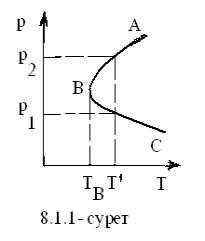
сызығынан
төмен ![]() болғандықтан жарылыс көлемінде жатады.
болғандықтан жарылыс көлемінде жатады.
|
Ал, |
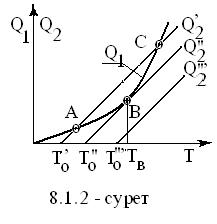
беріліп, тектесу
С нүктесіне жеткізілсе, әрі қарай өзі дамып, жарылуы
мүмкін, өйткені С нүктесінен жоғары ![]() болады.
Сондықтан тектесу жүйесі қызып, ыстықтығы
көтеріле, тектесу жылдамдығы Аррениус заңы бойынша тез
өседі.
болады.
Сондықтан тектесу жүйесі қызып, ыстықтығы
көтеріле, тектесу жылдамдығы Аррениус заңы бойынша тез
өседі.
Бұл жылулықтардың
ыстықтыққа тәуелділігін және тұтану
ыстықтығын
анықтайық.
Жылулық әсер
![]() (8.1.1)
(8.1.1)
Мұндағы ![]() - 1 кмоль тектесуші заттың жылулық әсері,
кДж/кмоль;
- 1 кмоль тектесуші заттың жылулық әсері,
кДж/кмоль;
![]() - бұл заттың тектесу жылдамдығы, яғни
бір секундта тектескен заттың көлемдік маңызы
(тығыздығы), кмоль/(м3с);
- бұл заттың тектесу жылдамдығы, яғни
бір секундта тектескен заттың көлемдік маңызы
(тығыздығы), кмоль/(м3с);
![]() - тектегіштің көлемі, м3.
- тектегіштің көлемі, м3.
Егер тектегіште екінші дәрежелі тектесу болса
![]() жану өнімдері,
(8.1.2)
жану өнімдері,
(8.1.2)
А не В
затының өзгеру жылдамдығы маңыздық әрекет
заңы бойынша
![]() (8.1.3)
(8.1.3)
Мұндағы жылдамдық тұрақтысын Аррениус (6.1.2)
заңымен ескеріп
 (8.1.4)
(8.1.4)
(8.1.1)-ге қойып
![]() (8.1.5)
(8.1.5)
табылғанның
(![]() еселеуішін (жуықты) ыстықтыққа
тәуелсіз деп) туындысын келесідей
анықтаймыз
еселеуішін (жуықты) ыстықтыққа
тәуелсіз деп) туындысын келесідей
анықтаймыз
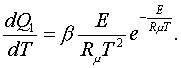 (8.1.6)
(8.1.6)
Жылуберу жылулығының
![]() (8.1.7)
(8.1.7)
туындысы
![]() (8.1.8)
(8.1.8)
Мұндағы ![]() жылуберу еселеуіші,
кВт/(м2К);
жылуберу еселеуіші,
кВт/(м2К);
Ғ-тектегіштің сыртқы жылуберу беті, м2.
Тұтану (т) нүктеге
табылған (8.1.5) пен (8.1.7) және (8.1.6) мен (8.1.8)-дердің
оң жақтарын теңестіре, екі белгісіз ТТ мен ![]() ыстықтарын анықтауға келесі екі
теңдеулерді табамыз
ыстықтарын анықтауға келесі екі
теңдеулерді табамыз
 (8.1.9)
(8.1.9)
 (8.1.10)
(8.1.10)
Тұтану ыстықтығын
(8.1.10)-нан сызбақ әдісімен тауып, (8.1.9) бен (8.1.10)-ның
қатынасынан ![]() -ді келесідей анықтаймыз
-ді келесідей анықтаймыз
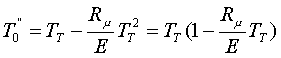 . (8.1.11)
. (8.1.11)
8.2 Жылулық
әсердің қысым мен текті күй өзгеруіне
тәуелділігі
Жылулық әсердің
қысымға тәуелділігі ыстықтыққа
тәуелділігінен көп кем; тек жоғары қысымдардың
әрекеті айтарлықтай. Жылуқозғалымның негізгі заңы
(теңестіктігі) бойынша
![]() (8.2.1)
(8.2.1)
анықталған
р,Т=тұрақтыдағы тектесу қажырының
қысымға тәуелділігіндегі
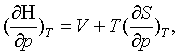 (8.2.2)
(8.2.2)
энтропияның
туындысын Максвеллдің белгілі IV теңдеуі арқылы шығарып
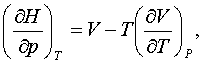 (8.2.3)
(8.2.3)
жылулық
әсердің (қажырдың) қысымға
тәуелділігін табамыз ![]()
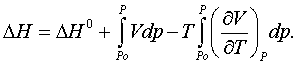 (8.2.4)
(8.2.4)
Мұндағы ![]() көлем
өзгерісі;
көлем
өзгерісі;
![]() - қалыпты қысым
- қалыпты қысым ![]()
Берілген р қысымдағы
жылулық әсерді анықтауға күй теңдеуі не
әрбір заттың баламалы көрсеткіштері белгілі болуы керек.
Мүлтіксіз газдың жылулық әсері қысымға
тәуелді![]() .
.
Тектікүй
өзгеруінің жылулық әсерге тиетін әрекетін
қатты не сұйық затты газ күйіне өзгертіп,
тектестіріп, өнімдерін қайта қатты не сұйық
күйіне келтіріп, жылулық әсерін анықтайды.
Бұған 1¸2 ғажайып мысал келтірейік.
Көміртегі екі түрде болады: графит пен алмаз. Әдеттегі
жағдайда графит орнықты (стабильно), ал алмаз салыстырмалы
орнықты (метастабильное) күйде болады. Алмаздың орнықты
күйі 104 ¸ 106 барда болады (8.2.1-сурет). Алмаздың табиғи
жағдайда өте сирек кездесетіні – графит алмазға өте
баяу (миллиондаған жылдарда) әзер өтеді.
|
Алмаз өндірісті (текті күй іліміне сүйене)
жасалады. Ол үшін әдеттегі қысымдағы (1 атмосфера)
графитті 6000 К-ге жуық қыздырып, буға айналдырылып,
қысымын миллион бардай көтеріп, әдеттегі
ыстықтыққа (~ 20 0С) дейін салқындатып, алмазға айналдырып,
қысымын түсірсе болғаны (4.2.1- суреттің 1- 2- 3- 4-
5 сызықшалары |

бойымен). Тектесу
жеделдеткіштермен (катализатормен) қарқындалады. Осы секілді
әдіспен 1957 жылы Кеңес одағының ғалымдары,
боразон деп аталатын, ВN бор нитридінің тектеше қиыршықты
(кристалды) жасанды түріне ![]() мен
мен ![]() -де (жеделдеткіштерді пайдалана) ие болған.
Боразонның қаттылығы алмаздың қаттылығынан
мол [13,14].
-де (жеделдеткіштерді пайдалана) ие болған.
Боразонның қаттылығы алмаздың қаттылығынан
мол [13,14].
Тектесушілердің
текті күйін өзгертіп, тектесудің жылулық әсерін жалпы түрде қарайық.
Бұл үшін р,Т=тұрақтыдағы сұйық (с)
күйіндегі затшалардың 8.2.2- суреттегідей
1-4-құбылысындағы тектесуін келесідей сатылы
жүргізейік.
Ең алдымен, 1-2- құбылыста затшаларды
қанығу рқ мен Тқ-да буландырып,
2-3- құбылыста р мен Т-да газды (г) затшаларды тектестірейік. Пайда
болған тектесу өнімдерін (3-4- құбылыс) рқ
мен Тқ-да шықтандырайық. Бұл
құбылыстардағы жылулық әсерлердің
![]() қосындысы
қаралып отырған сұйық затшалардың тектесу
жылулық әсеріне
қосындысы
қаралып отырған сұйық затшалардың тектесу
жылулық әсеріне ![]() тең
(өйткені қажыр күй бернесі, яғни Гесс заңына
сүйене)
тең
(өйткені қажыр күй бернесі, яғни Гесс заңына
сүйене)
![]() .
(8.2.5)
.
(8.2.5)
|
|
Мұның текті күй
өзгерістерінің жылулық әсерлерін берілген |
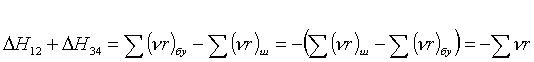 (8.2.6)
(8.2.6)
-
алгебралық қосынды белгісімен, келесідей жаза аламыз
![]()
![]() (8.2.7)
(8.2.7)
Енді бір еске алатын жағдай - ол отынның құрамында
әдетте сутегі мен ылғал болатындықтан, отынның
жануының жылулық қабілеттілігі жұмыстық (ж)
төменгі (т) ![]() және жұмыстық
(ж) жоғарғы (ж)
және жұмыстық
(ж) жоғарғы (ж) ![]() болын екіге бөлінетіні.
болын екіге бөлінетіні.
Бұлардың айырмашылығы - текті күй
өзгерісінің тектесудің жылулық әсеріне тиетін
(8.2.7)-дегідей әрекетінде ![]() Бұл физикалы
химиялық мекен қорғаулық (экология) және үнемиеттік
өте маңызды және көлемді мәселе. Сондықтан
мәселенің негізін қысқаша атайық.
Бұл физикалы
химиялық мекен қорғаулық (экология) және үнемиеттік
өте маңызды және көлемді мәселе. Сондықтан
мәселенің негізін қысқаша атайық.
Сутегі, әсіресе табиғи мен жасанды газ отындарында және
ылғалды көмірлерде (Канск-Ачинск көп таралған
көмірлерінде 40-пайыздай, Ілі өзенінің Балхаш көліне
құяр маңындағы ж.т.б.) мол болады. Мысалы, Газли
табиғи газының құрамындағы метанның (СН4)
үлесі 95 %-дан асады. Оның 25% сутегі үлесі жану құбылыстарында буға айналып және
ылғалдың буына қосылып, ![]() -ға жылулық қабілеттілігі азайып,
түтінмен
-ға жылулық қабілеттілігі азайып,
түтінмен ![]() далаға
тасталып, үнемиеттік және мекен қорғаулық
(жылулық ластау) зор зиян келтіреді. Тектікүй жылулығына
қоса, бу шықтанып, мол су болып, ол да далаға тасталады
(парниковый эффект (булық әрекетті) ұлғайтады).
далаға
тасталып, үнемиеттік және мекен қорғаулық
(жылулық ластау) зор зиян келтіреді. Тектікүй жылулығына
қоса, бу шықтанып, мол су болып, ол да далаға тасталады
(парниковый эффект (булық әрекетті) ұлғайтады).
Отын
жағудың бұл мәселесі түтіннің
ЖЭС-тарда 120-1400С-лі, ал өндірістік
қондырғыларда 10000С-ден аса
ыстықтықтарда
тасталуларымен де байланысты. Кеңес үкіметтік
республикаларда және, әсіресе европалық, шет елдердің
бір қатарында жылутәсілдік әдістемелері
![]() ге негізделіп жасалған. Сондықтан айтылған
мәселе әдістемелік кеңінен бейнеленбеген.
ге негізделіп жасалған. Сондықтан айтылған
мәселе әдістемелік кеңінен бейнеленбеген.
8.3 Күрделі
жүйенің жылулық әсері мен өнімдерінің
ыстықтығы
Қаралған жылулық
әсерлер тектесудің басты құраушылары мен өнімдері
бір ыстықтықта болғанда еді. Енді жылулық
әсерлерді тектесушілер - 1 мен өнімдерінің - 2
қажырлары: ![]() ,
, ![]() және ыстықтықтары әртүрлі,
тектікүй өзгерістері мен тектесуге қатынаспайтын газдары бар
және қоршаған ортамен жылу алмасатын - күрделі жүйелерге анықтаймыз.
және ыстықтықтары әртүрлі,
тектікүй өзгерістері мен тектесуге қатынаспайтын газдары бар
және қоршаған ортамен жылу алмасатын - күрделі жүйелерге анықтаймыз.
Қажыр мен ішкі қайрат (U)
күй бернелері болғандықтан жүйенің басты
күйінен соңғы күйіне өзгерулерін
жоғарғыдай үш сатылы қараған қолайлы
(8.3.1- сурет). Мұның дa қалыпты (![]() мен
мен ![]() ) күйіндегі тектесу мен тектікүй
өзгерістерінде DН0 болсын (қысымның қажырлық әсері
шамалы екені жоғарыда көрсетілген). Сонда, берілген Т0-дегі
тектікүй өзгерісінің меншікті r0
) күйіндегі тектесу мен тектікүй
өзгерістерінде DН0 болсын (қысымның қажырлық әсері
шамалы екені жоғарыда көрсетілген). Сонда, берілген Т0-дегі
тектікүй өзгерісінің меншікті r0
|
|
ғана есепке алып, тектікүй
затшаларының жылусыйымдылықтарын ескермеуге қолайлы болады.
Ал, қаралып отырылған екі басты (б) мен соңғы (с)
күйлерді жалғастыратын
екі aв мен cd
сатыларда жылулық әсер тектесушілер мен
өнімдердің қоршаған ортамен жылуалмасуларынан
өзгереді. Сонымен
тектесудің жылулық
әсерін, яғни
өнімдері (с) мен тектесушілерінің
(б) |
|
|
аралығындағы
қажырдың кемуін келесідей
жаза аламыз
![]() (8.3.1)
(8.3.1)
Мұндағы ![]() тектесудің (кестелерде келтірілетін) қалыпты жылулық әсер (стандартный тепловой эффект).
тектесудің (кестелерде келтірілетін) қалыпты жылулық әсер (стандартный тепловой эффект).
![]() (8.3.2)
(8.3.2)
![]() (8.3.3)
(8.3.3)
тектесу
өнімдері мен тектесушілердің сәйкесті Т0 мен Т2
және Т0 мен Т1 аралықтарындағы
жылулық әсерлерді көрсететін қажырлардың
төмен -деулері.
Сонымен күрделі
жүйенің толық жылулық әсерін келесідей жаза
аламыз
![]() (8.3.4)
(8.3.4)
Мұндағы ![]() 1 кмольға келтіріліген қалыпты жылулық
әсер, кестеден, мысалы А- тектесушіге анықталып, тектесудегі сол
тектесушінің қатынастық еселеуішіне (сәйкесті)
1 кмольға келтіріліген қалыпты жылулық
әсер, кестеден, мысалы А- тектесушіге анықталып, тектесудегі сол
тектесушінің қатынастық еселеуішіне (сәйкесті) ![]() -ға көбейтіліп алынған.
-ға көбейтіліп алынған.
Егер жүйеде тектеспейтін заттар
болса, олар (8.3.4)-тің сәйкесті
қосындыларында ескеріледі.
Егер кмольдік жылусыйымдылықтар
![]() (8.3.5)
(8.3.5)
деп
анықталса, (8.3.4)-тің аумаққысы жану
ыстықтығының келесі теңдеуін береді
 (8.36)
(8.36)
Тектесудің ![]() ыстықтығы
(8.3.6) арқылы анықталады, егер
ыстықтығы
(8.3.6) арқылы анықталады, егер ![]() және қоршаған ортамен жылуалмасулық
және қоршаған ортамен жылуалмасулық ![]() -тар белгілі болса.
-тар белгілі болса.
|
|
Егер Күрделі жүйенің жылулық әcерлерінің
іс жүзінде жиі кездесетін (8.3.6)-ның nА = 1 және тектікүй өзгерістері (nr0 = 0) болмайтын келесі дербесті түрлерін қарайық
(8.3.2-сурет: 1-тектесушілер, 2-тектесу өнімдері). |
10. Ыстықтығы Т0 =
тұрақты а-в тектесуде, тектесушілер беріліп, сол Т0 =
тұрақтыда өнімдері жүйеден алынып тұрғанда,
DН =DН0 болады.
20. Тұрақты ![]() -дегі с-d тектесуде тектесушілер беріліп, өнімдері сол Т1 =
тұрақтыда жүйеден алынып тұрғанда,
жүйенің қажыр Нd - Нс төмендеуін d-в-а-с
балама жолымен анықтауға болады:
-дегі с-d тектесуде тектесушілер беріліп, өнімдері сол Т1 =
тұрақтыда жүйеден алынып тұрғанда,
жүйенің қажыр Нd - Нс төмендеуін d-в-а-с
балама жолымен анықтауға болады:
DН =Нd - Нс = (Нd – Нв) + (Нв – На) + (На
- Нс)=![]() (8.3.7)
(8.3.7)
30. Ыстықтығы Т1
ден Т2-ге өзгермелі с-g тектесуде, тектесушілері
Т1-ге қыздырылып беріліп, өнімдері Т2-де
алынып тұрғанда,
жүйенің ![]() төмендеуін g–в–а-с
балама жолымен анықтауға болады
төмендеуін g–в–а-с
балама жолымен анықтауға болады
 (8.3.8)
(8.3.8)
Тектесудің 8.3.2-суреттегі жылуалмасусыз а - g
және с - е түрлерін маңыздығынан ерекше
келесі баппен қарайық.
8.4 Жылуалмасусыз
жануларының ыстықтықтары
Қоршаған ортамен жылуалмасусыз тектесу жүйедегі отынның ауа а - g не оттегімен с
- е жануларындағы (8.3.2-сурет) қажыр өзгерісі
нөл болады ![]() (8.4.1)
(8.4.1)
 (8.4.2)
(8.4.2)
Бұлардың ![]() тәуелділігін
(8.3.5)-тегідей ескеріп, (8.3.6) секілді аумаққыларынан жылуалмасусыз
Т2 мен Т21 жану ыстықтықтарын
анықтауға болады.
тәуелділігін
(8.3.5)-тегідей ескеріп, (8.3.6) секілді аумаққыларынан жылуалмасусыз
Т2 мен Т21 жану ыстықтықтарын
анықтауға болады.
Ауа оттегімен байытылғанда не тектесу алдында а - с
бойымен қыздырылғанда тектесушілер жүйеге ![]() жоғары
ыстықтығында енгізіліп НТ - сызбағындағы с - е
тектесуіндегідей жану өнімдері жоғары
жоғары
ыстықтығында енгізіліп НТ - сызбағындағы с - е
тектесуіндегідей жану өнімдері жоғары ![]() ыстықтығында жүйеден шығарылады.
ыстықтығында жүйеден шығарылады.
Іс жүзіндегі жану
ыстықтығы жылуалмасусыздық ыстықтығынан аздау
болады. Мысалы, метанның (СН4) жануға теориялық
қажетті (қатынастық) таза оттегіде жанғандағы
(автогенді балқытудағы) жылуалмасусыздық
ыстықтығы 4000К-ге жетеді. Ал, тектесулерде жануға
қажетсіз ауаның азоты болғанда бұл ыстықтық
2000К-ге төмендейді. Жылуалмасусыз ыстықтық стехиометриялық
жану жағдайында отынның толық жанбауынан да төмендейді.
Отынды толық жандыру үшін ауа қатынастық қажетті
мөлшерінен артығырақ беріледі. Артық ауаға жылу
кететіндіктен нақты жылу ыстықтығы бұл жолы да
жылуламасусыз ыстықтығынан төмен болады. Қоршаған
ортаға жылу кетсе, жану ыстықтығы тағы
төмендейді. Жану ыстықтығы су буы Н2О-ның Н2
мен О2 және СО2-нің СО мен О2-ге
ыдырауынан (60000С-де газдардың бәрі толық
ыдырайды) тағы төмендейді. Сонымен, жанулық тектесулерде жану
ыстықтығы аса жоғары
бола алмайды.
8.5
Жарылудың ыстықтығы
мен қысымы
Жарылу тез өтетін құбылыс болатындықтан
тұрақты көлемде және жылуалмасусыз деп жану тектесуінде
қаралады. Сондықтан, V=тұрақтыдағы жылулық
әсер жүйенің ішкі қайратының DU кемуімен
анықталады. Жарылу ыстықтығының анықталу
әдістемесі бұрынғыдай болады, тек теңдеуінде Н пен ср-лердің
орынында U мен сV болады.
|
|
Алдын ала (а – в құбылысында)
қыздырылған тектесуші газдардың тектесуін жалпы түрде
UТ- сызбағында қарайық (8.5.1-сурет: мұндағы 1-
тектесушілер мен 2- тектесу өнімдерінің U(Т) тәуелділіктері).
Бұл тектесу в - с- құбылысында өтеді. Оның
ішкі қайрат өзгерісін балама с – d – а - в жол
негізінде келесідей анықтаймыз
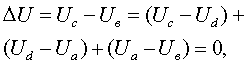 (8.5.1)
(8.5.1) 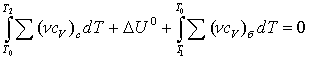 (8.5.2)
(8.5.2)
Мұндағы б мен с таңбалары жүйенің басты
және соңғы күйлерін көрсетеді.
Егер, бұрынғыдай, тектесушілер қоспасының басты
ыстықтығы Т1 мен жылусыйымдылығының СV(Т)
ыстықтыққа тәуелділігі және DU0 -
қалыпты жылулық
әсері белгілі болса, (8.5.2)
арқылы жарылу Т2 - ең үлкен ыстықтығы анықталады.
Бұл ыстықтықтың
мәнін біле және тектесу қоспасын - мүлтіксіз газ
деп, оның күй теңдеуі
![]() (8.5.3)
(8.5.3)
арқылы
![]() тұрақты (8.5.4)
тұрақты (8.5.4)
екенін ескере, оны
тектесудің басты
және соңғы күйлеріне
келесідей жазып
 (8.5.5)
(8.5.5)
жарылу
қысымын келесідей анықтаймыз
![]() . (8.5.6)
. (8.5.6)
Тектесушілердің ![]() моль сандары
қатынастық
моль сандары
қатынастық ![]() еселеуіштеріне сәйкес деп, (8.5.6)-ны келесідей
жазамыз
еселеуіштеріне сәйкес деп, (8.5.6)-ны келесідей
жазамыз
 . (8.5.7)
. (8.5.7)
Жарылудың
бұл үлкен қысымы, жану құбылысы тез өтіп,
тектесу жүйесі
жылуқозғалымдық теңеле қалды деп
жуықты анықталғанымен, тәжірибелік нақты
жағдайға сәйкесті.
Жарылу Т2 ыстықтығының (8.5.2) теңдеуі,
жану ыстықтығының (8.3.6)
теңдеуіндей
күрделі болатындықтан, алдын ала Т2-нің
жуықты мәнін алып, бұл
теңдеулер орындалғанша Т2-ні жуықтау
арқылы (әдетте 1-2-3 сатылы) есептеледі.
Егер U(Т) және Н(Т) тәуелділіктерінің кестелері болса,
бұлардың өзгерістері, яғни жылулық әсерлер,
қалыпты мәндерісіз және ![]() тәуелділіктерісіз сол кестелері арқылы Т1
мен Т2-лерге сәйкесті оңай анықталады.
тәуелділіктерісіз сол кестелері арқылы Т1
мен Т2-лерге сәйкесті оңай анықталады.
8.6 Тектесулік қабілеттік пен белсендіру қайраттың квантты
теориямен анықталуы
Затшалардың химиялық
қабілеттілігі зат өзгерістерінің әртүрлілігі мен
саны арқылы сапалы бағаланады. Ал, оның санды мөлшері
ретінде не химиялық тектік, яғни тектесудің Гиббс
қайратының өзгерісі (жылу- қозғалымды
тұрғыдан), не тектесу жылдамдығының
тұрақтысы (кинетикалық тұрғыдан) алынады.
Тектесудің толық
жылдамдық теориясында тектесушілердің құрылымы Аррениус
заңының экспонентасының алдындағы
тұрақтыға әсер етеді. Осы экспонентадағы Еа-белсендіру
қайраты бұл кинетикалық теорияда есептелмейді. Оның
мәні тәжірибелік не, осы баптың аяғында
көрсетілетіндегідей, химиялық квантты теориямен анықталады.
Тектесулік қабілеттік
заттың электрондарының күйлерімен анықталады.
Химиялық әртүрлі өзгерістерде электрондардың
күйлері (толық спиндері (кванттық айналдырғылары (толқындық
(волновые) моменттері)), айналғы жол айналдырғылары (орбитальные
моменты) және ыдыраулық пен пайда болулық байланыстардың айналғы жол
беттеспелігі (симметриялығы) өзгермеуге тырысады.
Бұлардың өзгеруі тектесуге беттеспелік болмауына (“тыйым
салуға” (“запретке”)) тең. Мұндай жағдайда да тектесу өтеді, бірақ өте
баяу не тектесуге өте жоғары
белсендіру қайрат қажет болады.
Тектесулік қабілеттілікті
таңдаудың бірнеше ережелері (правиласы) бар. Бұлардың
біреуінің орындалмауы - тектесуге
тыйым салғанмен бірдей.
Тектесуге тыйым спин
(Вичнер-Витмердің бірінші ережесі) бойынша салынады: егер
өнімдердің бір де бір спиндік күйі тектесушілердің бір
де бір спиндік күйіне тең болмаса ![]() , деп.
, деп.
Тектесуге тыйым орбиталық
момент (Вичнер-Втимердің екінші ережесі) бойынша
салынады: егер өнімдердің бір де бір орбиталық
күйі тектесушілердің бір де бір орбиталық күйіне
тең болмаса ![]() , деп. Бұл ереже белді (осевая,
аксиальная) беттеспелі тектесулерге пайдаланады. Мұндай
тектесудің тектесушілерінің затшалық (молекулалық)
атомдары ылғи бір сызықта тұрып, бір сызықты
молекуларлы өнім береді.
, деп. Бұл ереже белді (осевая,
аксиальная) беттеспелі тектесулерге пайдаланады. Мұндай
тектесудің тектесушілерінің затшалық (молекулалық)
атомдары ылғи бір сызықта тұрып, бір сызықты
молекуларлы өнім береді.
Вигнер-Витмер ережелерімен
сипатталмайтын жоғары мүмкіндіктік
тосқауылды (барьерлі) этиленнің циклобутанға
өзгеруі (димериация) ![]() секілді тектесулер
болады. Бұл үлкен белсендіру қайратты болатын Вигнер-Витмер
ережелерімен сезілмейтін мысалда өзгерістер тура сызықты болмайтын
жүйеде өтеді. Мұндай тосқауылдың тектесудегі
айқын затшалық айналғы жолдарының (определенных
молекулярных орбиталей) беттеспелігі сақталмағанынан болғанын
Вудворд пен Хоффман көрсеткен. Егер тектесушілер мен
өнімдерінің бұл жолдары беттеспелі болса, тектесулер
Вудворд-Хоффман ережесі бойынша ұлықсатты (тосқауылсыз)
болады. Егер бұл жолдардың біреуі бос айналғы жолдармен байланысты
болса, тектесуге тыйым салынады. Тектесу
жоғары тосқауылды не
басқадай тетікті өтуі
ғана мүмкін [2].
секілді тектесулер
болады. Бұл үлкен белсендіру қайратты болатын Вигнер-Витмер
ережелерімен сезілмейтін мысалда өзгерістер тура сызықты болмайтын
жүйеде өтеді. Мұндай тосқауылдың тектесудегі
айқын затшалық айналғы жолдарының (определенных
молекулярных орбиталей) беттеспелігі сақталмағанынан болғанын
Вудворд пен Хоффман көрсеткен. Егер тектесушілер мен
өнімдерінің бұл жолдары беттеспелі болса, тектесулер
Вудворд-Хоффман ережесі бойынша ұлықсатты (тосқауылсыз)
болады. Егер бұл жолдардың біреуі бос айналғы жолдармен байланысты
болса, тектесуге тыйым салынады. Тектесу
жоғары тосқауылды не
басқадай тетікті өтуі
ғана мүмкін [2].
Белсендіру қайратты анықтау үшін қайрат Е мен тектесу мекендігі L - көрнекті
сызбағынның (коррекционная диаграмма) қайраттық
деңгейлерінің қиылысу сүлбесінде тектесушілері Еб мен
өнімдерінің Ес белгілі қайраттарын
көрсетейік (8.6.1-сурет). Ұшбұрыш DАРR мен DАВС-ның
сәйкестігінен белсендіру Еа қайратты (Н1-Н2=DН деп) келесідей
анықтаймыз
|
|
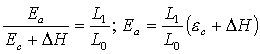 .(8.6.1)
.(8.6.1)
Екінші белгісіз L1/L0 шаманы табу үшін DNPM мен DNDK-лардың
сәйкестігін пайдаланамыз
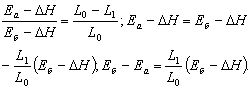 (8.6.2)
(8.6.2)
Енді (8.6.1) мен (8.6.2)-ні қоссақ, тектесу күйінің
мекендігі табылады
![]() (8.6.3)
(8.6.3)
Егер (8.6.3)-ті (8.6.1)-де ескерсек, тектесудің Аррениус
заңындағы белсендіру Еа қайраты химиялық
квантты теориямен келесідей анықталады
 (8.6.4)
(8.6.4)
Мысал ретінде ![]() затшаның жылулық ыдырауындағы белсендіру
қайратын (8.6.4)–пен анықтайық. Бұл тектесудің
ыдырау қайраты
затшаның жылулық ыдырауындағы белсендіру
қайратын (8.6.4)–пен анықтайық. Бұл тектесудің
ыдырау қайраты ![]() мен
өнімдерінің қайраты
мен
өнімдерінің қайраты ![]() және
жылулық әсері
және
жылулық әсері ![]() белгілі.
Сондағы, (8.6.4)–пен анықталатын белсендіру қайратының
мәні:
белгілі.
Сондағы, (8.6.4)–пен анықталатын белсендіру қайратының
мәні: ![]() тәжірибелік
мәнімен жақсы келіседі ([1], с.373).
тәжірибелік
мәнімен жақсы келіседі ([1], с.373).
Тектесулік қабілеттіліктің
осы кезеңгі ЕL- көрнекті сызбақты квантты-химиялық
талдауы органикалық қосылуларда, әртүрлі газды мен
шықты тектікүйлі тектесулерде және жеделдеткішті (катализаторлы) құбылыстардың
сатыларында кеңінен пайдалануда.
Жылутәсілдемелік маңызды
электр-химиялық және қоспалардың
жылуқозғалымын қарауға химиялық мүмкіндік
(химический потенциал) пен ұшпалық (фугитивность, летучесть)
және белсендік (активность)
ұғым- дармен танысуымыз
керек.
8.7 Тек Гиббс мүмкіндігі -
меншікті жылуқозғалымдық мүмкіндік
Заттардың маңыздары
өзгеретін жылуқозғалымдық жүйелер (химиялық
тектесу, булану, шықтану, электролиз қоспалар ж.т.б.)
қаралғанда химиялық
мүмкіндік (потенциал) jі ұғымы енгізіледі. Бұл өзгермелі ![]() маңызға
тәуелді ұғым сипаттаушы ішкі қайрат U(S,V,
маңызға
тәуелді ұғым сипаттаушы ішкі қайрат U(S,V,![]() ), қажыр Н(S,p,
), қажыр Н(S,p,![]() ) = U+pV+åjі, еркін қайрат (Гельмгольц мүмкіндігі)
) = U+pV+åjі, еркін қайрат (Гельмгольц мүмкіндігі) ![]() , еркін қажыр (Гиббс мүмкіндігі)
, еркін қажыр (Гиббс мүмкіндігі) ![]() бернелермен
байланысты.
бернелермен
байланысты.
Сипаттаушы бернелердің дербесті
туындылары жылулық (термические) күй көрсеткіштерін
анықтайтынын, жылуқозғалымның I заңының
![]() (8.7.1)
(8.7.1)
теңестіктерін
пайдаланатын Лежандр өзгертулері (преобразования) арқылы
табылғандармен салыстыра, келесідей көрсетуге болады
 (8.7.2)
(8.7.2)
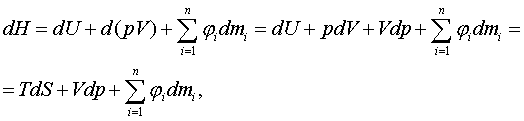 (8.7.3)
(8.7.3)
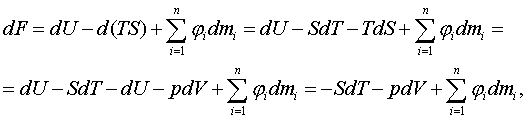 (8.7.4)
(8.7.4)
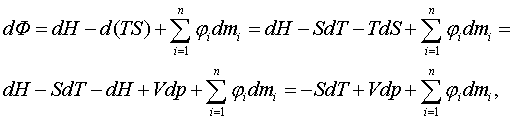 (8.7.5)
(8.7.5)
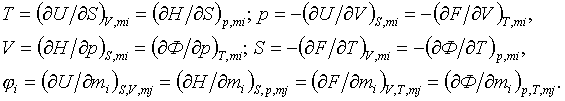 (8.7.6)
(8.7.6)
Сонымен, көрсеткіштері ((8.7.6)-дағыдай) тұрақты
жылуқозғалымдық теңдескен жүйенің сипаттаушы (U,H,F,Ф) бернелерінің маңыздық өзгеріс
қарқынын химиялық мүмкіндік дейміз.
Бірақ та, химиялық мүмкіндіктердің тек қана
Гиббс мүмкіндігі - меншікті жылуқозғалымдық
мүмкіндік екенін (![]() ) келесідей көрсетуге болады (басқалары
бұлай шықпайды:
) келесідей көрсетуге болады (басқалары
бұлай шықпайды: ![]()
![]() ):
):
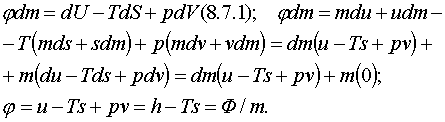 (8.7.7)
(8.7.7)
Теңдесу шарттары:
![]()
болатындықтан,
(8.7.6) бойынша, мысалы, Гиббс мүмкіндігінің өзгерісін
теңдесу құбылыстары мен теңдескен жүйелерге
келесідей жаза аламыз
 (8.7.8)
(8.7.8)
8.8 Мүлтіксіз және нақты газдардың химиялық
мүмкіндіктері.
Ұшпалық пен белсенділік
Газдардың теңдесулік
қасиеттерін (равновесные свойства) химиялық мүмкіндікпен
сипаттауға болады.
Күрделі жүйенің
жылуқозғалымдық негізгі (8.7.5) теңдеуін
келесідей алып
![]() (8.8.1)
(8.8.1)
оның
(8.7.6)-дағы jі мен V-ның мәндерін келесі күй
берненің шаққылау ретіне тәуелсіздігінде
 (8.8.2)
(8.8.2)
ескере,
(8.8.2)-ден келесіні табамыз
![]() (8.8.3)
(8.8.3)
Мұндағы ![]() - таза і
затының меншікті көлемі м3/кмоль. Сондықтан
(8.8.3)-ті келесідей жаза аламыз
(бұл (8.7.6)-ғыға да
сәйкес)
- таза і
затының меншікті көлемі м3/кмоль. Сондықтан
(8.8.3)-ті келесідей жаза аламыз
(бұл (8.7.6)-ғыға да
сәйкес)
![]() (8.8.4)
(8.8.4)
Мүлтіксіз газдың (n = 1) мольінің күй (![]() ) теңдеуін ескере, (8.8.4)-ті келесідей жазамыз
) теңдеуін ескере, (8.8.4)-ті келесідей жазамыз
![]() (8.8.5)
(8.8.5)
Мұны Т = тұрақтыда
аумаққылап, химиялық мүмкіндікті табамыз
![]() (8.8.6)
(8.8.6)
Мұндағы
аумаққылаудың тұрақтысы ![]() газдың табиғаты мен ыстықтығына тәуелді. Оның (8.8.6)
газдың табиғаты мен ыстықтығына тәуелді. Оның (8.8.6) ![]() дегі р0 = 0,10325 МПа = 1 атм -лық
мәні қалыпты (стандартный)
химиялық мүмкіндік болады
дегі р0 = 0,10325 МПа = 1 атм -лық
мәні қалыпты (стандартный)
химиялық мүмкіндік болады
![]() (8.8.7)
(8.8.7)
Сонда, соңғылардың
айырымы[2]
![]() (8.8.8)
(8.8.8)
Қоспаның і құраушысына (8.8.6)-ны келесідей
жазамыз
![]() (8.8.9)
(8.8.9)
 (8.8.10)
(8.8.10)
Мұндағы - і
құраушының меншікті
қысымы;
![]() -оның көлемдік шоғыры, кмоль/м3.
-оның көлемдік шоғыры, кмоль/м3.
Жоғарыда көрсетілген
мүлтіксіз газдар мен мүлтіксіз қоспалардың
заңдылықтарын нақты газдар мен нақты
қоспаларға пайдалану үшін 1901 жылы Льюис ұшпалық
(летучесть, фугитивность) пен белсенділік (активность)
ұғымдарын ұсынған. Ұшпалық деп
(8.8.5)-тегі қысымның орынына тұрақты
ыстықтықты нақты жүйеге сәйкесті енгізілген f
бернені атайды.
Ұшпалықты анықтау
үшін (8.8.5)-те (8.8.4)-ті ескеріп, табылғанды (8.8.8) секілді аумаққылап
![]() (8.8.11)
(8.8.11)
нақты
газдың меншікті көлемін жылуқозғалымның
күй, мысалы көп мүшелі, кейіптемесімен, ескереміз.
Егер нақты газ бен нақты
қоспалардың ұшпалықтары белгілі болса, олардың
көптеген қасиеттері анықталады. Бірақ,
ұшпалықтың толық мәнін анықтау ылғи
мүмкін бола бермейді. Мұндай жағдайларда
ұшпалықтың екі күйдегі мәндерінің
қатынасы қарастырылады. Берілген күйдегі
ұшпалықтың қалыпты күйдегі
ұшпалыққа қатынасын белсенділік дейді
![]() (8.8.12)
(8.8.12)
Химиялық мүмкіндіктері айырымы (8.8.11) белсенділік арқылы келесідей жазылады
![]() (8.8.13)
(8.8.13)
Тектесу құраушысының белсенділгінің оның
мольдік үлесіне (не құраушының қоспадағы
шоғырлығын көрсететін басқадай шамаға)
қатынасын белсенділіктің еселеуіші дейді
![]() (8.8.14)
(8.8.14)
8.9 Отындық түзгілер (Электр
химияға кіріспе)
Химиялық тотығу тектесуіндегі қайрат өзгерісін
қарайық. Мысал ретінде
қатты көміртегінің
тектесуін алайық
![]() (8.9.1)
(8.9.1)
Оның ![]() мен
мен ![]() тұрақтылардағы қалыпты жылулық
әсері мен ең үлкен (қайтымды тектесудегі) жұмысы
[2]-нің П3 кестесінен
тұрақтылардағы қалыпты жылулық
әсері мен ең үлкен (қайтымды тектесудегі) жұмысы
[2]-нің П3 кестесінен ![]() және
және ![]() .
.
Егер бұлар жанулық жылу
қайраты болса, оның тек 40 пайызындайы ғана жылулық
қозғалтқышта механикалық сыртқы
жұмысқа айналып, қалған 60 пайызы пайдасыз
(жылулық ластану ретінде) ортаға тасталады. Егер аталған
химиялық қайрат (жылу түріне өзгертілмей)
гальваникалық түзгіде (элементте) электр ағынына тікелей
өзгертілсе, құбылысы шексіз қайтымды бола
алатындықтан ПЖЕ-і қағидалы 100 пайызға
жететіндіктен жылулық
түрінен 2 еседен аса тиімді болады.
Қатты көміртегі не
басқадай тотығуы мүмкін заттың тотығу тектесуі
өтетін гальваникалық түзгі - отындық түзгі
(топливный элемент) деп аталады [12]. Мысалы, Даниэль-Якобидің
электр – химиялық (гальваникалық) түзгісі қатар алынған цинк пен мыс
сульфаттарының қоспаларына салынған цинк пен мыс электртегілерден
құралған (8.9.1-сурет)
|
|
[1]. Оның оң (+) үйегінде
екі электрон қосылып, мыс қалпына келтіріліп (воосстановление меди)
отырылады, ал теріс (–) үйегінде екі электрон алынып, цинк
қышқылданады. Сыртқы сыммен электрондар цинк электртегінен
мыс электртегіне ағып, электр ағынын құрады.
Фарадейдің электролиздік 2-
заңы бойынша, электртекте z кмоль - балама (эквивалент) зат шықса
не таралса, сыртқы сыммен zFE электр қайраты өтеді. Бұл
жылуқоз- ғалымның II заңы бойынша қайтымды электр
- химиялық p,T = тұрақты құбылыстың Гиббс
қайра-
тының
кемуіне, яғни ең үлкен пайдалы жұмысына тең
![]() (8.9.2)
(8.9.2)
Мұндағы: Ғ - Фарадей
саны - электртегіндегі заттың 1 моль – балама өзгерісіне тең
электр қайраты; Е – электр қозғалтқыш күш
(ЭҚК – ЭДС – электродвижущаяся сила)
![]() (8.9.3)
(8.9.3)
-
жылуқозғалымдық қайтымды электр – химиялық
түзгінің үйектеріндегі мүмкіндік (потенциал) айырымы.
Мысалы, Вестон қалыпты (нормальный) түзгісінің ЭҚК-сы
ондаған жылдары өзгермейді [1]
![]() (8.9.4)
(8.9.4)
|
|
Қазіргі кезеңде отындық түзгілердің дамуында
айтарлықтай жетістіктер бар. Мысалы, АҚШ үкіметі мен
өндірісінің және ғылыми – зерттеу
институттарының: ²Нөл тастаулы көмірді пайдалану қоғамы² (Zero Emission Coal Alliance (ZECA) – Союз для использования угля с
нулевыми выбросами ) Лос Аламостегі Ұлттық зерттеуханамен
келісе көмірден электр қайратты не/және сутегін
аса жоғары ПЖЕ ![]() мен шығару
тәсілдемесін тапқан (8.9.2-сурет) [17].
мен шығару
тәсілдемесін тапқан (8.9.2-сурет) [17].
Аса ыстықты қатты
қышқылды отындық түзгіде (в высо -котемпературных
твердо-оксидных топливных элементах)
сутегі мен электр қайраты
өндіріледі. Көмір мен бу (газөндіргіште) әрекеттескенде
сутегі пайда болады. Мұнда СО2 көмір
жағылғаннан екі еседей аз пайда болады. Әрі қарай ол
әкпен (известь) сіңіріледі. Әкті қайта пайдалану
үшін қатты қышқылды отындық түзгінің
қалдық жылуы арқылы кальций карбонаты қайта
карбондалады. Онымен бірге СО2-нің шоғырлы ағыны
өндіріліп сіңірілуіне дайындалады. Көмірдің зиянды
газдары сыртқа тасталмай, СО, NOх пен SO2-лері мен
ауыр металдары және т.б. қатты бөлшектері сұйық
не қатты табиғи денелер ретінде алынғанша,
қондырғының ішінде айнала беріледі [17].
Магний силикаттарын өндіруін
ескере, СО2-нің шығарылу құнын 15...20
доллар/т деп, қондырғының ПЖЕ-і 70 пайыз
болғандағы электр қайратының құны 1 цент/кВт×сағаттай бағалануда [17].
Жеделдеткішті қыздырғыш
түзгілердің қуаты 100 кВт-қа дейінгілерінің
тәсілдемелік сүлбелері мен есептік әдістемесі [18]-де
қаралған.
8-
жаттығу.
Жану мен жарылудың ыстықтықтары
8.1-есеп (П.1[2], с.378 - 379). Алдынала ![]() қыздырылған ауа мен метанның (ауаның
артықтық еселеуіші 1,2-гі) тектесуіндегі ең үлкен
(жылуалмасусыздық) ыстықтығын анықтаңыздар.
қыздырылған ауа мен метанның (ауаның
артықтық еселеуіші 1,2-гі) тектесуіндегі ең үлкен
(жылуалмасусыздық) ыстықтығын анықтаңыздар.
Шешімі. Тектесу теңдеуі
![]() (8.9.5)
(8.9.5)
Жылулық әсердің теңдеуі
 (8.9.6)
(8.9.6)
Мұндағы![]() -дегі
-дегі ![]() кестеден және n - тектесулік қатынастар, a, b, g-лар тектесу
(8.9.5) теңдеуіне және ауа мен метанның
кестеден және n - тектесулік қатынастар, a, b, g-лар тектесу
(8.9.5) теңдеуіне және ауа мен метанның ![]() жылусыйымдылықтарына сәйкесті анықталады.
Сондағы:
жылусыйымдылықтарына сәйкесті анықталады.
Сондағы:
а) басты ![]()
![]()
б)
соңғы ![]() (8.9.7)
(8.9.7)
Бірақ, (Ж8.1.2)-гі Т2-нің мәнін ең
алдымен жобалап беріп, біртіндеп жуықтау әдісімен
шығарған қолайлы: ![]() болса,-
болса,-![]()
![]() болса,
болса, ![]()
![]() де (Ж8.1.2) жуықты орындалатындықтан жауабы
болады.
де (Ж8.1.2) жуықты орындалатындықтан жауабы
болады.
8.2-есеп (П2[2], с.379-381). Газды сутегі мен
теориялық қажетті ауаның қоспасы ыстықтық Тб
= 298 К мен қысым рб = 0,1 МПа-де тұйық ыдыста
жылуалмасусыз (адиабатты) жарылған. Жарылғаннан кейінгі
ыстықтық пен қысымды анықтаңыздар
(төмендегі таңбалар: б - бастапқы, с
- соңғы, г - газ).
Шешімі. Жылуалмасусыз жарылудағы
ыстықтықты келесі теңдеумен анықтауға болады
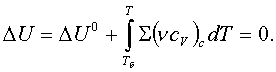 (8.9.8)
(8.9.8)
Сутегінің тектесуі азоты бар ауада өтетіндіктен,
тектесудің теңдеуі келесідей жазылады
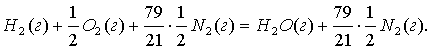 (8.9.9)
(8.9.9)
Бұл тектесудің р = тұрақтыдағы жылулық әсерін
кестеден DН0 = 242000 кДж деп табамыз. Тектесудің
V = тұрақтыдағы жылулық әсерін
![]() (8.9.10)
(8.9.10)
теңдеуі
арқылы табамыз.
Мұндағы ![]() ;
; ![]() :
:
![]()
Есептің оңай болуына азот
пен су буының жылусыйымдылықтарының ыстықтық ![]() аралығындағы
аралығындағы ![]() пен
пен ![]() орта мәндерін
қысымға тәуелсіз деп аламыз. Сонда (8.9.8)-ді келесідей алып
орта мәндерін
қысымға тәуелсіз деп аламыз. Сонда (8.9.8)-ді келесідей алып
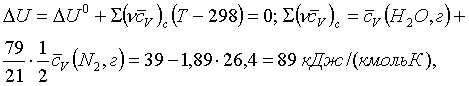
ыстықтықты
анықтаймыз 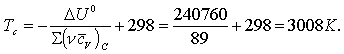
Мұндағы V = тұрақтыдағы жарылу ыстықтығы р = тұрақтыдағы 2245 К-гі (8.9.6) жану
ыстықтығынан әлде-қайда жоғары.
Жарылу қысымын V = тұрақтыдағы мүлтіксіз газдың күй
теңдеуі арқылы анықтаймыз

9 Ерітінділерге
кіріспе
Әртүрлі заттардың
әртүрлі ыстықтық пен қысымды және
құрамды араласқан затшалы-бөлшекті қоспаларын ерітінділер
(растворы) дейміз. Мысалы, су мен этил
спиртін қосса, жалпы көлемі
екеуінің көлемінен сәл аздау арақ шығады; күкірт
қышқылын суға біртелеп құйса, 5![]() 6 сағаттан кейін электролит пайда болады;
құм мен цементті және саз балшықты, су құя,
жақсы араластырса, 2
6 сағаттан кейін электролит пайда болады;
құм мен цементті және саз балшықты, су құя,
жақсы араластырса, 2![]() 3 күннен кейін, көлемі тек құм
құрамының көлеміндей-ақ, тастай қатты
бетон (мысалы (бөлшекті): 1
цемент + 2,5 құм + 4 щебенка + 1 су (7,5 шелек ерітіндіге 7л су) =
бетон) болады; смолаға сәл бекіткіш қосса,
әртүрлі желім мен (көпірді ұстай алатын) салқын
балқытпалар (“холодная сварка”) пайда болады. Осы секілді
әртүрлі ерітінділердің жылутетіктік және химиялық
қасиеттері әртүрлі болады. Бұларды физкалы
химиялық бейнелеу оңай емес. Ерітінділердің ерітуші
құраушысы басқаларынан басым жағдайлары,
мүлтіксіз және нақты газдардың химиялық
мүмкіндік ұғымына сүйене, теориялық бейнеленеді.
3 күннен кейін, көлемі тек құм
құрамының көлеміндей-ақ, тастай қатты
бетон (мысалы (бөлшекті): 1
цемент + 2,5 құм + 4 щебенка + 1 су (7,5 шелек ерітіндіге 7л су) =
бетон) болады; смолаға сәл бекіткіш қосса,
әртүрлі желім мен (көпірді ұстай алатын) салқын
балқытпалар (“холодная сварка”) пайда болады. Осы секілді
әртүрлі ерітінділердің жылутетіктік және химиялық
қасиеттері әртүрлі болады. Бұларды физкалы
химиялық бейнелеу оңай емес. Ерітінділердің ерітуші
құраушысы басқаларынан басым жағдайлары,
мүлтіксіз және нақты газдардың химиялық
мүмкіндік ұғымына сүйене, теориялық бейнеленеді.
9.1 Ерітінді құраушысының химиялық мүмкіндігі
Егер ерітіндінің әрбір
құраушысының химиялық мүмкіндігі мүлтіксіз
газдың әрбір құраушысының химиялық мүмкіндігімен
(8.8.9-секілді)
![]() (9.1.1)
(9.1.1)
мольдік
үлесі ri арқылы анықталса ![]() ,
мүлтіксіз ерітінді
дейміз.
,
мүлтіксіз ерітінді
дейміз.
Таза і-құраушыға: ![]() - үлгіқалыпты мәні (оның басқа
(өте сиретілген) шегінде
- үлгіқалыпты мәні (оның басқа
(өте сиретілген) шегінде ![]() ).
).
Мүлтіксіз газдардың
химиялық мүмкіндіктерінің ыстықтық пен
қысымға және
құраушының
үлесіне тәуелділігі (8.8.9) бойынша
![]() . (9.1.2)
. (9.1.2)
Ал, мүлтіксіз ерітіндінің (9.1.1) химиялық
мүмкіндігін осы секілді
қарау үшін (8.8.4)-тегі мольдік меншікті көлемді
қысымы аса жоғары емес (р <10МПа, яғни р®0 де)
сұйық пен қатты денелерге келесідей алуымызға болады
[2]
![]() (9.1.3)
(9.1.3)
Мұндағы ![]() - тұрақты
ыстықтықты сығылу еселеуіші;
- тұрақты
ыстықтықты сығылу еселеуіші;
![]() мен р®0)-дегі ерітіндінің
і - құраушысының
меншікті мольдік көлемі.
мен р®0)-дегі ерітіндінің
і - құраушысының
меншікті мольдік көлемі.
Сонда (8.8.4)-ті таза затқа ![]() (9.1.3)-ті ескере, келесідей аумаққылап
(9.1.3)-ті ескере, келесідей аумаққылап
![]()
 (9.1.4)
(9.1.4)
(9.1.1)-де
ескерсек, мүлтіксіз сұйық не қатты ерітіндінің
і-құраушысының
химиялық мүмкіндігін
(9.1.2)-ге ұқсас
анықтаймыз
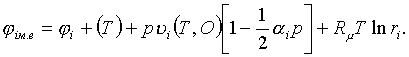 (9.1.5)
(9.1.5)
Сонымен, мүлтіксіз ерітінді мен мүлтіксіз газдардың
химиялық мүмкіндіктерінің ((9.1.5) пен
(9.1.2)-лердің)
айырмашылығы – олардың
тек қысымға
тәуелділік түрлерінде.
Нақты ерітінділердің химиялық мүмкіндіктері
(9.1.1), (9.1.5)-тегілердей
құраушылардың көлемдік үлестеріне емес,
(8.8.13)-тегідей, і-құраушының ![]() белсенділігінің
логарифміне сәйкес болады
белсенділігінің
логарифміне сәйкес болады
![]() (9.1.6)
(9.1.6)
не белсенділік
еселеуіші ![]() (4.8.14)
арқылы
(4.8.14)
арқылы
![]() (9.1.7)
(9.1.7)
9.2
Араластырудың жылуқозғалымдық бернелері
Ерітілгенде құраушыларының жылуқозғалымдық
қасиеттері өзгереді. Мысалы, мүлтіксіз газ
қоспасының химиялық ![]() мүмкіндігі оның таза күйіндегі
мүмкіндігі оның таза күйіндегі ![]() мәніне ((9.1.1) бойынша) қосылып өзгеше болады.
Осы секілді әрбір қарқынды жылуқозғалымдық
шама ерітіндіде екі
қосындыдан
құралады.
Оның тек р мен Т-ға
тәуелдісі – қалыпты берне, ал р мен Т және
құрамы
мәніне ((9.1.1) бойынша) қосылып өзгеше болады.
Осы секілді әрбір қарқынды жылуқозғалымдық
шама ерітіндіде екі
қосындыдан
құралады.
Оның тек р мен Т-ға
тәуелдісі – қалыпты берне, ал р мен Т және
құрамы ![]() -ге тәуелдісі – араластыру
бернесі болады. Араластыру берненің маңыздылары: химиялық мүмкіндік, қажыр
(жылулық), көлем және энтропия болады. Бұлар еркін
қажыр арқылы анықталады. Нақты ерітіндінің
химиялық мүмкіндігі (9.1.7)-мен жалпы түрде анықталады.
Мұның
-ге тәуелдісі – араластыру
бернесі болады. Араластыру берненің маңыздылары: химиялық мүмкіндік, қажыр
(жылулық), көлем және энтропия болады. Бұлар еркін
қажыр арқылы анықталады. Нақты ерітіндінің
химиялық мүмкіндігі (9.1.7)-мен жалпы түрде анықталады.
Мұның ![]() қосындысы берілген ерітіндінің
і-құраушысының
араластырулық
химиялық мүмкіндігі
болады. Бұл мүлтіксіз ерітіндікіндей
қосындысы берілген ерітіндінің
і-құраушысының
араластырулық
химиялық мүмкіндігі
болады. Бұл мүлтіксіз ерітіндікіндей ![]() болады.
болады.
Дербесті
 (9.2.1)
(9.2.1)
туындыны Гиббс-Гельмгольц (3.4.11) теңдеуі
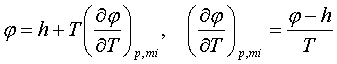 (9.2.2)
(9.2.2)
арқылы өзгертіп, химиялық мүмкіндіктің ыстықтыққа тәуелдігін келесідей табамыз
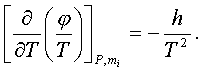 (9.2.3)
(9.2.3)
Бұған
сәйкесті і- құраушыға
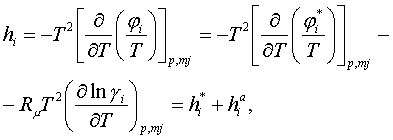 (9.2.4)
(9.2.4)
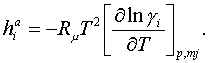 (9.2.5)
(9.2.5)
Араластыру р = тұрақтыда қаралып отырылғаннан,
жылуқозғалымның бірінші заңы ![]() бойынша араластырудың әрбір і-
құраушысының меншікті мольдік қажыры ерітуге кететін
жылулығы болады; k құраушылардан
құралған 1 кмоль ерітіндінің араластырулық
толық жылулығы
бойынша араластырудың әрбір і-
құраушысының меншікті мольдік қажыры ерітуге кететін
жылулығы болады; k құраушылардан
құралған 1 кмоль ерітіндінің араластырулық
толық жылулығы
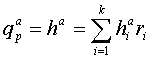 . (9.2.6)
. (9.2.6)
Араластырудың меншікті мольдік ![]() көлемі (8.8.4) бойынша, (9.1.7) ескеріле, анықталады
көлемі (8.8.4) бойынша, (9.1.7) ескеріле, анықталады
 (9.2.7)
(9.2.7)
![]() (9.2.8)
(9.2.8)
Мұндағы ![]() - таза заттың және
араластырудың меншікті мольдік көлемдері.
- таза заттың және
араластырудың меншікті мольдік көлемдері.
Бұларды
біле, ерітіндінің мольдік көлемін анықтауға болады
![]() (9.2.9)
(9.2.9)
Араластыру энтропиясын (9.1.7)-ні (8.7.6) –да ескеріп табамыз
![]() (9.2.10)
(9.2.10)
![]() (9.2.11)
(9.2.11)
Ерітіндінің 1 кмольдік меншікті энтропиясын (9.2.10)-ды барлық k
құраушыларына
қосып анықтаймыз
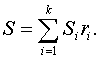 (9.2.12)
(9.2.12)
Мүлтіксіз ерітінділердің (gi = 1 -де (9.2.5) пен (9.3.7) бойынша араластырулық ![]() мен
мен ![]() болып) пайда
болуында жылулық әсері мен
көлем өзгеруі болмайды. Мүлтіксіз ерітінділерінің
өзінде де араластырулық
қайтымсыз болатындықтан
болып) пайда
болуында жылулық әсері мен
көлем өзгеруі болмайды. Мүлтіксіз ерітінділерінің
өзінде де араластырулық
қайтымсыз болатындықтан ![]() болғанымен
болғанымен
![]() (9.2.13)
(9.2.13)
болып өсіп
отырады.
9- жаттығу. Газ бен булардың
жұмысқа қабілеттілігі
Жұмыс дене ағынының
қоршаған ортамен қайтымды теңескенше жасайтын ең
үлкен тәсілдік (техникалық, пайдалы) жұмысын (жұмысқа)
қабілеттілігі не эксергия дейміз. Меншікті
эксергия
![]() (9.2.14)
(9.2.14)
Мұндағы h-қажыр (энтальпия); s-энтропия; Т0(s-s0)-дененің
(ыстықтығы Т0, энтропиясы s0)
қоршаған ортаға берген жылулығы (анергия); h-h0-дененің
қажыр өзгерісі (Т0=298 К мен р0=0,1013 МПа -
қалыпты жағдайдың ISO көрсеткіштері).
Қайтымсыз
құбылыстың тәсілдік (т) жұмысы эксергиясынан
ысырабына (ы) кем болады
![]() (9.2.15)
(9.2.15)
Бұл ысырап жүйенің
энтропиясының ұлғаюымен ![]() не жұмыс
дененің эксергиясының кемуімен (басқа дененің
эксергиясының ұлғаюымен), не табылған жұмыспен
салыстыра
не жұмыс
дененің эксергиясының кемуімен (басқа дененің
эксергиясының ұлғаюымен), не табылған жұмыспен
салыстыра ![]() анықталады.
Эксергиялық ПЖЕ (пайдалы жұмыс еселеуіші) ысыраптың
үлесіне кем болады
анықталады.
Эксергиялық ПЖЕ (пайдалы жұмыс еселеуіші) ысыраптың
үлесіне кем болады
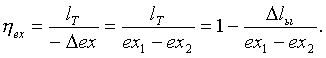 (9.2.16)
(9.2.16)
9.1-есеп (VII-27[4]). Қоршаған
ортаның қысымы р0 = 1бар мен ыстықтығы Т0
= 293 К болсын. Сонда қысымы р = 10 бар және ыстықтығы
Т = 600 К 1кг СО2-нің эксергиясы қанша болады? Шешімі:
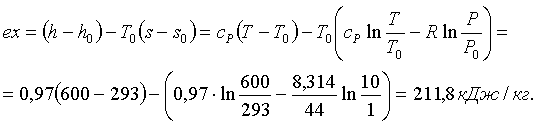 (9.2.17)
(9.2.17)
9.2-есеп (VII-30[4]).
Қоршаған ортаның ыстықтығы Т0=300 К.
Ауаны р1=100 бар қысымнан р2=50 барға дейін
кедергілегендегі (дросселирование) эксергия шығыны қанша
болады?
Шешімі: ![]()
Кедергілеудің теңдеуі h2
= h1 болатындықтан

9.3-есеп (VII-32[4]).
Қоршаған ортаның ыстықтығы Т0=283К.
Қысымы р1=7 бар және ыстықтығы Т1=770К
1кг азоттың көрсеткіштері р2=2 бар мен Т2=320К
күйге өзгергендегі эксергиясының азаюы қанша
болады? Шешімі:
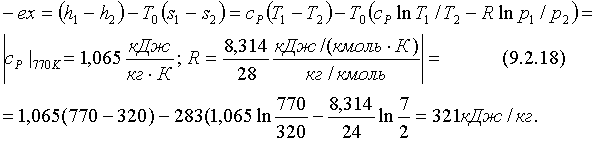 9.4-есеп
(VII-33[4]). Қоршаған ортаның ыстықтығы Т0=293
К. Бірдей қысым р мен Т ыстықтықтағы 4 кг сутегі (Н2)
мен 1кг көмірқышқыл СО2 газдың
араласқандағы энтропияның өсуі мен
эксергияның төмендеуін анықтаңыздар.
9.4-есеп
(VII-33[4]). Қоршаған ортаның ыстықтығы Т0=293
К. Бірдей қысым р мен Т ыстықтықтағы 4 кг сутегі (Н2)
мен 1кг көмірқышқыл СО2 газдың
араласқандағы энтропияның өсуі мен
эксергияның төмендеуін анықтаңыздар.
Шешімі. Газдардың
араласу алдындағы энтропияларының қосындысы
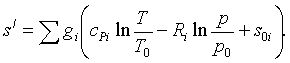 (9.2.19)
(9.2.19)
Газдардың қоспасының
(смесь) энтропиясы
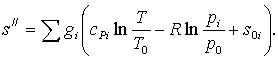 (9.2.20)
(9.2.20)
Бұлардағы Т0, р0 - энтропияның
өзгерісінің басты мекендігіне алынған қоршаған
ортаның көрсеткіштері;
Т, р -
қоспаның ыстықтығы мен қысымы;
рі
-газдардың қоспадағы меншікті қысымдары;
gi -
маңыздық үлестері.
Қайтымсыз араласудағы
энтропияның өсуі
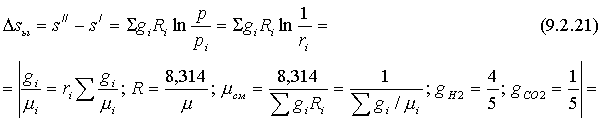
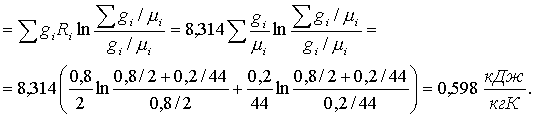
Эксергияның азаюы
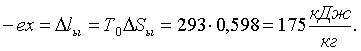
9.5-есеп (VII-35[4]).
Жаңғыртулы ауажылытқышта газшығырынан
шыққан түтіннің ыстықтығының ![]() нен
нен ![]() ге төмендеуі арқылы ауаның
ыстықтығы
ге төмендеуі арқылы ауаның
ыстықтығы ![]() нен
нен ![]() ге дейін көтеріледі. Қоршаған ортаның
ыстықтығы
ге дейін көтеріледі. Қоршаған ортаның
ыстықтығы ![]() және
түтіннің маңыздық шығысы (Gг = Gа,
кг/с) мен физикалық қасиеттері (срг = сра = 1,005 кДж/(кг×К) ауанікіндей және қарсы ағынды
ауажылытқыштың жылулық ысыраптарын кемнен кем (hж @ 1) деп, келесілерді анықтаңыздар: а)
түтіннің эксергиясының азаюын; б) ауаның
эксергиясының өсуін; в) жүйенің
жұмыстық қабілеттілігінің (работоспособность)
ысырабы мен ауажылытқышының эксергиялық ПЖЕ-н.
және
түтіннің маңыздық шығысы (Gг = Gа,
кг/с) мен физикалық қасиеттері (срг = сра = 1,005 кДж/(кг×К) ауанікіндей және қарсы ағынды
ауажылытқыштың жылулық ысыраптарын кемнен кем (hж @ 1) деп, келесілерді анықтаңыздар: а)
түтіннің эксергиясының азаюын; б) ауаның
эксергиясының өсуін; в) жүйенің
жұмыстық қабілеттілігінің (работоспособность)
ысырабы мен ауажылытқышының эксергиялық ПЖЕ-н.
Шешімі. Түтін мен ауаның
жылулық теңестігінен жылытылған ауаның
ыстықтығын анықтаймыз
Gасра(Та²-Та¢) = Gгсрг(Тг¢-Тг²)hж;
Та²=(Тг¢-Тг²) +Та¢ = 650–500 +425=575 К. (9.2.22)
1)Түтіннің эксергиясының азаюы
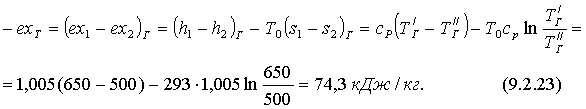
2)Ауаның эксергиясының өсуі
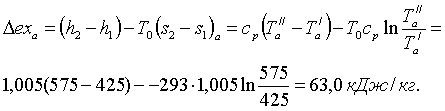 (9.2.24)
(9.2.24)
3)Жүйенің
жұмыстық қабілеттілігінің ысырабы
![]() (9.2.25)
(9.2.25)
мен
ауажылытқышының эксергиялық ПЖЕ-і
 (9.2.26)
(9.2.26)
9.6-есеп (VII-37[4]). К-200-130 бу
шығырының жоғары қысымды бөлігінде (ЖҚБ)
басты ![]() мен
мен ![]() көрсеткішті
күйінен бу жылуалмасусыз
көрсеткішті
күйінен бу жылуалмасусыз ![]() мен
мен ![]() күйіне дейін
кеңейеді. Қоршаған ортаның ыстықтығы
күйіне дейін
кеңейеді. Қоршаған ортаның ыстықтығы ![]() Су буы
күйінің көрнекті hs-сызбағы арқылы
ЖҚБ-нің эксергиялық ПЖЕ-н анықтаңыздар.
Су буы
күйінің көрнекті hs-сызбағы арқылы
ЖҚБ-нің эксергиялық ПЖЕ-н анықтаңыздар.
Шешімі. Қажырдың берілген
эксергиядағы туындысы ((9.2.15) бойынша):
|
|
|
сызбағында,
будың берілген күйлеріне сәйкесті, 1 мен 2- нүктелерден
![]() тұрақтыларын өткізсек, эксергия мен
қажырдың азаюлары сол эксергия
тұрақтылықтарының энтропия
тұрақтыдағы (1 – 3) және 1 мен 2 нүктелерінің
аралықтарымен сәйкесті келесідей болып табылады:
тұрақтыларын өткізсек, эксергия мен
қажырдың азаюлары сол эксергия
тұрақтылықтарының энтропия
тұрақтыдағы (1 – 3) және 1 мен 2 нүктелерінің
аралықтарымен сәйкесті келесідей болып табылады: ![]() = 448 кДж/кг
(қайтымды 1-3 құбылыста); lT = -Dh = 98 ккал/кг = 410,3 кДж/кг
(нақты 1-2 құбылыста).
= 448 кДж/кг
(қайтымды 1-3 құбылыста); lT = -Dh = 98 ккал/кг = 410,3 кДж/кг
(нақты 1-2 құбылыста).
ЖҚБ-тің эксергиялық ПЖЕ-і
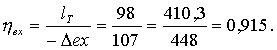 (9.2.27)
(9.2.27)
Бұл қорытындыға ех, h, s – көрнек сызбағы [12] (9.2- сурет)
арқылы да ие бола аламыз.
|
|
9.7-есеп (VII-39[4]).
Қақпақпен бөлінген және бір-бірінен жылуалмасусыз
оқшауланған А мен Б сырықтарда маңыздары бірдей ауа
орналасқан (9.3-сурет). Ауаның бастапқы қысымдары: рА1
= 10 бар мен рБ1 = 1 бар және ыстықтықтары ТА1 = ТБ1 = 400 К.
Сырық Б-да жылуалмастырмайтын піспек (поршень) бар.
Қақпақ ашылғанда қысым арынының
әсерімен піспек жылжып, Б сырықтағы ауаны
теңдескен күйге жеткенше,
сығады. Қоршаған ортаның ыстықтығы ![]() Теңдескен
күйдегі р2 қысымын , ауаның ТА2 мен ТБ2
ыстықтықтарын және жүйенің жұмыс
қабілеттілігінің ысырабы мен эксергиялық ПЖЕ-н
анықтаңыздар.
Теңдескен
күйдегі р2 қысымын , ауаның ТА2 мен ТБ2
ыстықтықтарын және жүйенің жұмыс
қабілеттілігінің ысырабы мен эксергиялық ПЖЕ-н
анықтаңыздар.
Шешімі. 1)
Теңдескен қысым қайраттың сақталу
теңдеуінен анықталады
![]() (9.2.28)
(9.2.28)
Мұнда ![]() мен Т = рV/(mR)-ларды
ескерсек
мен Т = рV/(mR)-ларды
ескерсек
![]() (9.2.29)
(9.2.29)
Мұндағы ![]() және
және ![]() Сондықтан
Сондықтан
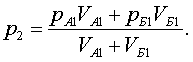 (9.2.30)
(9.2.30)
![]() мен
мен ![]() -дің арақатнасын анықтап, табылғанды
(Ж9.7.3) ескереміз
-дің арақатнасын анықтап, табылғанды
(Ж9.7.3) ескереміз
![]() (9.2.31)
(9.2.31)
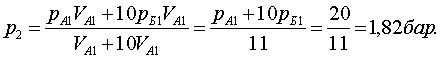 (9.2.32)
(9.2.32)
2) Піспектің оң
жағындағы ауаның ыстықтығы жылуалмасусыз
сығу құбылысының көрсеткіштерімен
анықталады
 (9.2.33)
(9.2.33)
3)Піспектің сол жағындағы ауаның
ыстықтығы қайраттың сақталу (8.7.1)
теңдеуінен анықталады
![]() (9.2.34)
(9.2.34)
4)Піспектің сол жағындағы ауаның
эксергиясының азаюы
 =1,005(400-327)-293[1,005ln(400/357)-0,287ln(10/1682)]=156,7 кДж/кг.
(9.2.35)
=1,005(400-327)-293[1,005ln(400/357)-0,287ln(10/1682)]=156,7 кДж/кг.
(9.2.35)
5)
Піспектің оң жағындағы ауаның
эксергиясының ұлғаюы

=1,005(473-400)-293[1,005ln(473/400)-0,287ln(1,82/1)]=73,4 кДж/кг. (9.2.36)
6)
Жүйенің жұмыс қабілеттілігінің ысырабы
![]() (9.2.37)
(9.2.37)
7) Эксергиялық ПЖЕ
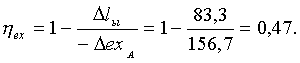 (9.2.37)
(9.2.37)
Әдебиеттер тізімі
1. Стромберг А.Г.,
Семченко Д.П. Физическая химия.-5-е изд.: УП для хим.спец.вузов.- М.: ВШ,
2003.-527 с.
2. Исаев С.И. Термодинамика: Уч. для вузов.-3-е
изд.- М.: МГТУ, 2000.-416 с.
3. Химия окружающей среды.- Пер. С англ. /Под ред. А.П.Цыганкова.- М.:
Химия, 1982.-672 с.
4. Юдаев Б.Н. Сборник задач по технической
термодинамике и теплопередаче: УП для вузов.- М.: ВШ, 1968.-372 с.
5. Физическая химия в вопросах и ответах / Под ред. К.В.Топчиевой,
Н.В.Федорович.- М.: МГУ, 1981.-264 с.
6. Кудряшев И.В., Каретников Г.С. Сборник
примеров и задач по физической химии.- М.: ВШ, 1991.-527 с.
7. Промышленные
тепломассообменные процессы и установки./ Под ред. А. М.
Бакластова.-
М.:
ЭАИ, 1986. –327 с.
8. Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу
процессов и аппаратов химической технологии: УП для вузов / Под ред. П.Г. Романкова.-10-е изд.,перераб. И
доп.- Л.: Химия, 1987.-576 с.
9. Янтовский
Е.И. Парокомпрессионные теплонасосные установки.- М.:
Энергоиздат, 1982.-144 с.
10. Соколов
Е.Я.,
Бродянский В.М. Энергетические основы транс-формации
тепла и процессов охлаждения.- М.: Энергоиздат,
1981.-320 с.
11. Мартынов
А.В. Установки для трансформации тепла и охлаждения: Cборник
задач.- М.:
ЭАИ,
1989.-200 с.
12. Вукалович М.П. и Новиков И.И. Техническая термодинамика.- М.: Энергия,
1968.-496 с.
13. Кириллин В.А., Сычев В.В., Шейндлин
А.Е. Техническая термодинамика.- М.: Энергия, 1974.-448 с.
14. Ермекбаев К.Б.,
Темирбаев Д.Ж. Термодинамические основы теплотехники: УП для вузов.- Алма-Ата:
КазПТИ им. В.И. Ленина, 1979.-58 с.
15. Рыжкин
В.Я. Тепловые электрические станции. - М.: ЭАИ, 1987.-328 с.
16. Промышленные
тепловые электростанции /М.И. Баженов, А.С. Богородский, Б.В. Сазанов, В.Н. Юренов //Под ред.
Е.Я. Соколова.-М:Энергия, 1979.-296с.
17.
Беликов С.Е., Котлер В.Р. Нулевые выбросы в атмосферу // Теплоэнергетика.-
2004.- №1.- С.69-72.
18. Кириллов В.А., Кузин Н.А., Куликов
А.В. Применение каталитического способа окисления углеводородных газов для
получения тепла в бытовой теплоэнергетике // Теплоэнергетика.- 2000. №1.-
С.18-22.
19. Пугач Л.И. Энергетика и экология:
Учебник.- Новосибирск: Изд-во НГТУ, 2003.-504 с.
Мазмұны
Алғы сөз . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . .3
1- бөлім. Жылу мен жұмыстың химиялық
өзгерістері . . . . . . . . . . . . . . . . . . . .4
1 Термохимия. Жылулық әсер . . . . . . . . . . . . . . . . .
. . . .. . . . . . . . . . . . . . . . . . .4
1.1 Химиялық жылуқозғалымның негізгі
ұғымдары . . . . . . . . .
. . . . . . .4
1.2 Химиялық тектесулердің жылулық әсерлері . . . .
. . . . . . . . . . . . . . . 6
1.3 Гесс заңы және оның пайдалануы . .
. . . . . . . . . . . . . . . . . . .. . . . . . . . 7
1- жаттығу. Жылулық әсерлер. Гесс заңы . . . . . . . . . . . . . . .
. . . . . . . 8
1.4 Кирхгоф заңы . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . ..10
2- жаттығу. Жылулық әсерлердің
ыстықтыққа тәуелділігі
. . . . . . 11
1.5 Еркін және байланған қайраттар.
Тұрақты ыстықтықты жұмыс . . .13
2 Химиялық
кинетика . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . 15
2.1 Химиялық тектесудің
жылдамдығы мен жылдамдық тұрақтысы
және маңыздық
әрекет заңы . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . 15
3 Химиялық
теңдесу. Пайдалы жұмыс. Химиялық мүмкіндік . . . . . . . . . . .. 17
3.1 Химиялық
тектесулердің қайтымдылығы мен теңдесуі және
теңдесу
тұрақтылары . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . .17
3.2 Ыдырау мен
ыдыраудың дәрежесі және мұның теңдесу
тұрақтысымен
байланысы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
.18
3.3 Химиялық тектесулердің
жылуқозғалымдық теңдесу
құбылыстары мен
теңдескен күйлерінің
жалпы шарттары . . . . . . .20
3.4 Жылу әсері мен пайдалы жұмыстың
Гиббс пен Гельмгольц
теңдеулері . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
3.5 Сипаттағыш бернелердің химиялық мүмкіндіктері .
. . . . . . . . . . . .23
3.6 Еркін қажырдың тектесу мөлшерімен байланысы . . . . .
. . . . . . . . .24
3.7 Мүлтіксіз газ қоспаларының химиялық мүмкіндігі
. . . . . . . . . . . . .24
3- жаттығу.
Химиялық теңдесу. Теңдесу тұрақтылары.
Ыдырау дәрежесі . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . 24
4 Химиялық
тектік . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . .27
4.1 Химиялық тектік пен тектесудің
ыстықтық
тұрақтылығының теңдеуі . . . . . . . . . . . . .
. . . . . . . . . . . . 27
4.2 Химиялық тектіктің жылулық әсерімен байланысы.
Бертло қағидасы .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
.29
4-
жаттығу. Химиялық тектік пен ең үлкен жұмыс . . . . . . . . . . . .. 30
5 Химиялық
тектік пен теңелу тұрақтыларының
ыстықтыққа
тәуелділіктері . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . .32
5.1 Химиялық тектіктің ыстықтыққа
тәуелділігі . . . . . . . . . . . . . . . . . ..32
5.2 Теңдесу тұрақтысының
ыстықтыққа тәуелділігі. Вант-Гофф заңы.
Ле-Шателье – Браун
қағидасы . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. .33
5.3 Теңелу тұрақтысының
ыстықтыққа тәуелді есептелуінің әдістері
.35
5- жаттығу. Теңдесу
тұрақтыларының ыстықтыққа
тәуелділіктері . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . .36
6 Химиялық
кинетиканың түзгілері . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . .39
6.1 Белсендіру қайраттың
айырымының жылулық әсерге теңдігі . . . . 39
6.2 Тектесу құраушыларының
шоғырлары мен жылдамдығының уақыт
пен қысымға тәуелділігі . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . .40
6.3 Тізбекті тектесулер . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . .42
6.4 Катализ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . 44
6-
жаттығу. Отынның жану өнімдері мен жылулық
қабілеттілігі . .45
7
Жылуқозғалымның үшінші заңы . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . .47
7.1 Нернсттің жылулық теоремасы . . . . . . . . . . . . . . . . . . . . . . . . . . .
..48
7.2
Жылуқозғалымның үшінші заңы . . . . . . . . . . .
. . . . . . . . . . . . . . . . . 50
7.3
Заттардың
толық нөл маңындағы қасиеттері . . . . . . . . .
. . . . . . . . 51
7- жаттығу.
Жылуқозғалымның шаққылық теңдеулері .
. . . . . . . . .52
7.4 Толық энтропияның
калориялық мәліметтері арқылы анықталуы .55
2- бөлім. Химиялық және тектікүй
өзгерістері . . . . . . . . . . . . . . . . . . . . . . . . .55
8 Күрделі тектесулердің физикалық
химиясы . . . . . . . . . . . . . . . . . . . . . . . . . .55
8.1 Жану мен
жарылудың ыстықтықтары . . . . . . . . . . . . . . . . . . .
. . . . .55
8.2 Жылулық
әсерінің қысым мен текті күй өзгеруіне
тәуелділігі . . . .57
8.3.
Күрделі жүйенің жылулық әсері мен
өнімдерінің ыстықтығы . . . 60
8.4 Жылуалмасусыз
жануларының ыстықтықтары . . . . . . . . . . . . . . . . 62
8.5 Жарылудың ыстықтығы мен қысымы . . .
. . . . . . . . . . . . . . . . . . . . .63
8.6 Тектесулік қабілеттік пен белсендіру қайраттың квантты
теориямен анықталуы . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64
8.7 Тек Гиббс
мүмкіндігі - меншікті
жылуқозғалымдық мүмкіндік. . .66
8.8 Мүлтіксіз және нақты газдардың химиялық
мүмкіндіктері.
Ұшпалық пен белсенділік . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 68
8.9 Отындық түзгілер (Электр химияға кіріспе) . . . . .
. . . . . . . . . . . . . .69
8- жаттығу. Жану мен жарылудың
ыстықтықтары . . . . . . . . . . . . . .71
9
Ерітінділерге кіріспе . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . .. 73
9.1. Ерітінді
құраушысының
химиялық мүмкіндігі . . . . . . . . . . . . . . ..73
9.2 Араластырудың
жылуқозғалымдық бернелері . . . . . . . . . . . . . . . . .74
9- жаттығу. Газ бен булардың
жұмысқа қабілеттілігі . . . . . . . . . . ..76
Әдебиеттер
тізімі . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. .
. . . . . . . . . . . . . . . . 82
Дүйсенби
Жүсіпұлы Темірбаев
Жылутәсілдемелік физикалық
химияның негіздері
Оқу құралы
Редакторы Ж.А. Байбураева
2006 ж. қосымша жоспары,
реті 57
Теруге берілген күні
Пішімі 60х80 1/16
Типография қағазы №1
Оқу - баспа таб. – 5,3. Таралымы 100 дана.
Тапсырыс. Бағасы 530 теңге.
Басуға
қол қойылды
Алматы энергетика және байланыс институтының
көшірмелі – көбейткіш бюросы
050013 Алматы, Байтұрсынұлы көшесі, 126