Некоммерческое акционерное общество
АЛМАТИНСКИЙ УНИВЕРСИТЕТ ЭНЕРГЕТИКИ И СВЯЗИ
Кафедра теплоэнергетических установок
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Методические указания к выполнению лабораторных работ
для студентов специальности 5В071700 – «Теплоэнергетика»
Алматы 2011
СОСТАВИТЕЛИ: М. И. Пак, Т. М. Ем. Техническая термодинамика. Методические указания к выполнению лабораторных работ для студентов специальности 5В071700 - «Теплоэнергетика». - Алматы: АУЭС, 2011- 34 с.
Методические указания содержат рекомендации к выполнению лабораторных работ по определению удельной теплоемкости воздуха и воды, исследованию цикла парокомпрессионной холодильной установки, определению степени сухости влажного водяного пара и определению эффективного коэффициента полезного действия компрессорной установки.
Ил. 8, табл. 8, библиогр. - 16 назв.
Рецензент: канд. техн. наук, доц. Кибарин А. А.
Печатается по плану издания некоммерческого акционерного общества «Алматинский институт энергетики и связи» на 2010 г.
©НАО «Алматинский университет энергетики и связи», 2011г.
Содержание
|
Введение |
4 |
|
1 Лабораторная работа № 1. Определение теплоемкости воздуха методом проточного калориметра |
6 |
|
2 Лабораторная работа № 2. Определение удельной изобарной теплоемкости воды. |
10 |
|
3 Лабораторная работа № 3. Определение эффективного коэффициента полезного действия компрессорной установки |
14 |
|
4 Лабораторная работа № 4. Исследование истечения воздуха из суживающегося сопла. |
17 |
|
5 Лабораторная работа № 5. Определение зависимости температуры кипения воды от давления. |
21 |
|
6 Лабораторная работа № 6. Определение степени сухости влажного водяного пара. |
24 |
|
7 Лабораторная работа № 7. Исследование цикла парокомпрессионной холодильной установки. |
27 |
|
8 Лабораторная работа № 8. Определение газовой постоянной воздуха. |
31 |
|
9 Список литературы |
34 |
|
10 Приложение |
35 |
Введение
Подготовка специалиста в области применения методов термодинамики для анализа физико-химических явлений, современных методов анализа и расчета термодинамических процессов и циклов идеального и реального газа с целью обеспечения надежной и эффективной работы теплоэнергетического и тепломеханического оборудования.
Задачей курса техническая термодинамика являются овладение термодинамическими методами анализа устойчивости состояния и направленности процессов в термодинамических системах; изучение термодинамических свойств веществ, методы расчета изменения термических и калорических параметров состояния в основных равновесных процессах и циклах; овладение методами анализа и оптимизации газовых и паросиловых циклов; получение представлений о методах прямого преобразования тепловой энергии в электрическую, о химической и неравновесной термодинамике.
Общие положения
Программа курса «Техническая термодинамика» предусматривает выполнение восьми лабораторных работ. Лабораторные работы имеют своей целью углубление и закрепление теоретических знаний студентов, полученных ими при изучении лекционного материала.
Основные этапы организации лабораторного практикума
Основными этапами организации лабораторного практикума являются:
- предварительная самостоятельная теоретическая подготовка студентов к занятиям [1-12];
- проверка знаний и допуск студента к лабораторным занятиям;
- выполнение студентами лабораторной работы;
- обработка результатов исследований и оформление отчёта;
- защита лабораторной работы.
В период подготовки студент обязаны:
- ознакомиться с методическими указаниями и описанием лабораторной работы;
- изучить общую постановку задачи и схему лабораторной установки;
- усвоить методику и порядок проведения работы;
- изучить методику обработки экспериментальных данных, при этом особое внимание следует обратить на размерность величин, подставленных в формулы;
- проработать соответствующие разделы теории по лекциям и рекомендованной литературе;
- ознакомиться с контрольными вопросами, приведенными в конце описания по работе и дать на них ответы;
- подготовить краткий конспект по работе с таблицами наблюдений и расчетными формулами, миллиметровку, чертежные принадлежности, вычислительную технику для обработки экспериментальных данных, с которыми студент должен явиться на занятия.
Отчет по лабораторной работе является одной из форм технологической документации, а потому должен оформляться в соответствии с требованиями СТ НАО 56023-1910-01-2009 – Работы учебные. Общие требования к построению, изложению, оформлению и содержанию работ учебных.
Отчет составляется отдельно каждым студентом и должен содержать разделы:
- цель работы;
- описание экспериментальной установки и схемы включения измерительных приборов;
- содержание работы и методики обработки опытных данных;
- результаты измерений и вычислений;
- графическая часть;
- выводы.
Правила техники безопасности
Перед выполнением лабораторных работ студент обязан прочитать правила техники безопасности и пожарной безопасности, действующий в лаборатории, и расписаться о прохождении вводного и первичного инструктажа на рабочем месте. Работы проводятся с вращающимися механизмами, электроприборами.
Прежде чем приступить к работе, необходимо внимательно ознакомиться с лабораторной установкой, правилами безопасного ведения работы, проверить исправность приборов и механизмов. О замеченных недостатках сообщить руководителю работ.
Запрещается включать и выключать без разрешения руководителя рубильники, приборы, вентиляторы. По окончанию работы место привести в порядок: выключить установки, приборы, поставить на место стулья.
Лабораторная работа №1. Определение изобарной теплоемкости воздуха методом проточного калориметра.
Цель работы: экспериментальное определение изобарной теплоемкости воздуха при атмосферном давлении, освоение метода проточного калориметра
Содержание работы: определение объемной
изобарной теплоемкости воздуха ![]() в 3-5 режимах проточного калориметра,
расчетное определение теплоемкостей: удельной Ср, удельной
изохорной Сv, мольной
μСр; оценка погрешности эксперимента,
проведение сравнительного анализа полученных результатов.
в 3-5 режимах проточного калориметра,
расчетное определение теплоемкостей: удельной Ср, удельной
изохорной Сv, мольной
μСр; оценка погрешности эксперимента,
проведение сравнительного анализа полученных результатов.
1.1 Теоретическое введение
Теплоемкостью термодинамической системы (ТДС) называется количество тепла, необходимое для нагрева (охлаждения) ее на 1 градус в процессе х = const, где х – параметр состояния ТДС. На практике используют изобарную теплоемкость Ср (х = р = const), изохорную теплоемкость Сv (х = v = const). Эти теплоемкости являются функциями состояния. Различают следующие теплоемкости:
удельные
 ,
,
объемные
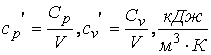 ,
,
мольные
 ,
,
где m – масса, кг, V – объем, м3, М – число молей ТДС, а также истинные и средние теплоемкости:
истинная, например, удельная равна
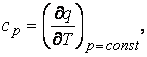 (1.1)
(1.1)
средняя в интервале температур Т1 и Т2 равна
 (1.2)
(1.2)
связь между ними
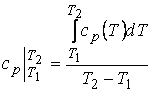 , (1.3)
, (1.3)
где q- удельное количество тепла, кДж/кг.
Удельные теплоемкости ср и сv для идеального газа связаны между собой уравнением Майера
ср – сv = R, (1.4)
где R – газовая постоянная.
1.2 Экспериментальная установка и проведение опытов
 |
1-проточный калориметр, 2- нагреватель электрический, 3- вентилятор (пылесос), измерительная диафрагма, 5- дифференциальный U- образный манометр.
Рисунок 1.1 -Схема экспериментальной установки
Экспериментальная установка (см. рисунок 1.1) состоит из проточного калориметра 1 с расположенным в нем электрическим нагревателем 2. Принудительное движение воздуха обеспечивается работой вентилятора (пылесоса) 3. Мощность нагревателя и производительность вентилятора регулируются лабораторными автотрансформаторами ЛАТР- 1, ЛАТР- 2. Расход воздуха при температуре t2 определяется с помощью измерительной диафрагмы 4, перепад давления на которой измеряется U- образным манометром 5. Для измерения разности температур (t2- t1) используются термопары гр. ХА, которые включены по дифференциальной схеме, так что величина термоэдс, мВ, пропорциональна разности температур (t2- t1).
Работа выполняется в следующем порядке:
- включить тумблер электрической сети;
- включить в сеть электродвигатель вентилятора (выключатель К1 в положение «ВКЛ»;
- изменяя напряжение на выходе из ЛАТР-1, установить на манометре перепад давления 160 –180 мм вод.ст.;
- включить в сеть нагреватель (К2 перевести в положение «ВКЛ») и установить с помощью ЛАТР- 2 рекомендуемую мощность нагревателя;
- измеряя с интервалом 2 минуты временную зависимость Dt(τ), дождаться наступления стационарного режима, при котором Dt не будет изменяться со временем Dt = const;
- в стационарном режиме провести три измерения: перепада давления на измерительной диафрагме Dh, мм вод. ст., тока в цепи нагревателя I, А, напряжения U, В, одновременно найти значения барометрического давления В, бар, температуры воздуха в помещении t1, ºС, по показаниям приборов в лаборатории;
- в таком же порядке провести измерения в трех различных стационарных режимах работы калориметра.
Таблица 1.1 – Результаты экспериментов
|
№ Измерений
|
Δh, мм вод. ст. |
I,А |
U, В |
Δt, мВ |
V, м3/с |
Vн, нм3/с
|
W Вт |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
1.3 Обработка результатов и оценка погрешности опыта
Для обработки результатов используют среднеарифметические значения прямых измерений в каждом стационарном режиме.
Расчетные формулы обработки результатов и определения приборной погрешности:
- мощность нагревателя
W= I · U, Вт, (1.5)
- расход воздуха V, м3/с, находятся по тарировочной кривой по величине Δh,
- расход воздуха Vн, нм3/с, приведенный к нормальным условиям
 (1.6)
(1.6)
где Во = 101 325 Па, То = 273,15 К, Т2 = 273,15 + t1 +Δt,
- объемная средняя изобарная теплоемкость
воздуха ![]() ,
кДж/нм3·К, в режиме
,
кДж/нм3·К, в режиме
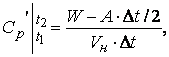 (1.7)
(1.7)
где А- постоянная установки, учитывающая потери тепла в окружающую среду калориметром. Она определяется предварительными опытами и А = 0,93, Вт/К.
- по соотношению (1.4) находится средняя удельная изохорная
теплоемкость ![]() .
.
Приборная погрешность определения теплоемкости определяется:
относительная
![]() =
= ![]() ,
,
![]() ,
,
![]()
![]() КI – класс точности
амперметра,
КI – класс точности
амперметра,
![]() КU – класс точности
вольтметра,
КU – класс точности
вольтметра,
![]() , где Δt выражено в мВ.
, где Δt выражено в мВ.
1.4 Контрольные вопросы
1) Что называется теплоемкостью?
2) Виды удельных теплоемкостей. Связь между ними.
3) Изобарная и изохорная теплоемкости. Связь между ними.
4) Истинная и средняя теплоемкости и связь между ними.
5) Уравнение Майера.
Литература: Л.1 гл. 1, гл 4; Л.2 гл. 6; Л. 3 гл. 4; Л. 4 гл. 6, гл. 7.
Список литературы
1. Кириллин В. А ., Сычев В. В., Шейндлин. Техническая термодинамика.-М.: Энергоатомиздат, 1983.- 416 с.
2. . Техническая термодинамика. 2 – е изд. / под ред. В. И. Крутова.- М.: ВШ., 1981.- 439 с.
3. Жуковский В. С. Термодинамика / под ред. А. А. Гухмана. М.: Энергоатомиздат, 1983.- 304 с.
4. Зубарев В. Н., Александров А. А., Охотин В. С. Практикум по технической термодинамике.- М.: Энергоатомиздат, 1986.- 304 с.
Лабораторная работа №2. Определение удельной изобарной теплоемкости воды
Цель работы: экспериментальное определение удельной изобарной теплоемкости воды, освоение метода адиабатного калориметра, получение навыков проведения теплотехнического эксперимента.
Содержание работы: экспериментальное
определение изобарной теплоемкости термодинамической системы (ТДС), расчетное
определение теплоемкостей воды: удельной ср , сv, объемной
![]() ,
мольной μср, а также
удельной энтальпии
h и внутренней энергии
u; расчет погрешности
эксперимента и проведение сравнительного анализа полученных результатов.
,
мольной μср, а также
удельной энтальпии
h и внутренней энергии
u; расчет погрешности
эксперимента и проведение сравнительного анализа полученных результатов.
2.1 Теоретическое введение
Определение теплоемкостей, связь между истинной и средней теплоемкостью приведены в описании к лабораторной работе № 1. Для реального газа удельная истинная изобарная теплоемкость ср и изохорная сv связаны соотношением:
 (2.1)
(2.1)
Поскольку ср и сv являются функциями состояния, то зависимость теплоемкостей от параметров состояния определяются соотношениями:
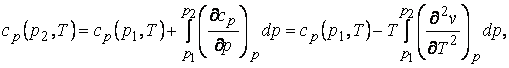 (2.2)
(2.2)
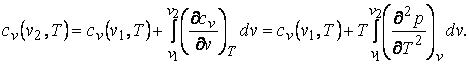 (2.3)
(2.3)
Из-за малой сжимаемости воды в технических расчетах можно принять, что ср и сv одинаковы.
Для воды и водяного пара принято, что внутренняя энергия uтр.т в главной тройной точке (t = 0,01°С, р = 610,8 Па) равна нулю. Тогда энтальпия в тройной точке будет равна hтр.т = uтр.т+ pv = 0,611 Дж/кг (vтр.т = 1,0002 см3/кг)
Используя уравнение
I начала термодинамики и
соотношения связи между истинной и средней теплоемкостями в интервале температур
![]() ,
,
![]() , можно
получить формулы определения энтальпии и внутренней энергии как функций
состояния:
, можно
получить формулы определения энтальпии и внутренней энергии как функций
состояния:
![]() (2.5)
(2.5)
![]() (2.6)
(2.6)
2.2 Экспериментальная установка и порядок проведения опыта
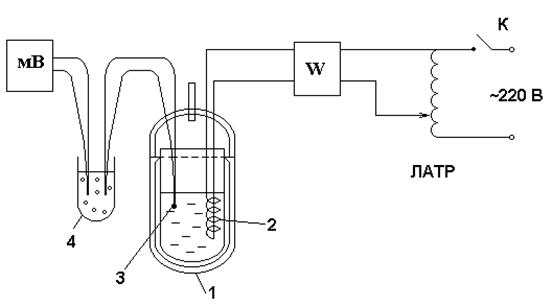 |
Рисунок 2.1-Схема экспериментальной установки
Установка состоит из термоса из нержавеющей стали 1 (адиабатный калориметр), в который налита вода массой m, г. Калориметр снабжен электрическим нагревателем 2, подключенный к сети переменного тока через ваттметр W, лабораторный автотрансформатор ЛАТР с выключателем сети К. Для измерения температуры используется хромель- копелевая термопара (гр. ХК), горячий спай которой находится в воде 3, а свободный спай – в сосуде Дьюара с тающим льдом 4. Термоэдс термопары измеряется цифровым милливольтметром мВ.
Работа выполняется в следующем порядке:
– измерить начальную температуру воды в
калориметре ![]() ,
°С;
,
°С;
– включить нагреватель в сеть ( выключатель К перевести в положение «ВКЛ»);
– с помощью ЛАТР установить мощность нагревателя 150-170 Вт, одновременно включить секундомер;
– при неизменной мощности нагреватель оставить включенным около 5 минут (τ = 5 мин);
– выключить нагреватель ( К в положение «ВЫКЛ»);
– с интервалом 2 минуты проводить измерение температуры воды в калориметре до наступления стационарного режима;
Последующие 2-3 режима проводятся в аналогичном порядке.
Таблица 2.1 – Результаты экспериментов
|
№ измерений |
W, Вт |
мВ |
мВ |
˚С |
Дж/кг ·К |
hi, Дж/кг |
ui, Дж/кг |
% |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
В связи с колебанием напряжения в сети в период работы нагревателя через 1 минуту нужно измерять мощность нагревателя. В расчете использовать среднеарифметическое значение мощности.
2.3 Обработка результатов и оценка погрешности опыта
Количество тепла, отданное нагревателем в i-том стационарном режиме определяется соотношением
Qi = Wi · τi ,Дж.
Средняя удельная изобарная теплоемкость равна
![]() =
= 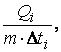 Дж/кг К,
Дж/кг К,
где ![]() .
.
Разность (ср- сv) в зависимости от температуры воды выражается, кДж/кг К:
|
Δt,˚С |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
(ср- сv) |
0 |
0,004 |
0,030 |
0,058 |
0,100 |
0,151 |
0,201 |
0,260 |
0,318 |
По формулам (2.5), (2.6) находятся значения удельной энтальпии и внутренней энергии.
Поскольку ср воды в интервале температур 20˚С - 70˚С практически постоянная, оценку погрешности опыта можно провести двумя способами:
1) оценка приборной погрешности
![]() ;
;
2) оценка среднеквадратичной погрешности измерения

![]() - среднеарифметическое значение
теплоемкостей трех режимов,
- среднеарифметическое значение
теплоемкостей трех режимов, ![]() - значение теплоемкости в каждом
стационарном режиме.
- значение теплоемкости в каждом
стационарном режиме.
2.4 Содержание отчета по работе
Отчет должен содержать краткий
конспект описания, схему экспериментальной установки, таблицу результатов
эксперимента и обработки данных, оценку погрешности измерений, значения сР,
сv, ![]() , μср, h,
u, а также краткие выводы по работе.
, μср, h,
u, а также краткие выводы по работе.
2.5 Контрольные вопросы
1) Что называется теплоемкостью?
2) Получите уравнение Майера для идеального газа и поясните, почему оно неприменимо для воды.
3) Что такое постоянная калориметра?
4) Каковы источники погрешности эксперимента?
5) Почему теплоемкости ср и сv примерно равны?
Литература:Л.1 § 6.2, 6.5; Л. 2 гл. 4, § 7.3, Л. 4 § VII –1, 5, 8.
Список литературы
1. Кириллин В. А ., Сычев В. В., Шейндлин. Техническая термодинамика.-М.: Энергоатомиздат, 1983.- 416 с.
2. . Техническая термодинамика. 2 – е изд. / под ред. В. И. Крутова.- М.: ВШ., 1981.- 439 с.
3. Жуковский В. С. Термодинамика / под ред. А. А. Гухмана. М.: Энергоатомиздат, 1983.- 304 с.
4. Зубарев В. Н., Александров А. А., Охотин В. С. Практикум по технической термодинамике.- М.: Энергоатомиздат, 1986.- 304 с.
Лабораторная работа № 3. Определение эффективного коэффициента полезного действия (кпд) компрессорной установки
Цель работы: экспериментальное определение эффективного кпд компрессорной установки, получение навыков проведения теплотехнического испытания установок.
Содержание работы: экспериментальное определение параметров сжатия воздуха в компрессоре, расчетное определение работы сжатия, экспериментальное определение работы привода и кпд компрессорной установки
3.1 Теоретическое введение
Работа сжатия газа в компрессоре определяется выражением
 (3.1)
(3.1)
где p1, p2 – давления всасывания и нагнетания, V – объем сжимаемого газа в цикле.
Реальный процесс сжатия в компрессоре представляет собой политропу, располагающуюся между изотермой и адиабатой, где показатель политропы
1< n <k.
Работа сжатия будет равна
 (3.2)
(3.2)
где G- количество сжатого воздуха, кг, R- газовая постоянная воздуха, Т1- начальная температура.
Работа привода компрессорной установки, состоящей из собственного компрессора, двигателя ( электромотора или двигателя внутреннего сгорания ), редуктора и системы автоматики, будет больше работы сжатия газа из-за потерь в двигателе, потерь энергии на трение и дросселирование в различных узлах компрессорной установки, а также из-за наличия вредного пространства, снижающего производительность компрессора. Для компрессорной установки с электродвигателем работа привода может быть определена
Lпр=
W
![]() ,
(3.3)
,
(3.3)
где
W- мощность потребляемая электродвигателем, Вт,
![]() - время работы
компрессора, с.
- время работы
компрессора, с.
Эффективное кпд
компрессорной установки ![]() е можно определить как
отношение
е можно определить как
отношение 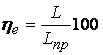 %, (3.4)
%, (3.4)
3.2 Схема экспериментальной установки и порядок выполнения работы.
Экспериментальная установка (см. рисунок 3.1) состоит из компрессора 1, резервуара большого объема 2, редуктора 3, задвижки 4, манометра 5, суживающего сопла 6, газосчетчика 7.

Сопло имеет площадь выходного сечения f = 2,355 мм2
Рисунок 3.1- Схема экспериментальной установки
Экспериментальная установка состоит из двухступенчатого поршневого компрессора с электроприводом от сети переменного тока 220В мощностью1,5 кВт, ресивера объемом 24л, редуктора, позволяющего устанавливать на выходе из него заданное давление. Ресивер снабжен манометром для измерения давления, а также термопарой гр. ХА для измерения температуры сжатого воздуха. При числе оборотов n= 2900 об/мин, компрессор совершает такое же количество циклов (всас, сжатие, нагнетание в ресивер) в минуту.
Порядок выполнения работы:
-с помощью клапана экстренного сброса давления установите в ресивере давление р1, равное атмосферному;
-измерьте начальную температуру в ресивере t1;
-закройте выходной вентиль редуктора и включите электродвигатель. Одновременно включите секундомер;
-при достижении давления в ресивере около 8 бар,
компрессор автоматически выключится. Определите время работы компрессора ![]() ,с. За время работы
компрессора снимите несколько показаний значений тока
I, А и напряжения
U, В. В расчете нужно
использовать среднеарифметическое их значение;
,с. За время работы
компрессора снимите несколько показаний значений тока
I, А и напряжения
U, В. В расчете нужно
использовать среднеарифметическое их значение;
-снимите показания манометра р2, бар и термоэдс термопары t2, ºС.
Таблица 3.1 – Результаты экспериментов
|
№ изм. |
I, А |
U, В |
W, Вт |
р1, бар |
t1, ºС |
р2 , бар |
t2, ºС |
L, Дж |
Lпр, Дж |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
3.3 Обработка результатов опыта
Работа привода определяется по соотношению
Lпр=
![]() Дж.
(3.5)
Дж.
(3.5)
Показатель политропы сжатия воздуха в компрессоре определяется по формуле:
 (3.6)
(3.6)
Начальный объем V1, м3, масса сжатого воздуха G, кг, находятся по уравнению состояния идеального газа:
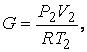 (3.7)
(3.7)
![]() (3.8)
(3.8)
Все величины в формулах (3.5 – 3.8) нужно подставлять в основных единицах измерения системы СИ.
Работа сжатия воздуха определяется по формуле (3.2) по показателю политропы n.
3.4 Содержание отчета
Отчет должен содержать краткий конспект теоретического введения, расчет работы сжатия, определение эффективного кпд компрессорной установки, краткие выводы по работе.
3.5 Контрольные вопросы
1) Какие работы совершает компрессор за один цикл кроме работы сжатия?
2) Изобразите процесс сжатия газа в компрессоре на рV – диаграмме, найдите графически работу сжатия в компрессоре.
3) Почему в многоступенчатых компрессорах процесс сжатия газа проводится по изотерме?
4) Получите выражение работы сжатия газа в компрессоре при политропном сжатии.
5) Почему в работе в период сжатия газа нужно снимать несколько показаний мощности привода компрессора?
Литература: Л. 1. § 7.9, 9.2, Л. 4. § VII – 1, 5, 8.
Список литературы
1. Кириллин В. А ., Сычев В. В., Шейндлин. Техническая термодинамика.-М.: Энергоатомиздат, 1983.- 416 с.
2. Техническая термодинамика. 2 – е изд. / под ред. В. И. Крутова.- М.: ВШ., 1981.- 439 с.
3. Жуковский В. С. Термодинамика / под ред. А. А. Гухмана. М.: Энергоатомиздат, 1983.- 304 с.
4. Зубарев В. Н., Александров А. А., Охотин В. С. Практикум по технической термодинамике.- М.: Энергоатомиздат, 1986.- 304 с.
Лабораторная работа № 4. Исследование истечения воздуха из суживающего сопла
Цель работы: экспериментальное
определение зависимости расхода газа через суживающееся сопло от отношения
давлений ![]() ,
определение
,
определение ![]() и
скорости звука при истечении воздуха.
и
скорости звука при истечении воздуха.
Содержание работы: экспериментально
определить расход воздуха через суживающееся сопло при различных значениях ![]() . На основе этих данных
определить
. На основе этих данных
определить ![]() ,
скорость звука в воздухе.
,
скорость звука в воздухе.
Теоретическое введение
При обратимом адиабатном истечении газа из сопла, соединенного с газовым резервуаром большого объема, где газ имеет параметры p1, v1 и скорость w1 в среду с давлением р2, скорость на выходе из сопла должна определяться соотношением
![]() (4.1а)
(4.1а)
или
![]() (4.1б)
(4.1б)
Для несжимаемой жидкости
![]()
![]() (4.2)
(4.2)
для идеального газа
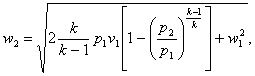 (4.3)
(4.3)
где k- показатель адиабаты.
Массовый расход газа через сопло G, кг/с, с выходным сечением f2 будет равен
G = f2 w2/v2 (4.3)
или в случае идеального газа
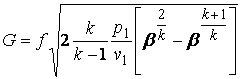 . (4.4)
. (4.4)
Из последнего выражения следует, что
расход газа из сопла должен монотонно возрасти при уменьшении ![]() . На самом деле при
. На самом деле при ![]() в выходном сечении
сопла устанавливается местная скорость звука и дальнейшее уменьшение р2,
которое распространяется в среде со скоростью звука, как бы «сносится» потоком,
и расход газа не изменяется.
в выходном сечении
сопла устанавливается местная скорость звука и дальнейшее уменьшение р2,
которое распространяется в среде со скоростью звука, как бы «сносится» потоком,
и расход газа не изменяется.
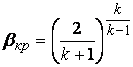 ,
(4.5)
,
(4.5)
![]() , (4.6)
, (4.6)
![]() - параметры газа в выходном сечении сопла,
- параметры газа в выходном сечении сопла,
![]() - скорость звука.
- скорость звука.
Экспериментальная установка и порядок проведения опыта
Экспериментальная установка (см. рисунок 4.1) состоит из компрессора 1, резервуара большого объема 2, редуктора 3, задвижки 4, манометра 5, суживающего сопла 6, газосчетчика 7.
Сопло имеет площадь выходного сечения f = 2,355 мм2

4.1 – Схема экспериментальной установки
Работа выполняется в следующем порядке:
- включить компрессор в сеть (см. лабораторную работу № 3), дождаться отключения электродвигателя;
- записать показания газосчетчика, установить на редукторе значение давления 1,2 бара, открыть задвижку 4 и одновременно включить секундомер;
- через 1 минуту записать показания газосчетчика, закрыть задвижку 4;
- аналогично провести опыты при давлениях в резервуаре 1,6 ; 2,0 ; 2,5 ; 3,0 бар.
Таблица 4.1 – Результаты экспериментов
|
№ изм. |
Р1, бар |
сек. |
Показания газосчетчика |
|
V, м3/с |
G, кг/с |
|
|
nн |
nк |
||||||
|
|
|
|
|
|
|
|
|
Обработка данных и оценка погрешности опыта
Объемный расход воздуха определяется по
показаниям газосчетчика
nн,
nк
за время
![]() :
:
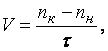 м3/с.
(4.7)
м3/с.
(4.7)
Массовый расход равен
G =V/
v
=![]() V. (4.8)
V. (4.8)
Cкорость в выходном сечении равна
V = ƒ2W2 , м/с.
По данным, занесенным в таблицу необходимо построить график зависимости G = ƒ(β), по нему определить значение βкр. Определить критическую скорость истечения из сопла и сравнить его со скоростью звука, вычисленного по формуле (2.6) при параметрах окружающего воздуха. βкр, определяемый по формуле (2.5), слабо зависит от показателя адиабаты. Поэтому в расчетах нужно использовать значение k = 1,34.
Из-за сложности расчетных формул определения W2, G для оценки погрешности эксперимента нужно использовать соотношения (2.7) и β = р2/р1, найти по приборной погрешности
δV = δ( nк
- nн) + δ![]() ,
,
δ β = δр2 + δр1
абсолютные погрешности ΔV (ΔG), Δβ и на графике G = ƒ(β) для каждой точки графика построить квадрат ошибок.
4.4 Содержание отчета по работе
Отчет должен содержать краткий конспект описания, схему экспериментальной установки, таблицу результатов эксперимента, обработку данных, оценку погрешности эксперимента и краткие выводы по работе.
4.5 Контрольные вопросы
1) Используя уравнение I начала термодинамики для движущегося потока получите выражение выходной скорости газа при истечении из суживающегося сопла при постоянном давлении в резервуаре и в окружающей среде.
2) Чем объясните «кризис» истечения газа из суживающегося сопла?
3) Как определяется скорость звука в идеальном газе?
4)
Как будет
изменятся значение 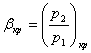 в
зависимости от свойств газа?
в
зависимости от свойств газа?
5) Как получить сверхзвуковые скорости истечения из сопла?
Литература: Л. 1 §8.1, 8.2, 8.3; Л. 2 §9.1, 9.3, гл. 4.
Список литературы
1. Кириллин В. А ., Сычев В. В., Шейндлин. Техническая термодинамика.-М.: Энергоатомиздат, 1983. - 416 с.
2. Зубарев В. Н., Александров А. А., Охотин В. С. Практикум по технической термодинамике.- М.: Энергоатомиздат, 1986. – 304 с.
3. Ривкин С. Л., Александров А. А. Термодинамические свойства воды и водяного пара: Справочник.- М.: Энергоатомиздат, 1984. – 80 с.
4. Гордов А. Н. Основы пирометрии.- М.: «Металлургия», 1971.- 448 с.
Лабораторная работа № 5.Определение зависимости температуры кипения воды от давления
Цель работы: приобретение навыков термодинамического эксперимента, определение зависимости температуры кипения (насыщения) воды от давления: Тн = f(р).
Содержание работы: определить зависимость Тн = f(р) в диапазоне р £ В, оценить погрешность определения искомой зависимости.
5.1 Теоретическое введение.
Насыщенный пар, т.е. пар, находящийся над кипящей жидкостью в состоянии термодинамического равновесия с ней, в соответствии с правилом фаз Гиббса обладает независимым термодинамическим параметром, однозначно определяющим все остальные параметры двухфазной системы.
В качестве такого параметра может выступать, например, давление. Известно, что с уменьшением давления температура, при которой жидкость закипает, падает. Связь между параметрами состояния двухфазной системы определяется уравнением Клапейрона – Клаузиуса
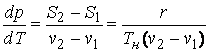 ,
(5.1)
,
(5.1)
в котором S, v, r – удельные энтропия, объем и теплота парообразования. Индексы ''1'' и ''2'' присвоены жидкой (вода) и газообразной (пар) фазам вещества.
Графической иллюстрацией служит фазовая р, Т-диаграмма, показанная на рисунке 5.1. Поле диаграммы разделено линией фазового перехода на две области, соответствующие жидкому (I) и газообразному (II) состоянию рабочего тела. Точка К называется критической точкой. Параметры рабочего тела в критической точке называются критическими. При параметрах, равных критическим, силы поверхностного натяжения в жидкости равны нулю, различия в свойствах жидкой и газообразной фаз исчезают (v1кр = v2кр), понятие фазового перехода выше точки К теряет смысл.
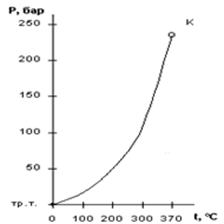
Рисунок 5.1 – Фазовая ![]() диаграмма воды и
водяного пара
диаграмма воды и
водяного пара
5.2 Экспериментальная установка и проведение опыта
Экспериментальная установка показана на рисунке 5.2. Она включает: испаритель 1 с электронагревателем 2, двухходовой кран 3, предназначенный для соединения полости испарителя с атмосферой или вакуумметром 4, хромель-копелевые термопары 5 для измерения температуры воды и пара, милливольтметр 6, охладитель 7.
До начала работы испаритель 1 должен быть примерно на ¼ заполнен водой и краном 3 соединен с атмосферой.
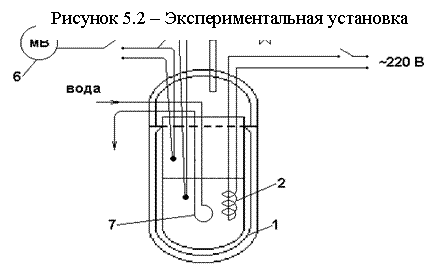 |
Включением электронагревателя 2 следует довести воду в испарителе до кипения и выдержать в этом режиме 1-2 мин., чтобы удалить воздух из паровой области испарителя. Затем включить мВ, после чего повернуть кран 3 в положение, отсоединяющее паровую область испарителя от атмосферы и соединяющее ее с вакуумметром 4. Одновременно нужно отключить нагреватель 2 и установить минимально возможный расход охлаждающей воды из водопровода через охладитель 7 и зафиксировать термо-ЭДС (Е) термопар 5 и разрежение (Рвак) в испарителе вакуумметром 4. Последующие одновременные измерения Рвак и Е необходимо производить либо каждые две-три минуты, либо при уменьшении температуры на 2 К. Эксперимент следует закончить при достижении Рвак = 0,4-0,5 кгс/см2.
Таблица 5.1 – Результаты экспериментов
|
Величина |
Единицы измерения |
№ опыта |
|||||
|
1 |
2 |
3 |
4 |
5 |
|||
|
Температура воды |
мВ |
°С |
|
|
|
|
|
|
Температура пара |
мВ |
°С |
|
|
|
|
|
|
Разрежение в испарителе рвак |
кгс/см2 |
Па |
|
|
|
|
|
|
Абс. давление пара |
Р=В-рвак |
Па |
|
|
|
|
|
Результаты следует также представить графически в виде Р, Т-диаграммы (см. рисунок 5.1).
В заключение нужно определить приборную погрешность эксперимента по формуле
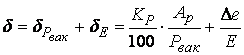 ,
(5.2)
,
(5.2)
в которой Кр – класс точности вакуумметра, Ар – предел измерений вакуумметра, Dе – абсолютная погрешность при измерении температуры термопарой.
5.3 Содержание отчета
Отчет должен содержать краткий конспект описания,
схему экспериментальной установки, экспериментально определенный график Тн
= f(р), а также график ![]() , построенный по таблице термодинамических
свойств воды и водяного пара, краткие выводы по работе.
, построенный по таблице термодинамических
свойств воды и водяного пара, краткие выводы по работе.
Литература: Л. 1. § 5; Л. 2. § 4, 8; Л. 3. § 1.
5.4 Контрольные вопросы
1) Что такое температура насыщения?
2) Какой пар называется насыщенным?
3) Охарактеризовать переход веществ из жидкого в газообразное состояние.
4) Почему с ростом давления растет температура насыщения?
5) Что такое гомогенная и гетерогенная система?
Список литературы
1. Кириллин В. А ., Сычев В. В., Шейндлин. Техническая термодинамика.-М.: Энергоатомиздат, 1983. – 416 с.
2. Техническая термодинамика: Учебник для вузов/ Под ред. Крутова В. И. – 2-е изд., перераб. и доп. –М.: ВШ, 1981.- 439 с.
3. Андрющенко А. И. Основы термодинамики циклов теплоэнергетических установок.- М.: ВШ, 1968 – 288 с.
4. Вукалович М. П., Новиков И. И. Термодинамика. – М.: Машиностроение, 1972. – 672 с.
5. Ривкин С. Л., Александров А. А. Термодинамические свойства воды и водяного пара: Справочник.- М.: Энергоатомиздат, 1984. – 80 с.
Лабораторная работа № 6. Определение степени сухости влажного водяного пара
Цель работы: экспериментальное определение степени сухости влажного пара, расчетное определение параметров влажного пара.
Содержание работы: определить методом адиабатного калориметра степень сухости влажного пара, рассчитать величины удельной энтальпии, энтропии, внутренней энергии, удельного объема влажного пара, оценить погрешность эксперимента.
6.1 Теоретическое введение
Влажный пар содержит молекулы пара и капельки воды различных диаметров. Степенью сухости называем массовое содержание пара во влажном паре
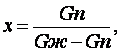 (6.1)
(6.1)
где Gж- масса воды, кг, Gп- масса пара, кг. В процессе фазового перехода вода- пар по линии насыщения ( p = const, t = const ). Х меняется от 0 на левой пограничной кривой до 1 на правой пограничной кривой. Поэтому степень сухости пара используется для однозначного задания состояния влажного пара, т. к. в этой области для чистого вещества по правилу Гиббса число независимых параметров, однозначно определяющих равновесное состояние системы, равно 1:
![]()
![]() (6.2)
(6.2)
![]()
![]()
где h, u, s, v- удельные энтальпия, внутреняя энергия, энтропия,объем; индексы ( ¢ ) и ( ¢¢ ) соответствуют параметрам рабочего тела в состоянии сухого насыщенного пара и кипящей жидкости.
Значения параметров
![]() и
и
![]() находятся по Таблице термодинамических
свойств по давлению или температуре.
находятся по Таблице термодинамических
свойств по давлению или температуре.
Если в эксперименте
определить, например, значение
hx, то ![]() равно
равно
![]() (6.3)
(6.3)
где ![]() -теплота фазового перехода.
-теплота фазового перехода.
В двухфазной области
![]()
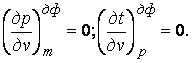
6.2 Экспериментальная установка и порядок проведения опыта
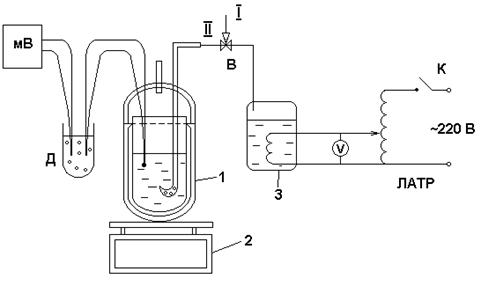 |
Рисунок 6.1 -Схема установки для определения степени сухости влажного пара.
Установка состоит из термоса 1, в который налита m, кг, воды, электронных весов, электрического парогенератора 3, нагреватель которого подключен к сети через ЛАТР и выключатель К, сосуда Дьюара Д, милливольтметра МВ, трехходового вентиля В. В термосе ( адиабатном калориметре ) в воде находится горячий спай термопары гр.ХК, свободный спай которой находится в сосуде Дьюара с тающим льдом. Пар из парогенератора через вентиль В подается в дырчатую трубку, дырки которой находятся в воде. Барботируя через слой воды, пар конденсируется. На крышке термоса имеется сквозное отверстие для поддержания в термосе атмосферного давления в период проведения опыта.
Работа проводится в следующем порядке:
- включить весы, взвесить термос без воды;
- налить в термос воду так, чтобы уровень воды на 1 см был выше уровня верхней дырки дырчатой трубки, определить массу воды;
- измерить начальную температуру воды tн, °С;
- подать напряжение на электронагреватель парогенератора (200В) при этом вентиль В открыт в атмосферу (положение I);
- при кипении воды сбросить напряжение на нагревателе до » 150В;
- поставить
вентиль В в положение
II, дождаться увеличения общей массы калориметра
за счет конденсации пара на ![]() 50 г;
50 г;
- перевести вентиль В в положение I, сбросить напряжение на нагревателе до 0 В;
- измеряя температуру воды через 2 мин дождитесь наступления стационарного режима, температура в этом режиме равна tк, °С.
Таким образом в опыте определены масса воды Gж, кг, масса конденсата Gп, кг, начальная температура воды tн, °С. Данные заносятся в Протокол наблюдений и обработки данных.
Таблица 6.1 Результаты экспериментов
|
Gж, кг |
Gп, кг |
tн, °С |
tк, °С |
Q, Дж |
Х |
dХ |
|
|
|
|
|
|
|
|
6.3 Обработка данных и оценка погрешности опыта
Энтальпия влажного пара hх определяется из уравнения баланса тепла при конденсации пара:
Q= ср×Gж(
tк-tн
) + А(
tк-tн
) = ср×Gп(
ts-tк ) +
Gп![]()
 , (6.4)
, (6.4)
где А – постоянная калориметра. А=0,1
Степень сухости пара находится по соотношению (6.3)
Основная погрешность эксперимента связана с погрешностью определения первого слагаемого в правой части соотношения (6.4)
dhx = dx = dGж+ dGп + 2dtк + dА.
6.4 Содержание отчета
Отчет должен содержать краткий конспект описания, схему экспериментальной установки, таблицу результатов эксперимента, обработку данных, оценку погрешности эксперимента и краткие выводы по работе.
6.5 Контрольные вопросы
1) Что такое насыщенный, влажный, сухой и перегретый пар?
2) Что такое степень сухости? Диапазон изменения степени сухости.
3) Что такое водяной эквивалент?
4) Все ли тепловые потери учтены в работе?
5) От чего зависит погрешность эксперимента?
Литература: Л. 1 §6.5, 6.8; Л. 2 §7.4,гл. 4; Л. 4 §VIII – 1,5,8.
Список литературы
1. Кириллин В. А ., Сычев В. В., Шейндлин. Техническая термодинамика.-М.: Энергоатомиздат, 1983. – 416 с.
2. Зубарев В. Н., Александров А. А., Охотин В. С. Практикум по технической термодинамике.- М.: Энергоатомиздат, 1986. – 304 с.
3. Ривкин С. Л., Александров А. А. Термодинамические свойства воды и водяного пара: Справочник.- М.: Энергоатомиздат, 1984. – 80 с.
4. Гордов А. Н. Основы пирометрии.- М.: «Металлургия», 1971. – 448 с.
Лабораторная работа №7. Исследование цикла парокомпрессионный холодильной установки
Цель работы: ознакомление с устройством и работой действующей холодильной установки, углубление знаний и приобретение экспериментальных навыков в определении параметров цикла ПКХУ.
Содержание работы: экспериментальным путем определить основные параметры, рассчитать недостающие параметры цикла, определить холодильный коэффициент и удельную холодопроизводительность. Сопоставить холодильный коэффициент цикла ПКХУ с холодильным коэффициентом обратного обратимого цикла Карно в том же интервале температур.
7.1 Теоретическое введение. Схема экспериментальной установки
Для понижения температуры тел ниже температуры окружающей среды и непрерывного поддержания заданной низкой температуры применяются холодильные установки (машины). Согласно второму началу термодинамики, перенос тепла от охлаждаемого тела к более нагретому сопровождается некоторым компенсирующим процессом, которым чаще всего является превращение работы в теплоту. Производство искусственного холода основано на совершении рабочим телом (холодильным агентом) обратного цикла, в котором графически в p, V -; T, s - и др. координатах такой цикл осуществляется против хода часовой стрелки.
Для обратимого обратного цикла справедливо соотношение
q1 = ℓц + q2, (7.1)
где qI – теплота, переданная к более нагретому телу (горячему источнику тепла); ℓц – работа, затраченная на совершение цикла; q2 – теплота, отводимая от охлаждаемого тела (холодного источника тепла). Важной характеристикой обратного цикла является холодильный коэффициент:
ξ = ![]() =
=
![]() , (7.2)
, (7.2)
Экспериментальная установка (см. рисунок 7.1а) собрана на базе установки бытового холодильника «Бирюса». В цикле ПКХУ (см. рисунок 7.1б) рабочим телом является пар легкокипящей жидкости, в данном случае, фреона – 12.
7.1 Схема и цикл ПКХУ
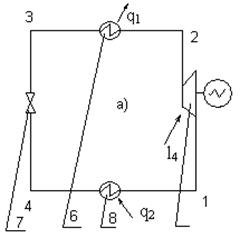
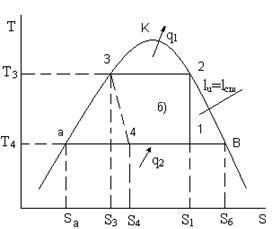
Рисунок 7.1а- Схема ПКХУ Рисунок 7.1б- Цикл ПКХУ
1 – 4 узловые точки цикла, 5 – компрессор, 6 – конденсатор, 7 – дроссельный вентиль, 8 – испаритель.
В компрессоре 5 влажный насыщенный пар адиабатически сжимается (1-2) до состояния, как правило, сухого насыщенного пара. В конденсаторе 6 теплота q1 отдаётся окружающей среде в изобарно – изотермическом процессе (2-3) конденсации фреона. Кипящий фреон дросселируется в вентиле 7 по изоэнтальпе (3-4) с понижением его температуры и давления. Изобарно – изотермический процесс (4-1) – отвод теплоты от холодного источника в испарителе 8.
С учётом изложенного холодильный коэффициент цикла ПКХУ (см. рисунок 7.1а) может быть найден по формуле
ξ = (h1-h4)/(h2-h3)-(h1-h4) = |h4=h3| =
![]() . (7.3)
. (7.3)
В которой hi - энтальпия рабочего тела в i – й точке цикла.
7.2 Проведение опытов и обработка результатов
Необходимо иметь в виду, что на схеме установки не показаны измерительные термосопротивления Tc0…Tc4, подключаемые с помощью многопозиционного переключателя к логометру, проградуированному в 0C. В положении переключателя «0» измеряется температура окружающей среды, в положениях «1»...«4» - температуры в точках 1...4 цикла соответственно.
Установку следует включить не менее, чем за 15 мин до начала опытов. В течение этого времени нужно каждые 5 мин фиксировать температуры в точках 1...4 цикла. Неизменность температур T1…T4 укажет, что установка вышла на стационарный режим и готова к работе.
При проведении эксперимента нужно зафиксировать температуры на точках T1...T4. Результаты измерений занести в таблицу 7.1.
Расчет энтальпий в (7.3) можно осуществить с помощью таблицы 10.2. В соответствии с рисунком 7.1б точки 2 и 3 цикла лежат на пограничных кривых, т.е., h2 и h3 (как и S2 и S3) – это hII и hI (SII и SI), определённые при Т3. В силу адиабатичности процесса 1-2 S1=S2 (где S2 определена выше). Т.к. процесс 3-4 изоэнтальпный, то h4=h3. Осталось определить h1. Для этого нужно найти ha и hв в точках а и в, лежащих на пограничных кривых. В соответствии с изложенным выше ha и hв – это hI и hII, определенные по таблице 10.2. при Т1(аналогично найти SII и SI).
Степень сухости пара фреона в точке 1 по определению
X1 =
![]() , (7.4)
, (7.4)
где все параметры известны. С другой стороны
X1 = ![]() , (7.5)
, (7.5)
откуда можно определить
h1 = X1(ha – hв) + ha, кДж/кг. (7.6)
далее по (6.3) следует найти ξ и рассчитать удельную холодопроизводительность ПКХУ:
q2 = h1 - h4, кДж/кг. (7.7)
Величину ξ можно сопоставить с холодильным коэффициентом обратного обратимого цикла Карно, осуществляемого в том же интервале температур, который может быть определен по формуле
ξ
к = ![]() . (7.8)
. (7.8)
В которой /Т/ = К
Результаты занести в таблицу 7.1
|
Режим |
Время |
Температуры |
Давления |
Расч. величины |
|||||||||
|
t0 |
t1 |
t2 |
t3 |
t4 |
Рваквх |
Рабсвх |
Ризбвых |
Рабсвых |
ξ |
ξк |
q2 |
||
|
- |
мин. |
0С |
0С |
0С |
0С |
0С |
кгс/см2 |
- |
- |
кДж/кг |
|||
|
|
5 |
|
|
|
|||||||||
|
Перек. |
10 |
|
|
|
|||||||||
|
|
15 |
|
|
|
|||||||||
|
Стац. |
|
|
|
|
|||||||||
7.3 Контрольные вопросы
1. Какой цикл называется обратным? Почему он холодильный?
2. Что такое холодильный коэффициент? Как он связан с термическим КПД цикла?
3. Описать циклы воздушной, парокомпрессионной, пароэжекторной холодильных установок.
4. Описать принцип действия теплового насоса.
5. Изобразить цикл ПКХУ в T, s – координатах.
Список литературы
1. Кириллин В. А ., Сычев В. В., Шейндлин. Техническая термодинамика.-М.: Энергоатомиздат, 1983. – 416 с.
2. Зубарев В. Н., Александров А. А., Охотин В. С. Практикум по технической термодинамике.- М.: Энергоатомиздат, 1986. – 304 с.
3. Ривкин С. Л., Александров А. А. Термодинамические свойства воды и водяного пара: Справочник.- М.: Энергоатомиздат, 1984. – 80 с.
4. Гордов А. Н. Основы пирометрии.- М.: «Металлургия», 1971.- 448 с.
Лабораторная работа № 8. Определение газовой постоянной воздуха
Цель работы: определение газовой постоянной воздуха, получение навыков проведения эксперимента по определению параметров идеального газа.
Содержание работы: найти значение газовой постоянной воздуха. Сравнить опытное значение газовой постоянной с его литературным значением. Определить приборную погрешность эксперимента.
8.1 Теоретическое введение
При давлениях близких атмосферному, и комнатной температуре воздух обладает свойствами идеального газа. Основные параметры равновесных состояний идеального газа связаны между собой уравнением Клайперона:
![]() ,
(8.1)
,
(8.1)
где ![]() - абсолютное давление, Па, и температура,
К,
- абсолютное давление, Па, и температура,
К, ![]() , удельный
объём, м3/кг,
R
– газовая постоянная, Дж/кг
, удельный
объём, м3/кг,
R
– газовая постоянная, Дж/кг![]() К,
V,
m
– объём и масса воздуха.
К,
V,
m
– объём и масса воздуха.
Если абсолютное давление Р в сосуде больше барометрического В, то Р определяется по формуле:
![]() , (8.2)
, (8.2)
А если меньше, то по формуле
![]() , (8.3)
, (8.3)
В (8.2) и (8.3) Ри и Рвак – избыточное (манометрическое) вакуумметрическое (разрежение) давление, Па, измеряемые соответственно манометром и вакуумметром.
Для 1 моль газа уравнение состояния
(уравнение Клайперона – Менделеева) можно получить путем умножения обеих частей
(8.1) на молекулярную массу газа (![]() ):
):
![]() (8.4)
(8.4)
или
![]() , (8.4’)
, (8.4’)
где: ![]() =
=![]() - объем одного киломоля газа. При
нормальных физических условиях ( Ро=1,013
- объем одного киломоля газа. При
нормальных физических условиях ( Ро=1,013![]() 105 Па; То=273 К)
для всех газов
105 Па; То=273 К)
для всех газов
![]() =22,4 м3/кмоль;
=22,4 м3/кмоль;
![]() =
=![]()
![]() 8314 Дж/мол
8314 Дж/мол![]() К – универсальная газовая постоянная, одинаковая
для всех газов.
К – универсальная газовая постоянная, одинаковая
для всех газов.
Для произвольной массы (m) газа уравнение состояния идеального газа можно получит путем умножения (8.1) на m:
![]() . (8.5)
. (8.5)
или
![]() . (8.5’)
. (8.5’)
8.2 Методика работы и описание экспериментальной установки
Экспериментальное определение газовой постоянной осуществляется следующим образом.
В сосуде с неизменным объемом V содержится воздух массой m при атмосферном давлении В и температуре помещения Т. Параметры его состояния связаны уравнением состояния:
![]() . (8.6)
. (8.6)
После откачки части воздуха из сосуда его давление станет Р, масса – m2, а новое состояние будет описываться уравнением:
![]() . (8.7)
. (8.7)
Если экспериментально определить параметры этих равновесных состояний воздуха, то вычтя (8.7) из (8.6), можно определить:
![]() , (8.8)
, (8.8)
Объем сосуда V указан на стенде.
Экспериментальная установка (см. рисунок 8.1) состоит из точных весов 1, на одной чашке которых находится опытный сосуд 2, с помощью разъединителя 3 и резиновых вакуумных трубок 4 соединенный с вакуумнасосом 5 и вакуумметром 6. На другой чашке весов находится груз 7, уравновешивающий вес сосуда 2, половину разъединителя 3 и зажим 8. Между вакуумнасосом 5 и сосудом 2 подключен ресивер 9 для сглаживания пульсаций давления при откачке воздуха.
8.1 Схема экспериментальной установки
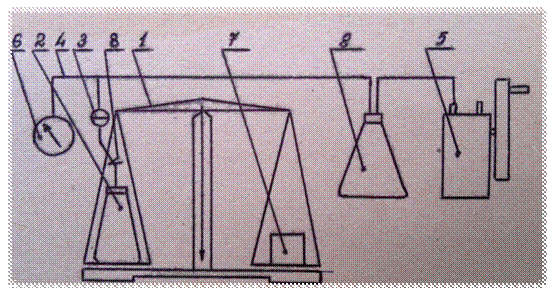
1 – точные весы; 2 – опытный сосуд; 3 – разъединитель; 4 – резиновые трубки; 5 – вакуумнасос; 6 – вакуумметр; 7 – уравновешивающий груз; 8 – зажим; 9 – ресивер.
Рисунок 8.1- Схема экспериментальной установки
Проведение опытов и обработка результатов
На одну чашку весов 1 установить сосуд 2 с половиной разъединителя 3 и зажимом 8. С помощью разновесов уравновесить весы 1. При этом давление и температура воздуха в сосуде равны В и Т=Ткомн .
Затем с помощью
разъединителя 3 подсоединить опытный сосуд 2 и вакуумнасосу 5 и откачать часть
воздуха, следя за величиной разрежения по вакуумметру 6. После откачки части
воздуха по заданной преподавателем величине Рвак выждать 15 –
30 с. и измерить Рвак в сосуде 1. Затем зажимом 8 пережать
шланг между сосудом и разъединителем, разъединить разъединитель, перевести весы
в рабочее положение и с помощью миллиграммовых разновесов определить вес
откаченного воздуха ![]() .
.
Опыт повторить 2-3 раза.
До начала опытов необходимо заготовить таблицу наблюдений (см.таблицу 8.1)
Таблица 8.1
|
В |
Т |
Рвак |
Δm |
R |
Rср |
|||
|
Па |
оС |
К |
кг/см2 |
Па |
мг |
кг |
Дж/кг |
Дж/кг |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
и занести в нее результаты опытов как в исходных единицах, так и в единицах СИ (см. таблицу 8.1). Затем по (8.8) найти R среднеарифметическое значение Rср.
Полученное значение
Rср надо сравнить с
литературным значением газовой постоянной воздуха (Rлит=287 Дж/кг![]() К) по формуле:
К) по формуле:
![]() R=
R=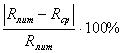 (8.9)
(8.9)
Приборная погрешность эксперимента может быть определена по формуле:
![]() Rп=
Rп=![]() , (8.10)
, (8.10)
где
![]() V –
абсолютная погрешность
измерения объема опытного сосуда, (
V –
абсолютная погрешность
измерения объема опытного сосуда, (![]() V
V![]() 5
5![]() 10-6 м3);
10-6 м3);
![]() -
абсолютная
погрешность измерения Рвак
(определяется
классом точности прибора);
-
абсолютная
погрешность измерения Рвак
(определяется
классом точности прибора);
![]() - абсолютная погрешность измерения массы выкаченного воздуха
(в данном случае вес наименьшего равновеса);
- абсолютная погрешность измерения массы выкаченного воздуха
(в данном случае вес наименьшего равновеса);
![]() - абсолютная погрешность измерения температуры воздуха (
- абсолютная погрешность измерения температуры воздуха (![]() =1К).
=1К).
Эксперимент считается проведенным удовлетворительно, если
![]() R
R![]() Rп
Rп
8.3 Контрольные вопросы
1) Чем отличается индивидуальная газовая и универсальная газовая постоянные, связь между ними, их размерности?
2) Что называется абсолютным, барометрическим, избыточным и вакуумметрическим давлениями, какими приборами они измеряются, какие существуют единицы измерения давления и связь между ними? Какое из давлений является параметром состояния и почему?
3) Что называется термодинамическим параметром состояния, какие параметры вы знаете, какие из них являются основными и почему?
4) Какие уравнения состояния идеального газа вы знаете, размерности величин, входящих в эти уравнения?
5) Укажите, погрешность измерения какой величины составляет максимальную долю погрешности определения газовой постоянной? Способы снижения этой погрешности?
6) Дайте формулировку и напишите уравнение 1-го начала термодинамики в дифференциальном и интегральном видах.
Список литературы
1. Кириллин В.А., Сычев В.В., Шейндлин А.Е. Техническая термодинамика. – М.: Энергоатомиздат. 1983. -416 с.
2. Андрианова Т.Н., Дзампов В.В., Зубарев В.Н., Ремизов С.А., Филатов Н. Я. Сборник задач по технической термодинамике : изд. 4-е. – М.: Изд. МЭИ, 2000. -354 с.
3. Практикум по технической термодинамике: Учебное пособие для вузов. Зубарев В.Н., Александров А.А., Охотин В.С.-3-е изд., перераб.-М.: Энергоатомиздат , 1986.
4. Юдаев Б.Н. Техническая термодинамика и теплопередача.-М.: Высшая школа. 1988- 320 с.
5. Техническая термодинамика. Под ред. Крутова В.И. - М.: Высшая школа. 1982.- 472 с.
6. Андрющенко А.И. Основы термодинамических циклов теплоэнергетических установок. Учебное пособие.-Изд.2-е. - М.: Высшая школа. 1977.-280 с.
7. Задачник по технической термодинамике и теории тепломассообмена: Учебное пособие. Под. ред. Крутова В.И. и Петражицкого Г.Б.- М.: Высшая школа. 1986.-383 с.
8. Ривкин С.Л., Александров А.А. Термодинамические свойства воды и водяного пара.- М.: Энерго Атомиздат, 1984.- 80 с.
9. Ривкин С. Л., Термодинамические свойства газов. - М.: Энергоатомиздат, 1987. - 286 с.
10.Приложение
Таблица 10.1 Соотношение между единицами давления
|
Единицы |
Н/м (Па) |
бар |
кгс/см |
мм.рт. ст. |
мм. вод.1 бар ст. |
|
1 Н/м (Па) |
1 |
1· 10-5 |
1,01972·10-5 |
7,50·10-3 |
0,102 |
|
1 бар |
105 |
1 |
1,01972 |
750 |
0,102·105 |
|
1 кгс/см |
9806,7 |
0,98067 |
1 |
735,6 |
0,1·105 |
|
1 мм.рт.ст. |
133,3 |
133,3· 10-5 |
135,6·10-5 |
1 |
13,56 |
|
1 мм. вод.ст. |
9,8067 |
9,8067·10-5 |
0,1·10-5 |
735,6·10-4 |
1 |
Таблица 10.2 Свойства насыщенных паров фреона
|
T, ºС |
Рн, бар |
Энтальпия, кДж/кг |
Теплота парообразования, кДж/кг |
Энтропия, кДж/(кг К) |
||
|
h´ |
h´´ |
r |
s´ |
s´´ |
||
|
-20 |
1,510 |
400,47 |
564,00 |
163,54 |
4,118 |
4,764 |
|
-18 |
1,631 |
402,27 |
565,01 |
162,74 |
4,125 |
4,763 |
|
-16 |
1,759 |
404,03 |
565,93 |
161,90 |
4,132 |
4,7614 |
|
-14 |
1,895 |
406,04 |
566,89 |
161,07 |
4,139 |
4,7607 |
|
-12 |
2,039 |
407,63 |
567,86 |
160,23 |
4,146 |
4,7596 |
|
-10 |
2,191 |
409,47 |
568,86 |
159,39 |
4,153 |
4,759 |
|
-8 |
2,352 |
411,27 |
569,78 |
158,51 |
4,160 |
4,7576 |
|
-6 |
2,522 |
413,11 |
570,74 |
157,63 |
4,166 |
4,7566 |
|
-4 |
2,700 |
414,95 |
571,67 |
156,71 |
4,173 |
4,7556 |
|
-2 |
2,887 |
416,84 |
572,63 |
155,79 |
4,180 |
4,7548 |
|
0 |
3,086 |
418,68 |
573,55 |
154,87 |
4,187 |
4,7539 |
|
5 |
3,624 |
423,37 |
575,85 |
152,48 |
4,204 |
4,752 |
|
10 |
4,230 |
428,14 |
578,11 |
149,97 |
4,220 |
4,750 |
|
15 |
4,911 |
433,00 |
580,33 |
147,33 |
4,237 |
4,748 |
|
20 |
5,700 |
437,90 |
582,47 |
144,57 |
4,254 |
4,747 |
|
25 |
6,508 |
442,84 |
584,52 |
141,68 |
4,270 |
4,745 |
|
30 |
7,434 |
447,86 |
586,49 |
138,62 |
4,287 |
4,744 |
|
35 |
8,460 |
452,93 |
588,29 |
135,36 |
4,303 |
4,743 |
|
40 |
9,582 |
458,08 |
590,09 |
132,01 |
4,319 |
4,741 |
|
45 |
10,810 |
463,31 |
591,72 |
128,41 |
4,336 |
4,739 |
|
50 |
12,147 |
468,54 |
593,10 |
124,56 |
4,352 |
4,7374 |
|
55 |
13,600 |
474,16 |
595,07 |
120,91 |
4,369 |
4,7373 |
|
60 |
15,182 |
479,68 |
596,58 |
116,90 |
4,385 |
4,7365 |
Св. план 2010 г., поз. 1
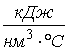
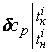 ,
,